-
Medical journals
- Career
Randomizované srovnání dlouhého GnRH agonistického vs. GnRH antagonistického protokolu – hormonální parametry a charakteristiky cyklů – pilotní studie
Authors: R. Středa 1; Tonko Mardešič 1; V. Sobotka 1; J. Tošner 2
Authors‘ workplace: Sanatorium Pronatal, Praha, vedoucí lékař doc. MUDr. T. Mardešič, CSc. 1; Gynekologicko-porodnická klinika, Fakultní nemocnice Hradec Králové, přednosta doc. MUDr. J. Tošner, CSc. 2
Published in: Ceska Gynekol 2009; 74(2): 75-80
Category: Original Article
Overview
Cíl:
Zhodnocení hormonálních parametrů a charakteristik cyklů (hladiny estradiolu a LH v den 5 a v den aplikace hCG) v randomizovaném srovnání dlouhého GnRH agonistického versus GnRH antagonistického protokolu v neselektované skupině žen.Typ studie:
Randomizovaná prospektivní pilotní studie.Název a sídlo pracoviště:
Sanatorium Pronatal, Praha.Předmět a metoda:
Od ledna 2006 do června 2006 jsme randomizovali 40 neselektovaných pacientek do GnRH agonistické (dlouhý protokol triptorelin 0,1 mg) a GnRH antagonistické (cetrorelix 0,25 mg) skupiny. Úvodní dávku jsme doporučili od 150 do 225 IU follitropinu beta nebo hMG na základě znalosti ovariální odpovědi na anamnestickou léčbu klomifencitrátem. Ultrazvukovou kontrolu jsme provedli 5. den cyklu a dále 8. den cyklu. Odběr krve na estradiol (E2) a LH jsme realizovali 5. den a v den aplikace hCG.Výsledky:
Randomizovali jsme 21 pacientek v GnRH agonistickém a 19 pacientek v GnRH antagonistickém protokolu. Prokázali jsme E2 den 5 (pg/ml) 269 ± 243 vs. 385 ± 293, LH den 5 (IU/l) 1,7 ± 1,2 vs. 2,8 ± 1,4, E2 v den aplikace hCG (pg/ml) 1548 ± 1167 vs. 1397 ± 1076 (p<0,05) and LH v den aplikace hCG (IU/l) 2,2 ± 1,9 vs. 1,4 ± 1,1 (ns), výšku endometria (mm) 10,6 ± 1,8 vs. 9,2 ± 0,9 (ns), celková spotřeba FSH (IU) 1865 ± 517 vs. 1513 ± 357 (p<0,001), počet dní aplikace FSH 9,3 ± 1,6 vs. 7,8 ± 1,2 (p<0,001) v GnRH agonistickém vs. GnRH antagonistickém protokolu, resp.Závěr:
Existují významné odlišnosti v hormonálních parametrech a v charakteristikách cyklu pro oba protokoly (delší stimulace a spotřeba většího množství gonadotropinů, vyšší hodnota E2 v den aplikace hCG v GnRH agonistickém protokolu oproti stimulaci s antagonisty GnRH).Klíčová slova:
indukce ovulace, IVF, ICSI, gonadotropiny, folitropin beta, estradiol, OHSS.ÚVOD
Na celém světě narůstá počet žen, které pro léčbu neplodnosti podstupují v rámci asistované reprodukce mimotělní oplodnění [12, 16]. Cílem asistované reprodukce je porod jednoho zdravého plodu. Indukce ovulace je metoda k zajištění omezeného počtu kvalitních oocytů [11]. Nehledě na typy stimulačních protokolů a použitých léků je ovariální hyperstimulační syndrom (OHSS) vedle vícečetného těhotenství nejčastější komplikací metod asistované reprodukce [7]. Incidence OHSS je do 14 % [19]. Jde o iatrogenní stav s potenciálně život ohrožujícími komplikacemi [16, 18]. V moderním pojetí je důležitější prevence než léčba [8]. U pacientů s OHSS byly prokázány vysoké hladiny estradiolu a dále byla prokázána skutečnost, že vysoké hladiny estradiolu jasně korelují s rozvojem, popř. závažností OHSS [3]. Na druhé straně vysoké dávky estrogenů nevyvolají OHSS v animálním modelu [5]. V průběhu cyklů mimotělního oplodnění jsou hladiny estradiolu používány společně s ultrazvukovým vyšetřením pro upřesnění dávky gonadotropinů [7, 16]. Haning et al. [9] shrnuje, že měření hladin estradiolu v průběhu stimulačního protokolu je spolu s přesným ultrazvukovým vyšetřením cestou predikce rizika OHSS.
Ideální stimulační protokol musí zajistit prevenci předčasné sekrece LH, patřičný počet oocytů, očekávaný těhotenský index a být přijatelný pro pacientky [19]. GnRH agonistický protokol byl standardem po více než 10 let [6]. GnRH agonisté se vážou na specifické receptory hypofýzy. Po počátečním stimulačním efektu (vyplavení endogenního FSH a LH) po 14 dnech účinku nastává fáze útlumu sekrece gonadotropinů – downregulace, spojená s hypoestrinním stavem – E2<50 pg/ml. Tím je zajišťěna prevence předčasné sekrece LH [7, 10]. Na druhé straně GnRH antagonistický protokol nabízí rychlou a krátkodobou kompetitivní blokádu hypofyzární sekrece vazbou na specifické receptory hypofýzy [1, 4]. V porovnání s GnRH agonisty chybí počáteční stimulační efekt. Užití GnRH antagonistického protokolu se v současné době rozšiřuje.
CÍL STUDIE
Primárním cílem je porovnání hormonálních charakteristik cyklů stimulovaných agonisty GnRH a gonadotropiny v dlouhém protokolu a cyklů stimulovaných antagonisty GnRH a gonadotropiny.
Sekundárním cílem je hodnocení výšky endometria, celkové spotřeby FSH, délky aplikace FSH a počtu folikulů.
STATISTICKÁ ANALÝZA
Statistická analýza je provedena pomocí χ2 testu analýzy četnosti, Studentova t-testu. Hladina významnosti alfa 0,05 (p<0,05) je považována za statisticky významnou.
SOUBOR PACIENTEK A METODIKA
Od ledna 2006 do června 2006 jsme randomizovali 40 neselektovaných pacientek do GnRH agonistické (dlouhý protokol triptorelin 0,1 mg) a GnRH antagonistické (cetrorelix 0,25 mg) skupiny. Randomizace byla provedena pomocí www.randomization.com a obálkové metody. Indikací léčby neplodnosti byl andrologický a tubární faktor, anovulace, endometrióza nebo idiopatický faktor neplodnosti. Úvodní dávku jsme doporučili od 150 do 225 IU folitropinu beta nebo hMG na základě znalosti ovariální odpovědi na anamnestickou léčbu klomifencitrátem. Ultrazvukovou kontrolu jsme provedli 5. den cyklu a dále 8. den cyklu. Odběr krve na estradiol a LH jsme realizovali 5. den a v den aplikace hCG.
Vstupní kritéria
Sterilita nejméně 1 rok.
Věk 18 až 38 let.
BMI 18–30 kg/m2.
Bazální hladiny FSH a LH<10 IU/l.
Kritéria zamítnutí účasti ve studii
Anamnéza nedostatečné ovariální odpovědi na ovariální stimulaci (low responder).
Anamnéza OHSS.
Spontánní těhotenství před léčbou.
Ovariální cysta nebo jiná abnormalita vaječníku.
Průběh studie
- Zajistili jsme souhlas Etické komise Fakultní nemocnice Hradec Králové.
- Vysvětlili jsme cíle a metodu studie, podepsali jsme informovaný souhlas.
- Ultrazvukovým vyšetřením před aplikací gonadotropinů jsme vyloučili ovariální cysty.
- Randomizovali jsme pacientky do skupiny GnRH agonista vs. GnRH antagonista.
- Počáteční dávku gonadotropinů jsme určili na základě hodnot bazálního FSH, počtu antrálních foliklů – antral follicle count (AFC) a znalosti předchozí odpovědi léčby klomifencitrátem(150–250 IU denně, obvykle 200 IU).
- Folikulární vývoj jsme monitorovali ultrazvukovým vyšetřením 5. a 8. den menstruačního cyklu, pátý den a v den aplikace hCG jsme odebrali krev na E2, LH.
- hCG 10 000 IU jsme aplikovali při dosažení průměru 18 mm u nejméně 3 foliklů a výšky endometria 8 mm.
VÝSLEDKY
Výsledky jsou shrnuty v tabulkách 1–6.
Table 1. Výsledky randomizace 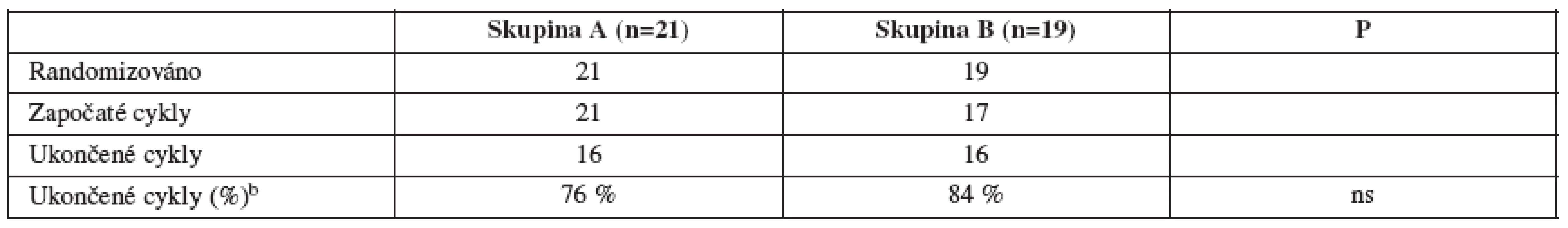
b Analýza četnosti χ2 test Table 2. Základní charakteristiky pacientů 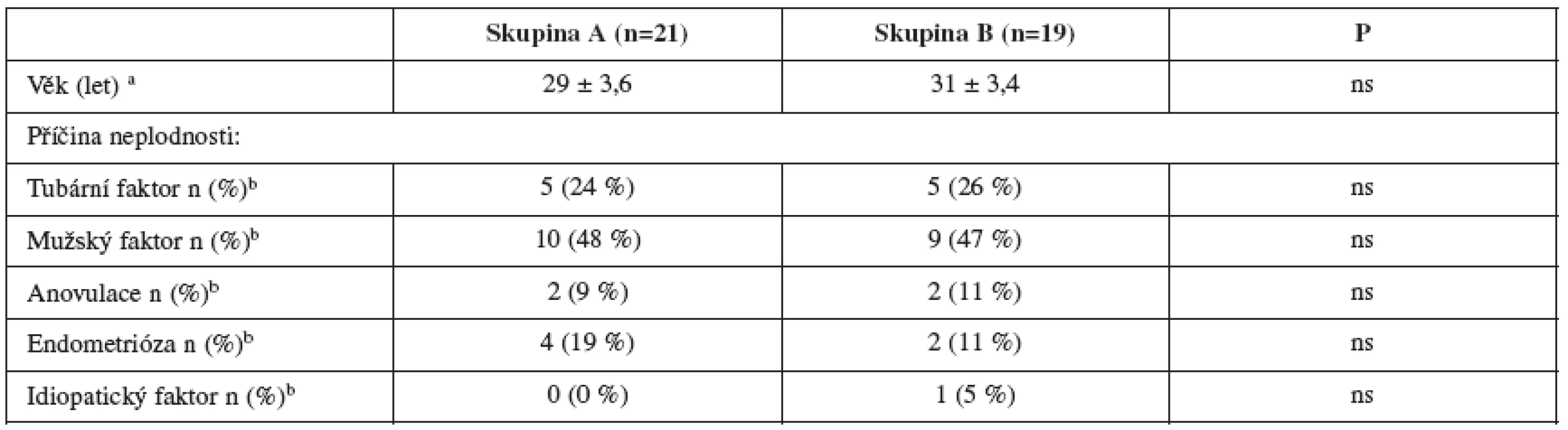
a Výsledky jsou vyjádřeny jako průměr ±SD, Studentův t-test b Analýza četnosti χ2 test Table 3. Charakteristiky pacientů 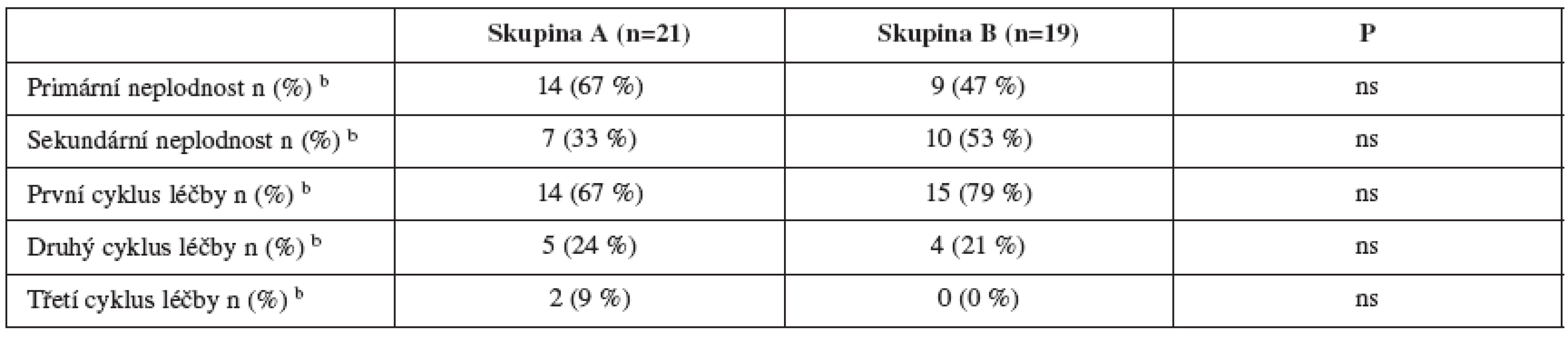
b Analýza četnosti χ2test Table 4. Hormonální charakteristiky pacientů 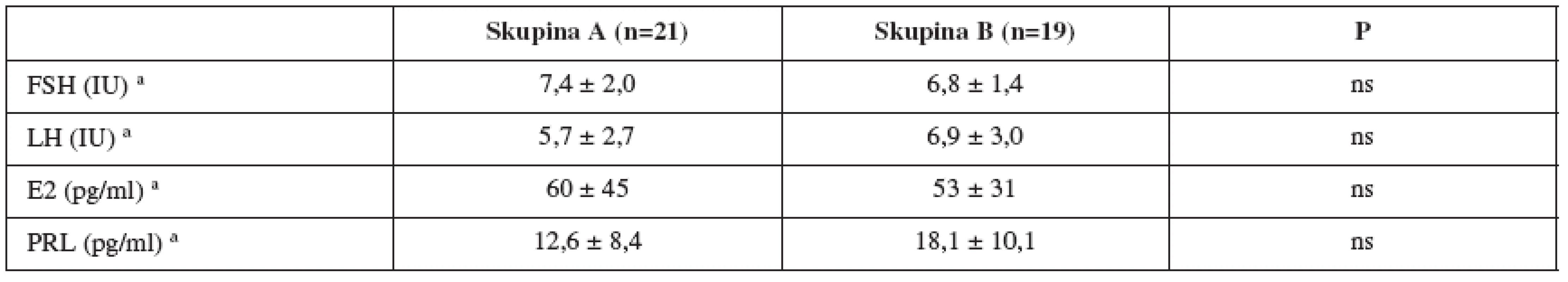
a Výsledky jsou vyjádřeny jako průměr ±SD, Studentův t-test Table 5. Charakteristiky cyklů 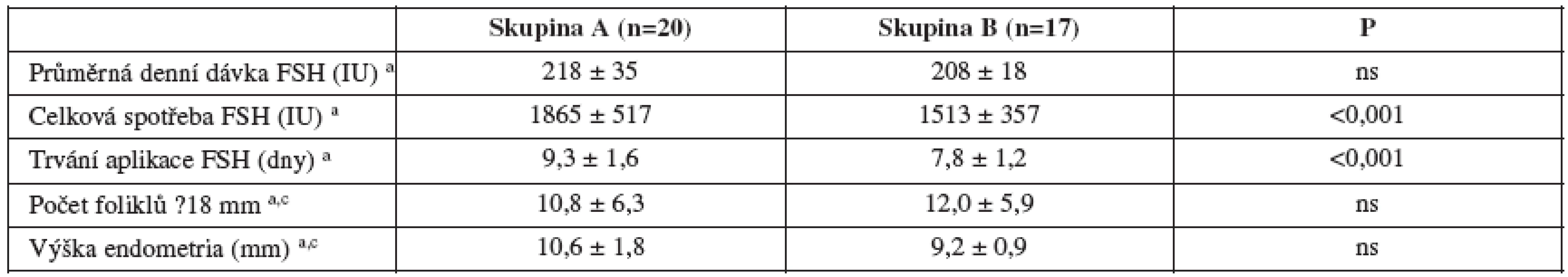
a Výsledky jsou vyjádřeny jako průměr ±SD, Studentův t-test c V den aplikace hCG Table 6. Hormonální charakteristiky cyklů 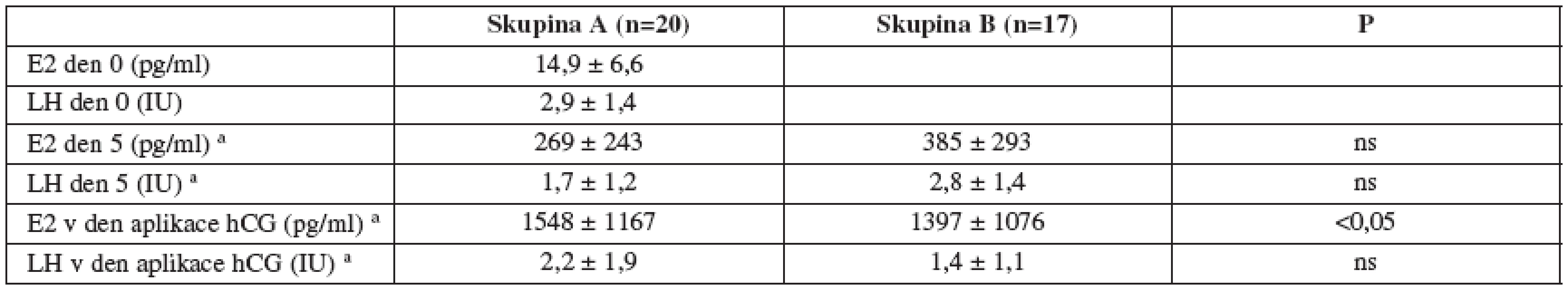
a Výsledky jsou vyjádřeny jako průměr ±SD, Studentův t-test DISKUSE
Estradiol plní v reprodukčním systému klíčové funkce. Je zodpovědný za produkci cervikálního hlenu, proliferaci endometria a indukuje LH vrchol uprostřed menstruačního cyklu. Hladina estradiolu v plazmě je dobrý indikátor diferenciace granulózových buněk a folikulární maturace před ovulací. Gardner uvádí, že syntéza E2 je přímo úměrná folikulární velikosti a udává, že zralý folikul produkuje 200 pg/ml estradiolu [7].
Hodnota E2 je významným parametrem v predikci rizika OHSS. Retrospektivní studie [3] prokazuje, že u pacientů s hodnotou E2 >6000 pg/ml v den aplikace hCG a s počtem získaných oocytů >30 je riziko rozvoje vážného OHSS 80 %. Morris et al. [9] shrnuje, že významná hodnota estradiolu je >4000 pg/ml a že monitorování indukce ovulace jen ultrazvukovým vyšetřením bez znalosti hladin estradiolu je nedostatečné k prevenci OHSS. Ve stimulaci s GnRH analogy Rizk et al. [17] doporučuje použít malé dávky gonadotropinů, dále upravit dávku podle ovariální odpovědi a předvídat riziko OHSS společným užitím ultrazvukového vyšetření a znalosti sérových hladin estradiolu. Aboulghar et al. uvádí, že sérová hladina E2 3000 pg/ml je všeobecně doporučována jako optimální pro podání hCG [2]. Brinsden [5] a Meirow [13] popisují ojedinělé případy OHSS i při nízkých hladinách estradiolu (předpokládá se porucha tvorby estrogenů).
Těhotenství hraje významnou roli v etiopatogenezi OHSS. Při porovnání rizika OHSS mezi ženami s darovanými vajíčky a ženami léčenými pro neplodnost autoři studie [14] prokázali, že u 139 cyklů (dárkyně vajíček n=72 a IVF n=67) s hladinou estradiolu >4000 pg/ml a počtem vajíček >25 nebyl pozorován případ OHSS ve skupině dárkyň vajíček v porovnání se 6 případy OHSS ve skupině léčených žen metodou IVF. Relativní riziko vzniku OHSS s těhotenstvím je 12.
Představu o výhodnosti časného průkazu hladin estradiolu nabízí Gardner [7]. Uvádí možnost průkazu hladin E2 v den 3 jako parametr predikce ovariální odpovědi. Velká multicentrická, randomizovaná studie [1] nabízí kontrolu hormonálních hladin den 6.
V naší práci byly poprvé určeny hladiny E2 a LH v den 5 a v den aplikace hCG pro oba protokoly pro neselektovanou skupinu žen. Taková randomizovaná studie nebyla dosud v odborné literatuře prezentována.
Koncentrace estradiolu a LH jsou uvedeny v grafu 1 a grafu 2.
Graph 1. Hladiny estradiolu den 5 a v den aplikace hCG 
Graph 2. Hladiny LH den 5 a v den aplikace hCG 
Pro vývoje hladin E2 a LH jsou oba protokoly odlišné a přitom charakteristické. U GnRH agonistického protokolu po ověření desenzitizace s hodnotou E2< 50 pg/ml pozorujeme pomalý nárůst E2 v den 5, následně vystřídaný rychlým nárůstem E2 v den aplikace hCG. U GnRH antagonistického protokolu naopak pozorujeme vyšší hladiny E2 v den 5 a v souvislosti s aplikací GnRH antagonisty v den 7 pomalejší nárůst E2 v den aplikace hCG. Účinek injekční formy GnRH agonisty s krátkým účinkem (triptorelin 0,1 mg denně s.c.) na prevenci LH vrcholu (LH <5 IU/l) je prokazatelný hladinami LH 1. den, 5. den i v den aplikace hCG. U GnRH antagonistického protokolu naopak 5. den hladina LH odpovídá endogenní sekreci (není útlum), dále klesá v souvislosti s aplikací GnRH antagonisty a jeho rychlým nástupem účinku. Nebyly prokázány statistické odlišnosti mezi studovanými skupinami. Byly prokázány statistické odlišnosti v parametrech celkové spotřeby FSH, trvání aplikace FSH, hladina E2 v den aplikace hCG pro oba srovnávané stimulační protokoly.
Sérovými hladinami E2, LH, FSH a prolaktinu ve skupině žen léčených pro idiopatický a andrologický faktor se zabýval Zikopoulos [19]. V jeho randomizované studii porovnával nazální formu GnRH agonisty (buserelin 600 μg) s GnRH antagonistou (cetrorelix 0,25 mg) s aplikací rekombinantního FSH (folitropin beta) následovanou intrauterinní inseminací. Autor popsal identický vývoj hladin E2 i LH jako v naší studii. Na rozdíl od naší práce ve skupině GnRH antagonisty odebíral krev na stanovení E2 a LH také v den 1. Při použití 150 IU rFSH denně autor zastavil 1 cyklus pro riziko OHSS. Samotný projev OHSS nepozoroval.
V prospektivním, ale nerandomizovaném porovnání obou studovaných protokolů Ragni potvrdil rychlejší vývoj foliklů a nižší spotřebu gonadotropinů ve skupině GnRH antagonisty [15]. Jeho výsledky jsou v souladu s naší prací.
Omezení pilotní randomizované studie jsme shledali v nejednotné skupině použitých gonadotropinů (urinární gonadotropiny i gonadotropiny rekombinantní). Vedeni snahou o co největší přesnost studie a její největší vypovídací hodnotu jsme následně připravili studii pro 100 žen (50 žen randomizovaných v každé skupině) a použili jsme jediný gonadotropin - folitropin beta. Randomizovanou studii jsme zaměřili na užití znalosti hladin estradiolu v den 5 a v den aplikace hCG na predikci rizika vzniku OHSS.
Práce je součástí doktorského studia Lékařské fakulty Univerzity Karlovy v Hradci Králové.
ZÁVĚR
Prokázali jsme významné odlišnosti v hormonálních charakteristikách a v charakteristikách cyklu pro oba protokoly (delší stimulace a spotřeba většího množství gonadotropinů, vyšší hodnota E2 v den aplikace hCG v GnRH agonistickém protokolu vs. GnRH antagonistický protokol).
MUDr.Robert Středa
Sanatorium Pronatal
Na Dlouhé mezi 4/12
147 00 Praha 4
rstreda@seznam.cz
Sources
1. Comparable clinical outcome using the GnRH antagonist ganirelix or a long protocol of the GnRH agonist triptorelin for the prevention of premature LH surges in women undergoing ovarian stimulation. Hum Reprod, 2001, 16, p. 644-651.
2. Aboulghar, MA., Mansour, RT. Ovarian hyperstimulation syndrome: classifications and critical analysis of preventive measures. Hum Reprod Update, 2003, 9, p. 275-289.
3. Asch, RH., Li, HP., Balmaceda, JP., et al. Severe ovarian hyperstimulation syndrome in assisted reproductive technology: definition of high risk groups. Hum Reprod, 1991, 6, p. 1395-1399.
4. Borm, G., Mannaerts, B. Treatment with the gonadotrophin-releasing hormone antagonist ganirelix in women undergoing ovarian stimulation with recombinant follicle stimulating hormone is effective, safe and convenient: results of a controlled, randomized, multicentre trial. The European Orgalutran Study Group. Hum Reprod, 2000, 15, p. 1490-1498.
5. Brinsden, PR. A textbook of In Vitro Fertilization and Assisted Reproduction. New York: Parthenon Publishing, 1999, p. 131-155.
6. Daya, S. Gonadotrophin-releasing hormone agonist protocols for pituitary desensitization in in vitro fertilization and gamete intrafallopian transfer cycles. Cochrane.Database.Syst.Rev, 2007, CD001299.
7. Gardner, DK., Weissman, A., Howles, CM., et al. Textbook of Assisted Reproductive Techniques. London: Martin Dunitz, 2001, p. 464-469.
8. Griesinger, G., Diedrich, K., Devroey, P., et al. GnRH agonist for triggering final oocyte maturation in the GnRH antagonist ovarian hyperstimulation protocol: a systematic review and meta-analysis. Hum Reprod Update, 2006, 12, p. 159-168.
9. Haning, RV., Austin, CW., Carlson, IH., et al. Plasma estradiol is superior to ultrasound and urinary estriol glucuronide as a predictor of ovarian hyperstimulation during induction of ovulation with menotropins. Fertil Steril, 1983, 40, p. 31-36.
10. Kolibianakis, S. Agonists and Antagonists. Besins Healthcare, 2007, p. 38-42.
11. Koryntová, D. Indukce ovulace a kontrolovaná ovariální hyperstimulace. Mod gynek porod, 2002, 11, s. 525-530.
12. Mardešič, T. Indikace a výsledky léčby sterility metodami asistované reprodukce. Mod gynek porod, 2002, 11, s. 565-571.
13. Meirow, D., Schenker, JG., Rosler, A. Ovarian hyperstimulation syndrome with low oestradiol in non-classical 17 alpha-hydroxylase, 17,20-lyase deficiency: what is the role of oestrogens? Hum Reprod, 1996, 11, p. 2119-2121.
14. Morris, RS., Paulson, RJ., Sauer, MV., et al. Predictive value of serum oestradiol concentrations and oocyte number in severe ovarian hyperstimulation syndrome. Hum Reprod, 1995, 10, p. 811-814.
15. Ragni, G., Vegetti, W., Riccaboni, A., et al. Comparison of GnRH agonists and antagonists in assisted reproduction cycles of patients at high risk of ovarian hyperstimulation syndrome. Hum Reprod, 2005, 20, p. 2421-2425.
16. Rizk, B., Aboulghar, M. Modern management of ovarian hyperstimulation syndrome. Hum Reprod, 1991, 6, p. 1082-1087.
17. Rizk, B., Smitz, J. Ovarian hyperstimulation syndrome after superovulation using GnRH agonists for IVF and related procedures. Hum Reprod, 1992, 7, p. 320-327.
18. Tortoriello, DV., McGovern, PG., Colon, JM., et al. Critical ovarian hyperstimulation syndrome in a coasted in-vitro fertilization patient. Hum Reprod, 1998, 13, p. 3005-3008.
19. Zikopoulos, K., Kaponis, A., Adonakis, G. A prospective randomized study comparing gonadotropin - releasing hormone agonists or gonadotropin-releasing hormone antagonists in couples with unexplained infertility and/or mild oligozoospermie. Fertil Steril, 2009, 83, p. 1354-1362.
Labels
Paediatric gynaecology Gynaecology and obstetrics Reproduction medicine
Article was published inCzech Gynaecology

2009 Issue 2-
All articles in this issue
- Randomizované srovnání dlouhého GnRH agonistického vs. GnRH antagonistického protokolu – hormonální parametry a charakteristiky cyklů – pilotní studie
- Hladiny PAPP-A ve folikulární tekutině a krvi pacientek stimulovaných k IVF s hrozícím ovariálním hyperstimulačním syndromem
- Heat shock protein 70 v plodové vodě u pacientek s předčasným odtokem plodové vody
- Interrupční chování a postoje k umělému přerušení těhotenství u českých žen: Výsledky národního výzkumu
- Vývoj vrozených vývojových vad u dvojčat v ČR v mezinárodním srovnání
- Srovnávací analýza ztráty heterozygozity (LOH) a profilu exprese v normální tkáni, DCIS a v tkáni invazivního karcinomu prsu
- Nádorová onemocnění u dětí narozených s vrozenou vadou Aktuální data v České republice
- Dlouhodobá úspěšnost tahuprosté vaginální pásky při léčbě stresové inkontinence moči
- Termoablace endometria systémem Thermachoice – 10 let zkušeností
- Sexuální funkce po laparoskopicky asistované vaginální hysterektomii (LAVH) a totální laparoskopické hysterektomii (TLH) u předoperačně asymptomatických žen
- Hematologické malignity v graviditě
- Surogátní mateřství – literární názory a praxe
- Syndrom ovariálního zbytku
- Fitz-Hugh-Curtis syndróm: kazuistika
- Czech Gynaecology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Sexuální funkce po laparoskopicky asistované vaginální hysterektomii (LAVH) a totální laparoskopické hysterektomii (TLH) u předoperačně asymptomatických žen
- Termoablace endometria systémem Thermachoice – 10 let zkušeností
- Fitz-Hugh-Curtis syndróm: kazuistika
- Syndrom ovariálního zbytku
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

