-
Medical journals
- Career
Nádor ovaria jako komplikace diagnostiky extraintestinálního gastrointestinálního stromálního tumoru – dvě kazuistiky
Authors: Z. Kinkor 1; O. Daum 2
Authors‘ workplace: Bioptická laboratoř s. r. o., vedoucí prof. MUDr. A. Skálová, CSc. 1; Šiklův ústav patologie, LF UK, Plzeň, přednosta, prof. MUDr. M. Michal, Ph. D. 2
Published in: Ceska Gynekol 2008; 73(1): 54-57
Overview
Cíl práce:
Cílem je upozornit na obtížnost diagnostiky gastrointestinálního stromálního tumoru (GIST) mimo vlastní trávicí trubici v souvislosti s tumorózním postižením ovaria. Při peritoneální diseminaci epiteloidně vřetenobuněčného neepitelového nádoru je vždy nutno diferenciálně diagnosticky uvažovat o možném GIST, na druhé straně pozdní intraabdominální recidiva primárního neepitelového tumoru/sarkomu vnitřního genitálu může tyto léze velmi napodobovat. Úplná anamnéza a přesný operační nález jsou mnohdy velmi cenné. Pozdní peritoneální generalizace endometroidního stromálního sarkomu dělohy a postižení ovaria při rozsevu extraintestinálního GIST tuto problematiku dokumentují.Typ studie:
Dvě kazuistiky.Název a sídlo pracoviště:
Bioptická laboratoř s.r.o. a Šiklův ústav patologie, LF UK a FN Plzeň.Metodika:
Kazuistické zpracování dvou případů s detailní morfologií a komplexním imunohistochemickým (LSAB+, Dako) a genetickým vyšetřením (ABI Prism 310, PE/Applied Biosystems).Výsledky:
U sedmdesátipětileté ženy byl zjištěn 5 cm veliký tumor mezenteria a diagnostikován jako extraintestinální GIST. Při mnohočetné peritoneální recidivě po deseti letech byla tato diagnóza zpochybněna a nádor byl reklasifikován jako diseminace endometroidního stromálního tumoru. Anamnéza potvrdila hysterektomii s adnexotomií v roce 1973 pro endometroidní stromální sarkom dělohy. Ve druhém případě u čtyřicetidevítileté ženy se jednalo o 9 cm veliký tumor ovaria s nádorovou obliterací malé pánve. Převážně epiteloidní mikroskopický vzhled nádoru vedl zprvu k úvaze např. o primární epitelové malignitě event. sex-cord tumoru ovaria či metastáze melanomu. Definitivní diagnostický závěr, podpořený expresí CD117, CD34 a mutací c-kit genu, pak zněl - extraintestinální GIST, nelze vyloučit origo v ovariu.Klíčová slova:
gastrointestinální stromální tumor, GIST, ovarium, peritoneum, endometroidní stromální sarkomÚVOD
Gastrointestinální stromální tumor (GIST) je nejčastějším mezenchymálním nádorem trávicího ústrojí s maximem výskytu v žaludku a tenkém střevě; až 10 % se však nachází mimo vlastní trávicí trubici (omentum, mezenterium, retroperitoneum, orgány malé pánve atd.), kde často působí diagnostické nesnáze [1, 2, 5-10]. Správnému histogenetickému zařazení napomáhá charakteristický imunoprofil, který u více než 90 % případů zahrnuje alternující pozitivitu antigenů CD117, CD34 resp. PGDFRŠ. Molekulárně biologický podklad GIST je poměrně dobře známý a až na určité výjimky (nález v souvislosti s neurofibromatózou I, Carneyovým syndromem, sporadickým GIST dětského věku aj.) se v patogenezi uplatňuje genetická alterace dvou různě dislokovaných, ale vysoce homologních genů - C-kit a PGDFRŠ [2, 4, 10, 11]. Syndromální a dále typicky familiární GIST jsou navíc běžně synchronně či metachronně multicentrické [3]. Konkrétní typ genetické poruchy, mnohdy topograficky příznačný, signalizuje nejen biologii vlastního tumoru, ale má především zásadní prediktivní význam – tzn., že určuje senzitivitu k cílené terapii blokátory tyrozin kinázy (imatinib, Gleevec) [2, 4, 5, 10, 11]. Grading GIST podle kritérií arbitrárně stanovených tzv. Consensus Conference z roku 2002 je prognosticky relevantní a rozčleňuje léze s nízkým, středním a vysokým maligním potenciálem [2]. Rozmanitá morfologie GIST je důvodem značných diagnostických těžkostí v neobvyklých lokalizacích, které mohou znemožnit využití potenciálně efektivní kauzální terapie. Uvádíme dva případy, kde tumorózní postižení ovaria sehrálo rozdílnou úlohu v pozitivní i negativní diagnostice diseminovaného extraintestinálního GIST.
VLASTNÍ POZOROVÁNÍ 1
Sedmdesátipětileté ženě byl v roce 1995 vyoperován solitární, ohraničený, 5 cm veliký tumor mezenteria/retroperitonea; bližší klinická anamnéza nebyla uvedena a místní patolog nález uzavíral jako extraintestinální GIST. V roce 2005 u nemocné došlo k mnohauzlové intraabdominální diseminaci nádoru s maximem postižení serózy ilea; byla provedena resekce 40 cm kliček ilea a paliativní odstranění většiny tumorózních nodozit. Materiál byl zaslán do naší laboratoře ke konzultačnímu vyšetření a k provedení molekulárně genetické typizace nádoru před plánovanou terapií Gleevecem. Mikroskopicky se jednalo o solidní, velmi buněčný tumor tvořený menšími oválnými buňkami s malým množstvím cytoplazmy, místy s naznačenou vřetenobuněčnou přeměnou. Monotónní, bazofilní jaderná populace s mozaikovitou úpravu byla protkána hustější sítí povětšinou příčně zastižených drobných arteriol (obr. 1). Zjevná jaderná pleomorfie nebyla patrná, mitotická aktivita se pohybovala kolem 10 mitóz na 10 velkých zorných polí. Lze říci, že histologický obraz nebyl úplně typický pro GIST a ani imunohistochemie (CD34 a CD117 negativní), ani molekulární biologie (absence mutace genů C-kit a PGDFRα) tuto diagnostickou eventualitu nepotvrdily. Naopak, mikrokopický dojem a exprese antigenu CD10 a estrogenového receptoru vedly k úvaze o možné metastáze (event. vzácné primární lokalizaci) endometroidního stromálního sarkomu (ESS). Posléze bylo zjištěno, že u ženy byla v roce 1973 provedena hysterektomie s oboustrannou adnexektomií pro ESS dělohy. Histologie nádorů z roku 1995 a 2005 byla totožná, parafínové bloky z původní biopsie v roce 1973 nebyly již bohužel k dispozici. Žena 20 měsíců po poslední operaci žije, prodělala chemoterapii a sonograficky je bez známek peritoneální recidivy onemocnění.
Image 1. ESS. Denzní, monotónní, naznačeně plsťovité uspořádání nádoru tvořeného buňkami s pravidelnými oválnými, bazofilními jádry s malým množstvím cytoplazmy. Tumor je protkán sítí drobných arteriol (HE, 200x) 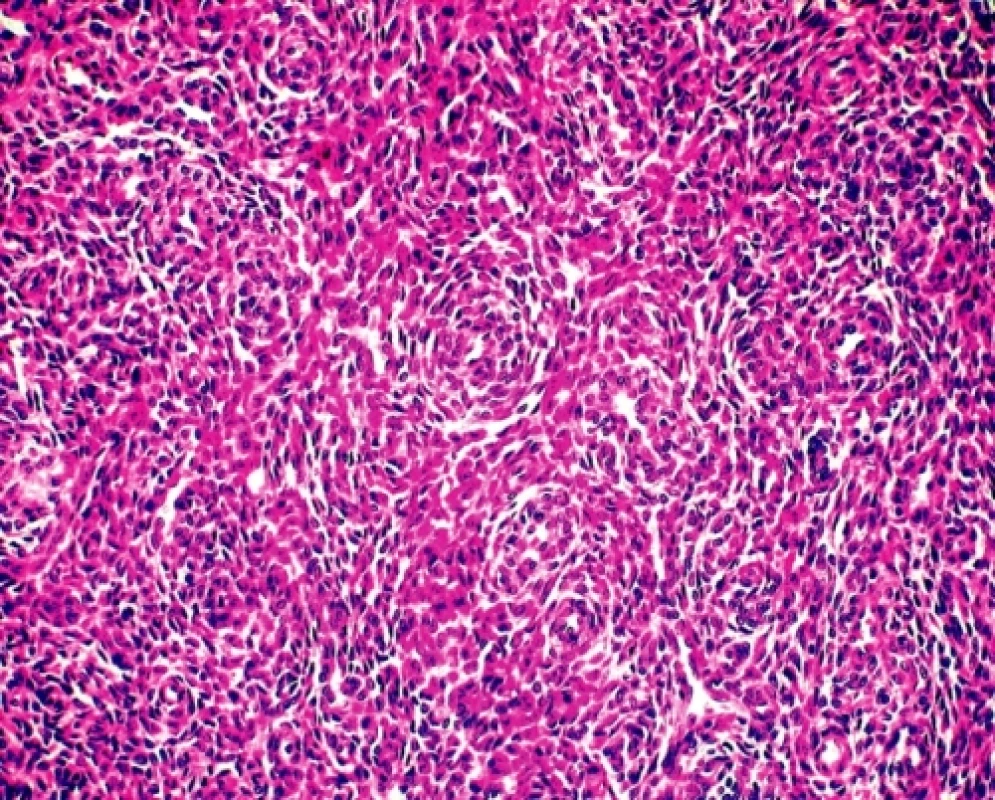
VLASTNÍ POZOROVÁNÍ 2
U čtyřicetidevítileté ženy byla provedena explorativní lapatomie pro narůstající objem břicha, trvající bolesti a „nepřehledný“ nález na CT a sonografickém vyšetření malé pánve. K histologickému vyšetření byl zaslán 9 cm veliký, solidní, tužší, šedobělavý, lehce hrbolatý uzel, na řezu homogenní, ložiskově měkčí s hlenovitým prosakem, který byl označen jako pravostranné ovarium. Histologicky se jednalo sarkomatoidně vyhlížející nádor tvořený vírovitě uspořádanými snopci převažujících vřetenitých elementů bez zřejmé strukturální úpravy (obr. 2). Místy, zejména kolem cév, docházelo k myxoidnímu prosaku tumorózní tkáně a epiteloidní přeměně buněk s tvorbou intracelulárních vakuol (obr. 3). Jádra byla spíše monomorfní bez zjevné polymorfie, mitotická aktivita byla pravidelná, nepřesahovala 15 mitóz na 10 velkých zorných polí.V několika preparátech byl zastižen původní kortex ovaria ostře ohraničený od nádorové tkáně. Pracovní mikroskopická diagnóza zněla - méně obvyklý sex-cord stromální tumor/sarkom? ovaria event. metastáza nejasného primárního zdroje. Dotazováním chirurga se ukázalo, že operační pole bylo velmi nepřehledné, prakticky nešlo diferencovat orgány malé pánve, které byly částečně srostlé s kličkami tenkého střeva a jediný volnější útvar byl považován za ovarium. Omentum bylo volné, mezenterium nepřehledné a fixované k nádorovému konvolutu. Operatér prakticky vylučoval, že by neoplazma souviselo s vlastní trávicí trubicí.
Image 2. GIST. Storiformní a fascikulární úprava je pro GIST charakteristická. Vřetenité nádorové buňky mají blandní jádra a bipolární výběžky eozinofilní cytoplazmy (HE, 200x) 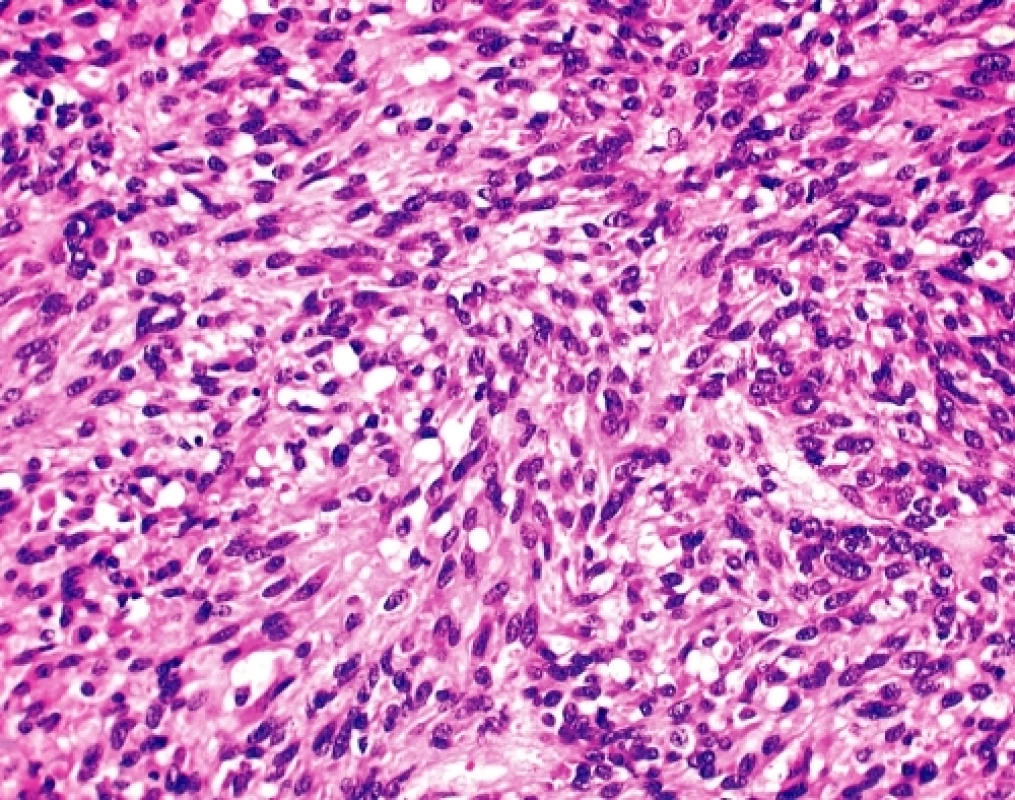
Image 3. GIST. Rozsáhlá ložiska epiteloidní přeměny nádorových elementů s tvorbou pruhů a hnízd. Patrná je výrazná intracelulární vakuolizace a myxoidní prosak mezibuněčné hmoty – obraz věrně napodobující epitelový tumor (HE, 200x) 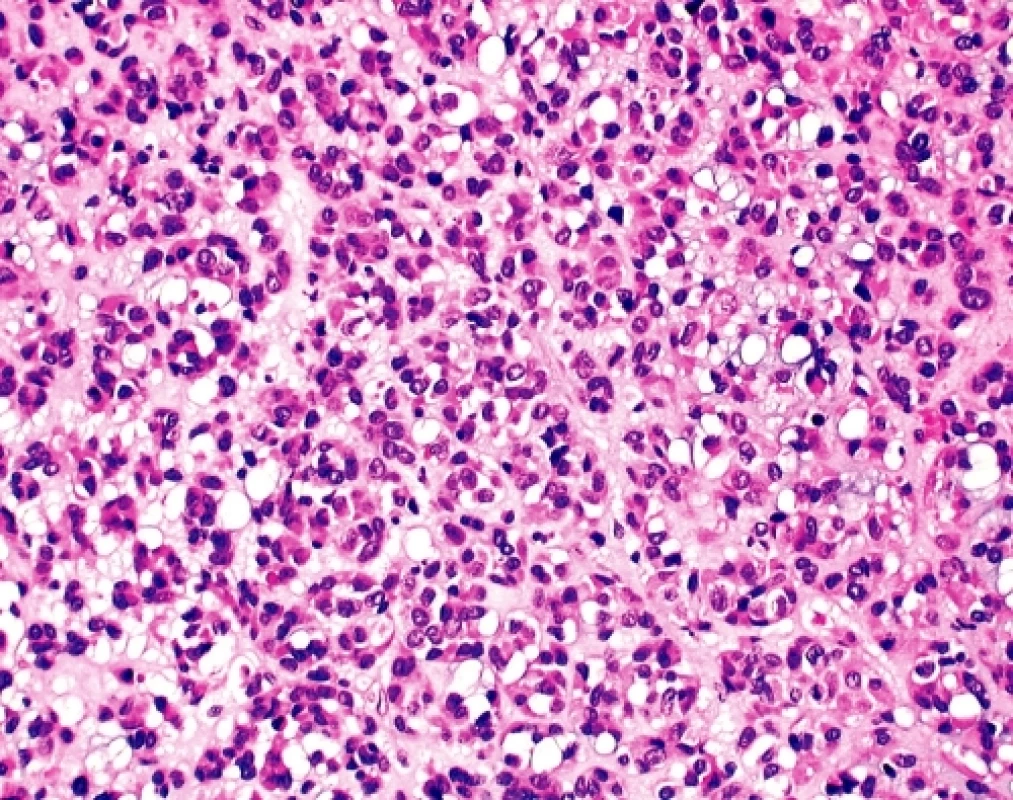
Imunohistochemické vyšetření zjistilo negativitu epitelových markerů, hladkosvalového aktinu, desminu, S100 proteinu, CD10, inhibinu a calretininu, což prakticky vylučovalo možnost epitelového novotvaru, sarkomu, melanomu a nádoru ze sex-cord diferenciací. Naopak pozitivita antigenů CD34 a CD117 svědčila pro možný GIST, což potvrdila prokázaná mutace C-kit genu (obr. 4). Anatomické poměry v malé pánvi neumožňovaly rozlišit origo tumoru v ovariu či sekundární ovariální postižení při jiném extraintestinálním GIST.
Image 4. GIST. Difuzní a homogenní exprese antigenů CD34 (vlevo) a CD117 (vpravo) v nádorových buňkách (DAB, 200x) 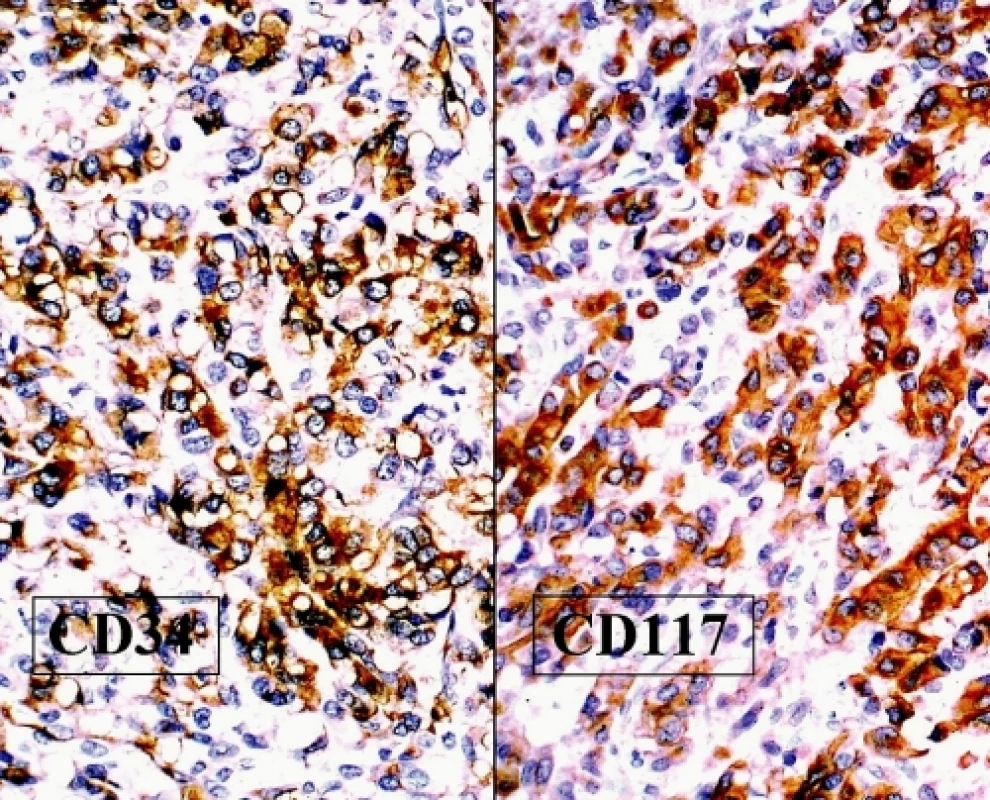
DISKUSE
Diagnostika GIST v nezvyklých lokalizacích mimo vlastní trávicí trubici je obtížná, přesto je nutné na tyto léze myslet, neboť existuje potenciální možnost cílené biologické léčby [1]. Složitost diagnostického uvažování dokumentují nálezy primárního GIST mimo jiné i v retroperitoneu, játrech, prostatě, močovém měchýři, vagině, rektovaginálním septu atd [1, 4, 6, 8-10]. Popsány byly též případy metastázy GIST do ovaria, které imponovaly jako primární ovariální tumor [7]. Opačná situace však může nastat i při pozdní peritoneální diseminaci vzácnějšího neepitelového novotvaru vnitřního genitálu, o kterém patolog a někdy bohužel ani operatér nemají povědomí – nejčastěji ESS či sex-cord stromální (granulózový) tumor [7]. Problematičnost rozpoznání extraintestinálního GIST je na druhé straně paradoxně kompenzována téměř patognomonickým imuno-/genotypem zjistitelným u více než 90 % případů [1, 2, 4, 10, 11].
Diseminované peritoneální tumory resp. pokročilá tumorózní obliterace dutiny břišní neepitelové geneze u žen jsou velmi vzácné. Tyto biologicky a morfologicky heterogenní nádory lze rozdělit podle místa vzniku na dvě hlavní skupiny:
- a) primární mezenchymální tumory/sarkomy peritonea a retroperitonea a
- b) peritoneální metastázy méně obvyklých tumorů nitrobřišních orgánů, nejčastěji urogenitálního ústrojí.
Již zde je však potřeba připomenout, že např. morfologie melanomu či sarkomatoidního karcinomu (mezoteliomu) může býti neodlišitelná a frekvence výskytu minimálně srovnatelná. Lze říci, že v některých případech a v malých probatorních excizích není diagnostický závěr možný učinit z pouhého histologického obrazu. Přesnou histogenezi nádoru pak většinou určí až imunofenotyp. Pro efektivní a racionální diferenciálně diagnostický algoritmus je zásadní, aby patolog vůbec pomyslel na pestrou škálu lézí i při relativně univerzálním strukturálním projevu; na druhé straně je nesmírně cenná onkologická anamnestická informace.
Mezi častějšími lézemi první skupiny, kam patří např. folikulárně dendritický retikulární sarkom nebo inflamatorní myofibroblastický tumor/sarkom, zaujímají svébytné postavení GIST a solitární fibrózní tumor. Jakkoliv je GIST při čistě peritoneální extraintestinální lokalizaci relativně vzácný, aktuální míra povědomí již skýtá značný diagnostický potenciál. Klinická preference domnělého konkrétního orgánového původu, např. ovarium, může být ale pro patologa matoucí. V našem prvním případě epiteloidně vřetenobuněčná úprava vedla k původní úvaze o méně diferencovaném sex-cord stromálním tumoru ovaria. Bohužel ani absence hormonálních projevů a běžného Sertoli/Leydigovského imunoprofilu (exprese inhibinu a calretininu) této histogenetické orientaci neodporovala. Tyto nádory však jen zřídka vytvoří nepřehledný nádorový konvolut v malé pánvi; mikroskopický nález zbytků původního ovariálního kortexu rovněž nesvědčil pro origo tumoru v ovariu, ale spíše pro metastázu či implantát. Případ zastupující další skupinu procesů poukazoval jednak na důležitost informovanosti o onkologické anamnéze, jednak na riziko zjednodušené resp. mylné interpretace domněle primárních/mezenchymálních, peritoneálních lézí jako automatické extraintestinální GIST. Druhé pozorování tak připomíná podobnost histologického projevu a snadnou záměnu ESS dělohy ve fázi pozdní peritoneální diseminace s GIST ve chvíli, kdy operační nález je vykládán jako vícečetné tumorózní uzle serózy tenkého střeva a údaj o dávné hysterektomii není zmíněn. V tomto případě prakticky pouze nepřítomnost charakteristické konfigurace imunoprofilu (absence exprese CD117, CD34 resp. h-caldesmonu) a negativní genetické vyšetření nakonec vedly ke zpochybnění diagnózy netypického GIST a správnému závěru peritoneálního rozsevu původního ESS dělohy.
Praktický význam diskutované problematiky a zkušenosti nabyté z výše popsaných případů lze shrnout do následujících bodů:
- Na GIST je vždy nutno myslet při nitrobřišní diseminaci epiteloidně/vřetenobuněčného tumoru i bez zjevné primární lokalizace v GIT – existuje možnost efektivní cílené bioterapie.
- GIST se může vyskytovat primárně i v urogenitálním ústrojí – např. ovariu, vagině, močovém měchýři, na seróze malé pánve atd. a je zde nezřídka mylně interpretován jako běžnější neepitelový novotvar – např. ESS, sex-cord stromální tumor či nediferencovaný sarkom.
- Převážnou většinu peroperačně zjištěných tzv. „karcinóz peritonea“ žen však tvoří i při nediferencované/vřetenobuněčné morfologii stále karcinomy (především ovaria, méně častěji GIT) a mezoteliomy.
- Melanom s oblibou metastazuje do dutiny břišní a makroskopicky i mikroskopicky může věrně napodobovat GIST, včetně primární extraintestinální lokalizace.
- Přesná a úplná onkologická anamnéza mnohdy patologovi zjednoduší přesnou a včasnou diagnostiku u „nejasných“ peritoneálních nádorových diseminací. Zdánlivě nepodstatná, nevědomky opomenutá event. nedostupná klinická onkologická informace (neplatí, že 10letý follow-up bez recidivy znamená vyléčení malignity!) může významně komplikovat efektivní diagnosticko-léčebný proces.
MUDr. Zdeněk Kinkor, Ph.D.
Bioptická laboratoř s.r.o.
Mikulášské náměstí 4
326 00 PLZEŇ
e-mail: kinkor@medima.cz
Sources
1. Abraham, SC. Distinguishing GIST from their mimics: an update. Ad Anat Pathol, 2007, 14, p. 178-188.
2. Fletcher, CDM., Bermann, JJ., Corless, CL. Diagnosis of gastrointestinal stromal tumor. A concensus approach. Hum Pathol, 2002, 33, p. 459-465.
3. Haller, F., Schulten, HJ., Armbrust, T., et al. Multicentric sporadic gastrointestinal stromal tumors (GIST) of the stomach with distinct clonal origin: differential diagnosis to familial and syndromal GIST variants and peritoneal metastasis. Am J Surg Pathol, 2007, 31, p. 933-937.
4. Hirota, S., Isozaki, K. Pathology of GIST. Pathol Int, 2006, 56, p. 1-9.
5. Hornick, JL., Fletcher, CDM. The role of Kit in the management of patients with GISTs. Hum Pathol, 2007, 38, p. 679-687.
6. Hu, X., Forster, J., Damjanov, I. Primary malignant gastrointestinal tumor of the liver. Arch Pathol Lab Med, 2003, 127, p. 1606-1608.
7. Irwing, JA., Lerwill, MF., Young, RH., et al. Gastrointestinal stromal tumors metastatic to the ovary. A report of five cases. Am J Surg Pathol, 2005, 29, p. 920-926.
8. Lam, MM., Corless CL., Goldblum, JR., et al. Extragastrointestinal stromal tumors presenting as vulvovaginal/rectovaginal septal masses: a diagnostic pitfall. Int J Gyn Pathol, 2006, 25, p. 288-292.
9. Lee, CH., Lyn, YH., Lyn, HY. GIST of the prostate: a case report and literature review. Hum Pathol, 2006, 37, p. 1361-1365.
10. Rubin, BP. GIST: an update. Histopathol., 2006, 48, p. 83-96.
11. Tornillo, L., Terracciano, ML. An update molecular genetics of GIST. J Clin Pathol, 2006, 59, p. 557-563.
Labels
Paediatric gynaecology Gynaecology and obstetrics Reproduction medicine
Article was published inCzech Gynaecology

2008 Issue 1-
All articles in this issue
- Psychomotorický a kognitivní vývoj dětí narozených po mimotělním oplodnění metodou intracytoplazmatické injekce spermie
- Rodičovské postoje a socioemoční vývoj dětí počatých po ICSI
- Děti narozené po intracytoplazmatické injekci spermie: Faktory neplodnosti, průběh těhotenství a porodu, perinatální období
- Vrozené vývojové vady, zdravotní stav a somatický vývoj dětí narozených po intracytoplazmatické injekci spermie
- Náplň předporodních kurzů z hlediska přípravy ke kojení
- Ochorenia štítnej žľazy matky a vrodené vývojové chyby plodu
- Ochorenia štítnej žľazy matky a hypotrofia plodu
- Abdominální sakrokolpopexe – jednoduchá a stále aktuální metoda léčby prolapsu poševního pahýlu?
- Nádor ovaria jako komplikace diagnostiky extraintestinálního gastrointestinálního stromálního tumoru – dvě kazuistiky
- Syndrom kaudální regrese – dvě kazuistiky
- Czech Gynaecology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Syndrom kaudální regrese – dvě kazuistiky
- Abdominální sakrokolpopexe – jednoduchá a stále aktuální metoda léčby prolapsu poševního pahýlu?
- Vrozené vývojové vady, zdravotní stav a somatický vývoj dětí narozených po intracytoplazmatické injekci spermie
- Ochorenia štítnej žľazy matky a hypotrofia plodu
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

