-
Medical journals
- Career
OŠETŘENÍ KAZU BLÍZKÉHO ZUBNÍ DŘENI A METODA ODLOŽENÉ EXKAVACE
Authors: B. Novotná; Ľ. Harvan; L. Somolová; Y. Morozova; I. Voborná
Authors‘ workplace: Klinika zubního lékařství, Lékařská fakulta Palackého univerzity a Fakultní nemocnice, Olomouc
Published in: Česká stomatologie / Praktické zubní lékařství, ročník 121, 2021, 3, s. 83-89
Category: Review Article
Overview
Úvod a cíl: Sanace kariézní léze patří ve stomatologii již odedávna mezi základní výkony, avšak i v dnešní době stále není zcela jednotný přístup k tomuto ošetření v případě kazu blízkého zubní dřeni. Existují tři rozdílné techniky ošetření, které mají své výhody i nevýhody, nicméně jejich společným cílem je zachování vitality zubu. První přístup k ošetření je totální exkavace všech kariézních tkání se zhotovením definitivní výplně, druhým způsobem ošetření je selektivní exkavace s ponecháním malého množství změklých tkání pulpálně a zhotovením definitivní výplně. Třetí technikou je sekvenční exkavace, což znamená dvoudobé ošetření s postupným odstraněním všech kariézních tkání. Toto přehledové sdělení je zaměřeno právě na třetí typ ošetření, tedy na odloženou exkavaci a možnosti provedení s využitím různých remineralizačních materiálů.
Metody: Pro tento přehledový článek byly vyhledány studie v anglickém jazyku za pomoci klíčových slov (kaz blízký dřeni, odložená exkavace, nepřímé překrytí zubní dřeně, hydroxid vápenatý, skloionomerní cement, kalciumsilikátový cement, kalciumfosfátový cement) a jejich obměnou s cílem shrnout současné poznatky o metodě odložené exkavace a materiálech používaných v této indikaci. Vyhledávalo se v databázích PubMed, Web of Science a Cochrane Library a zdrojích tuzemské literatury. Byly vybrány studie především z časopisů s impakt faktorem a vydaných v rozmezí let 2010 až 2020. Pro hlubší pochopení historického vývoje problematiky byla literatura doplněna i o několik publikací z druhé poloviny minulého století.
Závěr: Ošetření hlubokého kazu se zachováním vitality je v dnešní době velmi diskutované téma a stále není jednotný postup, jak tento výkon provést. Při dvoudobém ošetření jsou k nepřímému překrytí zubní dřeně nejčastěji využívány materiály na bázi hydroxidu vápenatého a skloionomerních cementů. Kalciumfosfátové cementy mají vzhledem ke svým vlastnostem vysoký potenciál využití v této indikaci a zvýšení úspěšnosti ošetření, ale je ještě třeba udělat podrobnější in vitro výzkum a klinické studie.
Klíčová slova:
kaz blízký dřeni – odložená exkavace – nepřímé překrytí zubní dřeně – hydroxid vápenatý – skloionomerní cement – kalciumsilikátový cement – kalciumfosfátový cement
ÚVOD DO PROBLEMATIKY
Moderním přístupem v zubním lékařství je minimálně invazivní ošetření a jednou z hlavních priorit je zachování vitality jednotlivých zubů. V případě sanace hlubokého kazu, u které by při tradičním kompletním odstranění kariézního dentinu hrozilo otevření dřeňové dutiny, je možné za určitých podmínek využít selektivní exkavaci (obr. 1). V tomto ohledu je v dnešní době velmi populární systematický přístup k ošetření, který v roce 2012 zveřejnili Alleman a Magne. Jedná se o eliminaci většiny kariézních tkání a následné adhezivní zapečetění defektu [1]. Odstraňování kariézních tkání probíhá primárně v periferní zóně (sklovina, dentino-sklovinná hranice), která pro zajištění dostatečně silné adhezivní vazby musí zůstat absolutně čistá. K ověření se používá detekční barvivo. Dále je odstraněn vnější infikovaný dentin, zatímco vnitřní afektovaný dentin barvící se lehce růžově je ponechán [1, 2]. Tento postup ošetření předpokládá eliminaci maximálního množství bakterií a omezení aktivity případných zbylých mikroorganismů zapečetěných adhezivem v dentinových tubulech. V případě velmi hlubokého defektu lze ponechat pulpálně i sytě růžový dentin, aby nedošlo k expozici pulpy, popřípadě k poškození. Kavita je následně hermeticky uzavřena pomocí adhezivního systému čtvrté generace a kompozitního materiálu [1]. Z histologických studií však vyplývá, že ponechání byť i malého množství bakterií v dentinu vede k jejich šíření dentinovými tubuly a přetrvání zánětlivých změn v pulpě [3]. Ricucci a kol. ve svých pracích doporučují kompletní exkavaci kariézních tkání bez ohledu na to, jak je defekt hluboký (obr. 2). Riziko perforace dřeňové dutiny je sice vyšší, nicméně je-li splněno několik podmínek pro případné přímé překrytí zubní dřeně, je tento druh ošetření pro histologický stav pulpy přínosnější než chronické dráždění při výše zmíněném postupu [3]. Pulpa vždy musí být zdravá nebo pouze reverzibilně změněná. Pokud nastane perforace, dochází ke krvácení, které je zastavitelné maximálně do čtyř minut po aplikaci roztoku 1% chlornanu sodného. Perforace musí mít okraje ve zdravém dentinu a dentinové piliny, vznikající v kavitě při preparaci, se nesmí dostat do kontaktu s pulpou. V opačném případě mohou být zdrojem infekce a vést k selhání ošetření.
Image 1. Selektivní exkavace;
a. otevření kariézního ložiska,
b. dokončení preparace – po obarvení detekčním barvivem,
c. definitivní výplň,
d. výchozí RTG,
e. RTG po ošetření
Fig. 1
Selective excavation;
a. opening of the carious lesion,
b. finishing the preparation – after staining,
c. permanent filling,
d. X-ray before the preparation,
e. X-ray after the treatment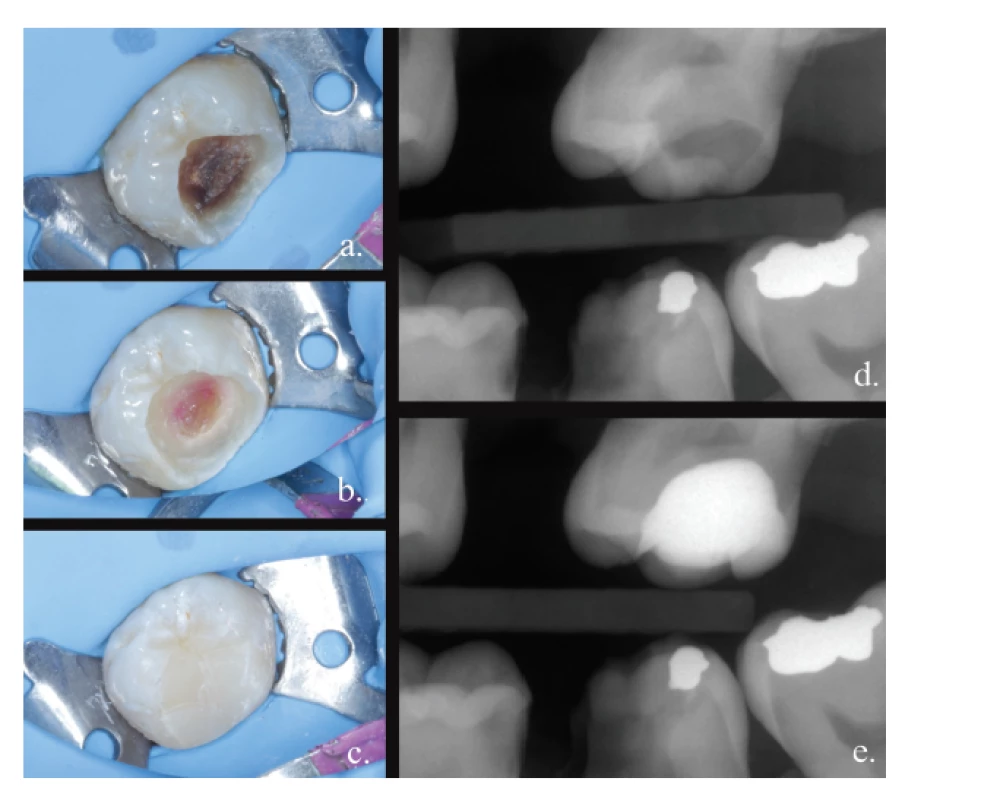
Image 2. Totální exkavace;
a. výchozí stav,
b. otevření kariézního ložiska,
c. dokončení preparace – po obarvení detekčním barvivem,
d. definitivní výplň
Fig. 2
Total excavation;
a. before treatment,
b. opening of the carious lesion,
c. finishing the preparation – after staining,
d. permanent filling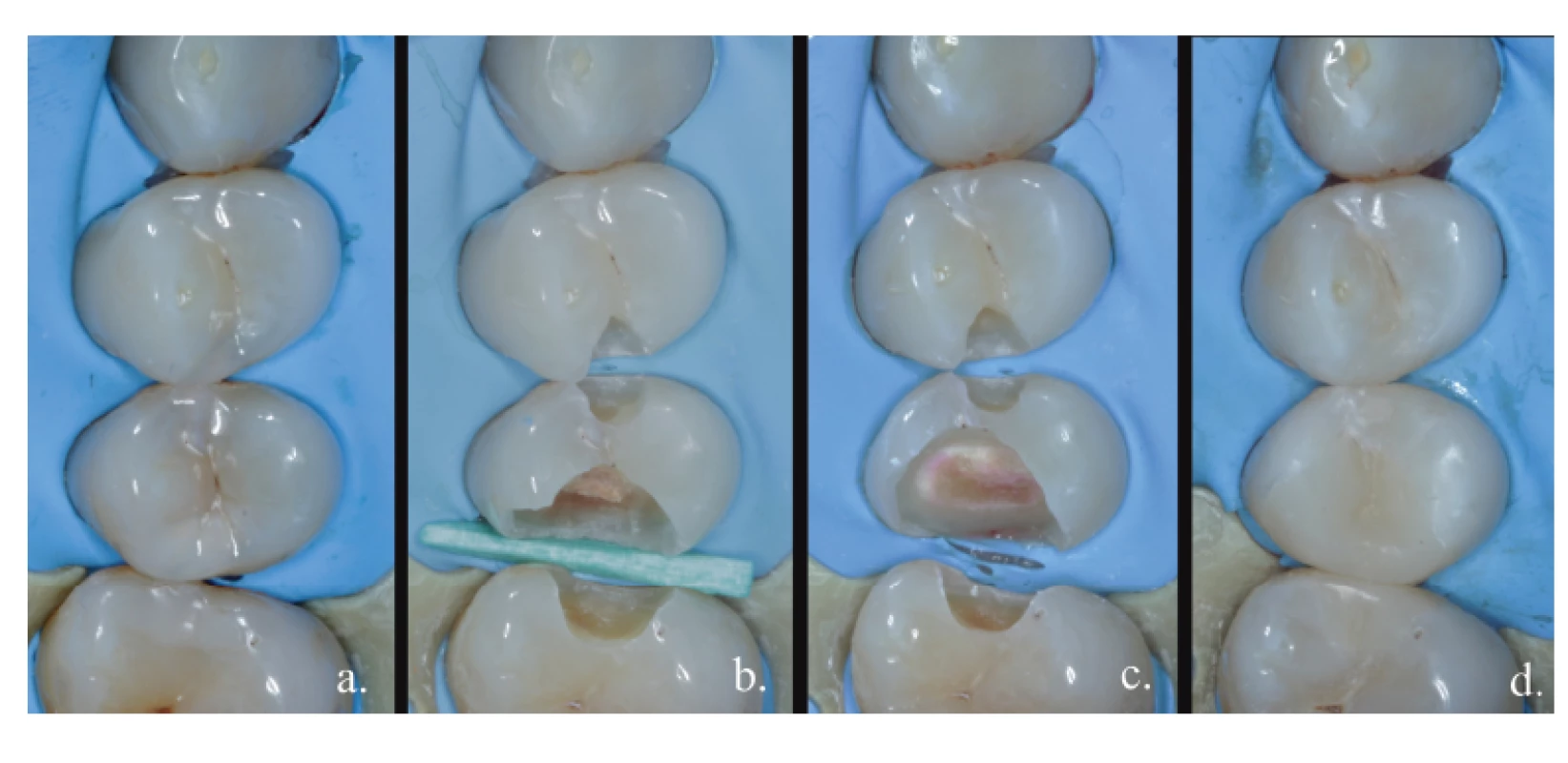
Podmínkou úspěchu je izolace ošetřovaného zubu kofferdamem, který zajistí aseptické a přehledné pracovní pole umožňující podrobnou vizuální kontrolu. Pro prediktabilitu kompletní exkavace kazu blízkého dřeni a případného přímého překrytí je nezbytné použít operační mikroskop [3]. V dnešní době se k ošetření vyžadujícímu izolaci používá kofferdam, jehož použití se oproti minulosti rozšiřuje, a to zejména mezi mladšími lékaři [4, 5]. Vybavení operačním mikroskopem je doménou spíše specializovaných pracovišť a menší části privátních praxí. Z tohoto důvodu pravděpodobně nebude pro většinu praktických zubních lékařů v běžném provozu zmíněné řešení hlubokého kazu snadno realizovatelné a bez adekvátního zvětšení může výrazně klesat jeho úspěšnost.
Jako vhodné řešení pro běžné praxe se nabízí další typ ošetření, který se zdá být kompromisem mezi selektivní exkavací s definitivní výplní a totální exkavací se zvýšeným rizikem expozice pulpy. Jedná se o sekvenční odstranění kazu (obr. 3), tedy dvoudobé ošetření, jehož princip je znám již z počátku 20. století [6, 7].
Image 3. Dvouetapové ošetření hlubokého kazu;
a. výchozí stav,
b. provizorní výplň k remineralizaci,
c. definitivní výplň
Fig. 3
Stepwise excavation;
a. before treatment,
b. temporary filling – for remineralization,
c. permanent filling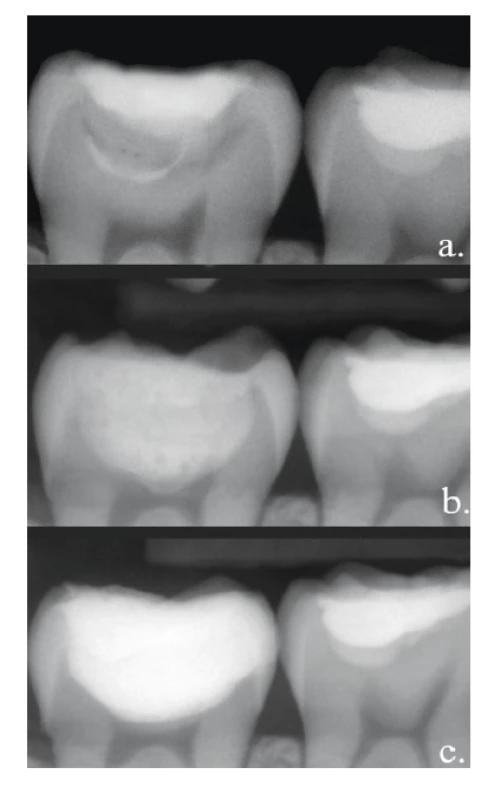
SEKVENČNÍ EXKAVACE A NEPŘÍMÉ PŘEKRYTÍ ZUBNÍ DŘENĚ
Sekvenční exkavace (dvouetapová, intermitentní, odložená exkavace, v angl. stepwise excavation) kariézních tkání je prediktabilní typ ošetření kazu blízkého dřeni se zachováním vitality pulpy [6, 8]. První část ošetření je zaměřena na změnu prostředí na hranici kazu a dentinu a umožnění následné tvorby terciárního dentinu [9, 10]. Prvním krokem je tedy odstranění většiny nekrotických kariézních tkání infikovaného dentinu, který obsahuje denaturovaná kolagenní vlákna a velké množství bakterií [2]. Postup preparace je obdobný jako u ostatních typů ošetření. Primárně je otevřena kavita tak, aby okraje zasahovaly do zdravé skloviny, aby byla očištěna dentino-sklovinná hranice, odstraněn nekrotický dentin, pulpálně je ponechána malá oblast změklého afektovaného dentinu [8]. Kavita může být dezinfikována 2% roztokem chlorhexidinu, což je považováno za zlatý standard, nebo účinnějším 1–5% roztokem chlornanu sodného [11]. Roztoky se však v kavitě nesmí smíchat, aby nedošlo ke vzniku karcinogenního precipitátu – parachloranilinu [12]. Následně je zvolen materiál a zhotovena provizorní výplň. Pacient odchází z ordinace poučen o provedeném typu ošetření, o předpokládaném pooperačním průběhu, případných komplikacích a nutnosti průběžných kontrol vitality zubu. Další návštěva běžně probíhá po šesti až dvanácti měsících, možná i dříve. Leksell a kol. uvádějí možnost provedení definitivního ošetření již po osmi týdnech [13]. Ve druhé fázi ošetření očekáváme změnu charakteru kazu z aktivního na zastavený. Po odstranění provizorní výplně je dokončena exkavace, poté identifikujeme změnu tvrdých zubních tkání z původně změklého probarveného a matného povrchu na tmavý, lesklý a především tvrdý dentin [9, 14, 15]. Ošetření je završeno zhotovením definitivní kompozitní výplně.
PODMÍNKY ÚSPĚŠNÉHO OŠETŘENÍ
Úspěšnost sekvenční exkavace závisí na několika faktorech, konktrétně na stavu pulpy, rozsahu afektovaného dentinu a volbě vhodného výplňového materiálu. Vzhledem k prvnímu zmíněnému kritériu je přistupováno k tomuto typu ošetření především u mladých pacientů do třiceti let, jelikož očekáváme vyšší regenerační potenciál a tvorbu terciárního dentinu [16]. Zub musí být asymptomatický, maximálně s projevy reverzibilních změn. Zjišťujeme zvýšenou reakci na chladové podněty, která do několika sekund odeznívá, chybí zde intervaly spontánní bolesti. Na rentgenovém snímku je zřejmý hluboký zubní kaz, jinak by měl být snímek bez dalších patologických změn ošetřovaného zubu [17]. Dalším faktorem ovlivňujícím úspěšnost ošetření je kvalita dentinu v defektu. Axiální stěny a gingivální schůdek při ošetření vždy musí sestávat z tvrdého nekariézního dentinu. Pulpálně se nachází afektovaný dentin, který je výrazně měkčí než zdravý dentin, obsahuje však neporušená kolagenní vlákna, a je tedy schopný remineralizace [18, 19]. Afektovaný dentin je možné v kavitě ponechat. Plocha ponechaného změklého dentinu by měla být co nejmenší. Hlavní nevýhodou tohoto ošetření je, že neexistuje jednoznačné rozhodovací kritérium, jak hluboko v preparaci pokračovat a kolik afektovaného dentinu ponechat. Záleží zejména na zkušenostech lékaře. Použití detekčního barviva může do určité míry pomoci, avšak u hlubokých lézí není spolehlivé, především při opakované aplikaci udává falešně pozitivní výsledek. Další podmínkou úspěšného dvoukrokového ošetření je spolupráce pacienta, ať už se jedná o kvalitu ústní hygieny, nebo o dodržování termínů kontrolních návštěv. V neposlední řadě je nutné zvolit vhodný podložkový, popřípadě výplňový materiál.
Druhou důležitou nevýhodou odložené exkavace je skutečnost, že při ošetření nelze přímo zjistit stav zubní dřeně. V případě ireverzibilní chronické pulpitidy není ihned zjištěno, že zubní dřeň je již nevratně poškozena a je indikován jiný způsob ošetření. Tento faktor snižuje úspěšnost odložené exkavace i jednorázové selektivní exkavace.
POŽADAVKY NA MATERIÁL PŘI DVOUFÁZOVÉM OŠETŘENÍ
Účelem první části ošetření je minimalizovat množství bakterií, převést kaz z akutní do chronické fáze, a tím vytvořit vhodnější podmínky pro pulpu k tvorbě terciárního dentinu [9, 10]. Tyto principy můžeme podpořit aplikací vhodného provizorního materiálu. Ideální prostředek by tedy měl mít antibakteriální vlastnosti, schopnost remineralizace změklého dentinu a indukce tvorby terciárního dentinu. Dále mezi požadované atributy patří dostatečný okrajový uzávěr, rentgenkontrastnost a barevný odstín odlišný od tvrdých zubních tkání pro následné přehlednější odstraňování z kavity.
V dnešní době je již k dispozici větší množství různých materiálů, které splňují dané požadavky různou měrou. Patří mezi ně mate - riály na bázi hydroxidu vápenatého, skloiono - merní cementy, kalciumsilikátové cementy, kalciumfosfátové materiály a historicky také zinkoxideugenolový cement.
VHODNÉ VÝPLŇOVÉ MATERIÁLY
Zinkoxideugenolový cement
Tento provizorní materiál byl dříve často využíván díky svým výhodným vlastnostem, mezi které patří především analgetické, protizánětlivé a antimikrobiální účinky, dále také nízká cena a relativně dobrá aplikovatelnost [20]. Nevýhodou zinkoxideugenolového cementu je možná alergická nebo cytotoxická reakce, tyto komplikace jsou však typické především pro užití materiálu jako sealeru v endodoncii [21]. Cement vzniká smícháním prášku oxidu zinečnatého a tekutiny obsahující eugenol. Vzniklý chelát eugenolátu zinečnatého se ve vodném prostředí dentinových tubulů rozkládá na hydroxid zinečnatý a eugenol, který může do dentinových tubulů penetrovat, reagovat s volnými radikály kompozitních materiálů, a tím snižovat pevnost vazby adhezivního systému na dentin [20, 22]. Proto není doporučován ve spojení se zhotovením kompozitních rekonstrukcí a v indikaci odložené exkavace byl převážně překonán novějšími materiály.
Materiály na bázi hydroxidu vápenatého
Hydroxid vápenatý a materiály na jeho bázi jsou v zubním lékařství používány již od 20. let minulého století [23]. Jsou uplatňovány v mnoha indikacích, v oblasti nepřímého překrytí je dodnes považujeme za zlatý standard [24]. Hydroxid vápenatý je silně zásaditý bílý prášek (pH 12,5–12,8). V kontaktu s vodou disociuje na hydroxylové a vápenaté ionty. Hydroxylové skupiny zajišťují vysoké pH materiálu, tím se podílejí na neutralizaci kyselých zánětlivých produktů a na antibakteriální aktivitě. Vápenaté ionty jsou součástí remineralizačního procesu a pravděpodobně i indukce tvorby terciárního dentinu [25, 26]. Vodní suspenze, jakožto netuhnoucí materiál s výrazně nízkou pevností v tlaku a vysokou rozpustností, není vzhledem k těmto vlastnostem ideálním materiálem pro nepřímé překrytí pulpy. Jsou proto doporučovány upravené chemicky tuhnoucí podložkové materiály s příměsí esteru kyseliny salicylové (tzv. kalciumsalicylátové cementy), jejichž disociační schopnost je dostatečná, popřípadě kombinované chemicky a světlem tuhnoucí cementy s příměsí esteru kyseliny salicylové a uretanmetakrylátu. Tento typ materiálu má nižší schopnost disociace na ionty, vykazuje však výrazně lepší fyzikální vlastnosti než výše zmíněné materiály [26, 27].
Skloionomerní cementy
Skloionomerní neboli sklopolyalkenoátový cement je materiál vytvořený na konci 70. let minulého století, jehož základním složením jsou organické kyseliny, anorganické skelné částice obsahující fluor, hliník a křemík a voda [28, 29]. Tuhnutí probíhá acidobazickou reakcí a následná chemická adheze k tvrdým zubním tkáním je zprostředkována iontovou vazbou mezi fosfátovou skupinou hydroxyapatitu v tvrdých zubních tkáních a karboxylovou skupinou kyselin. Pozitivní vlastností je teplotní roztažnost podobná dentinu, a především sklovině, dále přítomnost fluoridových iontů, která zajišťuje jak antibakteriální schopnost materiálu, tak také možnost remineralizace. Nevýhodou je obecně nízká pevnost a mechanická odolnost. Produkty jednotlivých výrobců se ve svém přesném složení liší, což také znamená do značné míry rozdílné mechanické i chemické vlastnosti [30, 31]. Velikost skelných částic určuje dobu tuhnutí, odolnost vůči tlaku a také ovlivňuje míru uvolňování fluoridových iontů [32]. Příměs například nanočástic titanu zvyšuje pevnost v ohybu, tlaku a antibakteriální schopnost materiálu [33]. Částice hydroxyapatitu mohou zvyšovat pevnost v ohybu a uvolňování fluoridových iontů [34]. Materiály označované jako karbomerní cementy mají skloionomerní základ s obsahem nanočástic fluorapatitu. Podobají se mechanickými vlastnostmi modifikovaným skloionomerním cementům, avšak míru uvolňování fluoridů mají vyšší, obdobně jako konvenční skloionomerní cementy. Jejich využití v rámci remineralizace vyžaduje další výzkum [35].
Kalciumsilikátové cementy
Kalciumsilikátové cementy byly poprvé popsány v 90. letech minulého století, jako materiály vhodné k uzavírání perforací vzniklých při endodontickém ošetření. Indikační spektrum se v průběhu let významně rozšířilo, stejně tak i nabídka různě upravených typů materiálů [36]. Základem pro všechny kalciumsilikátové cementy je portlandský cement nebo jeho jednotlivé složky (trikalciumsilikát, dikalciumsilikát a trikalciumaluminát) [37]. Dále je součástí oxid bismutitý, zirkoničitý nebo tantaličný zajištující různou rentgenkontrastnost materiálu a další aditiva upravující mechanické vlastnosti [36, 38]. Výhodou této skupiny cementů je reakce s vodou při tuhnutí, což ve srovnání s jinými dentálními materiály umožňuje jejich ztuhnutí i ve vlhkém prostředí [39]. Mezi další pozitiva patří reakce materiálu s dentinem s tvorbou specifické mezivrstvy (angl. interfacial layer), expanze při tuhnutí, minimální rozpustnost, postupné zlepšování mechanických vlastností v delším časovém úseku (zrání neboli maturace cementu). Hlavní nevýhodou je u některých starších materiálů z této skupiny tendence k dyskoloracím a relativně vysoká cena [36, 40]. Pokud jde o biologické vlastnosti, jedná se o materiály vysoce biokompatibilní, schopné stimulovat mineralizaci tvrdých zubních tkání a proliferaci kmenových buněk. Vzhledem k produkci hydroxidu vápenatého při tuhnutí vykazují antimikrobiální a antifungální účinky [41, 42].
Kalciumfosfátové cementy
Kalciumfosfátové cementy byly vyrobeny již v roce 1980. Od té doby byly v různých úpravách a složení zkoumány a nyní jsou díky svým vlastnostem běžně používány především v oblasti kostní regenerace v ortopedii, ale i v oblastech zubního lékařství. Jedná se o skupinu materiálů obsahujících v různé míře vápenaté kationty spolu s fosfátovými anionty, případně i skupiny H+ a OH - a další příměsi (chitosan, alginát, stroncium apod.) [43, 44, 45]. Vlastnosti materiálu závisí na velikosti částic, poměru jednotlivých složek a mísícím poměru prášek/tekutina [46]. Společným rysem všech materiálů této skupiny je biokompatibilita, osteointegrita a osteokonduktivita, dále dobrá aplikovatelnost a tuhnutí při tělesné teplotě [44, 46]. Bylo prokázáno, že cementy obsahující kalcium fosfát podporují také remineralizaci dentinu, který následně odpovídá zdravému dentinu [47]. V této indikaci je zmiňována nejvíce prověřená směs tetrakalcium fosfátu a kyselého dikalcium fosfátu – monetitu [48]. Její konečné tuhnutí probíhá acidobazickou reakcí v průběhu 24 hodin za vzniku kalcium-deficientního hydroxyapatitu (poměr Ca2+/(PO4)3 - je v rozmezí 1,5–1,67) [46]. Vykazuje také výrazně vyšší antimikrobiální účinky než běžně používaný hydroxid vápenatý [45, 49]. Tento materiál je však zatím v indikaci odložené exkavace předmětem dalšího podrobnějšího výzkumu.
ZÁVĚR
Ač je sanace kariézních defektů jedním z nejčastějších stomatologických výkonů, je způsob ošetření hlubokého kazu i v dnešní době stále kontroverzní téma, neboť existuje více značně odlišných přístupů k ošetření. Na jedné straně kompletní exkavace, která se zdá být histologicky nejvhodnějším typem ošetření, avšak s rizikem obnažení pulpy. To lze brát do určité míry i jako výhodu, neboť umožní ověřit, zda je poškození zubní dřeně kazem reverzibilní či ireverzibilní. Na straně druhé je selektivní exkavace s ponecháním malého množství kariézních tkání s adhezivním uzávěrem a na závěr jako kompromisní řešení mezi oběma zmíněnými je metoda odložené exkavace. Podle dostupných studií selektivní i odložená exkavace redukují riziko expozice pulpy oproti totálnímu odstranění kariézních tkání [50]. Částečná exkavace s definitivní výplní má menší riziko vzniku pulpálních komplikací oproti sekvenčnímu ošetření [10, 51]. Avšak po úspěšném dokončení ošetření technikou odložené exkavace je stav pulpy srovnatelný s kompletní exkavací [50]. Dalšími faktory, zda po ošetření zůstane vitalita zachována či nikoliv, jsou kvalita zhotovené výplně a její případné selhání a v neposlední řadě schopnosti, zkušenosti a vybavení ošetřujícího lékaře. Důležité je, zda po ošetření zůstane vitalita pulpy zachována, či nikoliv. Sekvenční odstranění kazu je proto i nyní aktuální téma a pro zlepšení dlouhodobých výsledků jsou stále vyvíjeny a upravovány remineralizační materiály. Ty jsou však předmětem dalšího výzkumu a klinických studií.
Tato práce vznikla za podpory grantového projektu LF UPOL číslo IGA_LF_2021_037.
MDDr. Barbora Novotná
Klinika zubního lékařství LF UP a FN
Palackého 12
772 00 Olomouc
e-mail: novotnaba@seznam.cz
Sources
1. Alleman DS, Magne P. A systematic approach to deep caries removal end points: the peripheral seal concept in adhesive dentistry. Quintessence Int. 2012; 43(3): 197–208.
2. Fusayama T, Terachima S. Differentiation of two layers of carious dentin by staining. J Dent Res. 1972; 51(3): 866.
3. Ricucci D, Siqueira JF, Li Y, Tay FR. Vital pulp therapy: histopathology and histobacteriology-based guidelines to treat teeth with deep caries and pulp exposure. J Dent. 2019; 86 : 41–52.
4. Kapitán M, Sustová Z. The use of rubber dam among Czech dental practitioners. Acta Medica (Hradec Kralove). 2011; 54(4): 144–148.
5. Morozova Y, Míšová E, Holík P, Voborná I. Názor pacientů a souboru zubních lékařů mladší věkové kategorie na ošetření s použitím kofferdamu. Čes stomatol Prakt zubní lék. 2019; 2 : 36–43.
6. Bjørndal L. Indirect pulp therapy and stepwise excavation. Pediatr Dent. 2008; 30 : 225–229.
7. Bodecker CF. Histologic evidence of the benefits of temporary fillings and the successful pulp capping of deciduous teeth. J Am Dent Assoc Dent Cosm. 1938; 25(5): 777–788.
8. Hayashi M, Fujitani M, Yamaki C, Momoi Y. Ways of enhancing pulp preservation by stepwise excavation – A systematic review. J Dent. 2011; 39(2): 95–107.
9. Bjørndal L, Simon S, Tomson PL, Duncan HF. Management of deep caries and the exposed pulp. Int Endod J. 2019; 52(7): 949–973.
10. Hoefler V, Nagaoka H, Miller CS. Long-term survival and vitality outcomes of permanent teeth following deep caries treatment with step-wise and partial-caries-removal: A systematic review. J Dent. 2016; 54 : 25–32.
11. Hamama HH, Yiu CK, Burrow MF. Viability of intratubular bacteria after chemomechanical caries removal. J Endod. 2014; 40(12): 1972–1976.
12. Kolosowski KP, Sodhi RNS, Kishen A, Basrani BR. Qualitative analysis of precipitate formation on the surface and in the tubules of dentin irrigated with sodium hypochlorite and a final rinse of chlorhexidine or QMiX. J Endod. 2014; 40(12): 2036–2040.
13. Leksell E, Ridell K, Cvek M, Mejare I. Pulp exposure after stepwise versus direct complete excavation of deep carious lesions in young posterior permanent teeth. Dent Traumatol. 1996; 12(4): 192–196.
14. Bjørndal L, Reit C, Bruun G, Markvart M, Kjældgaard M, Näsman P, et al. Treatment of deep caries lesions in adults: randomized clinical trials comparing stepwise vs. direct complete excavation, and direct pulp capping vs. partial pulpotomy. Eur J Oral Sci. 2010; 118(3): 290–297.
15. Corralo DJ, Maltz M. Clinical and ultrastructural effects of different liners/restorative materials on deep carious dentin: A randomized clinical trial. Caries Res. 2013; 47(3): 243–250.
16. Pashley DH, Walton RE, Slavkin HC. Histology and physiology of the dental pulp. Endodontics. 2002 : 25–61.
17. Abbott PV, Yu C. A clinical classification of the status of the pulp and the root canal system. Aust Dent J. 2007; 52(1Suppl.): 17–31.
18. Joves GJ, Inoue G, Sadr A, Nikaido T, Tagami J. Nanoindentation hardness of intertubular dentin in sound, demineralized and natural caries-affected dentin. J Mech Behav Biomed Mater. 2014; 32 : 39–45.
19. Kato S, Fusayama T. Recalcification of artificially decalcified dentin in vivo. J Dent Res. 1970; 49(5): 1060–1067.
20. Koch T, Peutzfeldt A, Malinovskii V, Flury S, Häner R, Lussi A. Temporary zinc oxide-eugenol cement: eugenol quantity in dentin and bond strength of resin composite. Eur J Oral Sci. 2013; 121(4): 363–369.
21. Syed M, Chopra R, Sachdev V. Allergic reactions to dental materials – a systematic review. J Clin Diagnostic Res. 2015; 9(10): ZE04–ZE09.
22. Ribeiro JCV, Coelho PG, Janal MN, Silva NRFA, Monteiro AJ, Fernandes CAO. The influence of temporary cements on dental adhesive systems for luting cementation. J Dent. 2011; 39(3): 255–262.
23. Hermann BW. Calciumhydroxyd als Mittel zum Behandein und Füllen von Zahnwurzelkanalen. Univ Wurzbg Med Diss. 1920.
24. Huang XQ, Camba J, Gu LS, Bergeron BE, Ricucci D, Pashley DH, et al. Mechanism of bioactive molecular extraction from mineralized dentin by calcium hydroxide and tricalcium silicate cement. Dent Mater. 2018; 34(2): 317–330.
25. Sangwan P, Sangwan A, Duhan J, Rohilla A. Tertiary dentinogenesis with calcium hydroxide: A review of proposed mechanisms. Int Endod J. 2013; 46(1): 3–19.
26. Farhad A, Mohammadi Z. Calcium hydroxide: A review. Int Dent J. 2005; 55(5): 293–301.
27. Minčík J, Šatanková M, Alexejenko M, Novotný R, Stošek M, Svoboda D. Ošetření dentinové rány. In: Kariologie. 1. vydání. Praha: StomaTeam; 2014, 129–132.
28. Sidhu S, Nicholson J. A review of glass-ionomer cements for clinical dentistry. J Funct Biomater. 2016; 7(3): 16.
29. McLean JW, Wilson AD. The clinical development of the glass-ionomer cements. I. Formulations and properties.Aust Dent J. 1977; 22(1): 31–36.
30. Lohbauer U. Dental glass ionomer cements as permanent filling materials? Properties, limitations and future trends. Materials (Basel). 2010; 3(1): 76–96.
31. Sidhu SK. Glass-ionomer cement restorative materials: A sticky subject? Aust Dent J. 2011; 56(Suppl. 1): 23–30.
32. De Caluwé T, Vercruysse CWJ, Fraeyman S, Verbeeck RMH. The influence of particle size and fluorine content of aluminosilicate glass on the glass ionomer cement properties. Dent Mater. 2014; 30(9): 1029–1038.
33. Garcia-Contreras R, Scougall-Vilchis RJ, Contreras-Bulnes R, Sakagami H, Morales-Luckie RA, Nakajima H. Mechanical, antibacterial and bond strength properties of nano-titanium-enriched glass ionomer cement. J Appl Oral Sci. 2015; 23(3): 321–328.
34. Arita K, Yamamoto A, Shinonaga Y, Harada K, Abe Y, Nakagawa K, et al. Hydroxyapatite particle characteristics influence the enhancement of the mechanical and chemical properties of conventional restorative glass ionomer cement. Dent Mater J. 2011; 30(5): 672–683.
35. Menne-Happ U, Ilie N. Effect of gloss and heat on the mechanical behaviour of a glass carbomer cement. J Dent. 2013; 41(3): 223–230.
36. Žižka R, Šedý J, Škrdlant J, Kučera P, Čtvrtlík R, Tomáštík J. Kalciumsilikátové cementy. 1. část: Vlastnosti a rozdělení. LKS. 2018; 28(2): 37–43.
37. Dawood AE, Parashos P, Wong RHK, Reynolds EC, Manton DJ. Calcium silicate-based cements: composition, properties, and clinical applications. J Investig Clin Dent. 2017; 8(2): 1–15.
38. Camilleri J, Gandolfi MG. Evaluation of the radiopacity of calcium silicate cements containing different radiopacifiers. Int Endod J. 2010; 43(1): 21–30.
39. Prati C, Gandolfi MG. Calcium silicate bioactive cements: Biological perspectives and clinical applications. Dent Mater. 2015; 31(4): 351–370.
40. Parirokh M, Torabinejad M. Mineral trioxide aggregate: A comprehensive literature review – Part III: Clinical applications, drawbacks, and mechanism of action. J Endod. 2010; 36(3): 400–413.
41. Parirokh M, Torabinejad M. Mineral trioxide aggregate: A comprehensive literature review – Part I: Chemical, physical, and antibacterial properties. J Endod. 2010; 36(1): 16–27.
42. Torabinejad M, Parirokh M. Mineral trioxide aggregate: A comprehensive literature revie – Part II: Leakage and biocompatibility investigations. J Endod. 2010; 36(2): 190–202.
43. Zhang J, Liu W, Schnitzler V, Tancret F, Bouler JM. Calcium phosphate cements for bone substitution: Chemistry, handling and mechanical properties. Acta Biomater. 2014; 10(3): 1035–1049.
44. Eliaz N, Metoki N. Calcium phosphate bioceramics: A review of their history, structure, properties, coating technologies and biomedical applications. Materials (Basel). 2017; 10(4).
45. Jayasree R, Kumar TSS, Mahalaxmi S, Abburi S, Rubaiya Y, Doble M. Dentin remineralizing ability and enhanced antibacterial activity of strontium and hydroxyl ion co-releasing radiopaque hydroxyapatite cement. J Mater Sci Mater Med. 2017; 28(6).
46. Medvecky L, Giretova M, Sopcak T. Preparation and properties of tetracalcium phosphate-monetite biocement. Mater Lett. 2013; 100 : 137–140.
47. Peters MC, Bresciani E, Barata TJE, Fagundes TC, Navarro RL, Navarro MFL, et al. In vivo dentin remineralization by calcium-phosphate cement. J Dent Res. 2010; 89(3): 286–291.
48. Medvecky L, Stulajterova R, Giretova M, Mincik J, Vojtko M, Balko J, et al. Effect of tetracalcium phosphate/monetite toothpaste on dentin remineralization and tubule occlusion in vitro. Dent Mater. 2018; 34(3): 442–451.
49. Medvecky L, Giretova M, Stulajterova R, Kasiarova M. Effect of microstructure characteristics on tetracalcium phosphate-nanomonetite cement in vitro cytotoxicity. Biomed Mater. 2015; 10(2).
50. Ricketts D, Lamont T, Innes NPT, Kidd E, Clarkson JE. Operative caries management in adults and children. Cochrane database Syst Rev. 2013;(3):CD003808.
51. Schwendicke F, Meyer-Lueckel H, Dörfer C, Paris S. Failure of incompletely excavated teeth – A systematic review. J Dent. 2013; 41(7): 569–580.
Labels
Maxillofacial surgery Orthodontics Dental medicine
Article was published inCzech Dental Journal

2021 Issue 3-
All articles in this issue
- EDITORIAL
- SLAVNOSTNÍ A ODBORNÉ UDÁLOSTI K 30. VÝROČÍ ČSK
- ZMĚNY ORÁLNÍHO MIKROBIOMU V PRŮBĚHU NECHIRURGICKÉ TERAPIE PACIENTŮ S POKROČILOU PARODONTITIDOU
- PROTEÓM SLINNÝCH EXOZÓMOV AKO NOVÝ PROSTRIEDOK PRE DIAGNOSTIKU ORÁLNYCH OCHORENÍ
- OŠETŘENÍ KAZU BLÍZKÉHO ZUBNÍ DŘENI A METODA ODLOŽENÉ EXKAVACE
- SBORNÍK ABSTRAKTŮ KONFERENCE ÚSMĚV 021
- Czech Dental Journal
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- OŠETŘENÍ KAZU BLÍZKÉHO ZUBNÍ DŘENI A METODA ODLOŽENÉ EXKAVACE
- ZMĚNY ORÁLNÍHO MIKROBIOMU V PRŮBĚHU NECHIRURGICKÉ TERAPIE PACIENTŮ S POKROČILOU PARODONTITIDOU
- PROTEÓM SLINNÝCH EXOZÓMOV AKO NOVÝ PROSTRIEDOK PRE DIAGNOSTIKU ORÁLNYCH OCHORENÍ
- SBORNÍK ABSTRAKTŮ KONFERENCE ÚSMĚV 021
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

