-
Medical journals
- Career
Diagnostický potenciál synoviálnej tekutiny
: V. Schwartzová 1; J. Kluknavská 1; A. Birková 2; M. Rabajdová 2
: I. stomatologická klinika LF UPJŠ, Košice 1; Ústav lekárskej a klinickej biochémie LF UPJŠ, Košice 2
: Česká stomatologie / Praktické zubní lékařství, ročník 118, 2018, 3, s. 68-72
: Original Article – Clinical Study
Úvod:
Biochemické zmeny sprevádzajúce intrakapsulárne patologické procesy predstavujú potenciálny zdroj informácií využiteľný na diagnostiku, diferenciálnu diagnostiku či monitorovanie ochorení temporomandibulárneho kĺbu. Miniinvazívne zásahy do integrity temporomandibulárneho kĺbu so sprístupnením synoviálnej tekutiny sa v stomatologickej praxi realizujú za účelom drenáže, prípadne terapeutických laváží a nie za účelom stanovenia akéhokoľvek biochemického parametra. Okrem invazivity punkcie temporomandibulárneho kĺbu využiteľnosť synoviálnej tekutiny z tejto lokality na diagnostiku komplikuje jej nízky objem.
Cieľom práce je zhrnúť aktuálne poznatky o histológii, fyziológii a patofyziológii temporomandibulárneho kĺbu, vyhodnotiť možnosti vyšetrenia synoviálnej tekutiny a otestovať diagnostický potenciál tejto tekutiny pomocou vysoko citlivej fluorescenčnej fingerprintovej analýzy.
Klíčová slova:
temporomandibulárny kĺb – synoviálna tekutina – osteoartróza – fluorescencia
ÚVOD
Vnútorný priestor temporomandibulárneho kĺbu (TMK) vypĺňa synoviálna tekutina (ST), ultrafiltrát krvnej plazmy produkovaný synovialocytmi. Pre funkciu kĺbu zohráva viaceré úlohy: pôsobí ako lubrikant, zabezpečuje fagocytózu cudzorodých častíc a umožňuje výživu kĺbovej chrupky [2, 8, 13]. Morfologické zmeny asociované s degeneráciou chrupky pri osteoartróze sú detegovateľné na RTG až s odstupom dvoch až troch rokov. Laboratórne vyšetrenie punktátu TMK môže prítomnosť degeneratívnych zmien v kĺbe odhaliť už krátko po ich nástupe, avšak toto vyšetrenie nie je súčasťou dennodennej praxe [10, 21]. Vyšetrenie synoviálnej tekutiny najčastejšie indikuje ortopéd alebo reumatológ pri ochoreniach kolenného kĺbu [20].
HISTOLÓGIA A FYZIOLÓGIA TMK
Výstelku vnútorných častí všetkých synoviálnych kĺbov, vrátane TMK, tvoria kĺbová chrupka a synoviálna membrána. Synoviálna membrána je tenká, hladká, bohato vaskularizovaná a inervovaná, bez epitelu. Tvoria ju málo diferencované synoviálne bunky mezenchýmového pôvodu s fagocytárnou a sekretorickou funkciou. Vďaka nízkej diferenciácii synovialocytov je synoviálna membrána schopná rýchlo a úplne regenerovať. Synovialocyty sú miestom syntézy kyseliny hyalurónovej a glykozaminoglykánov, ale aj mnohých cytokínov [4, 13]. Kĺbová chrupka je z prevažnej časti tvorená medzibunkovou hmotou (98 %) a chondrocytmi (2 %) uloženými v lakú-nach a usporiadanými do troch vrstiev, pričom v každej z nich majú chondrocyty charakteristický tvar a orientáciu (obr. 1). V hlbokej vrstve dochádza ku kalcifikácii chondrocytov a je tu prítomných niekoľko ciev [13, 16].
1. Kĺbová chrupka (upravené podľa Miloro, 2004) 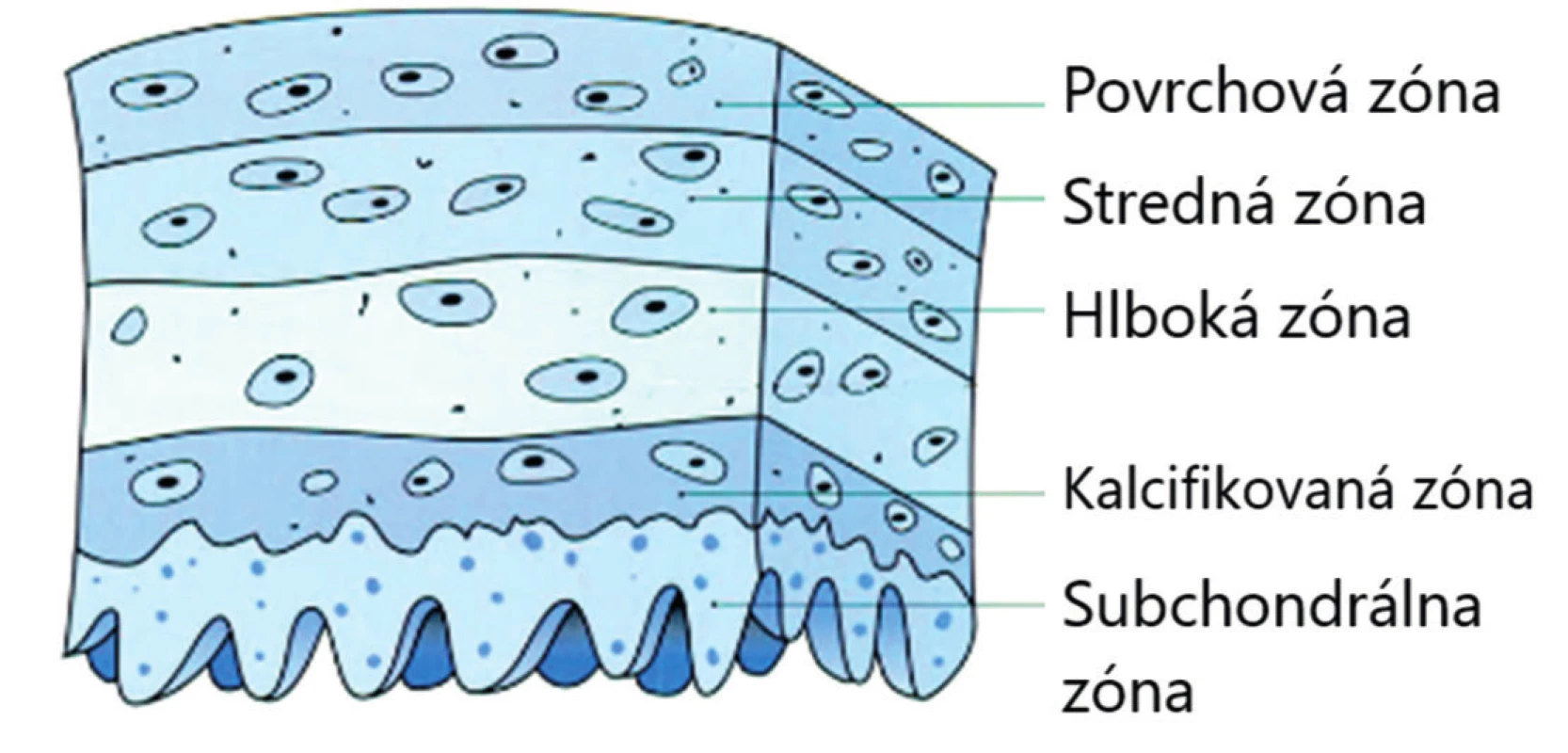
Chondrocyty sú zodpovedné za reguláciu syntézy intercelulárnej matrix, ktorú tvorí voda, kolagénové vlákna a nefibrózny výplňový materiál. Voda predstavuje 70 % tkaniva chrupky a je viazaná na kolagénové vlákna, ktoré sú tvoréne z 90 % kolagénom typu II. Podieľa sa na pružnosti chrupky [5]. Výplňový materiál tvoria rôzne plazmatické proteíny, proteoglykány syntetizované v Golgiho aparáte chondrocytov, ďalej glukóza, močovina a soli [13].
Chrupka je primárne vyživovaná zo synoviálnej tekutiny [13, 16] – čírej, nažltlej, viskóznej, nezráža-júcej sa tekutiny, o ktorej sa zmienil už Hippokrates [2]. Synoviálna tekutina je považovaná za filtrát plazmy a v zdravom TMK je jej objem približne dva mililitre. Za viskozitu zodpovedá kyselina hyalurónová naviazaná na proteíny. Proteóm synoviálnej tekutiny a krvnej plazmy sa odlišujú. Synoviálna tekutina obsahuje proteínov menej, ale s vyšším percentuálnym podielom albumínu a nižším podie-lom α2-globulínu. Fibrinogén a ostatné proteíny koagulačnej kaskády sa v synoviálnej tekutine nenachádzajú. Koncentrácia lipidov je na rozdiel od plazmy veľmi nízka. Katióny Na+, K+ a Ca2+ sú v nižších koncentráciách a naopak anióny Cl - a HCO3 vo vyššej koncentrácii ako v plazme. Fyziologické pH synoviálnej tekutiny sa pohybuje v rozsahu 7,31–7,64. Na jeho udržiavaní sa podieľa významným spôsobom pufrovací systém kalciumhyaluronát [5, 9, 13]. Synoviálna tekutina je na bunky chudobná (0,01 až 0,2 × 109/l), prevažujú leukocyty (dominantne monocyty, lymfocyty, makrofágy a < 25 % polymorfonukleárov) [6]. Vo veľmi nízkych koncentráciách sa aj v zdravom TMK môžu detegovať prozápalové cytokíny (IL-1 – interleukín 1, IL-6 – interleukín 6 a TNF-α – tumor nekrotizujúci faktor α), protizápalové cytokíny (napr. antagonista receptora IL-1), ale aj regulátory apoptózy RANKL (receptor aktivátor NF kappa-B ligand) a ich inhibítory zabezpečujúce homeostázu v zdravom kĺbe [19].
PATOGENÉZA POŠKODENIA CHRUPKY
Podstatou rozvoja osteoartrózy je poškodenie kĺbovej chrupky [5]. Proces deštrukcie chrupky je podmienený nerovnováhou medzi degradačnými enzýmami a ich inhibítormi. Spúšťačom degenerácie je pokles množstva a agregácie proteoglykánov s následným úbytkom matrix chrupky. Reaktívna stimulácia syntézy medzibunkovej hmoty chondrocytmi je obranným mechanizmom, vďaka ktorému je chrupka schopná plniť svoju funkciu ešte určitú dobu. S postupujúcou osteoartrózou chondrocyty vyčerpajú svoju reparačnú schopnosť, syntéza proteínov extracelulárneho matrixu chrupky klesá a výsledkom je redukcia chrupky [9] a obnaženie subchondrálnej kosti. Mikrotraumy vznikajúce pri zaťažovaní kĺbu sa hoja novotvorbou kosti, dochádza k hypertrofii synoviálnej membrány, neovaskularizácii rezíduí chrupky a vzniku osteofytov [5]. Keďže osteoartróza je chronické progredujúce ochorenie, včasnejšia diagnostika a možnosť sledovať priebeh ochorenia špecifickejšími a citlivejšími metodikami by pre pacientov bola benefitom [10].
BIOCHEMICKÉ ZMENY
Biochemické zmeny súvisia predovšetkým s prítomnosťou zápalu, vzniknutým oxidačným stresom počas zápalu a reparačnými mechanizmami. Za rovnováhu medzi procesmi riadenými anabolickými a katabolickými cytokínmi môže vzájomná súhra synovialocytov, chondrocytov a leukocytov [13]. V synoviálnej tekutine artrotického kĺbu je znížená koncentrácia aj molekulová hmotnosť kyseliny hyalurónovej. Príčinou je okrem fragmentácie aj narušená syntéza kyseliny hyalurónovej synovialocytmi [7]. Na tvorbu molekúl extracelulárnej matrix kĺbu sú potrebné anabolické cytokíny ako IGF-I (insulin-like growth factor – I) a TGF-β (transforming growth factor – beta) podporujúce reparačné mechanizmy pri osteoartróze a redukujúce množstvo receptorov IL-1 na chondrocytoch [9, 13]. Katabolické cytokíny IL-1, IL-6, TNF-α sú spojené so syntézou proteáz (aspartátová, cysteínová, serínová a matrix metaloproteinázy – MMP) aktívnych pri nízkom a neutrálnom pH. Zvýšené hladiny cytokínov a MMP boli pozorované u pacientov s osteoartrózou, ale aj u pacientov s dislokáciou disku bez repozície [10, 13]. Cytokín IL-1 a stromelyzín (MMP 3) môžu byť detegované už pri skorých štádiách deštrukcie kosti bez pozitívneho RTG nálezu [11]. Regulácia syntézy cytokínov je ovplyvnená aj pohlavným dimorfizmom. V TMK žien boli nájdené funkčné estrogénové receptory a je popísaný antinociceptívny efekt estrogénu a testosterónu počas zápalového procesu [1, 22].
Aktiváciu cytokínov, neuropeptidov, degradačných enzýmov a metabolitov kyseliny arachidónovej, ktorá vyúsťuje do degeneratívneho ochorenia kĺbu, zvyšujú aj voľné radikály. V patogenéze osteoartrózy sa významne uplatňuje oxid dusnatý (NO), a to viacerými mechanizmami. V nízkych koncentráciách zvyšuje permeabilitu ciev, zvyšuje uvoľňovanie TNF, IL-1 a MMP, inhibuje reparačné pochody chrupky a vyvoláva apoptózu. Vo vyšších koncentráciách reaguje s kyslíkovými radikálmi za vzniku cytotoxických látok, napríklad peroxynitritu reagujúceho s tyrozínom za vzniku nitrotyrozínu, ktorého prítomnosť bola pri osteoartróze dokázaná v synoviálnej tekutine. Za fyziologických okolností chrupka produkuje NO len po pôsobení cytokínov, zatiaľ čo pri osteoartróze prebieha syntéza NO aj spontánne [5, 13].
SÚČASNÉ MOŽNOSTI VYŠETRENIA SYNOVIÁLNEJ TEKUTINY
Synoviálna tekutina nepatrí medzi rutinne vyšetrované biologické tekutiny. V ortopédii a reumatológii sa najčastejšie vyšetruje synoviálna tekutina z kolenného kĺbu [5, 20]. Makroskopicky sa vyhodnocuje farba, zákal a viskozita. Za normálnych okolností je synoviálna tekutina bezfarebná, číra a vysoko viskózna. Viskozita synoviálnej tekutiny je normálna, ak kvapku synoviálnej tekutiny je možné natiahnuť na vlákno dlhšie ako tri centimetre. Pri osteoartróze je viskozita znížená. Ďalším orientačným testom na posúdenie polymerizácie kyseliny hyalurónovej je mucínový zrážací test, pri ktorom sa k jednému milimetra synoviálnej tekutiny pridajú 4 ml 2 % kyseliny octovej. Za fyziologických okolností vzniká tuhá formovaná zrazenina vo vyčírenom roztoku, avšak pri zápalových zmenách vzniká difúzne zakalenie. Ďalšie laboratórne vyšetrenia synoviálnej tekutiny sú biochemické (pH, glukóza, laktát, kyselina močová, celkové proteíny), cytologické (počet leukocytov + diferenciál), mikroskopické (dôkaz kryštálov) a imunologické (vyšetrenie protilátok, autoprotilátok a reumatoidného faktora). V prípade výrazne zakaleného výpotku sa synoviálna tekutina odosiela na mikrobiologické vyšetrenie [17, 20].
V priebehu posledných dvoch desaťročí došlo k veľkému pokroku v chápaní etiopatogenézy chronickej bolesti, zápalových a degeneratívnych zmien temporomandibulárneho kĺbu. Osteoartróza začína v kĺbovej chrupke a pozitívny rádiologický nález má latenciu dva až tri roky [10, 13]. Analýza synoviálnej tekutiny už v čase nástupu klinických ťažkostí (akými sú bolesti TMK, krepitus a hypomobilita TMK) by mohla byť prínosom pre skorší začiatok správnej liečby. Najnovšie vedecké práce informujú o význame stanovenia koncentrácie cytokínov, najmä IL-1β, IL-6, IL-8, IL-11, TNF-α a MMP3, pri hodnotení intenzity denegeratívnych zmien v čase negatívneho RTG nálezu [21].
FLUORESCENČNÁ ANALÝZA
V priebehu posledných dvadsiatich rokov došlo k zintenzívneniu používania fluorescencie v oblasti biologických vied. Z biochémie a biofyziky sa jej použitie rozšírilo aj do ďalších oblastí a dnes sa využíva v prietokovej cytometrii, biotechnológiách, medicínskej diagnostike, genetickej analýze a ďalších [12].
Luminiscencia je pojem označujúci emisiu svetla z akejkoľvek látky v excitovanom stave. Je rozdelená na dva typy (fluorescencia a fosforescencia) v závislosti od charakteru excitovaného stavu. Po absorpcii svetla určitej vlnovej dĺžky elektróny prechádzajú do vzbudeného stavu. Vzbudený singletový elektrón sa spáruje s druhým voľným elektrónom, čím sa vracia do základného tvaru a dochádza k emisii fotónov [14].
Fluorofóry sú látky, u ktorých je možné pozorovať fluorescenciu. Exogénne fluorofóry sú dodané do organizmu s cieľom dosiahnuť fluorescenciu. Ak sú prítomné v organizme, hovoríme o endogénnych fluorofóroch, čím umožňujú autofluorescenciu [18]. Medzi najdôležitejšie endogénne fluorofóry radíme molekuly, ktoré sú mohutne distribuované v bunkách a tkanivách, ako sú proteíny, ktoré obsahujú aromatické aminokyseliny, NADPH, lipopigmenty a flavíny. Autofluorescencia môže narastať vďaka štrukturálnym proteínom (najmä kolagén a elastín – najdôležitejšie fluorofóry extracelulárnej matrix). Hlavnou výhodou autofluorescencie je možnosť sledovania natívnych vzoriek v reálnom čase bez biopsie a potrebných príprav k histologickému vyšetreniu [15].
MATERIÁL A METODIKA NA PILOTNÉ FLUORESCENČNÉ VYŠETRENIE SYNOVIÁLNEJ TEKUTINY TEMPOROMANDIBULÁRNEHO KĹBU
Synoviálna tekutina bola odobraná dvom pacien-tom na I. stomatologickej klinike LF UPJŠ a UNLP v Košiciach. Pacientovi vo veku 57 rokov bola diagnostikovaná arthrosis articulationis temporomandibularis bilateralis, u pacienta vo veku 18 rokov bola pozorovaná dislocatio disci anterioris bilateralis. U oboch pacientov bola indikovaná artrocentéza s podaním kyseliny hyalurónovej. Odber vzorky synoviálnej tekutiny v objeme 20 µl bol uskutočnený po predchádzajúcej aplikácií dvoch mililitrov fyziologického roztoku.
Odber ST bol realizovaný tesne pred samotným výkonom. Spracovanie a fluorescenčná analýza vzoriek prebehla na Ústave lekárskej a klinickej biochémie LF UPJŠ v Košiciach. Vzorky ST boli nariedené deionizovanou vodou v pomere 20 µl vzorka ku 480 µl deionizované vody. Následne bola uskutočnená fluorescenčná analýza synoviálnej tekutiny s použitím spektrofotometra Perkin Elmer LS 55 (Waltham, Masschusetts, USA). Merané boli synchrónne fluorescenčné matrice pri nasledovných nastaveniach prístroja: rozsah vlnových dĺžok 200–600 nm, posun emisného monochromátora oproti excitačnému Δλ = 30 nm, počet skenov 10, krokovanie 20 nm, rýchlosť skenovania 1200 nm/min, štrbiny ex/em: 10/10 nm.
VÝSLEDKY
Z nameraných údajov je zrejmé, že u pacienta č.1 je vo fluorescenčnom fingerprinte prítomné fluo-rescenčné centrum ex/em 273/363 nm s intenzitou 280 a.u. typické pre proteíny s obsahom tryptofánu. Na rozdiel od pacienta 1 je u pacienta 2 nižšia intenzita fluorescencie (131 a.u.) v oblasti proteínov s obsahom tryptofánu. Zároveň je na synchrónnej matrici viditeľné výrazné atypické fluorescenčné centrum s maximom pri vlnových dĺžkach ex/em 312/362 nm (obr. 2, 3).
1. Porovnanie fluorescenčných fingerprintov pacientov 1 a 2 Os x – excitačná vlnová dĺžka v nm; os y – Stokesov posun v nm 
2. Porovnanie synchrónnych spektier u oboch pacientov pri Stokesovom posune 90 nm; obrázok demonštruje výrazne rozdielnu fluorescenciu v oblasti proteínov (excitácia 270–280 nm) a atypický pík pri 312 nm Os x – excitačná vlnová dĺžka; os y – intenzita fluorescencie; modrá – pacient 1; červená pacient 2 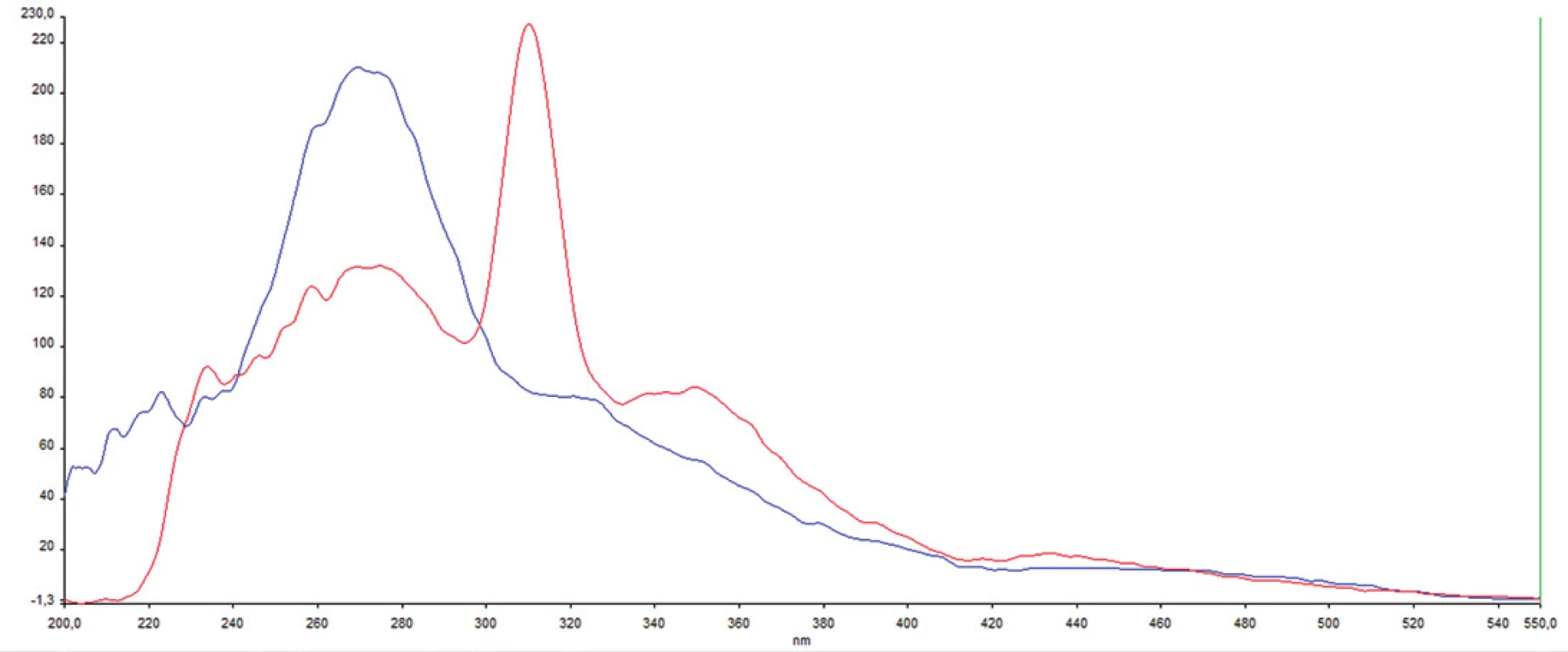
DISKUSIA
Jednou z možností vyšetrenia synoviálnej tekutiny je vysoko citlivá fluorescenčná analýza. Predošlé práce skúmajúce fluorescenciu synoviálnej tekutiny získanej z lakťového kĺbu psov popisujú vyššiu intenzitu fluorescencie typickej pre proteíny u skupiny psov so zápalovo-degeneratívnymi ochoreniami v porovnaní so skupinou zdravých psov [3]. V našom experimente mal pacient 1 bilaterálne artrózu TMK a zároveň jeho fluorescencia v oblasti 273/363 nm bola asi dvojnásobne vyššia ako u pacienta 2 ošetrovaného pre obojstrannú dislokáciu disku bez degeneratívno-zápalových zmien. Naše výsledky z pilotnej štúdie sú teda v súlade s porovnávanou štúdiou. Počet vzoriek bol vzhľadom na náročnosť odberu a jeho invazivitu nízky, a preto ich nemožno štatisticky vyhodnocovať, avšak korelácia s výsledkami autorov Bilská a kol. [3], u ktorých bol experiment vykonaný na väčšom súbore vzoriek (zdravý/s osteoartrózou N = 29/9), nasvedčuje, že vyšetrenie natívnej fluorescencie synoviálnej tekutiny metódou snímania fluorescenčného fingerprintu má určitý diagnostický potenciál, ktorý by mohol byť v budúcnosti bližšie popísaný.
ZÁVER
Vyšetrenie synoviálnej tekutiny temporomandibulárneho kĺbu nie je bežnou súčasťou diagnostiky ochorení TMK, ale potenciál vyšetrenia tohto relatívne málo prebádaného biologického materiálu pre včasnú diagnostiku intrakapsulárnych ochorení TMK je veľký napriek náročnosti odberu a nízkemu objem odobranej vzorky. Za zvýšenú popularitu fluo-rescenčných metodík v oblasti biologických vied je zodpovedná ich vysoká citlivosť a jednoduchosť prevedenia. Fluorescenčná analýza vykazuje diagnostický potenciál aj pri malom objeme vzorky. Pilotný experiment ukázal, že fluorescencia synoviálnej tekutiny v oblasti spektra vlnových dĺžok typického pre proteíny je signifikantne vyššia u pacientov s degeneratívno-zápalovými zmenami oproti kontrole a v prípade, že by sa odberová procedúra optimalizovala, mohla by sa v budúcnosti vykonať na väčšom počte pacientov.
MUDr. Vladimíra Schwartzová, PhD, MHA
1. stomatologická klinika LF UPJŠ a UNLP
Trieda SNP 1
040 11 Košice
Slovenská republika
e-mail: vladkaschwartzova@gmail.com
Sources
1. Abubaker, O. A., Lam, D., Benson, K. J.: Oral and maxillofacial surgery secrets. 3. vydanie. Mosby, 2015. 576 s. ISBN: 978-0-323-29430-0.
2. Aceves-Avila, F. J., et al.: The first descriptions of terapeutic arthrocentesis: a historical note. In: Rheumatology [online], roč. 42, 2003, č. 1, s.. 180–183. Dostupné na internete: http://rheumatology.oxfordjournals.org/content/42/1/180.full.
3. Bilská, K., Šteffeková, Z., Birková, A., et al.: The use of native fluorescence analysis of synovial fluid in diagnosis of medial compartment disease in medium - and large-breed dogs. J Veterinary Diagnostic Invest., roč. 28, 2016, č. 3, s. 332–337.
4. Čihák, R.: Anatomie 1. 3.vyd. Praha: Grada, 2011. 534 s. ISBN 978-80-247-3817-8.
5. Dungl, P.: Ortopedie. Praha: Grada, 2005. 1280 s. ISBN 80-247-0550-8.
6. Faryna, A., Goldenberg, K.: Joint fluid., clinical methods: the history, physical, and laboratory examinations. 3rd edition. Boston: Butterworths, 1990. In: Walker, H. K., Hall, W. D., Hurst, J. W., eds. Chapter 166. Available from: https://www.ncbi.nlm.nih.gov/books/NBK274/.
7. Guarda-Nardini, L., et al.: Intra-articular injection of hyaluronic acid for temporomandibular joint osteoarthritis in elderly patients. Stomatologija, Baltic Dental Maxillofacial. J., roč. 11, 2009, č. 2, s. 60–65.
8. Hand, A. R., Frank, M. E.: Fundamentals of oral histology and physiology. John Wiley&Sons Inc, 2014. 296 s. ISBN 978-1-118-34291-6.
9. Hulín, I., a kol.: Patofyziológia. 7. vyd. Bratislava: Slovak Academic Press, 2009. 1288 s. ISBN 978-80-8095-043-9.
10. Kostrzewa-Janicka, J., Jurkowski, P., Nędzi-Góra, M., Mierzwińska-Natalska, E.: Inflammatory markers in temporomandibular joint disorders. Central European Journal of Immunology [online]. roč. 37, 2012, č. 3, s. 290–293 [cit. 2016-07-30]. Dostupné na internete: www.termedia.pl/Review-paper-Inflammatory-markers-in-temporomandibular-joint-disorders,10,19473,0,1.html.
11. Kubota, E., et al.: Interleukin 1 beta and stromelysin (MMP3) activity of synovial fluid as possible markers of osteoarthritis in the temporomandibular joint. Journal of Oral and Maxillofacial Surgery [online]., roč. 55, 1997, č. 1, s. 20–27 [cit. 2016-08-01]. Dostupné na internete: www.ncbi.nlm.nih.gov/pubmed/8994464
12. Lakowicz, R. J.: Principles of fluorescence spectroscopy. 3. vyd. Baltimore: Springer, 2006. 954 s. ISBN 978-0-387-31278-1.
13. Miloro, M., Ghali, G. E., Larsen, P., Whaite, P.: Peterson´s principles of oral and maxillofacial surgery. 2. vyd. Hamilton: BC Decker Inc, 2004. 1500 s. ISBN 1-55009-234-0.
14. Miškovský, P., Uličný, J., Sedlák, M.: Praktikum k experimentálnym metódam biofyziky I: Metódy optickej spektroskopie. Košice: UPJŠ, 1989, 223 s. ISBN 8070970065.
15. Monici, M.: Cell and tissue autofluorescence research and diagnostic applications. Biotechnol. Ann. Rev., roč. 11, 2005, s. 227–256.
16. Naujoks, C., et al.: Principles of cartilage tissue engineering in TMJ reconstruction. In: Head&Face medicine [online]., roč. 4, 2008, č. 3 [cit. 2016-07-27]. Dostupné na internete: https://head-face-med.biomedcentral.com/articles/10.1186/1746-160X-4-3
17. Olejárová, M.: Revmatologie v kostce. Praha: Triton, 2008. 231 s. ISBN 978-80-7387-115-4.
18. Pierce, C. M., Javier, J. J., Richards-Kortum, R.: Optical contrast agents and imaging systems for detection and diagnosis of cancer. International Journal of Cancer. [online]., roč. 123, 2008, č. 9, s. 1979–1990 [cit. 2017-04-22]. Dostupné na internete: www.ncbi.nlm.nih.gov/pmc/articles/PMC2902964/.
19. Smith, M. D.: The normal synovium. In: The Open Rheumatology Journal [online]. roč. 5, 2011, č. 1, s. 100–106 [cit. 2016-07-27]. Dostupné na internete: www.benthamopen.com/FULLTEXT/TORJ-5-100
20. Trnavský, K., Rybka, V., a kol.: Syndrom bolestivého kolena. Praha: Galén, 2006, 225 s. ISBN 80-7262-391-5
21. Tvrdý, P.: Stanovení hladiny cytokinů v klobní tekutině jako alternatívní možnost vyšetření vnitřních poruch temporomandibulárního kloubu. Čes. Stomatol., roč. 111, 2011, č. 4, s. 82–88.
22. Torres-Chávez, K. E., Sanfins, J. M., Clemente-Napimoga, J. T., et al.: Effect of gonadal steroid hormones on formalin-induced temporomandibular joint inflammation. Eur. J. Pain., roč. 16, 2012, č. 2, s. 204–216. doi: 10.1016/j.ejpain.2011.06.007.
Labels
Maxillofacial surgery Orthodontics Dental medicine
Article was published inCzech Dental Journal

2018 Issue 3
Most read in this issue- Relationship between Breastfeeding and Severe Early Childhood Caries
- Diagnostic Potential of the Synovial Fluid
- Laser Use in Dentistry
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

