-
Medical journals
- Career
Orálne nosičstvo Staphylococcus aureus u stomatologických pacientov v závislosti od podmienok v ústnej dutine
(Pôvodná práca – retrospektívna štúdia)
Authors: A. Kaiglová 1; J. Špajdelová 1; M. Stanko 2; E. Dubajová 2
Authors‘ workplace: Katedra laboratórnych vyšetrovacích metód v zdravotníctve, Fakulta zdravotníctva a sociálnej práce, Trnavská univerzita, Trnava 1; Zubná ambulancia LUXDENT, s. r. o., Nitra 2
Published in: Česká stomatologie / Praktické zubní lékařství, ročník 116, 2016, 1, s. 12-19
Category: Original articles
Overview
Úvod a cieľ:
Staphylococcus aureus je významným oportunistickým patogénom s veľmi variabilným genómom, takže je zodpovedný za široké spektrum ochorení. Významným miestom výskytu tohto patogénu u zdravých jedincov, vrátane kmeňov rezistentných voči meticilínu, je okrem iných orgánov, akými sú napr. koža, hltan, sliznica nosa apod., aj ústna dutina. Hlavným cieľom našej štúdie bolo preto zistiť, či rôzne podmienky v ústnej dutine, ako parodontitída, fixné a snímateľné protetické zubné náhrady a stomatologické ochorenia s indikáciou na extrakciu, majú vplyv na mieru kolonizácie ústnej dutiny týmto mikroorganizmom a zároveň stanoviť frekvenciu výskytu meticilín rezistentných kmeňov Staphylococcus aureus u stomatologických pacientov.Metódy:
Vyšetrovaný súbor pozostával z 96 pacientov, ktorí v období od júna 2014 do januára 2015 navštívili zubnú ambulanciu LUXDENT, s.r.o., v Nitre. Súbor bol rozdelený do štyroch skupín podľa podmienok v ústnej dutine – a to do skupiny pacientov: 1. s parodontitídou, 2. so stomatologickými ochoreniami s indikáciou na extrakciu, 3. s fixnými alebo snímateľnými zubnými náhradami a 4. do kontrolnej skupiny. Pacientom sa sterilným tampónom urobili výtery z nosovej a ústnej dutiny a do 24 hodín sa transportovali do laboratória. V laboratóriu sa vzorky spracovali štandardnými metódami pre izoláciu a identifikáciu Staphylococcus aureus, s následnou konfirmáciou druhu metódou polymerázovej reťazovej reakcie, kde sa amplifikoval špecifický úsek nuc génu o veľkosti cca 270 bp, charakteristický pre tento druh mikroorganizmu. Meticilín rezistentné kmene Staphylococcus aureus sa identifikovali pomocou diskovej difúznej metódy podľa metodiky Európskeho výboru pre testovanie antimikrobiálnej citlivosti [8].Výsledky:
Prítomnosť tohto mikroorganizmu sa zistila v 35 vzorkách (20,2 %) zo 173 vyšetrených vzoriek (výtery z orálnej a nazálnej dutiny), z toho 31 vzoriek bolo na meticilín senzitívnych (88,58 %) a štyri vzorky boli voči meticilínu rezistentné (11,42 %). Medzi výskytom mikroorganizmu v nose a ústach bol štatisticky významný rozdiel (p < 0,05), s častejším výskytom v nazálnej dutine. Iba u troch z 96 pacientov (3,12 %) sa dokázala prítomnosť Staphylococcus aureus zároveň v nazálnej aj orálnej dutine. Pri porovnaní skupiny pacientov s fixnými a snímateľnými protetickými náhradami s ostatnými skupinami bol výskyt mikroorganizmu Staphylococcus aureus v tejto skupine signifikantne vyšší (p < 0,05).Závery:
Naše výsledky indikovali, že orálna dutina môže byť primárne (bez súčasnej prítomnosti mikroorganizmu v nose) kolonizovaná zlatým stafylokokom a podmienky v ústnej dutine, ako napr. fixné a snímateľné zubné náhrady, môžu mať na jej kolonizáciu významný vplyv.Klíčové slova:
Staphylococcus aureus – meticilín rezistentný Staphylococcus aureus – ústna dutina – parodontitída – protetické zubné náhradyÚVOD A CIEĽ ŠTÚDIE
Napriek množstvu vedeckých publikácií venovaných potenciálne patogénnemu mikroorganizmu Staphylococus aureus (S. aureus) a koaguláza negatívnym stafylokokom, je dostupných relatívne málo údajov o orálnej dutine ako rezervoári tohto mikroorganizmu. Orálna flóra pozostáva z viac ako 300 druhov baktérií a množstva nekultivovateľných mikroorganizmov, ktoré boli objavené až molekulárnymi biologickými technikami. Zatiaľ čo dôležitosť stafylokokov ako medicínsky významných patogénov je známa už mnoho rokov, existuje pomerne málo detailných štúdií o distribúcii stafylokokov v orálnej dutine. Je zjavné, že ústna dutina môže byť popri nazálnej dutine dôležitým rezervoárom stafylokokových infekcií – vrátane meticilín rezistentných, ktoré za istých podmienok môžu spôsobiť závažné ochorenia organizmu, vrátane infekčnej endokarditídy [11]. Meticilín rezistentné kmene S. aureus (MRSA), ktoré vykazujú mnohopočetnú rezistenciu voči bežne používaným antibiotikám sú jedným z najvýznamnejších gram-pozitívnych rezistentných patogénov. Okrem nemocničných kmeňov MRSA, spôsobujúcich nozokomiálne ochorenia, sa koncom minulého storočia objavujú u pacientov v ambulanciách aj tzv. komunitné (community-aquired) kmene, ktoré boli izolované od jedincov s negatívnou históriou pobytu v nemocničnom prostredí. Výsledky mnohých štúdií poukázali na zvyšujúci sa výskyt infekcií spôsobených komunitnými kmeňmi MRSA aj v bežnej populácii [24, 25, 26].
Informácií o podmienkach v ústnej dutine, ktoré podporujú jej kolonizáciu týmto patogénom, je však málo. Väčšina štúdií, ktorá sledovala možnosť eleminovať S. aureus z možného rezervoára infekcií sa zaoberala skôr prítomnosťou tohto mikroorganizmu v nazálnej dutine, zatiaľ čo orálna dutina bola z tohto pohľadu dlhodobo prehliadaná [16]. Cieľom našej štúdie bolo preto zistiť, či rôzne podmienky v ústnej dutine môžu ovplyvniť kolonizáciu týmto mikroorganizmom a zároveň stanoviť frekvenciu výskytu MRSA u stomatologických pacientov.
METÓDY
V spolupráci so stomatológom boli pacienti, ktorí boli oboznámení o štúdii a súhlasili s odberom vzoriek, zaradení do štyroch sledovaných skupín, a to do skupiny pacientov: 1. s parodontitídou, 2. so stomatologickými ochoreniami s indikáciou na extrakciu, 3. s fixnými alebo snímateľnými zubnými náhradami a 4. do kontrolnej skupiny. Pacientom sa sterilným tampónom, ktorý bol súčasťou odberovej súpravy Amies s agarovým gélovým transportným médiom bez aktívneho uhlia (fy Copan,Taliansko), urobili výtery z nosovej a ústnej dutiny a do 24 hod. sa transportovali do laboratória. Na zaradenie pacientov do prvej skupiny sa najskôr zistili hodnoty CPI indexu, na základe ktorých sa diagnostikoval stupeň poškodenia parodontu. Pacientom s parodontitídou sa potom odobrala vzorka pomocou papierových čapov, ktoré sa vložili do parodontálnych chobotov a následne do transportného média. Okrem papierových čapov sa do transportného média odobrala časť zubného kameňa. V skupine so stomatologickými ochoreniami s indikáciou na extrakciu sa pri extrakcii radixov do transportného média odobrali extrahované radixy zubov. U pacientov so snímateľnými náhradami bol ster robený priamo z miesta, kde protéza nasadá na sliznicu dutiny ústnej. Pri skupine s fixnými protetickými náhradami sa urobil ster vatovým tampónom v oblasti krčku zuba na vestibulárnej plôške. Kontrolnej skupine (pacienti so sanovaným chrupom, bez prítomnosti parodontitídy a protetických náhrad) bol sterilným tampónom odobraný ster zo supragingiválnej oblasti. V laboratóriu sa vzorky spracovali štandardnými metódami pre izoláciu a identifikáciu S. aureus. Odobratý biologický materiál sa z tampónu odberovej súpravy naniesol na krvný agar a na selektívno-diagnostickú pôdu – manitolový slaný agar (MSA) fy MkB Test, a.s., Slovensko, ktorý sa inkuboval 48 hodín pri teplote 37 °C.
Manitol-pozitívne kolónie boli ďalej analyzované farbením podľa Grama, katalázovým testom na dôkaz produkcie enzýmu katalázy a rýchlym aglutinačným testom PROLEX™ STAPH LATEX KIT, fy Pro-Lab Diagnostics, Veľká Británia, na prítomnosť proteínu A a viazanej koagulázy („clumping faktoru“). PROLEX™ STAPH LATEX KIT využíva latexové častice, senzibilizované fibrinogénom a IgG. Ak sa na bunkovej stene testovaných baktérií nachádza viazaná koaguláza (clumping factor) a/alebo proteín A, po ich zmiešaní s reagentom pozorujeme viditeľnú silnú aglutináciu latexových častíc, ktorá nastáva do 20 sekúnd po zmiešaní kolónií s reagentom. Kontrola testu sa uskutočňuje pomocou negatívneho kontrolného latexového reagentu, ktorý obsahuje latexové častice bez senzibilizácie.
Konfirmácia druhu S. aureus sa potom vykonala metódou polymerázovej reťazovej reakcie (PCR), pričom sa zisťovala prítomnosť špecifického fragmentu (cca 279bp) nuc génu, kódujúceho termostabilnú nukleázu tohto mikroorganizmu. Amplifikácii špecifického fragmentu nuc génu predchádzala izolácia DNA. Amplifikovaný úsek sa následne vizualizoval elektroforeticky za použitia agarózového gélu (obr. 1).
Image 1. Príklad gélovej elektroforézy amplifikovaného PCR produktu – špecifického úseku nuc génu S. aureus 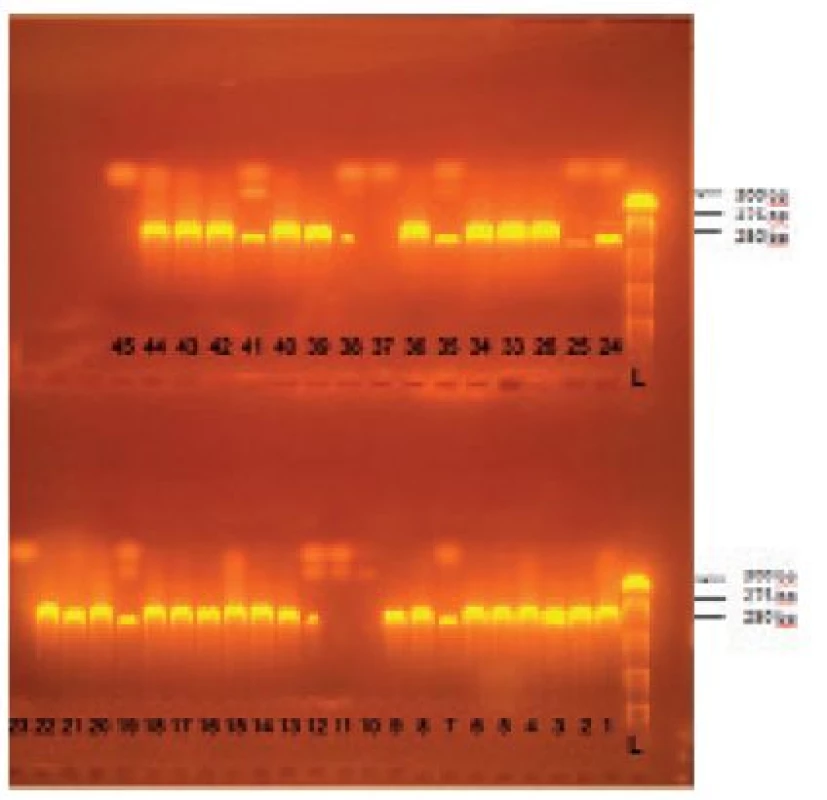
L –DNA ladder, 44 – pozitívna kontrola, 45 – negatívna kontrola, 10, 11, 23, 25, 37 – negatívne vzorky, ostatné jamky – pozitívne vzorky Izolácia DNA
Bakteriálna kultúra bola počas 24 hodín pri 37 °C rozmnožená v Muellerovom-Hintonovom bujóne a následne resuspendovaná vo fyziologickom roztoku tak, aby výsledná hustota suspenzie bola cca 1×10
8 baktérií/ml. Suspenzia baktérii (500 ml) sa centrifugovala pri 6000 × g počas troch minút. Po odstránení supernatantu boli usadené pelety následne resuspendované v 500 ml TE pufri (Tris-EDTA: 10 mM trisHCL, 1 mM EDTA – pH 8) a inkubované počas troch minút pri izbovej teplote. Po centrifugácii pri 6000× g počas troch minút a odstránení supernatantu boli pelety resuspendované v 250 ml PCR vody a vystavené teplote 100 °C počas 10 min. v termobloku. Po ochladení na izbovú teplotu bola bakteriálna suspenzia centrifugovaná pri 13 000 krát g počas 5 min., čím bola získaná uvoľnená DNA obsiahnutá v supernatante.
PCR amplifikácia
Amplifikácia špecifického úseku nuc génu S. aureus o veľkosti cca 270 bp sa uskutočnila v termocykleri T3000 Biometra, pričom boli použité primery podľa Brakstadta a kol. [3]. Ako master mix bol použitý komerčne dostupný Go Taq Green Master Mix (výrobca: Promega Corporation, USA).
Použitý program PCR bol nasledovný: 1. úvodná denaturácia – 4 min. (94 °C); 2. denaturácia DNA – 45 sekúnd (94 °C); 3. anelácia – 45 sekúnd (50 °C); 4. polymerizácia DNA – 60 sekúnd (72 °C);5. záverečná polymerizácia DNA – 2 min. (72 °C). Kroky 2, 3 a 4 sa opakovali tridsaťkrát.
Vizualizácia amplifikovaných vzoriek
Amplifikované vzorky sa ďalej analyzovali elektroforézou. Použil sa dvojpercentný agarózový gél na separáciu fragmentov. Na označenie DNA sa použila GelRed farbička (výrobca: Biotium Inc., USA).
Diskový difúzny test
Izoláty S. aureus sa ďalej testovali diskovou difúznou metódou na citlivosť k cefoxitínu podľa metodiky Európskeho výboru pre testovanie antimikrobiálnej citlivosti [8]. Podľa doporučení tejto organizácie, ako aj Inštitútu pre klinické a laboratórne štandardy [5] je diskový difúzny test s použitím diskov s obsahom 30 µg cefoxitínu odporúčanou metódou na stanovenie meticilín rezistentných kmeňov S. aureus (MRSA). Za rezistentné sme považovali kmene so zónou inhibície menšou ako 22 mm, za citlivé so zónou inhibície väčšou ako 22 mm. Všetci pacienti zaradení do štúdie vyplnili dotazník, na základe ktorého sme mohli zistiť prípadnú predchádzajúcu históriu hospitalizácie.
VÝSLEDKY
V tejto štúdii bolo celkovo vyšetrených 96 pacientov, ktorí boli zaradený v spolupráci so zubným lekárom do štyroch sledovaných skupín, a to do skupiny pacientov s parodontitídou, zubnými náhradami, stomatologickými ochoreniami s indikáciou na extrakciu a do kontrolnej skupiny. Z celkového počtu vyšetrených vzoriek bolo 77 výterov z nosa a 96 výterov z úst. Na štúdii sa zúčastnilo 63 žien a 33 mužov. Najstarším pacientom bola 88ročná žena a najmladším pacientom bol 32ročný muž. Štatistická analýza (Mannov-Whitneyho U test a Pearsonov χ2 test) nedokázala signifikantný vplyv veku ani pohlavia na výskyt mikroorganizmu S. aureus v ústnej dutine.
Prítomnosť S. aureus sa zistila v 35 vzorkách z celkového počtu 173 vyšetrených vzoriek, z toho 77 vzoriek pochádzalo z nosa a 96 vzoriek z úst pacientov. Celkový výskyt zlatého stafylokoka v sledovanom súbore bol 20,2 %. Z 35 vzoriek s dokázanou prítomnosťou S. aureus pochádzalo 22 vzoriek z nosa a 13 vzoriek z dutiny ústnej. V prípade troch pacientov (3,12 %) sa dokázala prítomnosť toho mikroorganizmu zároveň v nose aj v dutine ústnej.
Pri porovnaní výskytu S. aureus v ústach a v nose bol vyšší výskyt tejto baktérie v nose (22 zo 77) ako v ústach (13 z 96). χ2 testom sme zistili, že medzi výskytom S. aureus v nose a ústach bol štatisticky významný rozdiel (p < 0,05).
Z grafu 1 vidieť, že najväčší podiel pozitívnych vzoriek je v skupine pacientov s protetickými náhradami. Avšak vzhľadom na nízky počet pozitívnych vzoriek sme pri použití Fisherovho testu nepotvrdili štatisticky významný rozdiel medzi skupinami (p = 0,09). Preto sme v ďalšom skúmaní použili Pearsonov χ² test a porovnali skupiny s protetickými náhradami voči ostatným skupinám (graf 2), pričom sme zistili medzi skupinou pacientov s protetickými náhradami s ostatnými skupinami štatisticky významný rozdiel (χ² = 4,48; p < 0,05). Výskyt S. aureus bol v tejto skupine približne štyrikrát častejší (OR = 4,21; CI = 95 %).
Graph 1. Výskyt S. aureus v dutine ústnej v jednotlivých sledovaných skupinách 
KONTR kontrolná skupina, EXTR skupina s indikáciami na extrakciu, PAROD skupina s parodontitídou, PROTET skupina s protet. náhradami Graph 2. Výskyt S. aureus v dutine ústnej – porovnanie skupiny s protetickými náhradami s ostatnými skupinami 
PROTET skupina s protetickými náhradami, OSTATNÉ – súbor pozostávajúci z pacientov ostatných vyšetrovaných skupín Taktiež pri porovnávaní pomeru medzi prítomnosťou mikroorganizmu S. aureus v ústach a v nose v skupine pacientov s protetickými zubnými náhradami bol tento pomer obrátený ako v kontrolnej skupine a skupine s parodontitídou a extrakciami (tab. 1).
Table 1. Porovnanie výskytu SAU vs SAN v jednotlivých skupinách 
SAU % izolátov S. aureus v ústach (počet) , SAN % izolátov S. aureus v nose (počet) Z celkového počtu 35 izolovaných vzoriek S. aureus sme zistili v štyroch (11,42 %) prípadoch kmeň MRSA. Z toho ani jeden pacient nemal MRSA kmeň aj v ústach aj v nose.
DISKUSIA
S. aureus je významným oportunistickým patogénom s veľmi variabilným genómom, takže je zodpovedný za široké spektrum infekcií. Významným miestom výskytu tohto patogénu u zdravých jedincov, vrátane meticilín rezistentných kmeňov, je okrem iných orgánov, ako je koža, hltan, sliznica nosa apod., aj dutina ústna [2, 4, 16]. Navyše, ako naznačujú ďalšie štúdie, S. aureus sa môže pravdepodobne z ústnej dutiny diseminovať aj do iných častí tela a spôsobiť tu závažné infekcie [11, 21].
Čo sa týka zisteného percenta pozitívnych nálezov v nosovej dutine, naše výsledky sú podobné tým, ktoré zistili Mehraj a kol. v štúdii náhodne vybraných obyvateľov zo severného Nemecka. V tejto štúdii sa vyšetrili nosové výtery od 389 participantov kultivačne a pomocou PCR, pričom S. aureus bol izolovaný v osemdesiatich piatich vzorkách – t.j. 21, 9 % z celkového počtu participantov [15]. Podobne autori Fomda a kol. izolovali S. aureus z nosovej dutiny u 29,7 % zdravých jedincov vo vybraných geografických regiónoch v Indii [9]. Mechanizmus vedúci k osídleniu nazálnej dutiny týmto mikroorganizmom je multifaktoriálny a môže byť ovplyvnený rôznymi okolnosťami. S. aureus môže kolonizovať aj ústnu dutinu, ale informácií o podmienkach, ktoré podporujú jej kolonizáciu týmto mikroorganizmom je menej. Väčšina štúdií, ktorá sledovala možnosť eliminovať S. aureus z možného rezervoára infekcií sa zaoberala skôr prítomnosťou tohto mikroorganizmu v nazálnej dutine [1, 12], zatiaľ čo orálna dutina bola z tohto pohľadu dlhodobo prehliadaná. Práca Nilssona a Rippu však poukazuje na fakt, že S. aureus môže kolonizovať ústnu dutinu a orofarynx aj bez súčasnej prítomnosti v nazálnej dutine [19], ako je to napokon zrejmé aj z našich pozorovaní.
V rozsiahlej štúdii, pozostávajúcej z testovania 11 312 vzoriek v mikrobiologickom laboratóriu v Glasgowe, bol S. aureus izolovaný v 1312 vzorkách pacientov so suspektnými orálnymi a periorálnymi ochoreniami, čo bolo 18 % z celkového počtu vzoriek [16]. Toto je porovnateľné s našimi výsledkami (13,55 %), aj keď náš súbor pacientov bol oveľa menší a zahŕňal aj zdravých jedincov, ktorí navštívili zubnú ambulanciu v rámci prevencie a boli zaradení do kontrolnej skupiny. V skupine pacientov s protetickými náhradami sme izolovali S. aureus z ústnej dutiny vo väčšom počte prípadov ako v nose (tab. 1), čo naznačuje, že prítomnosť S. aureus v ústach by mohla primárne súvisieť s podmienkami v ústnej dutine. Podobne, Passariello a kol. zistili v skupine pacientov s protetickými náhradami a ochoreniami periodontu významne vyšší počet izolátov S. aureus v ústnej dutine než v nose (39,3 % vs. 14,3 %, p < 0,01),v porovnaní s kontrolou [20]. Na rozdiel od tejto štúdie, kde boli zaznamenané signifikantné rozdiely aj v prítomnosti S. aureus v ústnej dutine medzi kontrolou a skupinou pacientov s fixnými a snímateľnými protetickými náhradami, v našej štúdii tento rozdiel síce bol zaznamenaný, ale nebol na hladine významnosti (graf 1). Preto sme porovnali skupiny s protetickými náhradami so zlúčeným súborom z ostatných skupín (kontrolná skupina, skupina s parodontitídou, skupina s indikáciami na extrakciu) a zistili sme štatisticky významný rozdiel ( p < 0,05) – výskyt S. aureus bol v skupine s protetickými náhradami približne štyrikrát častejší (OR = 4,21; CI = 95 %) ako v porovnávanom súbore (graf 2).
Aby S. aureus mohol kolonizovať ústnu dutinu, vyvinul množstvo stratégií, ako napr. uvoľňovanie extracelulárnych enzýmov alebo formovanie biofilmu. Tento patogén má schopnosť tvoriť mnohobunkové spoločenstvá, ktoré rastú ponorené do extracelulárnej matrice – biofilmu, pozostávajúceho z exopolysacharidov, proteínov, nukleových kyselín a lipidov, ktoré chránia mikroorganizmus pred imunitným systémom hostiteľa. Heo a kol. dokázali, že niektoré proteíny v ľudských slinách (imunoglobulín A a G, lyzozým C, mucín 7), ktoré sa podieľajú na imunitnej odpovedi hostiteľského organizmu, sa selektívne viažu na povrch S. aureus [10]. Toto „zosieťovanie“ mikroorganizmov s proteínmi môže spôsobiť aglutináciu a následné odstránenie patogénov z ústnej dutiny napr. ich prehltnutím. Je zaujímavé, že kmene S. aureus formujúce biofilm adherujú k týmto proteínom v menšej miere ako planktonické formy. Autori práce sa zmieňujú o možnej asociácii medzi dysfunkciami, týkajúcimi sa tvorby slín, tvorbou biofilmu a kolonizáciou ústnej dutiny S. aureus. Podobne, Kukita a kol. zistili, že S. aureus sa viaže na glykoproteín prítomný v slinách – gp 340, ktorý podporuje bakteriálnu adhéziu na zuby a sliznicu [13]. Schopnosť adhézie je dôležitým faktorom bakteriálnej patogenity. S. aureus vytvára biofilm nielen na hostiteľských tkanivách, ale aj na materiáloch využívaných pre výrobu protetických náhrad. Merghni a kol. sledovali schopnosť tohto mikrooorganizmu vytvárať biofilm na bežne používaných dentálnych živiciach Bis-GMA a PMMA a zistili, že 90 % kmeňov S. aureus izolovaného z ústnej dutiny pacientov zubnej ambulancie bolo biofilm-pozitívnych a malo schopnosť tvoriť biofilm na oboch testovaných povrchoch [17]. Práve táto pozoruhodná schopnosť adhézie S. aureus na materiály používané pri výrobe protetických náhrad môže byť príčinou aj nami pozorovaného častejšieho výskytu tohto patogénu v skupine pacientov s protetickými náhradami. Keďže prítomnosť baktérii je kumulovaná v plaku, usadzujúcom sa na zubných náhradách, správna starostlivosť a hygiena dutiny ústnej u týchto pacientov je mimoriadne dôležitá. V štúdii autorov Shetty a kol. sa potvrdzuje, že inštruovanie pacienta o spôsobe udržania hygieny zubných protéz predchádza ochoreniam parodontu, zubným kazom a zápalovým zmenám na sliznici [23].
Závažné infekcie môžu spôsobiť predovšetkým tzv. meticilín rezistentné kmene S. aureus (MRSA), pre liečbu ktorých možno použiť len obmedzený výber antibiotík. MRSA je okrem oxacilínu, meticilínu a β-laktámových antibiotík, vrátane cefalosporínov a karbapenémov, často nositeľom mnohopočetnej rezistencie aj na iné bežne používané antibiotiká, ako je erytromycín, klindamycín a tetracyklín. Od roku 1996 sa objavujú správy o zníženej citlivosti MRSA voči vankomycínu. Mechanizmus rezistencie k β-laktámovým antibiotikám je sprostredkovaný génom mecA, ktorý kóduje PBP-2a (penicillin-binding protein 2a), a je začlenený do chromozómov meticilín citlivého kmeňa S. aureus. Beta-laktámové antibiotiká sa viažu na PBP (t.j. enzým transpeptidázu) a zabraňujú transpeptidácii disacharidových polymérov N-acetylmuramovej kyseliny a N-acetylglukózamínu, čím inhibujú tvorbu bunkovej steny. PBP-2a vykazuje – na rozdiel od PBP v meticilín citlivých kmeňoch – nízku afinitu k meticilínu a nezabraňuje formovaniu bunkovej steny baktérie. Pharma-report z roku 2012 tvrdí, že S. aureus je jednou z piatich najčastejšie sa vyskytujúcich príčin vzniku nozokomiálnych ochorení. V USA sa každoročne nakazí približne 500 000 pacientov [22]. Za distribúciu v populácii vďačí MRSA rýchlej klonálnej expanzívnosti existujúcich kmeňov, ako aj schopnosti včleniť MRSA stafylokokovú chromozómovú kazetu do genómu citlivých kmeňov, čím môžu neustále obnovovať svoj genóm. Takto vzniklo na svete množstvo kmeňov, ktoré sa naučili vyhnúť liečbe antibiotikami. Okrem nemocničných kmeňov, spôsobujúcich nozokomiálne ochorenia, sa koncom minulého storočia objavujú u pacientov v ambulanciách aj tzv. komunitné (community-aquired) kmene, ktoré boli izolované od jedincov s negatívnou históriou pobytu v nemocničnom prostredí alebo inom liečebnom zariadení. Množstvo štúdií dokumentuje, že meticilín-rezistentný S. aureus, ktorý je v posledných rokoch pod selekčným tlakom antibiotík, získal rozhodujúcu schopnosť infikovať ľudí aj mimo nemocnice [6, 7, 24, 26]. Za rizikovú skupinu ľudí, čo sa týka výskytu komunitných kmeňov MRSA, sa považujú užívatelia injekčných drog, homosexuálna komunita, väzni apod., ale Moran a kol. referovali o zvyšujúcom sa výskyte infekcií spôsobených komunitnými kmeňmi MRSA aj v bežnej populácii [18]. V našej štúdii, kde sme sa zaoberali izolovaním baktérie S. aureus od pacientov zubnej ambulancie, nás zaujímala aj frekvencia výskytu komunitných kmeňov MRSA v tomto súbore. Všetci pacienti, zaradení do štúdie, vyplnili dotazník, na základe ktorého sme mohli vyradiť pacientov s prípadnou predchádzajúcou históriu hospitalizácie alebo pobytu v liečebnom zariadení. Z 35 izolovaných vzoriek S. aureus sme zistili v štyroch prípadoch kmeň MRSA, čo predstavovalo 11,42 %. Z toho ani jeden pacient nemal kmeň MRSA zároveň v ústach aj v nose. Napriek tomu, že náš súbor sledovaných pacientov bol pomerne malý (n = 96), aj McCormack a kol. v oveľa rozsiahlejšom súbore referoval o 10% výskyte MRSA kmeňov, z celkového počtu 1782 sledovaných pacientov s dentálnymi problémami [16]. Orálne nosičstvo MRSA kmeňov môže znamenať riziko pre infikovanie iných častí organizmu, ale aj možnosť infikovať ďalších pacientov alebo zdravotníckych pracovníkov. V odbornej literatúre sú zaznamenané minimálne dva prípady prenosu MRSA od zubných lekárov na pacientov [14], preto preventívne opatrenia, ktoré zabránia šíreniu infekcie medzi pacientmi v zubnej ambulancii nadobúdajú mimoriadny význam.
ZÁVER
Údaje prezentované v tejto štúdii naznačujú, že popri tzv. nosovom nosičstve stafylokokov rezervoárom zlatého stafylokoka môže byť aj ústna dutina a prítomnosť fixných alebo snímateľných protetických náhrad môže významne zvýšiť mieru kolonizácie orálnej dutiny týmto mikroorganizmom. Pacienti so zubnými náhradami by preto mali viac dbať nielen o dentálnu hygienu dutiny ústnej, ale aj svojej protetickej náhrady. Kľúčom k predchádzaniu vzniku širokého spektra možných infekcií u takýchto pacientov by mohli byť pravidelné preventívne prehliadky u stomatológa s následnou terapiou a taktiež inštruktáž a ošetrenie dentálnou hygieničkou. V našej štúdii sme nedokázali na hladine významnosti vplyv parodontitídy a závažných stomatologických ochorení s indikáciou na extrakciu na osídlenie ústnej dutiny zlatým stafylokokom, aj keď pokračovanie štúdie s väčším počtom parcipitantov by mohlo vniesť svetlo do tejto problematiky. V sledovanom súbore pacientov sme odhalili aj štyroch nosičov kmeňov MRSA bez predchádzajúcej histórie hospitalizácie v nemocnici. Pretože je známe, že komunitné kmene MRSA majú dvojnásobnú rýchlosť šírenia oproti nemocničným kmeňom, preventívne opatrenia, ktoré zabránia šíreniu infekcie medzi pacientmi v zubnej ambulancii nadobúdajú mimoriadny význam.
MVDr. Alžbeta Kaiglová, PhD.
Trnavská univerzita, FZaSP, LVMvZ
Univerzitné námestie 1
918 43 Trnava
Slovensko
e-mail: alzbeta.kaiglova@truni.sk
Sources
1. Ammerlaan, H. S., Kluytmans, J. A., Wertheim, H. F., Nouwen, J. L., Bonten, M. J.: Eradication of methicillin-resistant Staphylococcus aureus carriage: a systematic review. Clin. Infect. Dis., roč. 48, 2009, č. 7, s. 922–930.
2. Blomqvist, S., Leonhardt, A., Arirachakaran, P., Carlen, A., Dahlén, G.: Phenotype, genotype, and antibiotic susceptibility of Swedish and Thai oral isolates of Staphylococcus aureus. J. Oral Microbiol. [online]. 2015, 7 [cit. 2015-08-15]. Dostupný z WWW: http://www.ncbi.nlm.nih.gov/pmc/articles/PMC4409631/.
3. Brakstad, G. O., Aasbakk, K., Maeland, A. J.: Detection of Staphylococcus aureus by polymerase chain reaction amplification of the nuc gene. J. Clin. Microbiol., roč. 30, 1992, č. 7, s. 1654–1660.
4. Buonavoglia, A., Latronico, F., Greco, M. F., D‘Abramo, M., Marinaro, M., Mangini, F., Corrente, M.: Methicillin-resistant staphylococci carriage in the oral cavity: a study conducted in Bari (Italy). Oral Dis. [online], roč. 16, 2010, č. 5, s. 465–468 [cit. 2015-08-15]. Dostupný z WWW: http://www.ncbi.nlm.nih.gov/pubmed/20233317.
5. Clinical and Laboratory Standards Institute: NCCLS Performance standards for Antimicrobial disc diffusion tests; Approved standards. 9th ed. CLSI Document M2-M9. Wayne, P.: Clinical and Laboratory Standards Institute; 2006.
6. Nozaki, C., Masaki, T., Kim, S. J., Cruz, R. S., Bermido, C. M., Kim, K. Y., Park, C.: Comparative prevalence of community-acquired-methicillin-resistant Staphyloccocus aureus (CA-MRSA) among Students of Centro Escolar University (Philippines), Kumamoto Health Science University (Japan) and Daegu Health College (Korea). Biomed. Res. [online], roč. 26, 2015, s. 259, cit. 2015-08-15]. Dostupný z WWW: http://www.biomedres.info/yahoo_site_admin/assets/docs/259-265.64225011.pdf.
7. Di Giacobbe, A., Pecetta, S., Virga, A., Scazzocchio, F., Aquilanti, L., Iebba, V., Passariello, C.: Diffusion of meticillin-resistant Staphylococcus aureus USA300 strains in central Italy. Int J. Antimicrob. Agents, roč. 37, 2010, č.4, s. 49–50.
8. European Committee on Antibacteral Susceptibility Testing: EUCAST: AST of bacteria. [on line]. 2014 [cit. 2015-04-01]. Dostupný z WWW: http://www.eucast.org/ast_of_bacteria/ .
9. Fomda, A. B. A., Thokar, M. A, Khan, A., Bhat, J. A., Zahoor, D., Bashir, G., Majid, A., Ray, P.: Nasal carriage of methicilin-resistant Staphylococcus aureus among healthy population of Kashmir. Indian J. Med. Microbiol., roč. 21, 2014, č. 13, s. 39–43.
10. Heo, S. M., Choi, K. S., Kazim, L. A., Reddy, M. S, Haase, E. M., Scannapieco, F. A., Ruhl, S.: Host defense proteins derived from human saliva bind to Staphylococcus aureus. Infect. Immun., roč. 81, 2013, č. 4, s. 1364–1373.
11. Kasmi, G., Refatllari, E., Dumani, S., Refatllari, A.: Early infective endocarditis due to Staphylococcus aureus following dental procedures. Clin. Lab., roč. 60, 2014, č. 11, s. 1933–1936.
12. Kaur, D. C., Narayan, P. A.: Mupirocin resistance in nasal carriage of Staphylococcus aureus among healthcare workers of a tertiary care rural hospital. Indian J. Crit. Care Med., roč. 18, 2014, č. 11, s. 716–721.
13. Kukita, K., Kawada-Matsuo, M., Oho, T., Nagatomo, M., Oogai, Y., Hashimoto, M., Suda, Y., Tanaka, T., Komatsuzawa, H.: Staphylococcus aureus SasA is responsible for binding to the salivary agglutinin gp 340, derived from human saliva. Infect. Immun., roč. 81, 2013, č. 14, s. 1870–1879.
14. Martin, M. V., Hardy, P.: Two cases of oral infection by methicillin-resistant Staphylococcus aureus. Brit. Dent. J., roč. 170, 1991, č. 2, s. 63–64.
15. Mehraj, J., Akmatov, M. K., Strompl, J., Gatzemeier, A., Layer, F., Werner, G., Pieper, D. H., Medina, E., Witte, W., Pessler, F., Krause, G.: Methicillin-sensitive and methicillin-resistant Staphylococcus aureus nasal carriage in a random sample of non-hospitalized adult population in northern Germany. PLoS One, roč. 9, 2014, č. 9, s. 24–29.
16. McCormack, M. G., Smith, A. J., Akram, A. N., Jackson, M., Robertson, D., Edwards, G.: Staphylococcus aureus and the oral cavity: An overlooked source of carriage and infection? Am. J. Infect. Control, roč. 43, 2015, č. 1, s. 35–37.
17. Merghni, A., Nejma, B. M., Hentati, H., Mahjoub, A., Mastouri, M.: Adhesive properties and extracellular enzymatic activity of Staphylococcus aureus strains isolated from oral cavity. Microb. Pathog., roč. 73, 2014, s. 7–12.
18. Moran, G. J., Krishnadasan, A., Gorwitz, R. J., Fosheim, G. E., Mcdougal, L. K., Carey, R. B., Talan, D. A.: Methicillin-resistant S. aureus infections among patients in the emergency department. N. Engl. J. Med., roč. 355, 2006, s. 666–674.
19. Nilsson, P., Ripa, T.: Staphylococcus aureus throat colonization is more frequent than colonization in the anterior nares. J. Clin. Microbiol., roč. 44, 2006, č. 9, s. 3334–3339.
20. Passariello, C., Puttini, M., Iebba, V., Pera, P., Gigola, P.: Influence of oral conditions on colonization by highly toxigenic Staphylococcus aureus strains. Oral Dis., roč. 18, 2012, č. 4, s. 402–409.
21. Petti, S., Polimeni, A.: Risk of methicillin-resistant Staphylococcus aureus transmision in the dental healthcare setting: a narrative review. Infect. Control. Hosp. Epidemiol., roč. 32, 2011, č. 11, s. 1109–1115.
22. Pharma-reports: Klinicky významné bakterie. 1. vyd., Praha, Triton, 2012, 128 s. ISBN 978-80 -7387-588-6.
23. Shetty, S. M., Shenoy, P. R., George, T. V.: Role of self care practices and denture maintenance in oral health, J. Orofac. Res., roč. 4, 2014, č. 1, s. 7–11.
24. Shetty, V., Trumbull, K., Hegde, A., Shenoy, V., Prabhu, R. K. S., Palavecino, E., Shetty, A. K.: Prevalence of community-acquired methicillin-resistant Staphylococcus aureus nasal colonization among children. J. Clin. Diagn. Res. [online], roč. 8, 2014, č. 12, s. 12–15 [cit. 2015-08-02]. Dostupný z WWW: http://www.ncbi.nlm.nih.gov/pubmed/25653946.
25. Kim, S. J., Park, C.: Panton-valentine leukocidin and staphylococcal cassette chromosome (SSCmec) from CA-MRSA (Community-Acquired Methicillin Resistant Staphylococcus aureus). Biomed. Res. [online], roč. 24, 2014, č. 4, s. 441–444 [cit. 2015-08-02]. Dostupný z WWW: http://www.biomedres.info/yahoo_site_admin/assets/docs/441-444-Kim-Cheolin.253134134.pdf.
26. Von Specht, M. H., Gardella, N., Ubeda, C., Grenon, S., Gutkind, G., Mollerach, M.: Community-associated methicillin-resistant Staphylococcus aureus skin and soft tissue infections in a pediatric hospital in Argentina. J. Infect. Dev. Ctries [online], roč. 8, 2014, č. 9, s. 1119–1128 [cit. 2015-08-01]. Dostupné z WWW: http://www.jidc.org/index.php/journal/article/view/4271.
Labels
Maxillofacial surgery Orthodontics Dental medicine
Article was published inCzech Dental Journal

2016 Issue 1-
All articles in this issue
-
In vitro kultivace kmenových buněk zubní pulpy dočasných zubů v nízkoprocentním xenogenním médiu
(Původní článek – experimentální studie) -
Orálne nosičstvo Staphylococcus aureus u stomatologických pacientov v závislosti od podmienok v ústnej dutine
(Pôvodná práca – retrospektívna štúdia) -
Maturogeneze
Část 1. Úvod, anatomie, kmenové buňky, tkáňové faktory, vnitřní matrice
(Přehledový článek)
-
In vitro kultivace kmenových buněk zubní pulpy dočasných zubů v nízkoprocentním xenogenním médiu
- Czech Dental Journal
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue-
Orálne nosičstvo Staphylococcus aureus u stomatologických pacientov v závislosti od podmienok v ústnej dutine
(Pôvodná práca – retrospektívna štúdia) -
Maturogeneze
Část 1. Úvod, anatomie, kmenové buňky, tkáňové faktory, vnitřní matrice
(Přehledový článek) -
In vitro kultivace kmenových buněk zubní pulpy dočasných zubů v nízkoprocentním xenogenním médiu
(Původní článek – experimentální studie)
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

