-
Medical journals
- Career
In vitro kultivace kmenových buněk zubní pulpy dočasných zubů v nízkoprocentním xenogenním médiu
(Původní článek – experimentální studie)
: T. Suchánková Kleplová 1,2; K. Z. Browne 2; T. Soukup 2; J. Suchánek 1,2
: Ústav histologie a embryologie LF UK, Hradec Králové 1; Stomatologická klinika LF UK a FN, Hradec Králové 2
: Česká stomatologie / Praktické zubní lékařství, ročník 116, 2016, 1, s. 3-11
: Original articles
Úvod a cíl:
Na základě odklonu lidské regenerativní medicíny od xenogenních materiálů jsme zkoumali, zda je možné efektivně expandovat kmenové buňky zubní pulpy dočasných zubů (SHED) v médiu, které obsahuje minimální množství fetálního telecího séra; čímž je snížena pravděpodobnost přenosu zoonóz a vzniku prionové infekce. Již v roce 2011 jsme dokázali, že takový protokol je použitelný pro kmenové buňky stálých zubů (DPSCs). Naše hypotéza, že SHED by měly na stejné médium reagovat podobně, vychází z faktu, že ač se od sebe tyto dvě populace buněk odlišují expresí povrchových znaků, sdílejí místo vzniku a mají podobné niche.Metoda:
Tři odlišné linie SHED, izolované pomocí enzymatické disociace, jsme kultivovali v médiu obsahujícím 2 % fetálního telecího séra (FCS) až do překročení Hayflickova limitu, čímž jsme prokázali jejich kmenovost. Následná fenotypová analýza kultivovaných SHED ukázala vysokou pozitivitu znaků mezenchymálních kmenových buněk, a tedy hodnoty charakteristické pro SHED. Poté, co jsme ověřili, že testovaná metoda izolace ani médium zásadně neovlivnilo fenotyp naší buněčné populace, jsme tyto buňky úspěšně diferencovali v následující unipotentní buněčné typy: osteoblasty, adipocyty, chondrocyty, neurální, endoteliální buňky a buňky kosterní svaloviny.Výsledky:
Naše data prokazují, že v porovnání s SHED kultivovanými v médiích s ≥ 10 % fetálního telecího séra si i SHED izolované a kultivované za výše uvedených podmínek udržují vysoký proliferační potenciál. Exprimují stabilní, ač o něco slabší pozitivitu povrchových znaků (v řádu 20 %) a diferencují ve všechny doposud s nimi asociované buněčné typy.Závěr:
Z našich výsledků vyplývá, že SHED jsou slibnou a výjimečně dosažitelnou buněčnou populací, a to především pro neuroregenerativní medicínu.Klíčová slova:
kmenové buňky zubní pulpy dočasných zubů – SHED – xenogenní sérum – fetální telecí sérum – 2% FCS – enzymatické natrávení – diferenciační potenciálÚVOD
Kmenové buňky zubní pulpy dočasných zubů (SHED – z anglického Stem cells from Human Exfoliated Deciduous teeth) vznikají za podobných podmínek jako kmenové buňky zubní pulpy třetích molárů (DPSCs – z anglického Dental Pulp Stem Cells), tedy interakcí mezenchymů neuroektomezodermáního a mezodermálního původu [2], a shodně vykazují znaky multipotentních mezenchymálních kmenových buněk. SHED vykazují navíc také znaky pluripotentních embryonálních buněk (Sox2, Nanong a Oct4) [8]. Pro jejich vynikající diferen-ciační potenciál jsou tak teoreticky ideálním zdrojem autologního materiálu pro regenerační medicínu a tkáňové inženýrství. Nevýhodou izolace SHED jsou však možný dopad předčasné extrakce dočasných zubů na prořezávání zubů stálých [13] i na vývoj čelistních kostí [15] a poměrně vysoká heretogenita populace SHED [11]. Ve fázích izolace, kultivace a diferen-ciace pak vyvstává u všech buněčných populací totožný problém výběru postupu a kultivačního prostředí, které má vliv na expresi jejich genů a povrchových markerů, stabilitu transkriptomu a proliferační a diferenciační potenciál [20, 18].
Tato práce si klade za cíl určit, zda náš izolační protokol úspěšně aplikovatelný na DPSCs [9], opírající se o enzymatickou disociaci a kultivační protokol v médiu s nízkým obsahem xenogenního séra (stanovený Suchánkem a kol. 2007 [21]), umožňuje stejně úspěšnou izolaci a expanzi potentní populace SHED. Metodu izolace jsme vybrali na základě heterogenního charakteru SHED [3] a kultivační médium s nízkým obsahem fetálního telecího séra (FCS) na základě odklonu lidské medicíny od xenogenních materiálů. Naše hypotéza, že SHED a DSPC, lišící se genetickým profilem [1, 6], budou reagovat podobně na stejné mechanické a chemické podněty, vyplývá z vysoké podobnosti jejich niche. Použitelnost protokolu je hodnocena na základě jeho vlivu na fenotyp [5, 10, 14, 19] a proliferační [21] a diferenciační potenciál kultivovaných SHED. Doposud provedené studie SHED, standardně kultivované v alfa modifikaci Eaglova média nebo Dulbeccově modifikaci Eaglova média (alphaMEM/DMEM) obsahujícím 10–15 % FCS, prokázaly jejich schopnost proliferace přes Hayflickův limit [21] a diferenciace v neurální buňky [17], osteoblasty a adipocyty [7], endoteliální buňky [4] a chondroblasty [16].
MATERIÁL A METODIKA
Izolace a kultivace SHED
Odběr zubní pulpy dočasných zubů (n = 6) byl proveden s informovaným souhlasem zákonných zástupců dárců (n = 3) ve věku tři až devět let (tab.1) jako součást ortodontické terapie na Stomatologické klinice LF UK a FN v Hradci Králové podle postupu schváleného etickou komisí fakultní nemocnice [21]. Chirurgický zákrok byl vykonán za standardních podmínek v lokální anestezii. Zub byl transportován do laboratoře tkáňových kultur v Hankově balancovaném solném roztoku (HBSS, InvitrogenTN, Thermo Fishing Scientific Inc., USA). Exstirpace zubní pulpy byla provedena po získání arteficiálního přístupu do dřeňové dutiny (obr. 1 A+B) Luerovými kleštěmi za sterilních podmínek. Rozvolnění extracelulární matrix tkáně zubní pulpy bylo zajištěno enzymatickou digescí v roztoku obohaceném o tři mg/ml kolagenázy typu I (Sevapharma, a.s., ČR) a 4 mg/ml dispázy (InvitrogenTN, Thermo Fishing Scientific Inc., USA) po dobu 35 minut, následovanou centrifugací 2000 rpm po dobu pěti minut. Po odsátí supernatantu byly získány výsledné buněčné pelety SHED.
1. Seznam dárců – pohlaví, věk, identifikace zubů 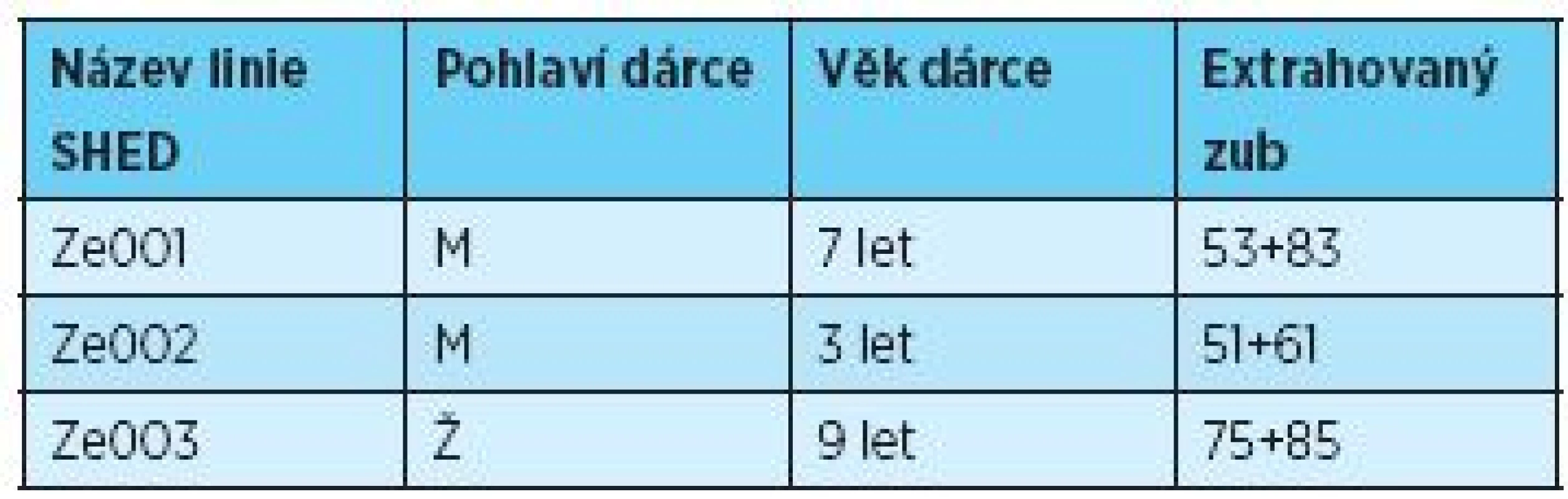
Obr. 1A Zub 51 Ze002 po exstirpaci zubní pulpy skrz kořenový kanálek po odlomení apexu kořene Obr. 1B Zub 85 Ze003 po snesení vestibulární plochy zubu 
SHED byly kultivovány v atmosféře s 5 % CO2 při 37 °C v kultivačním médiu (tab. 2, obr. 2), médium bylo měněno každé dva až tři dny. Primokultura SHED byla nasazena do kultivačních nádob s Cell+ povrchem (InvitrogenTN, Thermo Fishing Scientific Inc., USA), kde byla kultivována po dobu tři až pět dní, než se objevily jednotlivé buněčné kolonie. Po dosažení 70% konfluence byly buňky ošetřeny Trypsin-EDTA roztokem (InvitrogenTN, Thermo Fishing Scientific Inc., USA) a rozsazeny do standardních kultivačních nádob pro tkáňové kultury (ST/CT, Techno Plastic Products AB , Švýcarsko, NUNC®, Labware Products – Sigma Aldrich Inc., USA).
2. Složení kultivačních a diferenciačních médií 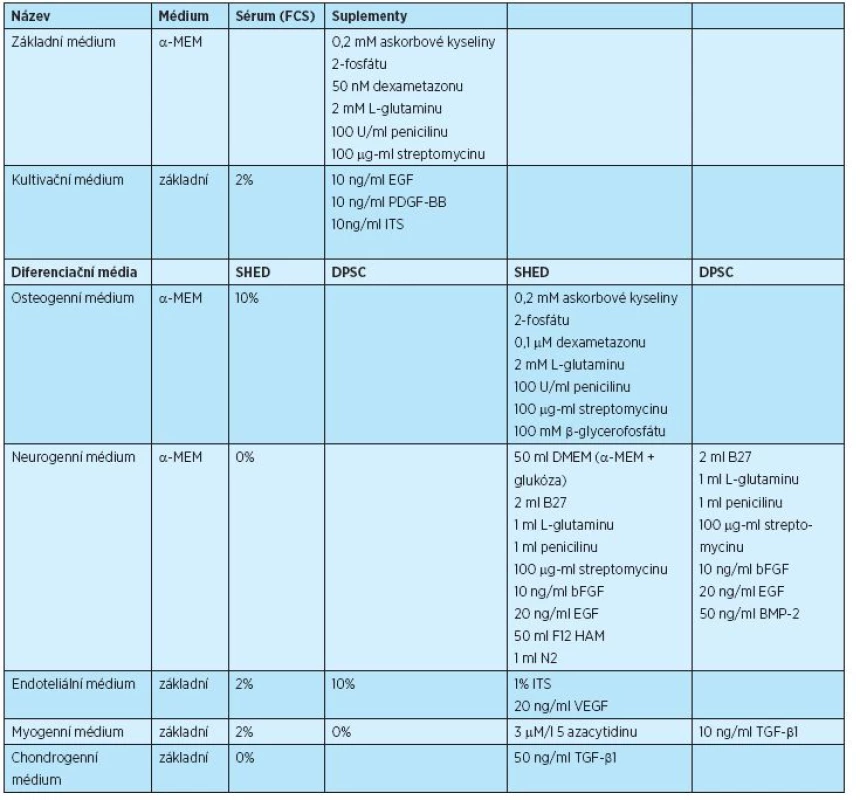
Kmenové buňky si zachovávají typický vzhled vřetenovitě protáhlých buněk. Mikroskop s fázovým kontrastem zvětšení 200krát Obr. 2A Ze001 
SHED byly do páté pasáže expandovány a část buněk byla zamražena pro budoucí diferenciační část experimentu. Zbylá část buněk byla kultivována do osmnácté pasáže k překročení Hayflickova limitu.
Ke stanovení počtu populačních zdvojení, populačnímu doubling time a viability byly využity přístroje Z2 Counter (Beckman Coulter Inc., USA) a Vi-Cell® analyzér (Beckman Coulter Inc., USA) (tab. 3).
3. Počet populačních zdvojení a průměrný doubling time se směrodatnou odchylkou 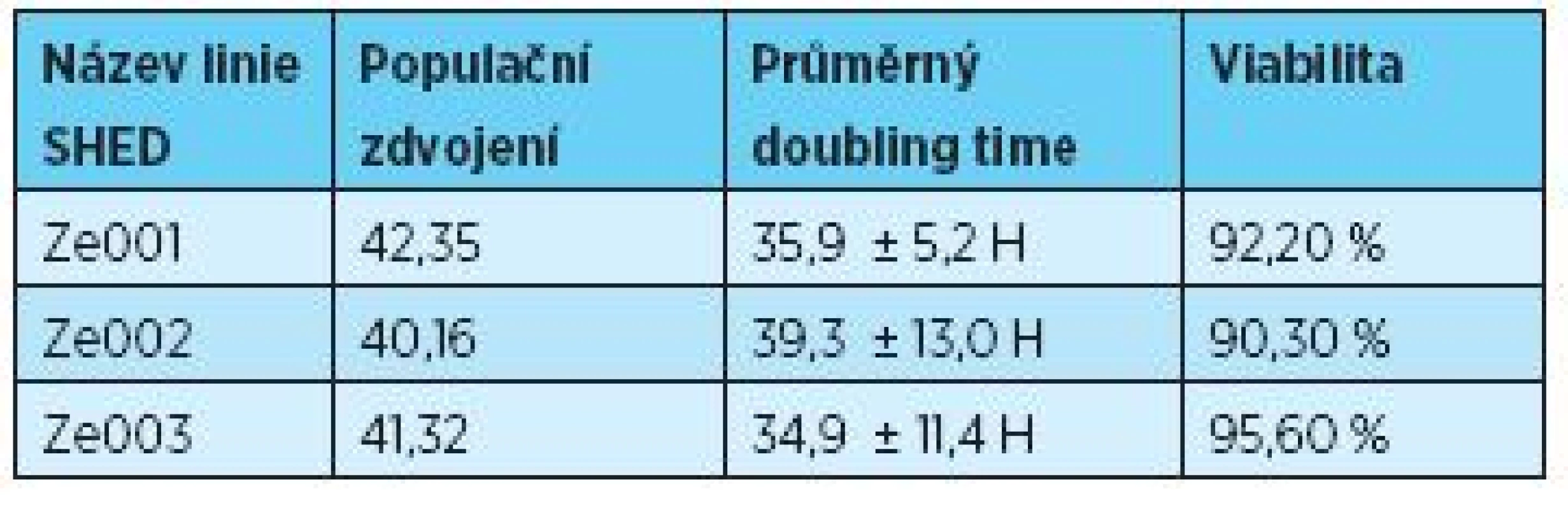
Fenotypová analýza – Průtoková cytometrie
SHED byly uvolněny z povrchu kultivační nádoby omýváním pomocí roztoku trypsin/EDTA n/EDTA po dobu pěti minut při 37 °C, poté byl roztok inaktivován a centrifugován (pět minut, 300 g), následně bylo 100 µl buněčné suspenze inkubováno 30 minut při 4 °C pomocí primárních protilátek značených fluorochromy FITC nebo PE podle do-poručení výrobce. Po proplachu PBS byla fenotypová analýza provedena na přístroji Cell Lab Quanta MPL (Beckman Coulter). SHED páté pasáže byly testovány na tyto povrchové znaky: CD29, CD44, CD73, CD90 (vše BD Biosciences Pharmingen, Belgie).
In vitro diferenciace SHED
SHED byly diferencovány in vitro v níže uvedené buněčné typy v páté pasáži za standardních kultivačních podmínek (37 °C, 5 % CO2) ve výše popsaných médiích.
Osteodiferenciace
SHED byly kultivovány ve splývavé jednovrstvě buněk s použitím osteodiferenciačního média (tab. 2) [93] po dobu čtyř týdnů. Médium bylo měněno každé dva až tři dny.
Chondrodiferenciace
SHED rostly v buněčné peletě, která vznikla spontánní agregací na dně 4ml kultivační zkumavky pod vlivem chondrogenního média [10] po dobu čtyř týdnů. Médium bylo měněno každé dva až tři dny.
Adipodiferenciace
SHED byly kultivovány ve splývavé jednovrstvě buněk s použitím adipogenního média Mesenchymal Stem Cell Adipogenic Differentiation Medium (Cyagen Biosciences Inc., USA) (tab. 2) po dobu čtyř týdnů. Médium bylo měněno každé dva až tři dny.
Endoteliální diferenciace
SHED byly nasazeny na standardní kultivační nádobu v jednovrstvě v koncentraci 104/cm v serum-free diferenciačním médiu (tab. 2) po dobu 28 dní.
Myogenní diferenciace
SHED byly kultivovány ve standardním kultivačním médiu obohacené o 5-azacytidin v koncentraci 3 µM/l po dobu 24 hodin. Následně byla kultura opláchnuta a diferenciační médium bylo nahrazeno po dobu čtyř týdnů standardním kultivačním médiem, které bylo měněno každé tři dny.
Neurodiferenciace
SHED byly kultivovány jako buněčná jednovrstva v neurogenním expanzním médiu (tab. 2) po dobu nejméně tří pasáží. Médium bylo měněno každé dva až tři dny.
Průkaz in vitro diferenciace
Histochemie
SHED rostoucí v peletě, či v buněčné jednovrstvě byly fixovány v 10% formalinu a ponořeny do parafínu. Řezy 5–6 µm byly vloženy mezi sklíčka s použitím montovacího média a ponechány v pokojové teplotě přes noc oschnout. Poté byl z řezů vymyt parafín pomocí xylolu a pak byly postupně ponořeny do alkoholu se snižující se koncentrací (96, 80 a 70 %) a dvakrát omyty destilovanou vodou. Sféroidní buněčné pelety byly fixovány v 4% roztoku paraformaldehydu v pufrovaném fyziologickém roztoku po dobu 30 minut, následně ošetřeny 20% roztokem sacharózy v PBS po dobu dvou hodin, ponořeny do TissueTek OCT compound (Sakura Finetek GmbH, Staufen, Německo), sféry ošetřeny 3-aminopropyltriethoxysilane (Sigma – Aldrich Inc., USA) a zmrazené rozřezány. Řezy byly následně permeabilizovány 0,1% Triton X-100 po dobu deseti minut při pokojové teplotě. Barvením podle Kossy jsme detekovali fosforečnan vápenatý v osteoidní matrix vzniklé při osteodiferenciaci SHED. Chondrogenní diferenciaci jsme prokazovali barvením alciánovou modří, která se váže na kyselé mukopolysacharidy, a Safraninem O, který prokazuje přítomnost chrupavčité tkáně. Barvení olejovou červení ukazuje tukové kapénky přítomné během adipogenní diferenciace. Následně bylo barvení kvantifikováno pomocí spektrofotometrie.
Imunocytochemie / Imunofluorescence
Buňky jsme ponořili třikrát do PBS a fixovali ve 4% paraformaldehydu v PBS při 4 °C na deset minut, následně omyli v PBS obsahující 0,1% Triton X-100 a ponořili do PBS obsahující 2% bovinní sérový albumin na 30 minut při pokojové teplotě. Tyto buňky byly přes noc inkubovány při 4 °C s primárními protilátkami. V negativní kontrole byla protilátka vynechána. Po oplachu byly buňky inkubovány s vhodnou fluorochromem konjugovanou a druhově specifickou sekundární protilátkou. K vizua-lizaci vzorků byl použit fotoaparát BX51 Olympus (Olympus Europa GmbH, Hamburg, Německo). Pro průkaz osteogenní diferenciace bylo použito primární protilátky proti prokolagenu I, chondrogenní diferenciace primární protilátky proti kolagenu typ II, endoteliální diferenciace protilátky proti von Wilebrandovu faktoru, myogenní diferen-ciace protilátky proti desminu, kardiaktroponinu a α-aktinu a neurogenní diferenciaci protilátky proti nestinu (všechny vyjmenované komponenty Sigma – Altrich Inc., USA).
VÝSLEDKY
Všechny kultivované linie SHED si držely standardní morfologii pozorovanou u kmenových buněk izolovaných ze zubní pulpy stálých i dočasných zubů (obr. 2). Část kmenových buněk byla v páté pasáži zamražena a uschována pro diferenciační experimenty. Zbylá část buněk byla dlouhodobě kultivována přes Hayflickůov limit (tab. 2). Viabilita u všech tří linií v průběhu kultivace neklesla pod 90 % (tab. 2).
Fenotypová analýza 2% FCS-SHED ukázala vysokou pozitivitu pro standardní znaky mezenchymálních kmenových buněk. Procento pozitivních buněk v liniích bylo následující: pro CD29 – 68,73/69,13/57,09, CD44 – 72,18/72,76/66,45, CD73 – 71,63/83,58/58,85, CD90 – 64,53/84,44/82,98.
Všechny tři linie po vystavení osteodiferenciač-nímu médiu produkovaly extracelulární matrix (obr. 3 A + B), Po čtyřech týdnech bylo možné v kultivačních nádobách pozorovat shluky osteoidního materiálu. Pomocí barvení podle Kossy jsme prokázali přítomnost vápníku v extracelulární matrix (obr. 3 C) a přítomnost prokolagenu I pomocí imunohistochemického barvení (obr. 3 D). U všech tří linií došlo během kultivace v adipogenním médiu ke změně morfologie, buňky byly více přisedlé a v jejich cytoplazmě se vytvářely vakuoly. Pomocí histologického barvení olejovou červení jsme prokázali přítomnost tuku uvnitř těchto vakuol (obr.3 E + F). Následně jsme pomocí spektrofotometrie kvantifikovali množství olejové červeně v negativní kontrole. U diferencovaných buněk jsme prokázali výrazně vyšší koncentraci olejové červeně. Pomocí imunohistochemické detekce proteinu desminu, kardiaktroponinu a α-aktinu jsme prokázali schopnost SHED diferencovat v buňky příčně pruhované svaloviny (obr. 3 G + H + CH). Během kultivace v neurodiferenciačním médiu jsme pozorovali postupně měnící se morfologii SHED. Ty se stávaly ještě více protažené a udržovaly mezi sebou kontakty pomocí velmi dlouhých výběžků. Diferenciaci v neurální elementy jsme prokázali pomocí pozitivní detekce nestinu ve všech třech liniích (obr. 3 I). U buněk kultivovaných v přítomnosti vaskulárního endotelového růstového faktoru (diferenciace v endoteliální buňky) jsme byli schopni prokázat slabou pozitivitu von Wilebrandova faktoru a výraznou změnu morfologie (obr. 3 J).
Obr. 3A Ze001 negativní kontrola osteodiferenciace 
Obr. 3B Ze002 po čtyřech týdnech kultivace v osteogenním médiu. Na povrchu buněk můžeme pozorovat malé nehomogenní částečky extracelulární matrix (větší částice označena šipkou) 
Obr. 3C Detekce vápníku pomocí barvení podle Kossy u buněk linie Ze002 kultivovaných v osteodiferenciačním médiu po dobu čtyř týdnů 
Obr. 3D Imunohistochemická detekce prokolagenu I u buněk linie Ze002 kultivovaných v osteodiferenciačním médiu po dobu čtyř týdnů 
Obr. 3E Barvení olejovou červení u negativní kontroly pro adipogenní diferenciaci, linie Ze002 
Obr. 3F Barvení olejovou červení buněk linie Ze002 kultivovaných deset dní v adipogenním médiu s pozitivním průkazem tukových vakuol v cytoplazmě 
Obr. 3G Imunochemický průkaz kardiaktropinu u linie Ze003 vystavené 5-azacytinu 
Obr. 3H Imunochemický průkaz desminu u linie Ze003 vystavené 5-azacytinu 
Obr. 3Ch Imunochemický průkaz α-aktinu u linie Ze003 vystavené 5-azacytinu 
Obr. 3I Imunodetekce nestinu u buněk linie Ze003 kultivovaných čtyři týdny v neurogenním médiu 
Obr. 3J Imunodetekce von Wilebrandova faktoru u buněk linie Ze002 kultivovaných v médiu s VEGF po dobu čtyř týdnů 
Buňky kultivované v chondrogenním médiu ochotně tvořily sféry (obr. 3 K). Tyto pelety nebyly však dostatečně soudržné, aby je bylo možné histologicky zpracovat. Tento experiment jsme opakovali třikrát, vždy se stejným výsledkem.
Obr. 3K Peleta buněk linie Ze002 kultivovaných čtyři týdny v chondrodiferenciačním médiu 
DISKUSE
Naše studie prokázala, že na rozdíl od SHED kultivovaných v médiu s ≥ 10 % FCS, 2 % FCS-SHED vykazují sníženou pozitivitu povrchových znaků, vysoký proliferační potenciál a diferenciační potenciál. Detailní data v této studii nemohou být brána za univerzální, jelikož fenotyp a potenciál testované populace SHED se mění s ohledem na několik proměnných, a to: k populaci dárců (počtu, pohlaví, věku, genetických predispozic atd.) [21], k stáří extrahované zubní pulpy [21] a možné selekci jedné z buněčných populací nalézající se v zubní pulpě, která je buněčně heterogenní [9, 21]. V naší studii jsme použili buněčný materiál od tří dárců různého pohlaví a stáří. Extrahované zuby měly stále živou zubní pulpu, která byla odebrána celá.
Metodu izolace jsme zvolili na základě předešlého výzkumu Bakopoulou a kol., 2011 [3], tak abychom heterogenitu buněčné populace co nejméně pozměnili. Složení testovaného kultivačního média bylo vybráno na základě nízkého obsahu FCS a zároveň na základě předchozí studie Karbanové a kol., 2010, která prokázala použitelnost tohoto média pro DPSC [9]. Přestože se počet kmenových buněk izolovaných ze zubní pulpy běžně pohybuje mezi 10 až 100 [21], během expanzní kultivace jsme dosáhli počtu v řádu desítek milionů a přesáhli Hayeckův limit, tedy jsme dosáhli výsledků shodných s SHED kultivovaných v médiích obsahujících ≥ 10 % FCS [6, 19]. Použitelnost izolační metody a kultivačního média pro SHED jsme následně ověřili fenotypovou analýzou, která ukázala expresi povrchových multipotentních mezenchymálních znaků u těchto buněk [5, 10, 14, 19]. Tento výsledek se shoduje s výsledky prací Karbanové a kol., 2011 a Akpinar a kol., 2014 [9, 21]. Na rozdíl od studií pracujících s vysokoprocentním FCS médiem [17] pozorujeme sníženou pozitivitu v expresi povrchových znaků, což si vysvětlujeme vlivem kultivačního média s nízkým obsahem FCS. Tento vliv FCS na fenotyp SHED je třeba ověřit ve screeningových studiích s větším počtem izolovaných linií.
Přestože jsme SHED úspěšně diferencovali v buněčné typy popsané v předchozích výzkumech [4, 7, 16, 17], vypozorovali jsme rozdílnou ochotu diferencovat v tyto buněčné typy. Tak 2% FCS-SHED se v endoteliální buňky diferencovaly značně neochotně, což si vysvětlujeme již dříve popsanou negativitou CD146 a CD34 jako hematopoetických markerů v základní populaci 2% FCS-SHED. Přestože jejich chondrogenní diferenciace byla úspěšná, nebyli jsme schopni dosáhnout soudržné pelety. Stejně jako ≥10% FCS-SHED, tak i 2% FCS-SHED diferencovaly úspěšně v adipogenní buňky [17]. Jejich aktivita pro nestin byla během neurogenní diferenciace velmi vysoká, shodně s ≥ 10% FCS-SHED [12, 17]. Během neurodiferenciace 2% FCS-SHED vytvářely plovoucí shluky podobné neurosférám; stejná pozorování učinili Miura a kol., 2003 [17, 22]. Během našeho experimentu jsme také prokázali, že 2% FCS-SHED, velmi ochotně diferencují v buňky kosterní svaloviny a disponují silným osteodiferenciačním potenciálem shodně s předešlými studiemi [8, 21]. Z našich výsledků vyplývá, že SHED jsou slibnou a výjimečně dosažitelnou buněčnou populací, a to především pro neuroregenerativní medicínu.
U 2% FCS-SHED se projevila vysoká proliferační kapacita, vysoký diferenciační potenciál v neurogenním a osteogenním médiu, avšak nižší v chondrogenní a adipogenní linii. Exprese pozorovaných povrchových znaků typických pro mezenchymální kmenové buňky je u 2% FCS-SHED přibližně o 20 % nižší v porovnání s fenotypem ≥ 10% FCS-SHED pozorovaným výzkumnou skupinou Kerkis a kol. [10].
Studie vznikla za podpory grantu PRVOUK P37/06 a PRVOUK P37/13.
MDDr. Tereza Suchánková Kleplová
Stomatologická klinika LF UK a FN
Sokolská 581
500 05 Hradec Králové
e-mail: suchanekj@lfhk.cuni.czw
Sources
1. Akpinar, G., Kasap, M., Aksoy, A., et al.: Phenotypic and proteo-mic characteristics of human dental pulp derived mesenchymal stem cells from a natal, an exfoliated deciduous, and an impacted third molar tooth. Stem Cells Int., 2014. 2014 : 457059. doi: 10.1155/2014/457059, 2014.
2. Arora, V., Arora, P.: Pediatric stem cells – the future ahead. Int. J. Biomed. Res., roč. 3, 2012, č. 11, s. 414–421.
3. Bakopoulou, A., Leyhausen, G., Volk, J., et al.: Assessment of the impact of two different isolation methods on the osteo/odontogenic differentiation potential of human dental stem cells derived from deciduous teeth. Calcif. Tissue Int., roč. 88, 2011, č. 2, s. 130–141.
4. Cordeiro, M. M., Dong, Z., Kaneko, T., et al.: Dental pulp tissue engineering with stem cells from exfoliated deciduous teeth. J. Endod., roč. 34, 2008, č. 8, s. 962–969.
5. Dominici, M., Le Blanc, K., Mueller, I., et al.: Minimal criteria for defining multipotent mesenchymal stromal cells. The International Society for Cellular Therapy position statement. Cytotherapy, roč. 8, 2006, č. 4, s. 315–317.
6. Govindasamy, V., et al.: Inherent differential propensity of dental pulp stem cells derived from human deciduous and permanent teeth. J. Endod., roč. 36, 2010, č. 9, s. 1504–1515.
7. Chen Xu, N. K., Shen, Y. Y.: Isolation and identification of stem cells derived from human exfoliated deciduous teeth. Nan Fang Yi Ke Da Xue Xue Bao J. Southern Medical University, roč. 29, 2009, č. 3, s. 479–482.
8. Ishiy, F. A. A., Fanganiello, R. D., Griesi-Oliveira, K., et al.: Improvement of in vitro osteogenic potential through differentiation of induced pluripotent stem cells from human exfoliated dental tissue towards mesenchymal-like stem cells. Stem Cells International, 2015.
9. Karbanová, J., Soukup, T., Suchánek, J., et al.: Characterization of dental pulp stem cells from impacted third molars cultured in low serum-containing medium. Cells Tissues Organ, roč. 193, 2011, č. 6, s. 344–365.
10. Kerkis, I., Kerkis, A., Dozortsev, D., et al.: Isolation and characterization of a population of immature dental pulp stem cells expressing OCT-4 and other embryonic stem cell markers. Cells Tissues Organs, roč. 184, 2006, č. 3–4, s. 105–116.
11. Kerkis, I., Caplan, A. I.: Stem cells in dental pulp of deciduous teeth. Tissue Engineering Part B: Reviews, roč. 18, 2011, č. 2, s. 129–138.
12. Kiyani, M. N., Rabiei, F., Mardani, M., et al.: Induced in vitro differentiation of neural-like cells from human exfoliated deciduous teeth-derived stem cells. Int. J. Dev. Biol., roč. 55, 2011, s. 189–195.
13. Law, C. S.: Management of premature primary tooth loss in the child patient. J. Calif. Dent. Assoc., roč. 48, 2013, s. 612–618.
14. Lindroos, B., Mäenpää, K., Ylikomi, T., et al.: Characterisation of human dental stem cells and buccal mucosa fibroblasts. Biochem. Biophys. Res. Commun., roč. 368, 2008, č. 2, s. 329–335.
15. Macena, M. C. B., Katz, C. R. T., Heimer, M. V., et al.: Space changes after premature loss of deciduous molars among Brazilian children. Am. J. Orthod. Dentofacial Orthop., roč. 140, 2011, č. 6, s. 771–778.
16. Mackay, A. M., Beck, S. C., Murphy, J. M., et al.: Chondrogenic differentiation of cultured human mesenchymal stem cells from marrow. Tissue Eng, roč. 4, 1998, č. 4, s. 415–428.
17. Miura, M., Gronthos, S., Zhao, M., Lu, B., et al.: SHED: stem cells from human exfoliated deciduous teeth. Proc. Natl. Acad. Sci. USA, roč. 100, 2003, č. 10, s. 5807–5812.
18. Nakamura, S., Yamada, Y., Katagiri, W., et al.: Stem cell proliferation pathways comparison between human exfoliated deciduous teeth and dental pulp stem cells by gene expression profile from promising dental pulp. J. Endodont, roč. 35, 2009, č. 11, s. 1536–1542.
19. Pittenger, M. F., Mackay, A. M., Beck, S. C., et al.: Multilineage potential of adult human mesenchymal stem cells. Science, 1999, č. 284, s. 143–147.
20. Shahdadfar, A., Frønsdal, K., Haug, T., et al.: In vitro expansion of human mesenchymal stem cells: choice of serum is a determinant of cell proliferation, differentiation, gene expression, and transcriptome stability. Stem Cells, roč. 23, 2005, č. 9, s. 1357–1366.
21. Suchánek, J., Soukup, T., Ivancaková, R., et al.: Human dental pulp stem cells-isolation and long term cultivation. Acta medica (Hradec Králové)/Universitas Carolina, Facultas Medica Hradec Králové, roč. 50, 2007, s. 195–201.
22. Suchánek, J., Visek, B., Soukup, T., et al.: Stem cells from human exfoliated deciduous teeth-isolation, long term cultivation and phenotypical analysis. Acta medica (Hradec Králové)/Universitas Carolina, Facultas Medica Hradec Králové, roč. 53, 2010, č. 2, s. 93–99.
Labels
Maxillofacial surgery Orthodontics Dental medicine
Article was published inCzech Dental Journal

2016 Issue 1-
All articles in this issue
-
In Vitro Cultivation of Dental Pulp Stem Cells from Human Exfoliated Deciduous Teeth in Low-Xenogeneic-Serum Containing Media
(Original Article – Experimental Study) -
Oral Carriage of Staphylococcus aureus among Dental Patients in Dependence on Conditions in Oral Cavity
(Original Article – Retrospective Study) -
Maturogenesis
Part I. Introduction, Stem Cells, Growth Factors and Matrix
(Review)
-
In Vitro Cultivation of Dental Pulp Stem Cells from Human Exfoliated Deciduous Teeth in Low-Xenogeneic-Serum Containing Media
- Czech Dental Journal
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue-
Oral Carriage of Staphylococcus aureus among Dental Patients in Dependence on Conditions in Oral Cavity
(Original Article – Retrospective Study) -
Maturogenesis
Part I. Introduction, Stem Cells, Growth Factors and Matrix
(Review) -
In Vitro Cultivation of Dental Pulp Stem Cells from Human Exfoliated Deciduous Teeth in Low-Xenogeneic-Serum Containing Media
(Original Article – Experimental Study)
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career



