-
Medical journals
- Career
Barevnost a obsah některých biologicky aktivních látek v medu
Authors: Jan Šubert; Jozef Kolář; Jozef Čižmárik
Published in: Čes. slov. Farm., 2022; 71, 127-134
Category: Review Articles
doi: https://doi.org/https://doi.org/10.5817/CSF2022-4-127Overview
Příspěvek upozorňuje na korelace mezi výsledky instrumentálního měření barevnosti a obsahem některých biologicky aktivních organických látek (zejména fenolů a flavonoidů) v medu. Dostatečně těsné korelace mohou vést k vývoji postupů pro rychlé stanovení obsahu těchto látek v medu měřením barevnosti bez nutnosti náročnější úpravy vzorků.
Úvod
Včelí med prospívá lidskému zdraví1, 2). Je významným zdrojem biologicky aktivních látek, včetně přírodních antioxidantů3–6). Proto byl a je zařazován do starších, např.7–9) i současných10, 11) lékopisů. Medy jsou prakticky vždy více či méně barevné, přičemž na souvislost barevnosti medů s obsahem některých biologicky aktivních látek bylo již vícekrát poukázáno. Obsah biologicky aktivních látek v medech podle publikovaných prací (např.3, 6, 12–15)) s intenzitou jejich zbarvení stoupá. Záměrem našeho příspěvku je poukázat na těsnější korelace ukazatelů barevnosti medů s obsahem některých biologicky aktivních látek se zaměřením na zdravotně prospěšné látky organického původu a na možné využití těchto korelací ke stanovení těchto biologicky aktivních látek v medech.
Hodnocení barevnosti medů
Údaje o barevnosti medů lze získat subjektivním hodnocením anebo objektivně trichromatickou kolorimetrií měřením založeným na číselném vyjádření barev ve vhodně voleném barevném prostoru16), přičemž východiskem k měření barevnosti je spektrální propustnost nebo odraz vzorků medů ve viditelné spektrální oblasti. V této souvislosti byl testován barevný prostor Hunter Lab17), v současnosti je však používán převážně novější barevný prostor CIELAB16). Ten se osvědčil již dříve při sledování biologicky aktivních látek v potravinách18). V analytice medů je mimoto časté hodnocení barevnosti medů na základě výsledků měření absorbance jejich vodných roztoků vzorků při vybraných vlnových délkách ve viditelné oblasti spektra. V publikacích zabývajících se hodnocením barevnosti s těsnějšími korelacemi výsledků s obsahem biologicky aktivních látek jde nejčastěji o vlnovou délku 450 nm, obvykle po snížení naměřené hodnoty o hodnotu absorbance při 720 nm. Další častěji volenou vlnovou délkou je 635 nm, přičemž hodnoty absorbance naměřené při této vlnové délce se obvykle používají k výpočtu hodnot charakterizujících barevnost medů ve stupnici podle Pfunda19). Méně často lze v publikacích zabývajících se barevností a obsahem biologicky aktivních látek v medech nalézt měření barevnosti medů jako absorbance při vlnových délkách v rozmezí 530–593 nm20–23). Výsledky měření absorbance vodných roztoků medů při jednotlivých vlnových délkách nepopisují jejich barevnost stejně výstižně jako parametry barevných prostorů, které jsou vyčísleny z měření v celé viditelné oblasti spektra; pravděpodobně i proto jsou v některých publikacích uváděny jako intenzita zbarvení. Zpravidla však s výsledky měření barevnosti v barevných prostorech uspokojivě korelují, přičemž hodnoty korelačního koeficientu se mohou pohybovat i okolo 0,9. Příkladem v tomto směru mohou být korelace hodnot rozdílu A450nm – A720nm nebo hodnot A560nm s hodnotami souřadnice a* barevného prostoru CIELAB s korelačním koeficientem 0,91524), 0,90525) nebo 0,8821). Těsnost korelací výsledků měření absorbance vodných roztoků medů při vhodně volených vlnových délkách s obsahem sledovaných biologicky aktivních látek v medech je podobná těsnosti korelace jednotlivých parametrů barevného prostoru CIELAB. Lze však nalézt i publikace (např.26–28)), v nichž jsou hodnoty korelačního koeficientu z měření absorbance vyšší.
Korelace výsledků měření barevnosti a obsahu některých biologicky aktivních látek v medech
Z četných zdraví prospěšných biologicky aktivních látek organického původu obsažených v medu byly v rámci příspěvku sledovány látky fenolického charakteru, tedy látky obsahující jeden či více fenolických hydroxylů (fenoly, polyfenoly, fenolické hydroxykarboxylové kyseliny, flavonoidy a další), v příspěvku jsou dále uváděny jako fenolické látky, resp. fenoly. Z nich byly mimoto samostatně sledovány flavonoidy. Dále karotenoidy, proteiny a prolin, který mezi aminokyselinami v medu převažuje. Prolin sám není barevný, nelze však vyloučit, že v medech vstupuje do barevných komplexů podobně jako proteiny s polyfenoly29–31).
Některé těsnější korelace mezi parametry získanými měřením barevnosti medů v barevných prostorech CIE a výsledky stanovení obsahu sledovaných biologicky aktivních látek jsou uvedeny v tabulce 1.
Table 1. Těsnější korelace mezi parametry získanými měřením barevnosti medů v barevných prostorech CIE a výsledky stanovení obsahu sledovaných biologicky aktivních látek v medech 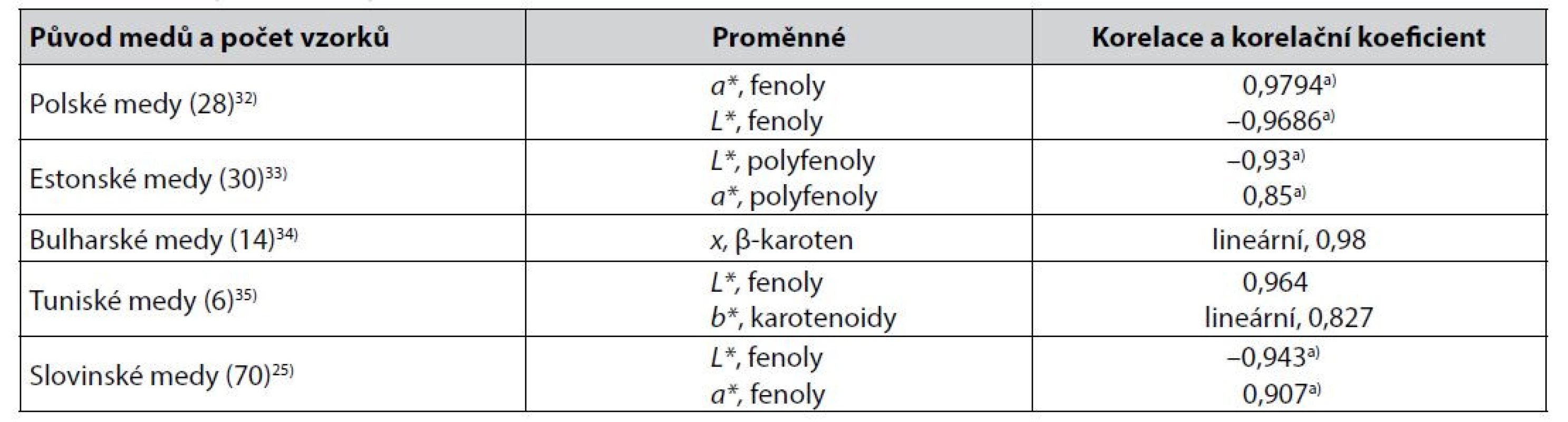
a) Pearsonův korelační koeficient Mezi korelacemi v tabulce 1 jsou i korelace souřadnice L* barevného prostoru CIELAB. Tento parametr charakterizující světlost vzorku (nikoliv tedy jeho barevný odstín) funkčně koresponduje s parametrem L barevného prostoru podle Huntera16, 36), který byl testován a doporučen k hodnocení barevnosti medů již dříve17). Mimoto byl parametr L* autory37) hodnocen jako výhodný pro kvantitativní kolorimetrickou analýzu v obecné rovině.
Z méně těsných korelací obsahu sledovaných biologicky aktivních látek s parametry barevných prostorů CIE byly popsány lineární korelace souřadnice b* a barevného rozdílu ΔE* s obsahem fenolických látek ve slovenských medech s korelačními koeficienty 0,7877 a 0,706838), souřadnice L* a parametru hab s obsahem stejných látek v polských medech s Pearsonovým korelačním koeficientem –0,72 a 0,7239), anebo souřadnice b* u jiných polských medů se Spearmanovým korelačním koeficientem 0,840).
U španělských medů byla popsána těsnost korelace souřadnic b* a L* a parametrů C*ab a hab s obsahem flavonoidů Spearmanovými korelačními koeficienty –0,853, –0,789, –0,834 a –0,86441). U jordánských medů byla těsnost korelace hodnot souřadnic a* a L* s obsahem flavonoidů popsána korelačními koeficienty 0,86 a –0,8221), u iránských medů byla těsnost korelace mezi hodnotami souřadnice a* a obsahem fenolických látek, resp. flavonoidů, popsána korelačními koeficienty 0,771, resp. 0,83424). U tureckých medů byla korelace mezi souřadnicemi L* a b* a obsahem fenolických látek popsána hodnotami Pearsonova korelačního koeficientu –0,764 a –0,74542). Jak ukazují práce z oblasti hodnocení obsahu biologicky aktivních látek v pomerančové šťávě, hodnotu korelačního koeficientu lze zvýšit korelací více než jednoho kolorimetrického parametru43, 44). V literatuře však lze nalézt i práce popisující u některých medů korelace sledovaných biologicky aktivních látek s parametry barevných prostorů CIE korelačními koeficienty < ± 0,4. Příkladem mohou být45, 46). Údaje o korelacích parametrů jiných barevných prostorů s obsahem sledovaných zdravotně prospěšných biologicky aktivních látek v medech nebyly v publikovaných pracích nalezeny. Zajímavé v tomto směru by mohlo být využití barevného prostoru RGB16). Tento barevný prostor vede v řadě případů k těsným lineárním korelacím ukazatelů barevnosti s obsahem biologicky aktivních látek v různých přírodninách a produktech přírodního původu47), např. chlorofylu a karotenoidů ve špenátu48) nebo kurkuminu v kurkumě49). Při sledování obsahu zdravotně prospěšných biologicky aktivních látek v medech nebyl dosud využíván, nebo byl pouze východiskem k transformaci do barevného prostoru CIE. V práci autorů50) byla data z barevného prostoru RGB konvertována do barevného prostoru CIELAB. V práci51) byl barevný prostor RGB použit ke stanovení fenolických látek v medech až po jejich chromogenní reakci.
Měření barevnosti medů jako absorbance jejich vodných roztoků při vhodně volených vlnových délkách ve viditelné spektrální oblasti je v korelacích používáno častěji než měření barevnosti medů v barevných prostorech CIE. Většinou jde o rozdíl absorbance při 450 nm a 720 nm. Některé z těsnějších korelací výsledků těchto měření s obsahem sledovaných biologicky aktivních látek jsou uvedeny v tabulce 2.
Table 2. Těsnější korelace mezi hodnotami získanými měřením barevnosti medů jako rozdílu absorbance jejich vodného roztoku při 450 a 720 nm a výsledky stanovení obsahu sledovaných biologicky aktivních látek v medech 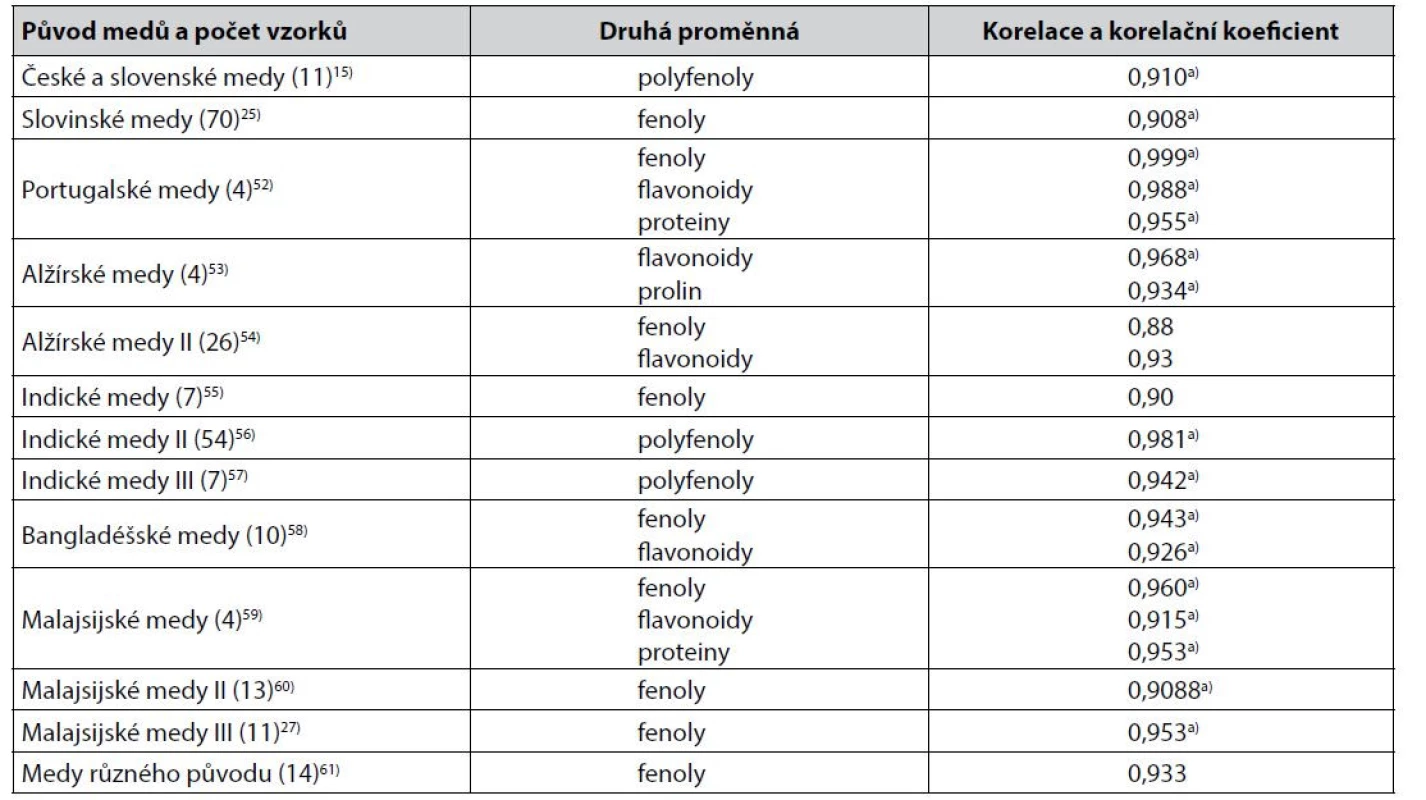
a) Pearsonův korelační koeficient Z méně těsných korelací hodnot rozdílu absorbance roztoků medů při 450 nm a 720 nm lze zmínit korelaci s obsahem fenolických látek u polských medů popsanou hodnotou Spearmanova korelačního koeficientu 0,83162) a u jiných polských medů hodnotou Pearsonova korelačního koeficientu 0,8939). U chorvatských medů byla stejná korelace popsána hodnotou Pearsonova korelačního koeficientů 0,79563), u jiných chorvatských medů byla hodnota Spearmanova korelačního koeficientu 0,89564), u kosovských medů byl v lineární korelaci korelační koeficient 0,71165). U alžírských medů byla popsána mimo fenolické látky a flavonoidy (tab. 2) korelace s karotenoidy, Pearsonův korelační koeficient byl 0,8054). Zajímavá je u těchto medů rovněž korelace s obsahem kyseliny askorbové (Pearsonův korelační koeficient 0,84)54). Ta byla popsána také u pákistánských medů s Pearsonovým korelačním koefiecientem rovným 0,859, což je hodnota vyšší než při korelaci s fenolickými látkami, u nichž byl korelační koeficient 0,77066). U iránských medů byl v korelaci rozdílu absorbance při 450 a 720 nm s obsahem fenolických látek korelační koeficient 0,772 a s obsahem flavonoidů 0,74624), u jiných iránských medů v korelaci s obsahem fenolických látek 0,879267). Indické medy zkoumané autory55) jsou mimo korelaci s fenolickými látkami (tab. 2) zajímavé korelací s prolinem a proteiny (Pearsonův korelační koeficient 0,77 a 0,67). Jiné indické medy pak mimo korelaci s polyfenoly (tab. 2) korelací s flavonoidy s Pearsonovým korelačním koeficientem 0,79756). To je hodnota blízká korelaci s flavonoidy u dalších indických medů (Pearsonův korelační koeficient 0,77), přičemž těsnost korelace s fenolickými látkami byla u těchto medů stejná68). U indických medů z Kašmíru byla popsána korelace s fenolickými látkami a s flavonoidy Pearsonovými korelačními koeficienty 0,85 a 0,7826), u bangladéšských medů byly hodnoty Pearsonova korelačního koeficientu 0,820 a 0,72769). Obdobně tomu bylo u malajsijských medů s hodnotami Pearsonova korelačního koeficientu 0,856 a 0,70812) i u jiných malajsijských medů (0,837 a 0,735), u nichž byly popsány i těsnější korelace s proteiny (Pearsonův korelační koeficient 0,783) a prolinem (0,701)70). U dalších malajsijských medů byla korelace s flavonoidy těsnější než s fenolickými látkami, Pearsonův korelační koeficient byl 0,842 a 0,81671). U brazilských medů byla popsána korelace rozdílu absorbance při 450 a 720 nm s fenolickými látkami Pearsonovým korelačním koeficientem 0,84472). Jak ukazuje příklad ze studia jordánských medů21), s obsahem sledovaných biologicky aktivních látek korelují hodnoty absorbance vodných roztoků medů i při některých jiných vlnových délkách (v daném případě 560 nm), a to bez jejich přepočtu do stupnice podle Pfunda. Korelační koeficient v korelaci s obsahem flavonoidů byl roven 0,8121). U medů z Bosny a Hercegoviny a okolních zemí byla korelace hodnot absorbance jejich 10% roztoků při 593 nm a obsahu polyfenolů popsána Pearsonovým korelačním koeficientem 0,944922).
Další často používanou metodou hodnocení barevnosti medů je její charakterizace ve stupnici podle Pfunda19), často (ne však vždy) výpočtem z měření absorbance roztoků medů při 635 nm. Přestože k hodnocení barevnosti medů podle Pfunda byly publikovány dílčí výhrady73), byly popsány četné těsnější korelace hodnot barevnosti medů ve stupnici Pfund (mm) s obsahem sledovaných biologicky aktivních látek. Příklady jsou uvedeny v tabulce 3.
Table 3. Těsnější korelace mezi hodnotami Pfundovy stupnice barevnosti medů a výsledky stanovení obsahu sledovaných biologicky aktivních látek v medech 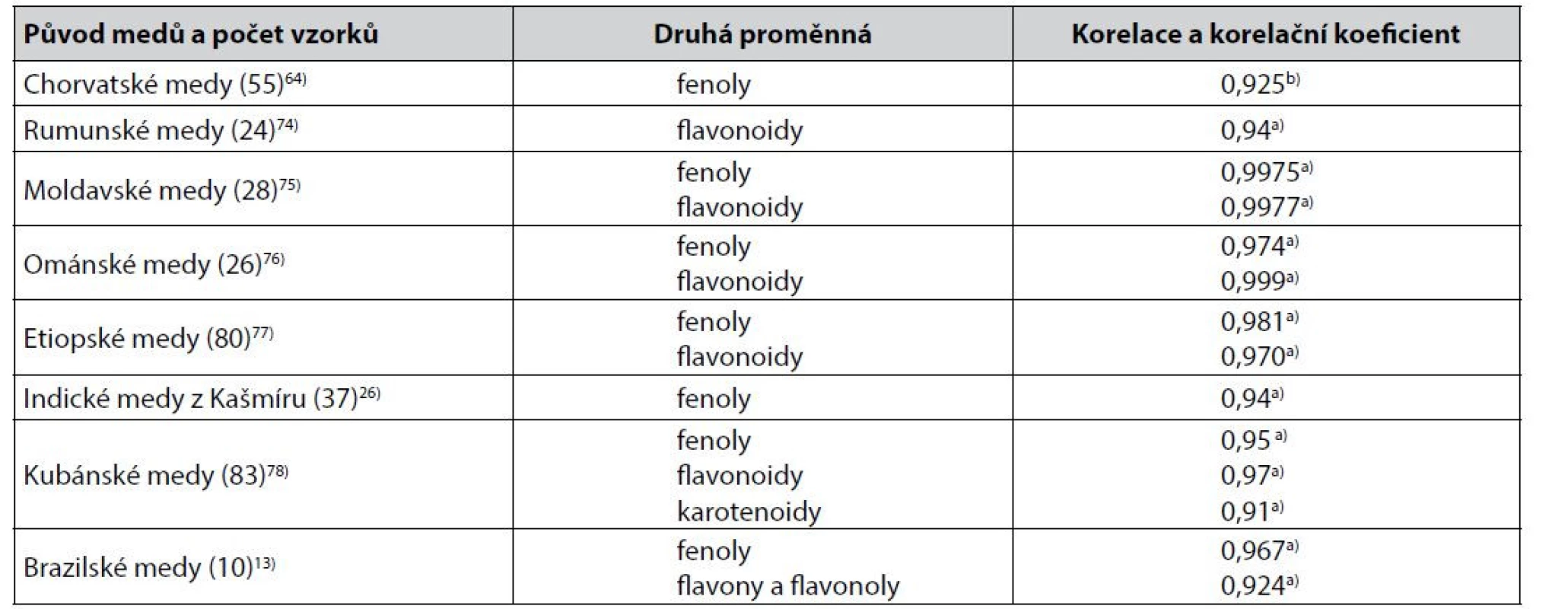
a) Pearsonův korelační koeficient
b) Spearmanův korelační koeficientMéně těsné korelace hodnot Pfundovy stupnice byly popsány u portugalských medů s obsahem flavonoidů, Pearsonův korelační koeficient byl 0,84379). U španělských medů byla korelace stejných proměnných charakterizována Spearmanovým korelačním koeficientem 0,88941), u srbských medů pak Pearsonovým korelačním koeficientem 0,771, přičemž s fenolickými látkami byla korelace těsnější80). U alžírských medů byly Pearsonovy korelační koeficienty korelace s flavonoidy 0,770 a s fenolickými látkami 0,73881). Korelace obsahu flavonoidů v marockých medech byla charakterizována Pearsovým korelačním koeficientem 0,81182), korelace obsahu fenolických látek a prolinu v jiných marockých medech a korelace fenolických látek v dalších marockých medech Pearsonovými korelačními koeficienty 0,861, 0,834 a 0,80883, 84). V tanzanských medech byla těsnost korelace obsahu fenolických látek i flavonoidů s barevností medů ve stupnici podle Pfunda popsána shodně korelačním koeficientem 0,80785).
Z tabulek 1 až 3 a údajů mimo ně je zřejmé, že ze sledovaných látek byly nejčastěji popsány těsnější korelace mezi charakteristikami barevnosti medů a obsahem látek fenolického charakteru. Mimoto byly častěji popsány těsnější korelace samotných flavonoidů, zatímco těsnější korelace karotenoidů, proteinů a prolinu lze nalézt v publikovaných pracích méně často. Pomineme - li práce s vysokými hodnotami korelačních koeficientů vyčíslenými z měření pouhých tří86, 87) či čtyř 52, 53, 59) vzorků, lze hodnotit dosud popsané těsnější korelace obsahu sledovaných biologicky aktivních látek v medech s charakteristikami jejich barevnosti zejména u fenolických látek a flavonoidů jako možné východisko pro vývoj analytických postupů ke stanovení obsahu těchto látek v medech měřením barevnosti bez náročnější úpravy vzorků a dalších potřebných kroků.
Seznam použitých zkratek a symbolů (viz také 16))
CIE Mezinárodní komise pro osvětlování (Commission Internationale de l‘Éclairage)
x souřadnice barevného prostoru CIE xyY
L*, a*, b* souřadnice barevného prostoru CIELAB
ΔE* barevný rozdíl v barevném prostoru CIELAB
Cab* chroma (měrná čistota) barvy v barevném prostoru CIELCH (CIE L* C* h)
hab měrný úhel barevného tónu v barevném prostoru CIELCH
Střet zájmů: žádný.
Došlo 10. června 2022/ Přijato 29. června 2022
J. Šubert
Dušínova 1512/42, 664 34 Kuřim
doc. RNDr. Jozef Kolář, CSc.
Ústav aplikované farmacie F
armaceutická fakulta, Masarykova univerzita
Palackého třída 1946/1, 612 00 Brno
e-mail: kolarj@pharm.muni.cz
J. Čižmárik
Katedra farmaceutickej chémie FaF
Univerzita Komenského v Bratislave
Sources
1. Meo S. A., Al-Asiri S. A., Mahesar A. L., Ansari M. J. Role of honey in modern medicine. Saudi J. Biol. Sci. 2017; 24, 975–978. https://doi.org/10.1016/j.sjbs.2016.12.010 (20.9.2021).
2. Rana S., Mishra M., Yadav D., Subramani S. K., Katare C., Prasad G. B. K. S. Medicinal uses of honey: A review on its benefits to human health. Prog. Nutr. 2018; 20(Suppl 1), 5–14. doi: 10.23751/pn.v20i1-S.6394 (20.9.2021).
3. Wieczorek J., Pietrzak M., Pomianowski J., Wieczorek Z. Honey as a source of bioactive compounds. Polish J. Nat. Sci. 2014; 29, 275–285. http://www.uwm.edu.pl/ polish-journal/sites/default/files/issues/articles/wieczorek_ et_al._2014.pdf (7.11.2021).
4. Cianciosi D., Forbes-Hernández T. Y., Afrin S., Gasparrini M., Reboredo-Rodriguez P., Manna P. P., Zhang J., Lamas L. B., Flórez S. M., Toyos P. A., Quiles J. L., Giampieri F., Battino M. Phenolic compounds in honey and their associated health benefits: A review. Molecules 2018; 23, 2322. https://doi.org/10.3390/molecules23092322 (23.1.2022).
5. da Silva P. M., Gauche C., Gonzaga L. V., Costa A. C. O., Fett R. Honey: Chemical composition, stability and authenticity. Food Chem. 2016; 196, 309–323. https:// doi.org/10.1016/j.foodchem.2015.09.051 (23.1.2022).
6. Machado De-Melo A. A., Almeida-Muradian L. B. D., Sancho M. T., Pascual-Maté A. Composition and properties of Apis mellifera honey: A review. J. Apic. Res. 2018; 57, 5–37. https://doi.org/10.1080/00218839.2017. 1338444 (23.1.2022).
7. Pharmacopoea Austriaca, Ed. Octava. Vienne: C.E.S. REG. AULE ET IMPERII TYPOGRAPFIA 1906; 244.
8. Deutsches Arzneibuch, 6. Ausgabe Berlin: Decker, 1926; 422.
9. Československý lékopis, vydání první (ČsL 1). Praha: Státní tiskárna 1947; 276.
10. Honey. European Pharmacopoeia (Ph. Eur.) 10th Edition. [online] s. 2831. https://pheur.edqm.eu/home (20.9.2021).
11. USP 43 2020 Vol. 3; s. 5816. https://www.ilovepharma. com/2021/05/united-state-pharmacopoeia - 2020-usp-43.html (20.9.2021).
12. Khalil M. I., Mahaneem M., Jamalullail S. M. S., Alam N., Sulaiman S. A. Evaluation of radical scavenging activity and colour intensity of nine Malaysian honeys of different origin. JAAS 2011; 3, 4–11. https://ibra.org.uk/ wp-content/JAAS/VOL3/3-1/JAAS%203%201%2002L. pdf (17.2.2022).
13. Pontis J. A., Costa L. A. M. A. D., Silva S. J. R. D., Flach A. Color, phenolic and flavonoid content, and antioxidant activity of honey from Roraima, Brazil. Food Sci. Technol. 2014; 34, 69–73. https://www.scielo.br/j/cta/a/ qPcdGM4DpjDsjFxjw33PxDf/?format=pdf&lang=en (17.2.2022).
14. Gonçalves J., Ribeiro I., Marçalo J., Rijo P., Faustino C., Pinheiro L. Physicochemical, antioxidant and antimicrobial properties of selected Portuguese commercial monofloral honeys. J. Food Nutr. Res. 2018; 6, 645–654. http://pubs.sciepub.com/jfnr/6/10/5 (29.5.2022).
15. Škrovánková S., Snopek L., Mlček J., Volaříková E. Bioactive compounds evaluation in different types of Czech and Slovak honeys. Potr. S. J. F. Sci. 2019; 13, 94–99. https://doi.org/10.5219/1025 (9.10.2021).
16. Ohta N., Robertson A. R. Colorimetry: Fundamentals and applications. Chichester: Wiley 2005.
17. Bowles L. H., Gullet E. A. Color classification of honey using reflectance measurement. Can. Inst. Food Sci.Technol. J. 1976; 9, 125–129. https://doi.org/10.1016/S0315 - 5463(76)73644-7 (25.1.2022).
18. Sant’Anna V., Gurak P. D., Marczak L. D. F., Tessaro I. C. Tracking bioactive compounds with colour changes in foods – A review. Dyes Pigm. 2013; 98, 601–608. https:// doi.org/10.1016/j.dyepig.2013.04.011 (24.1.2022).
19. Pfund scale. https://www.sizes.com/units/pfund_scale. htm (28.9.2021).
20. Martin M. J., Fredes C., Nuñez G., Ginocchio R., Montenegro G. Comparison of methods for determining the color of Chilean honeys and the relationship of color with botanical origin in central Chile. Cien. Inv. Agr. 2014; 41, 411–418. http:// www. s c i e l o. c l / s c i e l o.php?script=sci_ar t text& pid=S0718-16202014000300014 (29.5.2022).
21. Al-Dabbas M. M., Otoom H. A., Al-Antary T. M. Impact of honey color from Jordanian flora on total phenolic and flavonoids contents and antioxidant activity. Fresenius Environ. Bull. 2019; 28, 6898–6907.
22. Kesić A., Ćelan S., Mehmedinović N. I., Šestan A. Optical activity, total phenolic content and color intensity of nectarian honey and honeydew. Eur. J. Food Sci. Technol. 2020; 8, 12–33. Online ISSN: ISSN 2056-5801(online) (26.1.2022).
23. Imtara H., Elamine Y., Lyoussi B. Physicochemical characterization and antioxidant activity of Palestinian honey samples. Food Sci. Nutr. 2018; 6, 2056–2065. https://onlinelibrary.wiley.com/doi/full/10.1002/fsn3.754 (17.2.2022).
24. Khalafi R., Goli S. A. H., Behjatian M. Characterization and classification of several monofloral Iranian honeys based on physicochemical properties and antioxidant activity. Int. J. Food Prop. 2016; 19, 1065–1079. https:// doi.org/10.1080/10942912.2015.1055360 (28.9.2021).
25. Bertoncelj J., Doberšek U., Jamnik M., Golob T. Evaluation of the phenolic content, antioxidant activity and colour of Slovenian honey. Food Chem. 2007; 105, 822 – 828. https://doi.org/10.1016/j.foodchem.2007.01.060 (6.10.2021).
26. Nayik G. A., Nanda V. A chemometric approach to evaluate the phenolic compounds, antioxidant activity and mineral content of different unifloral honey types from Kashmir, India. LWT 2016; 74, 504–513. https://doi.org/ 10.1016/j.lwt.2016.08.016 (5.10.2021).
27. Kek S. P., Chin N. L., Yusof Y. A., Tan S. W., Chua L. S. Classification of entomological origin of honey based on its physicochemical and antioxidant properties. Int. J. Food Prop. 2017; 20, S2723–S2738. https://doi.org/10.10 80/10942912.2017.1359185 (5.10.2021).
28. Hunter M., Ghildyal R., D‘Cunha N. M., Gouws C., Georgousopoulou E. N., Naumovski N. The bioactive, antioxidant, antibacterial, and physicochemical properties of a range of commercially available Australian honeys. Curr. Res. Food Sci. 2021; 4, 532–542. https://doi. org/10.1016/j.crfs.2021.08.002 (2.5.2022).
29. Alvarez L. M. Honey proteins and their interaction with polyphenols. Submitted in partial fulfilment of the requirements for the degree of Master of Science. St. Catharines, Ontario: Brock University 2010. https://dr.library. brocku.ca/bitstream/handle/10464/3415/Brock_ Alvarez_Liset_2011.pdf?sequ&sequ (25.4.2022).
30. Rohn S. Possibilities and limitations in the analysis of covalent interactions between phenolic compounds and proteins. Food Res. Int. 2014; 65, 13–19. https://doi. org/10.1016/j.foodres.2014.05.042 (25.4.2022).
31. Brudzynski K., Maldonado-Alvarez L. Polyphenol-protein complexes and their consequences for the redox activity, structure and function of honey. A current view and new hypothesis–a review. Polish J. Food Nutr. Sci. 2015; 65, 71 – 80. https://doi.org/10.1515/pjfns-2015-0030 (25.4.2022).
32. Kuś P. M., Congiu F., Teper D., Sroka Z., Jerković I., Tuberoso C. I. G. Antioxidant activity, color characteristics, total phenol content and general HPLC fingerprints of six Polish unifloral honey types. LWT 2014; 55, 124–130. https:// doi.org/10.1016/j.lwt.2013.09.016 (3.10.2021).
33. Kivima E., Tanilas K., Martverk K., Rosenvald S., Timberg L., Laos K. The composition, physicochemical properties, antioxidant activity, and sensory properties of Estonian honeys. Foods 2021; 10, 511. https://doi. org/10.3390/foods10030511 (30.4.2022).
34. Nikolova K., Gentscheva G., Ivanova E. Survey of the mineral content and some physico-chemical parameters of Bulgarian bee honeys. Bulg. Chem. Commun. 2013; 45, 244–249. http://bcc.bas.bg/BCC_Volumes/Volume_45_ Number_2_2013/Volume_45_Number_2_2013_PDF/ BCC-54-2-244-249.pdf (29.5.2022).
35. Boussaid A., Chouaibi M., Rezig L., Hellal R., Donsì F., Ferrari G., Hamdi S. Physicochemical and bioactive properties of six honey samples from various floral origins from Tunisia. Arab. J. Chem. 2018; 11, 265–274. https:// doi.org/10.1016/j.arabjc.2014.08.011 (30.4.2022).
36. Whetzel N. Measuring Color using Hunter L, a, b versus CIE 1976 L*a*b* – AN-1005b. https://support.hunterlab. com/hc/en-us/articles/204137825-Measuring-Colorusing - Hunter-L-a-b-versus-CIE-1976 -L-a-b-AN-1005b (1.5.2022).
37. Kumpanenko I. V., Roshchin A. V., Ivanova N. A., Bloshenko A. V., Shalynina N. A., Korneeva T. N. Colorimetry: Choice of colorimetric parameters for chromophore concentration measurements. Russ. J. Gen. Chem. 2014; 84, 2295–2304. https://doi.org/10.1134/ S1070363214110498 (2.2.2021).
38. Zalibera M., Staško A., Šlebodová A., Jančovičová V., Čermáková T., Brezova V. Antioxidant and radical-scavenging activities of Slovak honeys – An electron paramagnetic resonance study. Food Chem. 2008; 110, 512 – 521. https://doi.org/10.1016/j.foodchem.2008.02.015 (2.10. 2021).
39. Kaczmarek A., Muzolf-Panek M., Tomaszewska-Gras J., Konieczny P. Predicting the botanical origin of honeys with chemometric analysis according to their antioxidant and physicochemical properties. Polish J. Food Nutr. Sci. 2019; 69, 191–201. doi: 10.31883/pjfns/108526 http://journal.pan.olsztyn.pl (5.5.2022).
40. Halagarda M., Groth S., Popek S., Rohn S., Pedan V. Antioxidant activity and phenolic profile of selected organic and conventional honeys from Poland. Antioxidants 2020; 9, 44. https://doi.org/10.3390/antiox9010044 (5.5.2022).
41. Escuredo O., Rodríguez-Flores M. S., Rojo-Martínez S., Seijo M. C. Contribution to the chromatic characterization of unifloral honeys from Galicia (NW Spain). Foods 2019; 8, 233. https://doi.org/10.3390/foods8070233 (5.5.2022).
42. Kolayli S., Can Z., Çakir H. E., Okan O. T., Yildiz O. An investigation on Trakya region oak (Quercus spp.) honeys of Turkey: their physico-chemical, antioxidant and phenolic compounds properties. Turk. J. Biochem. 2018; 43, 362 – 374. https://doi.org/10.1515/tjb-2017-0174 (8.5.2022).
43. Meléndez-Martínez A. J., Vicario I. M., Heredia F. J. Application of tristimulus colorimetry to estimate the carotenoids content in ultrafrozen orange juices. J. Agric. Food Chem. 2003; 51, 7266–7270. https://doi. org/10.1021/jf034873z (14.2.20121).
44. Meléndez-Martínez A. J., Vicario I. M., Heredia F. J. Rapid assessment of vitamin A activity through objective color measurements for the quality control of orange juices with diverse carotenoid profiles. J. Agric. Food Chem. 2007; 55, 2808–2815. https://doi.org/10.1021/jf0635412 (6.5.2022).
45. Perna A., Simonetti A., Intaglietta I., Gambacorta E. Antioxidant properties, polyphenol content and colorimetric characteristics of different floral origin honeys from different areas of Southern Italy. J. Life Sci. 2013; 7, 428–436. https://www.researchgate.net/ profile/Amalia-Simonetti/publication/303166757_Antioxidant_ properties_polyphenol_content_and_colorimetric_ characteristics_of_different_floral_origin_ honeys_from_different_areas_of_Southern_Italy/ links/5769115908ae1a43d23a0bd1/Antioxidant-properties - polyphenol-content-and-colorimetric-characteristics - of-different-floral-origin-honeys-from-different-areas - of-Southern-Italy.pdf (1.6.2022).
46. Soares S., Pinto D., Rodrigues F., Alves R. C., Oliveira M. B. P. Portuguese honeys from different geographical and botanical origins: A 4-year stability study regarding quality parameters and antioxidant activity. Molecules 2017; 22, 1338. https://doi.org/10.3390/molecules22081338 (6.5.2022).
47. Šubert J., Kolář J., Čižmárik J. Barevnost a obsah některých biologicky aktivních látek v přírodninách a v produktech přírodního původu. Čes. slov. Farm. 2021; 70, 83–90.
48. Agarwal A., Dongre P. K., Gupta S. D. Smartphone-assisted real-time estimation of chlorophyll and carotenoid contents in spinach following the inversion of red and green color features. bioRxiv. 2021; https:// ww.biorxiv.org/content/10.1101/2021.03.06.43423 7v1.full.pdf (25.1.2022).
49. Wongthanyakram J., Harfield A., Masawat P. A smart device-based digital image colorimetry for immediate and simultaneous determination of curcumin in turmeric. Comput. Electron. Agric. 2019; 166, 104981. https:// doi.org/10.1016/j.compag.2019.104981 (27.2.2021).
50. Shafiee S., Minaei S., Moghaddam-Charkari N., Barzegar M. Honey characterization using computer vision system and artificial neural networks. Food Chem. 2014; 159, 143–150. https://doi.org/10.1016/j.foodchem. 2014.02.136 (7.5.2022).
51. González-Ceballos L., del Mar Cavia M., Fernández - Muiño M. A., Osés S. M., Sancho M. T., Ibeas S., García F. C., García J. M., Vallejos S. A simple one-pot determination of both total phenolic content and antioxidant activity of honey by polymer chemosensors. Food Chem. 2021; 342, 128300. https://doi.org/10.1016/j.foodchem. 2020.128300 (7.5.2022).
52. Gonçalves J., Ribeiro I., Marçalo J., Rijo P., Faustino C., Pinheiro L. Physicochemical, antioxidant and antimicrobial properties of selected Portuguese commercial monofloral honeys. J. Food Nutr. Res. 2018; 6, 645–654. http://pubs.sciepub.com/jfnr/6/10/5 (8.5.2022).
53. Khalil M., Moniruzzaman M., Boukraâ L., Benhanifia M., Islam A., Islam N., Sulaiman S. A., Gan S. H. Physicochemical and antioxidant properties of Algerian honey. Molecules 2012; 17, 11199–11215. https://doi. org/10.3390/molecules170911199 (10.5.2022).
54. Otmani A., Amessis-Ouchemoukh N., Birinci C., Yahiaoui S., Kolayli S., Rodríguez-Flores M. S., Escurendo O., Seijo M. C., Ouchemoukh S. Phenolic compounds and antioxidant and antibacterial activities of Algerian honeys. Food Biosci. 2021; 42, 101070. https:// doi.org/10.1016/j.fbio.2021.101070 (10.5.2022).
55. Saxena S., Gautam S., Sharma A. Physical, biochemical and antioxidant properties of some Indian honeys. Food Chem. 2010; 118, 391–397. https://doi.org/10.1016/j. foodchem.2009.05.001 (10.5.2022).
56. Das A., Mukherjee A., Dhar P. Characterization of antioxidants and antioxidative properties of various unifloral honeys procured from West Bengal, India. IOSR-JESTFT 2013; 7(3), 56–63. www.iosrjournals.org (10.5.2022).
57. Das A., Datta S., Mukherjee S., Bose S., Ghosh, S., Dhar P. Evaluation of antioxidative, antibacterial and probiotic growth stimulatory activities of Sesamum indicum honey containing phenolic compounds and lignans. LWT 2015; 61, 244–250. https://doi.org/10.1016/j.lwt.2014.11.044 (12.10.2021).
58. Moniruzzaman M., Yung An C., Rao P. V., Hawlader M. N. I., Azlan S. A. B. M., Sulaiman S. A., Gan S. H. Identification of phenolic acids and flavonoids in monofloral honey from Bangladesh by high performance liquid chromatography: determination of antioxidant capacity. Biomed Res. Int. 2014; 737490. https://doi. org/10.1155/2014/737490 (12.10.2021).
59. Moniruzzaman M., Khalil M. I., Sulaiman S. A., Gan S. H. Physicochemical and antioxidant properties of Malaysian honeys produced by Apis cerana, Apis dorsata and Apis mellifera. BMC Complement. Altern. Med. 2013; 13, 1–12. https://doi.org/10.1186/1472-6882-13-43 (12.10.2021).
60. Kek S. P., Chin N. L., Yusof Y. A., Tan S. W., Chua, L. S. Total phenolic contents and colour intensity of Malaysian honeys from the Apis spp. and Trigona spp. bees. Agric. Agric. Sci. Procedia 2014; 2, 150–155. https://doi. org/10.1016/j.aaspro.2014.11.022 (1.6.2022).
61. Beretta G., Granata P., Ferrero M., Orioli M., Facino R. M. Standardization of antioxidant properties of honey by a combination of spectrophotometric/fluorimetric assays and chemometrics. Anal. Chim. Acta 2005; 533, 185–191. https://doi.org/10.1016/j.aca.2004.11.010 (5.10.2021).
62. Dżugan M., Tomczyk M., Sowa P., Grabek-Lejko D. Antioxidant activity as biomarker of honey variety. Molecules 2018; 23, 2069. https://doi.org/10.3390/molecules23082069 (18.5.2022).
63. Piljac-Žegarac J., Stipčević T., Belščak A. Antioxidant properties and phenolic content of different floral origin honeys. JAAS 2009; 1, 43–50. doi: 10.3896/IBRA.4.01.2.04 (18.5.2022).
64. Flanjak I., Kenjerić D., Bubalo D., Primorac L. Characterisation of selected Croatian honey types based on the combination of antioxidant capacity, quality parameters, and chemometrics. Eur. Food Res. Technol. 2016; 242, 467–475. https://doi.org/10.1007/s00217-015-2557-0 (3.10.2021).
65. Daci-Ajvazi M., Mehmeti, A. Zeneli L., Daci N. Evaluation of antioxidant activity, heavy metals and colour intensity of honeys from different parts of Kosovo. J. Environ. Prot. Ecol. 2017; 18, 737–748. https://www.researchgate. net/profile/Lulzim-Zeneli/publication/318745386_Evaluation_ of_Antioxidant_Activity_Heavy_Metals_ and_Colour_Intensity_of_Honeys_from_Different_ Parts_of_Kosovo/links/597dc518458515687b498dfa/ Evaluation-of-Antioxidant-Activity-Heavy-Metals-and - Colour-Intensity-of-Honeys-from-Different-Parts-of-Kosovo. pdf (21.5.2022).
66. Ahmed M., Shafiq M. I., Khaleeq A., Huma R., Qadir M. A., Khalid A., Ali A., Samad A. Physiochemical, biochemical, minerals content analysis, and antioxidant potential of national and international honeys in Pakistan. J. Chem. 2016. Article ID 8072305 https://doi. org/10.1155/2016/8072305 (11.10.2021).
67. Mahmoodi-Khaledi E., Lozano-Sanchez J., Bakhouche A., Habibi-Rezaei M., Sadeghian I., Segura-Carretero A. Physicochemical properties and biological activities of honeys from different geographical and botanical origins in Iran. Eur. Food Res. Technol. 2017; 243, 1019–1030. https://doi.org/10.1007/s00217-016-2811-0 (11.10.2021).
68. Vaghela J., Reddy A. S. Antioxidant potential of Apis florea honey from dryland ecosystem in Western India. Int. J. Adv. Res. 2016; 4, 1392–1402. https://www.academia. edu/23116680/ANTIOXIDANT_POTENTIAL_OF_APIS_ FLOREA_HONEY_FROM_DRYLAND_ECOSYSTEM_IN_ WESTERN_INDIA (14.11.2021).
69. Islam, A. Khalil I., Islam N., Moniruzzaman M., Mottalib A., Sulaiman S. A., Gan S. H. Physicochemical and antioxidant properties of Bangladeshi honeys stored for more than one year. BMC Complement. Altern. Med. 2012; 12, 1–10. https://doi.org/10.1186/1472-6882-12 - 177 (21.5.2022).
70. Moniruzzaman M., Sulaiman S. A., Khalil M. I., Gan S. H. Evaluation of physicochemical and antioxidant properties of sourwood and other Malaysian honeys: a comparison with manuka honey. Chem. Cent. J. 2013; 7, 1–12. https://doi.org/10.1186/1752-153X-7-138 (12.10.2021).
71. Moniruzzaman M., Sulaiman S. A., Azlan S. A. M., Gan S. H. Two-year variations of phenolics, flavonoids and antioxidant contents in acacia honey. Molecules 2013; 18, 14694–14710. htps://doi.org/10.3390/molecules181214694 (12.10.2021).
72. Cruz, L. C., Batista, J. E. S., Zemolin, A. P. P., Nunes, M. E. M., Lippert, D. B., Royes, L. F. F., Soares F. A., Pereira A. B., Posser T., Franco, J. L. A study on the quality and identity of Brazilian Pampa biome honey: evidence for its beneficial effects against oxidative stress and hyperglycemia. Int. J. Food Sci. 2014. Article ID 470214 https://doi. org/10.1155/2014/470214 (22.5.2022).
73. Bodor Z., Benedek C., Urbin A., Szabo D., Sipos L. Colour of honey: can we trust the Pfund scale? – An alternative graphical tool covering the whole visible spectra. LWT 2021; 149, 111859. https://doi.org/10.1016/j. lwt.2021.111859 (21.9.2021).
74. Albu A., Simona-Maria C. M., Pop I. M. Physicochemical parameters and spectral structure (FT-IR) of honey from Iasi County (North-Eastern Romania). Scientific Papers: Series D, Animal Science-The International Session of Scientific Communications of the Faculty of Animal Science 2019; 62(2). ISSN 2285-5750; ISSN CD-ROM 2285-5769; ISSN Online 2393-2260; ISSN-L 2285-5750 (24.5.2022).
75. Chirsanova A., Capcanari T., Boistean A., Siminiuc R. Physico-chemical profile of four types of honey from the south of the Republic of Moldova. Food Nutr. Sci. 2021; 12, 874–888. https://www.scirp.org/journal/fns (24.5.2022).
76. Al-Farsi M., Al-Amri A., Al-Hadhrami A., Al-Belushi S. Color, flavonoids, phenolics and antioxidants of Omani honey. Heliyon 2018; 4, e00874. https://doi. org/10.1016/j.heliyon.2018.e00874 (24.5.2022).
77. Hailu D., Belay A. Melissopalynology and antioxidant properties used to differentiate Schefflera abyssinica and polyfloral honey. PLoS One 2020; 15, e0240868. https:// doi. org/10.1371/journal.pone.0240868 (25.5.2022).
78. Alvarez-Suarez, J. M., Tulipani, S., Díaz, D., Estevez, Y., Romandini, S., Giampieri, F., Damiani E., Astolfi P., Bompadre S., Battino, M. Antioxidant and antimicrobial capacity of several monofloral Cuban honeys and their correlation with color, polyphenol content and other chemical compounds. Food Chem. Toxicol. 2010; 48, 2490–2499. https://doi.org/10.1016/j.fct.2010.06.021 (24.5.2022).
79. Aazza S., Lyoussi B., Antunes D., Miguel M. G. Physicochemical characterization and antioxidant activity of commercial Portuguese honeys. J. Food Sci. 2013; 78, C1159–C1165. https://doi.org/10.1111/1750 - 3841.12201 (25.5.2022).
80. Živković J., Sunarić S., Stanković N., Mihajilov-Krstev T., Spasić A. Total phenolic and flavonoid contents, antioxidant and antibacterial activities of selected honeys against human pathogenic bacteria. Acta Pol. Pharm. 2019; 76, 671–681. https://doi.org/10.32383/ appdr/105461 (25.5.2022).
81. Bouhala A., Ouchemoukh S., Moussi A., Beidjoudi S. Altitude effect on the properties of honeys from the region of Jijel (Algeria). Polish J. Food Nutr. Sci. 2020; 70, 169 – 178. https://doi.org/10.31883/pjfns/118528 (1.6.2022).
82. Aazza, S., Lyoussi, B., Antunes, D., Miguel, M. G. Physicochemical characterization and antioxidant activity of 17 commercial Moroccan honeys. Int. J. Food Sci. Nutr. 2014; 65, 449–457. https://doi.org/10.3109/09637486.20 13.873888 (26.5.2022).
83. Aazza S., Elamine Y., El‐Guendouz S., Lyoussi B., Antunes M. D., Estevinho L. M., Anjos O., Carlier J. D., Costa M. C., Miguel M. G. Physicochemical characterization and antioxidant activity of honey with Eragrostis spp. pollen predominance. J. Food Biochem. 2018; 42, e12431. https://doi.org/10.1111/jfbc.12431 (26.5.2022).
84. El Menyiy N., Akdad M., Elamine Y., Lyoussi B. Microbiological quality, physicochemical properties, and antioxidant capacity of honey samples commercialized in the Moroccan Errachidia region. J. Food Qual. 2020. https://doi.org/10.1155/2020/7383018 (26.5.2022).
85. Shekilango S. G., Mongi R. J., Shayo N. B. Colour and antioxidant activities of honey from different floral sources and geographical origins in Tanzania. Tanzan. J. Agric. Sci. 2016; 15, 101–113.https://www.ajol.info/index.php/ tjags/article/view/177785 (1.6.2022).
86. Ahmed M., Baghdad K., Aissat S., Djebli N. Colour intensity, polyphenol content and antibacterial capacity of unheated and heat-treated Sahara honey. J. Food Process. Technol. 2016; 7, 589. http://dx.doi. org/10.4172/2157-7110.1000589 (26.5.2022).
87. Srećković N. Z., Mihailović V. B., Katanić-Stanković J. S. Physico-chemical, antioxidant and antimicrobial properties of three different types of honey from Central Serbia. Kragujev. J. Sci. 2019; 41, 53–68. https://scidar. kg.ac.rs/handle/123456789/13294 (18.10.2021).
Labels
Pharmacy Clinical pharmacology
Article was published inCzech and Slovak Pharmacy

2022 Issue 4-
All articles in this issue
- Colour and content of some biologically active substances in honey
- Selected polyphenolic compounds and their use as a supportive therapy in metabolic syndrome
- Neuroactive steroids – new possibilities in the treatment of postpartum depression
- Vášeň pro krásu lékárníka Mojmíra Helceleta
- XLIII. pracovní dny Radiofarmaceutické sekce ČSNM Hotel Strážnice, 18. až 20. května 2022
- Prof. RNDr. Jan Šubert, CSc. – osemdesiaťročný
- Výstava Zahrada vůní aneb Rostliny v parfémech
- Investigation of the antimicrobial and antifungal activities of some 1,2,4-triazole derivatives
- Czech and Slovak Pharmacy
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Neuroactive steroids – new possibilities in the treatment of postpartum depression
- Selected polyphenolic compounds and their use as a supportive therapy in metabolic syndrome
- XLIII. pracovní dny Radiofarmaceutické sekce ČSNM Hotel Strážnice, 18. až 20. května 2022
- Colour and content of some biologically active substances in honey
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

