-
Medical journals
- Career
Metronomická terapie v léčbě nádorových onemocnění
Authors: Dana Mazánková; Veronika Bárková; Pavel Mazánek
Published in: Čes. slov. Farm., 2022; 71, 91-97
Category: Review Articles
doi: https://doi.org/https://doi.org/10.5817/CSF2022-3-91Overview
Metronomická terapie je léčebnou metodou u vybraných onkologických onemocnění, využívající dlouhodobého podávání nízkých dávek léků s přímým či nepřímým protinádorovým účinkem. Mimo přímou cytotoxickou eradikaci nádorových buněk dokáže metronomická terapie velmi silně ovlivnit nádorové mikroprostředí, má i účinek imunomodulační a antiangiogenní. Její minimální toxický profil umožňuje nasazení u pacientů s těžkými orgánovými dysfunkcemi a má i přímý vliv na kvalitu života a společenské uplatnění onkologicky nemocných pacientů.
Klíčová slova:
toxicita – rezistence – metronomická terapie – antiangiogenní účinek – imunomodulační účinek
Úvod
I přes veškeré medicínské pokroky léčba řady onkologických onemocnění selhává. Současné léčebné principy jsou postavené převážně na podávání maximálně tolerovaných dávkách léků, které jsou ale pro řadu pacientů nesnesitelně toxické a u řady onemocnění i neúčinné, protože některé typy nádorových buněk jsou vůči účinku konvenčních cytotoxických režimů rezistentní. Metronomická terapie je jedním z nových postupů, který využívá dlouhodobého podávání nízkých dávek léků s přímým i nepřímým protinádorovým účinkem. Mimo přímé cytotoxické eradikace nádorových buněk dokáže metronomická terapie velmi silně ovlivnit nádorové mikroprostředí, má i markantní účinek imunomodulační a antiangiogenní. Dlouhodobé podávání nízkých denních dávek léčiv v metronomických režimech výrazně eliminuje riziko závažných akutních toxických účinků metronomické léčby, a umožňuje tak její nasazení i u pacientů se závažnými orgánovými dysfunkcemi, a to jak primárními, tak získanými během předchozích linií onkologické léčby. Z dlouhodobého hlediska se ukazuje, že metronomická léčba dokáže u řady pacientů předcházet relapsům onemocnění, vzniku rezistence na léčbu, představuje i nižší zátěž organismu. Nižší výskyt komplikací spojených s léčbou má v neposlední řadě i přímý vliv na vyšší kvalitu života onkologických pacientů.
Z hlediska metronomické terapie můžeme zlomovým označit rok 2000, kdy Filder a Ellis vyjádřili tvrzení, že rakovina je chronická nemoc a jako chronická by také měla být léčena. Na základě této myšlenky se jednotlivé skupiny vědců začaly zabývat hledáním nových možností podávání léčiv1). Pojem „metronomická terapie“ poprvé použil Douglas Hanahan a je odvozený od přístroje metronom. Metronom svým pravidelným tikáním udržuje pevný a pravidelný hudební rytmus a hudebníci jej využívají při nácviku hudebních děl2).
Konvenční chemoterapie
Konvenční chemoterapie je postavená na podávání maximálních dávek cytotoxických léčiv, které mají ve svém množství za úkol zničit co největší množství nádorových buněk, ale na druhou stranu je pacient ještě toleruje a nejsou pro něj letální3). Takové dávky však vyžadují delší intervaly mezi jednotlivými podáními, které umožní obnovu zdravým buňkám, které jsou cytotoxickým léčivem také zasaženy. Poškození se týká především rychle proliferujících buněk, například epitele gastrointestinálního traktu, krevních buněk nebo keratinocytů4). Toto poškození bývá spojené s nežádoucími účinky typu zvracení, průjmů nebo zácpy, únavy, ztráty vlasů, anemie, infekcí v důsledku snížené funkce imunitního systému, změn na kůži, mukozitidy a problémů se spánkem. Všechny tyto nežádoucí účinky významně ovlivňují kvalitu života pacienta a v některých případech mohou být tak závažné, že je nutné chemoterapii přerušit. Navíc během pauzy nutné pro zotavení těla pacienta dochází i k regeneraci nádoru, jeho mikroprostředí a cév, které mu zajišťují vhodné podmínky k dalšímu růstu a výživě3).
I přes prozatím nezastupitelné postavení konvenční chemoterapie se setkáváme s komplexními typy nádorů, které rozsáhle zasahují do pacientova mikroprostředí. V tom spočívá problém nedostatečné odpovědi účinku mířeného přímo a pouze na nádorové buňky. Mezi tyto nádory patří sarkomy, nádory prsu, prostaty a plic4).
Další a významný problém spočívá ve vzniku chemorezistence nádorových buněk. Ta může být jak primární spočívající v tom, že v nádorové buňce nejsou žádné struktury, které by mohla chemoterapie poškodit, tak i sekundární, spočívající v tom, že si nádorová buňka vytvoří obranné mechanismy, které například nedovolí vstup cytostatika do buňky, nebo dojde k jeho rychlé aktivní eliminaci z nitra buňky do vnějšího prostředí. Zvláště tomu tak je u solidních nádorů, kde chemoterapie působí pouze na nádorové buňky citlivé vůči léčbě. Chemorezistentní buňky nijak zasaženy nejsou, což jim dává možnost znovu kolonizovat ložisko nádoru, a vede tak k relapsu onemocnění. Jednou ze strategií jak takovému relapsu předejít je jak uplatnění stále intenzivnější a tím pádem i toxičtější léčby, tak uplatnění kombinace chemoterapeutických režimů. Vzhledem k hlubšímu porozumění procesů při nádorovém onemocnění však cíle moderních terapií směřují nejen k přímému cytotoxickému působení vůči nádorovým buňkám, ale obrací se i k jiným cílům, jako je nádorové mikroprostředí nebo novotvorba cév. Metronomická terapie je tak cílena spíše k pomaleji nastupující, ale prodloužené léčebné odpovědi na léčbu než na rychlou a krátkodobou regresi onemocnění, kterou slibují konvenční léčebné režimy, které však nemusejí korespondovat s pacientovým vyšším dlouhodobým přežitím4).
Princip metronomické terapie
Vzhledem ke snaze poskytnout pacientům účinnou a bezpečnou léčbu s minimálním rizikem závažných nežádoucích účinků vznikaly nové strategie se záměrem najít takové terapeutické cíle, které by mohly zefektivnit boj proti nádorovým onemocněním. Jednou z těchto strategií je i metronomická terapie. Současnou definici metronomické terapie lze uvést jako režim souvislého podávání minimální biologicky účinné dávky terapeutického léčiva, který vede k protinádorové aktivitě. Porovnání schémat dávkování konvenční a metronomické terapie ukazuje obrázek 12).
Image 1. Schéma rozdílného dávkování cytotoxických léčiv v rámci konvenční a metronomické terapie (převzato a upraveno dle (2) 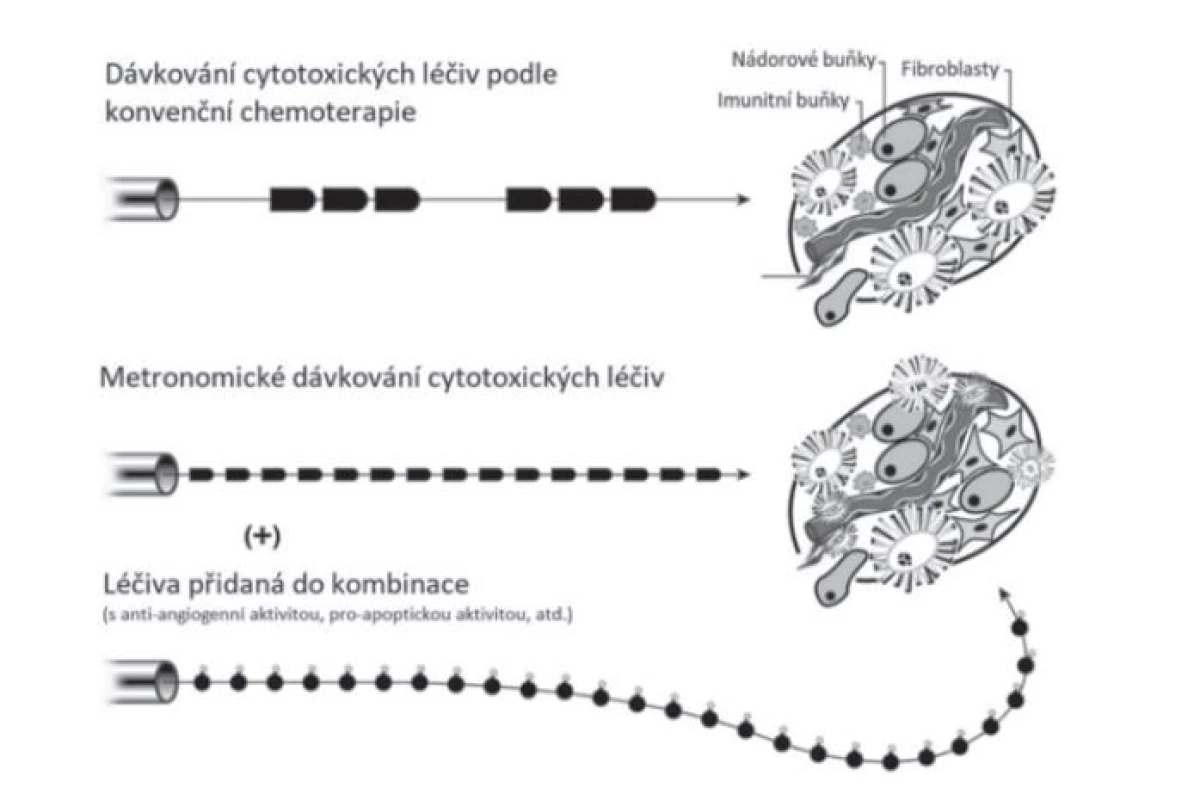
Hlavní vlastností metronomické terapie je tedy časté podávání léčiv, bez dlouhodobého přerušení, použití méně toxické, biologicky optimalizované dávky namísto maximální tolerované dávky, nepodávání žádných hematopoetických růstových faktorů, upřednostnění podávání léčiv per os a nízká frekvence výskytu vedlejších účinků spojených s léčbou. Nevýhodou může být potenciál pro vznik opožděné rezistence. Vzhledem k přímému i nepřímému účinku na nádor a jeho mikroprostředí působí tento typ terapie na více cílů5, 6).
V klinické praxi se v rámci metronomických režimů používají jak léčiva cytotoxická (cyklofosfamid, etoposid, vinblastin, topotecan), ale i léčiva užívaná v jiných indikacích, která ale při správně zvolených dávkách a frekvenci podávání prokazují přímý i nepřímý protinádorový efekt. Mezi ně patří například statiny, thiazolidindiony, thalidomid, kyselina retinová, metformin, celekoxib, kyselina valproová, propranolol, nelfinavir, nitroxolin nebo rifampicin6, 7).
Komplexní přístup k terapii nádorových onemocnění je klíčový, protože se nelze zaměřit pouze na likvidaci samotných nádorových buněk. Nádorové buňky lze přirovnat k „parazitovi“, který žije v prostředí nádorových endoteliálních a stromálních buněk zahrnující fibroblasty, pericyty a buňky imunitního systému, které všechny společně tvoří jakýsi ekosystém v rámci lidského organismu. Je tedy logické, že přežití nádoru značně závisí na vhodném prostředí a jeho stavu. Navíc stejně jako u antiparazitické léčby je potřeba volit takové dávky, které parazita zničí, ale pacienta nijak nepoškodí. V neposlední řadě hraje roli i rozvoj rezistence vůči léčbě4). Se všemi těmito překážkami se setkáváme u pacientů trpících nádorovým onemocněním, což posiluje tvrzení, že vyšší toxicita vůči nádorovým buňkám nemusí znamenat celkové zvýšení účinnosti léčby. Proto zaměření se na buňky v mikroprostředí nádoru, které se nacházejí bezprostředně v jeho blízkosti, se zdá být v rámci dlouhodobé strategie léčby účinnější4).
Mechanismus účinku metronomické terapie
Výhodou metronomické terapie je bezpochyby její působení na více úrovních. Zasahuje nejen přímo nádor, ale také do jeho mikroprostředí pomocí inhibice nádorové angiogeneze, aktivace imunitního systému vůči nádoru nebo pomocí zkoumaného 4D efektu. Mimo jiné se také zvažuje působení na nádorové kmenové buňky.
Antiangiogenní účinek/působení
Angiogeneze je běžným procesem, který se uplatňuje v rozvoji, reprodukci a obnově tkání. Za fyziologických okolností má význam například pro vývoj embrya, hojení zlomenin nebo třeba v průběhu menstruačního cyklu. Naopak zvýšená angiogenní aktivita je zodpovědná za řadu patologických jevů, mezi něž patří i úloha v rozvoji nádoru a jeho metastazování. Bez cévního zásobení je nádor schopný dorůst maximálně 1–2 mm3. Jakmile nádor roste do větších rozměrů, nemá dostatek živin a kyslíku. V důsledku hypoxie vzniká genetická nestabilita a vznikají mutace, v jejichž důsledku nádorové buňky produkují zvýšené množství angiogenních faktorů. Takový proces patologické angiogeneze označujeme jako „angiogenní switch“ 8).
Významem angiogeneze u nádorového onemocnění se zabýval již v roce 1971 Judah Folkman. Na základě pozorování, které ukázalo, že expanze nádoru byla limitovaná absencí kyslíku, navrhl koncept antiangiogenní léčby, která by předcházela formování nových cév zásobujících nádor a tím by omezovala rozvoj nádorového onemocnění9).
Důležitou roli v procesu angiogeneze hrají i zmíněné proangiogenní a antiangiogenní faktory. Mezi proangiogenní faktory můžeme zařadit vaskulární endotelový růstový faktor (vascular endothelial growth factor – VEGF) zodpovědný za iniciaci angiogenního procesu, bazický růstový fibroblastový faktor (basic fibroblast growth factor – bFGF) poskytující signály pro endoteliální proliferaci a formování nových cév a dále také růstový faktor z destiček (platelet derived growth factor – PDGF), jenž stabilizuje vytvořené cévy. Za normálních fyziologických podmínek je tento děj stabilizovaný faktory trombospondin 1 (TSP-1) a destičkovým faktorem 4 (platelet factor-4 – PF4). V nádorovém mikroprostředí dochází k porušení této rovnováhy a v důsledku působení protoonkogenů, jako jsou proteiny signálních kaskád (signální transduktor) Ras, transkripční faktor c-myc a růstové faktory (VEGF, bFGF, PDGF), převažuje účinek proangiogenních faktorů4).
Metronomická terapie působí na rozdíl od antiangiogenních léčiv přímo na zdroj výše zmíněných faktorů tím, že zasahuje nádorové endoteliální buňky a fibroblasty. Zasažené buňky se na rozdíl od konvenční terapie nestíhají obnovovat, protože léčiva podáváme kontinuálně bez pauz1). Snížená je také migrace endoteliálních buněk. Studie autorů Guido Bocci et al. pozorovala u myší léčených metronomickou terapií zvýšenou hladinu TSP-1, který má funkci vysoce specifického a potentního inhibitoru angiogeneze10–12). Zvýšená exprese byla pozorována v endoteliálních buňkách, které byly vystaveny nízkým koncentracím protinádorových léčiv (inhibitory mikrotubulů a alkylační činidla) a vykazovaly vyšší úroveň genové a proteinové exprese TSP-1. Dále pak byla vyšší hladina TSP-1 detekována u nádorem postižených myší, jež byly léčené metronomicky dávkovaným cyklofosfamidem13).
Růst některých typů nádorů je závislý nejen na angiogenezi (proces vzniku nových krevních cév závislý na zralých endoteliálních buňkách), ale i na vaskulogenezi (proces vzniku nových krevních cév závislý na cirkulujících endoteliálních progenitorových buňkách (circulating endothelial progenitor cells – CEP)1). Cirkulující endoteliální progenitory jsou alternativním zdrojem endotelií nově zformovaných cév v nádoru, vstupují do periferního krevního řečiště a následně se začleňují do distálních částí angiogenního procesu, kde se mohou diferencovat na zralé endoteliální buňky14, 15). Hladina cirkulujících endoteliálních buněk a CEP buněk se stala předmětem zkoumání, protože jejich zvýšená koncentrace byla pozorována u pacientů s nádorovým onemocněním. Dříve se také s ohledem na antiangiogenní léčbu uvažovalo o genetické stabilitě endoteliálních buněk na rozdíl od nádorových buněk. Nicméně tato úvaha byla vyvrácena, když byly u xenograftových modelů melanomu a liposarkomu objeveny endoteliální buňky s heterogenním jádrem. To by mohlo znamenat problém, protože účinek metronomicky podávaných léčiv by pak dále nemusel mít na tyto cirkulující buňky vliv16).
Na rozdíl od antiangiogenních léčiv, které cílí na určité molekuly nebo signální dráhy, spočívá účinek metronomické terapie v inhibici růstových faktorů přímo u zdroje tím, že způsobuje poškození fibroblastů a nádorových endoteliálních buněk. I přes to, že účinek antiangiogenních léčiv i metronomické terapie má stejný důsledek, mechanismy, jimiž je inhibice angiogeneze dosaženo, se liší. Vzhledem k tomu, že metronomická terapie cílí přímo na zdroj růstových faktorů, a ne pouze na růstové faktory samotné, má potenciál účinkovat trvaleji4).
Vzhledem k inhibici proliferace endoteliálních buněk a omezení přívodu živin nádoru tak lze překonat rozvoj rezistence na konvenční terapii používající maximální tolerovanou dávku (MTD) cytotoxických léčiv. Standardní chemoterapie by způsobila pouze slabé endoteliální poškození, protože by se endoteliální buňky během pauzy mezi podáním léčiv mohly obnovit. Zrychlené nebo zkrácené podávání nižších dávek by této obnově mohlo zabránit6).
Imunomodulační účinek/působení
Důležitou roli v kontrole rozvoje a růstu nádoru hraje jak vrozená, tak i získaná imunita. I přes dobře známý nežádoucí účinek konvenční chemoterapie na imunitní systém v důsledku neutropenie a lymfopenie bylo různými studiemi dokázáno, že některá cytotoxická léčiva, jako jsou antracykliny, taxany nebo cyklofosfamid, mají i imunostimulační vlastnosti4).
Účinek na imunitní systém pomocí frekventovaného podávání nízkých dávek cytotoxických léčiv je zprostředkovaný snížením hladiny regulačních T-buněk (Treg), indukcí maturace dendritických buněk a pozitivním účinkem na další antigen prezentující buňky. V neposlední řadě mohou nízké dávky cytotoxických léčiv ovlivňovat myeloidní buňky, které snižují supresi adaptivní imunitní odpovědi a umožňují zlepšenou protinádorovou aktivitu4).
V tomto kontextu je významný účinek metronomické terapie na Treg buňky (regulační T-buňky). Treg jsou CD4+ CD25+ lymfocyty, které mohou inhibovat antigen specifickou imunitní odpověď jak cytokin - dependentním, tak kontaktně-dependentním způsobem. Treg buňky mohou také inhibovat imunitní odpověď proti nádoru potlačováním aktivity pro nádor specifických (CD8+ cytotoxické lymfocyty a CD4+ pomocné T-buňky) a nespecifických (NK-buňky, natural killer-buňky) efektorových buněk. Treg lymfocyty byly nalezeny ve větší míře u různých typů nádorových onemocnění s tím, že jejich zvýšená hladina měla pravděpodobně vztah k rozvoji nádoru a nedostatečné odpovědi na léčbu. Snížení aktivity lymfocytů Treg buď specifickou blokádou, nebo deplecí je metodou jak zlepšit imunitní odpověď proti antigenům spojených s nádorem5).
4D účinek/efekt
4D efekt byl pozorován při přerušení dlouhodobé metronomické terapie. Během dlouhodobého vystavování nádoru léčivé látce si nádorové buňky mohou na tuto látku vytvořit závislost. Náhlé ukončení podávání léčiva nebo změna léčby by pak mohla vést ke smrti nádorových buněk. Název 4D je odvozený z anglického „drug driven dependency and forced deprivation“ 5, 6).
Rezistence na metronomickou terapii
Vzhledem k rozdílným mechanismům působení a mechanismům vzniku rezistence se metronomická terapie ukazuje jako možnost jak léčit pacienty se získanou rezistencí na konvenční chemoterapii. Nicméně bylo také zjištěno, že množství nádorových onemocnění vykazuje vnitřní rezistenci vůči metronomicky podávaným léčivům a že i vůči této léčbě může dojít i přes původní dobrou odpověď ke vzniku rezistence. Poznání těchto mechanismů je klíčové pro hledání možností jak vzniku získané rezistence předejít a především jak postupovat v léčbě při jejím vytvoření.
Rezistence na metronomickou terapii může být řízená nejen nádorovými buňkami, ale také buňkami endoteliálními. Endoteliální buňky a formování nových cév je především závislé na růstových faktorech a jejich inhibici. Ve chvíli, kdy i přes podávání metronomické terapie převažují proangiogenní faktory, dochází ke vzniku rezistence. V tomto případě se ukázalo jako vhodné terapii kombinovat s inhibitory VEGF. Výzkum se také zaměřuje na jednotlivé stupně Akt signální dráhy, která je aktivovaná VEGF a hraje roli při podpoře formace a růstu nových cév. Její aktivace by mohla souviset s hypoxií nádoru indukovanou metronomickou léčbou, na jejímž základě může docházet ke zvýšení exprese proangiogenních faktorů. Také se ukázalo, že endoteliální buňky nejsou tak geneticky stabilní, jak se předpokládalo. Nicméně jejich chemorezistence je stále nedostatečně prozkoumaná. V neposlední řadě je důležité zmínit i nález progenitorových endoteliálních buněk, u kterých byla zvýšená exprese P-glykoproteinových efluxních pump, které by také mohly mít vliv na vznik rezistence17, 18).
Dalším úskalím je rezistence samotných nádorových buněk. Ty jednak mohou uplatňovat zvýšenou expresi detoxifikačních enzymů, ale může také docházet k získání pluripotentního fenotypu, kdy se pluripotentní nádorové buňky transdiferencují na endoteliální buňky, které se začleňují do nově vzniklých cév. Cévy obsahující tyto buňky následně vykazují odolnost vůči terapii. Pozorovat lze i nádorové buňky, které mají snížené nároky na zásobení kyslíkem a živinami. Nicméně mechanismus vzniku těchto odolnějších buněk je stále velmi málo objasněn. Problémem zůstávají nadále i kmenové nádorové buňky, jejichž nekompletní zničení může vyústit v relaps onemocnění a tvorbu metastáz. Důvodem jejich nekompletní eliminace jsou zřejmě pluripotentní vlastnosti a mutace17).
Faktory související s pacientem
Vliv na odpověď na metronomickou léčbu má samozřejmě i organismus pacienta. U klasické chemoterapie, kde podáváme léčiva nepravidelně, je nepravděpodobné, že se metabolismus léčiva u následující dávky změní. Naproti tomu u metronomicky podávaných léčiv je velmi důležité, aby minimální dávka, kterou podáváme, zůstala nad prahem, kdy dochází k protinádorové aktivitě. Tím pádem jakákoliv změna v metabolismu může vést ke snížení této ustálené hladiny. Ke změnám v metabolismu může docházet vlivem působení samotné látky, která aktivuje metabolickou dráhu pro odbourání sebe samé a dále pak vlivem farmakogenomiky, kdy jednotliví pacienti mají metabolismus různě rychlý. V neposlední řadě je třeba myslet i na souběžně užívaná léčiva k terapii jiných onemocnění, compliance pacienta nebo dysfunkci metabolických orgánů, a to zejména u starších pacientů17).
Vzhledem k častému podávání nízkých dávek je důležité, aby koncentrace léčiva v organismu neklesaly pod minimální biologicky účinnou hladinu. Tato hladina je však stále obtížně zjistitelná, protože dostupné metody detekce léčiva v krvi často nejsou dostatečně citlivé k tak nízkým hladinám léčiv. Proto bude v budoucnu nutné provést více farmakokinetických studií, které pomohou nalézt optimální dávkování a zajištění sledování koncentrace léčiva v krvi17).
Biomarkery
Aby bylo možné určit, kteří pacienti mohou z metronomické terapie těžit nejvíce a jak nemoc odpovídá na léčbu, je klíčové znát spolehlivé diagnostické, prediktivní a prognostické biomarkery. Tyto biomarkery jsou důležité zejména z toho důvodu, že metronomická terapie trvá delší dobu a regresi tumoru indukuje se zpožděním. Dále jejich význam spočívá v určení typu léčiv, dávky, kombinace léčiv, dávkovacího režimu a také pro určení typu onemocnění. Například cytokiny jsou mezi odbornou veřejností stále předmětem sporu, kdy jedna část jejich roli v předpovídání efektivity metronomické terapie upřednostňuje, zatímco druhá část tuto teorii vyvrací6).
Jednou z nevýhod dlouhodobého metronomického podávání léčiv je fakt, že zatím nebyla určena nejúčinnější dávka a režim podávání. Proto byly za účelem získání těchto informací studovány úlohy jednotlivých markerů angiogeneze a vaskulogeneze, na jejichž základě by bylo potenciálně možné určit antivaskulární aktivitu léčiv samotných nebo jejich kombinací, a předpovědět tak odpověď na léčbu, případně dobu přežití.
Potenciální roli v určení biomarkerů by mohla mít i exprese hypoxií indukovaného faktoru 1 (hypoxia - -inducible factor-1 – HIF-1) a dále pak faktory, které se účastní na vzniku rezistence vůči metronomické terapii, jako je cathepsin B a gen kódující annexin 5 (ANXA3). Treg imunitní buňky a myeloidní supresorové buňky (myeloid-derived suppressor cell – MDSC) lze také považovat za jedny z možných budoucích biomarkerů. Jako biomarker se zpočátku zdál i VEGF a TSP-1, nicméně žádný významný vztah mezi jejich hladinami a odpovědí choroby nebyl zaznamenán. Vzhledem k možnostem využít technologii sekvenování nové generace by v budoucnosti mohlo být reálné hledání novějších potenciálních biomarkerů1, 6).
Toxicita metronomicky podávaných léčiv
Vzhledem k rozmanitosti populace pacientů, kombinacím léčiv a také typům nádorů jsou různé i údaje o toxicitě. Celkově se však metronomická kombinovaná terapie i monoterapie ukázaly při denním podávání jako velmi dobře tolerovatelné. Nejčastějšími nežádoucími účinky byly nauzea, anemie, neutropenie a únava. Bohužel, velkým problémem je absence rozsáhlých klinických studií fáze III, které by porovnávaly konvenční chemoterapii s terapií metronomickou.
Metronomická terapie je obecně popisována jako velmi dobře snášená a s minimální toxicitou, což pacientovi přináší vyšší kvalitu života. Je ale důležité vzít v potaz nejen akutní toxicitu, ale i toxicitu dlouhodobou, která se může projevit až po určitém čase. Pokud podáváme dlouhodobě cytotoxická léčiva, připadá v úvahu riziko kumulace látek v organismu. Například kumulace etoposidu, temozolomidu a cyklofosfamidu může v dlouhodobějším měřítku vést k sekundární leukemii nebo myelodysplastickému syndromu. Pokud je navíc metronomická terapie kombinována s antiangiogenními látkami, stále není jasné, jaké dávky těchto léčiv v rámci požadovaného účinku a bezpečnosti podávat. Všechny schválené antiangiogenní látky mají různé spektrum vedlejších účinků, z nichž některé mohou být pro pacienty velmi nepříjemné. Problém by mohl nastat v obtížném léčení některých příznaků, jako je únava, gastrointestinální obtíže v podobě nauzey, zvracení a průjmu. Akutní léčba těchto potíží je dostupná, nicméně vyrovnávání se s důsledky chronické toxicity je již značně obtížné19).
Metronomicky podávaná léčiva
Při metronomické terapii se uplatňují nejen cytotoxická léčiva, ale i další látky, které působí na inhibici angiogeneze. Vzhledem k tomu, že je nepravděpodobné, že by pouze jediný režim metronomické terapie měl univerzální účinky, je stále ještě třeba hledat optimální kombinace léčiv, a to vždy pro konkrétní typ nádorového onemocnění.
Léčiva s cytotoxickou aktivitou
Při metronomické terapii se setkáváme s orálně podávaným cyklofosfamidem a etoposidem, ať už samostatně nebo v kombinacích s celekoxibem či thalidomidem. Tato čtyřkombinace je používána u různých typů recidivujících a/nebo refrakterních solidních nádorů. U neuroblastomu, akutní lymfoblastické leukemie, sarkomů a anaplastického ependymomu je široce používán perorálně podávaný etoposid. Vinblastin a cyklofosfamid prokazují účinnost u rhabdomyosarkomu. Temozolomid se hojně používá především u nádorů mozku. Dále jsou používány i hormonální léčiva, jako je tamoxifen, a dále pak také cílené molekuly jako pazopanib a sunitinib6).
Léčiva bez cytotoxické aktivity
Řada sloučenin a léčiv, které se již běžně vyskytují na trhu v různých indikacích, ale nepatří mezi léčiva používaná u nádorových onemocnění, byla testována pro jejich anti-angiogenní a protinádorové účinky. Právě tato léčiva mají vhodný potenciál pro kombinaci v metronomických režimech.
Celekoxib jako selektivní inhibitor COX-2 (cyklooxygenáza - 2) se u nádorových onemocnění používá vzhledem k objevu zvýšeného množství tohoto enzymu jak u počátečních stadií nádorového onemocnění, tak u stadií pozdějších. Z perorálních antidiabetik se využívá metformin, jehož mechanismus účinku na nádorové onemocnění není zcela objasněn. Z dalších léčiv nalezneme v metronomických schématech inhibitor proteáz nelfinavir, jež inhibuje Akt signální dráhu, thiazolidindiony ovlivňující peroxisomový proliferátorem aktivovaný receptor gamma (peroxisome proliferator - activated receptor gamma – PPARγ) a Akt signální dráhu. Dále se používají nitroxolin a rifampicin jako zástupci antibakteriálních léčiv, které v pokusech in vitro a in vivo vykazovaly potlačení angiogeneze. Mezi další léčiva patří například statiny, fibráty nebo propranolol. Použití těchto dobře známých léčiv s sebou nese i výhodu zkušeností s jejich použitím a také ekonomickou nenáročnost6, 19–22).
Dávkování
Dávkování léčiv u metronomické terapie prozatím vychází z předchozích zkušeností a je zcela empirické. Definice „minimální biologicky aktivní dávky“ je proto zatím stále nejasná, protože u jednotlivých léčiv a navíc i v použití u různých nádorů se může lišit. To stejné platí i o frekvenci dávkování, které také vychází z poznatků z praxe. Za účelem zjištění těchto informací byly vyvíjeny matematické modely, které porovnávaly a vypočítaly například u temozolomidu na základě předchozích dat nejefektivnější dávku. Byl také vytvořený koncept matematického nástroje s názvem METRONORMOGRAM, který optimalizoval dávkování, frekvenci a trvání protinádorové terapie. Navíc také bral v úvahu nádorovou heterogenitu a populaci rezistentní na léčiva. Nicméně kvůli četným permutacím a možným kombinacím pro metronomické dávkování je empirické stanovení exaktního optimálního harmonogramu téměř nemožné6).
Závěr
Na základě preklinických i klinických studií lze usoudit, že metronomická terapie je příslibem pro pacienty s těžce léčitelným nebo rezistentním nádorovým onemocněním. Za posledních 20 let došlo k velkému posunu, díky kterému lze těmto pacientům zvýšit kvalitu života a prodloužit dobu přežití. Navíc vzhledem k nižším nákladům na léčbu lze tuto terapii uplatnit i v zemích s ekonomikou s nízkým příjmem. Při vzniku rezistence je důležité poznat možné mechanismy jejího vzniku, aby se jí mohlo předejít. Vždy je nutné stanovit exaktní schéma léčby a velikost dávek pro dané onemocnění, určit dobu trvání léčby a sledovat možné nežádoucí účinky.
Střet zájmů: žádný.
Došlo 24. února 2022 / Přijato 27. dubna 2022
PharmDr. Bc. Dana Mazánková, Ph.D.
Masarykova univerzita, Farmaceutická fakulta Ústav aplikované farmacie Palackého tř. 1946/1, 612 00 Brno
e-mail: mazankovad@pharm.muni.cz
V. Bárková
Oddělení klinické farmacie, Nemocniční lékárna FN u svaté Anny v Brně
P. Mazánek
Klinika dětské onkologie Lékařské fakulty Masarykovy univerzity, Oddělení dětské hematologie a biochemie Fakultní nemocnice Brno
Sources
1. Scharovsky O. G., Mainetti L., Rozados V. Metronomic chemotherapy: changing the paradigm that more is better. Current Oncol. 2009; 16(2), 7–15. doi: 10.3747/ co.v16i2.420. ISSN 1198-0052
2. Hanah D., Bergers G., Bergsland E. Less is more, regularly: metronomic dosing of cytotoxic drugs can target tumor angiogenesis in mice. J. Clin. Investig. 2000; 105(8), 1045–1047. doi: 10.1172/JCI9872. ISSN 0021-9738.
3. Browder T., Butterfield C. E., Brigit M., Shi B., Marshall B., O’Reilly M. S., Folkman J. Antiangiogenic scheduling of chemotherapy improves efficacy against experimental drug-resistant cancer. Cancer Res. 2000; 60(7), 1878–1886.
4. Kareva I., Waxman D. J., Klement G. L. Metronomic chemotherapy: An attractive alternative to maximum tolerated dose therapy that can activate anti-tumor immunity and minimize therapeutic resistance. Cancer Lett. 2015; 358(2), 100–106. doi: 10.1016/j.canlet.2014.12.039
5. Maiti R. Metronomic chemotherapy. J. Pharmacol. Pharmacotherapeutics 2014; 5(3), 186–192. doi: 10.4103/0976-500X.136098. ISSN 0976-500X.
6. Pramanik R., Bakhshi S. Metronomic therapy in pediatric oncology: A snapshot. Pediat. Blood and Cancer 2019; 66(9), 1–12. doi: 10.1002/pbc.27811.
7. Bronišová D., Múdry P., Štěrba J., Bajčiová V., Valík D., Dubská L., Mazánek P., Lokaj P., Zitterbart K. Metronomická léčba v onkologii jako nová léčebná metoda. Onkologie 2009; 3(4), 227–229.
8. Klener P. Angiogeneze a nádorová onemocnění. Remedia 2002; 12(1), 2–8.
9. Folkman J. Tumor angiogenesis: therapeutic implications. NEJM 1971; 285(21), 1182–1186. doi: 10.1056/ NEJM197111182852108
10. Chen H., Herndon M. E., Lawler J. The cell biology of thrombospondin-1. Matrix biology: journal of the International Society for Matrix Biol. 2000; 19(7), 597 – 614. doi: 10.1016/s0945-053x(00)00107-4. ISSN 0945 - 053X
11. de Fraipont F., Nicholson A. C., Feige J. J., Van Meir E. G. Thrombospondins and tumor angiogenesis. Trends Mol. Med. 2001; 7(9), 401–407. doi: 10.1016/s1471 - 4914(01)02102-5
12. Lawler J. Thrombospondin-1 as an Endogenous Inhibitor of Angiogenesis and Tumor Growth. J. Cell. Mol. Med. 2002; 6 (1), 1–12. doi: 10.1111/j.1582-4934.2002. tb00307.x
13. Bocci G., Francia G., Man S., Lawler J., Kerbler R. S. Thrombospondin 1, a mediator of the antiangiogenic effects of low-dose metronomic chemotherapy. PNAS 2003; 100(22), 12917–12922. doi: 10.1073/ pnas.2135406100
14. Bertolini F., Paul S., Mancuso P., Monestiroli S., Gobbi A., Shaked Y., Kerbel R. S. Maximum tolerable dose and low-dose metronomic chemotherapy have opposite effects on the mobilization and viability of circulating endothelial progenitor cells. Cancer Res. 2003; 63(15), 4342–4346.
15. Asahara T., Takahashi T., Masuda H., Kalka C., Chen D., Iwaguro H., Inai Y., Silver M., Iner J. M. VEGF contributes to postnatal neovascularization by mobilizing bone marrow-derived endothelial progenitor cells. EMBO J. 1999; 18(14), 3964–3972. doi: 10.1093/emboj/ 18.14.3964
16. Kerbel R. S. Inhibition of tumor angiogenesis as a strategy to circumvent acquired resistance to anti-cancer therapeutic agents. Bioassays 1991; 13(1), 31–36. doi: 10.1002/bies.950130106
17. Riesco-Martinez M., Parra K., Saluja R., Francia G., Emmenegger U. Resistance to metronomic chemotherapy and ways to overcome it. Cancer Lett. 2017; 400, 311–318. doi: 10.1016/j.canlet.2017.02.027
18. Shu-Ting P., Zhi-Ling L., Zhi-Xu H., Jia-Xuan Q., Shu - -Feng Z. Molecular mechanisms for tumour resistance to chemotherapy. Clin. Exp. Pharmacol. Physiol. 2016; 43(8), 723–737. doi: 10.1111/1440-1681.12581
19. Mross K., Steinbild S. Metronomic anti-cancer therapy – an ongoing treatment option for advanced cancer patients. J. Cancer Therap. Res. 2012; 1(1). doi: 10.7243/2049 - 7962-1-32
20. Koki A. T., Masferrer J. L. Celecoxib: A Specific COX – 2 Inhibitor With Anticancer Properties. Cancer Control 2002; 9(2), 28–35. doi: 10.1177/107327480200902S04
21. Shim J. S., Matsui Y., Bhat S., Nacev B. A., Xu J., Bhang H. C., Dhara S., Han K. Ch., Chong C. R., Pomper M. G., SO A., Liu J. O. Effect of Nitroxoline on Angiogenesis and Growth of Human Bladder Cancer. JNCI 2010; 102(24), 1855–1873. doi: 10.1093/jnci/djq457
22. Shichiri M., Fukai N., Kono Y., Tanaka Y. Rifampicin as an Oral Angiogenesis Inhibitor Targeting Hepatic Cancers. Cancer Res. 2009; 69(11), 4760–4768. doi: 10.1158/0008 - 5472.CAN-08-3417
Labels
Pharmacy Clinical pharmacology
Article was published inCzech and Slovak Pharmacy

2022 Issue 3-
All articles in this issue
- Metronomická terapie v léčbě nádorových onemocnění
- RNDr. PhMr. Ernest Alt – in memoriam
- Za prof. Ing. Petrom Kovácsom, DrSc. – in memoriam
- Výpočet energie pulzního elektrického pole pro poškození plátků oddenku červeného galgánu (Alpinia purpurata, K. Scumm) a výtěžek a kvalita jeho silice při hydrodestilaci
- Studie možných vlivů pohlaví na léčbu ramiprilem a candesartanem při experimentální arteriální hypertenzi u potkanů
- Vliv extraktu Aronia melanocarpa na složení fosfolipidů myokardu potkana během stresu
- Czech and Slovak Pharmacy
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Metronomická terapie v léčbě nádorových onemocnění
- Vliv extraktu Aronia melanocarpa na složení fosfolipidů myokardu potkana během stresu
- Studie možných vlivů pohlaví na léčbu ramiprilem a candesartanem při experimentální arteriální hypertenzi u potkanů
- Výpočet energie pulzního elektrického pole pro poškození plátků oddenku červeného galgánu (Alpinia purpurata, K. Scumm) a výtěžek a kvalita jeho silice při hydrodestilaci
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

