-
Medical journals
- Career
Barevnost a antioxidační aktivita medů
Authors: Jan Šubert; Jozef Kolář; Jozef Čižmárik
Published in: Čes. slov. Farm., 2022; 71, 20-26
Category: Review Articles
doi: https://doi.org/https://doi.org/10.5817/CSF2022-1-20Overview
Příspěvek upozorňuje na vztahy mezi výsledky instrumentálního měření barevnosti a výsledky stanovení antioxidační aktivity medů (zejména metodou DPPH a FRAP). Dostatečně těsné korelace ukazují, že po jejich ověření, doplnění regresní analýzou a kalibrací mohou najít uplatnění při rychlém stanovení antioxidační aktivity medů.
Úvod
Včelí med má řadu vlastností prospěšných lidskému zdraví1, 2). Je významným zdrojem biologicky aktivních látek, včetně přírodních antioxidantů1–6). Med tradičně byl a je zařazován do starších, např.7–10) i současných11–13) lékopisů. Jednou z důležitých vlastností medů je jejich antioxidační aktivita. Medy jsou také prakticky vždy více či méně barevné, přičemž na souvislost antioxidační aktivity medů s jejich barevností bylo již mnohokrát poukázáno. Řada publikovaných prací, např.2, 4, 6, 14) zmiňuje vyšší antioxidační kapacitu tmavších medů. Záměrem našeho příspěvku je poukázat na korelace některých instrumentálním měřením získaných ukazatelů barevnosti medů s jejich antioxidační aktivitou a na možné využití těchto korelací k hodnocení antioxidační aktivity medů.
Hodnocení barevnosti medů
Údaje o barevnosti medů lze získat mimo subjektivního hodnocení měřením založeným na číselném vyjádření barev ve vhodně voleném barevném prostoru. Většinou jde o barevné prostory CIELAB nebo CIELCH15–20), není tomu ale tak vždy21). Východiskem k měření barevnosti je spektrální propustnost nebo odraz vzorků ve viditelné spektrální oblasti. V analytice medů je však častější hodnocení barevnosti medů na základě výsledků měření absorbance vodných roztoků vzorků při některých vlnových délkách ve viditelné oblasti spektra. V publikacích zabývajících se hodnocením barevnosti a současně i antioxidační aktivity medů jde nejčastěji o vlnovou délku 450 nm, používanou po jejím snížení o hodnotu absorbance vzorku při 720 nm. Další častěji volenou vlnovou délkou je 635 nm, přičemž hodnoty absorbance naměřené při této vlnové délce se zpravidla používají k výpočtu hodnot ve stupnici podle Pfunda22). Přepočet do stupnice podle Pfunda je možný i z výsledků měření v trichromatickém systému CIELAB16). Méně často lze v publikacích zabývajících se barevností a antioxidační aktivitou medů k hodnocení barevnosti medů nalézt hodnoty absorbance při vlnových délkách v rozmezí 530–593 nm23–26). Výsledky měření absorbance vodných roztoků medů při jednotlivých vlnových délkách nepopisují jejich barevnost stejně výstižně jako parametry barevných prostorů, které jsou počítány z měření v celé viditelné oblasti spektra; zřejmě proto jsou v některých publikacích uvedeny jako intenzita zbarvení. V řadě případů však s výsledky měření barevnosti v barevných prostorech uspokojivě korelují, přičemž hodnoty korelačního koeficientu se mohou pohybovat až okolo 0,9. Příkladem v tomto směru mohou být korelace hodnot rozdílu A450nm – A720nm s hodnotami souřadnice a* barevného prostoru CIELAB s korelačním koeficientem 0,91527), 0,90528) nebo hodnot A560nm s korelačním koeficientem 0,8825).
Korelace výsledků měření barevnosti a antioxidační aktivity medů
U všech výše uvedených způsobů měření barevnosti medů byly popsány korelace jejich výsledků s výsledky stanovení antioxidační aktivity.
Některé z těsnějších korelací parametrů získaných instrumentálním měřením barevnosti medů v barevných prostorech (nejčastěji CIELAB) s výsledky stanovení jejich antioxidační aktivity jsou uvedeny v tabulce 1.
Table 1. Některé těsnější korelace mezi parametry získanými měřením barevnosti medů v barevných prostorech CIE a výsledky stanovení jejich antioxidační aktivity 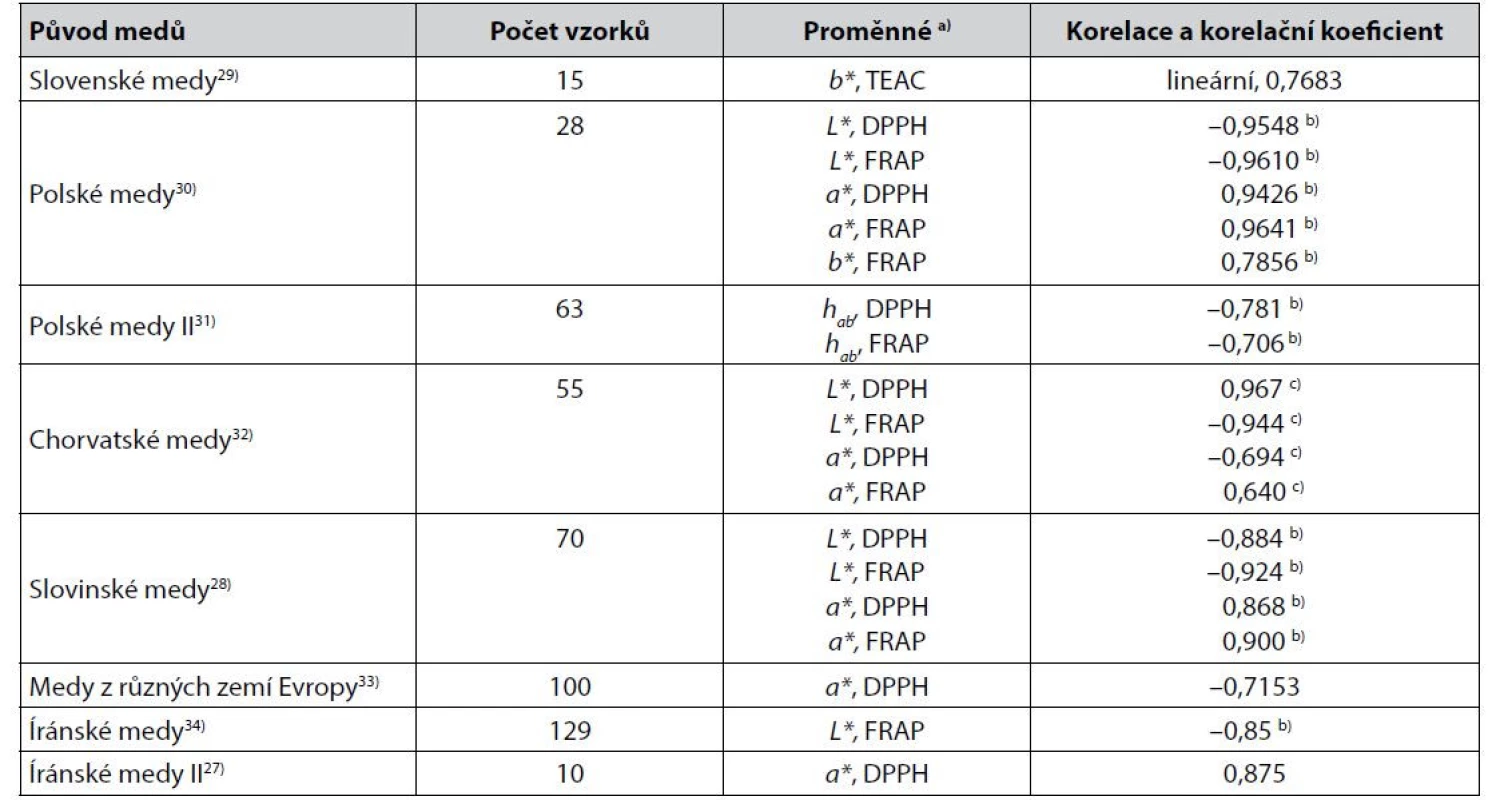
a) Metody stanovení antioxidační aktivity viz3, 5, 19, 35–38)
b) Pearsonův korelační koeficient
c) Spearmanův korelační koeficientZ dalších korelací téhož typu popsali autoři39) u jiných medů pozoruhodně těsné korelace mezi L*, a* a b* a aktivitou vůči radikálu NO. Pearsonův korelační koeficient byl 1,000, –1,000 a –1,000. U medů z Kašmíru byla popsána korelace s L* s DPPH hodnotou Pearsonova korelačního koeficientu –0,6940). V některých jiných případech však nepřesahují v korelaci parametrů barevného prostoru CIELAB hodnoty korelačního koeficientu zřetelněji hodnotu 0,6. Příkladem mohou být korelace hodnot souřadnice a* s FRAP nebo DPPH u italských medů, kdy byl Pearsonův korelační koeficient roven 0,45 a 0,3941), anebo korelace stejných proměnných u medů odlišného původu s Pearsonovým korelačním koeficientem –0,601 a –0,57042). Zvýšení těsnosti korelací antioxidační aktivity medů s parametry barevných prostorů by mohlo přinést použití vícenásobné korelace a regrese, které se osvědčilo např. autorům43) při sledování obsahu karotenoidů v pomerančové šťávě, anebo využití postupu popsaného v práci44). Jeho autor používá parametry barevných prostorů RGB a HSV.
V rámci měření barevnosti medů jako absorbance jejich vodného roztoku při jednotlivých vlnových délkách ve viditelné oblasti spektra dominuje rozdíl absorbance při 450 a 720 nm. Některé korelace výsledků těchto měření s výsledky stanovení antioxidační aktivity medů jsou uvedeny v tabulce 2.
Table 2. Některé těsnější korelace mezi hodnotami získanými měřením barevnosti medů jako rozdílu absorbance jejich vodného roztoku při 450 a 720 nm a výsledky stanovení jejich antioxidační aktivity 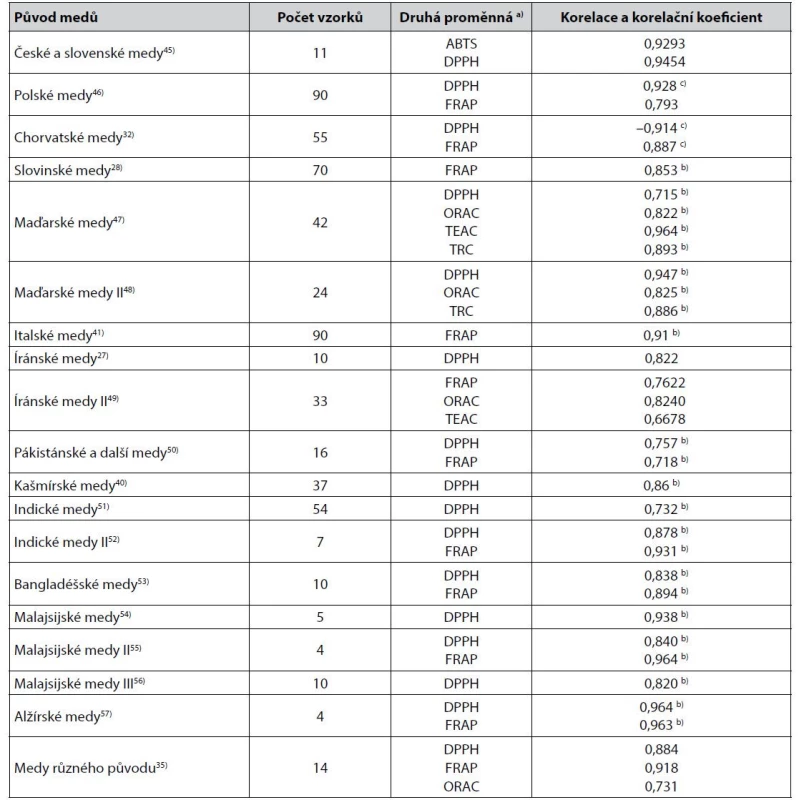
a) Metody stanovení antioxidační aktivity viz3, 5, 19, 35–38)
b) Pearsonův korelační koeficient
c) Spearmanův korelační koeficientZ dalších popsaných korelací hodnot rozdílu absorbance roztoků medů při 450 nm a 720 nm lze zmínit korelaci s DPPH (Pearsonův korelační koeficient 0,70) zjištěnou u jiných indických medů58), korelaci s DPPH (Pearsonův korelační koeficient 0,944) a FRAP (0,966) u jiných malajsijských medů42) a korelaci s DPPH (Pearsonův korelační koeficient 0,925) u australských medů59). Mimoto byly popsány korelace rozdílu absorbance při 560 nm a 720 nm (španělské medy, korelace s DPPH, Pearsonův korelační koeficient 0,771)24) anebo korelace hodnot absorbance měřené při 593 nm (nelineární korelace s FRAP, korelační koeficient 0,99)26).
Výsledky barevnosti medů měřením absorbance jejich vodných roztoků při 635 nm bývají zpravidla přepočítávány do stupnice barevnosti medů podle Pfunda22). Přestože k hodnocení barevnosti medů podle Pfunda (Pfund mm) byly publikovány dílčí výhrady20), byla popsána řada více, či méně těsných korelací hodnot Pfund (mm) s jejich antioxidační aktivitou. Příklady jsou uvedeny v tabulce 3.
Mimo korelace uvedené v tabulce 3 byly popsány i další, např. u alžírských jujubových medů Pfund (mm) (hodnoty získány výpočtem z absorbance při 635 nm) a s DPPH, Spearmanův korelační koeficient byl –0,67265), u ománských medů v analogické korelaci byl Pearsonův korelační koeficient –0,60866). U medů ze středního Srbska byl publikován Pearsonův korelační koeficient v korelaci s ABTS 0,997264 a s DPPH 0,99700967), autoři však zmiňují pouhé tři vzorky medů.
Table 3. Některé těsnější korelace mezi hodnotami Pfundovy stupnice barevnosti medů (mm) získanými výpočtem z měření absorbance vodných roztoků medů při 635 nm a výsledky stanovení jejich antioxidační aktivity 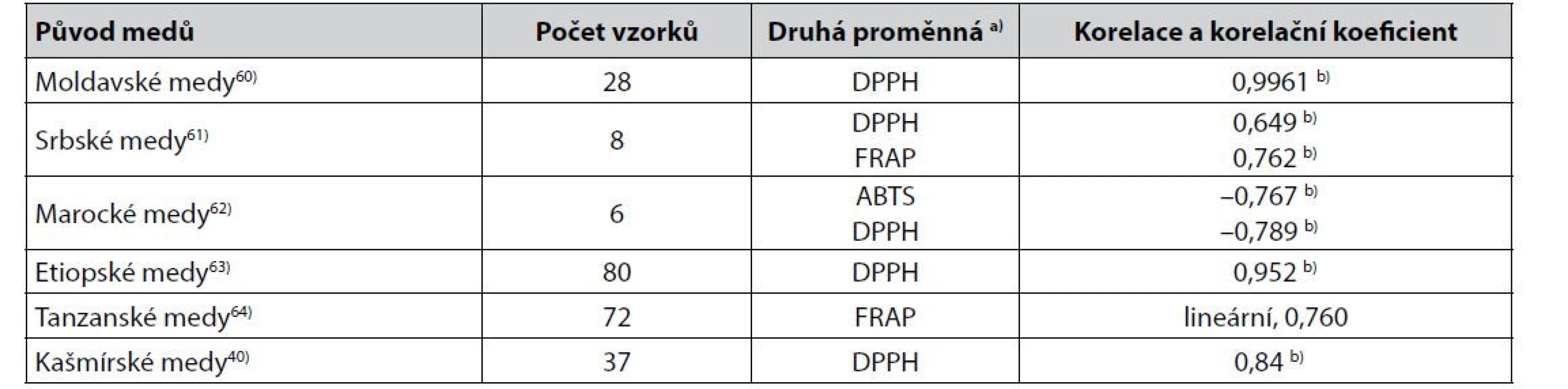
a) Metody stanovení antioxidační aktivity viz3, 5, 19, 35–38)
b) Pearsonův korelační koeficientZ údajů v tabulkách 1 až 3 je zřejmé, že nejčastěji byly popisovány korelace ukazatelů barevnosti medů s hodnotami antioxidační aktivity získanými metodami DPPH a FRAP. Při korelacích ukazatelů barevnosti s DPPH jako nejčastěji používanou metodou stanovení antioxidační aktivity medů19) používají někteří autoři místo hodnot DPPH parametr z nich odvozený a označovaný jako IC50 37, 38). Korelace se v těchto případech mění z nepřímé na přímou (korelace L* v 32)) nebo z přímé na nepřímou (korelace a* v 32, 33, 42), korelace rozdílu absorbance při 450 nm a 720 nm32), nebo hodnot ve stupnici Pfund62, 65, 66)).
Pokud jde o těsnost korelací různých ukazatelů barevnosti týchž medů s výsledky stanovení jejich antioxidační aktivity metodami DPPH a FRAP, mohou být hodnoty korelačních koeficientů při korelování nejvýhodnějších hodnot parametrů barevných prostorů CIE ve srovnání s korelačními koeficienty hodnot rozdílu absorbance při 450 a 720 nm vyšší27, 28, 32), v některých případech ale i nižší42); rozdíly hodnot korelačních koeficientů však jsou výrazné jen výjimečně42). Obdobné srovnání těsnosti korelací s výjimkou40) nelze z prací zabývajících se barevností a antioxidační aktivitou medů zahrnutých do našeho příspěvku odvodit v případě korelací hodnot Pfund (mm) získaných výpočtem z měření absorbance roztoků medů při 635 nm. Pomineme - li omezenou výpovědní schopnost korelačního koeficientu vyčísleného z měření několika málo vzorků (např.55, 57) a zejména67)), jde v tabulkách 1 až 3 i mimo ně často o korelace dostatečně těsné k úvahám o jejich možném analytickém využití při hodnocení antioxidační aktivity medů měřením jejich barevnosti. Je však nutné mít na zřeteli, že v publikovaných pracích jde většinou o korelační koeficient Pearsonův. Ten je sice vázán na stejné předpoklady jako korelační koeficient z klasické korelační analýzy (lineární závislost a dvourozměrné normální rozdělení), vzhledem k jeho citlivosti na extrémní hodnoty68, 69) lze ale očekávat, že korelační koeficienty z klasické regresní analýzy nebudou nabývat identických ani téměř identických hodnot. K bližšímu ověření včetně kalibrace se mimo korelací parametrů barevného prostoru CIELAB jeví jako vhodná zejména korelace rozdílu hodnot absorbance 50% vodného roztoku vzorků medu měřených při 450 a 720 nm.
Seznam zkratek a symbolů (viz také15))
CIE Mezinárodní komise pro osvětlování (Commission Internationale de l’Éclairage)
CIELAB barevné prostory bližší lidskému vidění
CIELCH barevné prostory bližší lidskému vidění
HSV barevné prostory bližší lidskému vidění
hab měrný úhel barevného tónu v barevném prostoru CIELCH
L*, a*, b* souřadnice barevného prostoru CIELAB
Střet zájmů: žádný.
doc. RNDr. Jozef Kolář, CSc.
Masarykova univerzita, Farmaceutická fakulta Ústav aplikované farmacie Palackého třída 1946/1, 612 00 Brno
e-mail: kolarj@pharm.muni.cz
J. Čižmárik
Univerzita Komenského, Bratislava Katedra farmaceutickej chémie FaF
Došlo 30. listopadu 2021 / Přijato 8. ledna 2022
Sources
1. Meo S. A., Al-Asiri S. A., Mahesar A. L., Ansari M. J. Role of honey in modern medicine. Saudi J. Biol. Sci. 2017; 24, 975–978. https://doi.org/10.1016/j.sjbs.2016.12.010 (20.9.2021).
2. Rana S., Mishra M., Yadav D., Subramani S. K., Katare C., Prasad, G. B. K. S. Medicinal uses of honey: A review on its benefits to human health. Prog. Nutr. 2018; 20(Suppl 1), 5–14. doi: 10.23751/pn.v20i1-S.6394 (20.9.2021).
3. Wieczorek J., Pietrzak M., Pomianowski J., Wieczorek Z. Honey as a source of bioactive compounds. Polish J. Nat. Sci. 2014; 29, 275–285. http://www.uwm.edu.pl/polish-journal/sites/default/files/issues/articles/wieczorek_et_ al._2014.pdf (7.11.2021).
4. Özcan M. M., Al Juhaimi F. Honey as source of natural antioxidants. J. Apic. Res. 2015; 54, 145–154. https://doi. org/10.1080/00218839.2016.1144976 (20.9.2021).
5. Martinello M., Mutinelli F. Antioxidant activity in bee products: A review. Antioxidants 2021; 10, 71. https:// doi.org/10.3390/antiox10010071 (20.9.2021).
6. Khalil M. I., Sulaiman S. A., Boukraa L. Antioxidant properties of honey and its role in preventing health disorder. Open Nutraceuticals J. 2010; 3, 6–16. https://doi. org/10.3390/antiox10010071 (20.9.2021).
7. Pharmacopoea Austriaca, Ed. Octava. Vienne: C.E.S. REG. AULE ET IMPERII TYPOGRAPFIA 1906; 244.
8. Deutsches Arzneibuch, 6. Ausgabe Berlin: Decker 1926; 422.
9. Československý lékopis, 1. vydání (ČsL 1). Praha: Státní tiskárna 1947; 276.
10. Československý lékopis, 2. vydání. Praha: Státní zdravotnické nakladatelství 1954; 455.
11. Honey. European Pharmacopoeia (Ph. Eur.) 10th Edition. [online] s. 2831. https://pheur.edqm.eu/home (20.9.2021).
12. USP43 2020 Vol. 3; s. 5816. https://www.ilovepharma. com/2021/05/united-state-pharmacopoeia - 2020-usp-43.html (20.9.2021).
13. The Japanese Pharmacopoeia, Seventeenth Edition (JP17) the Electronic version 2016; s.1899. http://jpdb. nihs.go.jp/jp17e/ (2.8.2019).
14. Frankel S., Robinson G. E., Berenbaum M. R. Antioxidant capacity and correlated characteristics of 14 unifloral honeys. J. Apic. Res. 1998; 37, 27–31. https://doi.org/1 0.1080/00218839.1998.11100951 (25.9.2021).
15. Ohta N., Robertson A. R. Colorimetry: Fundamentals and applications. Chichester: Wiley 2005.
16. Gallez L. M., Marconi A., Tourn E., Gonzáles-Miret M. L., Heredia F. J. Color of Honeys from the Southwestern Pampas Region: Relationship between the Pfund Color Scale and CIELAB Coordinates. In: Color in food. CRC Press 2012; 158–167. https://www.taylorfrancis.com/chapters/ edit/10.1201/b11878-17/color-honeys-southwestern - -pampas-region-relationship-pfund-color-scale-cielabcoordinates - liliana-gallez-alfredo-marconi-elian-tourn - lourdes-gonz%C3%A1lez-miret-francisco-heredia (26.9.2021).
17. Tuberoso C. I. G., Jerković I., Sarais G., Congiu F., Marijanović Z., Kuś P. M. Color evaluation of seventeen European unifloral honey types by means of spectrophotometrically determined CIE L* C*ab hab chromaticity coordinates. Food Chem. 2014; 145, 284–291. https:// doi.org/10.1016/j.foodchem.2013.08.032 28.9.2021 (20.9. 2021).
18. Szabó R. T., Mézes M., Szalai T., Zajácz E., Weber M. Colour identification of honey and methodical development of its instrumental measuring. Columella: J. Agr. Environ. Sci. 2016; 3, 29–36. http://real.mtak. hu/47064/1/Szabo_Columella_vol3no12016_29_36_u. pdf (26.9.2021).
19. Pascual-Maté A., Osés S. M., Fernández-Muiño M. A., Sancho M. T. Methods of analysis of honey. J. Apic. Res. 2018; 57, 38–74. https://doi.org/10.1080/00218839.2017. 1411178 (26.9.2021).
20. Bodor Z., Benedek C., Urbin Á., Szabó D., Sipos L. Colour of honey: can we trust the Pfund scale? – An alternative graphical tool covering the whole visible spectra. LWT 2021; 149, 111859. https://doi.org/10.1016/j. lwt.2021.111859 (21.9.2021).
21. Dominguez M. A., Centurión M. E. Application of digital images to determine color in honey samples from Argentina. Microchem. J. 2015; 118, 110–114. https://doi. org/10.1016/j.microc.2014.08.002 (26.9.2021).
22. Pfund scale. https://www.sizes.com/units/pfund_scale. htm (28.9.2021).
23. Martin M. J., Fredes C., Nuñez G., Ginocchio R., Montenegro G. Comparison of methods for determining the color of Chilean honeys and the relationship of color with botanical origin in central Chile. Cien. Inv. Agr. 2014; 41, 411–418. DOI: 10.4067/S0718-16202014000300014 (28.9.2021).
24. González Lorente M., de Lorenzo Carretero C., Peréz Martín R. A. Sensory attributes and antioxidant capacity of Spanish honeys. J. Sens. Stud. 2008; 23, 293–302. https://doi.org/10.1111/j.1745-459X.2008.00156.x (27.9.2021).
25. Al-Dabbas M. M., Otoom H. A., Al-Antary T. M. Impact of honey color from Jordanian flora on total phenolic and flavonoids contents and antioxidant activity. Fresenius Environ. Bull. 2019; 28, 6898–6907.
26. Taormina P. J., Niemira B. A., Beuchat L. R. Inhibitory activity of honey against foodborne pathogens as influenced by the presence of hydrogen peroxide and level of antioxidant power. Int. J. Food Microbiol. 2001; 69, 217–225. https://doi.org/10.1016/S0168-1605(01)00505 - 0 (28.9.2021).
27. Khalafi R., Goli S. A. H., Behjatian M. Characterization and classification of several monofloral Iranian honeys based on physicochemical properties and antioxidant activity. Int. J. Food Prop. 2016; 19, 1065–1079. https:// doi.org/10.1080/10942912.2015.1055360 (28.9.2021).
28. Bertoncelj J., Doberšek U., Jamnik M., Golob T. Evaluation of the phenolic content, antioxidant activity and colour of Slovenian honey. Food Chem. 2007; 105, 822–828. https:// doi.org/10.1016/j.foodchem.2007.01.060 (6.10.2021).
29. Zalibera M., Staško A., Šlebodová A., Jančovičová V., Čermáková T., Brezová V. Antioxidant and radical-scavenging activities of Slovak honeys – An electron paramagnetic resonance study. Food Chem. 2008; 110, 512 – 521. https://doi.org/10.1016/j.foodchem.2008.02.015 (2.10. 2021).
30. Kuś P. M., Congiu F., Teper D., Sroka Z., Jerković I., Tuberoso C. I. G. Antioxidant activity, color characteristics, total phenol content and general HPLC fingerprints of six Polish unifloral honey types. LWT 2014; 55, 124–130. https:// doi.org/10.1016/j.lwt.2013.09.016 (3.10.2021).
31. Kędzierska-Matysek M., Teter A., Stryjecka M., Skałecki P., Domaradzki P., Rudaś M., Florek M. Relationships linking the colour and elemental concentrations of blossom honeys with their antioxidant activity: A chemometric approach. Agriculture 2021; 11, 702. https:// doi.org/10.3390/agriculture11080702 (4.10.2021).
32. Flanjak I., Kenjerić D., Bubalo D., Primorac L. Characterisation of selected Croatian honey types based on the combination of antioxidant capacity, quality parameters, and chemometrics. Eur. Food Res. Technol. 2016; 242, 467–475. https://doi.org/10.1007/s00217-015-2557-0 (3.10.2021).
33. Marić A., Jovanov P., Sakač M., Novaković A., Hadnađev M., Pezo L., Mandić A., Milićević N., Durović A., Gadžurić S. A comprehensive study of parameters correlated with honey health benefits. RSC Adv. 2021; 11, 12434–12441. https://doi.org/10.1039/D0RA10887A (4.10.2021).
34. Shafiee S., Minaei S., Moghaddam-Charkari N., Barzegar M. Honey characterization using computer vision system and artificial neural networks. Food Chem. 2014; 159, 143–150. https://doi.org/10.1016/j.foodchem. 2014.02.136 (3.10.2021).
35. Beretta G., Granata P., Ferrero M., Orioli M., Facino R. M. Standardization of antioxidant properties of honey by a combination of spectrophotometric/fluorimetric assays and chemometrics. Anal. Chim. Acta 2005; 533, 185–191. https://doi.org/10.1016/j.aca.2004.11.010 (5.10.2021).
36. Alvarez-Suarez J. M., Tulipani S., Romandini S., Vidal A., Battino M. Methodological aspects about determination of phenolic compounds and in vitro evaluation of antioxidant capacity in the honey: A review. Curr. Anal. Chem. 2009; 5, 293–302. https://doi. org/10.2174/157341109789077768 (5.10.2021)
37. Moniruzzaman M., Khalil M. I., Sulaiman S. A., Gan, S. H. Advances in the analytical methods for determining the antioxidant properties of honey: A review. Afr. J. Tradit. Complement. Altern. Med. 2012; 9, 36–42. http:// dx.doi.org/10.4314/ajtcam.v9i1.5 (5.10.2021).
38. Lewoyehu M., Amare M. Comparative evaluation of analytical methods for determining the antioxidant activities of honey: A review. Cogent Food Agric. 2019; 5, 1685059. https://doi.org/10.1080/23311932.2019.16850 59 (5.10.2021).
39. Aumeeruddy M. Z., Aumeeruddy-Elalfi Z., Neetoo H., Zengin G., van Staden A. B., Fibrich B., Lambrechts I. A., Rademan S., Szuman K. M., Lall N., Mahomoodally F. Pharmacological activities, chemical profile, and physicochemical properties of raw and commercial honey. Biocatal. Agric. Biotechnol. 2019; 18, 101005. https://doi. org/10.1016/j.bcab.2019.01.043 (5.10.2021).
40. Nayik G. A., Nanda V. A chemometric approach to evaluate the phenolic compounds, antioxidant activity and mineral content of different unifloral honey types from Kashmir, India. LWT 2016; 74, 504–513. https://doi.org/ 10.1016/j.lwt.2016.08.016 (5.10.2021).
41. Perna A., Simonetti A., Intaglietta I., Gambacorta E. Antioxidant properties, polyphenol content and colorimetric characteristics of different floral origin honeys from different areas of Southern Italy. J. Life Sci. 2013; 7, 428–436.
42. Kek S. P., Chin N. L., Yusof Y. A., Tan S. W., Chua L. S. Classification of entomological origin of honey based on its physicochemical and antioxidant properties. Int. J. Food Prop. 2017; 20, S2723–S2738. https://doi.org/10.10 80/10942912.2017.1359185 (5.10.2021).
43. Meléndez-Martínez A. J., Vicario I. M., Heredia F. J. Application of tristimulus colorimetry to estimate the carotenoids content in ultrafrozen orange juices. J. Agric. Food Chem. 2003; 51, 7266–7270. https://doi. org/10.1021/jf034873z (5.10.2021).
44. Zhang H. Multiple regression model for identification of material concentration and color reading. IOP Conf. Ser.: Mater. Sci. Eng. 2019; 612, 022086. IOP Publishing. doi:10.1088/1757-899X/612/2/022086 (6.10.2021).
45. Škrovánková S., Snopek L., Mlček J., Volaříková E. Bioactive compounds evaluation in different types of Czech and Slovak honeys. Potr. S. J. F. Sci. 2019; 13, 94–99. https://doi.org/10.5219/1025 (9.10.2021).
46. Dżugan M., Tomczyk M., Sowa P., Grabek-Lejko D. Antioxidant activity as biomarker of honey variety. Molecules 2018; 23, 2069. https://doi.org/10.3390/molecules23082069 (9.10.2021).
47. Bodó A., Radványi L., Kőszegi T., Csepregi R., Nagy D. U., Farkas Á., Kocsis M. Melissopalynology, antioxidant activity and multielement analysis of two types of early spring honeys from Hungary. Food Biosci. 2020; 35, 100587. https:// doi.org/10.1016/j.fbio.2020.100587 (10.10.2021).
48. Bodó A., Radványi L., Kőszegi T., Csepregi, R., Nagy D. U., Farkas Á., Kocsis M. Quality evaluation of light-and dark-colored Hungarian honeys, focusing on botanical origin, antioxidant capacity and mineral content. Molecules 2021; 26, 2825. https://doi.org/10.3390/molecules26092825 (10.10.2021).
49. Mahmoodi-Khaledi E., Lozano-Sánchez J., Bakhouche A., Habibi-Rezaei M., Sadeghian I., Segura-Carretero A. Physicochemical properties and biological activities of honeys from different geographical and botanical origins in Iran. Eur. Food Res. Technol. 2017; 243, 1019–1030. https://doi.org/10.1007/s00217-016-2811-0 (11.10.2021).
50. Ahmed M., Shafiq M. I., Khaleeq A., Huma R., Qadir M. A., Khalid A., Ali A., Samad A. Physiochemical, biochemical, minerals content analysis, and antioxidant potential of national and international honeys in Pakistan. J. Chem. 2016. https://doi.org/10.1155/2016/8072305 (11.10.2021).
51. Das A., Mukherjee A., Dhar P. Characterization of antioxidants and antioxidative properties of various unifloral honeys procured from West Bengal, India. IOSR-JESTFT 2013; 7(3), 56–63. www.iosjournals.org (12.10.2021).
52. Das A., Datta S., Mukherjee S., Bose S., Ghosh, S., Dhar P. Evaluation of antioxidative, antibacterial and probiotic growth stimulatory activities of Sesamum indicum honey containing phenolic compounds and lignans. LWT 2015; 61, 244–250. https://doi.org/10.1016/j.lwt.2014.11.044 (12.10.2021).
53. Moniruzzaman M., Yung An C., Rao P. V., Hawlader M. N. I., Azlan S. A. B. M., Sulaiman S. A., Gan S. H. Identification of phenolic acids and flavonoids in monofloral honey from Bangladesh by high performance liquid chromatography: determination of antioxidant capacity. Biomed Res. Int. 2014; 737490. https://doi. org/10.1155/2014/737490 (12.10.2021).
54. Moniruzzaman M., Sulaiman S. A., Khalil M. I., Gan S. H. Evaluation of physicochemical and antioxidant properties of sourwood and other Malaysian honeys: a comparison with manuka honey. Chem. Cent. J. 2013; 7, 1–12. https://doi.org/10.1186/1752-153X-7-138 (12.10.2021).
55. Moniruzzaman M., Khalil M. I., Sulaiman S. A., Gan S. H. Physicochemical and antioxidant properties of Malaysian honeys produced by Apis cerana, Apis dorsata and Apis mellifera. BMC Complement. Altern. Med. 2013; 13, 1–12. https://doi.org/10.1186/1472-6882-13-43 (12.10.2021).
56. Moniruzzaman M., Sulaiman S. A., Azlan S. A. M., Gan S. H. Two-year variations of phenolics, flavonoids and antioxidant contents in acacia honey. Molecules 2013; 18, 14694–14710. https://doi.org/10.3390/molecules181214694 (12.10.2021).
57. Khalil M., Moniruzzaman M., Boukraâ L., Benhanifia M., Islam M. A., Islam M. N., Sulaiman S. A., Gan S. H. Physicochemical and antioxidant properties of Algerian honey. Molecules 2012; 17, 11199–11215. https://doi. org/10.3390/molecules170911199 (15.10.2021).
58. Vaghela J., Reddy A. S. Antioxidant potential of Apis florea honey from dryland ecosystem in Western India. Int. J. Adv. Res. 2016; 4, 1392–1402. https://www.academia. edu/23116680/ANTIOXIDANT_POTENTIAL_OF_APIS_FLOREA_HONEY_FROM_DRYLAND_ECOSYSTEM_IN_ WESTERN_INDIA (14.11.2021).
59. Anand S., Pang E., Livanos G., Mantri N. Characterization of physico-chemical properties and antioxidant capacities of bioactive honey produced from Australian grown Agastache rugosa and its correlation with colour and poly-phenol content. Molecules 2018; 23, 108. https:// doi.org/10.3390/molecules23010108 (14.10.2021).
60. Chirsanova A., Capcanari T., Boistean A., Siminiuc R. Physico-chemical profile of four types of honey from the south of the Republic of Moldova. Food Nutr. Sci. 2021; 12, 874–888. https://doi.org/10.4236/fns.2021.129065 (17.10.2021).
61. Živković J., Sunarić S., Stanković N., Mihajilov-Krstev T., Spasić A. Total phenolic and flavonoid contents, antioxidant and antibacterial activities of selected honeys against human pathogenic bacteria. Acta Pol. Pharm. 2019; 76, 671–681. http://dx.doi.org/10.32383/ appdr/105461 (17.10.2021).
62. Aazza S., Elamine Y., El‐Guendouz S., Lyoussi B., Antunes M. D., Estevinho L. M., Anjos O., Carlier J. D., Costa M. C., Miguel M. G. Physicochemical characterization and antioxidant activity of honey with Eragrostis spp. pollen predominance. J. Food Biochem. 2018; 42, e12431. https://doi.org/10.1111/jfbc.12431 (18.10.2021).
63. Hailu D., Belay A. Melissopalynology and antioxidant properties used to differentiate Schefflera abyssinica and polyfloral honey. PloS One 2020; 15, e0240868. https:// doi.org/10.1371/journal.pone.0240868 (18.10.2021).
64. Shekilango S. G., Mongi R. J., Shayo N. B. Colour and antioxidant activities of honey from different floral sources and geographical origins in Tanzania. Tanzan. J. Agric. Sci. 2016; 15, 101–113. 177785-Article Text - 454223-1-10-20180926 (14.11.2021). cle Text-4223 - 1-10-20180926.pdf 177785-Article Text-454223-1-10 - 20180926.pdf
65. Zerrouk S., Seijo M. C., Escuredo O., Rodríguez-Flores M. S. Characterization of Ziziphus lotus (jujube) honey produced in Algeria. J. Apic. Res. 2018; 57, 166 – 174. https://doi.org/10.1080/00218839.2017.1399663 (18.10.2021).
66. Al-Farsi M., Al-Amri A., Al-Hadhrami A., Al-Belushi S. Color, flavonoids, phenolics and antioxidants of Omani honey. Heliyon 2018; 4, e00874. https://doi.org/ 10.1016/j.heliyon.2018.e00874 (18.10.2021).
67. Srećković N. Z., Mihailović V. B., Katanić-Stanković J. S. Physico-chemical, antioxidant and antimicrobial properties of three different types of honey from Central Serbia. Kragujev. J. Sci. 2019; 41, 53–68. https://scidar. kg.ac.rs/handle/123456789/13294 (18.10.2021).
68. Korelace. https://ksoc.ff.cuni.cz/wp-content/uploads/sites/ 76/2018/09/4.-Statistika2-Korelace.pdf (17.11.2021). 69. Kružlicová D. Chemometria. Trnava: Univerzita sv. Cyrila a Metoda 2015; 119.
Labels
Pharmacy Clinical pharmacology
Article was published inCzech and Slovak Pharmacy

2022 Issue 1-
All articles in this issue
- Ethical and legal requirements for vaccination against COVID-19
- The role of individuals receiving health care – terminological notes
- Colour and antioxidant activity of honey
- Surviving of production probiotic strains in a selected application form
- Cerebroprotective properties of recombinant interleukin-1 receptor – an experimental study
- Czech and Slovak Pharmacy
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Ethical and legal requirements for vaccination against COVID-19
- The role of individuals receiving health care – terminological notes
- Surviving of production probiotic strains in a selected application form
- Colour and antioxidant activity of honey
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

