-
Medical journals
- Career
Antiadhezívna, antibiofilmová a disperzná aktivita biosurfaktantov izolovaných z Bacillus amyloliquefaciens 3/22
Authors: Karolína Englerová; Radomíra Nemcová; Zdenka Bedlovičová; Eva Styková
Published in: Čes. slov. Farm., 2021; 70, 172-178
Category: Original Article
doi: https://doi.org/https://doi.org/10.5817/CSF2021-5-172Overview
Cieľom práce bolo sledovanie potenciálnych antibiofilmových vlastností biosurfaktantov (BS) izolovaných z kmeňa Bacillus amyloliquefaciens 3/22 voči tvorbe biofilmu indikátorového kmeňa Staphylococcus aureus CCM 4223. V práci bol sledovaný účinok BS 3/22 na rast biofilmu počas spoločnej inkubácie, inhibícia adhézie biofilm tvoriacich buniek a disperzia biofilmu. BS 3/22 inhibovali tvorbu biofilmu, pričom sa jeho tvorba s rastúcou koncentráciou BS signifikantne (p < 0,05; p < 0,01; p < 0,001) znižovala. BS 3/22 preukázali aj antiadhezívnu aktivitu, ktorá korelovala s použitou koncentráciou. Detegovaný bol taktiež disperzný efekt izolovaných BS 3/22 na 24-hodinový biofilm S. aureus CCM 4223. BS 3/22 boli pri disperzii biofilmu účinné aj pri nižších koncentráciách v porovnaní s antiadhezívnou aktivitou a inhibíciou tvorby biofilmu.
Klíčová slova:
biofilm – biosurfaktanty – inhibícia – disperzia
Úvod
Biosurfaktanty (BS) sú povrchovo aktívne amfifilné molekuly získavané z rôznych mikroorganizmov1). V oblasti medicíny majú potenciál využitia v boji proti agresívnym patogénom vďaka ich cytotoxickým, antimikrobiálnym, antiadhezívnym, či antibiofilmovým vlastnostiam2). Baktérie patriace do rodu Bacillus sú osvedčenými producentmi lipopeptidov, veľkej skupiny BS, ktorých molekula pozostáva z aminokyselinového reťazca a rôznej dĺžky mastných kyselín3). Lipopeptidy produkované kmeňmi Bacillus možno kategorizovať do rodín surfaktínu, iturínu a fengycínu s dobre definovanou všeobecnou štruktúrou4).
Biofilm je spoločenstvo mikroorganizmov adherujúce na rôzne povrchy uložené v matrici zloženej z extracelulárnych polymérnych látok. Prítomnosť biofilmov môže spôsobiť vážne problémy v oblasti zdravia ľudí. Biofilmy môžu viesť k rozvinutiu infekcií u pacientov s medicínskymi pomôckami, ako sú močové, endotracheálne, intravenózne a iné typy katétrov a implantátov zavedených u viac ako 25 % hospitalizovaných pacientov5). V súčasnej dobe pretrváva problém s rezistenciou biofilmov na bežné antibiotiká a dezinfekčné prostriedky z dôvodu ich špecifických rastových podmienok a transformácie rezistentných génov6). Významným patogénom tvoriacim biofilmy je aj Staphylococcus aureus. MSSA (meticilín-senzitívny S. aureus) aj MRSA (meticilín-rezistentný S. aureus) sú mimoriadne úspešné a adaptabilné patogény spôsobujúce závažné nozokomiálne infekcie7). Preto sa biosurfaktanty dostávajú do popredia ako zaujímavé natívne antibiofilmové zlúčeniny vďaka svojej povrchovej aktivite a antimikrobiálnym vlastnostiam8, 9).
Práca poukazuje na potenciálnu inhibičnú aktivitu lipopeptidových biosurfaktantov produkovaných kmeňom Bacillus amyloliquefaciens 3/22 voči adhézii a tvorbe biofilmu u Staphylococcus aureus CCM 4223.
Experimentálna časť
Materiál a metodika
Mikroorganizmy
Na produkciu biosurfaktantov bol použitý kmeň Bacillus amyloliquefaciens 3/22 izolovaný zo vzorky morských rias z Jadranského mora, identifikovaný pomocou sekvenčnej metódy 16S rRNA10). Získané BS boli identifikované genotypicky ako lipopeptidy surfaktín, iturín a fengycín11). Ako indikátorový kmeň tvoriaci biofilm bol použitý Staphylococcus aureus CCM 4223 (Česká sbírka mikroorganismů, Brno, Česká republika).
Izolácia biosurfaktantov z B. amyloliquefaciens 3/22
Povrchovo aktívne BS boli izolované použitím modifikovanej metódy podľa Płaza et al.12). 300 ml McKeen média bolo naočkovaných 3 % (v/v) štartovacej kultúry B. amyloliquefaciens 3/22 kultivovanej v BHI bujóne počas 18 hodín pri teplote 27 °C. Inokulované médium bolo potom inkubované 72 hodín pri 27 °C a 140 ot./min. (Shaker SKO-D XL, ARGOlab, Carpi, Taliansko). Po kultivácii sa bakteriálna kultúra centrifugovala (4754 g/65 min/4 °C) a supernatant sa okyslil pomocou 6 M HCl na pH 2. Precipitát vytvorený pri 4 °C počas noci sa znovu centrifugoval (4754 g/55 min/4 °C) a sediment bol rozpustený v 100 ml destilovanej vody. pH všetkých vzoriek bolo upravené pomocou 1 M NaOH na hodnotu 7. BS boli extrahované vytrepaním do organickej fázy v sústave pozostávajúcej z etylacetátu a metanolu v pomere 4 : 1 (v/v). Organické vrstvy boli spojené a vysušené síranom sodným. Po filtrácii bolo organické rozpúšťadlo odparené (IKA RV 10 Digital, IKA, Nemecko). Žltý olejovitý produkt sa na záver lyofilizoval a uskladnil pri –20 °C.
Antibiofilmová aktivita biosurfaktantov izolovaných z kmeňaB. amyloliquefaciens 3/22 počas ko-kultivácie
Jamky polystyrénovej mikrotitračnej platničky (Greiner ELISA 8 Well Strips, 350 μl, Flat Bottom, Medium Binding; Cruinn Diagnostics Ltd., Dublin, Írsko) boli naplnené 100 μl BHI média (mBHI; Brain Heart infusion broth; HIMEDIA) obohateného o 1 % glukózu a 2 % NaCl a obsahujúceho BS 3/22 s koncentráciami 30 – 0,058 mg/ml (dvojkové riedenie). Médium bolo naočkované indikátorovým kmeňom S. aureus CCM 4223 (McFarland 1; 15 μl na jednu jamku). Negatívnou kontrolou bolo mBHI s fyziologickým roztokom, resp. mBHI s príslušnými koncentráciami BS 3/22. Ako pozitívna kontrola slúžilo mBHI s indikátorovým kmeňom bez BS 3/22. Platničky boli inkubované pri 37 °C 24 hodín.
Tvorba biofilmu bola stanovená pomocou modifikovaného testu s kryštálovou violeťou13). Supernatant bol z jamiek odstránený, jamky boli trikrát premyté deionizovanou vodou a sušené 40 minút pri izbovej teplote. Po vysušení sa jamky zafarbili 200 μl 0,1 % roztoku kryštálovej violeti a nechali sa inkubovať 30 minút pri izbovej teplote. Potom sa prebytočné farbivo odstránilo a jamky sa trikrát premyli deionizovanou vodou a nechali sa znova sušiť 30 minút pri izbovej teplote.
Kryštálová violeť naviazaná na adherujúce bunky (biofilm) bola extrahovaná 200 μl 30 % kyseliny octovej. Z každej jamky bolo prenesených 150 μl do novej platničky. Optická denzita bola meraná pomocou Synergy 4 Multi-Mode Microplate Reader (BioTek Instruments Inc., USA) pri vlnovej dĺžke 550 nm. Pokus bol uskutočnený trikrát a výsledky sú prezentované ako priemer ± smerodajná odchýlka. Percento inhibície bolo vypočítané ako % inhibície = [1–(ABS/A0)] x 100, kde ABS predstavuje absorbanciu jamky s BS a A0 absorbanciu kontrolnej jamky.
Antiadhezívna aktivita biosurfaktantov izolovaných z kmeňa B. amyloliquefaciens 3/22
Na testovanie antiadhezívnej aktivity BS 3/22 bola použitá metodika podľa Madhu a Prapulla14) s nasledovnými modifikáciami: jamky polystyrénovej mikrotitračnej platničky (Greiner ELISA 8 Well Strips, 350 μl, flat bottom, medium binding) boli naplnené 100 μl BS v PBS s koncentráciami 30 – 1,8 mg/ml (dvojkové riedenie) a inkubované 18 hodín pri 4 °C za účelom opracovania jamiek biosurfaktantom. Po inkubácii boli jamky premyté PBS a vysušené. Následne boli naplnené 100 μl mBHI naočkovaného indikátorovým kmeňom S. aureus CCM 4223 (1 % inokulum). Ako pozitívna kontrola bol použitý S. aureus CCM 4223 v jamkách neopracovaných BS a ako negatívna kontrola čisté mBHI médium bez pridania indikátorového kmeňa v jamkách opracovaných BS. Platničky boli inkubované 4 hodiny pri 37 °C. Po inkubácii sa kvantifikácia adhézie uskutočnila pomocou modifikovanej metodiky s využitím kryštálovej violete, ako je opísané vyššie. Pokus sa uskutočnil v troch nezávislých pokusoch a výsledky sú uvedené ako priemer ± smerodajná odchýlka. Percento antiadhezívnej aktivity bolo vypočítané obdobne ako percento inhibície tvorby biofilmu.
Disperzná aktivita biosurfaktantov izolovaných z kmeňa B. amyloliquefaciens 3/22
Disperzná aktivita BS 3/22 bola testovaná metódu podľa e Silva et al.15) s nasledovnou modifikáciou: jamky polystyrénovej mikrotitračnej platničky (Greiner ELISA 8 Well Strips, 350 μl, flat bottom, medium binding) boli naplnené 100 μl mBHI naočkovaného indikátorovým kmeňom S. aureus CCM 4223 (1 % inokulum). Platnička bola inkubovaná pri 37 °C 24 hodín za účelom vytvorenia biofimu S. aureus CCM 4223. Po inkubácii sa jamky premyli roztokom PBS. Po vysušení boli jamky polystyrénovej mikrotitračnej naplnené 100 μl BS v PBS s koncentráciami 30 – 0,06 mg/ml (dvojkové riedenie) a inkubované pri 37 °C 24 hodín za účelom disperzie biofimu S. aureus CCM 4223. Pozitívnou kontrolou boli jamky s vytvoreným biofilmom opracované len PBS a negatívnou kontrolou boli jamky opracované roztokom BS bez predvytvoreného biofilmu. Po inkubácii sa kvantifikácia adhézie znova uskutočnila pomocou modifikovanej metodiky s využitím kryštálovej violete. Pokus sa uskutočnil v troch nezávislých pokusoch a výsledky sú uvedené ako priemer ± smerodajná odchýlka. Percento disperzie bolo vypočítané obdobne ako percento inhibície tvorby biofilmu.
Štatistické vyhodnotenie
Pre vyhodnotenie výsledkov bola použitá jednorozmerná analýza rozptylu (ANOVA) s doplnkovým Dunnettovým testom v štatistickom programe GraphPad Prism 6.01 software (GraphPad Inc., San Diego, CA, USA).
Výsledky
Antibiofilmová aktivita biosurfaktantov izolovaných z kmeňa B. amyloliquefaciens 3/22 počas ko-kultivácie
BS mali inhibičný efekt na tvorbu biofilmu u testovaného indikátorového kmeňa S. aureus CCM 4223 (obr. 1). Jeho tvorba sa signifikantne znižovala (p < 0,05; p < 0,01; p < 0,001) v závislosti od zvyšujúcej sa koncentrácie 0,47 – 30 mg/ml BS 3/22. Koncentrácie nižšie ako 0,47 mg/ml nemali inhibičný efekt na tvorbu biofilmu. Najvyššie percento inhibície tvorby biofilmu (viac ako 89 %) bolo dosiahnuté pri koncentrácii 30 mg/ml BS 3/22 (tab. 1). Koncentrácie BS 3/22 od 15 do 3,75 mg/ml inhibovali tvorbu biofilmu viac ako 50 %. Percento inhibície tvorby biofilmu menej ako 50 % bolo pozorované pri koncentráciách BS 3/22 od 1,87 do 0,47 mg/ml.
Image 1. Tvorba biofilmu S. aureus CCM 4223 v prítomnosti rôznych koncentrácií BS 3/22 Kontrola: SA 4223 – S. aureus CCM 4223 v mBHI bez BS 3/22; údaje sú vyjadrené ako aritmetický priemer ± SD; ***p < 0,001; **p < 0,01; *p < 0,05 v porovnaní s kontrolou. 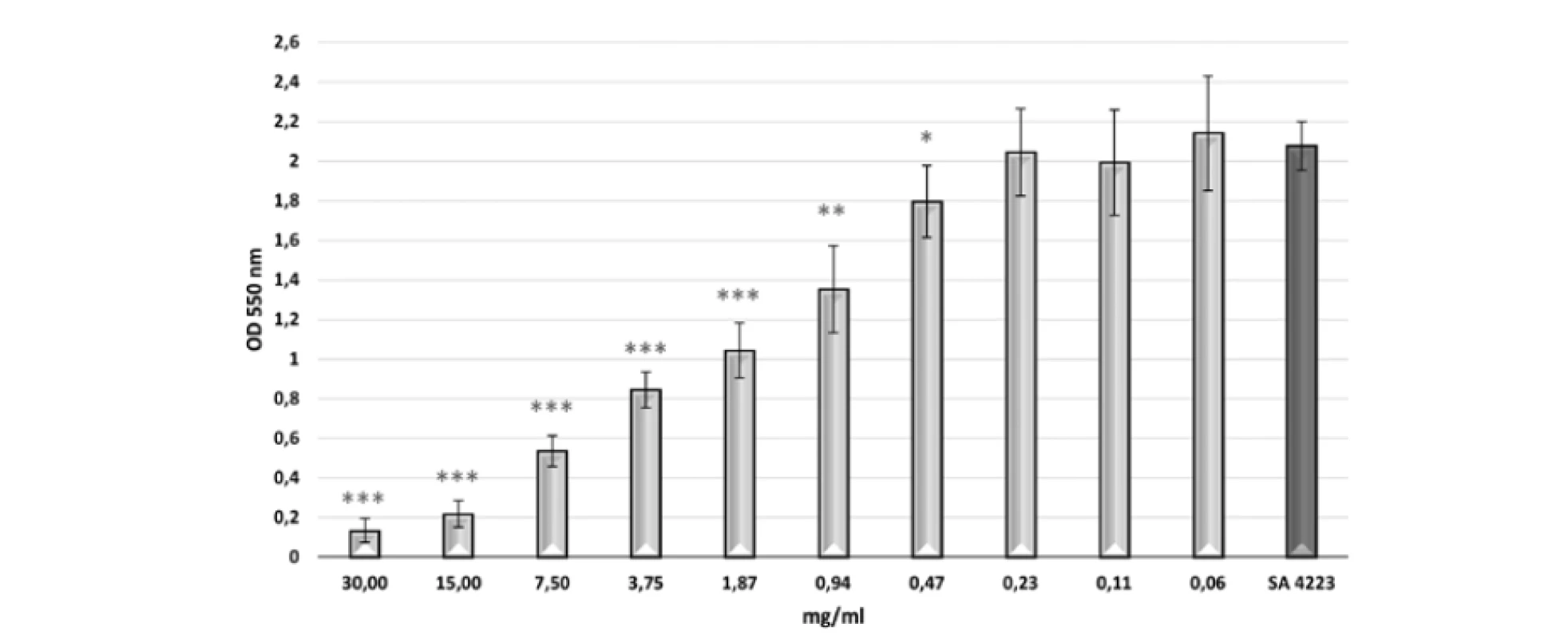
Table 1. Percento inhibície tvorby biofilmu S. aureus CCM 4223 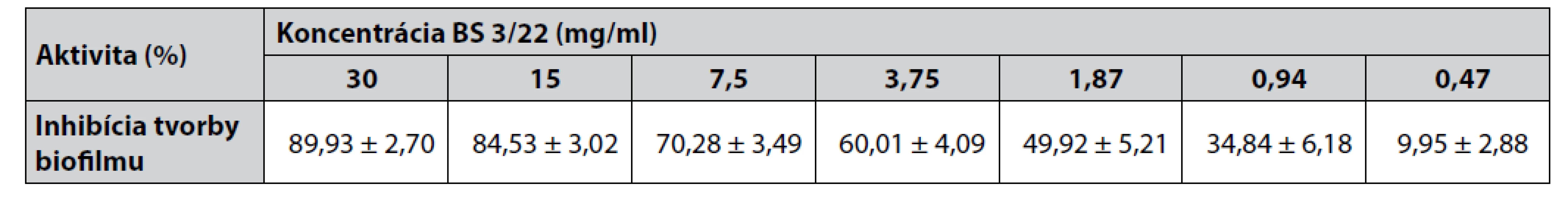
Antiadhezívna aktivita biosurfaktantov izolovaných z kmeňa B. amyloliquefaciens 3/22
Antiadhezívny efekt BS 3/22 koreloval s jeho koncentráciou (obr. 2). Po opracovaní jamiek s koncentráciami BS 3/22 30 – 15 – 7,5 mg/ml bolo zistené signifikantné zníženie (p < 0,001; p < 0,01; p < 0,05) schopnosti indikátorového kmeňa S. aureus CCM 4223 adherovať na steny jamiek v porovnaní s kontrolou (S. aureus CCM 4223 bez opracovania jamiek BS 3/22). Ostatné testované koncentrácie (3,75 a 1,87 mg/ml) neovplyvňovali adhéziu indikátorového kmeňa. Viac ako 50% inhibícia adhézie bola pozorovaná pri najvyššej testovanej koncentrácii BS 3/22 (tab. 2). Koncentrácie BS 3/22 nižšie ako 30 mg/ml inhibovali adhéziu S. aureus CCM 4223 menej ako 50 %.
Image 2. Adhézia S. aureus CCM 4223 pri rôznych koncentráciách BS 3/22
Kontrola: SA 4223 – S. aureus CCM 4223 v jamkách opracovaných PBS;
údaje sú vyjadrené ako aritmetický priemer ± SD; ***p < 0,001; **p < 0,01;
*p < 0,05 v porovnaní s kontrolou.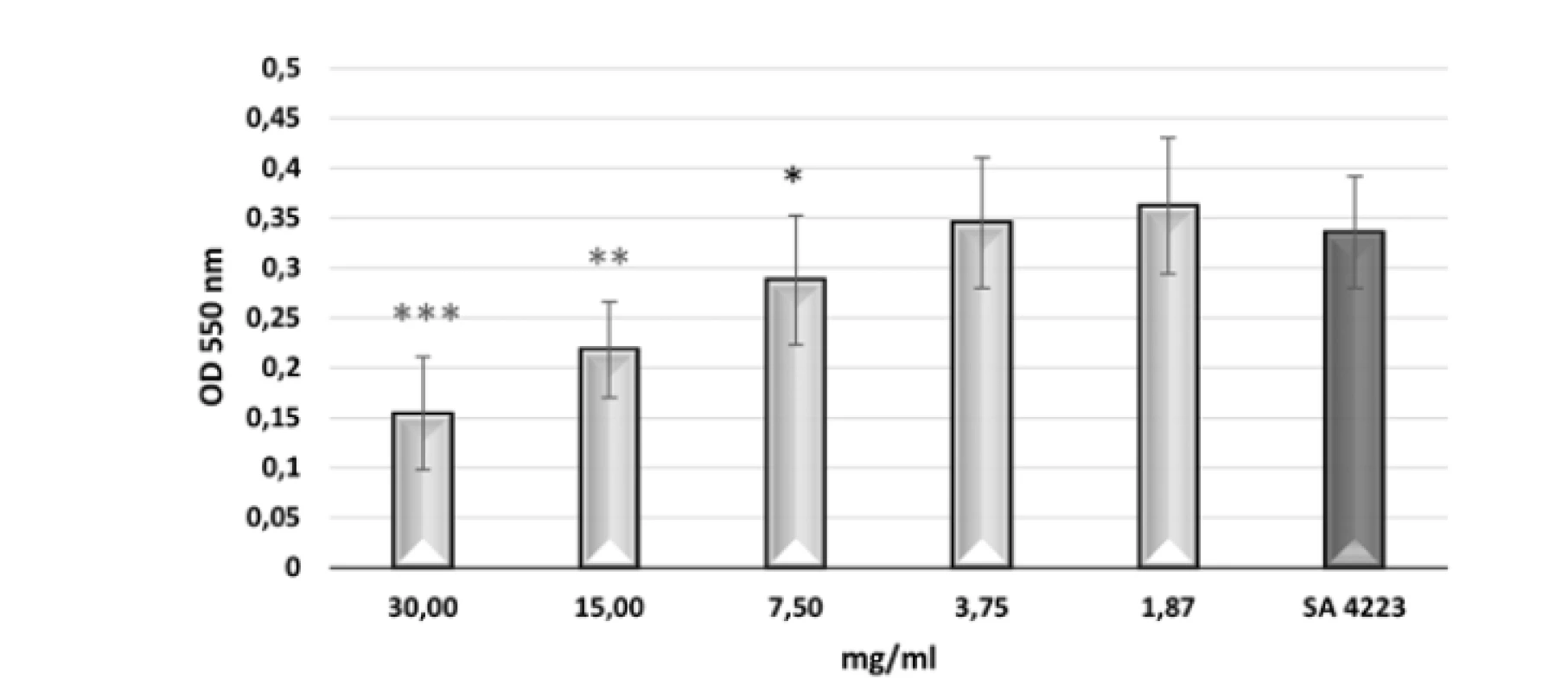
Table 2. Percento adhézie S. aureus CCM 4223 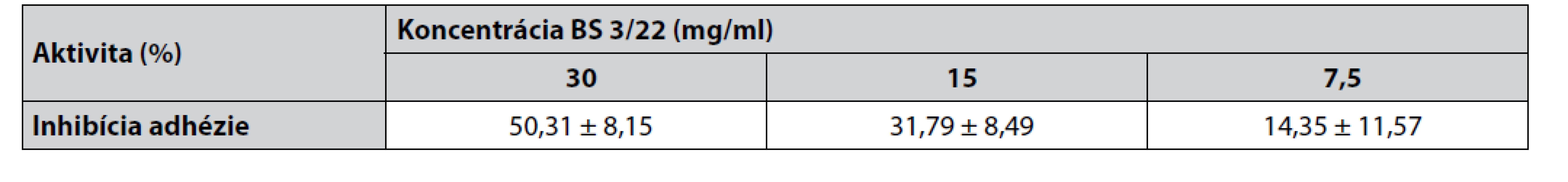
Disperzná aktivita biosurfaktantov izolovaných z kmeňa B. amyloliquefaciens 3/22
Ďalej bola testovaná schopnosť BS 3/22 redukovať (odlupovať) 24-hodinový predvytvorený biofilm S. aureus CCM 4223. Disperzný efekt BS 3/22 znova koreloval s jeho koncentráciou (obr. 3). Bola detegovaná signifikantná redukcia (p < 0,001; p < 0,05) predvytvotreného 24-hodinového biofilmu indikátorového kmeňa v porovnaní s kontrolou (predvytvorený 24-hodinový biofilm S. aureus CCM 4223 bez opracovania BS 3/22) pri koncentráciách od 30 – 0,11 mg/ml. BS 3/22 bol pri disperzii biofilmu S. aureus CCM 4223 účinný aj pri nižších koncentráciách v porovnaní s antiadhezívnou aktivitou, resp. inhibíciou tvorby biofilmu. Vysoké percento disperzie biofilmu (78 a viac %) bolo pozorované pri koncentráciách BS 3/22 od 30 do 3,75 mg/ml (tab. 3). Nižšie koncentrácie BS 3/22 stále účinne rozrušovali biofilm – percento disperzie sa postupne znižovalo v závislosti od koncentrácie BS 3/22 od 63 do 11,5 %.
Image 3. Efekt rôznych koncentrácií BS 3/22 na 24-hodinový biofilm S. aureus CCM 4223
Kontrola: jamky s vytvoreným biofilmom S. aureus CCM 4223, ktorý sme opracovali PBS; údaje sú vyjadrené ako aritmetický priemer ± SD ; ***p < 0,001; *p < 0,05 v porovnaní s kontrolou.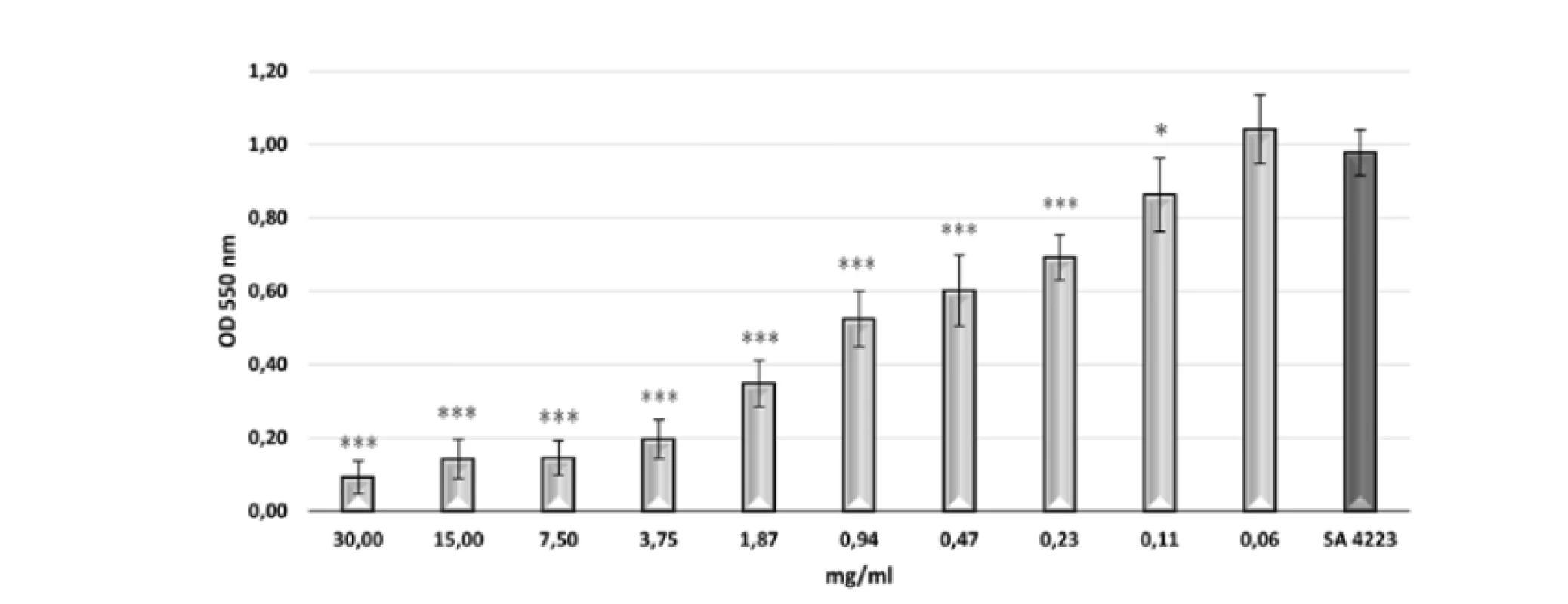
Table 3. Percento disperzie vytvoreného biofilmu S. aureus CCM 4223 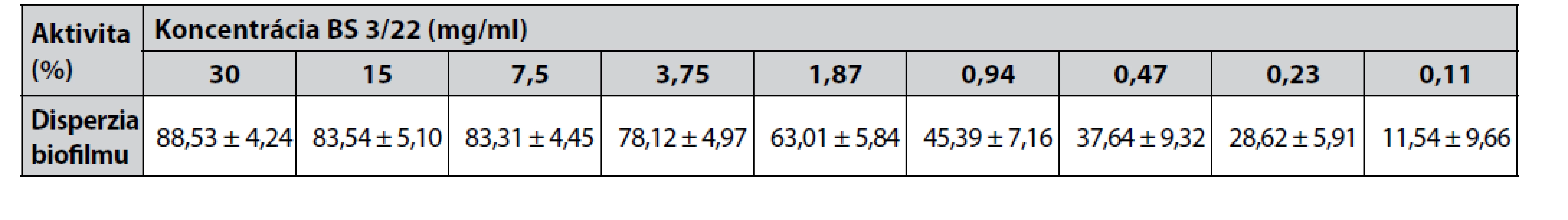
Diskusia
Kmene patriace do rodu Bacillus sú bohatými zdrojmi biologicky aktívnych látok. Medzi ne radíme aj biosurfaktanty, povrchovo aktívne látky so širokým potenciálom využitia v boji proti patogénnym mikroorganizmom. Lipopeptidy a glykolipidy sú najbežnejšie uvádzanými triedami BS s antimikrobiálnou aj antibiofilmovou aktivitou16). Z rodiny lipopeptidov sú najznámejšie polymyxín A a polymyxín B produkované Bacillus polymyxa17); surfaktín, iturín, fengycín, mykosubtilíny a bacillomycíny produkované Bacillus subtilis18); pumilacidín produkovaný Bacillus pumilus19); lichenyzín z Bacillus licheniformis20); a viskozín z Pseudomonas fluorescens21). Pokiaľ ide o glykolipidy, najlepšie sú preštudované rhamnolipidy z Pseudomonas aeruginosa22), soforolipidy z Candida bombicola23) a manozylerytritolové lipidy z Candida antarctica24).
Antibiofilmová aktivita izolovaných BS 3/22 voči biofilmu S. aureus CCM 4223 sa v tejto práci hodnotila tromi rôznymi spôsobmi: spoločnou inkubáciou, inhibíciou adhézie a disperzie biofilmu. Percento inhibície biofilmu bolo vzhľadom na kontrolu pri jednotlivých testoch odlišné. Ko-kultivačný test bol najefektívnejší, pretože pri použití 30 mg/ml BS 3/22 sa znížila tvorba biofilmu o viac ako 89 %. Percento inhibície sa s klesajúcou koncentráciou BS 3/22 znižovalo a pri koncentrácii nižšej ako 0,4 mg/ml inhibičný efekt nebol zaznamenaný. Inhibícia rastu S. aureus CCM 4223 v prítomnosti izolovaných BS 3/22 pri koncentráciách 30 – 7,5 mg/ml nebola zistená. Preto tento účinok pravdepodobne nesúvisí s antimikrobiálnou aktivitou. Podobné výsledky zistili aj Abdelli et al.25), kedy surfaktín získaný z kmeňna Bacillus safensis F4 v koncentráciách 5 a 10 mg/ml významne obmedzoval tvorbu biofilmu Staphylococcus epidermidis S61 s percentami inhibície 80 – 90 %. Zmes lipopeptidov (surfaktín, iturín a fengycín) izolovaných z B. subtilis preukázala dôležité antibiofilmové a antiadhezívne účinky na uropatogénne baktérie26). Liu et al.27) preukázali, že v podmienkach spoločnej inkubácie surfaktín produkovaný kmeňom Bacillus subtilis silne ovplyvňoval adhéziu S. aureus na niekoľkých materiáloch (sklo, polystyrén a nehrdzavejúca oceľ) a významne podporoval uvoľňovanie biofilmu.
Test na zistenie antiadhezívnej aktivity BS 3/22 odhalil, že najvyššia inhibícia adhézie 50,3 % bola dosiahnutá pri opracovaní povrchu BS 3/22 s koncentráciou 30 mg/ml. To naznačuje, že BS sú schopné modifikovať fyzikálno-chemické vlastnosti povrchu, čím znižujú adhéziu a inhibujú tvorbu biofilmu. Okrem toho BS menia hydrofóbnosť bakteriálneho povrchu a v dôsledku toho menia mechanizmus adhézie mikroorganizmov. Ich účinky závisia od počiatočnej bakteriálnej hydrofóbnosti, ako aj od typu BS a ich koncentrácie, ktorá môže zvyšovať alebo znižovať hydrofóbnosť bakteriálneho povrchu v dôsledku toho, že je viac alebo menej hydrofóbna28). Antiadhezívna aktivita BS už bola opísaná v predchádzajúcich prácach, napríklad Janek et al.29) prezentujú schopnosť pseudofaktínu II (0,5 mg/ml), cyklického lipopeptidu, brániť tvorbe biofilmu Escherichia coli, Enterococcus faecalis, Enterococcus hirae, Staphylococcus epidermidis, Proteus mirabilis a Candida albicans na polystyrénovom povrchu. De Araujo et al.30) zistili, že surfaktín pri 0,50 % (w/v) významne znížil adhéziu Listeria monocytogenes na polystyrénový povrch, keď sa použil pri vyšších koncentráciách, pričom dosiahol hodnoty až 54 % inhibície. Giri et al.31) skúmali antibiofilmový potenciál lipopeptidov produkovaných B. subtilis VSG4 a B. licheniformis VS16 proti S. aureus, Salmonella Typhimurium a Bacillus cereus. Prvotné opracovanie mikrotitračných doštičiek biosurfaktantmi významne inhibovalo tvorbu biofilmu a podporovalo eradikáciu biofilmu s percentom redukcie pri najvyššej testovanej koncentrácii (5 mg/ml) 65 – 82 %, resp. 61 – 76 %. Účinok surfaktínu na adhéziu a tvorbu biofilmu hodnotili aj de Araujo et al.32), kedy BS významne znížili adhéziu Pseudomonas fluorescens ATCC13525 na polystyrénové povrchy (54 % inhibícia) a tvorbu biofilmu (73 %) na povrchu z nehrdzavejúcej ocele.
V práci sme BS 3/22 použili taktiež na rozrušenie už existujúceho biofilmu, pričom bola dosiahnutá viac ako 88 % disperzia pri najvyššej použitej koncentrácii BS 3/22 (30 mg/ml). Percento disperzie zostalo na úrovni 83 % pri ošetrení biofilmu koncentráciami medzi 15 a 3,7 mg/ml. Pri nižších koncentráciách úmerne klesala aj účinnosť disperzie biofilmu. Zistené výsledky sú v zhode so zisteniami iných autorov6, 31, 32). Surfaktín izolovaný z B. amyloliquefaciens NS6 preukázal disperznú aktivitu voči vytvorenému biofilmu Streptococcus mutans, kedy pri najvyššej koncentrácii 80 mg/ml bolo percento disperzie 62,2 ± 7,1 %6). Meena et al.32) udávajú, že biofilmy patogénnych bakteriálnych kmeňov S. aureus ATCC 6538, Pseudomonas sp., Klebsiella pneumoniae, E. coli NCTC 10418, Salmonella Typhi a S. Typhimurium NCTC74 boli po ošetrení surfaktínom izolovaným z B. subtilis KLP2015 (100 μg/ml) znížené o 58,10 %, 47,86 %, 14,83 %, 13,91 %, 11,01 % a 10,23 %. Lipopeptidy izolované z kmeňov B. subtilis VSG4 a B. licheniformis VS16 s najvyššou použitou koncentráciou 5 mg/ml eradikovali vytvorený biofilm kmeňov S. aureus ATCC 11778, E. coli MTCC65 a S. Typhimurium ATCC1943031). Disperzia biofilmu bola pravdepodobne vyvolaná odstránením extracelulárnych polymérnych látok (EPS) a deštrukciou mikrokolónií spôsobenou BS33). EPS zohrávajú dôležitú úlohu v rezistencii biofilmu, pretože bránia kontaktu mikroorganizmov s antimikrobiálnou látkou34).
Záver
Predkladaná práca dokazuje, že biosurfaktanty izolované z kmeňa B. amyloliquefaciens 3/22 majú potenciál inhibovať nielen tvorbu biofilmu S. aureus v ich prítomnosti, ale majú taktiež schopnosť brániť adhézii biofilm-tvoriacich buniek a dokážu aj rozrušiť vytvorený biofilm. Tieto výsledky naznačujú, že získané bioaktívne látky je možné využiť ako potenciálne antibiofilmové agens v boji proti patogénnym kmeňom S. aureus v biomedicínskej oblasti. Je potrebné ďalej preskúmať podrobnosti o aktivite izolovaných biosurfaktantov v podmienkach in vivo.
Práca vznikla za podpory Agentúry na podporu výskumu a vývoja na základe zmluvy č. APVV-15-0377 a č. APVV-16-0203 a projektu Ministerstva školstva, vedy, výskumu a športu Slovenskej republiky VEGA 1/0081/17.
Stret záujmov: žiadny.
PharmDr. Karolína Englerová • R. Nemcová
Univerzita veterinárskeho lekárstva a farmácie v Košiciach
Komenského 73, 041 81 Košice, Slovenská republika
e-mail: karolina.englerova@gmail.com
Z. Bedlovičová
Univerzita veterinárskeho lekárstva a farmácie v Košiciach
Katedra chémie, biochémie a biofyziky
E. Styková
Univerzita veterinárskeho lekárstva a farmácie v Košiciach
Klinika koní
Sources
1. Kim B. S., Kim J. Y. Optimization Using 3 3 Full-Factorial Design for Crude Biosurfactant Activity from Bacillus pumilus IJ-1 in Submerged Fermentation. Microbiol. Biotechnol. Lett. 2020; 48(1), 48–56.
2. Mehjabin J. J., et al. Biosurfactants from Marine Cyanobacteria Collected in Sabah, Malaysia. J. Nat. Prod. 2020; 83(6), 1925–1930.
3. Shekhar S., Sundaramanickam A., Balasubramanian T. Biosurfactant producing microbes and their potential applications: a review. Crit. Rev. Environ. Sci. Technol. 2014; 45, 1522–1554.
4. Kourmentza K., Gromada X., Michael N., et al. Antimicrobial activity of lipopeptide biosurfactants against foodborne pathogen and food spoilage microorganisms and their cytotoxicity. Front. Microbiol. 2021; 11, 3398.
5. Nazareth T. C., Zanutto C. P., Tripathi L., et al. The use of low-cost brewery waste product for the production of surfactin as a natural microbial biocide. Biotechnol. Rep. 2020; 28, e00537.
6. Abdollahi S., Tofighi Z., Babaee T., et al. Evaluation of Anti-oxidant and Anti-biofilm Activities of Biogenic Surfactants Derived from Bacillus amyloliquefaciens and Pseudomonas aeruginosa. Iran. J. Pharm. Sci. 2020; 19(2), 115.
7. Tahaei S. A. S., Stájer A., Barrak I., et al. Correlation between biofilm-formation and the antibiotic resistant phenotype in Staphylococcus aureus isolates: a Laboratory - Based Study in Hungary and a review of the literature. Infect. Drug Resist. 2021; 14, 1155.
8. Meena K. R., Kanwar S. S. Lipopeptides as the antifungal and antibacterial agents: applications in food safety and therapeutics. Biomed. Res. Int. 2015; 2015, 1–15.
9. Merghni A., Dallel I., Noumi E., et al. Antioxidant and antiproliferative potential of biosurfactants isolated from Lactobacillus casei and their antibiofilm effect in oral Staphylococcus aureus strains. Microb. Pathog. 2017; 104, 84–89.
10. Fiľková A. Štúdium účinku prospešných mikroorganizmov na inhibíciu biofilm tvoriacich patogénov. Diplomová práca. Košice: UVLF 2021.
11. Englerová K., Nemcová R., Maďar M., et al. Morské baktérie rodu Bacillus – prirodzení producenti lipopeptidových biosurfaktantov. In: Seminár doktorandov venovaný pamiatke akademika Boďu. Vedecké práce doktorandov 2019: zborník zo seminára doktorandov venovaného pamiatke akademika Boďu. 1. vydanie. Košice: Slovenská akadémia vied, Centrum biovied 2019; 17–19.
12. Płaza G., Chojniak J., Rudnicka K., et al. Detection of biosurfactants in Bacillus species: Genes and products identification. J. Appl. Microbiol. 2015; 119, 1023 – 1034.
13. O’Toole G. A., Pratt L. A., Watnick P. I., et al. Genetic approaches to study of biofilms. In: Methods in enzymology. Elsevier 1999; 91–109.
14. Madhu A. N., Prapulla, S. G. Evaluation and functional characterization of a biosurfactant produced by Lactobacillus plantarum CFR 2194. Appl. Biochem. Biotechnol. 2014; 172(4), 1777–1789.
15. e Silva S. S., Carvalho J. W. P., Aires C. P., et al. Disruption of Staphylococcus aureus biofilms using rhamnolipid biosurfactants. Int. J. Dairy Sci. 2017; 100(10), 7864–7873.
16. Cochrane S. A., Vederas J. C. Lipopeptides from Bacillus and Paenibacillus spp.: a gold mine of antibiotic candidates. Med. Res. Rev. 2016; 36(1), 4–31.
17. Landman D., Georgescu C., Martin D. A., et al. Polymyxins revisited. Clin. Microbiol. Rev. 2008; 21, 449–465.
18. Vater J., Kablitz B., Wilde C., et al. Matrix-assisted laser desorption ionization–time of flight mass spectrometry of lipopeptide biosurfactants in whole cells and culture filtrates of Bacillus subtilis C-1 isolated from petroleum sludge. Appl. Environ. Microbiol. 2002; 68, 6210–6219.
19. Naruse N., Tenmyo O., Kobaru S., et al. Pumilacidin, a complex of new antiviral antibiotics. Production, isolation, chemical properties, structure and biological activity. J. Antibiot. 1990; 43, 267–280.
20. Grangemard I., Wallach J., Maget-Dana R., et al. Lichenysin: A more efficient cation chelator than surfactin. Appl. Biochem. Biotechnol. 2001; 90, 199–210.
21. Saini H. S., Barragán-Huerta B. E., Lebrón-Paler A., et al. Efficient purification of the biosurfactant viscosin from Pseudomonas libanensis strain M9-3 and its physicochemical and biological properties. J. Nat. Prod. 2008; 71, 1011–1015.
22. Benincasa M., Abalos A., Oliveira I., et al. Chemical structure, surface properties and biological activities of the biosurfactant produced by Pseudomonas aeruginosa LBI from soapstock. Antonie Van Leeuwenhoek 2004; 85, 1–8.
23. Díaz De Rienzo M. A., Banat I. M., Dolman B., et al. Sophorolipid biosurfactants: Possible uses as antibacterial and antibiofilm agent. New Biotechnol. 2015; 32, 720–726.
24. Kitamoto D., Yanagishita H., Shinbo T., et al. Surface active properties and antimicrobial activities of mannosylerythritol lipids as biosurfactants produced by Candida antarctica. J. Biotechnol. 1993; 29, 91–96.
25. Abdelli F., Jardak M., Elloumi J., et al. Antibacterial, anti-adherent and cytotoxic activities of surfactin(s) from a lipolytic strain Bacillus safensis F4. Biodegradation 2019; 30, 287–300.
26. Moryl M., Spętana M., Dziubek K., et al. Antimicrobial, antiadhesive and antibiofilm potential of lipopeptides synthesised by Bacillus subtilis, on uropathogenic bacteria. Acta Biochim. Pol. 2015; 62(4).
27. Liu J., Li W., Zhu X., et al. Surfactin effectively inhibits Staphylococcus aureus adhesion and biofilm formation on surfaces. Appl. Microbiol. Biotechnol. 2019; 103, 4565–4574.
28. Ahimou F., Jacques P., Deleu M. Surfactin and iturin A effects on Bacillus subtilis surface hydrophobicity. Enzyme Microb. Technol. 2000; 27(10), 749–754.
29. Janek T., Łukaszewicz M., Krasowska A. Antiadhesive activity of the biosurfactant pseudofactin II secreted by the Arctic bacterium Pseudomonas fluorescens BD5. BMC Microbiol. 2012; 12(1), 1–9.
30. de Araujo L. V., Guimarães C. R., e Silva S,S, Marquita R. L., et al. Rhamnolipid and surfactin: Anti-adhesion/ antibiofilm and antimicrobial effects. Food Control 2016; 63, 171–178.
31. Giri S. S., Ryu E. C., Sukumaran V., et al. Antioxidant, antibacterial, and anti-adhesive activities of biosurfactants isolated from Bacillus strains. Microb. Pathog. 2019; 132, 66–72.
32. Meena K. R., Sharma A., Kanwar S. S. Antitumoral and antimicrobial activity of surfactin extracted from Bacillus subtilis KLP2015. Int. J. Pept. Res. Ther. 2020; 26(1), 423–433.
33. Díaz De Rienzo M. A., Stevenson P. S., Marchant R., et al. Pseudomonas aeruginosa biofilm disruption using microbial surfactants. J. Appl. Microbiol. 2016; 120(4), 868–876.
34. Araujo L. V. D., Freire D. M. G., Nitschke M. Biossurfactantes: propriedades anticorrosivas, antibiofilmes e antimicrobianas. Quim. Nova 2013; 36(6), 848–858.
Labels
Pharmacy Clinical pharmacology
Article was published inCzech and Slovak Pharmacy

2021 Issue 5-
All articles in this issue
- Laudatio RNDr. Roman Smieško – 70 rokov
- Využití droplet-based mikrofluidních technik při přípravě mikročástic
- Telacebek (Q203): Vynára sa na obzore nové efektívne a bezpečné antituberkulotikum?
- Antiadhezívna, antibiofilmová a disperzná aktivita biosurfaktantov izolovaných z Bacillus amyloliquefaciens 3/22
- Vliv meloxikamu a extraktu z kryokonzervované placenty na počáteční zánětlivou reakci – experimentální studie
- Filmy z kyseliny poly-γ-glutamové a poly-ε-lysinu jako potenciální prostředek pro terapii ran – formulace, příprava a hodnocení
- Czech and Slovak Pharmacy
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Využití droplet-based mikrofluidních technik při přípravě mikročástic
- Telacebek (Q203): Vynára sa na obzore nové efektívne a bezpečné antituberkulotikum?
- Antiadhezívna, antibiofilmová a disperzná aktivita biosurfaktantov izolovaných z Bacillus amyloliquefaciens 3/22
- Vliv meloxikamu a extraktu z kryokonzervované placenty na počáteční zánětlivou reakci – experimentální studie
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

