-
Medical journals
- Career
Synergický účinok azolových antimykotík (klotrimazol, flukonazol) a prírodných látok
: Martin Kuruc; Eva Čonková
: Čes. slov. Farm., 2017; 66, 164-167
: Original Articles
Terapia mykotických infekcií je vzhľadom na narastajúci vývoj rezistencie patogénov na antimykotiká stále náročnejšia. Jej efektivitu je možné zvýšiť vhodnou kombináciou konvenčných liečiv s látkami prírodného charakteru. Testovaním citlivosti kvasiniek C. albicans na klotrimazol samotný a v kombinácii s prípravkom na báze tea tree oleja, resp. s polykompozitným prípravkom obsahujúcim konopný olej a rôzne silice, ako aj s propolisovou tinktúrou bola zistená 100% antimykotická aktivita, preto sa synergický účinok nedal porovnať. Perspektívnym sa však javí synergický účinok prírodných liečiv s flukonazolom. Antifungálna účinnosť flukonazolu samotného dosahovala 80,95%, avšak po pridaní prírodných liečiv sa zvýšila o 9,55–14,25%.
Kľúčové slová:
Candida albicans • flukonazol • klotrimazol • prírodné liečivá • synergizmusÚvod
Candida albicans je v posledných desaťročiach najčastejšie diagnostikovaným pôvodcom kandidových infekcií1, 2). Je oportúnnym patogénom a k nárastu virulencie a invázii do tkaniva dochádza len za určitých podmienok (potlačenie prirodzenej mikroflóry, liečba imunosupresívami, hormonálne zmeny)3).
Terapia kandidóz je v súčasnosti zabezpečovaná rôznymi antimykotikami, najmä zo skupiny polyénov a azolových zlúčenín4). Na báze azolov sú v lekárňach dostupné desiatky liekov, pričom mnohé z nich obsahujú klotrimazol alebo flukonazol5, 6).Vzhľadom na narastajúci vývoj rezistencie na antimykotiká7, 8) sa pozornosť odborníkov zameriava nielen na objavovanie nových liečiv, ale aj na využitie prírodných látok s potenciálnym antimykotickým účinkom.
Viaceré štúdie poukazujú na cytotoxický účinok rastlinných silíc, ktoré ovplyvnením priepustnosti bunkovej membrány húb a interakciou so signálnymi proteínmi viazanými na membránach sprostredkúvajú antifungálny účinok9). Stále častejšie sa objavujú vedecké práce zamerané na štúdium kombinácie syntetických a prírodných látok, pričom sa sleduje ich potenciálny synergizmus10, 11).
Predmetom tejto práce bolo porovnať a otestovať na izolátoch C. albicans antifungálnu aktivitu dvoch azolových antimykotík (klotrimazolu a flukonazolu) samostatne a v kombinácii s komerčnými prípravkami prírodného charakteru, ktoré si pacienti môžu voľne zakúpiť v lekárňach.
Pokusná časť
Materiál
Izoláty C. albicans (21 klinických vzoriek, Univerzitná nemocnica Louisa Pasteura v Košiciach, Košice); referenčný kmeň C. albicans CCM 8320 (Česká sbírka mikroorganizmů, Brno, Česká republika); komerčné prípravky: TT – čistý prírodný 100% tea tree olej s prímesou limonénu, linalolu a geraniolu; KN – polykompozitný prípravok na báze konopného oleja s obsahom arniky, citricidalu, geraniolu, extraktu z grapefruitových semienok, klinčekovej a šalviovej silice; PR – propolisová tinktúra; disky impregnované flukonazolom (FL), resp. klotrimazolom (CL) 10 µg/disk (CondaPronadisaMicro&MolecularBiology, Spain); Sabouraud dextrózový agar s chloramfenikolom (SDA) a Saboraud dextrózový bujón (SDB) (HiMediaLaboratoriesPvt. Ltd., Mumbai, India).
Metodika
Na vyhodnotenie antifungálneho účinku vybraných antimykotík (CL a FL) samostatne a v kombinácii s prírodnými liečivami, bola použitá štandardná disková difúzna metóda (DDM) M44-A212).
V pilotnom experimente bola pomocou štandardnej mikrodilučnej metódy M27-A3 stanovená MIC (minimálna inhibičná koncentrácia) prípravkov TT, KN a PR13). Hodnoty ich MIC50 predstavovali základné koncentrácie pri testovaní kombinovaného účinku s CL, resp. FL.
Obe metodiky boli čiastočne modifikované, ako živné médium bol použitý Sabouraud dextrózový agar, resp. Sabouraud dextrózový bujón.
Stanovenie MIC prírodných liečiv
Na testovanie boli použité 96 jamkové sterilné mikrotitračné platničky. Do jamiek 2 až 11 bol v množstve 100 µl aplikovaný komerčný prírodný prípravok (TT, resp. KN alebo PR), v koncentráciách od 1000 mg.ml–1 do 2 mg.ml–1, pripravených dvojkovým riedením. Následne bolo do jamiek pridané inokulum (100 µl), s obsahom 1–5 × 103 CFU.ml–1, nariedené v SDB. Do jamky 12 (negatívna kontrola) bol aplikovaný SDB v množstve 200 µl. Jamka 1 (pozitívna kontrola) obsahovala 200 µl nariedeného inokula. Výsledné koncentrácie prípravkov po pridaní 100 µl inokula predstavovali 500; 250; 125; 62,5; 31,3; 16; 8; 4; 2 a 1 mg.ml–1. Platničky boli inkubované pri teplote 37 °C a po 24 hodinách bola odčítaná hodnota MIC.
Stanovenie antifungálnej účinnosti testovaných látok DDM
Povrch SDA v Petriho miskách (priemer 90 mm) bol inokulovaný suspenziou kvasiniek (1–5 × 106 CFU.ml–1), ktorá bola pomocou sterilných tampónov nanesená v troch rôznych smeroch dvakrát s 15-minútovým odstupom.
V experimente č. 1 boli na povrch inokulovaného agaru asepticky uložené antimykotické disky impregnované klotrimazolom, resp. flukonazolom.
V experimente č. 2 boli na živnú pôdu umiestnené najskôr antimykotické disky (CL, resp. FL), na ktoré boli následne aplikované nariedené komerčné prípravky prírodného charakteru: TT a KN v koncentrácii 8 mg.ml–1 a PR v koncentrácii 4 mg.ml–1, v množstve 15 µl/disk. Koncentrácie prípravkov obsahujúce silice boli pripravené vo forme emulzií s arabskou gumou, ktorá predstavovala 50% z objemu prípravku. Pre zabezpečenie sterility boli pripravené koncentrácie roztokov pred aplikáciou do mikrotitračnej platničky prefiltrované cez sterilný 0,22 µm filter.
Petriho misky boli inkubované 24 hodín pri teplote 37 °C. Účinnosť testovaných látok bola vyhodnotená na základe veľkosti inhibičnej zóny.
Experimenty boli zopakované dvakrát.
Interpretácia výsledkov
MIC testovanej antifungálnej látky bola hodnotená na základe prítomnosti, resp. absencie zákalu v jamke s inokulom a bola porovnávaná s pozitívnou a negatívnou kontrolou. Hodnota MIC bola odčítaná v jamke, v ktorej bolo živné médium číre.
Pre vyhodnotenie citlivosti izolátov C. albicans na klotrimazol a flukonazol, testovaných DDM samostatne a v kombinácii s prírodnými liečivami, boli ako interpretačné kritériá použité údaje publikované Dotom14) a Elfekym15), na základe ktorých boli kvasinky klasifikované ako citlivé (S), citlivé v závislosti na dávke (S-DD) alebo rezistentné (R). Uvedení autori použili nasledovné kritériá pre CL: S = ≥ 20 mm, S-DD = 19–12 mm a R = ≤ 11 mm a pre FL: S = ≥ 19 mm, S-DD = 18–15 mm a R = ≤ 14 mm. Synergizmus testovaných látok bol hodnotený na základe percentuálneho rozdielu citlivosti kvasiniek na antimykotikum samotné a v kombinácii s prírodným liečivom: [(S0 + S-DD0) – (SPL+S-DDPL)].
Štatistické vyhodnotenie
Popisná štatistika bola vykonaná pomocou programu Excel Microsoft Office 2007, pričom sme sa zamerali na nasledujúce parametre: aritmetický priemer (x), smerodajnú odchýlku (SD), modus (Mo) a medián (Me). Pre posúdenie signifikantnosti údajov bol použitý párový t-test v programe GraphPadPrism.
Výsledky a diskusia
Hodnoty MIC testovaných komerčných prípravkov prírodného charakteru dokumentuje tabuľka 1. Rozpätie MIC pri jednotlivých prípravkoch je takmer zhodné (1–16 mg.ml–1, resp. 2–16 mg.ml–1). Najnižšia priemerná hodnota MIC bola zistená pri PR (6,95 mg.ml–1), čo korešponduje aj s nižším údajom MIC50 (4 mg.ml–1). Koncentrácie uvedené ako MIC50 boli použité pre testovanie synergického účinku konvenčných antimykotík (CL a FL) a prípravkov na prírodnej báze.
1. MIC (mg.ml–1) komerčných prípravkov s obsahom prírodných látok 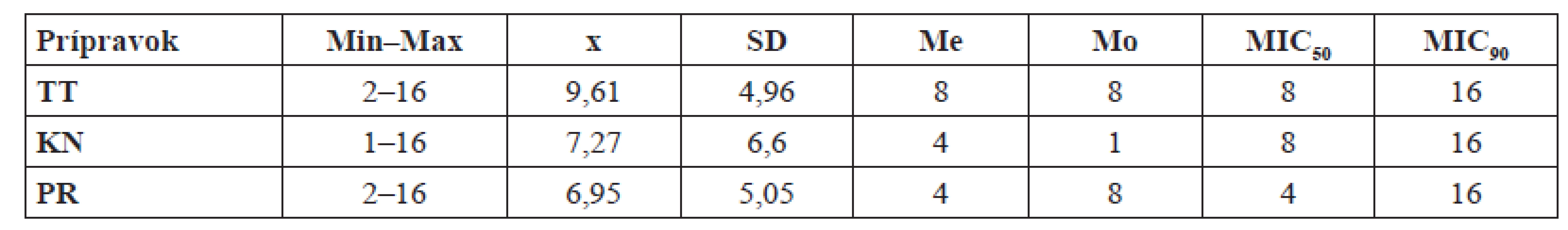
TT – teatree olej, KN – polykompozitný prípravok konopného oleja a silíc, PR – propolisová tinktúra, Min–Max – rozpätie najnižšej a najvyššej hodnoty, x – priemerná hodnota, SD – smerodajná odchýlka, Me – medián, Mo – modus Tabuľka 2 uvádza údaje vyhodnotenia citlivosti kvasiniek testovaných DDM. Pri porovnaní priemerných hodnôt veľkosti zón vytvorených pri klotrimazole samotnom a v kombinácii s prírodnými liečivami bol zaznamenaný mierny pokles. Signifikantný rozdiel (p < 0,05) bol ale zistený iba v kombinácii s prípravkom na báze propolisu. Na základe interpretačných kritérií však aj v tomto prípade všetky testované izoláty kandíd vykazovali 100% citlivosť.
Podľa literárnych údajov vznik rezistencie kandíd na klotrimazol sa spája najmä s jeho nekontrolovaným používaním, hlavne v krajinách tretieho sveta, v ktorých bola rezistencia zaznamenaná až u tretiny izolátov16).
Na flukonazol vykazovalo rezistenciu 19,05% testovaných izolátov C. albicans. Jej pokles bol pozorovaný pri použití kombinovaných prípravkov (tab. 2). Vývoj rezistencie na flukonazol je zisťovaný predovšetkým v nemocničných zariadeniach, v ktorých je liečba flukonazolom indikovaná pomerne často8). Vznik rezistencie pri C. albicans na flukonazol in vivo má zrejme multifaktoriálny pôvod. Počas dlhodobej liečby pacientov sa u pozorovaných subpopulácií kandíd postupne uplatňujú rôzne mechanizmy rezistencie, pričom za najdôležitejší faktor sa považuje tvorba biofilmu17, 18).
2. Citlivosť C. albicans na kombináciu syntetických liečiv a komerčných prípravkov prírodného charakteru 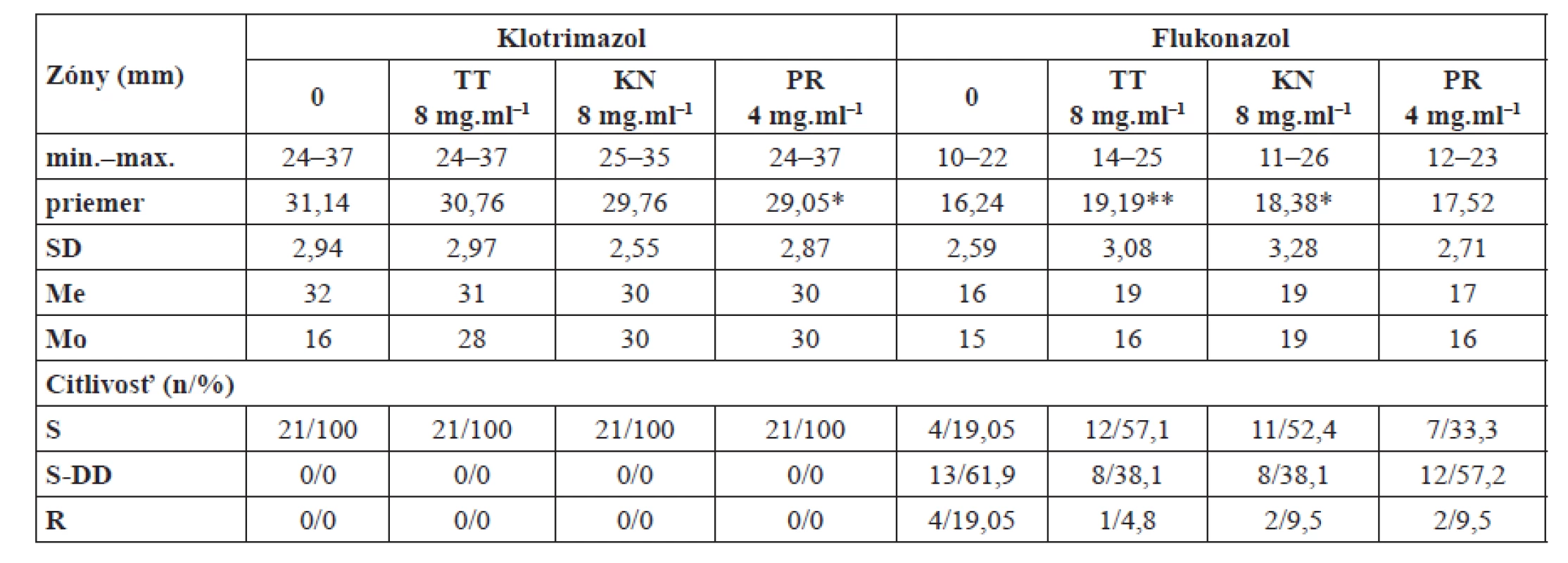
* p < 0,05; ** p < 0,001 TT – tea tree olej, KN – polykompozitný prípravok konopného oleja a silíc, PR – propolisová tinktúra, min.–max. – rozpätie najnižšej a najvyššej nameranej hodnoty, SD – smerodajná odchýlka, Me – medián, Mo – modus, n – počet citlivých kmeňov Vyššia antifungálna aktivita flukonazolu bola zaznamenaná v kombinácii s TT (95,2%), ako aj s prípravkom KN (90,5%). Tieto údaje korešpondujú aj so signifikantne vyššími priemernými veľkosťami zón inhibície pri FL+TT (19,19 mm; p < 0,001) a FL+KN (18,38 mm; p < 0,05), v porovnaní so samotným flukonazolom (16,24 mm). Nárast priemernej veľkosti inhibičnej zóny v kombinácii FL+PR nebol štatisticky významný. Táto kombinácia dosahovala 90,5% účinnosť, kým pri samotnom flukonazole činila 80,95%.
Tea tree olej, ktorý sa získava z rastliny Melaleuca alternifolia (Myrtaceae), je známy svojimi antimikrobiálnymi, antivírusovými, fungicídnymi a antiinflamačnými účinkami19). Popisovaná je jeho účinnosť aj na flukonazol-rezistentné kmene C. albicans20). Rovnako výsledky našej štúdie poukazujú na vhodnú kombináciu flukonazolu a prípravku s obsahom tea tree oleja, ktorý prispieva rôznou mierou k narušeniu integrity bunkovej membrány húb21). Najväčší podiel na jeho antimykotickom účinku majú zrejme terpinén-4-ol a α-terpineol22, 23).
Predpokladáme, že za antimykotickú aktivitu v nami testovanom polykompozitnom prípravku KN sú zodpovedné šalviová a klinčeková silica ako aj prímes geraniolu, u ktorých bol potvrdený antifungálny efekt24–26). Antimikrobiálne a antifungálne účinky klinčekovej silice sú pripisované obsahu eugenolu a karyofylénu27).
Propolis má ako včelí produkt variabilné zloženie, najväčšia časť účinných látok pozostáva z flavonoidov (flavanóny, flavóny, flavonoly a dihydroflavonoly) a fenolických kyselín28). Za narušenie bunkovej membrány kvasiniek a následné zvýšenie účinnosti liečby flukonazolom sú v prípade propolisu pravdepodobne zodpovedné jeho fenolické zložky29).
Záver
Na základe dosiahnutých výsledkov môžeme skonštatovať, že prírodné látky majú potenciál pre ich využitie pri liečbe kvasinkových infekcií. Potvrdili sme synergický účinok flukonazolu v kombinácii s komerčnými prípravkami s obsahom prírodných látok. Pri kombinácii s klotrimazolom sa však antifungálny efekt nemenil, citlivosť kvasiniek bola pri všetkých testovaniach 100%. Predpokladáme, že vhodná kombinácia prírodných látok s konvenčnými antimykotikami môže prispieť nielen k znižovaniu dávok potrebných k liečbe mykotických infekcií, ale aj zvrátiť vznik rezistencie kvasiniek.
Práca bola podporovaná Agentúrou na podporu výskumu a vývoja na základe Zmluvy č. APVV-15-0377
Stret záujmov: žiadny.
Martin Kuruc
doc. MVDr. Eva Čonková, PhD.
Univerzita veterinárskeho lekárstva a farmácie v Košiciach
Ústav farmakológie
Komenského 73, 041 81 Košice, Slovenská republika
e-mail: eva.conkova@uvlf.sk
Sources
1. Cheng, S. C., et al. Interplay between Candida albicans and the mammalian innate host defense. Infect. Immun. 2012; 80, 1304–1313.
2. Dabas P. S. An approach to etiology, diagnosis and management of different types of candidiasis. J. Yeast Fungal Res. 2013; 4(6), 63–74.
3. Tömölová Z., Zmrhal J. Mykotické vulvovaginitidy v našich ambulancích. Prakt. Gyn. 2005; 9(2), 35–39.
4. Williams D. W., Lewis M. Candida biofilms and oral candidiosis: Treatment and prevention. Periodontol. 2011; 55, 250–265.
5. Buchta V., et al. Současné možnosti léčby kožních a slizničních mykóz. Med. Pro Praxi 2009; 6(3), 155–164.
6. Mlynarčík D. Pestrý svet antimykotík. Prakt. Lekárn. 2013; 3, 20–22.
7. Cleveland A. A., et al. Declining incidence of candidemia and the shifting epidemiology of Candida resistance in two US metropolitan areas, 2008–2013: Results from population-based surveillance:PLoS ONE 10 (3): doi:10.1371/journal.pone.0120452
8. Theill L., et al. Prevalence and antifungal susceptibility of Candida albicans and its related species Candida dubliniensis and Candida africana isolated from vulvovaginal samples in a hospital of Argentina. Rev. Argent. Microbiol. 2016; 48, 43–49.
9. Zore B. G., et al. Terpenoids inhibit Candida albicans growth by affecting membrane integrity and arrest of cell cycle. Phytomedicine 2011; 11(13), 1181–1190.
10. Khan M. S. A., et al. Anti-candidal activity of essential oils alone and in combination with amphotericin B or fluconazole against multi-drug resistant isolates of Candida albicans. Med. Mycol. 2012; 50, 33–42.
11. Stringaro A., et al. Effects of Mentha suaveolens essential oil alone or in combination with other drugs in Candida albicans: Evidence-Based and Alternative Medicine 2014; Article ID 125904, 9 pages. http://dx.doi.org/10.1155/2014/125904
12. CLSI. Clinical and laboratory standards institute / National comitee for clinical laboratory standards: Method for antifungal disk diffusion susceptibility testing of yeasts. Approved Guideline – 2nd edition, Document M44-A2. National Comitee for Clinical Laboratory Standards, Wayne, P. A. Clinical and Laboratory Standards Institute 2009; 29(17), 23.
13. CLSI. Clinical and laboratory standards institute / National comitee for clinical laboratory standards: Reference method for broth dilution susceptibility testing yeasts. Approved Standard – 3rd edition, Document M27-A3. National Comitee for Clinical Laboratory Standards, Wayne, P. A. Clinical and Laboratory Standards Institute 2002; 28(14).
14. Dota K. F. D., et al. A challenge for clinical labolatories: Detection of antifungal resistance in Candida species causing vulvovaginal candidiasis. Lab. Med. 2011; 42(2), 87–93.
15. Elfeky D. S., et al. Species identification and antifungal susceptibility pattern of Candida isolatesin cases of vulvovaginal candidiasis. Alexan. J. Med. 2016; 52, 269–277.
16. Nelson M., et al. Identification and susceptibility profile of vaginal Candida species to antifungal agents among pregnant women attending antenatal clinic of Thika District Hospital, Kenya. Open. J. Med. Microb. 2013; 3(4), 239–247.
17. Martínez M. Heterogenous mechanisms of azole resistance in Candida albicans clinical isolates from an HIV-infected patient on continuous fluconazole tehrapy for oropharyngeal candidosis. J. Antimicrob. Chemother. 2002; 49(3), 515–524.
18. Niimi M., et al. Antifungal drug resistance of oral fungi. Odontology 2010; 98, 15–25.
19. Farrer-Halls G. Aromaterapie od A po Z. 1. vydanie. Praha: Metafora 2007.
20. Mondello F., et al. In vitro and in vivo activity of tea tree oil against azole-susceptible and -resistant human pathogenic yeasts. J. Antimicrob. Chemother. 2003; 51, 1223–1229.
21. Hammer K. A., et al. Antifungal effects of Melaleuca alternifolia (tea tree) oil and its components on Candida albicans, Candida glabrata and Saccharomyces cerevisiae. J. Antimicrob. Chemother. 2004; 53, 1081–1085.
22. Marcos-Arias C., et al. In vitro activities of natural products against oral Candida isolates from denture wearers. BMC Complement. Alter. Med. 2011; 11, 119. http://www.biomedcentral.com/1472-6882/11/119
23. Ramage G., et al. Antifungal, cytotoxic, and immunomodulatory properties of tea tree oil and its 3 derivate components: Potential role in management of oral candidosis in cancer patients. Front Microbiol. 2012; 3, 220. http://journal.frontiersin.org/article/10.3389/fmicb.2012.00220/full
24. Ahmad A., et al. In vitro synergy of eugenol and methyleugenol with fluconazole against clinical Candida isolates. J. Med. Microbiol. 2010; 59, 1178–1184.
25. Abu-Darwish M. S., et al. Essential oil of common sage (Salvia officinalis L.) from Jordan: Assessment of safety in mammalian cells and its antifungal and antiinflammatory potential: Biomed Res. Int. 2013; 538940. doi: 10.1155/2013/538940. Epub 2013 Oct 9.
26. Leite M. C. A., et al. Investigating the antifungal activity and mechanism(s) of geraniol against Candida albicans strains. Med. Mycol. 2014; 53, 275–284.
27. Pinto E., et al. Antifungal activity of the clove essential oil from Syzygium aromaticum on Candida, Aspergillus and dermatophyte species. J. Med. Microbiol. 2009; 58, 1454–1462.
28. Bankova V., et al. Chemical composition of european propolis: expected and unexpected results. Z. Naturforsch. C. 2014; 57(5–6), 530–533.
29. Stepanović S., et al. In vitro antimicrobial activity of propolis and synergism between propolis and antimicrobial drugs. Microbiol. Res. 2003; 158, 353–357.
Labels
Pharmacy Clinical pharmacology
Article was published inCzech and Slovak Pharmacy

2017 Issue 4-
All articles in this issue
- Cholinesterase activity assays and their use in the diagnosis of various pathological states including poisoning by neurotoxic agents
- Possibilities of using sodium hyaluronate in pharmaceutical and medical fields
- Specifics of some calcium salts in intravenous therapy of hypocalcemia and their further use
- Synergistic effect of azole antimycotics (clotrimazole and fluconazole) and natural substances
- Simplicia and medical containers from the Jesuit pharmacy in Telč
- Czech and Slovak Pharmacy
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Possibilities of using sodium hyaluronate in pharmaceutical and medical fields
- Specifics of some calcium salts in intravenous therapy of hypocalcemia and their further use
- Synergistic effect of azole antimycotics (clotrimazole and fluconazole) and natural substances
- Cholinesterase activity assays and their use in the diagnosis of various pathological states including poisoning by neurotoxic agents
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

