-
Medical journals
- Career
Separácia enantiomérov fenylalanínu a metionínu metódou HPLC: porovnanie typov stacionárnych fáz
: Katarína Hroboňová; Anna Lomenova; Jozef Čižmárik; Jozef Lehotay
: Čes. slov. Farm., 2017; 66, 62-66
: Original Articles
Témou práce je enantioselektívna separácia vybraných aminokyselín metódou vysokoúčinnej kvapalinovej chromatografie. Separácia enantiomérnych foriem bola testovaná pomocou chirálnych stacionárnych fáz na základe β-cyklodextrínu, izopropylkarbamát cyklofruktánu 6 a makrocyklického antibiotika teikoplanínu. Najúčinnejšia enantioseparácia sa dosiahla na teikoplanínovej chirálnej stacionárnej fáze v separačnom systéme s obrátenými fázami. UV spektrofotometrická detekcia pri vlnovej dĺžke 210 nm bola použitá na detekciu aminokyselín. Na hodnotenie vhodnosti HPLC metódy sa použili linearita, medza detekcie, medza stanovenia, presnosť a výťažnosť. Medze stanoviteľnosti pre enantioméry fenylalanínu a metionínu boli 0,3 a 0,2 µg.ml–1. HPLC metóda s použitím chirálnej stacionárnej fázy na základe teikolanínu bola aplikovaná na analýzu doplnkov výživy.
Kľúčové slová:
separácia enantiomérov • HPLC • fenylalanín • metionínÚvod
Aminokyseliny predstavujú dôležitú skupinu chirálnych organických zlúčenín. Sú základnými stavebnými jednotkami proteínov a zúčastňujú sa mnohých biologických procesov. Slúžia ako neurotransmitéry a prekurzory pre syntézu hormónov a iných látok, majú funkciu antioxidantov a sú stabilizátormi DNA a RNA1). V organizmoch sa vyskytujú väčšinou v L-enantiomérnej forme (homochiralita), čo môže byť v dôsledku rozdielnej stability oboch enantiomérov. Prírodný výskyt D-aminokyselín je zriedkavý a môže súvisieť so špecifickými procesmi2, 3). Enantioméry aminokyselín sa môžu líšiť nielen v ich biologických účinkoch, ale aj ďalšími vlastnosťami, napr. chuťou, rozpustnosťou4). Zmena enantiomérneho pomeru je vhodným ukazovateľom spracovania, skladovania, životnosti a kvality, predovšetkým, potravinárskych výrobkov. Separácia enantiomérov aminokyselín má teda nezastupiteľné miesto v biochemickej, farmaceutickej a potravinárskej analýze.
Mnohé látky s výživovým alebo fyziologickým účinkom, vitamíny a minerálne látky dôležité pre správne fungovanie ľudského organizmu chýbajú v prirodzenej, aj keď pestrej strave, a preto je vhodné ich prísun dopĺňať formou výživových doplnkov. Fenylalanín a metionín sú esenciálne aminokyseliny, ktoré si ľudský organizmus nedokáže sám vytvoriť a ich prísun do organizmu sa dodávaná vo forme potravín, príp. iných doplnkov. Fenylalanín je prekurzorom pre tvorbu tyrozínu, katecholamínov (dopamín, adrenalín, noradrenalín) a kožného pigmentu melanínu. Užívanie fenylalanínu má priaznivý vplyv na nervový systém a psychiku, potláča nadmernú chuť k jedlu, povzbudzuje mozgové tkanivo k tvorbe látok endorfínov a enkefalínov v centrálnej nervovej sústave, potláča činnosť enzýmov, ktoré tlmia činnosť endorfínov, čím predlžuje ich pôsobenie, podporuje mentálnu bdelosť a pamäť5). Metionín sa v organizme podieľa na rozklade tukov a bráni ich ukladaniu v pečeni a cievach, podporuje funkcie tráviacej sústavy, detoxikuje od škodlivých látok, bráni lámavosti vlasov, je potrebný pri liečbe reumatickej horúčky, syntéze nukleových kyselín, kolagénu a bielkovín. Je zdrojom síry, ktorá deaktivuje voľné radikály. Metionín je účinný antioxidant6). Fenylalanín a metionín sú preto jednými z hlavných zložiek mnohých aminokyselinových doplnkov výživy.
Chromatografické metódy (HPLC, TLC, GC) sú vhodné na separáciu enantiomérov, a teda sa často využívajú na kontrolu procesov výroby, pri štúdiu interakcií optických izomérov s inými chirálnymi alebo nechirálnymi molekulami. Pri priamej HPLC separácii enantiomérov sa využívajú stacionárne fázy obsahujúce rôzne typy chirálnych selektorov. Separácia je založená na tvorbe prechodných diastereoizomérnych komplexov medzi enantiomérmi a stacionárnou fázou. Medzi najčastejšie chirálne selektory patria makrocyklické antibiotiká teikoplanín a teikoplanín aglykón7, 8), cyklodextríny, kruhové étery, deriváty polysacharidov a proteínov, cyklofruktány9, 10). Prítomnosť stereogénnych centier a heterogénnosť funkčných skupín v ich molekulách, ako aj zloženie mobilných fáz, má významný vplyv na stereoselektívne interakcie medzi enantiomérom a selektorom, ktoré sú zodpovedné za chirálne rozpoznávanie. Príklad aplikovateľnosti chirálnych stacionárnych fáz (CSF) na báze teikoplanínu a separačných systémov v závislosti od typu separovaných zlúčenín dokumentuje tabuľka 1.
1. Aplikovateľnosť chirálnych stacionárnych fáz na základe teikoplanínu pre HPLC separáciu enantiomérov rôznych typov látok7, 11, 12 ) 
PI – polárno-iónový separačný systém, NP – separačný systém s konvenčným usporiadaním fáz, PO – polárnoorganický separačný systém, RP – separačný systém s obráteným usporiadaním fáz Cieľom práce bolo zvoliť vhodné podmienky (zloženie stacionárnej a mobilnej fázy) separácie enantiomérov vybraných esenciálnych aminokyselín pre ich následné stanovenie vo vzorkách výživových doplnkov metódou vysokoúčinnej kvapalinovej chromatografie.
Pokusná časť
Chemikálie
DL-metionín, DL-fenylalanín, L-metionín a L-fenylalanín (> 98%) boli získané zo Sigma Aldrich. Acetonitril, metanol, (pre gradientovú HPLC), etanol, n-hexán (pre HPLC), kyselina octová (100 %), kyselina trifluoroctová, trietylamín (p.a.) boli získané z Merck. Na prípravu deionizovanej vody bolo použité zariadenie AquaMax ultra 370.
Vzorky výživových doplnkov s obsahom metionínu (vzorka 1) a fenylalanínu (vzorka 2) sa získali z obchodnej siete lekárni.
HPLC podmienky
Kvapalinový chromatograf Agilent Technologies (séria 1100) pozostával z binárneho vysokotlakového čerpadla, dávkovacieho ventilu Rheodyne, termostatu kolóny a spektrofotometrického detektora (chromatogramy boli zaznamenávané pri vlnovej dĺžke 210 nm). Na HPLC separáciu enantiomérov sa použili chirálne stacionárne fázy Chirobiotic T (chirálny selektor teikoplanín), IP-CF6 (chirálny selektor izopropylkarbamát cyklofruktánu 6) a Chiradex (chirálny selektor β-cyklodextrín, β-CD) (4 × 250 mm ID, 5 µm). Mobilné fázy tvorili zmesi: vodný roztok acetonitrilu (pre T a β-CD), n-hexán/etanol/kyselina trifluorooctová (pre IP-CF6 a β-CD) a metanol/acetonitril/kyselina octová/trietylamín (pre β-CD). Prietok mobilnej fázy bol 0,8 ml.min–1 a dávkovaný objem 20 µl. Separácie sa uskutočnili pri teplote kolóny 0 °C.
Pracovné postupy
Roztoky racemátov aminokyselín a L-enantomérnych foriem boli pripravené rozpustením látky v mobilnej fáze (koncentrácia 1 mg.ml–1 a následne sa riedili na nižšie koncentrácie podľa potreby).
Vzorky sa spracovali kvapalinovou extrakciou: Obsah piatich kapsúl vzorky sa zhomogenizoval. Presne odvážené množstvo vzorky zodpovedajúce jednej kapsule (okolo 0,4 g vzorky 1; 0,3 g vzorky 2) sa zmiešalo s metanolom (20 ml pre vzorku 1, 100 ml pre vzorku 2), zmes sa miešala 30 min na laboratórnej miešačke pri teplote 23 ºC a centifugovala (5 min, 400 rpm). Extrakt bol prefiltrovaný cez 0,45 µm membránový filter a následne dávkovaný do HPLC. Extrakt vzorky 2 sa pred HPLC analýzou riedili 5-krát mobilnou fázou.
Analytické parametre
Na hodnotenie vhodnosti HPLC metódy sa použili parametre: linearita, medza detekcie, medza stanovenia, presnosť a výťažnosť.
Matricové kalibračné závislosti boli zostrojené v rozsahu koncentrácií 0,3–500 µg.ml–1 pre enantioméry metionínu a 0,2–500 µg.ml–1 pre enantioméry fenylalanínu (šesť kalibračných roztokov, 7-krát prípravené). Kalibračné roztoky boli dávkované 3-krát. Parametre kalibračných závislostí, závislosti plochy píku (y) enantioméru of koncentrácie (x, v µg.ml–1), dosahovali nasledovné hodnoty: y = 106,2x + 7,9 pre L-metionín; y = 112,5x + 6,4 pre D-metionín; y = 754,3x + 7,0 pre L-fenylalanín; y = 734,3x + 7,6 pre D-fenylalanín.
Medza stanovenia (LOQ) a medza detekcie (LOD) boli stanovené ako najnižšie koncentrácie kalibračných roztokov, ktoré je možné danou metódou detegovať (LOD) a stanoviť (LOQ) určené pre pomer odozvy plochy píku a šumu nulovej línie S/N = 3 a 10.
Vnútrodňová a medzidňová presnosť metódy boli hodnotené z opakovaných analýz vzoriek (7-krát pripravené) počas 1 dňa a počas 6 dni. Výsledky boli vyjadrené ako percentá relatívnej smerodajnej odchýlky.
Výťažnosť bola stanovená na troch úrovniach koncentrácií (20 mg.g–1, 143 mg.g–1 a 357 mg.g–1 pre D - a L-fenylalanín; 5 mg.g–1, 10 mg.g–1 a 25 mg.g–1 pre D - a L-metionín). Vzorky s prídavkom a bez prídavku boli spracované rovnakým postupom a výťažnosti boli vypočítané ako percentuálny rozdiel medzi plochami píkov.
Výsledky a diskusia
Separácia enantiomérov aminokyselín
Na separáciu enantiomérov vybraných nederivatizovaných aminokyselín sa testovali stacionárne fázy s rôznymi chirálnymi selektormi, na základe cyklodextrínov, makrocyklických antibiotík a cyklofruktánov.
Separácia enantiomérov fenylalanínu a metionínu na β-cyklodextrínovej CSF sa testovala v polárno-organickom, obrátenom a konvenčnom separačnom systéme fáz. Čiastočná separácia enantiomérov metionínu a fenylalanínu (Rij ~ 1,1) sa dosiahla v konvenčnom separačnom systéme fáz, pri použití mobilnej fázy etanol/n-hexán/kyselina trifluóroctová (25/75/0,2 v/v/v). Účinnosť kolóny však bola nízka a uvedená stacionárna fáza ani v jednom s testovaných separačných usporiadaní nebola vhodná na analýzu výživových doplnkov. Stacionárna fáza s β-cyklodextrínom ako chirálnym selektorom v separačnom systéme s obrátenými fázami je vhodnejšia na separáciu enantiomérov derivatizovaných (dansyl-, dinitrobenzoyl-, dabzyl-deriváty) aminokyselín13).
Separácia enantiomérov vybraných nederivatizovaných aminokyselín na CSF na základe izopropylkarbamát cyklofructanu 6 sa testovala v polárno-organickom (zmes metanol/acetonitril/kyselina octová/trietylamín ako mobilná fáza) a konvenčnom (zmes n-hexán/etanol/kyselina trifluóroctová ako mobilná fáza) separačnom systéme fáz. V systéme s polárno-organickým usporiadaním fáz sa so zvyšovaním koncentrácie organického modifikátora, metanolu, v mobilnej fáze od 20 do 85 % znižovali hodnoty retenčných faktorov a rozlíšenia. Separácia enantiomérov metionínu a fenylalanínu sa dosiahla pri elúcií mobilnou fázou metanol/acetonitril/kyselina octová/trietylamín (75/25/0,3/0,2 v/v/v/v). Hodnota rozlišovacieho faktora bola 1,0 pre D - a L-metionín a 0,7 pre D - a L-fenylalanín. Pri priamej enantioseparácií vybraných aminokyselín na izopropylkarbamát cyklofructán 6 CSF v systéme s konvenčným usporiadaním fáz sa zvýšená retencia a selektivita pozorovali, keď mobilná fáza obsahovala menej ako 50% etanolu. Zvyšujúca sa koncentrácia etanolu mala za následok zhoršenie účinnosti enantioseparácie (zníženie hodnôt rozlíšenia enantiomérov). Vhodnou mobilnou fázou na separáciu enantiomérov D,L-metionínu a D,L-fenylalanínu bola zmes n-hexán/etanol/kyselina trifluóroctová (50/50/0,1 v/v/v), pri ktorej hodnoty rozlišovacích faktorov boli 1,1 a 1,2.
Separácia na CSF na báze teikoplanínu bola uskutočnená v separačnom systéme s obrátenými fázami, s mobilnou fázou acetonitril-voda. Testovali sa mobilné fázy, ktorých zloženie sa menilo v rozsahu od 30 do 90 obj. % organického modifikátora, acetonitrilu. Závislosti hodnôt retenčných faktorov D-, L-metionínu a D-, L-fenylalanínu od zloženia mobilnej fázy mali od 30–45 % acetonitrilu klesajúci charakter a od 45–90 % stúpajúci charakter. Hodnoty rozlíšenia enantiomérov metionínu a fenylalanínu v závislosti od zloženia mobilnej fázy mali podobný trend ako hodnoty retenčných faktorov. Z experimentálnych výsledkov vyplynulo, že najvhodnejšou mobilnou fázou na separáciu enentiomérov vybraných aminokyselín bola zmes acetonitril/voda (75/25 v/v). Hodnoty rozlišovacieho faktora boli 1,6 pre D - a L-fenylalanín a 3,0 pre D - a L-metionín.
Porovnanie metód stanovenia aminokyselín
Typy CSF testovaných pre separáciu enantiomérov metionínu a fenylalanínu, typy separačných systémov a chromatografické charakteristiky získané pri najvhodnejších chromatografických podmienkach sú zhrnuté v tabuľke 2. Chromatografické záznamy enantioseparácie D,L-metionínu a D,L-fenylalanínu na testovaných CSF dokumentuje obrázok 1. Z porovnania chromatografických charakteristík vyplýva, že najúčinnejšia enantioseparácia (najvyššie hodnoty rozlíšenia enantiomérov) sa dosiahla na použitím CSF na základe teikoplanínu, kde aj podľa očakávania boli výrazne nižšie medze detekcie v porovnaní s HPLC-UV metódou s CSF na základe izopropylkarbamát cyklofruktánu 6 alebo β-cyklodextrínu (tab. 3). Zvolená HPLC metóda sa vyznačovala aj väčším lineárnym rozsahom.
2. Chromatografické charakteristiky a medze detekcie pre separáciu enantiomérov metionínu a fenylalanínu na rôznych chirálnych stacionárnych fázach 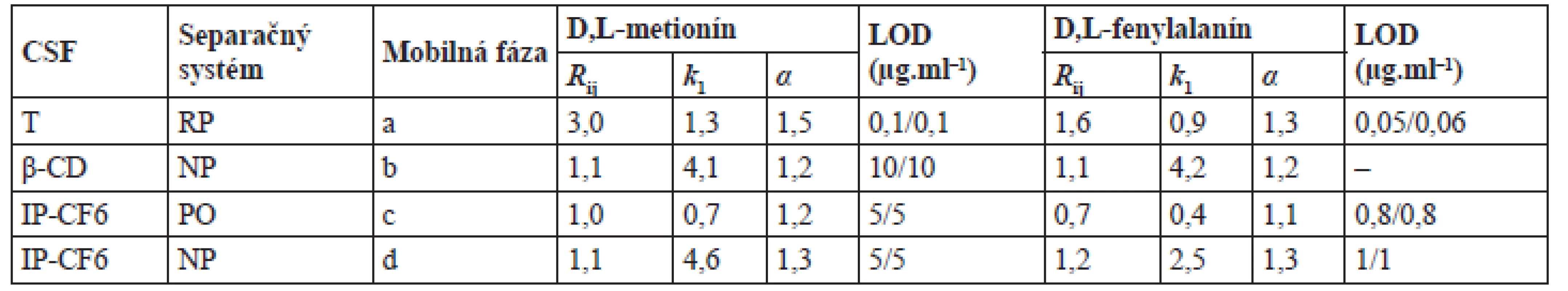
CSF – chirálna stacionárna fáza, T – teikoplanín, IP-CF6 – izopropylkarbamát cyklofruktánu 6, β-CD – β-cyklodextrín, RP – separačný systém s obráteným usporiadaním fáz, NP – separačný systém s konvenčným usporiadaním fáz, PO – polárno-organický separačný systém, Rij – rozlíšenie, k1 – retenčný faktor enantioméru, ktorý eluuje z chromatografickej kolóny ako prvý, α – selektivitný koeficient, LOD – medza detekcie (pre L-enantiomér/D-enantiomér), a – acetonitril/voda (75/25 v/v), 0 ºC; b – etanol/n-hexán/ kyselina trifluórooctová (25/75/0,2 v/v/v), 0 ºC; c – metanol/acetonitril/kyselina octová/trietylamín (75/25/0,3/0,2 v/v/v/v), 0 ºC; d – etanol/n-hexán/kyselina trifluoroctová (60/40/0,1 v/v/v), 0 ºC; RSD(k) ≤ 3,2 %, n = 3 3. Validačné parametre HPLC metódy pre stanovenie enantiomérov metionínu a fenylalanínu 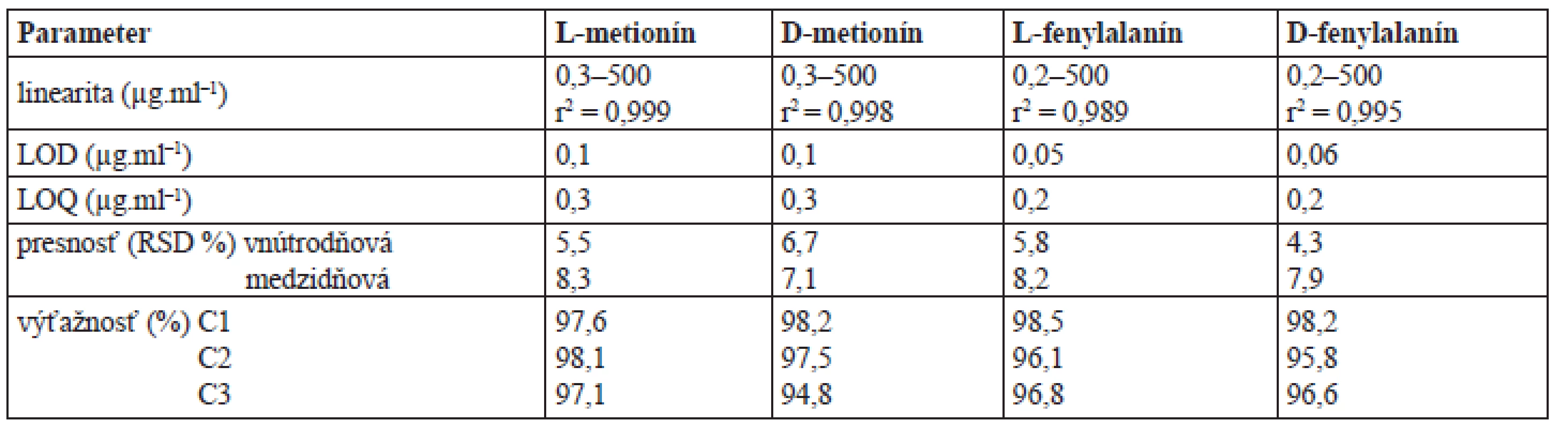
LOQ – medza stanovenia, LOQ – medza detekcie, C1 – 20 mg.g–1 pre D- a L-fenylalanín, 5 mg.g–1 pre D- a L-metionín, C2 – 143 mg.g–1 pre D- a L-fenylalanín, 10 mg.g–1 pre D- a L-metionín, C3 – 357 mg.g–1 pre D- a -fenylalanín, 25 mg.g–1 pre D- a L-metionín 1. Chromatografické záznamy separácie enantomérov D,L-metionínu a D,L-fenylalanínu použitím testovaných chirálnych stacionárnych fáz 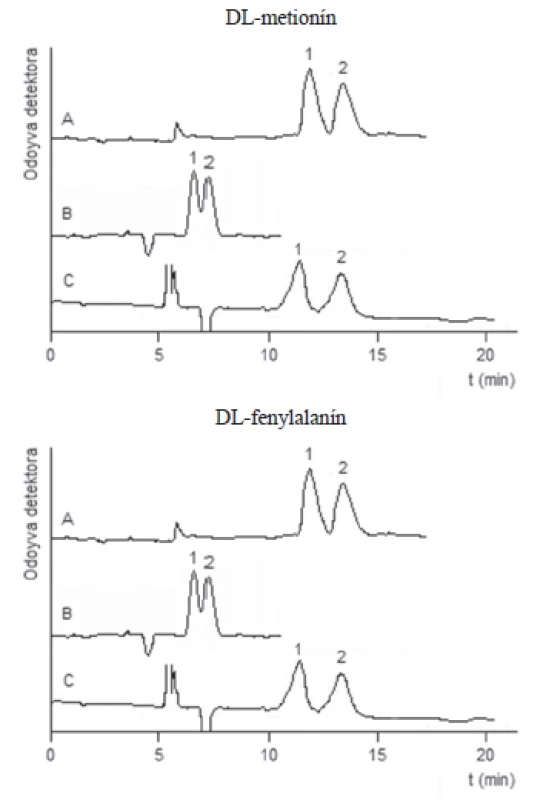
Chromatografické podmienky: (A) Chirobiotic T, mobilná fáza acetonitril/voda (75/25, v/v); (B) IP-CF6, mobilná fáza metanol/acetonitril/kyselina octová/trietylamín (75/25/0,3/0,2, v/v/v/v); (C) IP-CF6, mobilná fáza n-hexán/etanol/kyselina trifluóroctová (50/50/0,1,v v/v); prietok mobilnej fázy: 0,8 ml.min–1; detektor: UV (λ = 210 nm); teplota kolóny: 0 °C. 1 – L-enantiomér, 2 – D-enantiomér Analýza doplnkov výživy s obsahom metionínu a fenylalanínu
Na stanovenie enantiomérov vybraných aminokyselín vo vzorkách doplnkov výživy sa použila HPLC metóda s CSF na základe teikoplanínu v separačnom systéme s obrátenými fázami a so spektrofotometrickou detekciou. Na hodnotenie vhodnosti metódy sa použili parametre, linearita, medza detekcie, medza stanovenia, presnosť a výťažnosť. Pre testované analyty bola výťažnosť viac ako 94 % (RSD < 10 %) (tab. 3). Výsledky dokumentujú, že výťažnosť v uvedenom koncentračnom rozsahu nezávisela od koncentrácie analytov.
Výživový doplnok s obsahom D,L-metionínu (vzorka 1) je doporučený užívať na podporu rastu nechtov a vlasov. Výsledky ukázali, že testovaný výživový doplnok, tak ako uvádza výrobca, obsahuje zmes enantiomérov metionínu (obr. 2). Ďalšími zložkami výživového doplnku boli L-cysteín, vitamíny a iné stopové prvky, ktoré pri použitých separačných podmienkach neinterferovali so žiadnou z enantiomérnych foriem metionínu. V jednej kapsule vzorky 1 sa nachádza 47,5 mg L-metionínu a 46,2 mg D-metionínu (RSD 5 %). Doplnok výživy s obsahom fenylalanínu (vzorka 2) je doporučené používať na zlepšenie pamäti a pri mentálnej únave. Kvantitatívnou analýzou sa zistilo, že v jednej kapsule vzorky 2 sa nachádza 178,1 mg L-fenylalanínu a 177,9 mg D-fenylalanínu (RSD 7 %). Testovaná vzorka výživového doplnku obsahuje zmes enantiomérov, čo dokumentuje obrázok 2. Ďalšie zložky výživového doplnku, pri použitých separačných podmienkach, neinterferovali s enantiomérnými formami fenylalanínu.
2. Chromatogramy separácie extraktov testovaných vzoriek 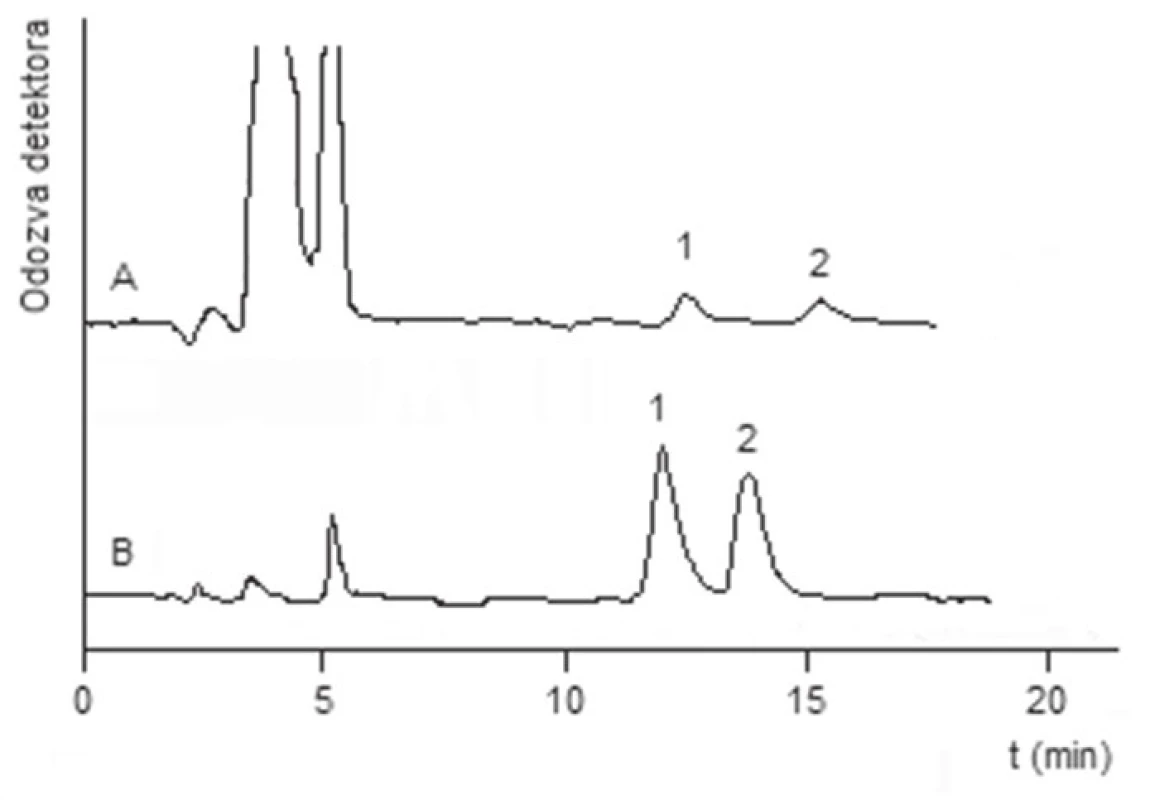
Chromatografické podmienky: Chiroboptic T, mobilná fáza: acetonitril/voda (75/25, v/v); prietok mobilnej fázy: 0,8 ml.min–1; detektor: UV (λ = 210 nm); teplota kolóny: 0 °C. A – vzorka s obsahom metionínu, B – vzorka s obsahom fenylalanínu 1 – L-enantiomér, 2 – D-enantiomér Záver
Aminokyseliny patria medzi jednu z najdôležitejších skupín biologicky aktívnych látok. HPLC enantioseparácia nederivatizovaných aminokyselín sa dosiahla použitím chirálnej stacionárnej fázy na základe I. teikoplanínu v systéme s obrátenými fázami, II. izopropylkarbamát cyclofructánu 6 v systéme s polárno-organickým usporiadaním fáz a III. izopropylkarbamát cyclofructánu 6 v systéme s konvenčným usporiadaním fáz. HPLC-UV metóda s teikoplanínovou CSF sa využila pri analýze vzoriek výživových prípravkov s obsahom D,L-metionínu a D,L-fenylalanínu.
Poďakovanie
Práca vznikla za podpory grantu APVV-15-0355 Agentúry na podporu výskumu a vývoja Autori ďakujú prof. D.W. Armstrongovi za poskytnutie chirálnych stacionárnych fáz Chirobiotic T a IP-CF6.
Stret záujmov: žiadny.
Došlo: 14. marca 2017
Prijato: 11. apríla 2017
doc. Ing. Katarína Hroboňová, PhD.
A. Lomenova
Ústav analytickej chémie Fakulta chemickej a potravinárskej technológie,
Slovenská technická univerzita v Bratislave
Radlinského 9,
812 37 Bratislava,
Slovenská republika
e-mail: katarina.hrobonova@stuba.sk
J. Čižmárik
Katedra farmaceutickej chémie Farmaceutická fakulta,
Univerzita Komenského,
Slovenská republika
J. Lehotay
Katedra chémie,
Fakulta prírodných vied
Univerzita Sv. Cyrila a Metoda v Trnave,
Slovenská republika
Sources
1. Guo M., Shi T., Duan Y., Zhu J., Li J., Cao Y. Investigation of amino acids in wolfberry fruit (Lycium barbarum) by solid-phase extraction and liquid chromatography with precolumn derivatization. J. Food. Compos. Anal. 2015; 42, 84–90.
2. Zahradníčková H., Haratvich P., Holoubek, I. Historie a význam chirálných analýz aminokyselin v biologických matricích a v životním prostředí. Chem. Listy. 2005; 99, 703–710.
3. Brückner H., Westhauser T. Chromatographic determination of L - and D-amino acids in plants. Amino acids 2003; 24, 43–55.
4. Shinitzky M., Nudelman F., Barda Y., Haimovitz R., Chen E., Dealer D. W. Unexpected differences between D - and L - thyrosine lead to chiral enhancement in racemic mixtures dedicated to the memory of Prof. Shneior Lifson – A great liberal thinker. Orig. Life Evol. Biosphere 2002; 32, 285–297.
5. MacDermott A. J. Electroweak enantioselection and the origin of life. Orig. Life Evol. Biosphere 25 (1995) 191–199.
6. Wu G. Amino Acids: Biochemistry and nutrition. Boca Raton: CRC Press 2013.
7. Armstrong D. W., Youbang L., Ekborgott K. A covalently bonded teicoplanin chiral stationary phase for HPLC enantioseparations. Chirality 1995; 7, 474–497.
8. Ilisz I., Berkecz R., Forro E., Fülöp F., Armstrong D.W., Peter A. The role of π-acidic and π-basic chiral stationary phases in the high performance liquid chromatographic enantioseparation of unusual β-amino acids. Chirality 2009; 21, 339–348.
9. Sun P., Armstrong D. W. Effective enantiomeric separations of racemic primary amines by the isopropyl carbamate – cyclofructan 6 chiral stationary phase. J. Chromatogr. A 2010; 1217, 4904–4918.
10. Moravčík J., Hroboňová K. Separácia enantiomérov aminokyselín metódou vysokoúčinnej kvapalinovej chromatografie. Čes. slov. Farm. 2014; 63, 4–12.
11. Armstrong D. W., Tang Y., Chen S., Zhou Y., Bagwill C., Chen J.-R. Macrocyclic antibiotics as a new class of chiral selectors for liquid chromatography. Anal. Chem. 1994; 66, 1473–1484.
12. Berthold A., Chen X., Kullman J. P., Armstrong D. W., Gasparrini F., D’Acquarica I., Villani C., Carotti A. Role of the carbohydrate moieties in chiral recognition on teicoplanin-based LC stationary phases. Anal. Chem. 2000; 72, 1767–1780.
13. Lee S. H., Berthod A., Armstrong D. W. Systematic study on the resolution of derivatized amino acids enantiomers on defferent cyclodextrin-bonded stationarz phases. J. Chromatogr. 1992; 603, 83–94.
Labels
Pharmacy Clinical pharmacology
Article was published inCzech and Slovak Pharmacy

2017 Issue 2-
All articles in this issue
- Separation of phenylalanine and methionine enantiomers by HPLC method: a comparison of stationary phase types
- Targeted drug delivery system: potential application to resveratrol
- The image of a good pharmacist in the works of Saladin di Ascoli and Valerius Cordus
- Mobile applications as good intervention tools for individuals with depression
- Identifying the interprofessional agreement between community pharmacist’s and general practitioner’s views on collaborative practice in Slovakia
- Czech and Slovak Pharmacy
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Targeted drug delivery system: potential application to resveratrol
- Mobile applications as good intervention tools for individuals with depression
- Separation of phenylalanine and methionine enantiomers by HPLC method: a comparison of stationary phase types
- The image of a good pharmacist in the works of Saladin di Ascoli and Valerius Cordus
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

