-
Medical journals
- Career
Fyziologické aspekty lipoxygenázy v signálnych systémoch rastlín
Časť I. Oktadekánová cesta
Authors: Renáta Kollárová; Marek Obložinský; Veronika Kováčiková
Authors‘ workplace: Univerzity Komenského v Bratislave, Farmaceutická fakulta, Katedra bunkovej a molekulárnej biológie liečiv
Published in: Čes. slov. Farm., 2013; 62, 59-64
Category: Review Articles
Overview
Lipoxygenázy (LOX, linoleate: oxygen oxidoreductases, EC 1.13.11.12) tvoria rodinu dioxygenáz, ktoré obsahujú nehémové, nesulfidové železo. Vyskytujú sa nielen u živočíchov, ale aj u rastlín. Ich prítomnosť bola dokázaná aj v koraloch, machu, hubách a v niektorých baktériách. LOX katalyzujú polohovo - a stereo - špecifickú inzerciu molekulového kyslíka do molekuly nenasýtenej mastnej kyseliny s cis,cis-1,4-pentadiénovým systémom za vzniku príslušných hydroperoxidových derivátov. Tento krok dioxygenácie vyúsťuje do kaskády reakcií, ktoré sa označujú ako lipoxygenázová (oktadekánová) cesta. Koncové produkty tejto cesty (nazývané oxylipíny) zohrávajú u rastlín významnú úlohu ako signálne molekuly pri hojení rán a pri obranných procesoch. V živočíšnych organizmoch sú zase zapojené do procesov zápalových reakcií, astmy a ochorení srdca.
Kľúčové slová:
signálny systém • lipoxygenáza • oktadekánová cesta • oxylipínyÚvod – enzýmy signálnych systémov rastlín
Bunky všetkých živých organizmov neustále prijímajú signály z vonkajšieho prostredia. Za účelom rozpoznania a translácie (prekladu) týchto informácií do primeranej odpovede, musí bunka neustále monitorovať svoje vonkajšie prostredie.
Vo všeobecnosti sú externé signály zachytené na povrchu bunky pomocou proteínových receptorov, ktoré transdukujú informácie cez plazmatickú membránu do vnútra bunky a následne aktivujú špecifický sled reakcií. Transmembránová signalizácia môže prebiehať cez iónové kanály, receptorové kinázy alebo receptormi aktivované efektory, ktoré sa zúčastňujú na tvorbe intracelulárnych sekundárnych poslov. V bunke títo poslovia posúvajú informáciu na ďalšie ciele, ktorými môžu byť kinázy na začiatku signálnej kaskády. Kaskáda potom môže aktivovať transkripčné faktory a syntézu proteínov. Výsledkom je odpoveď bunky na vonkajšie podnety, ktorá môže zahŕňať diferenciáciu bunky alebo aktiváciu transkripcie génov1).
Všeobecná charakteristika
Fosfolipidy sú zložené lipidy prítomné vo všetkých živých organizmoch. Spolu s glykolipidmi sú dôležitým stavebným prvkom biologických membrán eukaryotov2). Membránová dvojvrstva je tvorená prevažne štrukturálnymi lipidmi, ako sú fosfatidylcholín alebo fosfatidyletanolamín. Okrem nich sú v membráne prítomné aj prechodne, prípadne v menšej miere sa vyskytujúce lipidy s regulačnými funkciami odvodené od fosfatidylinozitolu – fosfoinozitidy3).
Súčasné vedecké poznatky poukazujú nielen na stavebnú funkciu fosfolipidov, ale čoraz intenzívnejšie sa vyzdvihuje ich úloha v komunikácii bunky s vonkajším prostredím, a v regulácii signálnych dráh. Dôležité signálne molekuly vznikajú modifikáciou štruktúry fosfolipidu na rôznych miestach aktivitou lipidových kináz alebo fosfolipáz, ako pohotová odpoveď organizmu na rozličné bunkové stimuly – elicitory biotického a abiotického pôvodu (obr. 1)4).
Image 1. (Fosfo)lipidová signalizácia v rastlinách (DAG – diacylglycerol, DAGK – diacylglycerolkináza, IP<sub>3</sub> – inozitol-1,4,5-trifosfát, LOX – lipoxygenáza, PA – kyselina fosfatidová, PAP – fosfatáza kyseliny fosfatidovej, PC – fosfatidylcholín, PIP2 – fosfatidylinozitol-4,5-difosfát, PLA – fosfolipáza A, PLC – fosfolipáza C, PLD – fosfolipáza D, PUFA – polynenasýtené mastné kyseliny, ROS – „reactive oxygen species“= reaktívne formy kyslíka) (upravené podľa <sup>38)</sup>) 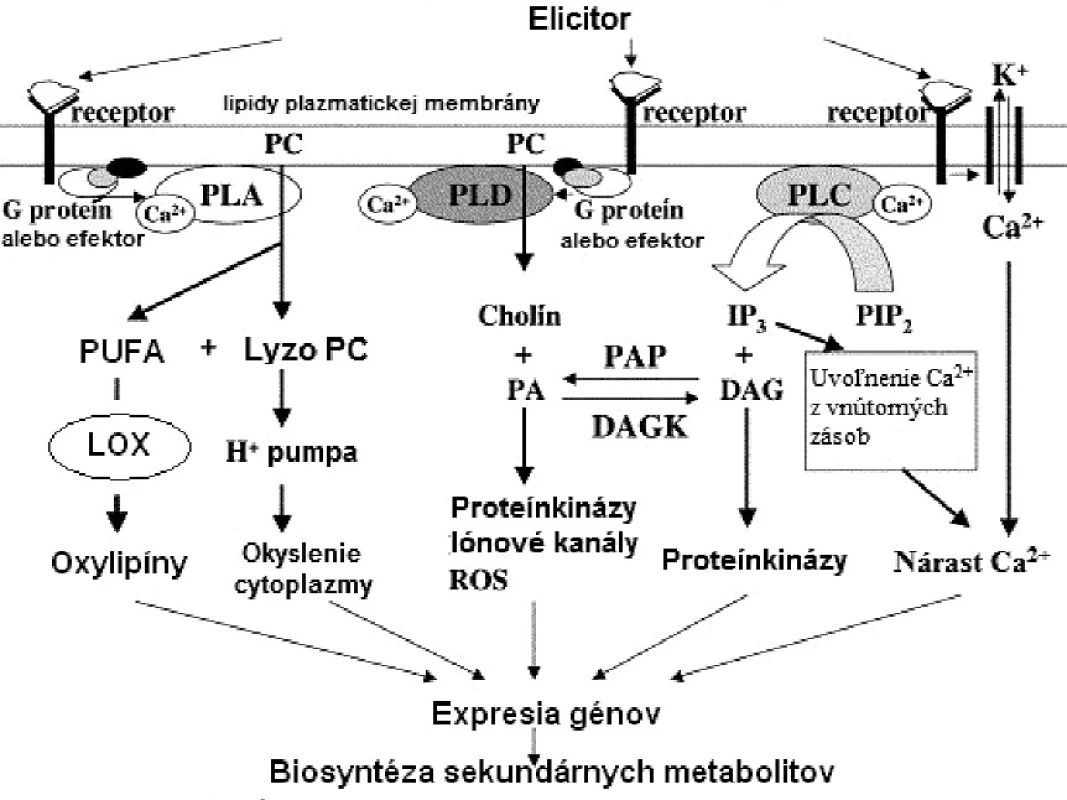
Fosfolipázy sú všadeprítomné enzýmy, ktoré katalyzujú hydrolytické štiepenie diacylglycerolfosfolipidov. Tieto sú derivátmi sn‑glycerol‑3‑fosfátu. Podľa typu esterovej väzby, ktorú fosfolipázy štiepia vo fosfolipidoch ich klasifikujeme do niekoľkých skupín. Medzi acylhydrolázy, ktoré uvoľňujú acylový reťazec v polohe sn-1 resp. sn-2, zaraďujeme fosfolipázu A1 (sn-1, PLA1, EC 3.1.1.32) resp. fosfolipázu A2 (sn-2, PLA2, EC 3.1.1.4). Enzýmy schopné uvoľniť obe acylové skupiny sa nazývajú fosfolipázy B (PLB, EC 3.1.1.5). Medzi fosfodiesterázy patrí fosfolipáza C (PLC, EC 3.1.4.3), ktorá štiepi fosfodiesterovú väzbu fosfolipidu za vzniku diacylglycerolu a fosforylovaného alkoholu, a fosfolipáza D (PLD, EC 3.1.4.4), ktorá uvoľňuje kyselinu fosfatidovú a alkohol5).
Fosforyláciou inozitolového kruhu fosfatidylinozitolu (PI) vznikajú fosfoinozitidy4). Reakcia je katalyzovaná fosfatidylinozitol-kinázami (PI-kinázy: PI-3-kináza, EC 2.7.1.137; PI-4-kináza 2.7.1.67), pričom fosfatidylinozitol-monofosfáty (PI-3-P, PI-4-P) vznikajúce ich aktivitou slúžia ako substráty pre ďalšiu fosforyláciu fosfatidylinozitol-monofosfát-kinázami (PIP-kinázy, EC 2.7.1.68)3).
Na rozdiel od dobre preskúmanej fosfolipidovej signalizácie v živočíšnych systémoch, mechanizmy, ktorými rastliny transdukujú extracelulárne stimuly do bunkovej odpovede sú oveľa menej objasnené. Vzhľadom na všeobecné princípy signalizácie však nie je prekvapujúce, že väčšina živočíšnych mechanizmov je prítomná aj v rastlinách, hoci dôkazy o nich sú často roztrieštené a neúplné.
PLC v živočíšnych bunkách „premieňa“ signály z tyrozínkinázového receptora a receptora spriahnutého s G-proteínom na konkrétny efekt v raste, proliferácii, metabolizme, sekrécii a kontrakcii.
PLD a kyselina fosfatidová sú u živočíchov zapojené napr. do regulácie proteínkináz, PIP-5-kinázy, GTP-viažuceho proteínu, mitogenézy, sekrécie, zhromaždovania aktínu a oxidatívneho vzplanutia v neutrofiloch.
Väčšina komponentov PLC - a PLD-signalizácie má štrukturálne alebo funkčné ekvivalenty aj v rastlinách. PLD sa tak zúčastňuje mnohých fyziologických procesov, ako je starnutie, dozrievanie plodov, stresové odpovede, zranenie, alebo napadnutie rastliny patogénmi1).
PLA2 katalyzuje hydrolýzu esterovej väzby v sn-2 pozícii glycerofosfolipidu, čo vedie k tvorbe lyzofosfolipidu a voľnej mastnej kyseliny (MK)6).
V živočíšnych organizmoch je PLA2 aktivovaná v rôznych typoch buniek v rámci ich odpovede na pôsobenie hormónov a rastových faktorov. Kyselina arachidónová (AA) ako najčastejšie uvoľňovaná MK je oxidatívne transformovaná na bioaktívne molekuly, tzv. eikozanoidy. Eikozanoidy – prostaglandíny a leukotriény vznikajúce aktivitou cyklooxygenázy, resp. lipoxygenázy sú zapojené do zápalových a alergických reakcií v organizme7). Lyzofosfolipidy môžu slúžiť ako prekurzor pre faktor aktivujúci trombocyty (platelet-activating factor, PAF) – fosfoglycerid, ktorý nemá len patologicky význam, ale je dôležitý aj pre fyziologické stavy organizmu, ako je reprodukcia a regulácia krvného tlaku1).
Aktivita PLA2 bola preukázaná aj v bunkových procesoch prebiehajúcich v rastlinách, konkrétne pri raste a vývoji rastliny, stresových odpovediach a v obrannej signalizácii8). PLA2 uvoľňuje v rastlinách kyselinu linolovú (LA) (C18 : 2) a kyselinu linolénovú (LeA) (C18 : 3), ktoré sú enzýmami lipidového metabolizmu v rámci lipoxygenázovej cesty konvertované na rastové regulátory, antimikrobiálne a antifungálne zlúčeniny, aromatické látky a signálne molekuly9).
Lipoxygenázy (LOX, linoleate: oxygen oxidoreductase, EC 1.13.11.12) tvoria rodinu dioxygenáz, ktoré obsahujú v aktívnom mieste nehémové a nesulfidové železo. Tieto enzýmy katalyzujú polohovošpecifickú a stereošpecifickú inzerciu molekulového kyslíka do polynenasýtenej mastnej kyseliny (PUFA) s (1Z,4Z) - -pentadiénovým systémom za vzniku príslušných hydroperoxidových derivátov (obr. 2)10).
Image 2. Hydroperoxidácia (1Z,4Z)-penta-1,4-diénovej štrukturálnej jednotky v alifatickom reťazci MK (R,R´ – alifatický zvyšok, <sub>S,R</sub> – stereošpecifické označenie) 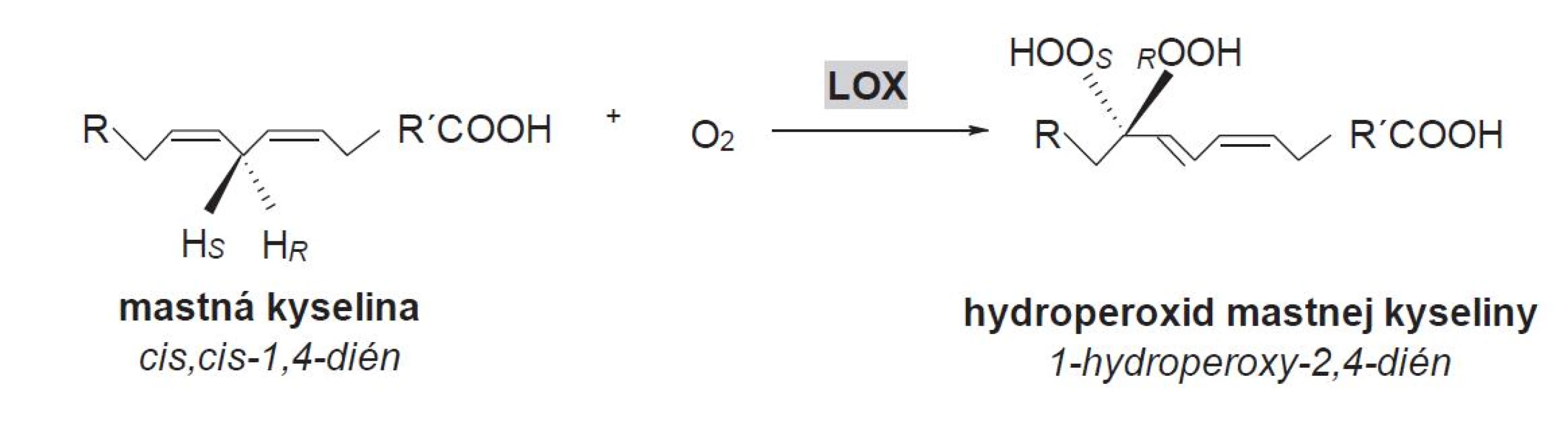
Postavenie LOX v oktadekánovej signálnej ceste
Metabolická cesta PUFA prebiehajúca cez LOX katalyzovanú reakciu ako aj následné reakcie v tejto ceste sa označuje ako oxylipínová cesta: v rastlinách ide o oktadekánovú cestu, v živočíšnych systémoch o eikozanoidnú cestu11). Lipoxygenáza je v rastlinách významným enzýmom, ktorý má dôležité postavenie v transformácii PUFA. Pre ústredné postavenie LOX na začiatku oktadekánovej (lipoxygenázovej) cesty predstavuje tento enzým dôležité miesto regulácie a ovplyvňuje tvorbu produktov tejto cesty12). K najvýznamnejším substrátom LOX v rastlinách patrí LA (C18 : 2) a LeA (C18 : 3) (obr. 3), ktoré sú hlavnými PUFA rastlinných membránových fosfolipidov9). Dlhé obdobie sa PUFA považovali za jediné substráty LOX, ktoré podliehali dioxygenačným reakciám. Avšak štúdie potvrdili, že niektoré LOX sú schopné katalyzovať oxygenáciu esterifikovaných MK, ako sú fosfolipidy a galaktolipidy13), triacylglyceroly14) alebo estery cholesterolu15).
Image 3. Substráty rastlinnej LOX: kyselina linolová a kyselina linolénová 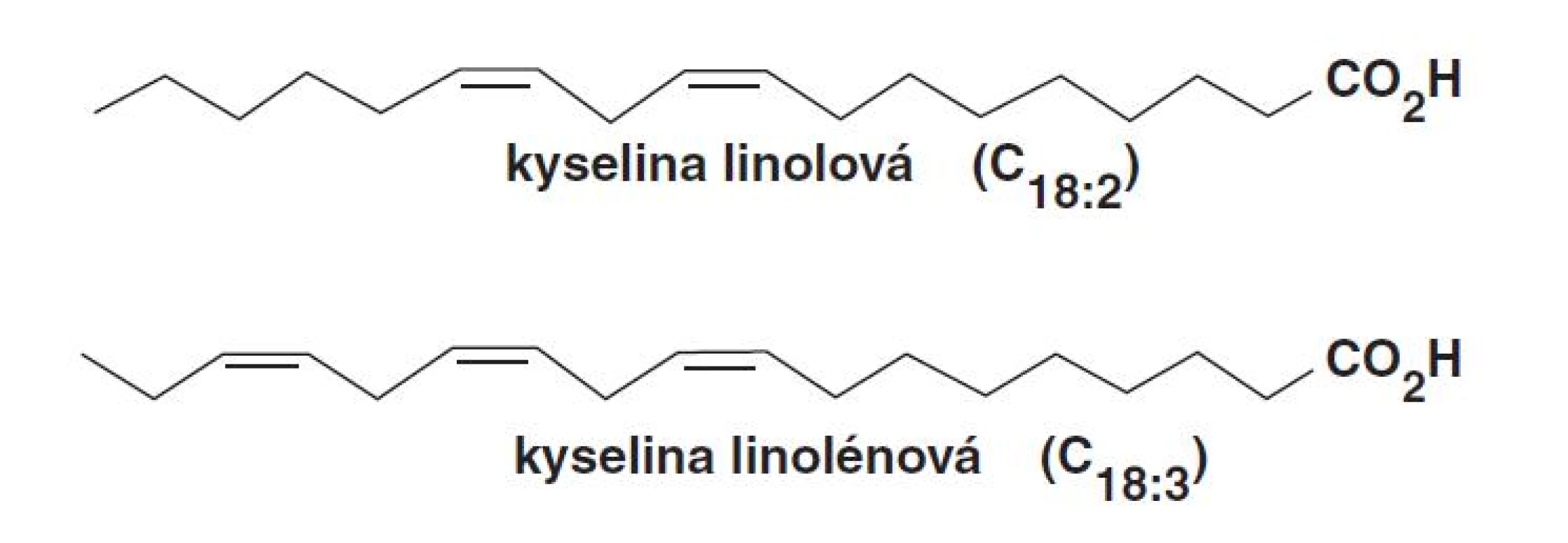
Snaha objasniť signalizačný proces u rastlín vychádza z predpokladanej podobnosti signalizačných procesov živočíšnych a rastlinných buniek. To už viedlo k identifikácii niektorých rastlinných génov so značnou sekvenčnou a funkčnou homológiou s podobnými génmi živočíšnych buniek. Tento prístup viedol k zisteniu, že rastlinné bunky často používajú veľmi podobné signalizačné prvky ako živočíšne bunky.
G-proteín
Na základe poznatkov zo živočíšnych systémov je známe, že mnohé receptory na povrchu bunky odpovedajú na väzbu agonistu aktiváciou G-proteínu. Aktivácia G-proteínu zahŕňa výmenu guanozíndifosfátu (GDP) za guanozíntrifosfát (GTP) na αα-podjednotke a rozlíšenie od βγ-diméru. Obe podjednotky (α - aj βγ-) môžu následne modulovať rôzne cieľové efektory zahŕňajúc PLC, PLD, PLA2, PI‑3‑kinázy, adenylcyklázu a iónové kanály, ktoré sú závislé od špecifickej podjednotky. Aktivácia G‑proteínu poskytuje dôležitý mechanizmus transdukcie informácií do bunky a ich nasmerovanie do špecifických signálnych dráh1).
Napriek tomu, že sa G-proteíny vyskytujú v rastlinách aj u živočíchov, existujú medzi nimi značné rozdiely. Štúdie zamerané na rastlinné G-proteíny z Arabidopsis thaliana a ryže zistili, že rastlinné G-proteíny majú len jednu α-, jednu β-podjednotku a dve γ‑podjednotky. V prípade sóje sa identifikovali štyri α-, štyri β - podjednotky a dve γ‑podjednotky. Na druhej strane, u živočíšnych proteínov je každá podjednotka reprezentovaná viacnásobnými proteínmi, napr. u ľudí sa vyskytuje 23 α-, 5 β-podjednotiek a 12 γ‑podjednotiek16).
Proteínkinázy a fosfoproteínfosfatázy
V membránovej dvojvrstve sú prítomné aj lipidy s dôležitými regulačnými funkciami, a to fosfoinozitidy. Namiesto štrukturálnych úloh sú zapojené do rôznych bunkových procesov, ako je kontrola membránových komunikačných sietí, remodelácia cytoskeletu, transport iónov a signálna transdukcia3).
Fosfoinozitidy môžu byť fosforylované na fosfatidylinozitol-4-fosfát (PI-4-P) aktivitou PI‑4‑kinázy (EC 2.7.1.67) alebo na fosfatidylinozitol-3-fosfát (PI-3-P) prostredníctvom PI‑3‑kinázy (EC 2.7.1.137)17). Prítomnosť enzýmu, ktorý by katalyzoval syntézu PI-5-P, sa zatiaľ v rastlinách nepotvrdila, takže PI-5-P pravdepodobne vzniká defosforyláciou PI‑bisfosfátov4). PI-4-P aj PI-3-P slúžia ako substráty pre ďalšiu fosforyláciu rôznymi typmi fosfatidylinozitol-monofosfát-kinázy (PIP-kináza, EC 2.7.1.68)17).
Vnútrobunkové signálne molekuly
Ca2+ je významným sekundárnym poslom v rastlinných bunkách a mnoho enzýmov, ktoré sú regulované práve prostredníctvom Ca2+, sú zapojené do rozličných procesov v rastlinnej bunke. Intracelulárna koncentrácia Ca2+ sa zvyšuje pôsobením červeného svetla, fungálneho elicitora, fytohormónov a chladom1). V rastlinách boli identifikované aj Ca2+‑kanály, ktoré sú zodpovedné za rýchly a prechodný vzostup hladiny Ca2+ v intracelulárnom priestore. Za spätné vyrovnanie koncentrácie a návrat intracelulárnej hladiny Ca2+ k fyziologickým hodnotám sú zodpovedné ATP-zavislé Ca2+-pumpy a H+/Ca2+-antiportné systémy18).
Fyziologická úloha LOX v rastlinných systémoch
Lipoxygenázová cesta
V rastlinách sú v lipoxygenázovej (oktadekánovej) ceste PUFA metabolizované na hydroperoxidové deriváty za katalytického pôsobenia LOX a následne podliehajú tieto metabolity prostredníctvom ďalších enzýmov degradácii za vzniku aktívnych zlúčenín označovaných ako oxylipíny19). Lipoxygenázová cesta má v rastlinách významné postavenie z hľadiska regulácie viacerých biologických procesov od metabolizmu, reprodukcie cez odpoveď na biotický a abiotický stres až po reguláciu transkripcie génov11).
Biosyntéza oxylipínov je iniciovaná pôsobením lipázy na membránové lipidy, čo vedie k uvoľňovaniu PUFA. Následne dochádza k inzercii molekulového kyslíka do PUFA za katalytického pôsobenia LOX a k vzniku príslušných hydroperoxidových derivátov. V rastlinách sú oxylipíny odvodené z produktov oxidácie LeA a LA11). Hydroperoxidy PUFA sú nakoniec sledom reakcií transformované cez sedem vetiev lipoxygenázovej cesty na významné produkty – oxylipíny. Takto vzniknuté oxylipíny zahŕňajú hydroperoxidy MK, hydroxy-, oxo-, epoxy - alebo keto - zlúčeniny MK, ďalej divinylétery, aldehydy alebo rastlinné hormóny, ako je kyselina jasmónová (JA)20). Tieto zlúčeniny vznikajúce v jednotlivých vetvách lipoxygenázovej cesty sú významné antimikrobiálne a antifungálne látky (aldehydy). Taktiež pôsobia ako signálne molekuly v bunke, ako napríklad JA a od nej odvodené zlúčeniny9).
V rastlinách sú hydroperoxidové deriváty PUFA metabolizované v lipoxygenázovej ceste cez sedem vetiev, ktoré sú pomenované podľa enzýmu zahajujúceho danú vetvu lipoxygenázovej cesty (obr. 4)20).
Image 4. Lipoxygenázová (oktadekánová) cesta (PUFA – polynenasýtené mastné kyseliny, POX – peroxygenáza, DES – divinylétersyntáza, HPL – hydroperoxidlyáza, LOX – lipoxygenáza, EAS – epoxyalkoholsyntáza, AOS – allenoxidsyntáza) 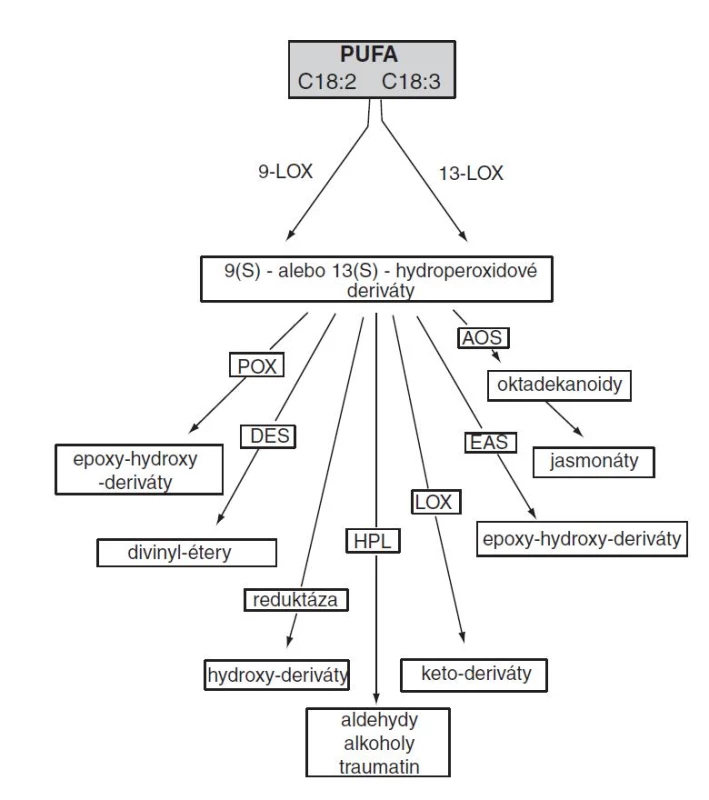
Štyri enzýmy lipoxygenázovej cesty zaraďujeme k atypickej rodine monooxygenáz cytochrómu P450, ktoré sú označované ako CYP74 enzýmy. Enzýmy patriace do tejto rodiny sú allenoxidsyntáza (AOS), hydroperoxidlyáza (HPL), divinylétersyntáza (DES) a epoxyalkoholsyntáza (EAS)21). AOS je klasifikovaná do podrodiny CYP74A alebo CYP74C, HPL sa zaraďuje do podrodiny CYP74B alebo CYP74C, a DES patrí do CYP74D podrodiny. V porovnaní s cytochrómom P450, proteíny z rodiny CYP74 nevyžadujú molekulový kyslík ani NAD(P)H-závislú cytochróm P450-reduktázu ako kofaktor, ale ako substrát a donor kyslíka využívajú hydroperoxidy MK22). CYP74 sa vyznačujú redukovanou afinitou k oxidu uhoľnatému, čím sú podobné ku katalytickým vlastnostiam ostatných P450 ako prostacyklínsyntáza a tromboxánsyntáza v kaskáde AA v živočíšnych systémoch23).
Vetvy lipoxygenázovej cesty
Allenoxidsyntázová vetva
Allenoxidsyntáza (AOS), pôvodne označovaná ako hydroperoxid-dehydratáza, je v rastlinách membránovo-viazaný enzým, ktorý premieňa hydroperoxidy MK na nestabilné epoxidy MK20). Tieto molekuly následne podliehajú neenzýmovej hydrolýze za vzniku α ‑ a γ‑ketolov, alebo sú v chloroplastoch allenoxidcyklázou cyklizované na kyselinu 12‑oxofytodiénovú (OPDA). OPDA je následne transportovaná do peroxizómov, kde je jej cyklopentenónový kruh redukovaný enzýmom OPDA-reduktáza na kyselinu 3‑oxopentenyl-cyklopentan-1-oktánovú (OPC), ktorá po troch cykloch β-oxidácie vytvára konečný produkt tejto vetvy – JA. Tieto metabolity, označované aj ako jasmonáty, sa podieľajú na programovanej bunkovej smrti v mieste poranenia, regulácii rastu a vývoja rastliny, starnutí, expresii génov a zohrávajú úlohu aj v obrane rastliny pred hmyzom a patogénmi11, 24). JA sa využíva aj v ochrane rastlín proti škodcom, nakoľko stimuluje prirodzenú ochranu proti škodcom v rastlinách bez inhibície rastu samotnej rastliny24).
Hydroperoxidlyázová vetva
Hydroperoxidlyáza (HPL), pôvodne označovaná ako hydroperoxid-izomeráza, katalyzuje oxidatívne štiepenie uhľovodíkového reťazca hydroperoxidov MK21). Dochádza k vzniku aldehydov s krátkym reťazcom (C6 - alebo C9-) a C12 - alebo C9-oxo-MK. V zelených rastlinách sú aldehydy zapojené do viacerých procesov, ako je obrana rastliny proti hmyzu, vábenie opeľovačov, komunikácia rastlina – rastlina, interakcia medzi patogénom a rastlinou, odstránenie reaktívneho kyslíka a adaptácia rastliny na environmentálny stres24). Taktiež sú tieto aldehydy a príslušné deriváty alkoholu zodpovedné za vôňu zelených listov, ovocia a zeleniny22). Niektoré štúdie potvrdili prítomnosť HPL ako aj AOS v chloroplastoch listov25).
Divinylétersyntázová vetva
Divinylétersyntáza (DES) katalyzuje premenu hydroperoxidov MK na divinylétery MK20). Oxylipíny získané touto vetvou lipoxygenázovej cesty majú dôležité postavenie v obrane rastliny pred patogénmi26). V rajčiakoch, zemiakoch a tabaku DES uprednostňuje 9‑hydroperoxidy ako substrát, avšak v cesnaku je DES vysokošpecifická pre 13‑hydroperoxidové deriváty25). Zatiaľ čo AOS a HPL sa javia ako všadeprítomné enzýmy v rastlinách, výskyt DES sa potvrdil len v niektorých rastlinných druhoch ako napr. cesnak a semená ľanu, a v čeľadiach Solanaceae a Ranunculaceae20).
Epoxyalkoholsyntázová vetva
Za katalytického pôsobenia epoxyalkoholsyntázy (EAS) nastáva intramolekulové preskupenie hydroperoxidov MK a vznikajú epoxy-hydroxyderiváty MK 27). Produkty tejto vetvy sú identické s produktmi POX vetvy, odlišujú sa od seba len stereochemicky. EAS vetva LOX cesty bola zatiaľ identifikovaná len v čeľadi Solanaceae a predpokladá sa účasť produktov tejto vetvy v obranných procesoch rastliny voči patogénom 28).
Peroxygenázová vetva
Enzým peroxygenáza (POX alebo PXG) nazývaný aj hydroperoxid-izomeráza sa zúčastňuje premeny hydroperoxidov MK na epoxy - alebo dihydrodiol polyénové MK prostredníctvom intramolekulového prenosu kyslíka29). POX je membránovo-viazaný proteín, ktorý obsahuje hém b ako prostetickú skupinu. Napriek tomu, že tento enzým obsahuje hémovú skupinu, nezaraďuje sa do rodiny enzýmov CYP7430). POX sa zúčastňuje na obranných reakciách rastlín pred vplyvom patogénov23).
Lipoxygenázová vetva
Ako už bolo spomínané, v rastlinách majú LOX významné postavenie v lipoxygenázovej ceste a katalyzujú polohovo - a stereo - špecifickú inzerciu molekulového kyslíka do PUFA1). Avšak za určitých podmienok (napr. nízky tlak kyslíka) je LOX schopná katalyzovať homolytické štiepenie O‑O väzby za tvorby alkoxidových radikálov, z ktorých následne vznikajú ketodiény31). Napriek tomu, že ich endogénny výskyt bol popísaný, fyziologická úloha ketodiénov nie je doteraz objasnená23).
Reduktázová vetva
V reduktázovej vetve dochádza k POX-independetnej redukcii hydroperoxidov MK na príslušné hydroxy-deriváty. Mechanizmus tejto redukcie nie je doteraz úplne objasnený, avšak v reakcii sa predpokladá zapojenie glutatiónu23).
Regulácia lipoxygenázovej cesty
Oxylipíny sú lipoxygenázovou cestou produkované zo substrátov ako LA a LeA cez sedem vetiev tejto cesty, pričom ústredné postavenie na začiatku lipoxygenázovej cesty má LOX. Práve LOX, ktorá katalyzuje tvorbu 9 - a 13 - hydroperoxidových derivátov, je hlavným miestom regulácie tejto metabolickej cesty. Rôzna substrátová špecifita, intracelulárna lokalizácia, pH optimum, aktivácia traknskripcie a pletivová špecifita môže ovplyvniť aktiváciu niektorej zo siedmich vetiev lipoxygenázovej cesty23).
Najlepšie preštudovanou vetvou je allenoxidsyntázová vetva vedúca k biosyntéze JA. Väčšina génov, ktoré kódujú enzýmy tejto vetvy, sú regulované procesom poranenia alebo pôsobením jasmonátov. Napríklad v listoch Arabidopsis thaliana je mRNA AOS a allenoxidcykláza (AOC) indukovaná práve poranením32). Podobne aj v listoch rajčiaka a zemiaka dochádza k akumulácii mRNA 13‑LOX, 13-AOS a AOC33).
Novšie štúdie považujú za kľúčový aspekt dostupnosť substrátu, ktorá je významným regulačným aspektom v lipoxygenázovej ceste. Zvýšené hodnoty JA sa zistili pri poranení a pôsobením 13(S)-hydroperoxidu LeA cez 13-AOS vetvu (v tabaku) a cez AOC vetvu (v rajčiaku).
Biosyntéza a pôsobenie JA je regulované niekoľkými faktormi: 1. dostupnosťou substrátu na základe vplyvu vonkajších faktorov, 2. intracelulárnym nedostatkom JA, 3. pletivovo-špecifickou tvorbou a akumuláciou JA, 4. metabolickou transformáciou JA na jej metylester alebo na prchavý degradačný produkt cis-jasmón23).
Hydroperoxidlyázová vetva je pravdepodobne taktiež regulovaná dostupnosťou substrátu34), pričom orgánovo-špecifická a poranením indukovaná aktivácia transkripcie je navzájom prepojená35).
O regulácii ostatných vetiev lipoxygenázovej cesty nie je dostatok informácií a nie sú dostatočne objasnené regulačné mechanizmy. Predpokladá sa, že sú regulované fosforyláciou/defosforyláciou enzýmov36) alebo degradáciou enzýmu ubikvitináciou37).
Skratky
AA kyselina arachidónová
AOC allenoxidcykláza
AOS allenoxidsyntáza
DES divinylétersyntáza
EAS epoxyalkoholsyntáza
GDP guanozíndifosfát
GTP guanozíntrifosfát
HPL hydroperoxidlyáza
JA kyselina jasmónová
LA kyselina linolová
LeA kyselina linolénová
LOX lipoxygenáza
MK mastná kyselina
OPC kyselina 3‑oxopentenyl-cyklopentan-1-oktánová
OPDA kyselina 12‑oxofytodiénová
PAF faktor aktivujúci trombocyty (platelet-activating factor)
PI fosfatidylinozitol
PI-3-kináza fosfatidylinozitol-3-kináza
PI-4-kináza fosfatidylinozitol-4-kináza
PI-3-P fosfatidylinozitol-3-fosfát
PI-4-P fosfatidylinozitol-4-fosfát
PI-5-P fosfatidylinozitol-5-fosfát
PIP-kinázy fosfatidylinozitol-monofosfát-kináza
PLA1 fosfolipáza A1
PLA2 fosfolipáza A2
PLB fosfolipáza B
PLC fosfolipáza C
PLD fosfolipáza D
POX (PXG) peroxygenáza
PUFA polynenasýtená mastná kyselina
Konflikt záujmov: žiadny.
Došlo 5. februára 2013 / Přijato 20. februára 2013
PharmDr. Renáta Kollárová, M. Obložinský, V. Kováčiková
Univerzity Komenského v Bratislave, Farmaceutická fakulta, Katedra bunkovej a molekulárnej biológie liečiv
Kalinčiakova 8, 832 32 Bratislava, Slovenská republika
e-mail: kollarova@fpharm.uniba.sk
Sources
1 Munnik T., Irvine R. F., Musgrave A. Phospholipid signalling in plants. Biochim. Biophys. Acta 1998; 1389, 222–272.
2. De Maria L., Vind J., Oxenboll K. M., Svendsen A., Patkar S. Phospholipases and their industrial applications. Appl. Microbiol. Biotechnol. 2007; 74, 290–300.
3. Heilmann I. Plant Lipid Biochemistry: Phosphoinositide signaling in plants 2010. http://lipidlibrary.aocs.org/plantbio/phosphoinositide/index.htm (28. 1. 2013)
4. Meijer H. J. G., Munnik T. Phospholipid-based signaling in plants. Annu. Rev. Plant Biol. 2003; 54, 265–306.
5. Šimočková M., Griač P. Degradácia fosfolipidov: tvorba nového zo starého. Chem. Listy 2009; 103, 704–711.
6. Lee H. Y., Bahn S. C., Shin J. S., Hwang I., Back K., Doelling J. H., Ryu S. B. Multiple forms of secretory phospholipase A2 in plants. Prog. Lipid Res. 2005; 44, 52–67.
7. Murakami M., Kudo I. Secretory phospholipase A2. Biol. Pharm. Bull. 2004; 27, 1158–1164.
8. Wang X. Lipid signaling. Curr. Opin. Plant Biol. 2004; 7, 329–336.
9. Holková I., Bezáková L., Vanko M., Bilka F., Obložinský M. Lipoxygenázy a ich význam v biochemických procesoch v rastlinných organizmoch. Chem. Listy 2009; 103, 487–495.
10. Andreou A., Feussner I. Lipoxygenases – Structure and reaction mechanism. Phytochemistry 2009; 70, 1504–1510.
11. Chehab E. W., Perea J. V., Gopalan B., Theg S., Dehesh K. Oxylipin pathway in rice and Arabidopsis. J. Integr. Plant Biol. 2007; 49, 43–51.
12. Shibata D., Slusarenko A., Casey R., Hildebrand D., Bell E. Lipoxygenases. Plant Mol. Biol. Rep. 1994; 12, 41–42.
13. Brash A. R. Lipoxygenases: Occurrence, functions, catalysis, and acquisition of substrate. J. Biol. Chem. 1999; 274, 23679–23679.
14. Feussner I., Balkenhohl T. J., Porzel A., Kühn H., Wasternack C. Structural elucidation of oxygenated storage lipids in cucumber cotyledons – implication of lipid body lipoxygenase in lipid mobilization during germination. J. Biol. Chem. 1997; 272, 21635–21641.
15. Belkner J., Stender H., Kühn H. The rabbit 15-lipoxygenase preferentially oxygenates LDL cholesterol esters, and this reaction does not require vitamin E. J. Biol. Chem. 1998; 273, 23225–23232.
16. Pandey S. More (G-proteins) please! Identification of an elaborate network of G‑proteins in soybean. Plant Signal. Behav. 2011; 66, 780–782.
17. Mueller-Roeber B., Pical C. Inositol phospholipid metabolism in Arabidopsis. Characterized and putative isoforms of inositol phospholipid kinase and phosphoinositide-specific phospholipase C. Plant Physiol. 2002; 130, 22–46.
18. Evans N. H., McAinsh M. R., Hetherington A. M. Calcium oscillations in higher plants. Curr. Opin. Plant Biol. 2001; 4, 415–420.
19. Schaller A., Stintzi A. Enzymes in jasmonate biosynthesis - Structure, function, regulation. Phytochemistry 2009; 70, 1532–1538.
20. Andreou A., Brodhun F., Feussner I. Biosynthesis of oxylipins in non-mammals. Prog. Lipid Res. 2009; 48, 148–170.
21. Mosblech A., Feussner I., Heilmann I. Oxylipins: Structurally diverse metabolites from fatty acid oxidation. Plant Physiol. Bioch. 2009; 47, 511–517.
22. Gullner G., Künstler A., Király L., Pogány M., Tóbiás I. Up-regulated expression of lipoxygenase and divinyl ether synthase genes in pepper leaves inoculated with Tobamoviruses. Physiol. Mol. Plant Pathol. 2010; 74, 387–393.
23. Feussner I., Wasternack C. The lipoxygenase pathway. Annu. Rev. Plant Biol. 2002; 53, 275–297.
24. Joo Y.-C., Oh D.-K. Lipoxygenases: Potential starting biocatalysts for the synthesis of signaling compounds. Biotechnol. Adv. 2012; 30, 1524–1532.
25. Farmaki T., Sanmartin M., Jimenez P., Paneque M., Sanz C., Vancanneyt G., Leon J., Sanchez-Serrano J. J. Differential distribution of the lipoxygenase pathway enzymes within potato chloroplasts. J. Exp. Bot. 2007; 58, 555–568.
26. Eschen-Lippold L., Rothe G., Stumpe M., Gobel C., Feussner I., Rosahl S. Reduction of divinyl ether-containing polyunsaturated fatty acids in transgenic potato plants. Phytochemistry 2007; 68, 797–801.
27. Hamberg M. An epoxy alcohol synthase pathway in higher plants: biosynthesis of antifungal trihydroxy oxylipins in leaves of potato. Lipids 1999; 34, 1131–1142.
28. Göbel C., Feussner I., Hamberg M., Rosahl S. Oxylipin profiling in pathogen-infected potato leaves. Biochim. Biophys. Acta 2002; 1584, 55–64.
29. Blée E. Biosynthesis of phytooxylipins: the Peroxygenase pathway. Fett/Lipid 1998; 100, 121–127.
30. Hanano A., Burcklen M., Flenet M., Ivancich A., Louwagie M., Garin J., Blée E. Plant seed peroxygenase is an original heme-oxygenase with EF-hand calcium binding motif. J. Biol. Chem. 2006; 281, 33140–33151.
31. Kühn H., Wiesner R., Rathmann J., Schewe T. Formation of ketodienoic fatty acids by the pure pea lipoxygenase-1. Eicosanoids 1991; 4, 9–14.
32. Laudert D., Weiler E. W. Allene oxide synthase: a major control point in Arabidopsis thaliana octadecanoid signalling. Plant J. 1998; 197, 156–162.
33. Sivasankar S., Sheldrick B., Rothstein S. J. Expression of allene oxide synthase determines defense gene activation in tomato. Plant Physiol. 2000; 122, 1335–1342.
34. Vancanneyt G., Sanz C., Farmaki T., Paneque M., Ortego F., Castanera P., Sanchez-Serrano J. J. Hydroperoxid lyase depletion in transgenic potato plants leads to an increase in aphid performance. Proc. Natl. Acad. Sci. USA. 2001; 98, 8139–8144.
35. Matsui K., Wilkinson J., Hiatt B., Knauf V., Kajiwara T. Molecular cloning and expression of Arabidopsis fatty acid hydroperoxide lyase. Plant Cell Physiol. 1999; 40, 477–481.
36. Leon J., Rojo E., Sanchez-Serrano J. J. Wound signalling in plants. J. Exp. Bot. 2001; 52, 1–9.
37. Xie D. X., Feys B. F., James S., Nietorostro M., Turner J. G. COI1: an Arabidopsis gene required for jasmonate-regulated defense and fertility. Science 1998; 280, 1091–1094.
38. Zhao J., Davis L. C., Verpoorte R. Elicitor signal transduction leading to production of plant secondary metabolites. Biotechnol. Adv. 2005; 23, 283–333.
Labels
Pharmacy Clinical pharmacology
Article was published inCzech and Slovak Pharmacy

2013 Issue 2-
All articles in this issue
-
Fyziologické aspekty lipoxygenázy v signálnych systémoch rastlín
Časť I. Oktadekánová cesta - Pokroky ve využití instrumentálního měření barevnosti ve vývoji, výrobě a v kontrole jakosti léčiv, léčivých přípravků a farmaceutických pomocných látek I
- Vliv stupně substituce na nasákavost kyselé formy karboxymethylcelulosy v podobě netkané textilie
- Hodnocení vlivu sterilizační metody na stabilitu karboxymethylcelulosového krytí na rány
- Prolegomenon of the Czech pharmacognosy: 21st century
- Optimalizace disolučního profilu diklofenaku sodné soli z halloysitových nanotubulů
- Thiosemikarbazony a jejich antimykobakteriální účinky
- Estery aminopyrazinkarboxylové kyseliny jako potenciální antimykobakteriální léčiva
-
Fyziologické aspekty lipoxygenázy v signálnych systémoch rastlín
- Czech and Slovak Pharmacy
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Hodnocení vlivu sterilizační metody na stabilitu karboxymethylcelulosového krytí na rány
- Prolegomenon of the Czech pharmacognosy: 21st century
-
Fyziologické aspekty lipoxygenázy v signálnych systémoch rastlín
Časť I. Oktadekánová cesta - Vliv stupně substituce na nasákavost kyselé formy karboxymethylcelulosy v podobě netkané textilie
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

