-
Medical journals
- Career
Význam genetického polymorfizmu enzýmov cytochrómu P450 – časť I.Enzýmový systém cytochrómu P450 a cytochróm P450 1A2
: Jana Ďuricová; Milan Grundmann
: Ostravská Univerzita v Ostravě, Lékařská fakulta, Ústav klinické farmakologie FN
: Čes. slov. Farm., 2011; 60, 110-115
: Review Articles
Interindividuálna variabilita v odpovedi na liečivo je významným klinickým problémom. Významný podiel na tom májú rozdiely v metabolizme liečiv, jedná sa hlavne o enzýmy cytochrómu P450. Genetický polymorfizmus týchto enzýmov môže ovplyvniť odpoveď pacienta u bežne užívaných liečiv. Cieľom prvej časti tohoto článku je podať stručný výklad o enzýmovom systéme cytochrómu P450 a zároveň popísať vplyv genetického polymorfizmu cytochrómu P450 1A2 na účinok liečiv.
Kľúčové slová:
cytochróm P450 – genetický polymorfizmus – CYP1A2Enzýmový systém cytochrómu P450
Enzymový systém cytochrómu P450 je univerzálnym systémom biotransformačných enzýmov nachádzajúcich sa v baktériách, rastlinách a rôznych živočíšnych druhoch. Pôvodnou funkciou cytochrómu P450 bolo zachovanie integrity bunečnej membrány metabolizmom a biosyntézou steroidov. Neskôr cytochróm P450 prevzal úlohu v zbavovaní sa organizmu cudzorodých látok 1). Enzýmy cytochrómu P450 tvoria superrodinu hemoproteínov. Pojem „cytochróm P450“ vznikol na základe absorbčného píku redukovanej formy enzýmu v komplexe s oxidom uhoľnatým pri vlnovej dĺžke 450 nm 2, 3). Enzýmy cytochrómu P450 sú podľa svojho reakčného mechanizmu často nazývané i oxidázami so zmiešanou funkciou, pretože pri ich metabolickej reakcii sa spotrebováva molekula kyslíka na oxidáciu substrátu.
Na klasifikáciu jednotlivých enzýmov cytochrómu P450 sa využíva podobnosti aminokyselinovej sekvencie. V rámci tejto nomenklatúry sú jednotlivé enzýmy združené v rodinách a subrodinách označované predponou „CYP“. Enzýmy so zhodnosťou v sekvencii aminokyselín 40 % a viac patria do jednej rodiny (značí sa arabským číslom, napr. CYP3). Enzýmy so zhodnosťou sekvencie vyššou než 55 % patria do jednej subrodiny (značia sa veľkým písmenom, napr. CYP3A). Enzýmy, ktorých proteíny sú kódované jednotlivými génmi (označené italikou), sa označujú ako formy alebo izoformy (značia sa arabským číslom za písmenom, napr. CYP3A4). U človeka bolo doteraz popísaných 18 rodín a 44 podrodín. Spomedzi nich rodiny CYP 1, 2 a 3 tvoria 70 % celkového obsahu v pečeni a podieľajú sa v 94 % na metabolizme liečiv v pečeni 2–5). Najvýznamnejších je šesť základných izoenzýmov cytochrómu P450, ide o CYP1A2, CYP2A6, CYP2C9, CYP2C19, CYP2D6, CYP2E1, CYP3A4 a CYP3A5.
Distribúcia enzýmov cytochrómu P450 v organizme človeka je vysoká. Najvyššie hladiny sa nachádzajú v pečeni, významné hladiny sú taktiež v pľúcach, tenkom čreve, ľadvinách, koži, mozgu a nadľadvinkách. V bunke je cytochróm P450 lokalizovaný v hladkom endoplazmatickom retikule a v mitochondriách. Čo sa týka podielu jednotlivých enzýmov z rodín cytochrómu P450 1–3 na celkovom obsahu v pečeni, má najvyššie zastúpenie CYP3A4 s 30 %. Kvantitatívne zastúpenie jednotlivých izoenzýmov v pečeni však nekoreluje s ich významnosťou pre metabolizmus liečiv. Priemerný podiel jednotlivých izoforiem na celkovom obsahu cytochrómu P450 v pečeni a na biotransformácii liečiv je uvedený v tabuľke 1.
1. Priemerný podiel jednotlivých izoforiem na celkovom obsahu cytochrómu P450 v pečeni a na biotransformácii liečiv <sup>4)</sup> 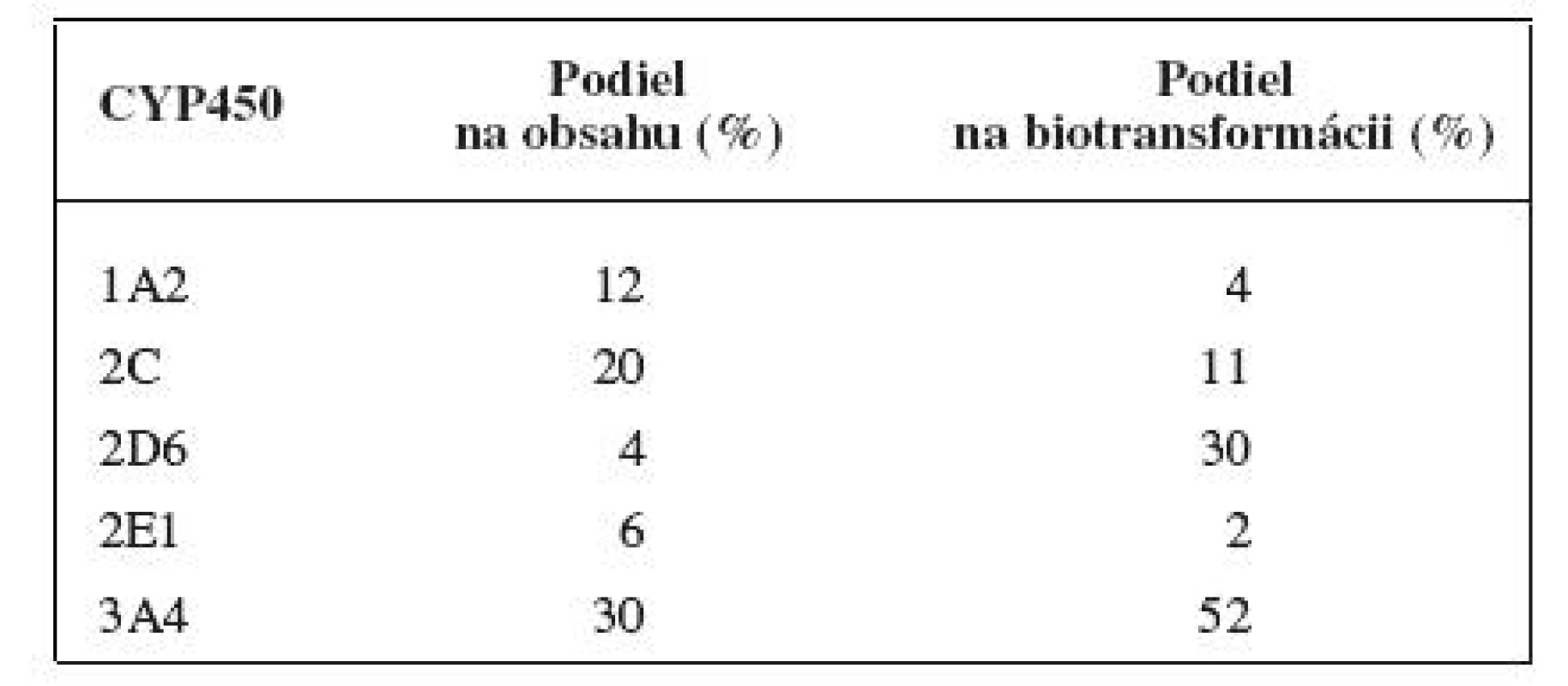
Enzýmový systém cytochrómu P450 je najdôležitejším systémom prvej fáze biotransformačných reakcií. Podieľa sa na metabolizme jak exogénnych, tak i endogénnych látok (tab. 2). Biotransformáciou väčšinou mení lipofilné látky na hydrofilné či polárne, ktoré môžu byť z organizmu následne vylúčené. Pri metabolizme niektorých látok však dochádza naopak k ich aktivácii. Niektoré cytochrómy P450 sú dokonca zodpovedné za iniciáciu kancerogenézie 2, 6). Pre enzýmovú aktivitu je nutný nielen cytochróm P450, ale i ďalší enzým NADPH-cytochróm P450 reduktáza a fosfolipidová frakcia membrán. Uvedené tri súčasti tvoria mikrozomálny cytochrómový monooxygenázový systém. Centrálnym enzýmom monooxygenázového systému je cytochróm P450. Typickou reakciou katalyzovanou monooxygenázovým systémom je:
RH + 02 + NADPH + H+ → ROH + H2O + NADP+.
2. Endogénne substráty cytochrómu P450 <sup>7)</sup> 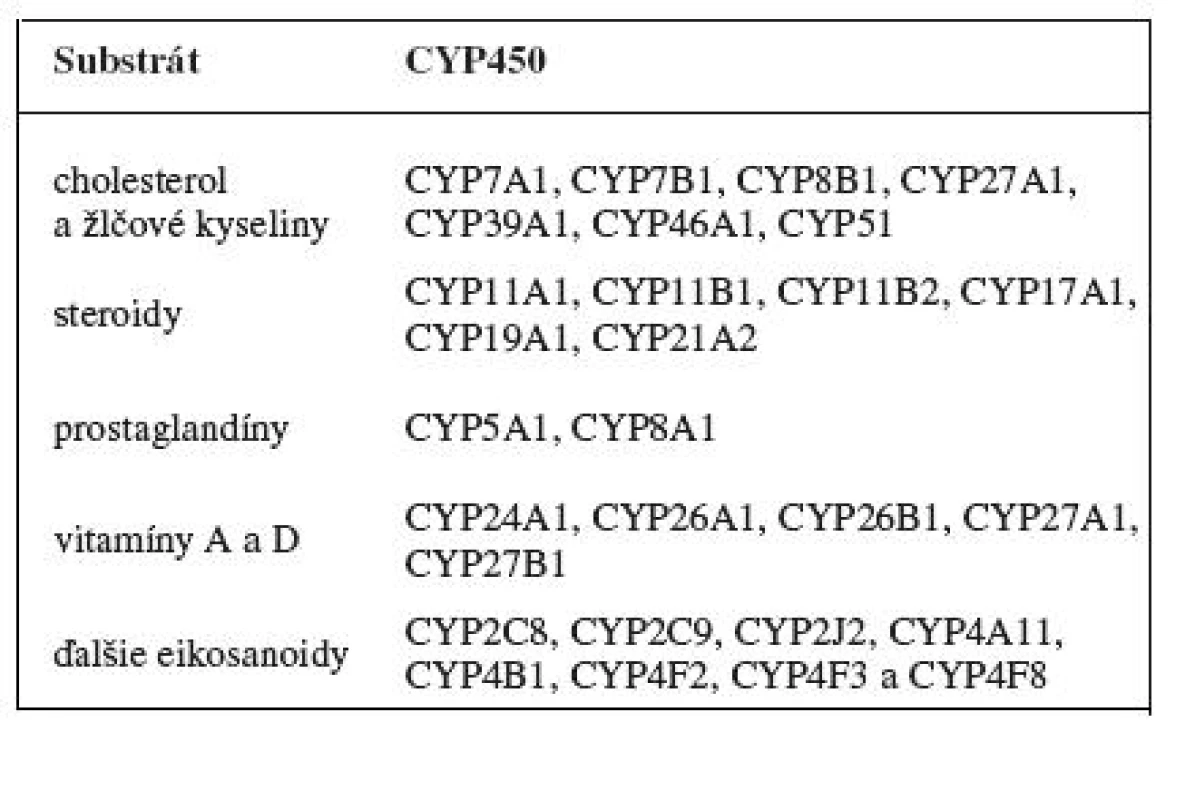
Aktíve miesto cytochrómu P450 obsahuje atóm železa, ktorý sa v oxidovanej forme (Fe3+) viaže so substrátom. Dochádza k redukcii (Fe2+) komplexu enzým-substrát prenosom elektrónu z NADPH. Tento redukovaný komplex viaže molekulárny kyslík a je následne redukovaný ďalším elektrónom. Komplex enzým – substrát – kyslík sa nakoniec štiepi na vodu, oxidovaný substrát a oxidovanú formu enzýmu. Enzýmy cytochrómu P450 katalyzujú rozmanité chemické reakcie ako N-dealkyláciu, O-dealkyláciu, S-oxidáciu, epoxidáciu a hydroxyláciu. Enzýmy cytochrómu P450 majú rozličnú ale často sa prekrývajúcu substrátovú špecificitu, vykazujú veľkú variabilitu v katalytickej účinnosti a regulácii medzi jednotlivými živočíšnymi druhmi i v rámci nich. Na metabolizme jedného liečiva sa môže podieľať i viacero enzýmov cytochrómu P450 3–5, 7).
Na rozdiel od enzýmov cytochrómu P450 podieľajúcich sa na metabolizme endogénnych látok, aktivita enzýmov cytochrómu P450 metabolizujúcich látky exogénne môže významne kolísať 8). Rozdiely v hladinách a aktivitách týchto enzýmov môžu viesť k rozdielnym plazmatickým hladinám liečiv medzi jednotlivými pacientmi, a tým k rozdielnym odpovediam na liek (nedostatočný alebo nadmerný účinok lieku). Tieto odlišnosti v metabolickej aktivite enzýmov cytochrómu P450 môžu byť spôsobené faktormi genetickými (genetický polymorfizmus) a negenetickými (pohlavie, rasa, patologický stav a faktory prostredia ako fajčenie a expozícia rôznym látkam).
Genetické faktory variability
Dnes je už známe, že veľký podiel v rozdielnej odpovedi na liek zohráva dedičnosť. Polymorfizmus v géne kódujúcom metabolické enzýmy má významnú úlohu, je obecne definovaný ako genetické rozdiely vyskytujúce sa medzi jednotlivcami v incidencii > 1% 9) . Pre genetický polymorfizmus v biotransformácii liečiv sú podstatné génové mutácie. Ich podkladom môže byť zámena, chýbanie, vsunutie jedného alebo viacerých nukleotidov, duplifikácia alebo amplifikácia genómu. Genetické rozdiely tvoria významnú príčinu variability hlavne u CYP2D6, CYP2C9 a CYP2C19. Aktivita týchto enzýmov je polymorficky distribuovaná v populácii a závisí na prítomnosti a počte alelických variant 10–12). CYP3A4 a CYP1A2 sa vyznačujú veľkou inter - a intraindividuálnou variabilitou, ktorá je výsledkom konštitučných a enviromentálnych faktorov 13). Najčastejšie sa vyskytujúca alela pre každý enzým („wild type“) je označovaná *1. Alelické varianty sú následne označované podľa ich identifikácie (napr. *2, *3 atď.). Súčasný prehľad alelických variant je na webových stránkach http://cypalleles.ki.se 14). Funkčný význam jednotlivých alelických variant sa líši, je taktiež odlišná ich frekvencia distribúcie medzi jednotlivými etnickými skupinami 15). Enzymový defekt prejavujúci sa zmenou v metabolickej aktivite je v populácii prenášaný autozomálne recesívne, prejavy sú preto najvýraznejšie u homozygotov pre defektný gén. Na základe stupňa aktivity enzýmov cytochrómu P450 možno rozdeliť populáciu do štyroch metabolických skupín: 1. pomalí metabolizátori (PM), 2. intermediárni metabolizátori (IM), 3. extenzívni metabolizátori (EM) a 4. ultrarýchli metabolizátori (UM). PM sú jedinci, ktorí postrádajú funkčný enzým, a majú teda najnižšiu metabolickú aktivitu. Sú vystavení vyššiemu riziku toxicity následkom vysokých hladín nezmetabolizovaného liečiva, alebo je u nich naopak riziko zlyhania terapie v prípade užívania liečiv, ktoré vyžadujú pre svoj účinok metabolickú premenu. IM sú nositeľmi buď jednej nefunkčnej variantnej alely (heterozygoti), alebo nositeľmi dvoch variantných aliel so zníženou metabolickou aktivitou. Väčšinu populácie tvoria EM, ktorí majú dve funkčné (normálne) alely. UM vykazujú najvyššiu metabolickú aktivitu v dôsledku duplifikácie alebo amplifikácie génu. Metabolizujú liečivá rýchlejšie než EM a môžu vyžadovať vyššie než bežné dávky liečiva, aby dosiahli terapeutické plazmatické koncentrácie 11, 16). Výsledný účinok polymorfizmu na metabolizme liečiva závisí na množstve enzýmov, ktoré sa na premene liečiva podieľajú. Enzýmy cytochrómu P450 majú obecne širokú substrátovú špecificitu, čo znamená, že sa na metabolizme určitého lieku môže zúčastniť niekoľko enzýmov cytochrómu P450. V prípade, že je metabolizmus liečiva závislý principiálne na jednej izoforme, genetický polymorfizmus môže viesť k významnej zmene účinku tohto liečiva (hlavne u liečiv s úzkym terapeutickým indexom). Naopak tam, kde sa na metabolizme podieľajú viaceré formy cytochrómu P450, môžu ostatné enzýmy prevziať úlohu v metabolizme daného liečiva. Nie vždy však musí alternativná metabolická cesta plne nahradiť tú nefunkčnú 12, 17).
Negenetické faktory variability
Hoci genetický polymorfizmus enzýmov cytochrómu P450 má veľký dopad na biotransformáciu liečiv, genetika sama o sebe nevysvetľuje všetku variabilitu 18). Rozdielnu biotrasformáciu možno pozorovať aj v rámci jednej genotypovej skupiny. Pekným príkladom je práca Aklillu et al. poukazujúca na vplyv faktorov prostredia na zmenu aktivity enzýmu CYP2D6 u populácie Étiopčanov po presťahovaní do Švédska 19). Metabolickú aktivitu enzýmov cytochrómu P450 môže ovplyvniť pohlavie 20), patologický stav 21), zmena fyziologického stavu (tehotenstvo) 22) a faktory prostredia ako fajčenie 23) a expozícia rôznym látkam (potrava, liečiva ...). Je známych veľa príkladov interakcií niektorých potravín 24, 25) a liečiv 26, 27) s enzýmami cytochrómu P450, následkom ktorých došlo ku klinicky významnej inhibícii či indukcii metabolickej aktivity daného enzýmu.
Enzýmová indukcia
Niektoré liečivá i zložky potravy vyvolávajú zvýšenú enzymatickú aktivitu, indukciu. Dôsledkom enzýmovej indukcie po opakovanom podaní látky je zrýchlenie biotransformácie, zníženie plazmatických hladin a terapeutického účinku daného liečiva. K tejto situácii dochádza v prípade, pokiaľ metabolity liečiva majú malý alebo žiaden farmakologický účinok. Pokiaľ majú metabolity väčší účinok, resp. vyššiu toxicitu, môže dôjsť pri enzýmovej indukcii k prejavom intoxikácie.
Enzýmová inhibícia
Niektoré liečivá i zložky potravy naopak enzýmovú aktivitu tĺmia, inhibujú. Najčastejšie sa jedná o reverzibilnú inhibíciu. Výsledkom inhibície biotransformačných procesov je väčšinou predĺženie farmakologického účinku zvýšením plazmatických hladin daného liečiva s možnými prejavmi intoxikácie. V prípade, že sa jedná o neaktívne liečivo (proliečivo), ktoré sa potrebuje transformovať na aktívnu formu, môže naopak následkom inhibície dôjsť ku zlyhaniu terapeutického účinku.
Stanovenie biotransformačnej aktivity
Na predikciu individuálnej biotransformačnej kapacity sa používa metóda genotypovania a fenotypovania. Genotyp možno určiť analýzou DNA, použitím metódy PCR (polymerázová reťazová reakcia) a RFLP (polymorfizmus dĺžky restrikčných fragmentov). Novou alternativou genotypizácie je AmpliChip P450 test (Roche), prvý mikroanalytický farmakogenetický test. Jedná sa o prvý systém založený na znalosti časti ľudského genómu určený pre rutinnú diagnostiku využívajúci dve moderné technológie Roche PCR a Affymetrix mikroanalytiku. Poskytuje kompletnú gynotypizáciu génov CYP2C19 a CYP2D6 28). Výsledok genotypovania však nie je ovplyvniteľný faktormi prostredia. Navyše citlivosť genotypovania v predikcii výskytu ultrarychlých metabolizátorov je stále nízka. Fenotypovanie je založené na podaní látky, ktorá je pre určitý enzým vysoko špecifická (substrátová látka, probe drug), je teda týmto enzýmom exkluzívne metabolizovaná. Výsledná metabolická aktivita sa stanoví z metabolického pomeru MR (materská látka/metabolit) v krvi či v moči a rozdelí populáciu do odpovedajúcich skupín. Pomalý metabolizátori majú najvyššiu hodnotu MR, naopak ultrarýchli metabolizátori vykazujú najnižšiu hodnotu MR. Fenotypovanie umožňuje stanovenie aktuálnej enzymatickej aktivity in vivo, pretože zohľadňuje i vplyv faktorov prostredia 12).
Cytochróm P450 1A2
Zástupci podrodiny CYP1A, enzýmy CYP1A1 a CYP1A2, majú významnú úlohu v biotransformácii xenobiotik, vrátane xenobiotik bežne sa nachádzajúcich v potrave a škodlivinách životného prostredia. Oba enzýmy sa podieľajú na aktivácii niekoľkých prekarcinogénov, ako sú polyaromatické hydrouľovodíky, aromatické a heterocyklické amíny a mykotoxíny. Enzým CYP1A1 sa nachádza prevážne extrahepatálne, naopak, enzým CYP1A2 sa vyskytuje hlavne v pečeni 2).
Enzým CYP1A2 vykazuje vysoký stupeň interindividuálnej variability. Jednou z príčin veľkej variability je vysoká inducibilita CYP1A2, na ktorej sa okrem xenobiotík, podieľajú i zložky potravy a fajčenie. Hlúbovitá zelenina (kapusta, brokolica, karfiol a ružičkový kel ...) je známa zvýšením aktivity enzýmu CYP1A2. Aktivita enzýmu CYP1A2 je taktiež indukovaná heterocyklickými amínmi a polycyklickými aromatickými uhľovodíkmi, ktoré sa nachádzajú napríklad v mäse upravenom za vyšších teplôt na drevenom uhlí 24). Ďalším faktorom variability CYP1A2 aktivity je genetický polymorfizmus 29). Výskyt mnohých polymorfných aliel je zriedkavý a ich funkčný význam na aktivitu enzýmu CYP1A2 nie je známy (tab. 3). Alela CYP1A2*1F je najčastejšie sa vyskytujúcou alelou v Európskej populácii (55,9 % výskyt vo švédskej populácii). Táto alela je u fajčiarov spojovaná s významne vyššou enzymatickou aktivitou, u nefajčiarov nemá prítomnosť tejto alely na aktivitu CYP1A2 vplyv 30, 31). Polymorfné alely CYP1A2 *1C a *1K sú spojované so zníženou aktivitou CYP1A2, prvá z aliel bola nájdená v japonskej populácii s frekvenciou výskytu okolo 23 %, druhá allela bola objavená v étiopskej populácii, vo švedskej populácii je jej výskyt vzácny 32, 33). Medzi etnikami existujú významné rozdiely v aktivite CYP1A2. Švédská populácia má 1,54krát vyššiu CYP1A2 aktivitu v porovnaní s Korejcami 30). Nižšia CYP1A2 aktivita bola nájdená u ázijskej a africkej populácie v porovnaní s belošskou populáciou 34).
3. Aktivita variantných aleliel CYP1A2 in vivo a výskyt v populácii <sup>14, 30, 33, 35)</sup> 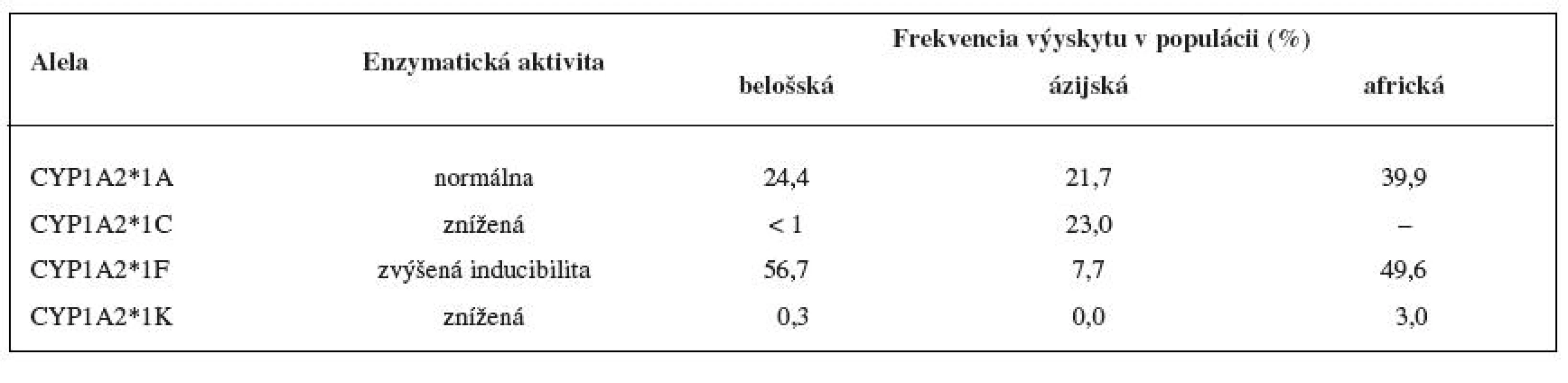
Teofylín
V poslednej dobe bolo publikovaných niekoľko prací, ktoré sledovali vplyv polymorfizmu CYP1A2 na hladiny a účinok liečiv, prípadne výskyt nežiadúcich účinkov. Uslu et al. vo svojej práci skúmali vplyv polymorfizmu na metabolizmus teofylinu u pacientov s chronickou obstrukčnou bronchopulmonálnou chorobou. Jedinci, ktorí boli nositeľmi CYP1A2*1D a CYP1A2*1F variatných aliel, mali významne nižšie hladiny teofylinu v porovnaní s ostatnými pacientmi 36). Naopak prítomnosť CYP1A2*1C variatnej alely bola spojená s nižšou clearance teofylinu u astmatických pacientov 37).
Antipsychotiká
Rezistencia na terapiu klozapínom bola popísaná u schizofrénnych pacientov fajčiarov, ktorí boli nositeľmi variatnej alely CYP1A2*1F. Tento polymorfizmus v kombinácii s fajčením viedol k ultrarýchlemu metabolizmu a nízkým hladinám klozapínu s následným zlyhaním účinku antipsychotika. Po zvýšení dávky klozapínu alebo nasadení inhibítora CYP1A2 (fluvoxamín) došlo ku zlepšeniu klinického stavu pacientov 38, 39). Výskyt nežiadúcich účinkov z dôvodu zvýšenia hladiny klozapínu bol popísaný u pacientov, ktorý prestali fajčiť. Pacienti boli nositeľmi variatnej alely CYP1A2 *1F, a tým, že prestali fajčiť, došlo u nich k spomaleniu aktivity metabolického enzýmu 40). V inej práci naopak nebol potvrdený vzťah medzi CYP1A2*1F polymorfizmom, aktivitou enzýmu a hladinou klozapínu v skupine fajčiarov 41, 42). Vplyv CYP1A2 genotypu je popísaný i u ďalšieho antipsychotika olanzapínu 43). Clearance olanzapínu korelovala s aktivitou enzýmu CYP1A2 stanovenou pomocou kofeínu ako substrátovej látky u zdravých dobrovoľníkov 44).
Ostatné látky
U pacientov užívajúcich antireumatikum leflunomid s genotypom CYP1A2*1F CC bolo pozorované 9,7násobne vyššie riziko toxicity v porovnaní s pacientmi s CYP1A2*1F A alelou 45).
4. Príklady substrátov, inhibítorov a induktorov enzýmu CYP1A2 
Enzým CYP1A2 je hlavným enzýmom v metabolizme kofeínu, ktorý je zároveň využívaný ako substrátová látka pre stanovenie fenotypu CYP1A2 46). Pomalí metabolizátori mali vyššie riziko výskytu hypertenzie v spojení s pitím kávy 47) a dokonca vyššie riziko nefatálneho infarktu myokardu 48).
ZÁVER
Enzýmy cytochrómu P450 sú dôležitým systémom prvej fáze biotransformácie exogénnych látok. Aktivitu biotransformačných enzýmov môže ovplyvniť celá škála faktorov, významnú úlohu zohráva genetický polymorfizmus. Enzým CYP1A2 sa zúčastňuje na biotransformácii niekoľkých bežne užívaných liečiv. Aktivita tohto enzýmu je vysoko variabilná. Zdá sa však, že samotný polymorfizmus nevysvetľuje dostatočne významné rozdiely medzi jednotlivcami, významný podiel na aktivite tak budú zohrávať faktory prostredia.
Adresa pro korespondenci:
Mgr. Jana Ďuricová
Ústav klinické farmakologie LF OU
17. listopadu 1790, 708 52 Ostrava
e-mail: jana.duricova@fno.cz
Sources
1. Gonzalez, F. J., Gelboin, H. V.: Human Cytochrome P450: Evolution and cDNA-directed expression. Environ. Health Perspect. 1992; 98, 81–85.
2. Omiecinski, C. J., Remmel, R. P., Hosagrahara, V.P.: Concise review of the cytochrome P450s and their roles in toxicology. Toxicol. Sci. 1999; 48, 151–156.
3. Chang, G. W., Kam, P. C.: The physiological and pharmacological roles of cytochrome P450 isoenzymes. Anaesthesia 1999; 54, 42–50.
4. Anzenbacher, P, Anzenbacherová, E.: Cytochromes P450 and metabolism of xenobiotics. Cell. Mol. Life. Sci. 2001; 58, 737–747.
5. Guengerich, F. P.: Cytochrome P450: What have we learned and what are the future issues? Drug. Metab. Rev. 2004; 36, 159–197.
6. Soucek, P., Gut, I.: Co je to cytochrom P 450? Enzymatické formy cytochromu P450 – dosažený stupeň znalostí. Cas. Lek. Cesk. 1993; 12, 353–358.
7. Guengerich, F. P.: Cytochromes P450, drugs and diseases. Mol. Interv. 2003; 3, 194–204.
8. Guengerich, F. P.: Cytochrome P450s and other enzymes in drug metabolism and toxicity. The APPS J. 2006; 8, E101–110.
9. Guengerich, F. P.: Update information on human P450s. Drug. Metab. Rev. 2002; 34, 7–15.
10. Güzey, C., Spigset, O.: Genotyping as a tool to predict adverse drug reactions. Curr. TP. Med. Chem. 2004; 4, 1411–1421.
11. Rogers, J. F., Nafzinger, A. N., Bertino, J. S.: Pharmacogenetics affects dosing, efficacy, and toxicity of cytochrome P450 – metabolized drugs. Am. J. Med. 2002; 113, 746–750.
12. Buzková, H., Pechandová, K., Slanař, O., Perlík, F.: Genetic polymorphism of cytochrome P450 and methods for its determination. Prague. Med. Rep. 2006; 107 : 383–393.
13. Dahl, M. L.: Cytochrome P450 phenotyping/genotyping in patients receiving antipsychotics. Useful aid to Prescribing? Clin. Pharmacokinet. 2002; 41, 453–470.
14. Home page of the human cytochrome P450 (CYP 2D6) allele nomenclature (updated 2010 July 20). Available from: http://www.cypalleles.ki.se/cyp2d6.htm
15. Bertilsson, L.: Geographical/interracial differences in polymorphic drug oxidation. Current state of knowledge of cytochromes P450 (CYP) 2D6 and 2C19. Clin. Pharmacokinet. 1995; 29, 192–209.
16. Ingelman-Sundberg, M.: Pharmacogenetics of cytochrome P450 and its applications in drug therapy: the past, present and future. Trends. Pharmacol. Sci. 2004; 25, 193–200.
17. Pirmohamed, M., Park, B. K.: Cytochrome P450 enzyme polymorphisms and adverse drug reactions. Toxicology 2003; 192, 23–32.
18. Steiner, E., Iselius, L., Alván, G., Lindsten, J., Sjöqvist, F.: A family study of genetic and environmental factors determing polymorphic hydroxylation of debrisoquin. Clin. Pharmacol. Ther. 1985; 38, 394–401.
19. Aklillu, E., Herrlin, K., Gustafsson, L. L., Bertilsson, L., Ingelman-Sundberg, M.: Evidence for environmental influence on CYP2D6-cataysed debrisoquine hydroxylation as demonstrated by phenotyping and genotyping of Ethiopians living or in Sweden. Pharmacogenetics 2002; 12, 375–383.
20. Wolbold, R., Klein, K., Burk, O., Nüssler, A. K., Neuhaus, P., Eichelbaum, M., Schwab, M., Zanger, U. M.: Sex is a major determinant of CYP3A4 expression in human liver. Hepatology 2003; 38, 978–988.
21. Villeneuve, J. P., Pichette, V.: Cytochrome P450 and liver diseases. Curr. Drug. Metab. 2004; 5, 273–282.
22. Tracy, T. S., Venkataramanan, R., Glover, D., Caritis, S. N.: Temporal changes in drug metabolism (CYP1A2, CYP2D6 and CYP3A4 activity) during pregnancy. Am J Obstet. Gynecol. 2005; 192, 633–639.
23. Schaffer, S. D., Yoon, S., Zadezensky, I.: A review of smoking cessation: potentially risky effects on prescribed medications. J. Clin. Nurs. 2009; 18, 1533–1540.
24. Nekvidová, J., Anzenbacher, P.: Interactions of food and dietary supplements with drug metabolising cytochrome P450 enzymes. Ces slov. Farm. 2007; 56, 165–173.
25. Guengerich, F. P.: Influence of nutrients and other dietary materials on cytochrome P-450 enzymes. Am. J. Clin. Nutr. 1995; 61, 651–658.
26. Tanaka E., Hisawa S.: Clinically significant pharmacokinetic drug interactions with psychoactive drugs: antidepressants and antipsychotics and the cytochrome P450 system. J. Clin. Pharm. Ther. 1999; 24, 7–16.
27. Perucca, E.: Clinically relevant drug interactions with antiepileptic drugs. Br. J. Clin. Pharmacol. 2005; 61, 246–255.
28. Jain, K. K.: Applications of AmpliChip CYP450. Mol. Diagn. 2005; 9, 119–127.
29. Pucci, L., Geppetti, A., Maggini, V., Lucchesi, D., Maria Rossi A., Longo V.: CYP1A2 F21L and F186L polymorphisms in an Italian population sample. Drug Metab. Pharmacokinet. 2007; 22, 220–222.
30. Ghotbi, R., Christensen, M., Roh, H., Ingelman-Sundberg M., Aklillu E, Bertilsson L.: Comparisons of CYP1A2 genetic polymorphisms, enzyme activity and the genotype-phenotype relationship in Swedes and Koreans. Eur. J. Clin. Pharmacol. 2007; 63, 537–546.
31. Sachse, C., Brockmöller, J., Bauer, S., Roots, I.: Functional signifance of a C→A polymorphism in intron I of the cytochrome P450 CYP1A2 gene tested with caffeine. Br. J. Clin. Pharmacol. 1999; 47, 445–449.
32. Nakajima, M., Yokoi, T., Mizutani, M., Kinoshita, M., Funayama, M., Kamataki, T.: Genetic polymorphism in the 5’-flanking region of human CYP1A2 gene: effect on the CYP1A2 inducibility in humans. J. Biochem. 1999;125, 803–808.
33. Aklillu, E., Carrillo, J. A., Makonnen, E., Hellman K., Pitarque M., Bertilsson L., Ingelman-Sundberg M.: Genetic polymorphism of CYP1A2 in Ethiopians affecting induction and expression: characterization of novel haplotypes with single-nucleotide polymorphisms in intron 1. Mol. Pharmacol. 2003; 64, 659–69.
34. Relling, M. V., Lin, J. S., Ayers, G. D., Evans, W. E.: Racial and gender differences in N-acetyltransferase, xanthine oxidase, and CYP1A activities. Clin. Pharmacol. Ther. 1992; 52, 643–658.
35. Zhou, S. F., Yang, L. P., Zhou, Z. W., Liu, Y. H., Chan, E.: Insights into the substrate specificity, inhibitors, regulation, and polymorphisms and the clinical impact of human cytochrome P450 1A2. AAPS J. 2009; 11 : 481–494.
36. Uslu, A., Ogus, C., Ozdemir, T., Bilgen, T., Tosun, O., Keser, I.: The effect of CYP1A2 gene polymorphism on Theophylline metabolism and chronic obstructive pulmonary disease in Turkish patients. BMB Rep. 2010; 43, 530–534.
37. Obase, Y, Shimoda, T, Kawano, T, Saeki, S., Tomari, S. Y., Mitsuta-Izaki, K., Matsuse, H., Kinoshita, M., Kohno, S.: Polymorphisms in the CYP1A2 gene and theophylline metabolism in patients with astma. Clin. Pharmacol. Ther. 2003; 73, 468–474.
38. Eap, C. B., Bender, .S, Jaquenoud Sirot, E., Cucchia, G., Jonzier-Perey, M., Baumann, P., Allorge, D., Broly, F.: Nonresponse to clozapine and ultrarapid CYP1A2 activity: Clinical data and analysis of CYP1A2 gene. J. Clin. Psychopharmacol. 2004; 24, 214–219.
39. Ozdemir, V., Kalow, W., Okey, A. B., Lam, M. S., Albers, L. J., Reist, C., Fourie, J., Posner, P., Collins, E. J., Roy, R.: Treatment-resistance to clozapine in association with ultrarapid CYP1A2 activity and the C→A polymorphism in intron 1 of the CYP1A2 gene: effect of grapefruit juice and low-dose fluvoxamine. J. Clin. Psychopharmacol. 2001; 21, 603–606.
40. Bondolfi G., Morel F., Crettol S., Rachid F., Baumann P., Eap C. B.: Increased clozapine plasma concentrations and side effects induced by smoking cessation in 2 CYP1A2 genotyped patients. Ther. Drug. Monit. 2005; 27, 539–543.
41. Jaquenoud Sirot, E., Knezevic, B., Morena, G. P., Harenberg, S., Oneda, B., Crettol, S., Ansermot, N., Baumann, P., Eap, C. B.: ABCB1 and cytochrome P450 polymorphisms: clinical pharmacogenetics of clozapine. J. Clin. Psychopharmacol. 2009; 29, 319–326.
42. Kootstra-Ros, J. E., Smallegoor, W., van der Weide, J.: The cytochrome P450 CYP1A2 genetic polymorphisms *1F and *1D do not affect clozapine clearance in a group of schizophrenic patients. Ann. Clin. Biochem. 2005; 42, 216–219.
43. Laika, B., Leucht, S., Heres, S., Schneider, H., Steimer, W.: Pharmacogenetics and olanzapine treatment: CYP1A2*1F and serotonergic polymorphisms influence therapeutic outcome. Pharmacogenomics J. 2010; 10, 20–29.
44. Shirley, K. L., Hon, Y. Y., Penzak, S. R., Lam, Y. W., Spratlin, V., Jann, M. W.: Correlation of cytochrome P450 (CYP) 1A2 activity using caffeine phenotyping and olanzapine disposition in healthy volunteers. Neuropsychopharmacology 2003; 28, 961–966.
45. Bohanec Grabar, P., Rozman, B., Tomsic, M., Suput, D., Logar, D., Dolzan, V.: Genetic polymorphism of CYP1A2 and the toxicity of leflunomide treatment in rheumatoid arthritis patients. Eur. J. Clin. Pharmacol. 2008; 64, 871–876.
46. Fuhr, U., Rost, K. L.: Simple and reliable CYP1A2 phenotyping by the paraxanthine/caffeine ratio in plasma and in saliva. Pharmacogenetics 1994; 4, 109–116.
47. Palatini, P., Ceolotto, G., Ragazzo, F., Dorigatti, F., Saladini, F., Papparella, I., Mos, L., Zanata, G., Santonastaso, M.: CYP1A2 genotype modifies the association between coffee intake and the risk of hypertension. J. Hypertens. 2009; 27, 1594–1601.
48. Cornelis, M. C., El-Sohemy, A., Kabagambe, E. K., Campos, H.: Coffee, CYP1A2 genotype, and risk of myocardial infarction. JAMA 2006; 295, 1135–1141.
Labels
Pharmacy Clinical pharmacology
Article was published inCzech and Slovak Pharmacy

2011 Issue 3-
All articles in this issue
-
Effects of health-service reform in the field of medicinal drugs
I. Analysis from the standpoint of a pharmacy -
Effects of health-service reform in the field of medicinal drugs
II. Analysis from the standpoint of financial participation of the patient in pharmacotherapy - Clinical significance of cytochrome P450 genetic polymorphism – Part I. Enzymatic system of cytochrome P450 and cytochrome P450 1A2
- Farmaceutické aspekty živočíšnej lipoxygenázy
- Influence of membranes on alaptide permeation from hydrogels
- Synthesis and basic physicochemical properties of 1-[3-(Y-alkoxyphenylcarbamoyloxy)-2--hydroxypropyl]-4-(2-methylphenyl)piperazinium chlorides
- The inhibition activity of selected ß‑carboline alkaloids on enzymes of acetylcholinesterase and butyrylcholinesterase
-
Effects of health-service reform in the field of medicinal drugs
- Czech and Slovak Pharmacy
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Clinical significance of cytochrome P450 genetic polymorphism – Part I. Enzymatic system of cytochrome P450 and cytochrome P450 1A2
- Influence of membranes on alaptide permeation from hydrogels
- Farmaceutické aspekty živočíšnej lipoxygenázy
- Synthesis and basic physicochemical properties of 1-[3-(Y-alkoxyphenylcarbamoyloxy)-2--hydroxypropyl]-4-(2-methylphenyl)piperazinium chlorides
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

