-
Medical journals
- Career
Sledování přítomnosti cyklofosfamidu ve vnitřním ovzduší a na povrchu materiálního vybavení Masarykova onkologického ústavu
: Lucie Gorná 1; Pavel Odráška 1,2; Lenka Doležalová 1; Pavel Piler 2; Michal Oravec 2; Luděk Bláha 1,2
: Masarykův onkologický ústav, Brno 1; Masarykova univerzita v Brně, Přírodovědecká fakulta, RECETOX (Výzkumné centrum pro toxické látky v prostředí) 2
: Čes. slov. Farm., 2011; 60, 25-31
: Original Articles
Používání cytotoxických léčiv (CL) v chemoterapii nádorových onemocnění je spojeno s potenciálním ohrožením zdraví zdravotnického personálu v důsledku profesní expozice těmto nebezpečným léčivům. Hlavním cílem této práce bylo popsat distribuci vybraného zástupce CL (cyklofosfamidu, CP) mezi jednotlivými složkami pracovního prostředí s vazbou na posouzení významnosti příjmu CL inhalací a dermální cestou. Distribuce CP v pracovním prostředí byla studována kombinací metod pro stanovení CP v ovzduší a na povrchu vybavení pracoviště. Stanovení vzdušné kontaminace bylo založeno na sledování CP ve vzorcích odebraných pomocí aktivního čerpání vzduchu přes PTFE filtr, pevný sorbent (Anasorb 708 a Strata-X) a promývačku vzduchu naplněnou destilovanou vodou. Povrchová kontaminace pracoviště byla sledována v místech intenzivní manipulace s CL využitím stěrů pracovního prostředí. Četnost nálezů CP v ovzduší byla nízká a pozorované koncentrace byly hluboko pod hodnotou rovnovážné koncentrace odvozené z tlaku par (0,36 mg/m3 při 20 °C). Měřitelné koncentrace plynného CP (≥ 0,1 ng/m3) byly zjištěny pouze na chemoterapeutickém stacionáři (max. 4,3 ng/m3). Četnost nálezů CP ve stěrech pracovního prostředí byla vyšší. Měřitelné koncentrace CP (≥ 20 ng/m2) byly zjištěny u 75 % vzorků (medián 750 ng/m2). Z provedených měření vyplývá, že při dodržení předepsaných podmínek pro zacházení s CL (používání podtlakových izolátorů pro přípravu CL, centralizace přípravy CL v nemocniční lékárně) má inhalační příjem v oblasti profesní expozice CL relativně malý význam. Naprostá většina zjištěné kontaminace byla zjištěna na povrchu vybavení pracoviště. Velká pozornost by proto měla být věnována především eliminaci zdrojů povrchové kontaminace a ochraně pracovníků před dermální expozicí.
Klíčová slova:
cytotoxická léčiva – cyklofosfamid – profesní expozice – povrchová kontaminace – kontaminace ovzdušíÚvod
Cytostatická léčiva užívaná při léčbě nádorových onemocnění se vyznačují mnohými nežádoucími vlastnostmi, jako je mutagenita, teratogenita a imunosupresivita 1–4). S ohledem na tyto vlastnosti se o cytostatikách často mluví jako o nebezpečných nebo cytotoxických léčivech (CL). Poté, co byla pozorována u některých CL schopnost způsobovat sekundární malignity 1, 5–7), se stala zdravotní rizika práce s CL předmětem zájmu mnohých studií. Vědecký zájem o CL ještě vzrostl, když četné monitorovací studie potvrdily častou kontaminaci pracovního prostředí. Nanogramy až mikrogramy jednotlivých CL na metr krychlový byly nalezeny ve vzduchu ve formě aerosolu 8–10). Stejná množství připadající na čtvereční centimetr byla nalezena také na podlahách, stěnách, lavicích, policích, dveřích, telefonech a ostatních površích v lékárnách a na stacionářích 10–13), stejně jako na ochranných rukavicích, ložním prádle, toaletách a v sanitární místnosti 13, 14). Biologický příjem CL zdravotnickými pracovníky byl doložen stanovením těchto léčiv nebo jejich metabolitů v moči exponovaných osob 15–19).
V reakci na zprávy o profesní expozici CL byla různými vládními orgány a mezinárodními agenturami vypracována mnohá doporučení a směrnice pro bezpečnou manipulaci s CL 20–22). Velkým přínosem byla především centralizace přípravy CL vázaná na specializované prostory vybavené biologickými bezpečnostními boxy nebo podtlakovými izolátory. Prostřednictvím tohoto opatření došlo k přenesení nejvíce nebezpečných činností souvisejících s přípravou CL do kontrolovaných prostor s přísnými pravidly pro používání osobních ochranných prostředků. I přes nesporný přínos centralizace přípravy CL se však i nadále shledáváme s častou kontaminací zdravotnických pracovišť, o čemž vypovídají také dvě nedávno publikované studie provedené v České republice 23–24).
Tento článek prezentuje výsledky studie, jejímž hlavním cílem bylo na příkladu Masarykova onkologického ústavu ověřit a kvantifikovat přítomnost cyklofosfamidu (CP) ve dvou základních složkách pracovního prostředí, a to v ovzduší a na povrchu materiálního vybavení pracoviště. Za účelem postihnout situaci na úseku přípravy chemoterapie byly do studie zařazeny prostory skladu a přípravny CL. Oddělení zajišťující aplikaci chemoterapie byla reprezentována chemoterapeutickým stacionářem.
POKUSNÁ ČÁST
Chemikálie
Cyklofosfamid monohydrát (purity 99,5%) byl zakoupen u Sigma-Aldrich Chemie (Steinheim, Německo). Izotopicky značený cyklofosfamid (CP-D4; purity 97%) byl získán od Niomech (Bielefeld, Německo). Methanol (HPLC gradient grade 99,9%), acetonitril (HPLC gradient grade 99,9%), kyselina octová (p.a. pro LC-MS) a octan amonný (p.a. pro HPLC 99%) dodala Sigma-Aldrich Chemie (Steinheim, Německo). Voda pro HPLC byla připravována systémem Milli-Q Water Purier (Millipore, Billerica, MA, USA).
Charakterizace studovaných pracovišť
Nemocniční lékárna. Příprava CL v Masarykově onkologickém ústavu je centralizovaná v nemocniční lékárně. Příjem CL se provádí na stole vyhrazeném pro nebezpečné látky. Během příjmu jsou CL rozbalena a primární obal (lahvička) je označen čipem RFID umožňujícím přesnou identifikaci konkrétního balení v nemocničním lékově-logistickém systému. Uskladnění CL je prováděno v místnosti větrané vzduchotechnickým systémem. Přípravna CL se nachází ve zvláštních čistých prostorech vybavených dvěma podtlakovými izolátory (Envair CDC – D 2GD a Envair CDC – F 2G2D (BSC třída III)) s odtahem potenciálně kontaminovaného vzduchu mimo budovu. Pro přípravu CL se využívá běžné techniky přenosu roztoků CL pomocí injekční jehly a stříkačky. Připravená CL jsou před výstupem z přípravny CL zabaleny (a zataveny) do nepropustné plastové fólie. Vnitřní prostor přípravny CL je izolován od vnějšího pracovního prostředí přetlakovou bariérou udržovanou v přilehlých tranzitních místnostech.
Chemoterapeutický stacionář. Chemoterapeutický stacionář je tvořen ošetřovatelskou místností, malou místností poskytující zázemí pro převzetí a rozbalení CL a dvou toalet využívaných léčenými pacienty. Celková kapacita tohoto oddělení je 20 pacientů, což umožňuje ošetření přibližně 120 pacientů denně. Aplikace CP je prováděna výlučně pomocí intravenózního infuzního setu a rychlost infúze je řízena infuzní pumpou. Za účelem minimalizace úniku CL do pracovního prostředí je kompletace (propojení) infuzních setů s infuzními vaky prováděna již v izolátoru během přípravy CL. Ze stejného důvodu není dovoleno odpojovat infuzní set od vaku před jeho likvidací.
Design studie
Každé pracoviště (sklad CL, přípravna CL, chemoterapeutický stacionář) bylo sledováno po dobu pěti pracovních dnů. Vzorkování ovzduší probíhalo v rámci celé pracovní doby (8 hodin) a odběr stěrů pracovního prostředí byl prováděn na závěr pracovního dne před úklidem a sanitací pracoviště.
Odběr a zpracování vzorků ovzduší
Vzorkování vzdušné kontaminace bylo založeno na stacionárních odběrech prováděných v místech intenzivní manipulace s CL. Odběry vzduchu byly provedeny pomocí nízko-kapacitních čerpadel XR5000 (SKC Ltd., USA). Vzdušné aerosoly byly zachytávány na PTFE filtry s porézností 1,0 μm a průměrem 47 mm (SKC Ltd., USA). Pro vzorkování plynného CP byly použity tři různé vzorkovače: promývačka vzduchu naplněná destilovanou vodou, kolonky se sorbentem Anasorb 708 (polymer kyseliny methakrylové, hmotnost sorbentu: 100 mg na trubici, plocha: 140 m2/g, výrobce: SKC Ltd., USA) a kolonky se sorbentem Strata X (polymer modifikovaného styrenu; hmotnost sorbentu: 30 mg; plocha: 800 m2/g, výrobce: Phenomenex, Inc., USA). Vzduch byl čerpán rychlostí 0,25 l/min (Anasorb 708 a Strata-X), 1 l/min (destilovaná voda) a 2 l/min (PTFE filtr). Pro zvýšení kapacity vzorkovačů se sorbenty (Anasorb 708 a Strata-X) byl každý odběr prováděn na 5 kolonek od každého typu.
Zpracování vzorků spočívalo v extrakci použitého média směsí acetonitrilu a methanolu (1 : 1, v/v). Vodné roztoky z promývačky vzduchu byly napřed lyofilizovány. Organické extrakty byly odpařeny do sucha ve Speed Vac koncentrátoru. Vysušené vzorky byly rozpuštěny v acetátovém pufru (20mM, pH = 4) obsahující CP-4D (25 ng/ml) a analyzovány.
Odběr a zpracování stěrů pracovního prostředí
Vybrané plochy byly setřeny stěrkou z netkané textilie Mesoft (7,5 × 7,5 cm; Mölnlycke Health Care AB, Göteborg, Švédsko) navlhčenou 0,75 ml acetátového pufru (20 mM, pH = 4). Všechny vzorky byly odebrány jednotným postupem (tři opakované stěry v různém směru jedním tamponem přeloženým na polovinu po každém setření). Odebrané vzorky byly extrahovány 25 ml acetátového pufru (20 mM, pH = 4) na ultrazvukové lázni po dobu 30 minut. Po extrakci byly vzorky centrifugovány 10 minut při 20.103.g. K 1 ml supernatantu bylo pak přidáno 10 μl methanolového roztoku s 25 ng CP-4D.
Kapalinová chromatografie/hmotnostní spektrometrie
Vzorky byly analyzovány pomocí LC-MS/MS systému složeného z kapalinového chromatografu Agilent 1200 a hmotnostního spektrometru Agilent 6410 Triple-Quad s elektrosprejem operujícím v negativním módu ionizace. K separaci byla použita kolona Zorbax SB-C18 (2,1 × 30 mm, 3,5 μm, Agilent Technologies Inc, USA) temperovaná na 30 °C. Mobilní fáze byla připravena z acetátového pufru (5 mM, pH = 4; složka A) a acetonitrilu (složka B) a protékala systémem rychlostí 0,3 ml/min. Složení mobilní fáze se při analýze měnilo dle následujícího gradientu (min:%B): 0 : 10, 6 : 25, 7 : 80, 10 : 80, 11 : 10, 15 : 10. Hmotnostní spektrometr byl provozován v režimu multi-reakčního monitoringu (MRM) s kolizní energií 22 eV. Kapilární napětí a fragmentační energie byly 2000 V a 130 V. Pro detekci CP a CP-D4 byly sledovány iontové přechody 261,1–140,0 (m/z), respektive 265,1 – 144,0 (m/z). Kvantifikace analytu byla provedena metodou kalibrační přímky s hodnotami normalizovanými vnitřním standardem. Limit detekce LC-MS/MS byl nižší než 0,1 μg/l při nástřiku 10 μl vzorku (1 pg/nástřik).
Charakteristika analytických metod
Zavedené metody byly podrobeny částečné validaci spočívající v hodnocení výtěžnosti a opakovatelnosti metody. U každého vzorkovače vzdušné kontaminace byla ověřována výtěžnost extrakce a schopnost retence analytu po dobu odběru vzorků. Účinnost extrakce udává množství analytu (%) extrahovaného z kontrolního vzorku připraveného přidáním známého množství analytu k nepoužitému vzorkovači. Retenční účinnost určuje množství analytu (%), které bylo extrahováno z kontrolního vzorku vystavenému podmínkám při vzorkování (odpovídající průtok vzduchu, 20 °C, vlhkost 40%, 8 hod.). Obě účinnosti byly stanoveny ze tří opakovaných experimentů provedených s kontrolními vzorky obsahujícími 50 ng analytu.
Metoda pro stanovení povrchové kontaminace byla charakterizována v rozsahu 18–1800 pg/cm2. Výtěžnost extrakce se pohybuje v rozmezí 90–98 %. Výtěžnost metody včetně vzorkování dosahuje 96–116 %. Maximální hodnoty krátkodobé a dlouhodobé opakovatelnosti činí 6 %, respektive 12 %. Limit detekce je ≤ 8 pg/cm2 (dle velikosti vzorkované plochy). Podrobné výsledky byly publikovány ve studii Odráška et al. 24).
Výsledky
Charakterizace metod pro stanovení CP v ovzduší
Limit detekce metody (definovaný jako poměr signálu k šumu ≥ 3) byl ≤ 0,1 ng/m3 (dle průtokové kapacity vzorkovacího materiálu). Extrakční účinnost metody byla pro všechny vzorkovače dobrá, stejně tak i retenční schopnost těchto vzorkovačů (tab. 1). Při podrobném porovnání nalezených hodnot lze seřadit použité vzorkovače dle pozorovaných účinností následovně: PTFE filtr ≥ Anasorb 708 > Strata-X > dest. voda. Opakovatelnost metody daná variačním koeficientem hodnot získaných v průběhu charakterizace metod (C.V. %, 100 × SD/průměr) se pohybovala v rozmezí od 2 do 7 % (PTFE filtr, Anasorb 708, Strata-X) a 13–16 % (destilovaná voda).
1. Extrakční účinnost metody pro použité vzorkovací materiály a jejich retenční schopnost prezentovaná jako procentuální návratnost analytu aplikovaného na daný vzorkovač (50 ng) 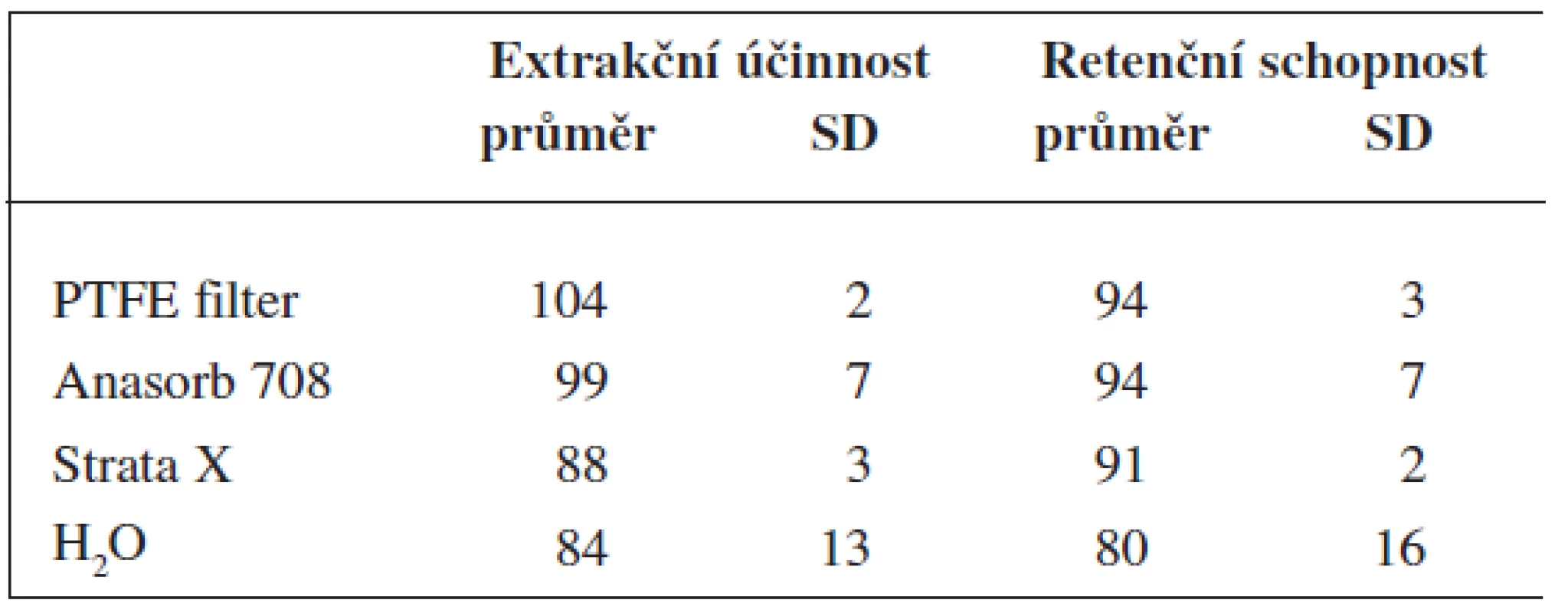
Koncentrace CP v ovzduší
Detekovatelná množství CP byla zaznamenána pouze u vzorků odebraných pomocí sorbentu Strata-X. Pomocí tohoto materiálu byly nalezeny nízké koncentrace CP (0,3–4,3 ng/m3) na chemoterapeutickém stacionáři. Měřitelné hodnoty byly zjištěny u všech 5 vzorků odebraných na tomto pracovišti (tab. 2). V ostatních vzorcích, které byly odebrány na jiných pracovištích (sklad a přípravna CL), žádné pozitivní nálezy zjištěny nebyly.
2. Přehled výsledků stanovení CP na povrchu vybavení a v ovzduší studovaných pracovišť 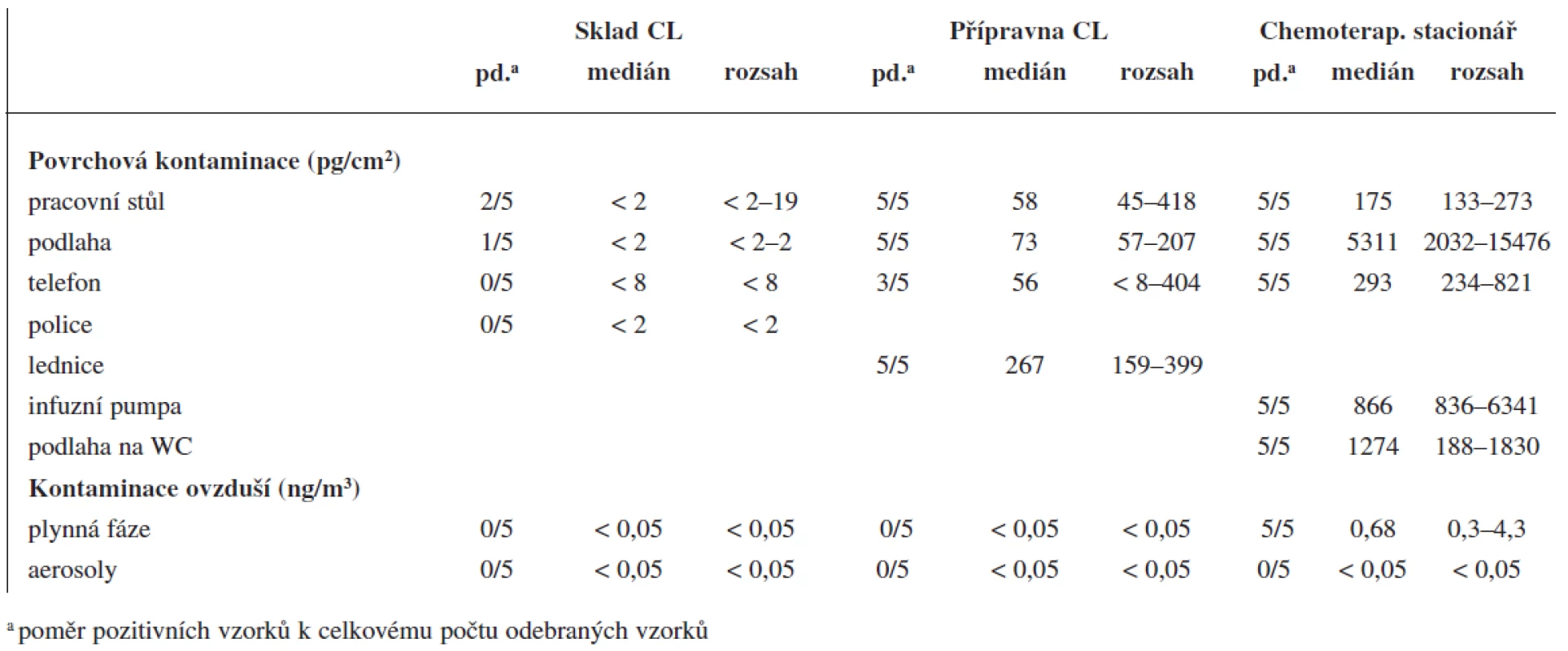
Koncentrace CP na povrchu vybavení pracoviště
Povrchová kontaminace byla nejčastější v přípravně a na chemoterapeutickém stacionáři. Nejvyšší kontaminace byla nalezena na podlaze pod infuzním stojanem, kde maximální koncentrace CP dosáhla hodnoty 15,5 ng/cm2. Naopak nejnižší koncentrace byly zjištěny ve skladu nemocniční lékárny (koncentrace do 19 pg/cm2 byly nalezeny u tří z 20 vzorků).
Diskuze
CL lze v pracovním prostředí očekávat v několika různých formách. V kondenzovaném stavu je můžeme nalézt na povrchu různých objektů nebo rozptýlené ve vzduchu v podobě aerosolů tvořených CL. Po odpaření mohou být CL přítomna ve vzduchu ve formě par, případně se mohou adsorbovat na prachové částice či jiné vzdušné aerosoly. První studie poukazující na schopnost CL vypařovat se za běžných atmosférických podmínek byly publikovány přibližně před 10 lety 25, 26). Studie charakterizující tenzi par CL pak uvádějí, že mnohá CL mohou za určitých podmínek (uzavřená soustava, nadbytek kondenzovaných CL, dosažení rovnovážného stavu) nasytit ovzduší parami do koncentrací v řádu mg/m3 (tab. 3).
3. Přehled CL se známou tenzí par a rovnovážnou koncentrací 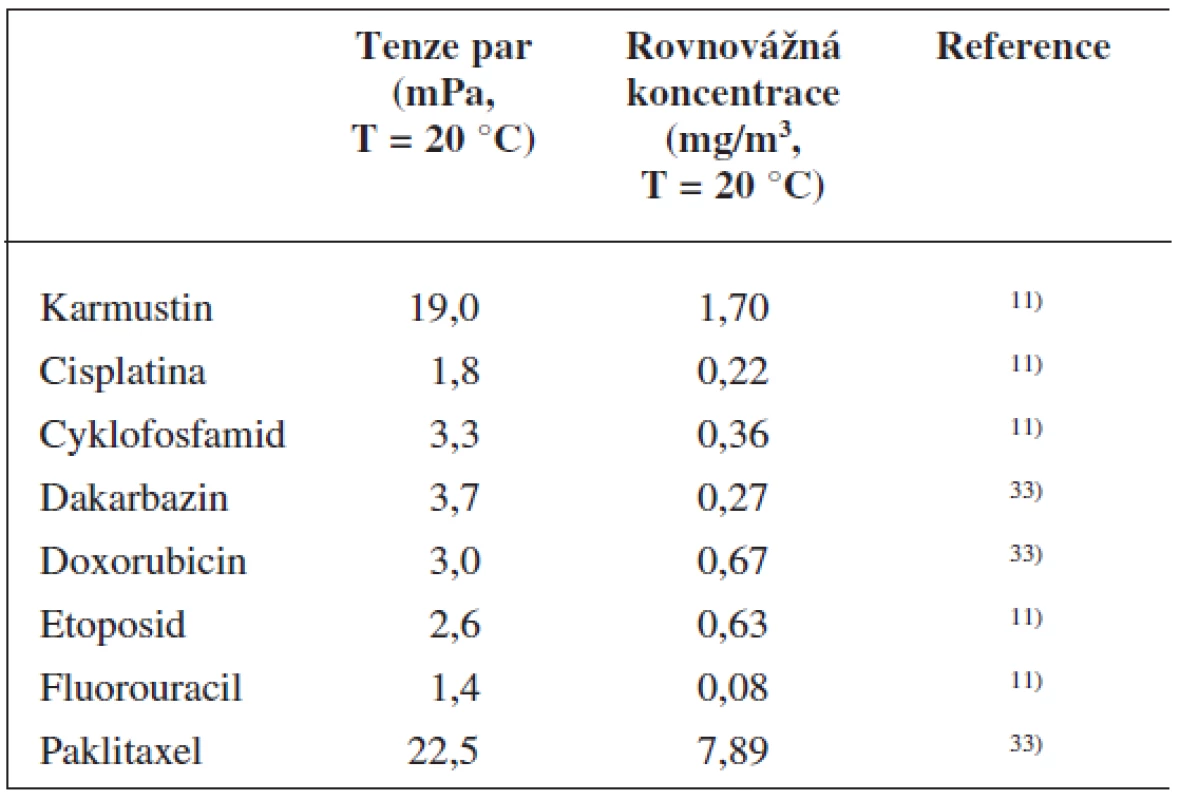
Za účelem pokrytí všech možných forem výskytu CL v reálném pracovním prostředí jsme byli nuceni použít kombinaci různých analytických metod a technik. Stanovení povrchové kontaminace a aerosolové frakce kontaminace ovzduší bylo založeno na technikách popsaných ve studiích publikovaných dříve (viz Pokusná část). S ohledem na velmi omezené literární údaje o stanovování par CL jsme pro vzorkování plynného CP využili tři dostupné vzorkovače. Kolonky Anasorb 708 byly vybrány na základě metodické práce věnované identifikaci pevných sorbentů potenciálně vhodných pro stanovení CL v ovzduší 27). Kolonky Strata-X se sorbentem na bázi modifikovaného styrenu byly využity s ohledem na naše předchozí zkušenosti při používání tohoto sorbentu pro extrakci CP z kapalných vzorků na pevnou fázi. Podobný typ sorbentu byl v minulosti použit například při stanovování plynného trimethylaminu 28) a organofosfátů 29). Promývačka vzduchu byla do studie zahrnuta na základě známé rozpustnosti CP ve vodných roztocích.
V rámci naší studie se vzdušnou kontaminaci CP podařilo pozorovat pouze na chemoterapeutickém stacionáři. Pomocí kolonek se sorbentem Strata-X jsme na tomto pracovišti zachytili CP v koncentracích od 0,3 do 4,3 ng/m3 (viz tab. 2). Na základě negativních výsledků u vzorků odebraných pomocí částicových filtrů předpokládáme, že detekovaný CP byl především plynného původu. V porovnání s hodnotami odvozenými z tenze páry jsou zjištěné koncentrace přibližně o šest řádů nižší, což naznačuje, že vypařovací proces bude probíhat poměrně pomalu. Faktory podmiňující přítomnost par CP na tomto pracovišti nejsou známy, nicméně se lze domnívat, že nepřítomnost ventilace vzduchotechnickým systémem umožňuje kumulaci par vznikajících evaporací/sublimací částic deponovaných na povrchu vybavení pracoviště nebo rozptýlených v ovzduší.
V přípravně a skladu nemocniční lékárny žádné pozitivní nálezy přítomnosti CP v ovzduší zjištěny nebyly. V případě přípravny CL tento výsledek přičítáme hlavně provětrávání místnosti vzduchotechnickým systémem, využívání podtlakových izolátorů pro přípravu CL a odtahu vzduchu prošlého izolátorem mimo prostor budovy. V tomto ohledu jsme zjistili lepší výsledky než obdobné zahraniční studie, které byly provedeny na pracovištích s laminárními průtokovými boxy a které zaznamenaly kontaminaci ovzduší aerosoly CP v koncentracích od 0,06 do 10,1 μg/m3 8, 11, 19, 30, 31) a parami CP v koncentracích do 13 μg/m311).
Ve srovnání s kontaminací ovzduší byla povrchová kontaminace studovaných pracovišť častější. Nejvíce pozitivních vzorků bylo nalezeno na chemoterapeutickém stacionáři (100 %) a v přípravně CL (90 %). Množství CP nalezeného na povrchu sledovaného vybavení byla taktéž vyšší. Pro srovnání: kontaminace ovzduší dosahovala několika jednotek ng/m3 a povrchová kontaminace se nejčastěji pohybovala v řádu jednotek μg/m2 (stovky pg/cm2) (viz tab. 2). Množství CP přítomného na površích studovaných pracovišť je tak nejméně 1000× vyšší než množství CP ve vzduchu nad těmito povrchy. Toto zjištění podporuje názor některých jiných výzkumníků, že dermální expozice je v současné době nejvýznamnější cestou příjmu CL zdravotními pracovníky 8, 12, 15, 32). Toto tvrzení samozřejmě platí především pro pracoviště s vysokou povrchovou kontaminací a nedostatečnými provozními předpisy týkající se užívání osobních ochranných prostředků.
Na základě poznatků o výši povrchové kontaminace v různých místech pracoviště se domníváme, že hlavním zdrojem kontaminace je v současné době otevřená manipulace s CL během aplikace chemoterapie. Nejnebezpečnější částí aplikace je pravděpodobně odpojování infuzního setu od intravenózního portu na konci aplikace CL, kdy hrozí únik zbytků CL z konců rozpojených hadiček. Mezi další zdroje kontaminace patří připojování a odpojování infuzního setu k/od infuzního vaku, manipulace s připravenými léčivy, jejichž obaly jsou externě kontaminované CL a povrchová kontaminace toalet znečištěných močí onkologických pacientů.
Závěr
Provedená měření zaznamenala častý výskyt CP na povrchu materiálního vybavení studovaných zdravotnických pracovišť. V pracovním ovzduší byl CP nalezen méně často a vždy jen ve velmi nízkých koncentracích. S ohledem na tato zjištění shledáváme dermální expozici jako potenciálně více významnou a inhalaci jako méně významnou cestu biologického příjmu CP a potažmo i dalších CL s podobnou schopností přecházet do plynného skupenství (viz tab. 3). V rámci snahy o minimalizaci kontaminace pracovního prostředí a následně i profesní expozice CL by se další pozornost měla věnovat především opatření pro omezování a kontrolu otevřené manipulace s CL (zejména při aplikaci CL).
Studie vznikla v rámci řešení projektu CYTO podporovaného MŠMT ČR (NPVII, 2B06171). Infrastruktura Centra pro výzkum toxických látek v prostředí je podporována projektem CETOCOEN financovaným ze strukturálních fondů EU (CZ.1.05/2.1.00/01.0001). Infrastruktura Masarykova onkologického ústavu je podporována projektem RECAMO (CZ 1.05/2.1.00/03.0101).
Došlo 3. prosince 2010
Přijato 15. prosince 2010
Adresa pro korespondenci:
Mgr. Pavel Odráška
Oddělení laboratorní medicíny
Masarykův onkologický ústav
Žlutý kopec 7, 656 53 Brno
e-mail: odraska@mou.cz
Sources
1. Baker, G. L., Kahl, L. E., Zee, B. C., Stolzer, B. L., Agarwal, A. K., Medsger, T. A.: Malignancy following treatment of rheumatoid-arthritis with cyclophosphamide – long-term case-control follow-up study. Am. J. Med. 1987; 83, 1–9.
2. Fuchs, J., Hengstler, J. G., Jung, D., Hiltl, G., Konietzko, J., Oesch, F.: DNA damage in nurses handling antineoplastic agents. Mutation Research/ Genetic Toxicology 1995; 342, 17–23.
3. Krstev, S., Perunicic, B. and Vidakovic, A.: Work practice and some adverse health effects in nurses handling antineoplastic drugs. Med. Lav. 2003; 94, 432–439.
4. Hemminki, K., Kyyronen, P., Lindbohm, M. L.: Spontaneous–abortions and malformations in the offspring of nurses exposed to anesthetic-gases, cytostatic drugs, and other potential hazards in hospitals, based on registered information of outcome. J. Epidemiol. Community Health 1985; 39, 141–147.
5. Greene, M. H., Harris, E. L., Gershenson, D. M., Malkasian, G. D., Melton, L. J., Dembo, A. J., Bennett, J. M., Moloney, W. C., Boice, J. D.: Melphalan may be a more potent leukemogen than cyclophosphamide. Ann. Intern. Med. 1986; 105, 360–367.
6. Haas, J. F., Kittelmann, B., Mehnert, W. H., Staneczek, W., Mohner, M., Kaldor, J. M., Day, N. E.: Risk of leukemia in ovarian tumor and breast-cancer patients following treatment by cyclophosphamide. Br. J. Cancer 1987; 55, 213–218.
7. Kaldor, J. M., Day, N. E., Pettersson, F., Clarke, E. A., Pedersen, D., Mehnert, W., Bell, J., Host, H., Prior, P., Karjalainen, S., Neal, F., Koch, M., Band, P., Choi, W., Kirn, V. P., Arslan, A., Zaren, B., Belch, A. R., Storm, H., Kittelmann, B., Fraser, P., Stovall, M.: Leukemia following chemotherapy for ovarian-cancer. N. Engl. J. Med. 1990; 322, 1–6.
8. Sessink, P. J. M., Vandekerkhof, M. C. A., Anzion, R. B. M., Noordhoek, J., Bos, R. P.: Environmental contamination and assessment of exposure to antineoplastic agents by determination of cyclophosphamide in urine of exposed pharmacy technicians – is skin absorption an important exposure route. Arch. Environ. Health 1994; 49, 165–169.
9. Micoli, G., Turci, R., Arpellini, M., Minoia, C.: Determination of 5–fluorouracil in environmental samples by solid–phase extraction and high-performance liquid chromatography with ultraviolet detection. Journal of Chromatography B 2001; 750, 25–32.
10. Mason, H. J., Blair, S., Sams, C., Jones, K., Garfitt, S. J., Cuschieri, M. J., Baxter, P. J.: Exposure to antineoplastic drugs in two uk hospital pharmacy units. Ann. Occup. Hyg. 2005; 49, 603–610.
11. Kiffmeyer, T., Kube, C., Opiolka, S., Schmidt, K. G., Schoppe, G., Sessink, P. J. M.: Vapour pressures, evaporation behaviour and airborne concentrations of hazardous drugs: Implications for occupational safety. The Pharmaceutical Journal 2002; 268, 331–337.
12. Kromhout, H., Hoek, F., Uitterhoeve, R., Huijbers, R., Overmars, R. F., Anzion, R., Vermeulen, R.: Postulating a dermal pathway for exposure to anti–neoplastic drugs among hospital workers. Ann Occup Hyg 2000; 44, 551–560.
13. Fransman, W., Vermeulen, R., Kromhout, H.: Dermal exposure to cyclophosphamide in hospitals during preparation, nursing and cleaning activities. Int. Arch. Occup. Environ. Health 2005; 78, 403–412.
14. Sessink, P. J. M., Boer, K. A., Scheefhals, A. P. H., Anzion, R. B. M., Bos, R. P.: Occupational exposure to antineoplastic agents at several departments in a hospital – environmental contamination and excretion of cyclophosphamide and ifosfamide in urine of exposed workers. Int. Arch. Occup. Environ. Health 1992; 64, 105–112.
15. Sessink, P. J. M., Timmersmans, J. L., Anzion, R. B. M., Bos, R. P.: Assessment of occupational exposure of pharmaceutical plant workers to 5-fluorouracil – determination of alpha-fluoro-beta-alanine in urine. J. Occup. Environ. Med. 1994; 36, 79–83.
16. Sessink, P. J. M., Cerna, M., Rossner, P., Pastorkova, A., Bavarova, H., Frankova, K., Anzion, R. B. M., Bos, R. P.: Urinary cyclophosphamide excretion and chromosomal aberrations in peripheral blood lymphocytes after occupational exposure to antineoplastic agents. Mutation Research/Fundamental and Molecular Mechanisms of Mutagenesis 1994; 309, 193–199.
17. Mader, R. M., Rizovski, B., Steger, G. G., Wachter, A., Kotz, R., Rainer, H.: Exposure of oncologic nurses to methotrexate in the treatment of osteosarcoma. Arch. Environ. Health 1996; 51, 310–314.
18. Nygren, O. and Lundgren, C.: Determination of platinum in workroom air and in blood and urine from nursing staff attending patients receiving cisplatin chemotherapy. Int. Arch. Occup. Environ. Health 1997; 70, 209–214.
19. Minoia, C., Turci, R., Sottani, C., Schiavi, A., Perbellini, L., Angeleri, S., Draicchio, F. and Apostoli, P.: Application of high performance liquid chromatography tandem mass spectrometry in the environmental and biological monitoring of health care personnel occupationally exposed to cyclophosphamide and ifosfamide. Rapid Commun. Mass Spectrom. 1998; 12, 1485–1493.
20. NIOSH: Preventing occupational exposures to antineoplastic and other hazardous drugs in health care settings. NIOSH Alert. Cincinnati, OH: NIOSH. 2004; 1–61.
21. ASHP: Guidelines on handling hazardous drugs. Am. J. Health. Syst. Pharm. 2006; 63, 1172–1193.
22. ISOPP: Isopp standards of practice: Safe handling of cytotoxics. Journal of Oncology Pharmacy Practice 2007; 13(Suppl.), 1–81.
23. Doležalová, L., Odráška, P., Gorná, L., Kuta, J., Oravec, M., Prudilová, M., Vejpustková, R., Bláha, L.: Studium kontaminace pracovišť a profesionální expozice zdravotnických pracovníků zajišťujících přípravu a aplikaci protinádorových léčiv. Pracovní lékařství 2009; 61, 117–122.
24. Odráška, P., Gorná, L., Doležalová, L., Oravec, M., Kuta, J., Bláha, L.: Monitoring povrchové kontaminace cytotoxickými léčivy v nemocničních lékárnách české republiky. Čes. slov Farm. 2009; 58, 225–229.
25. Opiolka, S., Molter, W., Kiffmeyer, T., Goldschmidt, R., Schoppe, G., Schmidt, K. G.: Dampfdrucke von zytostatika. Gefahrstoffe Reinhaltung Der Luft 1999; 59, 443–444.
26. Connor, T. H., Shults, M., Fraser, M. P.: Determination of the vaporization of solutions of mutagenic antineoplastic agents at 23 and 37 ľC using a desiccator technique. Mutation Research/Genetic Toxicology and Environmental Mutagenesis 2000; 470, 85–92.
27. Larson, R. R., Khazaeli, M. B., Dillon, H. K.: A new monitoring method using solid sorbent media for evaluation of airborne cyclophosphamide and other antineoplastic agents. Appl. Occup. Environ. Hyg. 2003; 18, 120–131.
28. Chafer-Pericas, C., Herraez-Hernandez, R., Campins-Falco, P.: Selective determination of trimethylamine in air by liquid chromatography using solid phase extraction cartridges for sampling. Journal of Chromatography A 2004; 1042, 219–223.
29. Tollback, J., Tamburro, D., Crescenzi, C., Carlsson, H.: Air sampling with empore solid phase extraction membranes and online single-channel desorption/liquid chromatography/mass spectrometry analysis: Determination of volatile and semi–volatile organophosphate esters. Journal of Chromatography A 2006; 1129, 1–8.
30. deWerk Neal, A., Wadden, R., Chiou, W.: Exposure of hospital workers to airborne antineoplastic agents. Am. J. Health Syst. Pharm. 1983; 40, 597–601.
31. Sessink, P. J. M., Wittenhorst, B. C. J., Anzion, R. B. M., Bos, R. P.: Exposure of pharmacy technicians to antineoplastic agents: Reevaluation after additional protective measures. Arch. Environ. Health 1997; 52, 240–244.
32. McDevitt, J. J., Lees, P. S. J., McDiarmid, M. A.: Exposure of hospital pharmacists and nurses to antineoplastic agents. J. Occup. Environ. Med. 1993; 35, 57–60.
33. Doležalová, L., Odráška, P., Gorná, L., Prudilová, M., Vejpustková, R., Bláha, L.: Studie evaporace vybraných cytostatik a propustnosti ochranných rukavic v rámci výzkumu profesní zátěže zdravotnických pracovníků exponovaných cytotoxickým protinádorovým léčivům (projekt cyto). Klinická onkologie 2009; 22, 218–222.
Labels
Pharmacy Clinical pharmacology
Article was published inCzech and Slovak Pharmacy

2011 Issue 1-
All articles in this issue
- On teaching the chemistry of pharmaceutical auxiliary substances within the framework of pharmaceutical education in the Czech and Slovak Republics
- Determination of nabumetone and 6-methoxy-2-naphthylacetic acid in plasma using HPLC with UV and MS detection
- Determination of airborne and surface contamination with cyclophosphamide at the Masaryk Memorial Cancer Institute, Brno, Czech Republic
- Energy evaluation of the compaction process of directly compressible isomalt
- Study on 99mTc-MAG3 and 99mTc-DMSA renal accumulation using in vitro cellular model
- Czech and Slovak Pharmacy
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- On teaching the chemistry of pharmaceutical auxiliary substances within the framework of pharmaceutical education in the Czech and Slovak Republics
- Study on 99mTc-MAG3 and 99mTc-DMSA renal accumulation using in vitro cellular model
- Determination of nabumetone and 6-methoxy-2-naphthylacetic acid in plasma using HPLC with UV and MS detection
- Determination of airborne and surface contamination with cyclophosphamide at the Masaryk Memorial Cancer Institute, Brno, Czech Republic
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

