-
Medical journals
- Career
Standardní receptura pro přípravu léčivých přípravků v lékárnách IV
Čím může být užitečná sbírka Formularium hospitale
: J. Šubert; J. Kolář 1
: Veterinární a farmaceutická univerzita Brno, Farmaceutická fakulta, Ústav aplikované farmacie 1
: Čes. slov. Farm., 2010; 59, 160-162
Příspěvek ukazuje na příkladech přípravků uvedených ve sbírce Herstellungsvorschriften aus Krankenhausapotheken (Formularium hospitale) některé možnosti inovací a standardizace receptury léčivých přípravků připravovaných v lékárnách v České republice.
Klíčová slova:
léčivé přípravky – příprava v lékárnách – standardní receptura – Formularium hospitale – Český lékopisJe-li Deutscher Arzneimittel-Codex/Neues Rezeptur-Formularium (DAC/NRF, dále NRF) 1) v České republice dosud málo známým a nevyužívaným zdrojem informací pro standardizaci receptury přípravků připravovaných v lékárnách, je sbírka standardních receptur používaných v nemocničních lékárnách v Německu Formularium hospitale 2) (dále FOHO) zdrojem v České republice dosud neznámým. Záměrem našeho příspěvku je přiblížení jejího obsahu ve vybraných částech, nadějných pro využití v našem lékárenství. Proto nebyly zvažovány přípravky obsahující látky, jejichž použití pro přípravu léčivých přípravků není povoleno vyhláškou č. 85/2008 Sb. ani přípravky, které jsou v České republice pokryty průmyslovou produkcí. Vzhledem k vysokým nárokům na prostory, vybavení a technologii přípravy nebyly (s jednou výjimkou) do výběru zařazeny přípravky k parenterální aplikaci, které jsou ve FOHO časté a tvoří přes 20 % monografií zařazených jako léčiva. Využití některých přípravků sestávajících z léčivých či pomocných látek (dále LPL), které jsou v České republice povoleny, předpokládá rozšíření současného sortimentu LPL nabízených lékárnám s platným certifikátem, např. o dimenhydrinát, fenoterol-hydrobromid, oktyldodekanol, střední nasycené triacylglyceroly.
Monografie FOHO jsou sestaveny tak, že mimo složení přípravku a postup jeho přípravy popisují i jeho analytiku včetně mezioperační kontroly (rozsah analytiky však většinou neodpovídá obvyklému rozsahu lékopisných zkoušek), vhodný obal, údaje o stabilitě přípravku a o podmínkách jeho uchovávání. Mimoto řadu dalších informací důležitých pro použití přípravku, jako jsou jeho indikace, kontraindikace, interakce a vedlejší účinky. Tyto údaje však nejsou u všech přípravků FOHO ve stejném rozsahu. Výběr z přípravků FOHO, které by mohly být zajímavé z pohledu přípravy léčivých přípravků v lékárnách v České republice, je uveden v tabulce 1.
1. Některé z přípravků Formularium hospitale (FOHO) s možným využitím v České republice <sup>a)</sup> 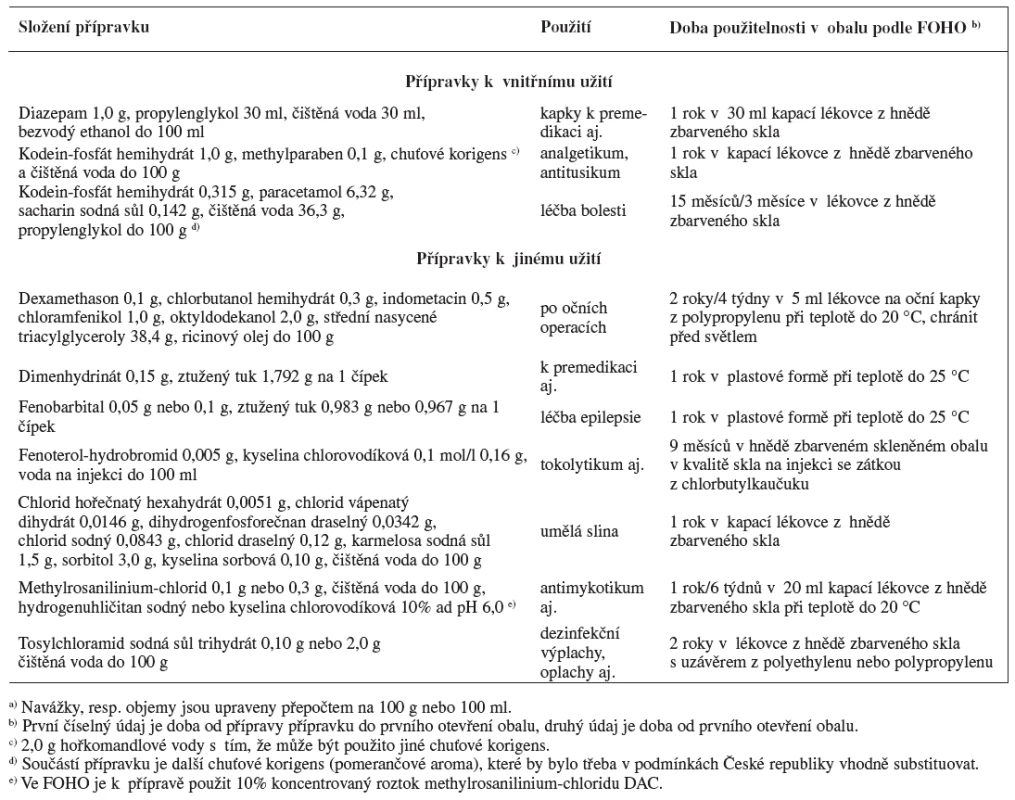
Přípravky uvedené v tabulce 1 nemají v České republice protějšek z průmyslové produkce. Jsou mezi nimi přípravky, které by se mohly uplatnit především v nemocniční péči, tedy k přípravě v nemocničních lékárnách (kapky k vnitřnímu užití obsahující diazepam, oční kapky obsahující dexamethason, indometacin a chloramfenikol a infuzní přípravek obsahující fenoterol-hydrobromid), převažují však přípravky vhodné i pro ambulantní péči, tedy s přípravou v běžných lékárnách. Z těchto přípravků kapky obsahující kodein-fosfát ve vyšší koncentraci nejsou v České republice novinkou a byly uvedeny již ve sbírce Praescriptiones magistrales 3), kde však byly s obsahem léčiva až 2,5 % a chuťově korigované mátovou vodou. Do tabulky byly zařazeny zejména k porovnání doby použitelnosti uváděné u této standardní receptury FOHO (1 rok) s řádově kratší dobou použitelnosti, která by pro tento přípravek vyplývala z pokynu SÚKL LEK – 5 4). Doba použitelnosti přípravku podle FOHO je však zřejmě vázána na obal z hnědě zbarveného skla. V plastových obalech byla stabilita 0,3% roztoku léčiva nepříliš odlišného složení a prakticky shodného pH dostatečná jen o něco více než 3 měsíce 5). Tekutý přípravek k vnitřnímu užití s relativně vysokým obsahem paracetamolu (6,32 %) a kodein-fosfátu hemihydrátu v hmotnostním zastoupení dvacetkrát nižším, v chuťově korigovaném roztoku, jehož hlavní součástí je propylenglykol, je určen k léčbě silné bolesti v důsledku tumorů i z jiných příčin u hospitalizovaných pacientů i v ambulantní péči 6). Původní receptura s ethanolem a 70% sorbitolem 6) byla dalším vývojem pozměněna zejména náhradou ethanolu a 70% sorbitolu propylenglykolem 7). Při sledování stability přípravku obsahujícího 6,5 % paracetamolu, 0,32 % kodein-fosfátu hemihydrátu a 58,5 % propylenglykolu (tedy přípravku se složením velmi blízkým složení podle FOHO) HPLC nedošlo v průběhu 2 let k signifikantnímu poklesu obsahu účinných látek 7).
U vodných roztoků methylrosanilinium-chloridu FOHO je pro Českou republiku nový obsah léčiva 0,1, resp. 0,3 %, který potvrzuje trend používat jeho roztoky v nižších koncentracích, než jsou koncentrace běžné v České republice, kde jsou nyní v lékopisu roztoky 0,5 a 1%, přičemž do roku 2009 byl koncentrovanější lékopisný roztok 2%. Což byla koncentrace násobně vyšší, než je doporučená 8), a receptury uvedené v 3) tento problém řešily ředěním 2% roztoku v rámci přípravy IPLP na nejvýše 1%. pH 6,0 je považováno za vhodné z pohledu stability léčiva 1), nutnost jeho úpravy však podle standardní receptury na 0,1% a 0,5% roztoky léčiva NRF není nezbytná. NRF u těchto roztoků bez požadavku na úpravu pH uvádí dobu použitelnosti 1 rok/6 měsíců 1).
Umělá slina je předepisována a používána při nedostatku vlastních slin různého původu 1, 2, 9). Mimo standardní recepturu FOHO je pro úvahy o standardizaci receptury přípravku v rámci České repubilky k dispozici také standardní receptura na umělou slinu podle NRF 1) obsahující chlorid hořečnatý hexahydrát 0,005 g, chlorid vápenatý dihydrát 0,015 g, hydrogenfosforečnan sodný dodekahydrát 0,25 g, chlorid sodný 0,085 g, chlorid draselný 0,12 g, karmelosa sodná sůl 0,5 g, sorbitol 70% 4,3 g, kyselina sorbová 0,1 g, čištěná voda do 100 g, tedy mimo zřetelně nižší obsah sodné soli karmelosy ve složení nepodstatně odlišném. Složení umělé sliny podle 9) obsahuje 1 % sodné soli karmelosy, zatímco další receptura podle 9) je založena na mucinu. Umělá slina podle 10) obsahuje rovněž 1 % sodné soli karmelosy a jako protimikrobní látku 0,2 % methylparabenu. Její pH je upravováno hydroxidem draselným na 6,75, což je hodnota blízká hodnotě fyziologické 1). Ve studii 11) jsou porovnávány vlastnosti umělé sliny založené na sodné soli karmelosy s umělými slinami založenými na xanthanu. Od umělých slin určených k použití jako léčivý přípravek je nutné odlišovat receptury na umělé sliny určené jako prostředí k testování stomatologických materiálů in vitro 12).
U vodných roztoků sodné soli tosylchloramidu zařazených ve FOHO jde z pohledu lékáren v České republice daleko víc než o novinku o klasiku předepisovanou v minulosti na lékařský předpis často i poté, co se stala sodná sůl tosylchloramidu s platným certifikátem pro lékárny nedostupnou. Ve snaze vyhovět požadavkům byly proto v některých lékárnách roztoky připravovány z přípravku Chloramin B, který byl vyráběn pro jiné účely (dezinfekce ploch a povrchů), a to přesto, že sodná sůl benzensulfochloramidu nebyla povolena příslušnou vyhláškou k přípravě léčivých přípravků. Tuto nelegální praxi ukončilo obnovení dodávek sodné soli tosylchloramidu s platným certifikátem. Vzhledem k tomu, že jde o látku povolenou Vyhláškou č. 85/2008 Sb., nestojí širší přípravě roztoků této látky v lékárnách a jejich standardizaci nic v cestě a údaje o stabilitě těchto roztoků ve vhodných uzavřených obalech uvedené ve FOHO k tomu mohou přispět. Nejen podle FOHO jde o roztoky v zahraničí stále používané, viz také například 13, 14).
Přípravky připravované v lékárnách mají i v současnosti důležité místo v terapii. Mimoto jsou oblastí, ve které je farmaceut nezastupitelným odborníkem. Přípravy léčivých přípravků v lékárnách však v České republice v posledních desetiletích zřejmě ubývá více než v některých jiných zemích Evropské unie. Bylo referováno, že v Německu tvoří přípravky připravované v lékárnách přes 40 % dermatologické receptury, ve Švýcarsku okolo 30 % 15). V České republice k tomu mimo rozšíření nabídky z průmyslové výroby přispívá i nedostatek standardní receptury pro přípravu v lékárnách, který je výsledkem dlouhodobé stagnace v této oblasti v rámci lékopisu i mimo něj, přičemž výčet nových článků národní části Českého lékopisu 2009 – Doplněk 2010 16) týkajících se léčivých přípravků připravovaných v lékárnách je daleko víc diskutabilní než povzbuzující. V této situaci by mohly být některé z článků zařazených do FOHO užitečnou pomůckou.
Adresa pro korespondenci:
doc. RNDr. Jozef Kolář, CSc.
Ústav aplikované farmacie FaF VFU
Palackého 1–3, 612 42 Brno
e-mail: kolarj@vfu.cz
Sources
1. Deutscher Arzneimittel-Codex / Neues Rezeptur-Formularium. Band 1–3, Stand 2008. Eschborn, Govi-Verlag, Stuttgart, Deutscher Apotheker-Verlag.
2. Bundesverband Deutscher Krankenhausapotheker: Herstellungsvorschriften aus Krankenhausapotheken (Formularium hospitale). Stand 2005, Stuttgart, Deutscher Apotheker Verlag.
3. Modr, Z., Hejlek, J., Šedivý, J.: Praescriptiones magistrales, 5. vyd. Praha: Grada – Avicenum 1994; 325 s.
4. Pokyn SÚKL LEK-5 verze 2: Doporučené doby použitelnosti léčivých přípravků připravovaných v lékárně. Dostupné na: http://www.sukl.cz/lek-5-verze-2 (27. 5. 2010).
5. Dentinger, P. J., Swenson, C. F.: Stability of codeine phosphate in an extemporaneously compounded syrup. Am. J. Health Syst. Pharm., 2007; 64, 2569–2573.
6. Müller, F., Diehl, V., Schönhöfer, P. S.: Paracetamol – Mixtur MHH mit Zusatz von Codein oder Levomethadon. Krankenhauspharmazie, 1982; 3, 118–119.
7. Riedel, H.: Paracetamol Mixtur mit Codein. Krankenhauspharmazie, 1987; 7, 237–240.
8. Fadrhoncová, A.: Farmakoterapie kožních nemocí. Praha: Grada 1999, s. 237.
9. Ferguson, M. M., Barker, M. J.: Saliva substitutes in the management of salivary gland dysfunction. Adv. Drug Delivery Rev., 1994; 13, 151–159.
10. Artificial saliva preparation. Dostupné na: kb.psu.ac.th/ psukb/bitstream/2553/1491/2/248839_app.pdf (4. 6. 2010).
11. Preetha, A., Banerjee, R.: Comparison of artificial saliva substitutes. Trends Biomater. Artif. Organs 2005; 18, 178–186. Dostupné na: http://www.sbaoi.org (4. 6. 2010).
12. Gal, J.-Y. et al.: About a synthetic saliva for in vitro studies. Talanta, 2001; 53, 1103–1115.
13. Bundesvereinigung Deutscher Apothekerverbände: Neues Rezeptur – Formularium, Rezepturhinweise: Tosylchloramid-Natrium. Dostupné na: http://www.phar mazeutische-zeitung.de/fileadmin/nrf/PDF/1-Tosylchlor amin.pdf (27. 5. 2010).
14. Dermatologische Magistralrezepturen der Schweiz. Chloraminlösung 0,5%. Dostupné na: http://www. magistralrezepturen.ch/index.asp?stSpr=D&stMenu=rezepturen&stSubMenu=mitw&stTitel=&iPraepNr=215 (27. 5. 2010).
15. Gründe und Grenzen für den Einsatz von Magistralrezepturen (2006). Dostupné na: http://www. magist ralrezepturen.ch/pdf/pdf_d/7_1_1_D.pdf (27. 5. 2010).
16. Portych, J.: Český lékopis 2009 – Doplněk 2010. Dostupné na: http://www.medon-solutio.cz/online2010/ index.php?linkID=txt21&lang=1 (27. 5. 2010).
Labels
Pharmacy Clinical pharmacology
Article was published inCzech and Slovak Pharmacy

2010 Issue 4-
All articles in this issue
- Antimicrobial substances produced by lactic acid bacteria
-
Standardní receptura pro přípravu léčivých přípravků v lékárnách IV
Čím může být užitečná sbírka Formularium hospitale
- Drug controlled release from dosage forms coated with aqueous cellulose and acrylic polymer dispersions
- Vývoj terapie těhotných žen s epilepsií v ostravském regionu v letech 1991 až 2006
- Technology of controlled-release tablets containing highly soluble active ingredients
- Czech and Slovak Pharmacy
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue-
Standardní receptura pro přípravu léčivých přípravků v lékárnách IV
Čím může být užitečná sbírka Formularium hospitale
- Technology of controlled-release tablets containing highly soluble active ingredients
- Drug controlled release from dosage forms coated with aqueous cellulose and acrylic polymer dispersions
- Antimicrobial substances produced by lactic acid bacteria
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

