-
Medical journals
- Career
Syntéza alkylesterů kyseliny 2-{3-[4-(4-fluorfenyl)-piperazin-1-yl]-2-hydroxy-propoxy}-fenylkarbamové a in vitro hodnocení jejich β-antiadrenergní a vazodilatační aktivity
Authors: T. Goněc 1; E. Račanská 2; J. Csöllei 1
Authors‘ workplace: Veterinární a farmaceutická univerzita Brno, Farmaceutická fakulta, Ústav chemických léčiv 1; Univerzita Komenského v Bratislave, Farmaceutická fakulta, Katedra farmakológie a toxikológie 2
Published in: Čes. slov. Farm., 2008; 57, 115-118
Category: Original Articles
Overview
Ve snaze získat látky příznivě ovlivňující patologicky změněné kardiovaskulární funkce, jako je hypertenze a ischemická choroba srdeční, byla připravena nová série látek ze skupiny aryloxyaminopropanolů. Čtyři z těchto látek lišící se substitucí fenylkarbamátu (methyl, ethyl, propyl, butyl) byly vybrány pro základní farmakologické hodnocení in vitro. Všechny látky snižovaly v pokusech na izolovaných spontánně tepajících předsíních morčete v konc. 1,0.10⁻⁶ základní tepovou frekvenci (7,6–13,6 %) a inhibovaly pozitivně chronotropní efekt isoprenalinu (pA2 = 6,28–6,81). Látky vykazovaly pouze mírnou relaxaci KCl prekontrahovaných potkaních aortálních preparátů (až při koncentraci 1,0.10⁻⁵). Sloučeniny s propyl - a butyl - substitucí se jeví být účinnější než methyl - a ethyl - deriváty.
Klíčová slova:
aryloxyaminopropanoly – ß-antiadrenergní aktivita – izolovaná předsíň – izolovaná aortaÚvod
Arteriální hypertenze je nejčastějším onemocněním kardiovaskulárního systému s 25% prevalencí v populaci dospělých. Neléčená hypertenze mnohonásobně zvyšuje riziko ischemické choroby srdeční, infarktu myokardu a zejména mozkové ischémie, onemocnění s nejvyšší mortalitou vůbec. Esenciální hypertenze je způsobena patologickým zvýšením tonu sympatické složky vegetativního nervového systému, a proto se k její terapii používají především látky antagonizující adrenergní receptory tohoto systému. Základní strukturou antagonizující ß-adrenergní receptory je aryloxyaminopropanol, případně arylaminoethanol. Látky obsahující ve své struktuře substituovaný fenylpiperazin (urapidil, naftipidil) pak výrazně antagonizují α-adrenergní receptory. Klinicky využívané sloučeniny s kombinovaným účinkem na α i β adrenergní receptory jsou v současnosti labetalol, karvedilol a celiprolol 1–3).
Snaha o nalezení látky s kombinovaným antihypertenzním účinkem vyústila v přípravu sérií látek ze skupiny jak arylaminoethanolu, tak aryloxyaminopropanolu, obsahujících ve své struktuře substituované fenylpiperaziny. 4-fluoro substituce fenylpiperazinu navíc vykazovala výrazné vazodilatační účinky (na rozdíl od 2-methoxy - substituce) 4–6). Cílem práce byla proto příprava čtyř dalších sloučenin s 4-fluorfenylpiperazinem v bazické části molekuly a alkylkarbamátovou skupinou v poloze 2 fenylového jádra a in vitro zhodnocení jejich β-antiadrenergní a vazodilatační aktivity.
Pokusná část
Syntetická část
Rozpouštědla a chemikálie byly dodány od koncernu Sigma-Aldrich (GE) a firmy Lachner (CZ) a byly použity bez dalšího přečištění.
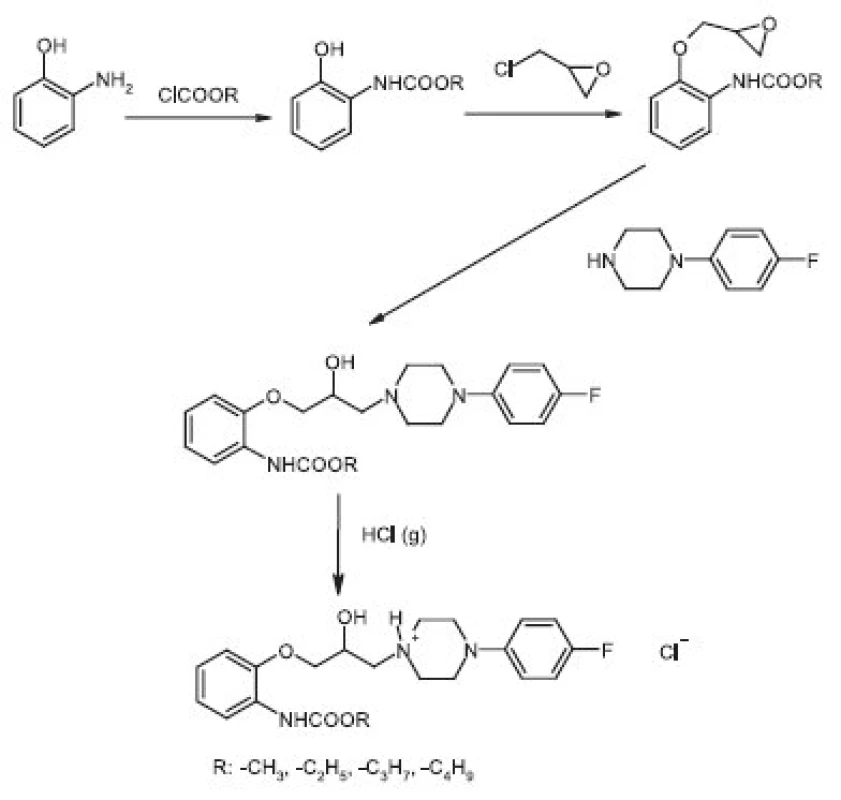
Látky UCHL 11-UCHL 14 byly připraveny třístupňovou syntézou (obr. 1). Alkylestery kyseliny 2-hydroxyfenylkarbamové byly připraveny reakcí 2-aminofenolu (0,2 mol) s odpovídajícími alkylestery kyseliny chlormravenčí (0,1 mol) v prostředí diethyletheru. Alkylestery kyseliny 2-[(2,3-epoxy)-propoxy]-fenylkarbamové byly připraveny reakcí alkylesteru kyseliny 2-hydroxyfenylkarbamové (0,1 mol) s 1-chlor-2,3-epoxypropanem (0,3 mol) v zásaditém prostředí hydroxidu draselného. Metody byly již dříve popsány 7). Konečné látky byly připraveny reakcí příslušné epoxysloučeniny (0,01 mol) s 1-(4-fluorfenyl)-piperazinem (0,01 mol) v prostředí 2-propanolu. Směs byla zahřívána 6 hodin při teplotě varu rozpouštědla. Rozpouštědlo bylo vakuově oddestilováno, surový produkt rozpuštěn v diethyletheru a přidáním nasyceného etherického roztoku chlorovodíku byly získány amorfní sraženiny příslušných hydrochloridů, jež byly následně rekrystalizovány z ethanolu.
Teploty tání byly stanoveny na Kofflerově bloku po vysušení nad P2O5 za sníženého tlaku. Nejsou korigovány.
NMR spektra byla změřena na přístroji Varian Gemini 200 (1H 200 MHz, 13C 50,3 MHz). Chemické posuny jsou uvedeny v ppm (δ) v poměru k tetramethylsilanu jako vnitřnímu standartu.
Infračervená spektra byla změřena na IČ spektrofotometru NICOLET Model Impact 410, v rozsahu vlnových délek 4000–400 cm-1. Vzorky byly měřeny v pevné formě, připravené lisováním do tablety s KBr v koncentraci 1,0–1,5 mg látky na 400 mg KBr.
Biologická část
Antagonistický účinek nově syntetizovaných látek na pozitivně chronotropní efekt ß-adrenergního agonistyisoprenalinu byl sledován na izolovaných, spontánně tepajících předsíních morčat. Pravá předsíň srdce z morčete byla napojena na izometrický snímač v Tyrodově roztoku (složení v mmol.l-1: NaCl 137,0; KCl 2,7; NaHCO3 25,0; MgCl2 1,0; NaH2PO4 0,42; CaCl2 1,9 a glukosa 11,0) při teplotě 30 °C pod stálým napětím 1 g a provzdušňována pneumoxidem (O2 + 5% CO2). Po 30 minutách stabilizace preparátu byl kumulativně přidáván isoprenalin ve formě hydrochloridu (Sigma-Aldrich, GE) v koncentracích 10-12 až 10 6 mol.l-1 a po každém přidání byly zaznamenány změny tepové frekvence. Po propláchnutí a ustálení preparátu byla do lázně podána testovaná látka v koncentraci 10-6 mol.l-1 a po 20 min znovu kumulativně aplikován isoprenalin. Afinita k isoprenalinu byla vyjádřena jako jeho střední efektivní koncentrace (EC50). Míra antagonistického působení testovaných látek byla vypočítána z posunu křivek závislosti účinku na koncentraci jako disociační konstanta pA2 8). Relativní změny tepové frekvence předsíní byly hodnoceny vzhledem k počátečním hodnotám v pětiminutových intervalech po aplikaci testované látky. Pro porovnání účinku byl použit jako standard ß-adrenergní antagonista celiprolol ve formě hydrochloridu (Rhône-Poulenc Rorer, FR) v koncentraci 10 7 mol.l-1.
Vazodilatační účinek nově syntetizovaných látek byl sledován na izolovaných a KCl prekontrahovaných aortách potkanů. Dospělí potkani kmene Wistar o hmotnosti 240–300 g byli anestezováni i.p. aplikací pentobarbitalu (50 mg.kg-1) a následně byla izolována aorta. Nařezané kroužky (4 mm) byly upevněny k snímači pro izometrické měření v orgánové lázni naplněné Krebs-Henseleitovým roztokem (složení v mmol.l-1: NaCl 118,0; KCl 4,7; NaHCO3 25,0; MgSO4 1,6; KH2PO4 1,2; CaCl2 2,5 a glukosa 11,0) při teplotě 37 °C pod stálým napětím 1 g a provzdušňovány pneumoxidem. Po 2 hodinách stabilizace preparátu byl přidán vodný roztok KCl (50 mmol.l-1), který navodil depolarizaci buněčné membrány doprovázenou otevřením pomalých napěťově řízených vápníkových kanálů a vniknutím Ca2+ do buňky. Po ustálení napětí preparátu byly kumulativně přidávány testované látky v koncentracích 10-7 až 10-5 mol.l-1 a zaznamenány změny napětí aorty na lineárním zapisovači (Laboratorní přístroje, Praha). Při maximální relaxaci byl k preparátu aplikován roztok CaCl2 o koncentraci 8.10-3 mol.l-1 a zaznamenána následovná kontrakce. Pro porovnání účinku byla použita vasodilatancia působící prostřednictvím inhibice účinku Ca2+ v buňce hladkého svalu, tj. verapamil hydrochlorid (Sigma-Aldrich, GE) a flunarizin dihydrochlorid (VÚL, Modra, SR).
Výsledky a diskuze
Syntetická část
Byly připraveny čtyři nové látky, alkylestery kyseliny 2 {3-[4-(4-fluorfenyl)-piperazin-1-yl]-2-hydroxy-propoxy}-fenylkarbamové lišící se navzájem délkou alifatického řetězce. Základní charakteristiku nově syntetizovaných látek uvádí tabulka 1. Struktura látek byla potvrzena 1H NMR (tab. 2) a 13C NMR (tab. 3) spektroskopií.
Table 1. Připravené látky a jejich charakteristika 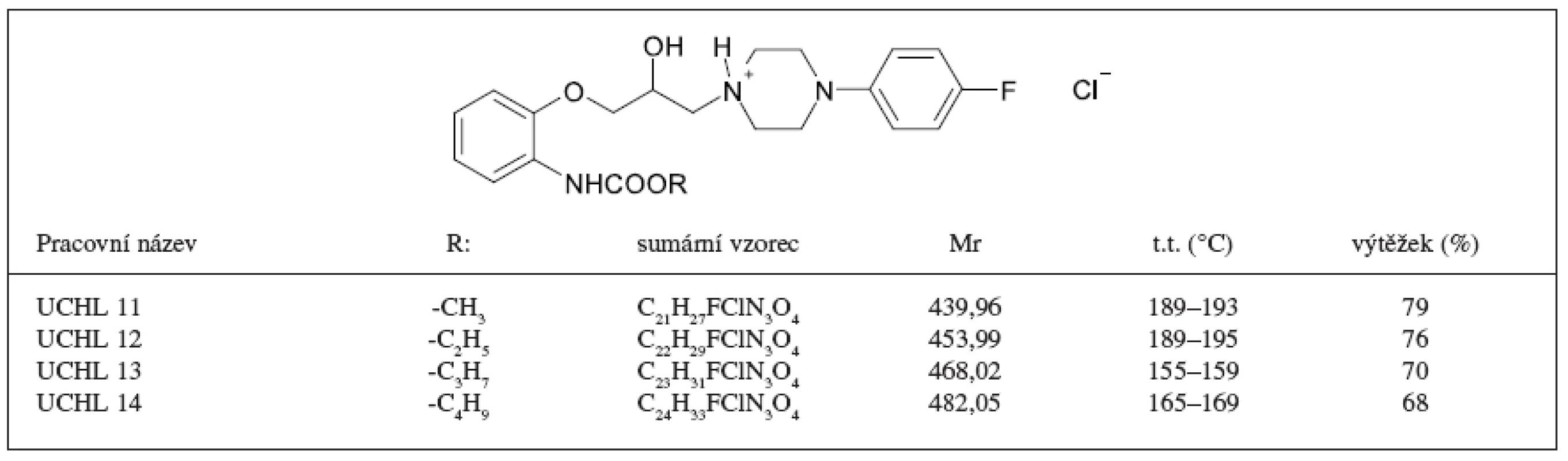
Table 2. 1H NMR charakteristika připravených látek 
Table 3. 13C NMR charakteristika připravených látek 
V infračervené oblasti spektra látky vykazují charakteristické vibrační pásy (tab. 4).
Table 4. Absorpční pásy IČ spektra ν (cm-1) látka 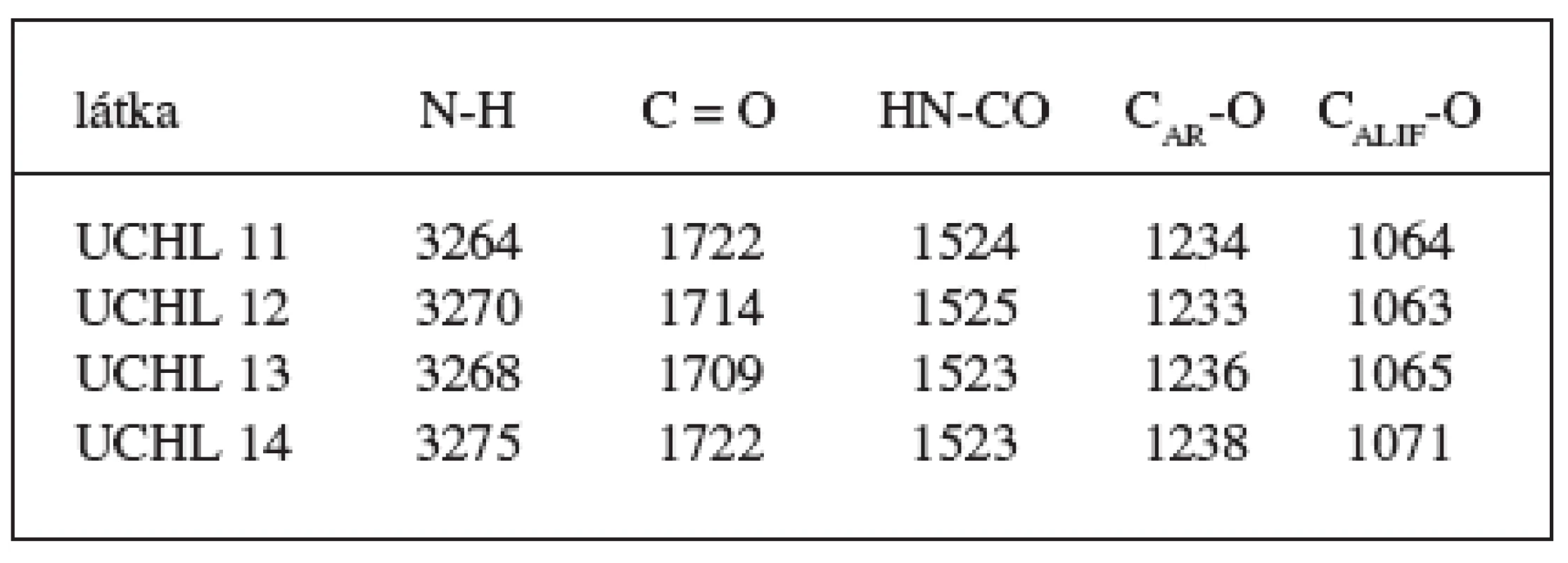
Biologická část
Hodnoty EC50, pA2 a hodnoty relativních změn tepové frekvence uvádějí tabulky 5 a 6. Jak ukazují hodnoty pA2, všechny testované látky vykazují ß-antiadrenergní aktivitu, která je přibližně 16 - až 57násobně nižší než aktivita celiprololu, přičemž se mírně zvyšuje s velikostí alkylu karbamátu. Rozdíly mezi jednotlivými deriváty však nebyly statisticky významné. Podobnou aktivitu vykazují i strukturálně příbuzné látky hodnocené dříve 5,6).
Table 5. Antiisoprenalinové působení testovaných látek. Hodnoty EC50 a pA2. Výsledky jsou průměrem ze 6 měření ± S.E.M. 
Všechny látky přidané k izolovanému myokardiálnímu preparátu v koncentraci 10-6 mol.l-1 snižovaly tepovou frekvenci v průměru o 7,6–13,6 %. Tento pokles byl pozvolný, rozvíjející se v průběhu sledovaných 20 min. Intenzita negativní chronotropie se prohlubovala se zvětšujícím se substituentem od methylu po butyl. Účinek látek na TF je u látek s větším substituentem (UCHL 13 a 14) porovnatelný s celiprololem, který byl však podán v desetinásobně nižší koncentraci (10-7 mol.l-1) (tab. 6).
Table 6. Hodnoty relativních změn tepové frekvence po aplikaci látek. Výsledky jsou průměrem ze 6 měření ± S.E.M. 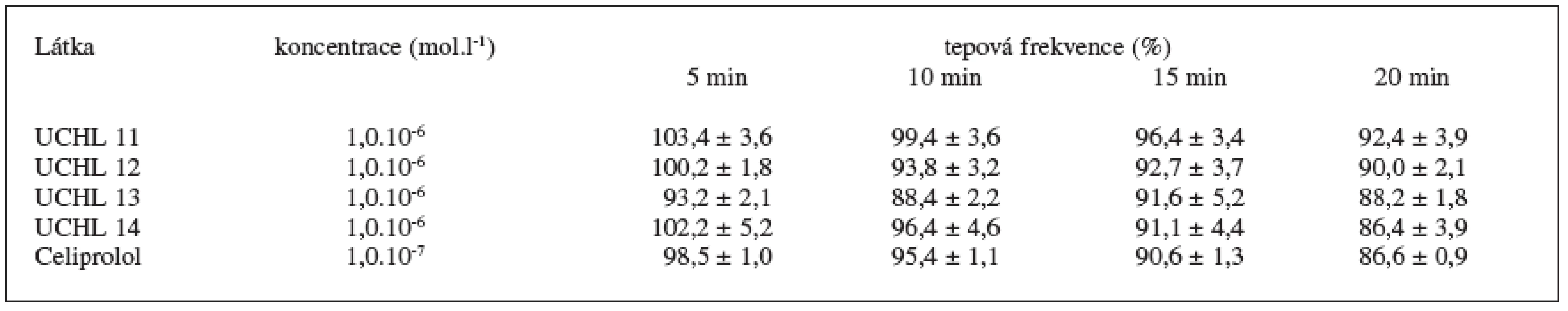
Míru relaxace izolované aorty potkanů prekontrahované KCl uvádí tabulka 7. Všechny látky podávané kumulativně vykazovaly výraznou relaxaci až v koncentraci 10-5 mol.l-1, na rozdíl od verapamilu a flunarizinu, u kterých se relaxace projevila už v 100násobně nižších koncentracích. Ve srovnání s 4-alkylkarbamátovým polohovým izomerem 5) se jeví 2-substituce fenylu jako méně výhodná a oproti benzofuranovým analogům 6) vykazují látky výrazně nižší vazodilatační efekt. Vzhledem ke skutečnosti, že po přidání roztoku CaCl2 došlo opět ke kontrakci aorty, je pravděpodobné, že sledované látky působí přímo inhibičně na účinky Ca2+ v hladké svalovině aorty.
Table 7. Relaxační efekt testovaných látek na KCl depolarizované izolované aorty potkanů. Výsledky jsou průměrem ze 7 měření ± S.E.M. 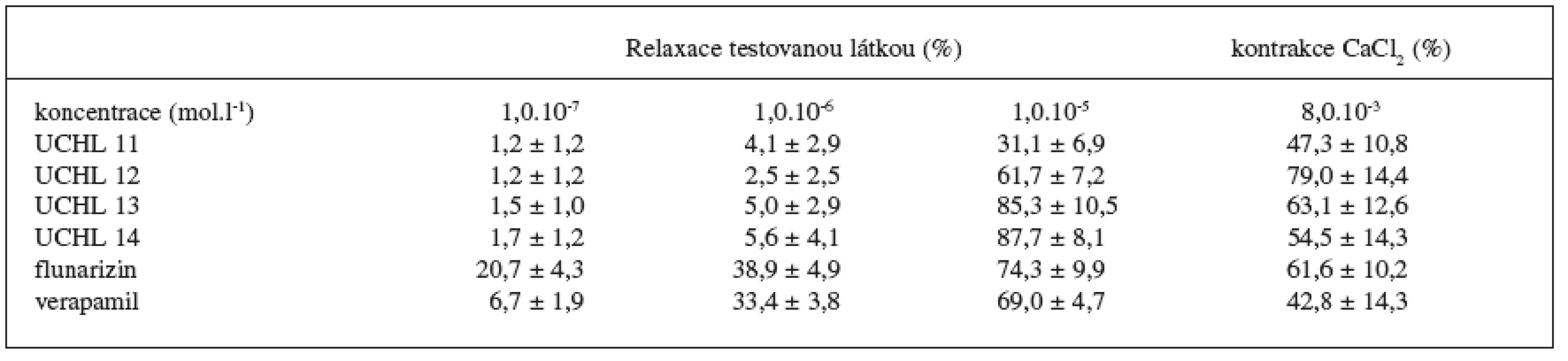
Ze získaných výsledků vyplývá, že látky s většími substituenty na jádře, tj. s propyl (UCHL 13) a butylkarbamátovou substitucí (UCHL 14), mají vyšší schopnost ovlivňovat základní kardiovaskulární funkce. Obě látky potvrdily schopnost specificky inhibovat pozitivně chronotropní účinky izoprenalinu na srdci i působit vazodilatačně. Proto se v našich dalších experimentech budeme věnovat studiu jejich účinků v podmínkách in vivo u intaktních zvířat a sledovat jejich potenciální antihypertenzní aktivitu.
Došlo 18. dubna 2008
Přijato 30. dubna 2008
Adresa pro korespondenci:
Mgr. Tomáš Goněc
Ústav chemických léčiv VFU FaF
Palackého 1–3, 612 42 Brno
e-mail: tgonec@vfu.cz
Sources
1. Fölsch, U. R., Kochisek, K., Schmidt, R. F.: Patologická fyziologie. Praha, Grada Publishing, 2003, 138-143.
2. Lülmann, H., Mohr, K., Wehling, M.: Farmakologie a toxikologie. Praha, Grada Publishing, 2004, 97-121.
3. Marek, J. et.al.: Farmakoterapie vnitřních nemocí. Praha, Grada Publishing, 2005, 87-110.
4. Čelková, H., Csöllei, J., Čižmárik, J. et al.: Čes. slov. Farm., 1996; 45, 255-259.
5. Mlynárová, J., Čelková, H., Račanská, E.: Čes. slov. Farm., 1996; 45, 260-264.
6. Račanská, E., Kurfürst, P., Csöllei, J., Švec, P.: Acta Facult. Pharm. Univ. Comenianae, 2004; 51, 182-191.
7. Csöllei, J., Borovanský, A., Beneš, L. et al.: Čes. slov. Farm., 1982; 31, 229-235.
8. Van Rosum, J. N.: Arch. Int. Pharmacol. Ther., 1963; 143, 299-330.
Labels
Pharmacy Clinical pharmacology
Article was published inCzech and Slovak Pharmacy

2008 Issue 3-
All articles in this issue
- Syntéza alkylesterů kyseliny 2-{3-[4-(4-fluorfenyl)-piperazin-1-yl]-2-hydroxy-propoxy}-fenylkarbamové a in vitro hodnocení jejich β-antiadrenergní a vazodilatační aktivity
- Štúdium lokálnych anestetíkČasť 183: Micelizácia a termodynamické parametre heptakaíniumchloridu v prostredí roztoku KBr
- Léčivé přípravky v Mattioliho herbáři z roku 1596
- K obsahu národní části Českého lékopisu z pohledu přípravy léčivých přípravků v lékárnách
- Biotická elicitace suspenzní kultury Trifolium pratense L.
- Vliv Mg-ATP na produkci flavonoidů v suspenzních kulturách Scutellaria baicalensis Georgii
- Czech and Slovak Pharmacy
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Léčivé přípravky v Mattioliho herbáři z roku 1596
- K obsahu národní části Českého lékopisu z pohledu přípravy léčivých přípravků v lékárnách
- Štúdium lokálnych anestetíkČasť 183: Micelizácia a termodynamické parametre heptakaíniumchloridu v prostredí roztoku KBr
- Syntéza alkylesterů kyseliny 2-{3-[4-(4-fluorfenyl)-piperazin-1-yl]-2-hydroxy-propoxy}-fenylkarbamové a in vitro hodnocení jejich β-antiadrenergní a vazodilatační aktivity
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career