-
Medical journals
- Career
ATYPICKÉ FORMY OČNÍ TOXOPLAZMÓZY V DĚTSTVÍ. KAZUISTIKY
Authors: J. Krásný 1; J. Šach 2; E. Daňková 3
Authors‘ workplace: Oční klinika FN Královské Vinohrady, Praha 1; Ústav patologie, 3. lékařská fakulta Univerzity Karlovy, Praha 2; Imunia s. r. o. a Imumed s. r. o., Praha 3
Published in: Čes. a slov. Oftal., 78, 2022, No. 5, p. 258-270
Category: Case Report
doi: https://doi.org/10.31348/2022/27Overview
Cíl: Seznámit se získanými atypickými formami oční toxoplazmózy (OT) v dětství, s přihlédnutím k stoletému výročí objevu této etiologie profesorem Janků z Československa. Jmenovaný poprvé popsal klinický kongenitální obraz OT charakterizovaný makulární jizvou.
Materiál: U 6tiletého děvčete se objevily příznaky nitrooční oboustranné neuritidy se zrakovou ostrostí (ZO) oboustranně 0,1. Laboratorně byla prokázaná toxoplazmová etiologie, jednalo se imunokompetentní pacientku. Po léčbě makrolidovým antibiotikem a aplikaci kortikosteroidu parabulbárně se stav trvale normalizoval na ZO 1,0 na obou očích. U 8letého chlapce byla zjištěna oboustranná vaskulitida sítnice se ZO vpravo 0,25 a vlevo 1,0 s anamnézou strabismu detekovaného po varicelle. Vyšetření na toxoplasmózu bylo negativní, byla však odhalena výrazná celková hypogamaglobulinémie tříd IgG, IgM i IgA. Imunosupresivní a imunomodulační terapie nepřinesla efekt, stav progredoval do retinochoroiditidy. Pro slepotu a dolorózní glaukom vpravo byla ve věku 15 let provedena enukleace. Histologicky byly odhaleny toxoplazmové cysty s bradozoity, následné laboratorní vyšetření prokázalo toxoplazmovou etiologii při přetrvávající ustupující hypogamaglobulinémii. Celková protitoxoplazmová i následná imunosupresivní léčba nepřinesla efekt a ve věku 22 let pacient oslepl i na levé oko.
Závěr: Atypická forma OT intraokulární neuritidy u imunokompetentního pacienta měla příznivý průběh, zatímco retinální vaskulitida s retinochoroiditidou u přechodně imunokompromitovaného pacienta skončila oboustrannou slepotou.
Klíčová slova:
hypogamaglobulinémie – toxoplazmóza – prof. MUDr. Janků – intraokulární neuritida – retinální vaskulitida – retinochoroiditida – varicella
ÚVOD
Toxoplasma gondii (intracelulární parazit) vyvolává granulomatózní zánět charakterizovaný nekrotizující retinitidou se spoluúčastí postižení cévnatky s výrazným zkalením sklivce (toxoplazmová retinochoroiditida). Existují tři vegetativní formy tohoto parazita: tachyzoit-trofozoit (invazivní forma), bradyzoit (encystovaná forma) a sporozoit (oocysta). Kromě klasické formy retinochoroiditidy existují i další atypické formy s vedlejšími projevy: papilitida, vaskulitida, přední uveitida (spill-over) atd. Přenos infekce na člověka je možný několika cestami: perorálně (špatně tepelně zpracované maso s oocystami či nedostatečná hygiena rukou nebo kontaminovanou zeleninou rovněž oocyty), proniknutí tachyzoitů poraněnou kůží a konečně se jedná transplacentární přenos [1], který vytváří její kongenitální formu již u novorozenců.
Před sto lety (1922) odhalil tehdejší oční konsiliář v nemocnici na Královských Vinohradech v Praze MUDr. Josef Janků na histologických preparátech očí sporocyty, tedy parazitární podstatu nitroočního zánětu. Sledoval tříměsíčního kojence s očním nálezem a s postupně se vyvíjejícím enormním hydrocefalem do věku tří let, kdy dítě umírá. Doktor Janků se posléze zúčastnil i jeho pitvy. Tehdy byla ještě tato jizevnatá ložiska na sítnici v krajině žluté skvrny nazývaná „coloboma maculae lutae congenitale“.
Profesor MUDr. Josef Janků (Obrázek 1 – vpravo) se narodil v roce 1886 v Chrastavci u Svitav. Po studiích na gymnáziu v Litomyšli absolvoval Lékařskou fakultu Karlovy University v Praze, po promoci v roce 1912 nastoupil na Oční kliniku profesora Deyla. Během 1. světové války působil jako vojenský lékař. V roce 1919 se stal na České oční klinice v Praze asistentem a v roce 1923 habilitoval. Také začal působit jako oční konsiliář ve vinohradské nemocnici. Stál u vzniku tamního očního oddělení v roce 1930, kde působil po 2. světové válce jako primář. V roce 1953 založil Oční kliniku Fakultní nemocnice Královské Vinohrady v rámci nově koncipované Hygienické fakulty a stal se jejím přednostou do roku 1957. V roce 1955 byl jmenován profesorem a v roce 1956 byl oceněn zlatou medailí Jana Evangelisty Purkyně. Do důchodu odešel v roce 1959, zemřel v roce 1963 [2,3]. V roce 2008 mu byla odhalena pamětní deska v rodné obci [2].
Image 1. Vrozená forma oční toxoplazmózy v podobě oboustranné makulární jizvy – vpravo. Prof. MUDr. Josef Janků (1886–1963) – vlevo 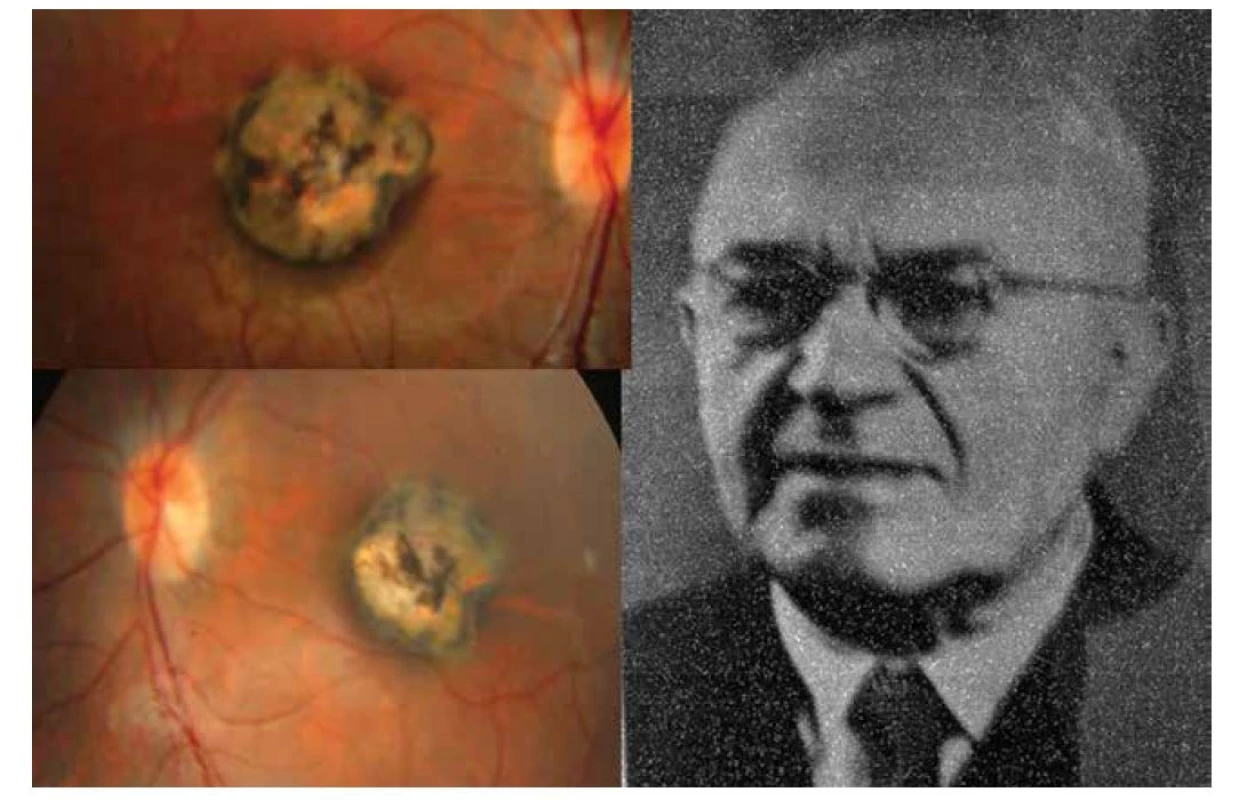
V roce 1923 publikoval výše uvedené pozorování z roku 1922 s barevnou kreslenou dokumentací [4]. Určit parazita do té doby nebylo možné, jak dokládá jeho setkání s profesorem mikrobiologie Levanditim z Paříže v roce 1924. Ten preparáty prohlédl a blahopřál mu k prvenství objevu – nálezu parazita v oku u člověka. Objev zůstal nepovšimnut vzhledem k české publikaci [2]. Až po 2. světové válce se dostává tento prioritní objev do povědomí světové literatury [5], později označen jako „Morbus Janku“ či „Janku´s disease“. Smutné je, že pochopení a uznání důležitosti objevu zůstalo dlouho v našich vědeckých kruzích nepoznáno a jak prof. Janků vzpomínal, bylo spojeno s mnohou hořkostí [2]. V základních očních učebnicích a monografiích je vzpomenuto na jeho jméno jen v knihách od akademika Josefa Kurze: Základy očního lékařství (1957), od prof. Jana Kolína: Oftalmologie praktického lékaře (1994) a od prof. Pavla Kuchynky: Oční lékařství (2002). Profesor Gary Holland, jeden z hlavních autorů základní monografie na téma uveitid ve světě, jeho jméno uvádí v historickém přehledu o diagnostice toxoplasmózy na prvním místě: „I když někteří badatelé uvádějí práci dr. Janků v 50. letech 20 století. Detaily originální české jazykové publikace zůstaly do značné míry neznámé pro lékařskou společnost mimo Československo, dokud se neobjevila v německém jazykovém překladu v roce 1959“ [6]. Kongenitální forma oční toxoplasmózy (OT) může postihovat pouze makulární krajinu v podobě okrouhlé jizvy bohatě pigmentované o různém průměru (popsanou poprvé právě profesorem Janků). Nález může být i oboustranný (Obrázek 1 – vlevo). Tento nález znamená vždy slepotu postiženého oka, ale neobjevuje se již exacerbace zánětu, tvoří proto samostatnou klinickou jednotku OT. Další možností je rekurentní forma retinochoroiditidy, rovněž na podkladě intrauterinní infekce v centrální oblasti sítnice. Klinický obraz má podobu okrouhlých bělavých jizevnatých ložisek o průměru často menším než 1 papilární diametr (PD) s případným pigmentovým ohraničením. Nové ložisko s nekrotizující retinitidou se objevuje na okraji starého ložiska a proces se může znovu a znovu opakovat a vytvářel satelitní ložiska (Obrázek 2A). Většinou se jedná o jednostranný proces. Doprovodnou složkou bývá zánětlivá sklivcová reakce, což po zklidnění vede k zvýraznění jizevnatého procesu v ložisku (Obrázek 2B, C). K očnímu lékaři přivádí pacienty náhlé zhoršení zrakové ostrosti (ZO), kdy rozsah určila lokalizace nového satelitního ložiska či progredující zamlžení obrazu pro sklivcový proces. Problém spočívá v časovém faktoru exacerbace, může se objevit v předškolním věku i v dospělosti. Ložisko OT může být lokalizováno juxtapapilárně s možností papilitidy, pak se jedná o obraz tzv. Jensenovy formy (obrázek 2D). Má podobu různě rozsáhlých bělavě žlutých ložisek ve tvaru nepravidelného trojúhelníku nasedající na papilu zrakového nervu s minimální pigmentovou reakcí. Jejich podkladem je rovněž intrauterinní infekce. Edém zrakového nervu a ložiska spolu s postižením sklivce bývá obrazem exacerbace spolu se zhoršením ZO při této rekurentní formě. Všechny tyto uvedené klinické obrazy OT představují nejčastější projevy této parazitární infekce, neboť získané formy jsou vzácné, především v dětském věku. Uvedené dvě kasuistiky se zabývají právě těmito raritními pozorováními.
Image 2. Rekurentní retinochoroiditida s mnohočetnými satelitními ložisky (akutními i jizevnatými) a CME (A), Jensenova forma rekurentní retinochoroiditidy se satelitními ložisky(B), exacerbace retinochoroiditidy s vitritidou (C), zklidnění zánětu s atrofizací ložiska (D) 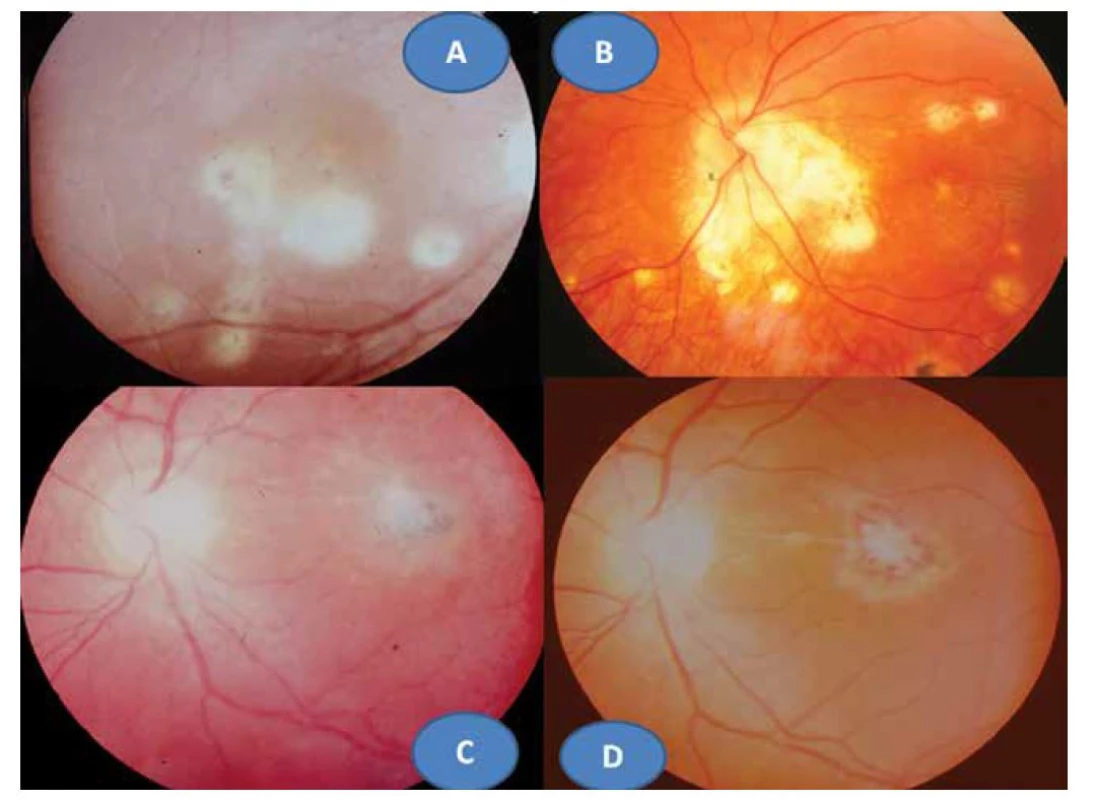
KAZUISTIKA 1
6leté děvče bylo na poli pokousáno na ruce myší. Úraz byl ošetřen na chirurgii. Až s odstupem šesti týdnů se dostavila malátnost, horečka, bolesti v zádech. Nález byl hodnocen vzhledem k podzimnímu období jako chřipka a příslušně byla léčena antipyretiky. Za dva další týdny se projevilo zhoršení ZO. Při očním vyšetření bylo zjištěno prosáknutí obou papil zrakových nervů s rozšířenými kapilárami (Obrázek 3A, B), sítnice včetně centrální oblasti byly bez ložiskových změn. ZO pravého oka (OP) = ZO levého oka (OL) 0,1 naturálně, korekce nelepšila. Nález jsme uzavřeli: oboustranná intraokulární neuritida. Bylo provedeno komplexní laboratorní vyšetření včetně zoonóz. Byl pozván neurolog, který konstatoval, že neurologický nález byl již v normě. Krevní obraz vykazoval mírnou leukocytózu s 2% eosinofilií, sedimentace byla 20 za hodinu. Překvapujícím nálezem byla přítomnost pozitivních protilátek na toxoplasmózu. Komplement fixační reakce (KFR) 1 : 512 a Nepřímá imunofluoresceční reakce (NFR) IgG 1 : 2048, IgM 1 : 32. Byla zahájena léčba perorálně Rovamycinem (spiramycinum) 4 x 250 mg per os po dobu 14 dní, která byla doplněna jednorázově o Kenalog (triamcinolon) 1 ml parabulbárně oboustranně. Po třech měsících se ZO normalizovala na 1,0 naturálně vpravo i vlevo. Papily zrakových nervů se ohraničily a atrofovaly (Obrázek 3C, D). Normalizovaly se laboratorní hodnoty krevního obrazu i sedimentace. KFR klesla na 1 : 32 a NFR IgG 1 : 512 a IgM byla již negativní. Po roce se oční nález nezměnil, dále klesaly laboratorní hodnoty toxoplazmových protilátek: KFR 1 : 8 a NFR IgG 1 : 64.
Image 3. Toxoplazmová neuritida vpravo (A) a vlevo (B). Pozánětlivá atrofizace papily zrakového nervu vpravo (C) a vlevo (D) 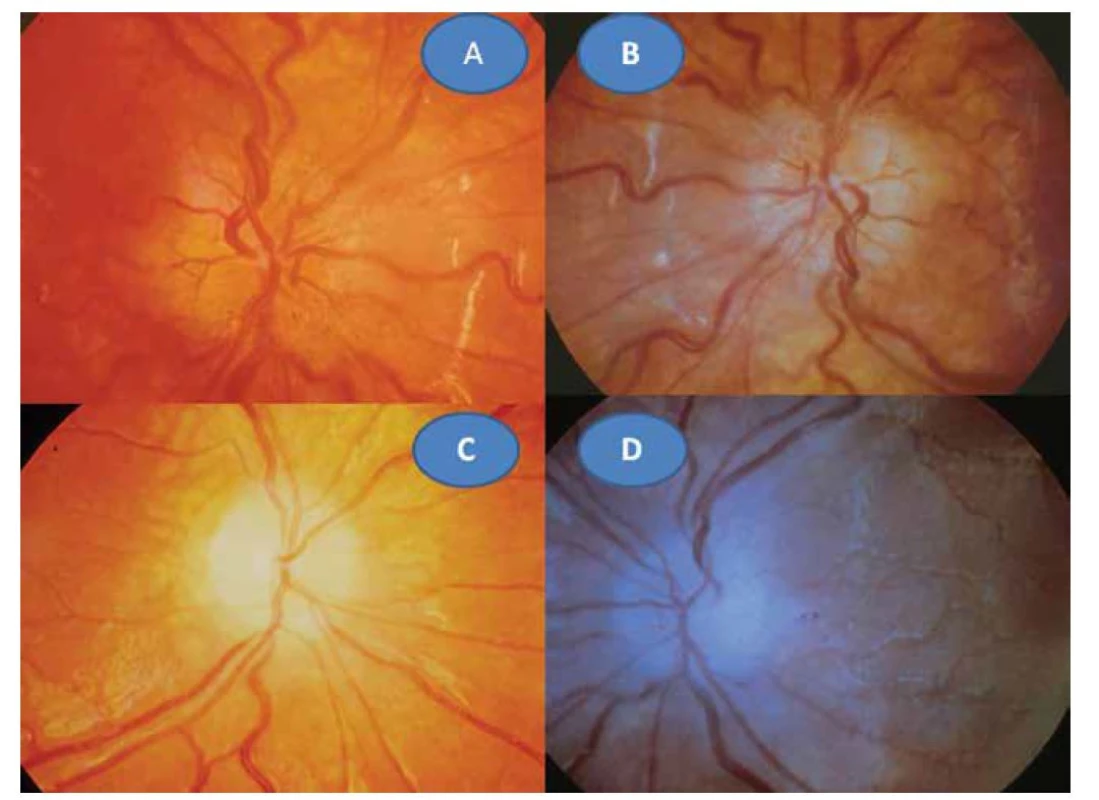
Shrnutí: Přenos infekce nelze zpětně odhalit, ve hře je možnost geofagie či průnik oocyst poraněnou kůži. Prvotními příznaky byly možná neurologické symptomy. Celková léčba akutní toxoplazmózy především s atypickými očními příznaky makrolidovým antibiotikem v kombinaci s kortikoidem byla vysoce efektivní. Rekurence zánětu se neobjevila u této imunokompetentní pacientky po celou dobu sledování.
KAZUISTIKA 2
8letý pacient byl až ze čtvrtého těhotenství, které bylo úspěšně donošeno. Dvě předchozí těhotenství skončily spontánním abortem a jedno úmrtím dítě ve 14 dnech věku pro Camptomelický syndrom. Rodiče byli proto před 4. těhotenstvím podrobně vyšetřeni, měli normální imunologický nález a toxoplazmóza či žádná jiná infekce u nich nebyla sérologicky odhalena. Byly stanoveny jejich HLA lokusy, oba měli ve výbavě HLA B5. U chlapce probíhal vývoj od fyziologického porodu v termínu bez problémů. Vážněji nestonal, pouze pro opakované angíny prodělal tonsilektomii před nástupem do školy. Až ve věku 7 let, měsíc po prodělané varicelle s horečnatým průběhem, si rodiče všimli konvergentního strabismu vpravo s poklesem vidění. Při podrobném vyšetření byl nález na předním segmentu obou očí bez zánětlivých či degenerativních projevů oboustranně. Vpravo byla patrná deformace papily se shrnutím cévního svazku mírně temporálně (Obrázek 4A), opacita sklivce nad papilou a v periferii, hlavně temporálně dole vitreoretinální cystické a proliferativní změny v důsledku vaskulitidy, místy připomínající obraz retinoschízy (Obrázek 4B). ZO OP 6/24 a ZO do blízka Jaeger (J) č. 4 naturálně. Vlevo byl nález v centrální oblasti fyziologický (Obrázek 4C), v periferii nad cévami přemosťující proužky vaskulitidy (Obrázek 4D). ZO OL 6/6 a četl J.č. 1 naturálně. Uzavřeno: vasculitis retinae bilaterálně, více vpravo s vitritidou vpravo. Podrobné sérologické vyšetření včetně toxoplazmózy bylo negativní. Byla zachycena hypogamaglobulinémie IgG a IgA s hraničními hodnotami IgM (Tabulka 1). E-rozety (vyšetření využívané na ověření buněčné imunity před rokem 1990) byly v normě. Vzhledem k nálezu vaskulitidy a HLA B5 jako jeho hlavní lokus bylo provedeno podrobné vyšetření ledvin a jater s negativním výsledkem. Byla nasazena imunosupresivní terapie prednisonem (syntetický glukokortikoid) 2 mg/kg/den po dobu 14 dní s postupným vysazováním. Přes udržovací imunosupresivní léčbu 10 mg prednisonu ob den nález progredoval. Po necelém roce byla hypogamaglobulonemie IgA s hraničními hodnotami IgG a IgM (hraniční hodnota IgG byla relativní podle norem, neboť pro věk 6–7 let by znamenala již patologicky sníženou hodnotu). Následovala další imunosupresivní léčba prednisonem doplněná o substituci imunoglobulinů opakovanými náplavy čerstvé stejnoskupinové plasmy 20 ml/kg. Přes následnou udržovací imunosupresivní terapii oční nález oboustranně progredoval, avšak hladiny imuglobulinů se postupně znormalizovaly. V patnácti letech nález panuveitidy vpravo s komplikovanou kataraktou a sekundárním dolorózním glaukomem (Obrázek 5A) vedl k rozhodnutí provést enukleaci oka také pro prokázané totální odchlípení sítnice na ultrazvukovém vyšetření (UZ) a při ZO: sporný světlocit. Vlevo se přidal nález retinitidy, který provázel obraz centrálního makulárního edému včetně star figury (Obrázek 5B) a zhoršení vaskulitidy v periferii a vitritidou (Obrázek 5C), ZO OL 0,4 a četl J.č. 6 naturálně, korekce nelepšila. V té době trvale probíhalo postupné vyrovnání hladin imunoglobulinů (Tabulka 1). Histologická verifikace byla překvapením; jednalo se o těžkou nekrotizující granulomatózní retinochoroiditidu s basofilními toxoplazmovými cystami a vaskulitidu sítnice s trombózami a mikrokalcifikacemi v granulomech (Obrázek 6A, B, C, D). Sérologicky byla následně potvrzena získaná toxoplazmová infekce (KFR 1 : 16; IgG 0,576 g/l; IgA 0,7g/L; IgM 0,8 g/l a IgE 14,0 IU/l). Chlapec byl přeložen na infekční kliniku k celkové léčbě: 100 mg Daraprimu (pyrimethamin) spolu s 3 g Sulfadiazinu (pyrimidinylsulfanilamid) a dva bolusy 2 x 500mg Solumedrolu (methylprednisolon) s převodem na Medrol (prednisolon) 64 mg denně po dobu týdne, poté byl Medrol snižován a po 6 týdnech vysazen. Pokračovala jizevnatá progrese na očním pozadí, nejprve se objevila makulární žluť (Obrázek 7A), zvýraznil se rozsah vaskulitidy v periferii (Obrázek 7B) ve věku 18 let bez výraznějšího postižení ZO. Laboratorní hodnocení toxoplazmózy vykazovalo snížení: KFR negativní, IgG 0,505, IgA 0,3 a IgM 0,1, což bylo hodnoceno pouze jako anamnestické hladiny IgG. Ve věku 20 let proliferativní změny postihly i centrum (Obrázek 7C) a dále se zvýraznil obraz vaskulitidy v periferii nabývající granulomatózního charakteru (Obrázek 7D). ZO poklesla na 0,1 naturálně, ale s optickým systémem na 0,5 a četl J.č. 10. Kontrolní vyšetření stále prokazovalo mírný, pouze přechodný opětovný pokles hypogamaglobulinémie IgG, ale hladiny IgA a IgM byly již v normě (Tabulka 1). Hodnoty absolutního množství T lymfocytů (CD3) a lymfocytů (CD20) se pohybovaly při dolní hranici normy při normálním imunoregulačním indexu (poměr CD4/CD8) a bylo prokázáno zmnožení NK buněk (natural killer – CD3-CD56+). Objevilo se zvýšení CD56 a CD20. Nasazena imunosuprese, nejprve prednison 2 mg/kg/den s Azaprine (azathioprinem) 1 mg/kg/den v nárazu 14 dní se snižováním. Tato kombinace imunosupresivní léčby byla zaměněna za Equoral (cyclosporin A) 2 mg/kg/den v nárazu měsíc s udržovací dávkou dlouhodobě. Stav byl v dalším průběhu ve 22 letech opět komplikován kataraktou, která se později spontánně redukovala (Obrázek 8A) s pokračujícím vitreoretinálním jizvením v podobě totální amoce a těžkých granulomatózních změn v podobě granulomu 2,9 x 9,6 mm na ultrazvuku (UZ) (Obrázek 8B, C), které byly příčinou slepoty a kontraindikací chirurgického řešení. Dostavil se sekundární glaukom, který byl dostatečně kompenzován konzervativně. Udržovací imunosupresivní léčba cyclosporinem A 0,5 mg/kg/den byla proto ve věku 23 let vysazena, v té době hladiny imunoglobulinů ve všech třídách se znormalizovaly a také buněčná imunita nevykazovala patologické změny. Naposledy byly imunoglobuliny vyšetřeny ve věku 26 let.
Image 4. Obraz shrnutí obraz svazku papily vpravo (A), fyziologický obraz centrální krajiny vlevo (B). Vitreoretinální cystické a proliferativní změny vaskulitidy v periferii vpravo (C), pouze přemosťující proužky vaskulitidy v periferii vlevo (D) ve věku 8 let 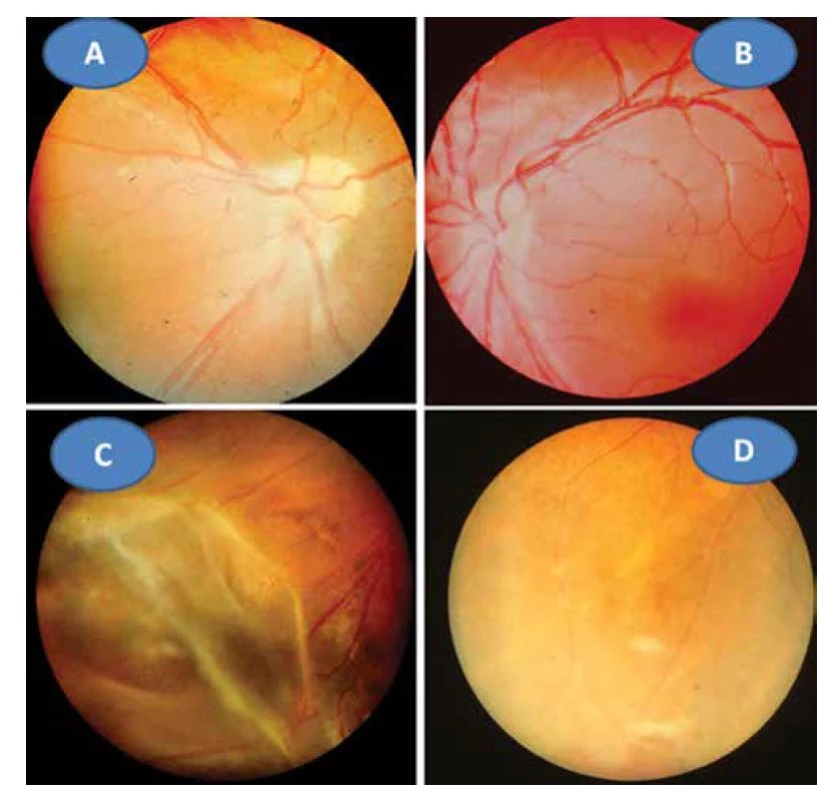
Table 1. Imunoglobuliny IgG, IgA, IgM ve vztahu k věku: snížené hodnoty (žlutě), hraniční hodnoty (zeleně) 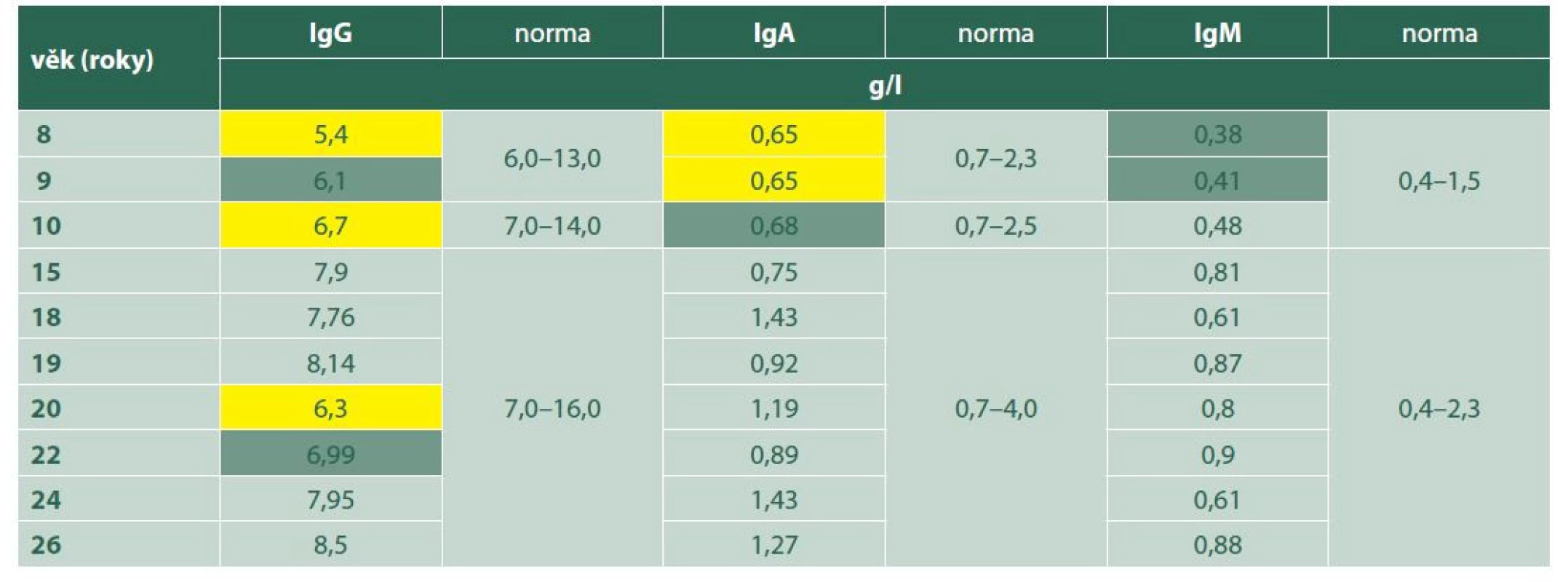
Image 5. Panuveitida s kataraktou a sekundárním glaukomem vpravo v 8 letech (A) a obraz star figury při makulárním edému (B) a progrese vaskulitidy a vitritidy v periferii vlevo (C) v době enukleace 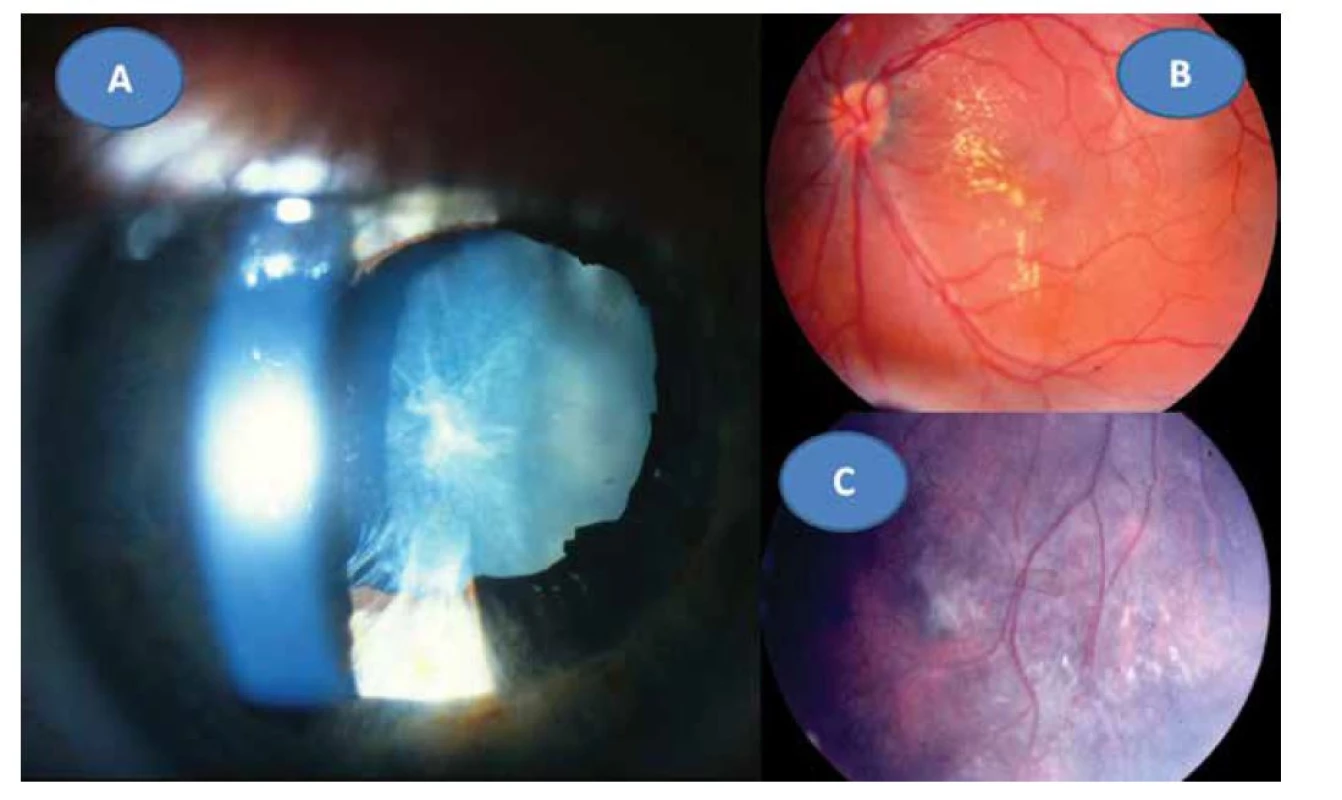
Image 6. Chronická retinochoroiditida (A) zvětšení 50x, HE. Toxoplazmová cysta s bradyzoity – šipka (B), zvětšení 500x, HE. Vaskulitida sítnice s trombózami (C), zvětšení 125x, HE. Mikrokalcifikace zachycené v granulomech (D), zvětšení 500x, HE 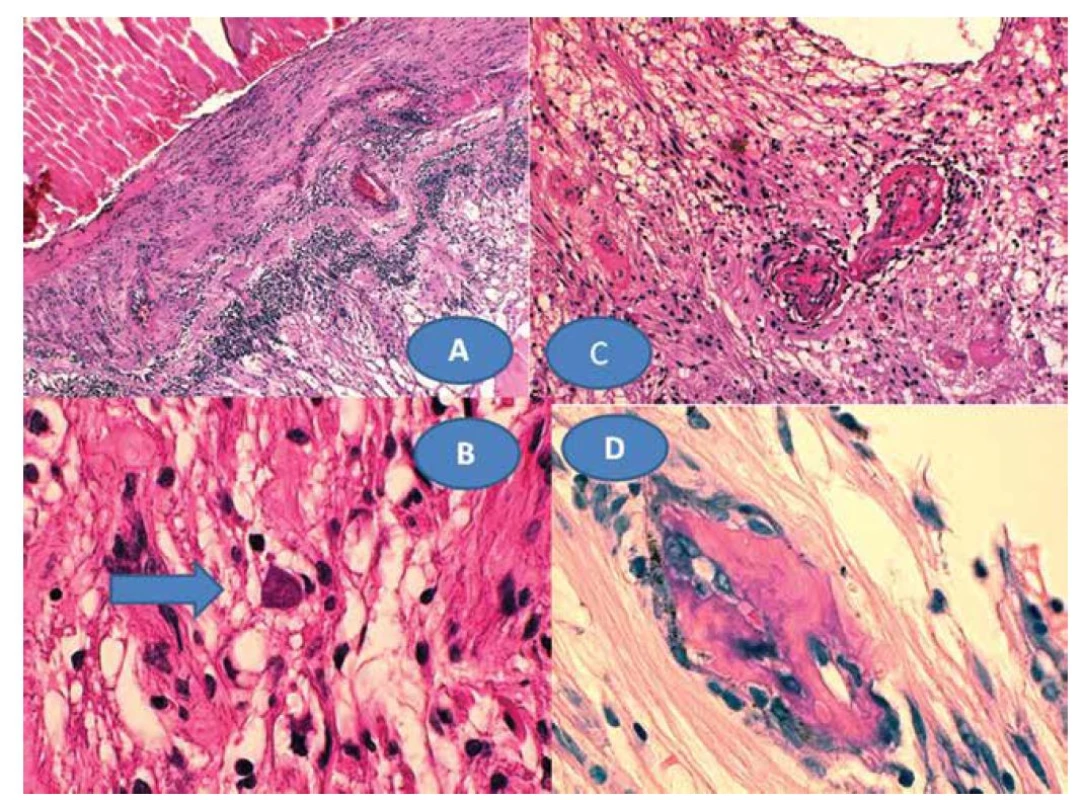
Image 7. Jizevnatá progrese v centru vlevo s vyraženou makulární žlutí (A) a zvýraznění vaskulitidy v periferii v 18 letech (C). Proliferativní změny i v centru (B) vaskulitida v periferii nabývá granulomatózního charakteru (D) ve 20 letech 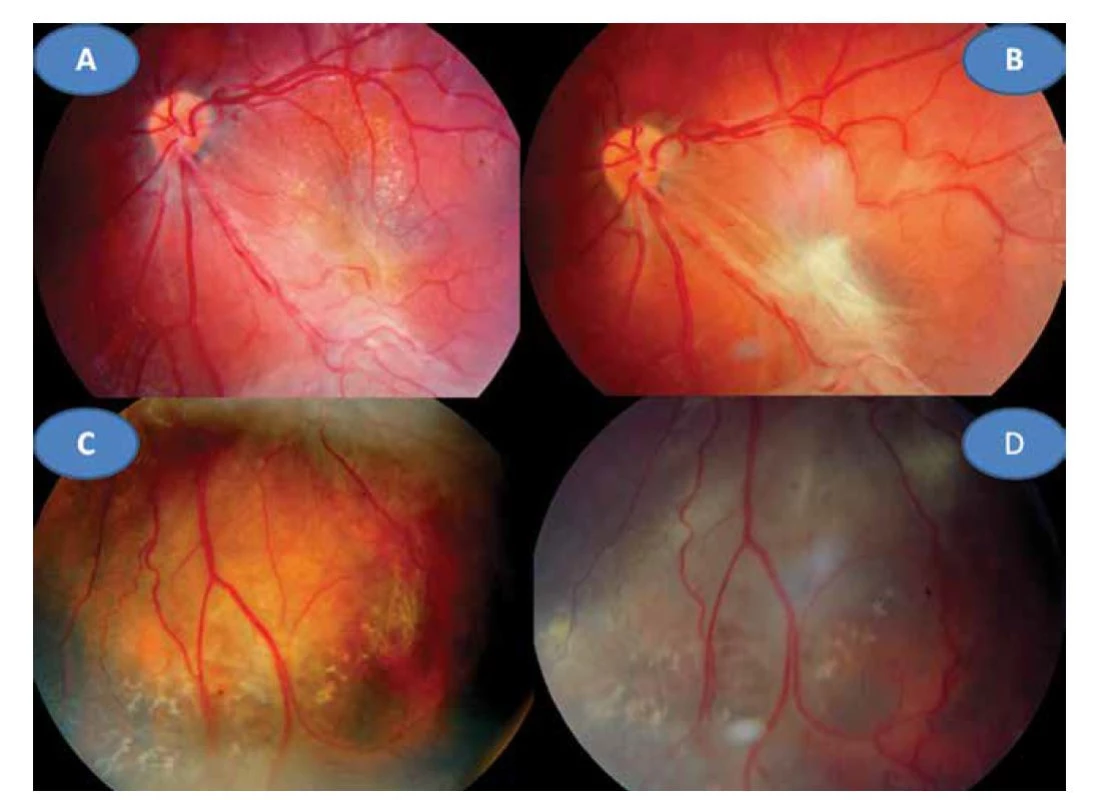
Image 8. Reduková totální katarakta se sekluzí zornice ve 22 letech (A) ultrazvukový obraz totální amoce (B) a granulom sítnice 2,9 x 9,6 mm (C) 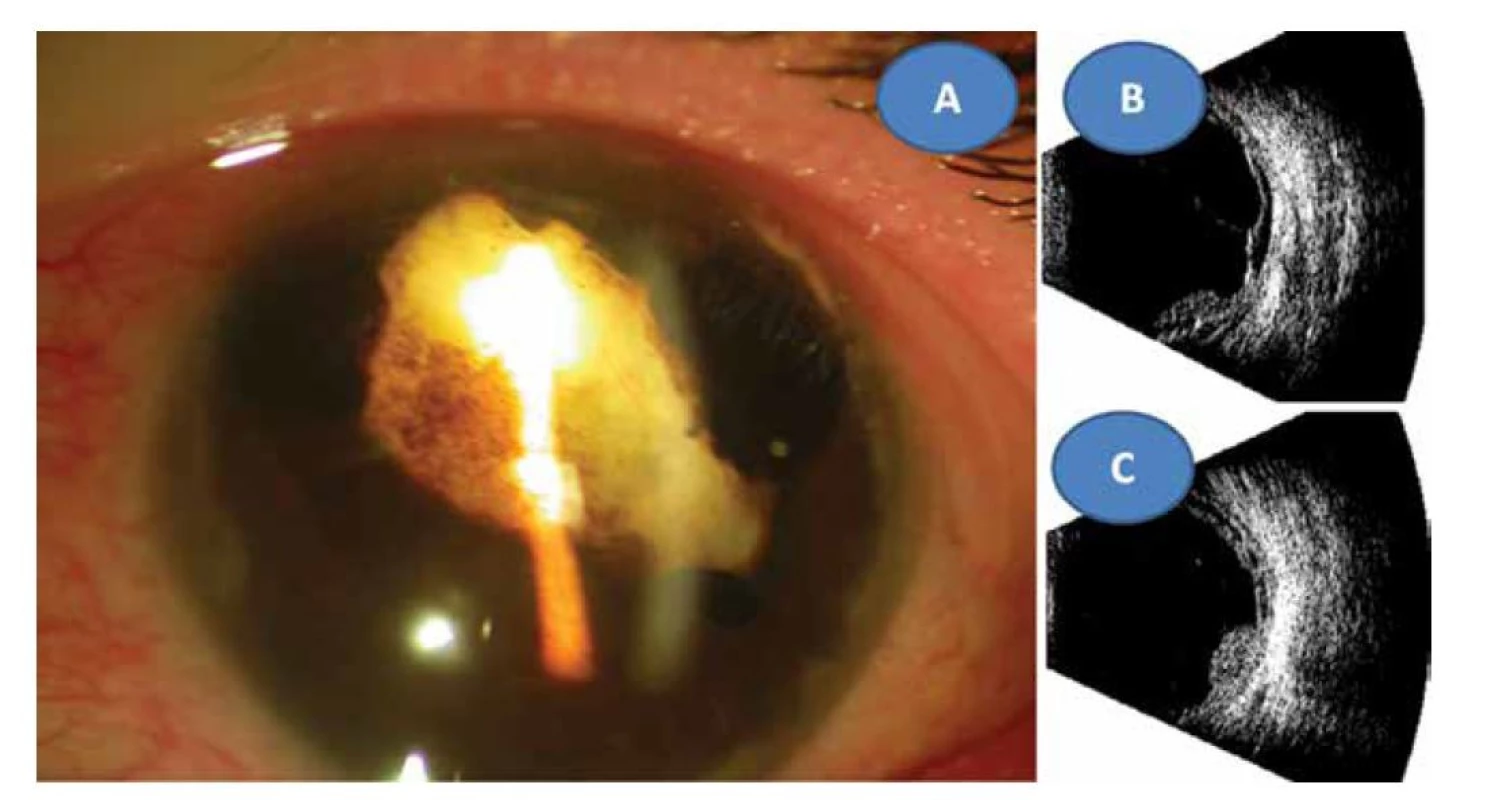
Shrnutí: Strabismus mohl být vyvolán horečnatým stavem vyvolávajícím dráždění mozkové tkáně. Změny na papile pravého oka byly s největší pravděpodobností kongenitálního původu a vaskulitida sítnice s vitritidou mohla souviset s prodělanou varicellou, neboť patří k raritním očním komplikacím této choroby. Nelze ale předpokládat, že by sama za tak krátkou dobu způsobila komplexní hypogamaglobulinémii, která musela být dlouhodobá. Zda byla vrozená nelze již zpětně potvrdit. Pacient podědil lokus HLA B5, který má vztah k vaskulitidám, jiné orgánové postižení tohoto typu nebylo odhaleno. Toxoplazmová infekce byla získaného původu v průběhu oční choroby. Bylo to ještě v době imunokompromitovaného stavu pacienta. Tato infekce se podílela na destrukci cévnatky a sítnice, i když její podíl nelze přesně stanovit. Diagnostikovaná imunodeficience protilátkového typu mohla jejímu projevu napomoci stejně jako dopad varicelly na sítnici. Kombinovaná dlouhodobá imunosupresivní terapie s modulační složkou v jedné fázi léčby mohla napomoci k normalizaci hladin imunoglobulinů, ale toto nelze přesně posoudit. Ani následná protitoxoplazmová léčba nepřinesla efekt v prakticky třicetiletém průběhu sledování.
DISKUZE
Toxoplazmóza představuje jedno z mnoha parazitárních onemocnění člověka, které významně postihuje oči po funkční stránce podle lokalizace zánětu. Rozhodující je postižení makulární krajiny či jejího okolí, zatímco periferní ložiska jsou často detekována náhodně v rámci preventivních vyšetření [6]. Přesto existuje rozdíl mezi ZO a poruchami zorného pole, které je u OT postiženo významněji. Při poklesu ZO u 41 % očí byl defekt zorného pole až u 94 % očí; byl tedy statisticky zásadním rozdílem u retinochoroidálního poškození [7]. Klasické rozdělení OT uvádí dvě základní skupiny postižení komplexu sítnice a cévnatky, ale i postižení dalších očních struktur. Jedná se rekurentní retinochoroiditidu a získanou retinochoroiditidu [6]. Námi uvedená fotodokumentace vychází z bohatého fotoarchivu v průběhu posledních třiceti let a dotýká se prakticky čtyřiceti pacientů. V našem regionu se OT označuje spíše jako chorioretinitida [8–10], což je podmíněno historickým pohledem z doby profesora Janků na centrální makulární jizvu. Rozdíl mezi obojím označením OT lze vystopovat i z oflalmologického pohledu na jizevnaté změny na očním pozadí u satelitních (dceřiných ložisek), jak je patrné ve fotografické podobě (Obrázek 9A, B). Rekurentní zánět již většinou nemá vlastní infekční podklad, ale je imunologickou odpovědí na sekvestrovaný antigen z cyst parazita (viz. níže) a může nabýt obrazu kolobomové jizvy se ztrátou cévnatky a sítnice připomínající chorioretinální kolobom s bělavou sklérou na dně defektu. Sítnice je primárním místem toxoplazmové infekce v obou výše uvedených formách. Většinou jsou to bělavé, lokální léze, často doprovázené vitreální zánětlivou reakcí. Cévnatka je až sekundárně postižena, protože její ložiskový nález se nevyskytuje bez retinální etiologie [6]. Vývoj tohoto kongenitálního zánětu byl popsán i v současné české literatuře i z pohledu diferenciální diagnostiky při celkovém neurologickém postižení novorozence [10]. Primárně může být postižen i zrakový nerv nebo duhovka, a to většinou jen u imunokompromitovaných pacientů. Druhou skupinu OT tvoří zánětlivé léze bez zjevné akutní oční infekce: neuroretinitis, retinální vaskulitida u pacientů s nedávno získanou systémovou toxoplazmózou. Dále jsou to oční projevy spojené se starými náhodně odhalenými toxoplazmovými retinochoroidálními jizvami pod obrazem rekurentní iridocyklitidy či persistující vitritidy [6]. Oba klinické obrazy u našich pacientů získané atypické formy by bylo možno zařadit do druhé skupiny postižení OT.
Image 9. Stav po rekurentní formě okulární toxoplazmózy v podobě tří satelitních ložisek: u chorioretinitidy – vpravo a retinochoroiditidy – vlevo 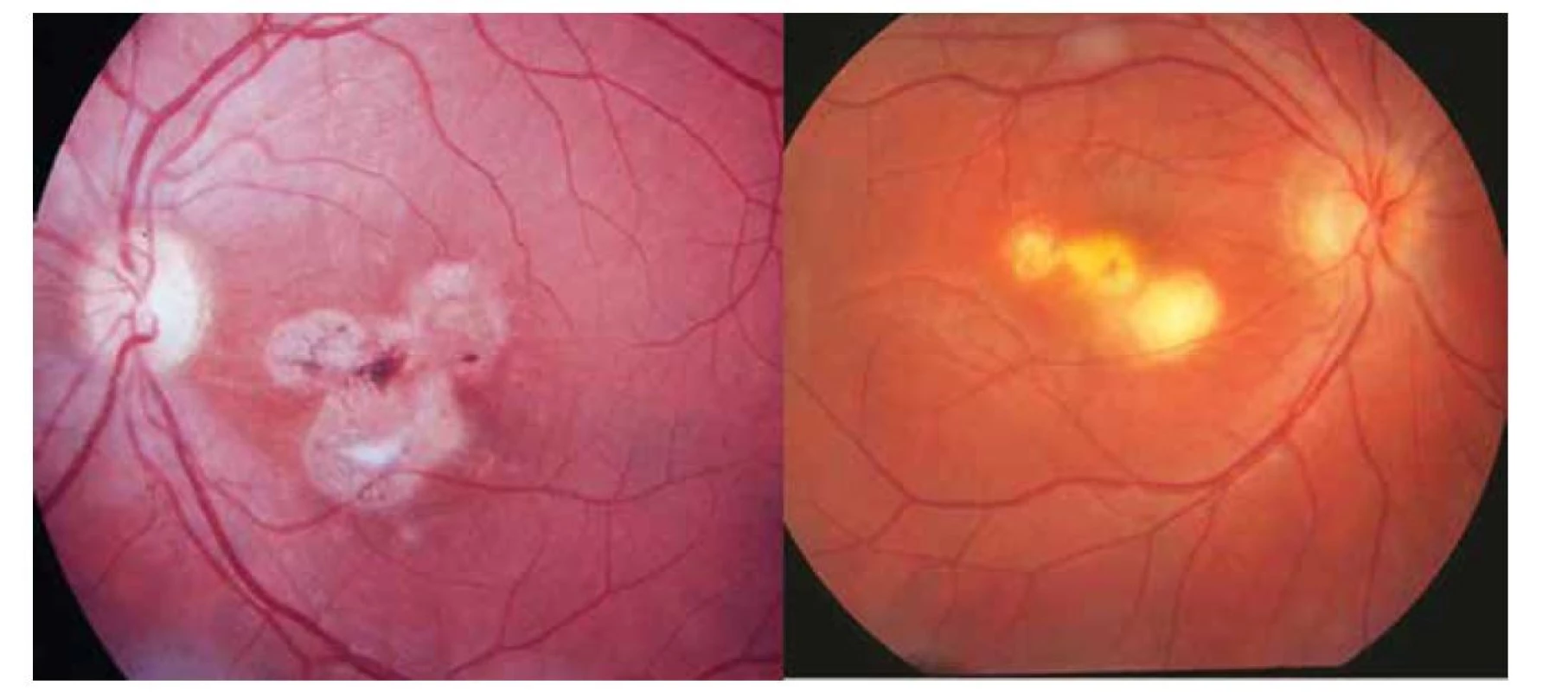
V poválečném Československu se objevily v minulém století dvě rozsáhlejší komplexní práce o dětských uveitidách zabývající se také problematikou OT [8,9]. Další publikace se objevuje po 45 letech a zabývá se kazuistikou oboustranné vrozené formy OT z hlediska postupně se odvíjející diagnózy od prvotního hydrocefalu až k očním projevům. Je podán rozsáhlý přehled léčebného postupu i vývoj očních změn v rámci terapie řízené infekcionistou [10].
Podrobná studie za necelých 6 let z 1300 pacientů s uveitidami prokázala OT u 154 nemocných (12 %). Primární sítnicová léze byla jen u 28 % nemocných a větší zbývající skupinu OT představovala kombinace aktivního ložiska se současnou retinochoroidální jizvou [11]. Postižení optického nervu u OT patří k jejím klinickým projevům; bylo pozorováno na třech očích (14,4 %) z 18 postižených s juxtapapilární aktivací (70,5 %). Efekt léčby byl příznivý v závislosti na lokalizaci zánětu [12]. Retrospektivně u dětí (průměrný věk 9,5 roku) představovaly hlavní oční symptomy: strabismus v 32 % a pokles ZO v 23 %. V klinickém obraze dominovala inaktivní retinální jizva v 71,5 %, panuvetida v 14 %, zadní uveitida v 12,5 %, jednou se jednalo neuroretinitidu [13].
Patogeneze zánětu je spojená s reakcí lymfocytů sekretujících lymfokiny, které destruují toxoplazmového parazita se spoluúčastí makrofágů. Rekurenci zánětu podmiňuje hypersensitivita retinálního antigenu vznikajícího po ruptuře cyst toxoplazmózy. Podílí se 4. typ přecitlivělosti [14], experimentálně to bylo prokázáno za použití extraktu z retinálních fotoreceptorů [15]. V souladu se schopností vysoce purifikovaných rozpustných S-antigenů, které mohou vyvolat specifický stimulus pro lymfoblastické změny [16]. Dále byla experimentálně do 48 hodin vyvolána iridocyklitida po intravitreální inokulaci rozpustného toxoplazmového antigenu, což potvrdilo zpožděnou hypersensitivní buněčnou reakci [13]. Exacerbace zánětu potom nemusí mít podklad v infekčním agens toxoplazmózy, ale v hypersensitivní reakci, pokud se nepotvrdí vzestup hladin protilátek při nové atace infekce. U našeho imunokompromitovaného pacienta byl problém složitější, neboť podědil lokus HLA B5, což ukazovalo na skutečnost, že tento lokus spolu se subtypem B51 je u nemocných s Behcetovou chorobou 3–6x vyšší než u zdravé populace [17]. Naštěstí laboratorní testy změny v rámci vaskulitid to nepotvrdily. Podíl toxoplazmové infekce na destrukci retinochoroidálního komplexu nebyl stanoven, ale diagnostikovaná imunodeficience protilátkového typu mohla jejímu projevu napomoci, tato velice pravděpodobně byla vrozená [18]. V sedmi letech mohlo být sérologické vyšetření specifických protilátek na toxoplazmózu totiž falešně negativní. Je popisováno u imunokompromitovaných, vzácně u imunokompetentních osob [19,20]. U chlapce mohla být přítomná klinicky asymptomatická chronická toxoplasmóza. Varicella v 7 letech s horečnatým závažnějším průběhem při zřejmě vrozené hypogamaglobulinémii mohla chronickou toxoplazmózu aktivovat [21].
Epidemiologicky se odhadovalo na konci minulého století, že byla na světě půl miliarda lidí postižena toxoplazmovou infekcí, prevalence protilátek (the antibody backgraund) byla cca v 70 % v dospělosti. Toxoplazmová infekce postihuje kromě očí hlavně mozek, ale také srdce, játra, plíce a svaly. Prevalence získané formy toxoplazmózy v těhotenství se v té době udávala 1 : 750 až 1 : 8000, přičemž v 1. trimestru byla 10 %, v 2. trimestru 30 % a zbývajících 60 % patří do 3. trimestru [6]. Potrat je vyvolán při transplacentární infekci v 1. trimestru. Mozkové malformace jsou spojené s infekcí v 2. trimestru a vyvolávají obstrukční hydocefalus a nekrotizující granulomatózní záněty, kalcifikace podél 3. mozkové komory a aqueduktu Sylvii a centrální postižení sítnice. Ve 3. trimestru je již mírný průběh postižení, z očního hlediska jen retinochoroiditida, většinou mimo centrální krajinu [22]. OT častěji vzniká postnatálně na základě kontaminace oocystami v nedostatečně zpracovaném mase, neopláchnuté zelenině či pitím kontaminované vody. Léze OT se objevují za několik let po toxoplazmové infekci [23]. Zásadní je výskyt očního postižení. U dětí s neurologickou symptomatologií jsou oční příznaky v 95 %, u diseminované formy jsou oči postiženy ve 2/3, ale v 10 % může být OT bez celkových příznaků. Vyplývá z toho i prognóza onemocnění. Zatímco u dospělých imunokompetentních pacientů je všeobecně dobrá, u kongenitální formy se může projevit v rámci celkového dopadu parazitární infekce mentální i tělesné postižení [6], ale i možnost slepoty, především oboustranné, je statisticky významnější [11].
V padesátých letech minulého století byl poprvé použit v léčbě toxoplazmózy synergismus mezi pyrimethaminem a sulfonamidy [24]. Pyrimethamin zasahuje do převedení kyseliny folinové na listovou blokováním enzymu dihydrofolin reduktázy, současně sulfonamidy zasahují do formování kyseliny folinové. Výsledkem je poškození buněčného dělení při replikaci parazita [6]. Klasickou terapii tedy tvoří trojkombinace pyrimethaminu (Daraprim) + sulfonamid (Sulfodiazim) + kortikosteroid, doplněná o kyselinu listovou. Tento typ terapie je respektovaný a schválený i v České republice Společností infekčního lékařství České lékařské společnosti [25] a je stále považován za optimální postup i ve světě [26]. U našeho pacienta po potvrzení toxoplazmové etiologie byla na infekční klinice podána tato trojkombinace, jako kortikosteroid byl intravenózně aplikován Solu-Medrol a poté Medrol per orálně v postupně snižujících se dávkách. V léčbě toxoplazmózy se uplatňují vzhledem k toxicitě sulfonamidů (gastrointestinální obtíže, kožní alergické projevy až Stevensův-Johnsonův a Leylleův syndrom) a pyrimethaminu (útlum krvetvorby) také antibiotika, především makrolidy (clindamycin, claritromycin, spiramycin) [6] a v České republice azitromycin [1]. V kombinaci s kortikosteroidy by se měl podat dva dny před jejich podáním, neboť samotná monoterapie kortikosteroidu by mohla vyvolat fulminantní průběh zánětu s fatálními následky pro oko [1], což platí i pro rekurentní formy, pokud se neaplikuje antiparazitická léčba s výsledně horší ZO [11]. Je správnější podat antibiotikum s kortikosteroidy než čekat na eventuální posun hladin protilátek potvrzující reaktivovanou infekční etiologii. Cílem léčby je u ložisek v centrální oblasti v akutní fázi rychlejší zhojení a zmenšení jizev, tím i zlepšení ZO [1]. U naší pacientky jsme úspěšné použili spiramycin. Z makrolidových antibiotik se zdá nejúčinnější Clindamycin, neboť proniká do očních tkání a penetruje do cyst parazita, čímž redukuje jejich počet [27]. Clindamycin byl aplikován u dospělých pacientů s těžkou formou akutních forem se zhoršenou ZO intravitreálně s perorálními kortikosteroidy [28] nebo celkově s intravitreální aplikací dexamethazonu [29], s regresí ložisek a zlepšením ZO. Toto antibiotikum bylo také použito v kombinaci s Cotrimoxazolem (sulfamethoxazol) patřící do škály sulfonamidů [30]. Celkově lze uzavřít, že nejvhodnější léčebnou kombinací je pyrimethamin + clindamycin + kortikosteroidy, jak dokládá uvedený případ laboratorně potvrzené získané OT. V první fázi léčby 28letého muže byl podán azithromycin, pyrimethamin a lokální steroid bez efektu. Přidružily se neurologické symptomy a teprve klasická trojkombinace sice zlepšila stav, ale pro vomitus byl sulfonamid vyměněn za clindamycin s celkovým klinickým i očním zlepšením [31]. Exacerbace OT je v průměru možná v 12–15 % v prvních dvou letech postižení a dále klesá. Byla zkoušena celková profylaxe celkovým podáním trimethoprimu a sulfamehoxazolu třikrát týdně podobu 12 měsíců, a to se sedminásobným snížením relapsů v průběhu tří let [32]. Obdobné potvrzení prokázal průběh 20ti měsíční randomizované studie [33]. Pro prevenci exacerbace zánětu je také vhodný clindamycin [27] či co-trimoxazol [31]. Medián doby bez recidivy zánětu byl významně prodloužen po použití systematické monoterapie kortisteroidy ve srovnání při použití samotné specifické antibiotické terapie proti toxoplazmóze [34].
Toxoplazmová retinochoroiditida může přinášet komplikace, a to subretinální neovaskularizace, uzávěr větví arteriol a venul a centrální makulární edém [6]. K jejich léčbě lze využit intravitreální aplikace anti-VEGF (vaskulární endotelový růstový faktor) především u neovaskularizací, a to ranibizumab [35] či aflibercept [36].
Problematika diagnostiky toxoplazmové etiologie u očního procesu spočívá v posouzení dynamiky změn hladin protilátek pro jasné stanovení diagnózy. Vyšší hodnoty IgG a IgM lze potvrdit jen v akutní fázi u získané formy, ale také u relapsu kongenitální formy jsou IgG nízké a IgM mohou chybět [6], kdy infekčnost procesu nelze takto potvrdit. Navíc pozitivní hladiny IgG mohou svědčit pro skutečnost, že jmenovaný se s parazitární infekcí setkal, mají pouze anamnestickou hodnotu [6], což potvrzuje vysokou promořenost populace. Mohou být falešně pozitivní výsledky např. u lupus erythomatodes [27] či u pacientů s antinukleárním a revmatoidním faktorem [6]. Pro dětský věk je charakteristická pozitivita IgE u očního akutního či exacerbovaného procesu při infekční etiologií [6]. U pacientky s neuritidou se titr těchto protilátek nestanovoval a u pacienta s vaskulitidou nebyly specifické.
Plané neštovice (varicella) i herpes zooster vyvolává stejný virus varicella-zooster virus. Vlastní varicella je typické onemocnění pro primoinfekci, zpravidla v dětském věku, projevující se horečkami s charakteristickým kožním exantémem, který se objevuje po inkubaci průměrně 14–16 dní. Papulomatózní výsev často přechází ve vřídky a může postihnout i sliznice. Progresivní varicella se projevuje u imunodeficientních dětí, nemocných s nádory a hematoblastózami či u podvyživených dětí matek, které neprodělaly varicellu. Tato forma i v současné době má až 10% úmrtnost. Celkové komplikace u jinak zdravých dětí jsou vzácné, a to intersticiální pneumonie či encefalitida (0,05 % nemocných). Symtomatická léčba je místní (tekutý pudr) a celková (paracetamol eventuálně při výrazném svědění antihistaminika). U závažných průběhů u imunokompromitovaných dětí je vhodná léčba acyklovirem. Preventivně u dětí se sníženou imunitou je vhodné podat specifický imunoglobulin (Varitec) nebo efekt má i klasický imunoglobulin (Norga), ale po expozici nákazou do tří dnů, tedy ještě před kožními projevy. Existují očkovací látky proti planým neštovicím, kterými lze aktivně imunizovat také vnímavé imunokompromitované jedince [37]. U našeho nemocného se o snížené imunitě dopředu nevědělo, navíc imunizace do tří dnů po expozici představuje technický problém, neboť časovou souvislost je těžké vždy určit.
K očním projevům patří také kožní léze na víčkách s možnými bodovými jizvícími se nekrózami. Dále se mohou také projevit konjunktivitidou a dendritickou intersticiální keratitidou vedoucí k neovaskularizacím [6]. Další postižení je již vzácné: přední uvetida, chorioretinitida a neuritida zrakového nervu či extraokulární parézy [38]. Byl zaznamenán případ jednostranné chorioretinitidy se žlutobělavými exsudáty s periflebitidou a vitritidou u mladého muže, kdy chorioretinitida se zajizvila [39]. Také byla pozorována jednostranná ischemická retinální vaskulitida s edémem zrakového nervu s poklesem ZO na pohyb před okem u 18letého mladíka s dvoutýdenní anamnézou varicelly. Byla léčena acyclovirem, zrakový nerv atrofoval a úroveň ZO se zlepšila jen na počítání prstů před okem [40]. U 10leté dívky proběhly plané neštovice měsíc před panuveitidou s nekrotizující retinitidou. Okamžitá antivirová terapie zánětlivé symptomy upravila [41]. Dva měsíce po varicelle u chlapce stejného věku se objevilo rozmazané vidění a rozšířené zornice pro vnitřní oftalmoplegii, byla detekovaná přední uveitida a intersticiální keratitida. Následná topická léčba steroidy zánětlivé symptomy utlumila, ale vnitřní oftalmoplegie přetrvala [42]. Dále byla popsaná i neuritida optiku s retinitidou makuly u tříletého chlapce již tři dny po objevení planých neštovic. ZO byla postižena pro výše uvedené postižení [43]. U imunokompromitovaných dětí se mohou objevit retinitidy po varicelle, např. u lymfoblastické leukémie [44] nebo primární imunodeficienci [45]. Všechna tato raritní pozorování ukazují, že i plané neštovice mohou mít zásadně negativní dopad na zrakový orgán. Proto ve spojení s toxoplazmózou u našeho imunokompromitovaného pacienta v době těchto zánětů devastovaly ZO na obou očích na úroveň slepoty přes veškerou léčebnou snahu. Dokládá to i histologický rozbor, kdy vaskulitida v počátku byla způsobena varicellou, ale již v té době mohla mít na zánětlivý nitrooční proces vliv do té doby eventuálně skrytá toxoplazmóza. Pro akutní fázi zánětu pod obrazem vaskulitidy svědčily trombózy. Granulomatózní forma retinochoroiditidy byla chronickou, „quiscent“ fází příslušnou spíše pro toxoplazmovou infekci s patrnými pseudomicrocystami s bradyzoity. Stará ložiska byla potom charakteristická nekrózou a kalcifikacemi [46].
ZÁVĚR
Cílem sdělení bylo ukázat na problematiku a pestrost obrazů OT, kdy na léčebné postupy nejsou jednotné názory i proto, že snahy o terapii nejsou vždy úspěšné. Atypická forma OT intraokulární neuritidy u imunokompetentní pacientky měla příznivý průběh a normalizaci ZO, zatímco retinální vaskulitida s retinochoroiditidou u přechodně imunokompromitovaného pacienta skončila oboustrannou slepotou.
Autoři práce prohlašují, že vznik a téma odborného sdělení a jeho zveřejnění není ve střetu zájmů a není podpořeno žádnou farmaceutickou firmou. Práce nebyla zadána jinému časopisu ani jinde otištěna kromě kongresových abstrakt či doporučených postupů.
Předneseno na Vědeckém dni ČOS (Česká oftalmologická společnost) – Den uveitid, Praha, 2007, na 49. výročním meetingu EOPS (Europen Ophtalologic Pathology Society) v Dublinu, 2010, na 16. Vejdovském vědeckém dni, Olomouc, 2015 a na 14. Sympóziu detskej oftalmologie, Bratislava, 2019.
Připomenutí prof. MUDr. Josefa Janků, DrSc. – světově významného oftalmologa a histologa, objevitele oční toxoplazmózy, kdy uběhlo 100 let od odhalení tohoto světového prioritního pozorování, které bylo publikováno o rok později.
Do redakce doručeno dne: 14. 1. 2022
Přijato k publikaci dne: 27. 7 2022
MUDr. Jan Krásný
Oční klinika FNKV Praha
Šrobárova 56
10034 Praha 10
E-mail: jan.krasny@fnkv.cz
Sources
1. Říhová E, et al. Uvetitidy [Uveites], 1.ed., Praha (Czech Republic); Grada; 2009; Jeníčková D. Toxoplasmóza [Toxoplamosis], Chapter 2.1.2. pp. 32-34. Czech.
2. Kolin J. Odhalení pamětní desky Prof. MUDr. Josefa Janků (1886-1968). [The uveiling of the memorial plaque of professor Josef Janků, MD. (1886-1968)]. Ces Slov Oftalmol. 2008;64 : 252. Czech.
3. Řehák S, Řehák J. Historie očního lékařství v Čechách, na Moravě a na Slovensku. [History of ophthalmology in the Bohemia, Moravia and Slovakia]. Ces Slov Oftalmol. 2002;58: suppl. 35-36. Czech.
4. Janků J. Patogenese a patologická anatomie vrozeného kolobómu Toxoplasmosy žluté skvrny oka na normálně velikém a mikroftalmickém oku s nálezem parazita v sítnici [Patogenesis and pathologic anatomy of congenital coloboma of toxoplasmosis yellow spot of the eye on a normaly large and microophthalmia a finding of a parasite in the retina]. Cas Lek Ces. 1923;62 : 1021 - 1027. Czech.
5. Janku. J. Die pathogenese und pathologische anatomie des sogenannten ageborenen koloboms des gelhen flecks in normal grossen sowie mikrophalmischen auge mit parasi - tenbefunl in der netzhaut. Cls Parasit.1959;6 : 9-16. German
6. Pepose JS, Holland GH, Wilhalmus KR. Ocular Infection Immunity. St. Louis (USA); Mosby; 1996; Holland GH. O´Connor R, Belfort R, Remington JS. Toxoplasmosis, Chapter 85. pp. 1183 - 1224.
7. Scherer J, Iliev ME, Halberstadt M, et al. Visual function in human ocular toxoplasmosis. Br J Ophthalmol. 2007;91 : 233-236.
8. Divišová G, Kadlecová V, Lomíčková H, Brůnová B. Dětské uveitidy. [Childhood uveitis]. Cesk Oftalmol. 1967; 23 : 86-94. Czech.
9. Lomíčková H. Endogenní uveitid u dětí. [Endogenous uveitis in childhood]. Cesk Oftalmol. 1973; 29 : 213-220. Czech.
10. Maršolková K. Timkovič J. Lesková V. et al. Congenital central toxoplasma chorioretinitis – Case study. Ces Slov Oftal. 2018;74 : 114 - 118. doi:10.31348/2018/1/6-3-2018
11. Bosch-Driessen L, Berendschot Z, Ongkosuwito J, Rothova A. Ocular toxoplasmosis: clinical features and prognosis of 154 patients. Ophthalmology. 2002;109 : 869-878.
12. Simek M. Ozdal PC, Kocer AM. Optic nerve involoment in ocular toxoplasmosis: 12 year data from a tertiary center in Turkey. Arq Bras Oftalmol. 2019;82 : 302-309.
13. Garza-Leon M, Garcia LA. Ocular toxoplasmosis: clinical characteristics in pediatric patients. Ocul Immunol Inflamm. 2012;20 : 130 - 138.
14. Kraus-Mackiw E, O´Connor GR. Uveitis - Pathophysiology and Therapy. New York (USA); Thieme – Stratton; 1983; O´Connor GR. Endogenous uveitis, Chapter 4. pp. 117-151.
15. Wyler DJ, Blockman HJ, Lunda MN. Cellular hypersensitivity to toxoplamosis and retinal antigens in patients with toxoplasmal retinochoroiditis. Am J Trop Med. 1980;29 : 1181-1192.
16. Nussenblatt RB, Gery I, Ballontine EJ, Wacker WB. Cellular immune responsiveness of uveitis patient to retinal S-antigen. Am J Ophthalmol. 1980; 173 : 89-95.
17. Bečvář R. Primární vaskulitidy – aktuální diagnostika a léčba. [Primary vascultitis – current diagnosis and treatment]. Ces Slov Patol. 2020; 56 : 74-82. Czech.
18. Krásný J, Šach J, Daňková, E. Oboustranná panuveitida komplikovaná toxoplasmovou infekcí při vrozené hypogamaglobulinémii. [Bilateral panuvetis with complicity of toxoplasmosa infection in congenitale hypogamaglobulinemia]. Volume of abstrakt XIV. Symposium of pediatric ophthalmology, ISBN 978-80-89797-47-9, Bratislava, 2019 : 13.
19. Liu Q, Wang ZD, Huang SY, et al. Diagnosis of toxoplasmosis and typing of toxoplamosis gondi. Ocul Immunol Inflamm. 2018;26 : 1200 - 1202.
20. Rajput R, Denniston AK, Murray PI. False negative toxoplasmosis serology in an immunocopromised patient with PCR positive ocular toxoplasmosis. doi: 10.1080/09273948.2017.1332769
21. Munoz-Ortiz J, Rubio-Romero OL, Cedeno MC, et al. A white circular - spot pattern of iridis atrophy associated with Varicella-zooster virus and Toxoplamosis gondii coinfection: a case report. BMC Ophthalmol. 2020;20 : 479. doi: 10.1186/s12886-020-01748-8
22. Yanoff M, Sassani JW. Ocular Pathology, 6th ed. New York (USA); Mosby; 2009; Yanoff M. Parasitic diseases, Chapter 5, pp. 88-90.
23. Holland G.N. Ocular toxoplasmosis: a globalreassessment. Part I: epidemiology and course of disease. Am J Ophthalmol. 2003;136 : 973-988.
24. Eyles DE, Coleman N. Synergitic effect of sulfodiazine and daraprim against experimental toxoplasmosis in the mouse. Antibiotic chemother. 1953;3 : 483-490.
25. Geleneky M, Prášil P, Kodym, P. Doporučený postup pro diagnostiku a léčbu toxoplasmózy. [Recommended diagnosis and treatment of toxoplamosis]. Czech. www.infekce.cz/doportoxo17
26. Ozgonul C, Besirdi CG. Recent development in the diagnosis and treatment of ocular toxoplasmosis. Ophthmol Res. 2017;57 : 57 : 1 - 12.
27. Tabbara KF, O´Connor GR. Treatment of ocular toxoplasmosis with Clindamycin and Sufadiazine. Ophthalmology. 1980;87 : 129-134.
28. Del Barno LT, Morelo HH, Cuadro MM, et al. Intravitreal clindamycin as a therapeutic alternative in severe ocular toxoplasmosis. Arch Soc Esp Oftamol. 2019;94 : 602-604.
29. Zamora YF, Arantes T, Reis FA, et al. Local treatment of toxoplasmosis retinochorioiditis with intravitreal clindamycin and dexamethazone. Arq Bras Oftalmol. 2015;78 : 216-219.
30. Rothova A, Meenken C, Buitenhuis HJ, et al. Therapy for ocular toxoplasmosis. Am J Ophthalmol. 1993;115 : 517-523.
31. Matias M, Gomes A, Marques T, Fonseca AC. Ocular toxoplasmosis: a very rare presentation in an immunocompetent paient. BMJ Case Rep. 2014: doi. 11 : 11136/BCR-2014-205846
32. Pleyer U, Ness T, Garweg J. Prävention das Wiederauftretens von Toxoplasmosis – Was? Wie? Dem? [Prevention of Recurrence of Toxoplasmosis – What? How? Whom? ]. Klin Monbl. Augenheilkd. 2020;237 : 559-604. German.
33. Holland G.N. Ocular toxoplasmosis: a globalreassessment. Part II: disease manifestation and management. Am J Ophthalmol. 2004;137 : 1-17.
34. Reich M, Becker MD, Mackensen F. Influence of drug therapy on the risk of recurrence of ocular toxoplasmosis. Br J Ophthalmol. 2016;100 : 195-199.
35. Shah NJ, Shah U. Intravitreal ranibizulab for the treatment of choriodal neovascularization secundary to ocular toxoplasmosis. Indian J Ophthalmol. 2011;59 : 318-319.
36. Korol AR, Zborovska O, Kustrym T, et al. Intravitreal aflibercept for choriodal neovacularization associated with chorioretinitis: a pilot study. Clin Ophthalmol. 2017;11.1351-1320.
37. Hrodek O, Vavřinec J et al. Pediatrics (Pediatrie). Praha (Czech Republik): Galén; 2002. Chapter 28. Havlík J Infectious disease (Infektologie): pp. 626-627. Czech.
38. Pepose JS, Holland GH, Wilhalmus KR. Ocular Infection Immunity. St. Louis (USA); Mosby; 1996; Paulat-Longiton D, Danken E. Varicella - zoster virus disease. Chapter 72. pp.: 932-957.
39. Kitamei H, Namba K, Kitaichi N, et al. Chickenpox chorioretinitis with retinal exudates and periphlebitis. Case Rep Ophthalmol. 2012;3 : 180-184.
40. Poonyathalang A, Sukavatcharin S, Sujirakal T. Ischemic retinal vasculitis ab 18-year-old man with chickenpox infection. Clin Ophthalmol. 2014;8 : 441-443.
41. Shin YU, Kim J, Hong EH, et al. Varicella-Zoster virus associated necrotizing retinitis after chickenpox in a 10-year-old female: a case report. Pediatric Infect Dis J. 2017; 36 : 1008-1011.
42. Fernandez de Castro LE, Sarraf OA, Hawthorne KM, et al. Ocular manifestation after primary varicella infection. Cornea. 2006;25 : 866-867.
43. Tappeiner C, Aebi C, Garweg JG. Retinitis and optic neuritis a child with chickenpox: case report and review of literature. Pediatric Infect Dis J. 2010;29 : 1150-1152.
44. Ross A, McLean TW, Farber R, et al. Retinitis following varicella in a vaccinated child with acute lymphoblastic leukemia. Pediatr Blodd Cancer. 2005;45 : 191-194.
45 Kumar A, Ziahosseini K, Saeed MU, et al. Bilateral viral retinitis with immune deficiency because of purine nucleoside phosphorylase deficiency. Retin Cases Brief Rep. 2012; 6 : 153-155.
46. Šach J, Krásný J. Ocular toxoplasmosis. Protocol of 49. annular meeting of EOPS (Europen Ophthalmological Pathology Society), Dublin, 2010.
Labels
Ophthalmology
Article was published inCzech and Slovak Ophthalmology
2022 Issue 5-
All articles in this issue
- ANALÝZA PŘEDOZADNÍHO POMĚRU OPTICKÉ MOHUTNOSTI ROHOVKY POMOCÍ OCT
- PRIMÁRNÍ GLAUKOM OTEVŘENÉHO ÚHLU NA PODKLADĚ MUTACÍ V GENU MYOC
- CHELACE ZONULÁRNÍ KERATOPATIE V DLOUHODOBÉM SLEDOVÁNÍ
- ATYPICKÉ FORMY OČNÍ TOXOPLAZMÓZY V DĚTSTVÍ. KAZUISTIKY
- PANDÉMIA SARS-COV-2 Z POHĽADU OFTALMOLÓGA. PREHĽAD
- THE EXACTNESS OF INTRAOCULAR LENS POWER CALCULATION FORMULAS FOR SHORT EYES AND CORRELATION BETWEEN METHOD ACCURACY AND EYEBALL AXIAL LENGTH
- Czech and Slovak Ophthalmology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- CHELACE ZONULÁRNÍ KERATOPATIE V DLOUHODOBÉM SLEDOVÁNÍ
- PANDÉMIA SARS-COV-2 Z POHĽADU OFTALMOLÓGA. PREHĽAD
- ATYPICKÉ FORMY OČNÍ TOXOPLAZMÓZY V DĚTSTVÍ. KAZUISTIKY
- PRIMÁRNÍ GLAUKOM OTEVŘENÉHO ÚHLU NA PODKLADĚ MUTACÍ V GENU MYOC
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career


