-
Medical journals
- Career
Stereotaktická rádiochirurgia (LINAC) uveálnych melanómov; postradiačné komplikácie
Authors: A. Furdová 1; M. Šramka 2; I. Waczulíková 3; M. Chorvath 2; O. Trompak 2; I. Krčová 1; K. Horkovičová 1
Authors‘ workplace: Klinika oftalmológie Lekárskej fakulty Univerzity Komenského a Univerzitná nemocnica, Nemocnica Ružinov, Bratislava, prednosta doc. MUDr. Vladimír Krásnik, PhD. 1; Klinika stereotaktickej rádiochirurgie OÚSA a VŠZaSP, Bratislava, prednosta prof. MUDr. Miron Šramka, DrSc. 2; Katedra jadrovej fyziky a biofyziky, Oddelenie biomedicínskej fyziky, Fakulta matematiky, fyziky a informatiky Univerzity Komenského, Bratislava, vedúci doc. RNDr. Stanislav Tokár, CSc. 3
Published in: Čes. a slov. Oftal., 71, 2015, No. 3, p. 134-142
Category: Original Article
Časť práce bola prednesená na XXII. Výročnom zjazde Českej oftalmologickej spoločnosti v Prahe, jún 2014.
Overview
Cieľ práce:
V práci hodnotíme skupinu pacientov s malígnym melanómom uvey liečených stereotaktickou rádiochirurgiou v r. 2009–2011 na lineárnom urýchľovači LINAC.Materiál a metodika:
V r. 2009–2011 sme sledovali 40 pacientov s malígnym melanómom uvey v štádiu T2 a T3, ktorí boli liečení stereotaktickou rádiochirurgiou (LINAC), terapeutická dávka TD 35,0 Gy, TD max 42,0 Gy. Hodnotili sme vplyv faktorov (vek, ožiarenie rizikových štruktúr, čas) na hodnotu vnútroočného tlaku (VOT) a časové zmeny vnútroočného tlaku po zákroku medzi kontrolnou skupinou a skupinou pacientov, ktorí podstúpili enukleáciu.
Normálnosť rozdelenia dát sme testovali Shapiro-Wilkovým W testom a graficky. Vzťahy medzi parametrami boli testované pomocou jednoduchej a viacnásobnej lineárnej regresie (korelačné koeficienty r, hladina významnosti p).Výsledky:
Priemerný vek v súbore 40 pacientov s malígnym melanómom indikovaných na stereotaxiu na lineárnom urýchľovači v r. 2009 až 2011 bol 55,13 ± 11,11 rokov. Priemerná maximálna dávka žiarenia pre citlivé štruktúry bola pre terč zrakového nervu 12,0 Gy a pre corpus ciliare 10,0 Gy.
Analýza v našej skupine potvrdzuje, že prevalencia tumoru nezávisí od pohlavia, zvyšuje sa s vekom, pričom najviac pacientov je diagnostikovaných medzi 60. a 70. rokom života.
Analýza rozdielu vnútroočného tlaku (VOT) pred zákrokom neukázala signifikantný rozdiel medzi skupinou mužov a žien (p = 0,54). Pomocou jednoduchej lineárnej regresie sme nepotvrdili predpoklad súvisu hodnoty VOT pred stereotaktickou rádiochirurgiou s vekom (r = -0,09, p = 0,65). Viacnásobnou lineárnu regresiou sme hodnotili vzťah medzi prediktormi (dávkou na rizikových štruktúrach – šošovke a zrakovom nerve) a zmenou hodnoty VOT od hodnoty pred stereotaxiou v každom časovom intervale. Vzťahy medzi prediktormi (dávka na šošovky – L, dávka na zrakovom nerve – O) a hodnotami VOT v celom súbore sú popísané parciálnymi korelačnými koeficientami po 2 týždňoch. Za signifikantné vzťahy považujeme koreláciu medzi dávkou na šošovke a VOT v čase 1 roku, 1,5 roka, 2 a 4 rokoch po zákroku.Záver:
Jednorázová stereotaktická rádiochirurgia na lineárnom urýchľovači LINAC je možná v dávke 35,0–38,0 Gy u vnútroočných melanómov v štádiu T1 až T3. Podľa našich výsledkov ide o vysoko efektívnu metódu liečby uveálnych melanómov s eleváciou do 6 mm a objemom do 0,4 cm3. Sekundárny glaukóm je jednou z najzávažnejších príčin enukleácie po jednorázovom rádiochirurgickom výkone na lineárnom akcelerátore (LINAC) uveálneho melanómu, percento enukleácií v našom sledovanom súbore (17,5 %) pre sekundárny glaukóm je približne rovnaké ako v iných štúdiách.Kľúčové slová:
vnútroočné nádory, malígny melanóm uvey, stereotaktická rádiochirurgia, lineárny akcelerátorÚvod
Malígny melanóm je najčastejšie sa vyskytujúcim vnútroočným nádorom v dospelosti a jeho diagnostika ešte aj v súčasnosti naráža na mnohé nejasnosti. Liečba závisí od štádia, v ktorom bol proces diagnostikovaný aj od celkového stavu pacienta. Stanovenie diagnózy vnútroočného melanómu v minulosti znamenalo radikálny operačný prístup – enukleáciu bulbu, resp. až exenteráciu orbity. V posledných rokoch sa ustupuje od primárnej radikálnej liečby a do popredia sa dostávajú postupy zachovávajúce orgán zraku.
Malígny melanóm uvey (MMU), v 75–85 % lokalizovaný v choroidey, je najčastejším primárnym vnútroočným nádorom u dospelých. Jednou z možností liečby je využitie ionizujúceho žiarenia pri stereotaktickej rádiochirurgii z externého zdroja žiarenia pomocou lineárneho urýchľovača (LINAC). Cieľom liečby je cielené ožiarenie nádoru terapeutickou dávkou 35,0 Gy a zároveň minimalizácia škodlivého vplyvu žiarenia na citlivé štruktúry oka, ako je cievny systém sietnice, terč zrakového nervu a corpus ciliare [14, 25, 36].
Napriek maximálnej snahe vyhnúť sa poškodeniu rádiosenzitívnych štruktúr, úplná eliminácia tohto rizika nie je možná. Hlavným dôvodom je častý výskyt nádoru v oblasti fovey alebo terču zrakového nervu. Najčastejšou a zároveň najzávažnejšou postradiačnou komplikáciou je sekundárny glaukóm. Vzniku sekundárneho glaukómu predchádza rozvoj rubeosis iridis na podklade neovaskularizácie. Predpokladá sa, že ožiarenie ciev vedie k ischémii, ktorá následne podporuje novotvorbu ciev a rozvoj sekundárneho glaukómu, ktorý v niektorých prípadoch môže byť dôvodom k enukleácii bulbu. Pri ischémii je zvýšená tvorba faktorov, ako sú VEGF (cievny endotelový rastový faktor), oxid dusnatý, zápalové cytokíny, voľné radikály a zvýšená akumulácia intracelulárneho glutamátu. Najdôležitejší je práve VEGF, ktorý podnecuje tvorbu ciev dúhovky a fibrovaskulárneho tkaniva, tvorbu synechií a uzáver uhla, čo mechanicky bráni odtoku vnútroočnej tekutiny a vedie k narastaniu vnútroočného tlaku. So zvyšovaním vnútroočného tlaku klesá perfúzny tlak, čo zhoršuje ischemický stav zrakového nervu a buniek sietnice a vedie k ich poškodeniu, čo má za následok zužovanie zorného poľa, slepotu, alebo nutnosť pristúpenia k enukleácii bulbu [32].
Cieľ práce
Sledovanie skupiny pacientov s malígnym melanómom uvey liečených stereotaktickou rádiochirurgiou v r. 2009–2011 na lineárnom urýchľovači LINAC, sledovanie postradiačných komplikácií.
Metodika
Sledovali sme 40 pacientov s malígnym melanómom uvey v štádiu T2 a T3, ktorí boli liečení stereotaktickou rádiochirurgiou (LINAC) v období 2009 až 2011, terapeutická dávka do ložiska bola TD 35,0 Gy, maximálna TD max 42,0 Gy (obr. 1, 2, 3, 4, 5).
Image 1. Označenie nádorového intrabulbárneho ložiska (červená farba) a rizikových štruktúr (šošovky, zrakové nervy, kmeň) pred vytvorením stereotaktického rádiochirurgického plánu pre pacienta s malígnym melanómom choroidey 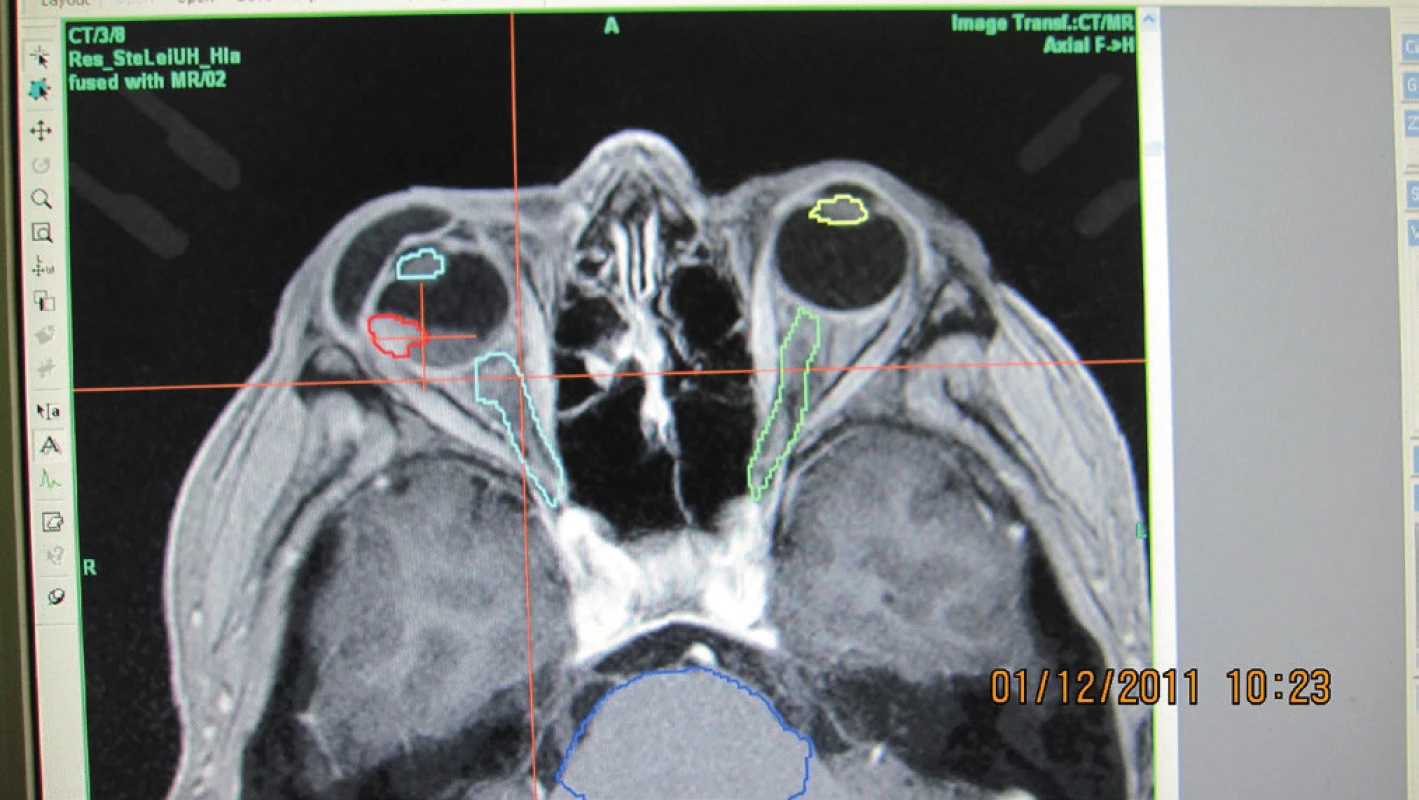
Image 2. Stereotaktický rádiochirurgický plán pacienta s malígnym melanómom choroidey, grafické naznačenie DVH (Dose Volume Histogram) 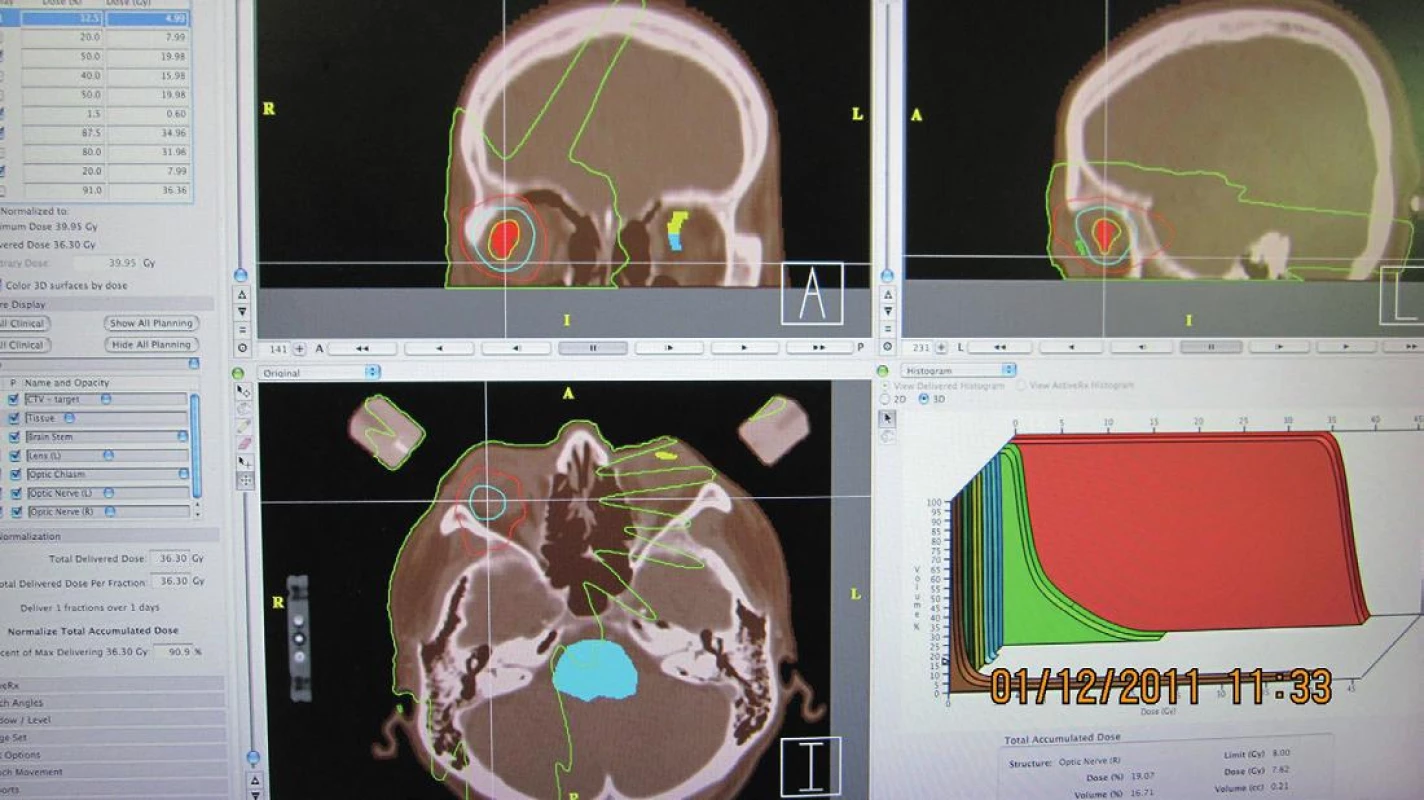
Image 3. Poloha pacienta s naloženým stereotaktickým kruhom a imobilizovanou očnou guľou pred ožiarením 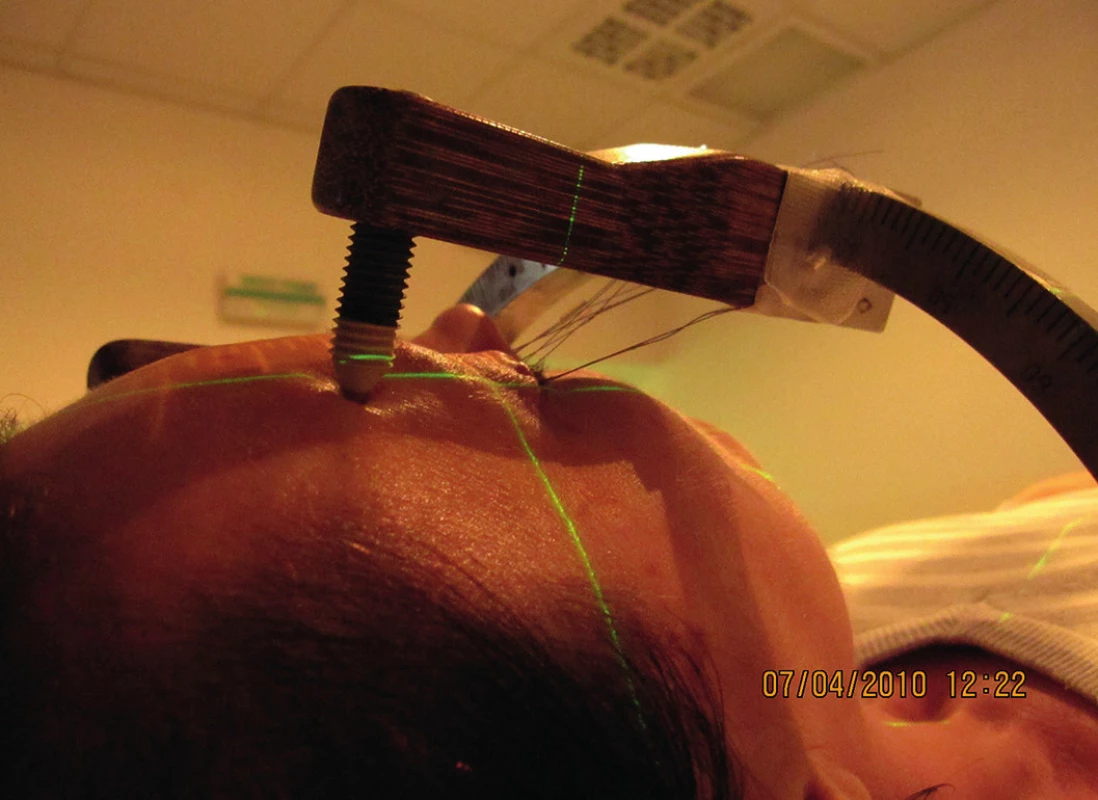
Image 4. Stereotaktický rádiochirurgický plán pacientky s veľkým vnútroočným melanómom – objem 1,0 cm<sup>3</sup> (apríl 2010) 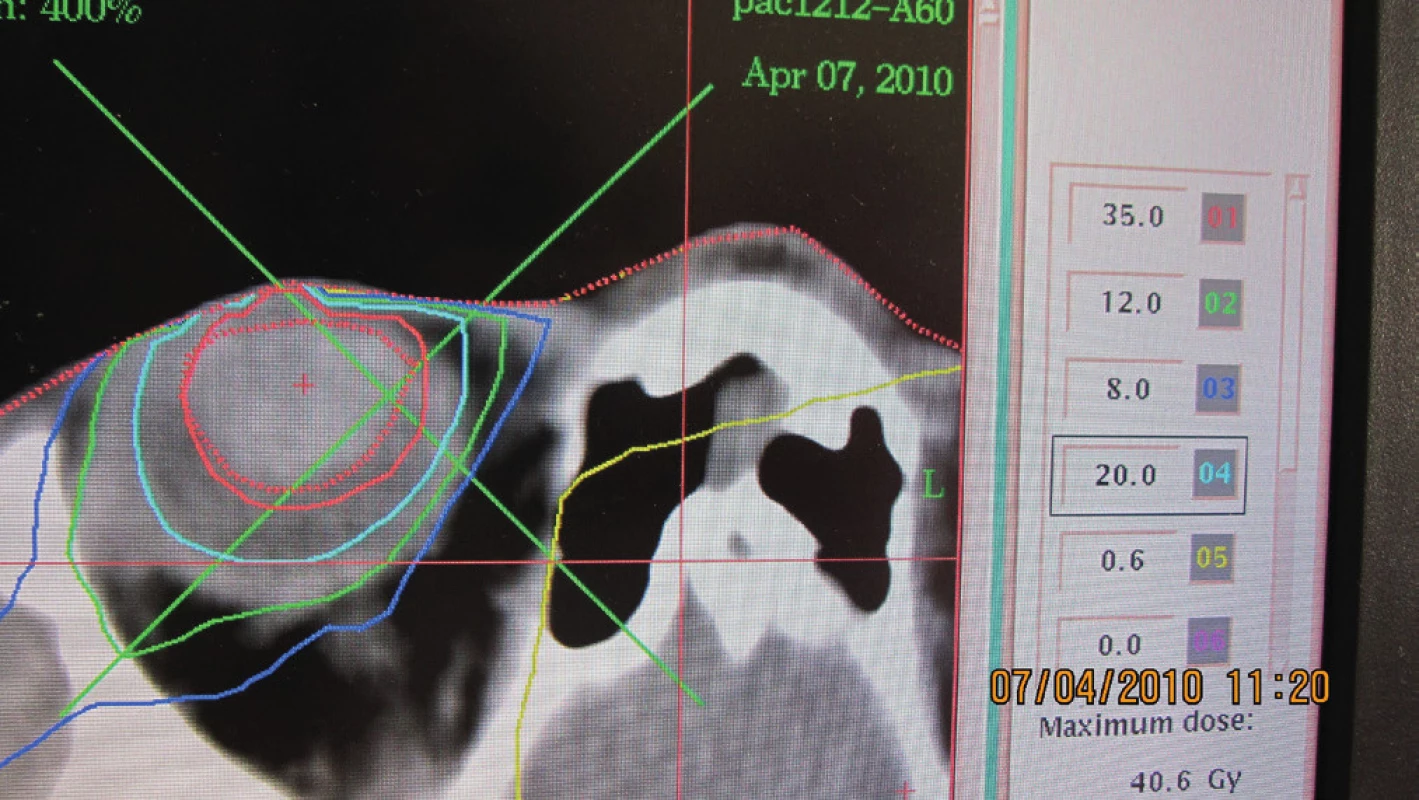
Image 5. Poloha pacientky pri ožiarení na lineárnom urýchľovači (apríl 2010) 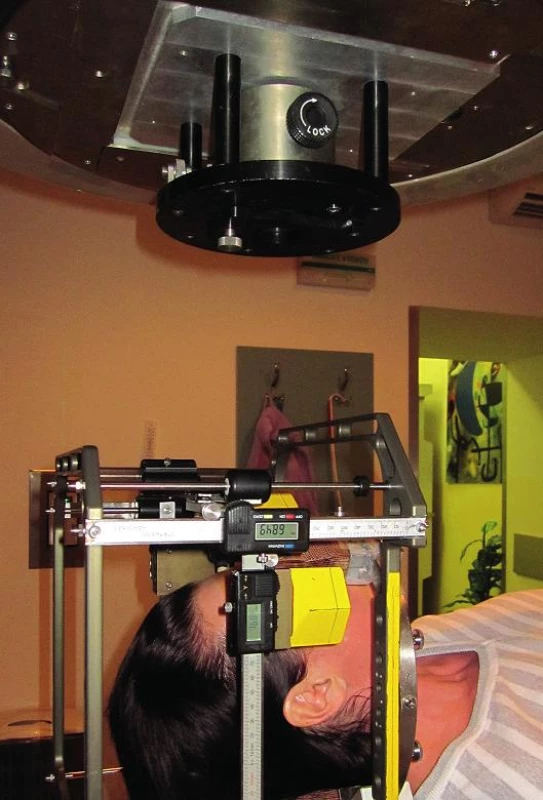
Hodnotili sme vplyv faktorov (vek, ožiarenie rizikových štruktúr, čas) na hodnotu vnútroočného tlaku (VOT) a časové zmeny vnútroočného tlaku po zákroku medzi kontrolnou skupinou a skupinou pacientov, ktorí podstúpili enukleáciu.
Normálnosť rozdelenia dát sme testovali Shapiro-Wilkovým W testom a graficky. Vzťahy medzi parametrami boli testované pomocou jednoduchej a viacnásobnej lineárnej regresie (korelačné koeficienty r, hladina významnosti p). Hodnotenie rozdielov medzi skupinami v čase sme vykonali pomocou dvojfaktorovej analýzy variancie (ANOVA). Všetky testy sme uskutočnili na hladine významnosti alfa 5 % (α = 0,05). Výsledky boli štatisticky spracované a vyhodnotené pomocou programu StatsDirect® 2.7.8 software (StatsDirect Ltd., Cheshire, UK, GraphPad Prism 6.01 (GraphPad Software Inc.) a Microsoft Office Excel 2007.
Výsledky
Priemerný vek v súbore 40 pacientov s malígnym melanómom uvey, ktorí boli indikovaní na stereotaktickú rádiochirurgiu na lineárnom urýchľovači v r. 2009 až 2011 bol 55,13 ± 11,11 rokov. Priemerná maximálna dávka žiarenia pre citlivé štruktúry bola pre terč zrakového nervu 12,0 Gy a pre corpus ciliare 10,0 Gy. Enukleáciu bolo nutné vykonať v 7 prípadoch, a to s priemerným časovým odstupom 14 mesiacov po stereotaktickom rádiochirurgickom výkone.
Analýza v našej skupine potvrdzuje, že prevalencia tumoru nezávisí od pohlavia, zvyšuje sa s vekom, pričom najviac pacientov je diagnostikovaných medzi 60. a 70. rokom života.
Analýza rozdielu vnútroočného tlaku (VOT) pred zákrokom neukázala signifikantný rozdiel medzi skupinou mužov a žien (p = 0,54). Pomocou jednoduchej lineárnej regresie sme nepotvrdili predpoklad súvisu hodnoty VOT pred stereotaxiou s vekom (r = -0,09, p = 0,65). Viacnásobnou lineárnu regresiou sme hodnotili vzťah medzi prediktormi (dávkou na rizikových štruktúrach – šošovke a zrakovom nerve) a zmenou hodnoty VOT od hodnoty pred stereotaxiou v časovom intervale. Vzťahy medzi prediktormi (dávka na šošovky – L, dávka na zrakovom nerve – O) a hodnotami VOT v celom súbore sú popísané parciálnymi korelačnými koeficientami po 2 týždňoch. Za signifikantné vzťahy považujeme koreláciu medzi dávkou na šošovke a VOT v čase 1 roku, 1,5 roka, 2 a 4 rokoch po zákroku.
Pri porovnaní hodnôt VOT získaných v rôznych časových obdobiach medzi kontrolnou skupinou a enukleovaných pacientov sme dáta vyniesli do grafu krabicového typu (odľahlé hodnoty, min. interkvartilové rozpätie 25–75 %, max. odľahlé hodnoty). Rozdiely medzi skupinami boli hodnotené pomocou dvojfaktorovej analýzy rozptylu ANOVA (graf 1). Analýza poukázala na významné rozdiely v priemeroch medzi skupinami - kontrolná a po enukleácii (p < 0,0001), v priemerných hodnotách VOT v rôznych časoch zaznamenania (p = 0,0005). Zároveň je signifikantná aj interakcia medzi oboma faktormi - časom a zaradení do skupiny (p = 0,0118).
Na zistenie odlišností medzi dvomi skupinami v čase sme použili metódu viacnásobného porovnania. Za signifikantný rozdiel medzi skupinami – kontrolnej a po enukleácii je považovaný rozdiel v čase 2 týždňov (p = 0,004), 24 mesiacov (p = 0,03) a 36 mesiacov (p = 0,009) po zákroku (graf 1).
Graph 1. Grafické zobrazenie hodnôt VOT v skupine pacientov po enukleácii a kontrolnej skupiny v časovom vývoji 
Postradiačné komplikácie po stereotaktickej rádiochirurgii
Prechodné ťažkosti bezprostredne po stereotaktickej rádiochirurgii (erózia rohovky po vybratí stehov) sa u všetkých pacientov riešili lubrikanciami a antibiotickými kvapkami, nezaznamenali sme neskorú komplikáciu defektu rohovky, ktorá by bola indikáciou napríklad na našitie amniovej membrány.
Skoré ani neskoré postradiačné komplikácie na koži okolia oka sme nezaznamenali, u 2 pacientov sme zaznamenali madarózu – v intervale viac ako 12 mesiacov od ožiarenia, na strane, kde bolo ožarované ložisko v bulbe, ale bez kozmetických problémov.
Z neskorých komplikácií po jednorázovom rádiochirurgickom výkone sme zaznamenali u 3 pacientov keratopatiu viac ako 2 roky po ožiarení (išlo o lézie v oblasti corpus ciliare a dávka na oblasť komorového uhla a rohovku bola viac ako 10,0 Gy). Tieto neboli indikáciou k enukleácii.
U 2 pacientov po kombinovanej rádiochirurgii a následnej inkompletnej endoresekcii bulbus postupne prešiel z glaukómového štádia v priebehu ďalšieho roka do atrofie aj s nálezom na rohovke a bola indikovaná enukleácia.
Komplikácie u pacientov po izolovanej stereotaktickej rádiochirurgii, ktoré viedli až k sekundárnej enukleácii u 5 pacientov, boli u každého pacienta spojené s prítomnosťou reziduálneho tumoru alebo progresiou primárneho ložiska. U každého pacienta bol základnou indikáciou k enukleácii sekundárny glaukóm s hodnotami VOT nad 55 Torr, konzervatívnym postupom nezvládnuteľný. U týchto pacientov bol prítomný hemoftalmus – štvrté štádium klasifikácie podľa Fingera a zistili sme aj prítomnosť krvácania do prednej komory.
Postradiačná katarakta
U 5 pacientov bola indikovaná operácia katarakty aj s implantáciou umelej vnútroočnej šošovky na ožiarenom bulbe. Neskoré komplikácie na šošovke kontralaterálneho oka sme nezaznamenali v žiadnom prípade.
U pacientov, u ktorých bola operovaná katarakta s implantáciou umelej vnútroočnej šošovky (UVŠ) v intervale od 2 do 5 rokov po stereotaktickej rádiochirurgii (SRCH) a nemali sme k dispozícii údaje o opalescencii zadného puzdra v časovom intervale, sme ďalej tieto zmeny nehodnotili.
Stabilizovaný nález viac ako 2 roky po ožiarení bulbu sme zaznamenali u 15 pacientov bez ohľadu na progresiu senilnej katarakty, resp. nález na šošovke pred SRCH výkonom na lineárnom urýchľovači. Rozvoj postradiačnej katarakty v časovom intervale po stereotaxii viac ako 2 roky bol len postupný (obr. 6, 7).
Image 6. Nález na prednom segmente pacientky v apríli 2013 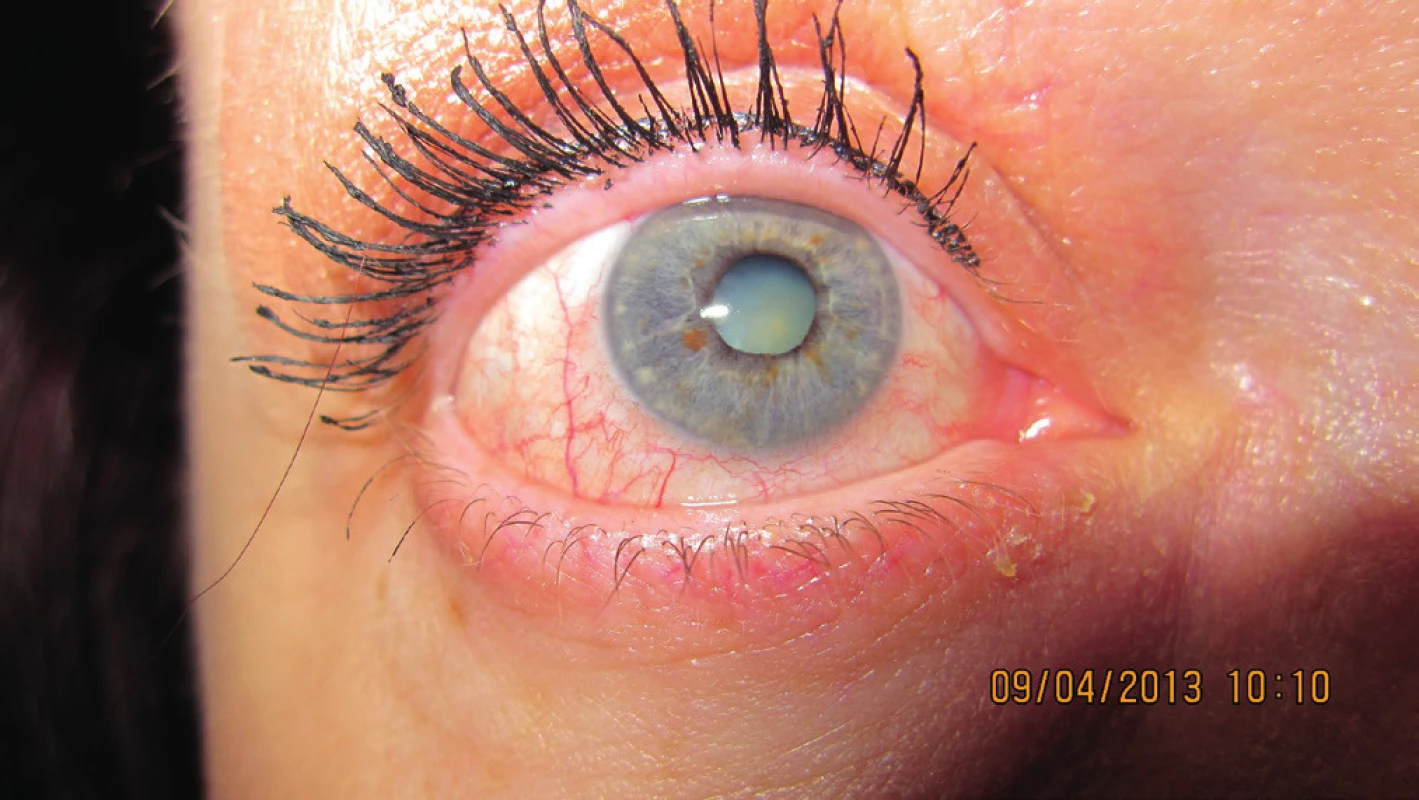
Image 7. Nález na prednom segmente pacientky vo februári 2014 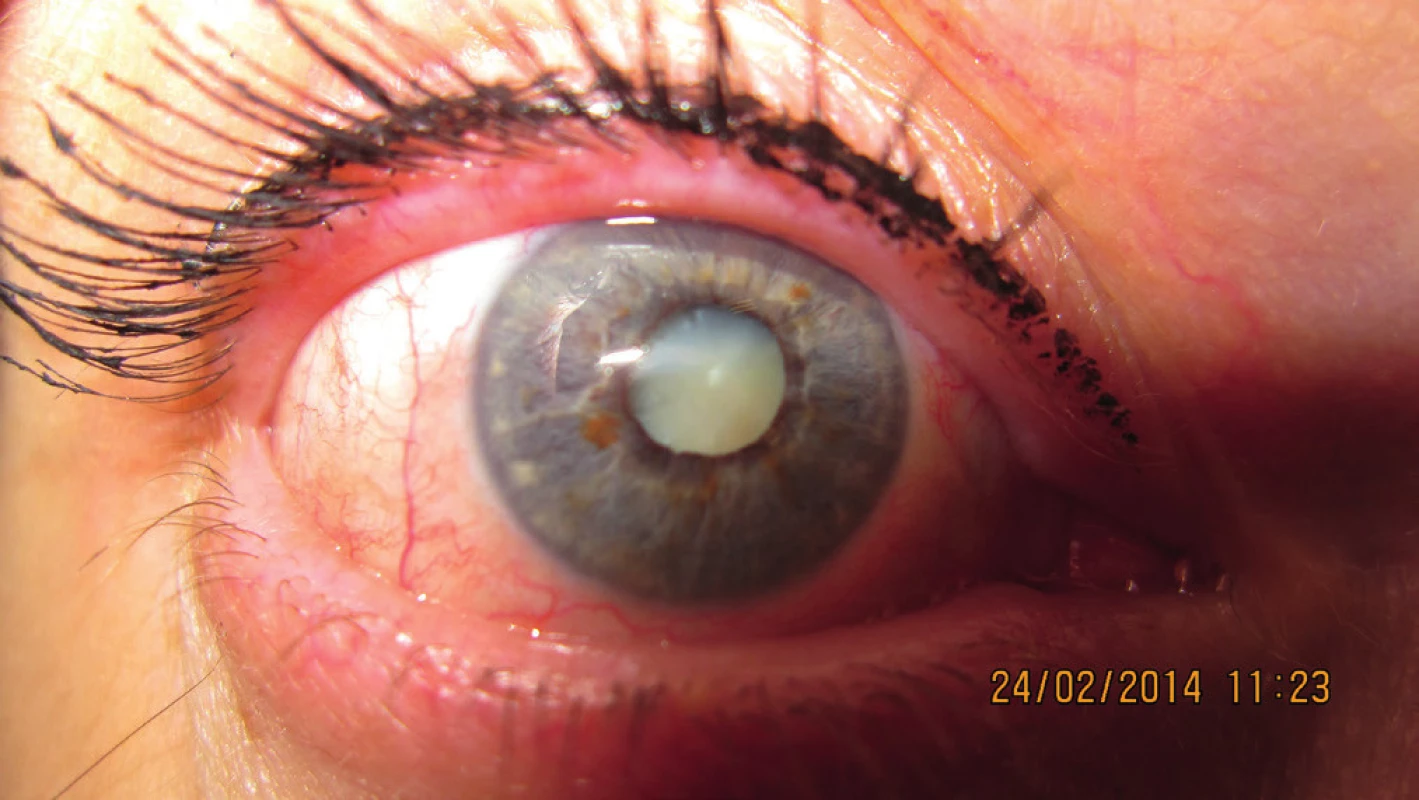
Postradiačná optikoneuropatia
Postradiačná optikoneuropatia sa zaznamenala u 8 pacientov v intervale 12 až 24 mesiacov od stereotaktickej rádiochirurgie. V týchto prípadoch išlo o ložisko vo vzdialenosti do 2 PD od terča. U 4 pacientov, u ktorých bola dávka ožiarenia viac ako 12,0 Gy na oblasť hranice terča zrakového nervu, došlo v dobe od 12 do 24 mesiacov k rozvoju postradiačnej neuropatie a ischemickým zmenám sietnice a postupne viedli k vzniku sekundárneho glaukómu. U jedného pacienta s peripapilárnym ložiskom s eleváciou do 4 mm v intervale 24 mesiacov od rádiochirurgie vznikol sekundárny glaukóm, hodnoty VOT sú dlhodobo viac ako 55 Torr a bulbus postupne prechádza do štádia atrofie; pacient odmietol enukleáciu a klinicky ho pozorujeme; pôvodné ložisko je redukované na maximálnu eleváciu 1 mm.
U pacientov, kde okrajová dávka žiarenia na oblasť terča zrakového nervu nepresiahla 8,0 Gy a ložisko bolo v priebehu viac ako 2 rokov marginalizované, sme zaznamenali optikoneuropatiu.
Postradiačná makulopatia
Postradiačná makulopatia pri ložiskách v blízkosti makuly, resp. do 1 PD vzdialenosti od makuly, sa rozvinula u 9 pacientov do 24 mesiacov od ožiarenia. Prítomný bol aj edém makuly ako ďalší z dôvodov poklesu centrálnej zrakovej ostrosti. Pacientov odosielame na vyšetrenie optickou koherenčnou tomografiou (OCT) v 6-mesačných intervaloch a hodnotíme objem makuly a progresiu edému.
V prípadoch pacientov, kde sme nemohli zaznamenať zmeny na očnom pozadí fundus kamerou alebo OCT vyšetrením pre nepriehľadnosť optických médií, sme zaznamenávali len ultrazvukom progresiu rozvoja sekundárnej amócie, výšku elevácie v oblasti makuly. Eleváciu tumoru sme sledovali UZV B systém vyšetrením, pričom sme hodnotili vždy maximálnu eleváciu tumoru pri vyšetrení a takisto aj maximálnu výšku elevácie v centrálnej časti makuly pri suponovanom makulárnom postradiačnom edéme pri nepriehľadných optických médiách. U niektorých pacientov zmeny v makule, resp. na zadnom póle, ako neovaskularizácia, boli spojené aj s krvácaním do sklovca.
MRI vyšetrenie sme indikovali v 6-mesačných intervaloch u všetkých pacientov, ale mnohí sa z technických a iných dôvodov na vyšetrenie magnetickou rezonanciou nedostavili. Z nálezu MRI sme akceptovali v popise vždy hodnotu maximálnej elevácie tumoru a rozsah sekundárnej amócie sme zisťovali našim ultrazvukovým vyšetrením zadného pólu, resp. oblasti makuly.
Klinické pozorovanie pacientov po izolovanej SRCH s výškou maximálnej elevácie tumoru od 5 do 7 mm pred ožiarením
V súčasnosti je snahou, aby pacienti po absolvovaní rádiochirurgickej liečby absolvovali prvé MRI vyšetrenie po 3 mesiacoch od liečby na pracovisku v OÚSA a neskôr v intervaloch podľa charakteru ložiska a klinického priebehu na tom istom pracovisku, aby bolo možné nálezy porovnávať.
Hoci ide o veľmi malý súbor pacientov a ložiská neboli u všetkých pacientov na korešpondujúcich miestach, nemohli sme ani štatisticky spracovať údaje. Z nášho pohľadu ale ide o významný fakt, že ložisko malígneho choroidálneho melanómu s maximálnou eleváciou od 5 do 7 mm je možné stereotaktickou rádiochirurgickou metódou v dávke 35,0 Gy stabilizovať a zaznamenali sme aj regresiu v intervale 24 mesiacov od liečby.
Diskusia
Otázka, či je samotné ožiarenie dostatočná liečba pri uveálnom melanóme a aká má byť dávka žiarenia, sa diskutuje od osemdesiatych rokov [26]. Nové prístupy k manažmentu liečby uveálneho melanómu nastali začiatkom 80. rokov [33, 34].
Na základe 20-ročného sledovania súboru 309 pacientov po episklerálnej aplikácii β žiaričov sa uvádza 61,5 %, prežívajúcich v priemere 6,7 roka po ožiarení, resp. 12,9 % exitovaných pre metastázy v rovnakom období [24]. Podľa údajov tejto štúdie 52,8 % úspešne liečených pacientov má plochú jazvu po ožiarení. Súčasne medzi 2. až 3. rokom uvádza po pôvodnom úbytku tumoru mierne pribudnutie (o 2,7 %). Predtým už Shields v súbore 500 pacientov liečených episklerálnymi žiaričmi s 60Co zistil, že prognóza v odstupe 5 rokov je dobrá, ak nie lepšia ako po enukleácii pre MMU rovnakých rozmerov [33, 34]. K analogickým záverom dospeli Augsburger a kol. na základe hodnotenia súboru 237 pacientov, z čoho bolo 140 liečených enukleáciou a 97 episklerálne fixovaným žiaričom 60Co, počas 15-ročného dispenzárneho sledovania [1]. Na základe uvedenej retrospektívnej štúdie preukázali, že v prežívaní pacientov s primárnym malígnym melanómom choroidey a corpus ciliare liečených lokálnou brachyterapiou 60Co a enukleáciou je pomerne malý rozdiel. Výsledky pacientov liečených brachyterapiou sú lepšie len asi o 10 %.
Veľmi dôležité je brať do úvahy, že pri liečebných postupoch MMU bez enukleácie bulbu v deštruovanom, nekrotickom a následne jazvovite premenenom materiáli nádoru, môžu ostať skupiny nádorových buniek bez cytolýzy, ktoré sú východiskom pre lokálnu recidívu i metastáz. To sa negatívne odzrkadlí na prognóze [1, 7, 12, 15].
Damato a kol. upozorňujú na rizikové faktory zvyšujúce možnosti metastázovania po transsklerálnej lokálnej excízii MMU, doplnenej následnou brachyterapiou 106Ru [5]. Hodnotili pritom súbor 332 pacientov s MMU s priemerom 13,1 mm a eleváciou 7,5 mm, histologicky prevažne z epiteloidných buniek. Zistili 52 úmrtí na metastázy a ako signifikantné rizikové faktory uvádzajú:
- vek (nad 60 rokov);
- bunkové typy zmiešané a epiteloidné;
- lokalizáciu (v predných a horných častiach);
- priemer nádoru 16 a viac mm;
- nerealizovanie dodatočnej brachyterapie;
- sekundárna enukleácia pre reziduálny/recidivujúci nádor;
- sekundárna enukleácia pre reziduálny, resp. recidívujúci nádor mimo oka.
Mortalita sa signifikantne nezmenila po enukleácii po nekompletnom odstránení tumoru, resp. pri malých reziduách, resp. recidívach. Prežívanie klesá na 30 % v priebehu tri a pol roka, ak sa zistia u pacienta viac ako 3 rizikové faktory. V paralelnej štúdii Damato a kol. hodnotili súbor 286 pacientov, kde v 57 prípadoch (6 %) zistili po lokálnej transsklerálnej resekcii recidívu MMU [6]. V danom súbore v 57 % nebola súvislosť s uvedenými rizikovými faktormi.
Z hľadiska prognózy MMU treba ešte zdôrazniť nutnosť enukleácie atrofických bulbov, keďže sa pri histopatologickom vyšetrení dá zistiť prítomnosť uveálneho melanómu, ktorý bol klinicky nezistený, resp. aj pri vyšetrení napríklad ultrazvukom pred enukleáciou bol nález nejednoznačný. Asi v 10 % bulbov po enukleácii pre iné príčiny bol patohistologicky zistený MMU [35]. Najčastejšou príčinou omylov je nepriehľadnosť optických médií oka. Pri prehľadnom zisťovaní enukleovaných bulbov na našej klinike v období od r. 2001–2008 všetky odoslané bulby na histopatologické vyšetrenie, ktoré mali klinicky stanovenú diagnózu MM, boli potvrdené aj patológom. U všetkých ostatných enukleovaných bulbov z iných príčin (atrofické, amaurotické bulby) sa ani v jednom prípade nevyskytla diagnóza intrabulbárneho melanómu [16].
Z hľadiska klinicko-patologickej korelácie MMU jednou z možností diagnózy je aj cytodiagnostika po transklerálnom prístupe. Ide o odber na zistenie prítomnosti buniek v subretinálnej tekutine, resp. je možná priama punkcia nádoru, v súčasnosti aj pri PPV). Postup je však spojený s problémami rozpoznávania izolovaných skupín buniek, najmä pri rozlišovaní buniek malígneho melanómu a histiocytov. Treba rátať aj so zvýšením rizika inokulácie buniek MMU do para - a retrobulbárnych tkanivových štruktúr počas odberu, a tým aj rýchlejším, resp. včasnejším metastázovaním [35]. V našom súbore sme ani v jednom prípade nerobili priamu punkciu nádoru transsklerálnym prístupom.
Hodnotenie klinicko-patologickej korelácie je aj základom rozhodovacieho procesu pre výber terapeutického postupu v zmysle mikrochirurgie (iridocyklektómia, resp. blok excízia, brachyterapia, event. kombinácia oboch s laserovou liečbou) alebo v zmysle enukleácie bulbu. Analýza vzájomného vzťahu klinického nálezu a patohistologickej stavby nádoru a okolitých štruktúr umožní posúdiť aj efektivitu zvoleného liečebného postupu, resp. posúdiť zhojenie procesu a súčasne i možnosť okamžitej terapeutickej reakcie na prípadné neskôr zistené zmeny.
Stereotaktická rádiochirurgia je „konzervatívnou“ a neinvazívnou alternatívou enukleácie bulbu v liečbe malígnych melanómov uveálneho traktu. Umožňuje dosiahnuť regresiu tumoru bez nutnosti otvorenia bulbu cieleným ožiarením nádorového ložiska. Na hodnotenie úspešnosti intervenčných zákrokov sa sleduje viacero charakteristík. Zvýšenie VOT po rádiochirurgickom zákroku je neskorou, ale vážnou komplikáciou, ktorá v niektorých prípadoch môže viesť až k enukleácii ožiareného oka, aj keď klinickým sledovaním je dokázaná regresia nádorového procesu. V našom súbore 40 pacientov s malígnym melanómom uvey sme nezistili rozdiel v hodnote VOT pred zákrokom medzi skupinou mužov a žien. Nepotvrdili sme významný vzťah medzi vekom a hodnotou VOT. Našim cieľom bolo hodnotenie vplyvu dávky na rizikových štruktúrach a časovej zmeny hodnoty VOT po ožiarení. Predpokladali sme súvis veľkosti dávky na rizikových štruktúrach a hodnoty VOT v čase, vzhľadom na známy odklad prejavenia viacerých postradiačných komplikácii. Našli sme signifikantné vzťahy vo viacerých časových obdobiach, kde veľkosť dávky na šošovke korelovala s hodnotou VOT. Na potvrdenie predpokladu určenia dávky na šošovke ako prediktora pre VOT je potrebný ďalší zber dát, vzhľadom na výskyt časových údajov, kde sa vzťah nepotvrdil.
Sekundárne ťažkosti vyúsťujúce do enukleácie sú prítomné približne u 16,3 % [10].
V našom súbore pacientov sme zaznamenali 7 sekundárne enukleovaných očí u pacientov (17,5 %).
Rádiochirurgické metódy liečby sa začali rozvíjať v 80. rokoch minulého storočia. Skupina lekárov z Viedne sledovala r. 1997 do r. 2001 celkove 90 pacientov s MMU liečených stereotaktickou rádioterapiou na lineárnom urýchľovači. Ožarovanie bolo realizované v 5 frakciách v celkovej dávke 60,0 Gy. Imobilizácia oka bola zabezpečená optickým fixačným systémom. Objem nádorov bol 70–1430 mm3 a výška elevácie bola 2,7–15,9 mm. U 98 % pacientov došlo k zmenšeniu nádoru, sekundárne enukleácia bola realizovaná u 7 pacientov [8].
Dávka žiarenia v centre tumoru, ale aj na jeho okrajoch, je stále diskutovaná, prvá štúdia porovnávajúca ožiarenie uveálneho melanómu na jeho okraji gama nožom a protónovým žiarením bola publikovaná až v r. 2007. Pri plánovacom systéme sú presné kritéria na ožiarenie jednotlivých častí lézie [39]. Rôzne pracoviská aplikujú rôzne dávky žiarenia do ložiska v závislosti od technických možností. V našom súbore sme zistili, že regresia alebo stabilizácia primárneho melanómového ložiska s maximálnou eleváciou od 5 mm do 7 mm je možná rádiochirurgickou metódou v dávke 35,0 Gy.
Pracoviská používajú rôzne systémy fixácie bulbu počas ožarovania, mechanické, ako používame doposiaľ na Slovensku, alebo neinvazívne – externé fixačné systémy, ktoré nevyžadujú priamo naloženie stehov pred výkonom [21]. Niektorí autori preferujú frakcionovanú stereotaktickú rádiochirurgiu v liečbe uveálnych melanómov [37].
Autori z Mníchova sledovali počas 3 rokov skupinu 100 pacientov s MMU liečených gama nožom [28]. Boli to pacienti s veľkými nádormi lokalizovanými na zadnom póle. U 2 pacientov došlo k recidíve. Pred ožarovaním bola maximálna apikálna výška nádoru 7,8 mm, po jednom roku po ožarovaní bola táto výška 5,7 mm, po 2 rokoch 4,3 mm a po 3 rokoch 4,6 mm. Počas prvého roka po ožarovaní bola u 7 pacientov realizovaná pre sekundárny glaukóm enukleácia, počas druhého roka u ďalších 2 pacientov a počas tretieho roka u ďalšieho pacienta. U 98 % pacientov sa nádor zmenšil [28].
Na pracovisku v Prahe liečili od novembra 1995 do decembra 1996 spolu 11 pacientov s MMU Leksellovým gama nožom. Nádory mali prominenciu nad 8 mm a lokalizáciu parapapilárnu alebo makulárnu. Priemerná doba sledovania bola 6 mesiacov. Zraková ostrosť poklesla u 5 pacientov. K zmenšeniu nádoru došlo u 10 pacientov. U 1 pacienta bola pre rast nádoru realizovaná enukleácia [30].
Výhodou cyklotrónu je homogénne dávkovanie a možnosť frakcionácie. Nevýhodou je skutočnosť, že cyklotrón sa môže postaviť len na určitých miestach za presne definovaných podmienok. Liečba vyžaduje náročnú a presnú lokalizáciu nádoru, určenie objemu, okraja a polohy nádoru, stanovenie rozsahu nálezu v 3D zobrazení, stanovenie ochranného lemu minimálne 2,5 mm. Prvé štúdie sa objavili koncom deväťdesiatych rokov. Egger a kol. publikovali súbor 2 465 pacientov s MMU liečených protónovou a hadrónovou rádioterapiou od r. 1984 do roku 1999 [9]. Priemerná doba sledovania bola 44 mesiacov. Zachovanie oka počas 5, 10 a 15 rokov po liečbe bolo u 88 % pacientov, resp. 86 % a 83 % po 15 rokoch od liečby. Enukleovaných bolo 218 očí. Pri optimalizácii liečebnej techniky sa zvýšilo zachovanie oka po 5 rokoch z 97 % na 100 % pri malých nádoroch, z 86 % na 99 % pri stredných nádoroch a z 71 % na 89 % pri veľkých nádoroch. Vo veľkých súboroch MMU liečených protónovým žiarením sa uvádzajú ako jednou z najčastejších príčin enukleácie recidíva pôvodného tumoru, progresia rastu [20].
Multimodálny prístup k liečbe uveálnych melanómov akceptuje aj Damato [4]. Dlhodobé výsledky s aplikáciou liečby uveálneho melanómu gama nožom uviedol Ghazi [18]. Štúdia Gragoudas a kol. spracovala 2 069 pacientov s MMU liečených protónovou a hadrónovou rádioterapiou [20]. Až 95 % pacientov bolo sledovaných 15 rokov. K opätovnému rastu došlo u 60 pacientov. U 84 % pacientov bolo počas 15 rokov zachované liečené oko [20]. V inej štúdii Gragoudasa a kol. publikovali výsledky liečby 1 922 pacientov liečených teleterapiou na Harvardskom cyklotróne od r. 1975 do r. 1996 [19]. Priemerná doba sledovania bola 5,2 roka. Lokálna recidíva bola dokumentovaná u 45 pacientov, u ďalších 17 pacientov bolo oko enukleované pre rast nádoru. Recidíva bola zaznamenaná od 2 mesiacov do 11 rokov po ožiarení ložiska. Iná štúdia dokumentovala súbor 39 pacientov s MMU liečených protónovou rádioterapiou, u ktorých bola realizovaná fluoroangiografia a angiografia indocyanínovou zelenou v období od r. 1998 do 2001 [22]. Nádory mali priemernú eleváciu 3,65 mm a boli lokalizované parapapilárne alebo paramakulárne. Angiografia bola realizovaná pred ožarovaním a následne po 3 mesiacoch, po pol roku a po jednom roku. Cievy v nádore boli zobrazené v 89 % u všetkých nádorov pri indocyanínovej zelenej, ale len u 33 % fluoroangiografií. Po 3 mesiacoch neboli zistené žiadne zmeny a po 6 mesiacoch bolo pomocou indocyanínovej zelenej detekované veľké presakovanie z ciev v oblasti nádoru. Po 1 roku sa toto presakovanie zvýraznilo a bolo taktiež viditeľné pri fluoroangiografii.
Po teleterapii vnútroočných melanómov je potrebné v určitom časovom intervale počítať aj s komplikáciami, u lézií s prítomnosťou sekundárnej amócie je treba počítať s ešte vyšším percentom komplikácií ako je rubeóza dúhovky, sekundárny glaukóm až totálne odlúpenie sietnice. To je najčastejšia príčina a dôvod pre následnú enukleáciu [11]. Zmeny choroidálnej cirkulácie sú následkom iradiácie [27].
V našom súbore máme evidovaného jedného pacienta s juxtapapilárnym melanómom, u ktorého po liečbe došlo k radikálnemu poklesu zrakovej funkcie, ale bulbus je anatomicky zachovaný. Juxtapapilárne melanómy je možné riešiť rádiochirurgiou, ale riziko neuropatie je prakticky nevyhnutné [23].
Zníženie postradiačných komplikácií je cieľom mnohých oftalmo-onkologických centier. V r. 2010 bola publikovaná štúdia, ktorá preukázala výrazne znížené postradiačné poškodenie makuly pri ožiarení malígneho melanómu, kde silikónový olej implantovaný do dutiny sklovca absorboval až 50 % radiačnej dávky žiarenia [29].
Predchádzajúce ožiarenie gama-nožom pred resekciou a endoresekciou zaviedli Bornfeld a kol. [2]. Vykonali endoresekciu MMU u 29 pacientov, objem nádorov sa pohyboval od 0,2 do 1,4 cm3. U 17 pacientov doožarovali lôžko tumoru ruténiovým žiaričom. Len u 5 pacientov bola neskôr nutná enukleácia [2].
Dávka žiarenia pred endoresekciou je v každom oftalmo-onkologickom centre iná, v našich podmienkach to bolo 35,0–38,0 Gy v jednom sedení [13, 14]. Pri ožiarení gama-nožom v jednom sedení je možné aplikovať vyššiu dávku žiarenia. Imobilizácia bulbu je možná aj iným ako mechanickým spôsobom [28]. Pri frakcionovanej liečbe stereotaktickou rádiochirurgiou pomocou externého optického fixačného systému vo Viedni aplikujú spôsob nie mechanickej, ale optickej fixácie bulbu, čo umožňuje frakcionáciu, a tým aj zvýšenie celkovej dávky žiarenia [38]. V našich podmienkach nie je možné v súčasnosti frakcionáciu z technických príčin vykonať, naďalej uskutočňujeme stereotaktické rádiochirurgické výkony fixáciou bulbu mechanickým postupom (imobilizácia cez priame extraokulárne svaly) a následne sa robí fixácia prostredníctvom stehov na stereotaktický kruh.
V retrospektívnej štúdii v r. 1990–2000 analyzovali Cohen a kol. 198 pacientov s choroidálnym melanómom, ktorí boli liečení stereotaktickou rádiochirurgiou – 78 pacientov, alebo enukleáciou – 118 pacientov [3]. U všetkých pacientov s potvrdenými metastázami v intervale sledovania od liečby boli potvrdené metastázy pečene sonograficky alebo CT vyšetrením – 53 pacientov (27 %). U 8 pacientov po liečbe stereotaktickou rádiochirurgiou bola nutná enukleácia. Dĺžka sledovania bola od 1 mesiaca do 10 rokov, 7 pacienti vypadli zo sledovaného súboru v skupine enukleovaných pacientov, v skupine pacientov po stereotaxii nikto nevypadol zo sledovania. Táto štúdia bola prvou analýzou prežívania pacientov po enukleácii a po stereotaktickej rádiochirurgii. Nepreukázal sa signifikantný vplyv na interval bez prítomnosti metastáz po liečbe v závislosti od veku, pohlavia, prítomnosti extrasklerálneho šírenia alebo sekundárnej amócie [3]. Táto štúdia potvrdila, že najväčší rozmer tumoru a lokalizácia tumoru sú nezávislé prognostické faktory pri prežívaní pacientov [31].
Záver
Jednorázová stereotaktická rádiochirurgia na lineárnom urýchľovači LINAC je možná v dávke 35,0–38,0 Gy u vnútroočných melanómov v štádiu T1 až T3. Podľa našich výsledkov ide o vysoko efektívnu metódu liečby uveálnych melanómov s eleváciou do 6 mm a objemom do 0,4 cm3. U pacientov s melanómom o objeme viac ako 0,8 cm3 je potrebné pristúpiť ku kombinovaným operačným postupom. Stereotaktická rádiochirurgia je v súčasnosti jediná možná metóda liečby uveálnych melanómov ionizujúcim žiarením na Slovensku a vyžaduje si dokonalú spoluprácu viacerých medicínskych odborov [17].
Sekundárny glaukóm je jednou z najzávažnejších príčin enukleácie u pacientov s uveálnym melanómom, u ktorých bola indikovaná stereotaktická rádiochirurgia na lineárnom akcelerátore (LINAC); percento enukleácií v našom sledovanom súbore (17,5 %) pre sekundárny glaukóm je približne rovnaké ako v iných štúdiách. Predpokladaný súvis veľkosti dávky na rizikové štruktúry v korelácii s hodnotou vnútroočného tlaku sa prejavil aj v našom súbore.
Podporené grantom KEGA 008 UK – 4/2014
Autori článku prehlasujú, že vznik odborného článku, jeho publikovanie a zverejnenie nie je predmetom stretu záujmov a nie je podporené žiadnou farmaceutickou firmou.
Doc. Mgr. MUDr. Alena Furdová, PhD., MPH, MSc.
Klinika oftalmológie LFUK a UNB,
Nemocnica Ružinov
Pažítková 4
821 01 Bratislava
e-mail: alikafurdova@gmail.com
tel: pracovisko 421 2 48234 kl. 607
Do redakce doručeno dne 5. 12. 2014
Do tisku přijato dne 10. 4. 2015
Sources
1. Augsburger, J.J., Schneider, S., Freire, J., et al.: Survival following enucleation versus plaque radiotherapy in statistically matched subgroups of patients with choroidal melanomas: results in patients treated between 1980 and 1987. Graefes Arch Clin Exp Ophthalmol, 237; 1999 : 558–567.
2. Bornfeld, N., Talies, S., Anastassiou, G., et al.: Endoresection maligner Melanome der Uvea nach praoperativer stereotaktischer Einzeldosis-Konvergenzbestrahlung mit dem Leksell-Gamma-knife. Ophthalmologe, 99; 2002 : 338–344.
3. Cohen, V.M.L., Carter, M.J., Kemeny, A., et al.: Metastasis-free survival following treatment for uveal melanoma with either stereotactic radiosurgery or enucleation. Acta Ophthalmol Scand, 81; 2003 : 383–388.
4. Damato, B.E., Lecuona, K.: Conservation of eyes with choroidal melanoma by a multimodality approach to treatment. An audit of 1632 patients. Ophthalmology, 111; 2004 : 977–983.
5. Damato, B.E., Paul, J., Foulds, W.S.: Risk factors for metastatic uveal melanoma after transscleral local resection. Br J Ophthal, 8; 1996 : 109–116.
6. Damato, B.E., Paul, J., Foulds, W.S.: Risk factors for residual and recurrent uveal melanoma after transscleral local resection. Br J Ophthal, 80; 1996 : 102–108.
7. Diaz, C.E., Capone, Jr. A., Grossinklaus, H.E.: Clinicopathologic Findings in Recurrent Choroidal Melanoma after Transpupillary Thermotherapy. Ophthalmology, 105(8); 1998 : 1419–1424.
8. Dieckmann, K., Georg, D., Zehetmayer, M., et al.: LINAC based stereotactic radiotherapy of uveal melanoma: 4 years clinical experience. Radiother Oncol, 67; 2003 : 199–206.
9. Egger, E., Zografos, L., Schalenbourg, A., et al.: Eye retention after proton beam radiotherapy for uveal melanoma. Int J Radiat Oncol Biol Phys, 55; 2003 : 867–880.
10. Finger, P.T.: Radiation Therapy for Choroidal Melanoma. Survey of Ophthalmology, 42; 1997 : 215–232.
11. Foss, A.J., Whelehan, I., Hungerford, J.L., et al.: Predictive factors for the development of rubeosis following proton beam radiotherapy for uveal melanoma. Br J Ophthalmol, 91; 1997 : 748–754.
12. Furdová, A., Chorváth, M., Waczulíková, I., et al.: No differences in outcome between radical surgical treatment (enucleation) and stereotactic radiosurgery in patients with posterior uveal melanoma. Neoplasma, 57(4); 2010 : 377–381.
13. Furdová, A., Oláh, Z.: Malígny melanóm v uveálnom trakte. Bratislava, Asklepios. 2002, 172 s.
14. Furdová, A., Oláh, Z.: Nádory oka a okolitých štruktúr. Brno, CERM. 2010, 152 s.
15. Furdova, A., Strmen, P., Sramka, M.: Complications in patients with uveal melanoma after stereotactic radiosurgery and brachytherapy. Bratislava Medical Journal – BLL, 106(12); 2005 : 401–406.
16. Furdova, A., Strmen, P., Waczulikova, I., et al.: One-day session LINAC-based stereotactic radiosurgery of posterior uveal melanoma. Eur J Ophthalmol, 22(2); 2012 : 226–235.
17. Furdová, A., Šramka, M.: Uveal malignant melanoma and stereotactic radiosurgery. Saarbrücken: LAP LAMBERT Academic Publishing. 2014, 181 s.
18. Ghazi, N.G., Ketscheride, C.S., Sheehan, J., et al.: Gamma knife radiosurgery for uveal melanoma ineligible for brachytherapy by the Collaborative Ocular Melanoma Study criteria. Open Access Surgery, 1; 2008 : 21–24.
19. Gragoudas, E.S.: Proton beam therapy: proton therapy for uveal melanoma – 20 years experience. 2001 Subspeciality Day, Retina, 2001, American Academy of Ophthalmology, New Orleans, Lousiana, 10; 2001.
20. Gragoudas, E.S., Lane, A.M., Munzenrider, J., et al.: Long-term risk of local failure after proton therapy for choroidal/ciliary body melanoma. Trans Am Ophthalmol Soc, 100; 2002 : 43–48.
21. Jaywant, S.M., Osei, E.K., Ladak, S.: Stereotactic radiotherapy in treatment of ocular melanoma: A noninvasive eye fixation aid and tracking system. Am Coll Med Phys, 4; 2003 : 156–161.
22. Krause, L., Bechrakis, N., Heinrich, S., et al.: Indocyanine green angiography and fluorescein angiography of malignant choroidal melanomas following proton beam irradiation. Graefe´s Archive for Clinical and Experimental Ophthalmology, 246(6); 2004 : 545–550.
23. Krema, H., Somani, S., Sahgal, A., et al.: Stereotactic radiotherapy for treatment of juxtapapillary choroidal melanoma: 3-year follow-up. Br J Ophthalmol, 93; 2009 : 1172–1176.
24. Lommatzsch, P.K.: Intraoculare Tumoren. Leitfaden für Diagnostik und Therapie. Enke Verlag, Stuttgart, 1989, 161 p.
25. Lučenič, A., Fríbertová, M., Chorváth, M.: Stereotaktická rádiochirurgia malígneho melanómu oka. Onkológia, 6; 2011 : 35.
26. Manschot, W.A., van Strik, R.: Is irradiation a justifable treatment of choroidal melanoma? Analysis of published results. Br J Ophthal, 71; 1987 : 348–352.
27. Midena, E., Segato, T., Valenti, M., et al.: The Effect of external Eye Irradiation on Choroidal Circulation. Ophthalmology, 103; 1996 : 1651–1660.
28. Mueller, A.J., Schaller, U., Talies, S., et al.: Stereotaktische Konvergenz-bestrahlung grosser uvealer Melanome mit dem Gamma-knife. Ophthalmologe, 100; 2003 : 122–128.
29. Oliver, S., Leu, M., Demarco, J., et al.: Attenuation of iodine 125 radiation with vitreous substitutes in the treatment of uveal melanoma. Arch Ophthalmol, 128(7); 2010 : 888–893.
30. Pochop, P., Pilbauer, J., Křepelková, J., et al.: Dva roky zkušeností s léčbou Leksellovým gama nožem. Čes a slov Oftalmol, 54(4); 1998 : 222–234.
31. Seregard, S., Kock, E.: Prognostic indicators following enucleation for posterior uveal melanoma. A multivariate analysis of longterm survival with minimized loss to follow-up. Acta Ophthalmol Scand, 73; 1995 : 340–344.
32. Shields, C.L., Shields, J.A., et al.: Prevalence and Mechanisms of Secondary Intraocular Pressure Elevation in Eyes with Intraocular Tumors. Ophthalmology, 94; 1987 : 839–846.
33. Shields, J.A.: Advances in management of intraocular tumors. Highlights of Ophthalmology, 22; 1994 : 32–34.
34. Shields, J.A., Shields, C.L.: Current alternatives in the management of posterior uveal melanomas. Trans. Am. Acad. Ophthalmol. Otolaringol., 42; 1990 : 938–944.
35. Shields, J.A., Shields, C.L., Davidson, R., et al.: Iris Melanoma Arising From sector Congenital Ocular Melanocytosis in a Child. Cornea, 28(10); 2009 : 1191-1193.
36. Šramka, M.: Stereotaktická rádiochirurgia v liečbe nádorov hlavy a krku. Onkológia 2; 2006 : 126–129.
37. Tokuuye, K., Akine, Y., Sumi, M., et al.: Fractionated stereotactic radiotherapy for choroidal melanomas. Radiother Oncol, 42; 1997 : 87–91.
38. Zehetmeyer, M., Kitz, K., Menapace, R., et al.: Local tumor control and morbidity after one to three fractions of stereotactic external beam irradiation for uveal melanoma. Radiother Oncol, 55; 2000 : 135–144.
39. Zytkovicz, A., Daftari, I., Phillips, T.L., et al.: Peripheral dose in ocular treatment with Cyberknife and Gamma Knife radiosurgery compared to proton radiotherapy. Phys Med Biol, 52; 2007 : 5957–5971.
Labels
Ophthalmology
Article was published inCzech and Slovak Ophthalmology

2015 Issue 3-
All articles in this issue
- Funkční magnetická rezonance u vybraných očních onemocnění
- Stereotaktická rádiochirurgia (LINAC) uveálnych melanómov; postradiačné komplikácie
- Vnitřně fotosenzitivní gangliové buňky sítnice
- Exenterácia očnice pre malígny melanóm choroidey v štádiu T4; možnosti epitetického riešenia
- Corneal cross-linking v liečbe keratokónusu – výsledky a komplikácie v dvojročnom sledovaní
- Chirurgické řešení idiopatické makulární díry 25-gauge pars plana vitrektomií s peelingem vnitřní limitující membrány asistované briliantovou modří a plynovou tamponádou
- Multifokálna viteliformná retinálna lézia
- Czech and Slovak Ophthalmology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Vnitřně fotosenzitivní gangliové buňky sítnice
- Funkční magnetická rezonance u vybraných očních onemocnění
- Chirurgické řešení idiopatické makulární díry 25-gauge pars plana vitrektomií s peelingem vnitřní limitující membrány asistované briliantovou modří a plynovou tamponádou
- Exenterácia očnice pre malígny melanóm choroidey v štádiu T4; možnosti epitetického riešenia
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

