-
Medical journals
- Career
Vnitřně fotosenzitivní gangliové buňky sítnice
: K. Skorkovská 1; Š. Skorkovská 2
: Klinika nemocí očních a optometrie, Lékařská fakulta Masarykovy univerzity Fakultní nemocnice u sv. Anny, Brno přednosta doc. MUDr. Svatopluk Synek, CSc. 1; Evropská oční klinika Lexum, Bezručova 22, Brno 2
: Čes. a slov. Oftal., 71, 2015, No. 3, p. 144-149
: Original Article
Gangliové buňky sítnice s obsahem melanopsinu jsou nově objevenými fotoreceptory sítnice. Díky pigmentu melanopsinu jsou stejně jako tyčinky a čípky schopné vlastní vnitřní fototransdukce. Podílí se na řízení cirkadiánního rytmu a zornicového reflexu, možná mají i doplňkovou úlohu v procesu vidění. Pupilární reakci řízenou gangliovými buňkami s obsahem melanopsinu lze separovat pomocí tzv. chromatické pupilografie. Použití barevných stimulů k odlišení přispění jednotlivých fotoreceptorů k pupilární reakci na osvit může v pokročilých stadiích pigmentové retinopatie přinést detailnější informace o funkci fotoreceptorů než standardní elektroretinografie. Přehled shrnuje současné poznatky o gangliových buňkách sítnice s obsahem melanopsinu s důrazem na jejich význam pro klinickou praxi.
Klíčová slova:
gangliové buňky sítnice, melanopsin, pupilografie, pigmentová retinopatieNové fotoreceptory sítnice
Světlo je důležitým regulátorem fyziologických procesů. Kromě vidění ovlivňuje řadu dalších pochodů jako je syntéza melatoninu, cirkadiánní rytmus a spánek. U člověka má navíc světlo vliv na náladu, koncentraci a psychické zdraví. Vidění a světlo nejsou tedy předmětem zkoumání pouze oftalmologie, nýbrž i dalších oborů jako je biologie, psychologie či spánková medicína.
A právě při chronobiologickém výzkumu byly v roce 2002 identifikovány speciální gangliové buňky sítnice, které jsou díky obsahu melanopsinu schopné vlastní vnitřní fototransdukce [1, 9, 18]. Tento objev představoval naprosto senzační nález, vždyť více než sto let byly za jediné fotoreceptory sítnice schopné fototransdukce považovány tyčinky a čípky. Zatímco klasické fotoreceptory se nacházejí v zevní jádrové vrstvě sítnice, leží gangliové buňky s obsahem melanopsinu ve vnitřní jádrové vrstvě sítnice a jejich axony jsou součástí zrakového nervu (obr. 1). Melanopsin funguje jako fotopigment a propůjčuje těmto speciálním buňkám sítnice tzv. vnitřní fotosenzitivitu. K aktivaci vnitřně fotosenzitivních gangliových buněk sítnice (v anglické literatuře ipRGCs – intrinsically photosensitive retinal ganglion cells) může dojít buď po fototransdukci v tyčinkách a čípcích, vlastní vnitřní fototransdukcí za účasti melanopsinu, nebo oběma způsoby najednou [16, 19, 22].
1. Schematické znázornění vrstev sítnice a vnitřně fotosenzitivních gangliových buněk sítnice (ipRGC) 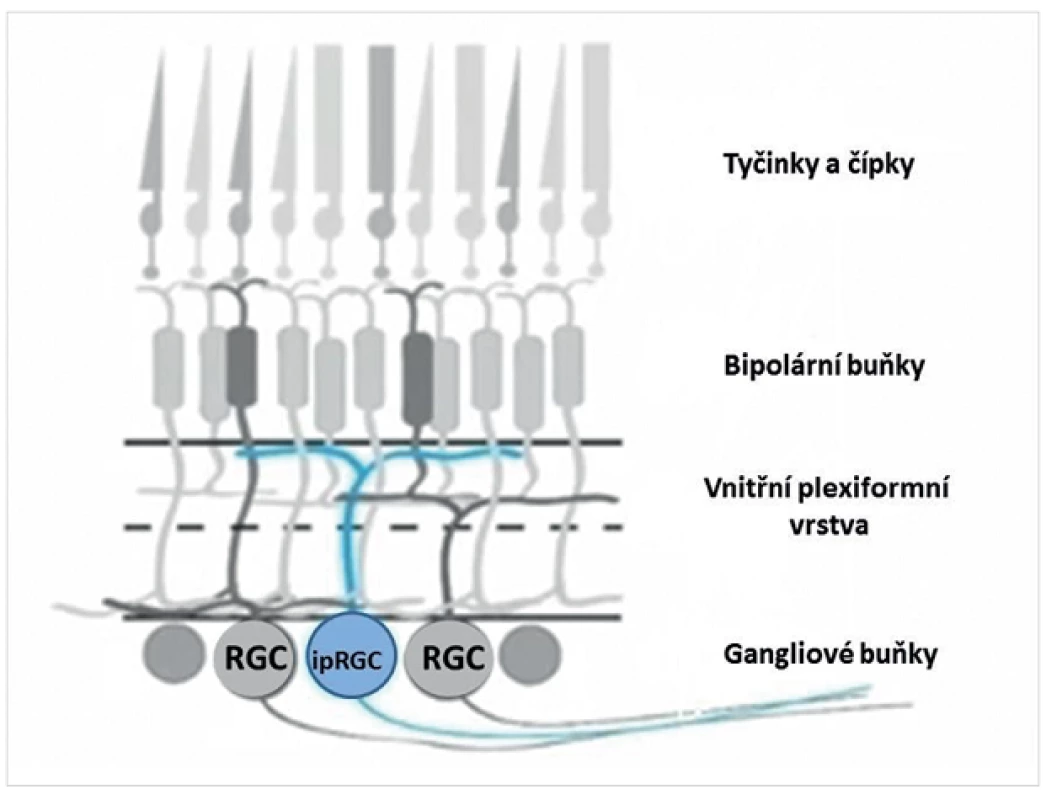
Objevení dalších fotoreceptorů umožnilo vysvětlit některé nejasnosti, které se neshodovaly s tradičním modelem fotorecepce v sítnici, jako například přítomnost zornicového reflexu nebo normálního cirkadiánního rytmu u pacientů, kteří oslepli v důsledku pigmentové retinopatie. V přehledu jsou shrnuty současné poznatky o retinálních gangliových buňkách s obsahem melanopsinu s důrazem na jejich možné využití v klinické praxi.
Morfologické a funkční charakteristiky vnitřně fotosenzitivních gangliových buněk sítnice
U primátů včetně člověka tvoří gangliové buňky sítnice s obsahem melanopsinu 0,2 % všech gangliových buněk sítnice, což je zhruba 3000 buněk na jedno oko [3]. I v rámci takto malé populace vnitřně fotosenzitivních buněk s obsahem melanopsinu lze rozlišit různé podskupiny, z nichž každá má jedinečné morfologické a fyziologické vlastnosti a potenciálně i různé role. V současné době rozlišujeme pět typů vnitřně fotosenzitivních gangliových buněk sítnice (M1 až M5), většinu populace tvoří M1 a M2 buňky (74–90 %) [20]. Původně popsané gangliové buňky sítnice s obsahem melanopsinu přitom odpovídají pouze dnešní podskupině M1. Všechny gangliové buňky s obsahem melanopsinu mají velké tělo a obrovská dendritická pole. Dlouhé dendritické výběžky těchto buněk sahají do vnitřní plexiformní vrstvy sítnice, kde se vzájemně propojují.
K aktivaci fotosenzitivních gangliových buněk sítnice může dojít buď nepřímo ze zevních vrstev sítnice (tedy z tyčinek a čípků) přes bipolární buňky, přímo jejich vnitřní aktivací, nebo oběma procesy zároveň. K vnitřní aktivaci fotosenzitivních gangliových buněk dochází při působení světla o vyšším jasu, než vyžadují klasické fotoreceptory, udávají se hodnoty kolem 100 cd/m2. Při vnitřní aktivaci gangliových buněk dochází k jejich depolarizaci a generování akčních potenciálů, jejichž charakter se poněkud liší od odpovědi tyčinek nebo čípků na světlo. Po depolarizaci gangliové buňky s obsahem melanopsinu následuje dlouhá latence k dosažení prvního akčního potenciálu, rychlost výbojů pak pomalu narůstá až do dosažení maxima, které je přímo úměrné jasu stimulu, a poté je rychlost výbojů udržována v konstantním stavu po celou dobu trvání světelného stimulu. Po ukončení stimulu neklesne frekvence výbojů náhle, nýbrž postupně [3]. Naopak při hyperpolarizaci tyčinek a čípků je latence do počáteční depolarizace gangliových buněk sítnice krátká, počáteční výboj ihned dosahuje maxima a následně se frekvence výbojů rychle snižuje, což ukazuje na časnou adaptaci těchto klasických fotoreceptorů.
Spektrální senzitivita vnitřně fotosenzitivních gangliových buněk sítnice je nejvyšší kolem 482 nm (modré světlo), částečně se tedy překrývá se senzitivitou tyčinek (497 nm) a čípků (S-čípky mají absorpční maximum kolem 420 nm, M-čípky kolem 534 nm a L-čípky vykazují nejvyšší senzitivitu při 563 nm) [1]. Schopnost absorbovat světlo je však u gangliových buněk s obsahem melanopsinu oproti tyčinkám a čípkům snížená, proto je pro jejich vnitřní aktivaci potřeba mnohem vyššího jasu [4].
Podle dosavadních poznatků tedy dochází k přímé (vnitřní) aktivaci gangliových buněk s obsahem melanopsinu zejména při stimulaci modrým světlem (cca 482 nm) o velkém jasu (100 cd/m2) a dlouhém trvání (13 s) [16]. Kromě schopnosti vlastní vnitřní depolarizace při vhodné světelné stimulaci, mohou být gangliové buňky aktivovány nepřímo z tyčinek a čípků, se kterými jsou trvale propojeny přes bipolární buňky. Tato vnější aktivace vykazuje rychlejší a výraznější depolarizaci a větší citlivost ke světlu než vnitřní fotosenzitivita [19].
Fyziologické funkce vnitřně fotosenzitivních gangliových buněk sítnice
Na rozdíl od tyčinek a čípků přispívají gangliové buňky s obsahem melanopsinu k tvorbě zrakového vjemu pravděpodobně jen okrajově [3, 6]. Fungují spíše jako detektory intenzity okolního osvětlení a podílejí se na řízení cirkadiánního rytmu. Jsou ve spojení s centry pro řízení cirkadiánního rytmu v předním hypothalamu (nucleus suprachiasmaticus, intergenikulární vrstva nucleus geniculatum laterale) a spánku (nucleus preopticus ventrolateralis). Kromě toho vedou axony gangliových buněk s obsahem melanopsinu také do nucleus pretectalis olivaris v dorzálním středním mozku a tvoří tak aferentní část zornicového reflexu (obr. 2). Právě zachování gangliových buněk s obsahem melanopsinu vysvětluje, proč osoby, které osleply v důsledku postižení klasických fotoreceptorů sítnice (tyčinek a čípků u pigmentové retinopatie), mají zachovalý zornicový reflex a normální cirkadiánní rytmus [16, 19, 22]. Tyčinky, čípky a gangliové buňky s obsahem melanopsinu se při řízení cirkadiánního rytmu i pupilárního reflexu vzájemně doplňují. Například tyčinky řídí cirkadiánní rytmus při nízkých intenzitách osvětlení, gangliové buňky s obsahem melanopsinu se zapojují při vyšší světelné intenzitě. Podobně funguje komplementarita fotoreceptorů i při pupilární reakci na osvit.
2. Podskupiny vnitřně fotosenzitivních retinálních gangliových buněk (M1 až M5) a jejich projekce k mozkovým strukturám, které pravděpodobně ovlivňují (NSC – nucleus suprachiasmaticus, NPO – nucleus pretectalis olivaris, dCGL – dorzální část corpus geniculatum laterale, CS – colliculus superior). (Modifikováno podle reference 20) 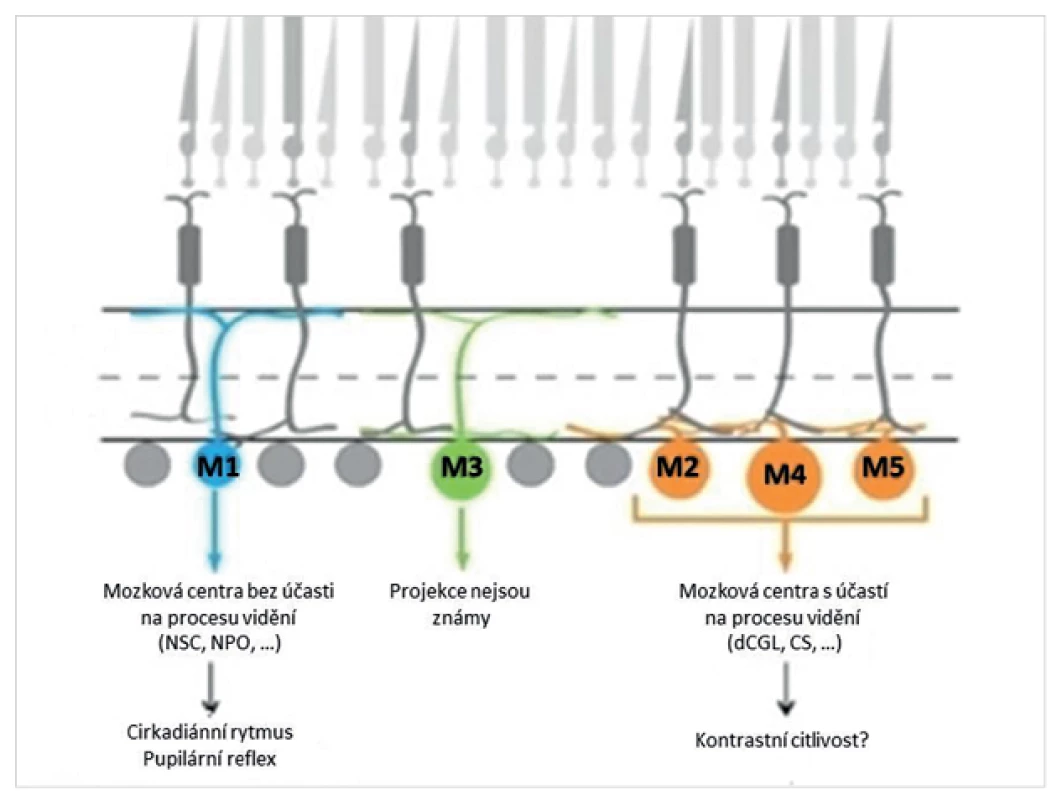
Pupilární reflex
Podle klasického schématu je pupilární reflexní oblouk tvořen čtyřmi neurony. Aferentní axony retinálních gangliových buněk probíhají nejdříve ve zrakovém nervu. V chiasma opticum přechází axony z nazálních polovin sítnic obou očí do druhostranného tractus opticus, axony z temporálních polovin sítnic probíhají ipsilaterálně. V poslední třetině tractus opticus se oddělí pupilomotorická vlákna od vláken senzorických a postupují dále v brachium colliculi superioris do area pretectalis v dorzálním středním mozku. Odtud vedou interneurony k oběma jádrům Edinger-Westphal, která pomocí parasympatických vláken inervují musculus sphincter pupillae.
Pupilární reflex kontroluje změnou průměru zornice množství světla dopadajícího na sítnici. Až do nedávna byl u člověka spojován pouze s aktivací tyčinek v šeru a čípků při denním osvětlení. Z těchto klasických fotoreceptorů je informace vedena pomocí bipolárních, amakrinních a horizontálních buněk sítnice ke gangliovým buňkám sítnice a dále do mozku. Objev vnitřně fotosenzitivních buněk sítnice však ukázal, že pupilomotorická informace přivedená do středního mozku může pocházet nejen ze zevní vrstvy sítnice (aktivace tyčinek a čípků), nýbrž také z vnitřní vrstvy sítnice (aktivace melanopsinu).
Přesné stanovení vlivu jednotlivých fotoreceptorů na pupilární reakci u člověka je na rozdíl od zvířecích modelů obtížné, jistou pomoc ale nabízí hodnocení průběhu pupilární reakce pomocí pupilografie. Na obr. 3 je zobrazena typická pupilární reakce při osvitu oka jasným světelným stimulem bílé barvy o délce 10 sekund. Během zúžení zornice lze na pupilografické křivce pozorovat dvě fáze. Po zapnutí stimulu dochází k rychlé kontrakci zornice až do dosažení minimálního průměru zornice (maximální konstrikční amplituda). Tato časná, přechodná („transient“) odpověď je rychle následovaná pupilární redilatací (neboli únikem) a přechází v prolongované („sustained“), částečné zúžení zornice, které pokračuje po zbytek trvání stimulu [16, 19]. Až existence gangliových buněk s obsahem melanopsinu umožnila vysvětlit obě fáze pupilární reakce poměrným zapojením klasických fotoreceptorů a vnitřně fotosenzitivních gangliových buněk sítnice do pupilární odpovědi. Zatímco „přechodná“ komponenta pupilárního reflexu je dána časnou adaptací tyčinek a čípků na osvit, je „prolongovaná“ pupilární kontrakce způsobena vnitřní aktivací gangliových buněk s obsahem melanopsinu a souvisí s déletrvající elektrickou aktivitou těchto buněk, jak bylo popsáno výše.
3. Pupilografický záznam pupilární reakce na jasný, bílý, světelný stimulus o délce 5 sekund u zdravého člověka. Pupilární reakce se skládá ze dvou fází. Po zapnutí stimulu dochází k rychlé, maximální pupilární konstrikci s krátkou latencí (přechodná fáze pupilární reakce na osvit). Poté se zornice poněkud rozšíří (částečná redilatace) do stadia částečného zúžení zornice, které reprezentuje prolongovanou fázi pupilární reakce na osvit a přetrvává i po vypnutí stimulu. (Modifikováno podle reference 16) 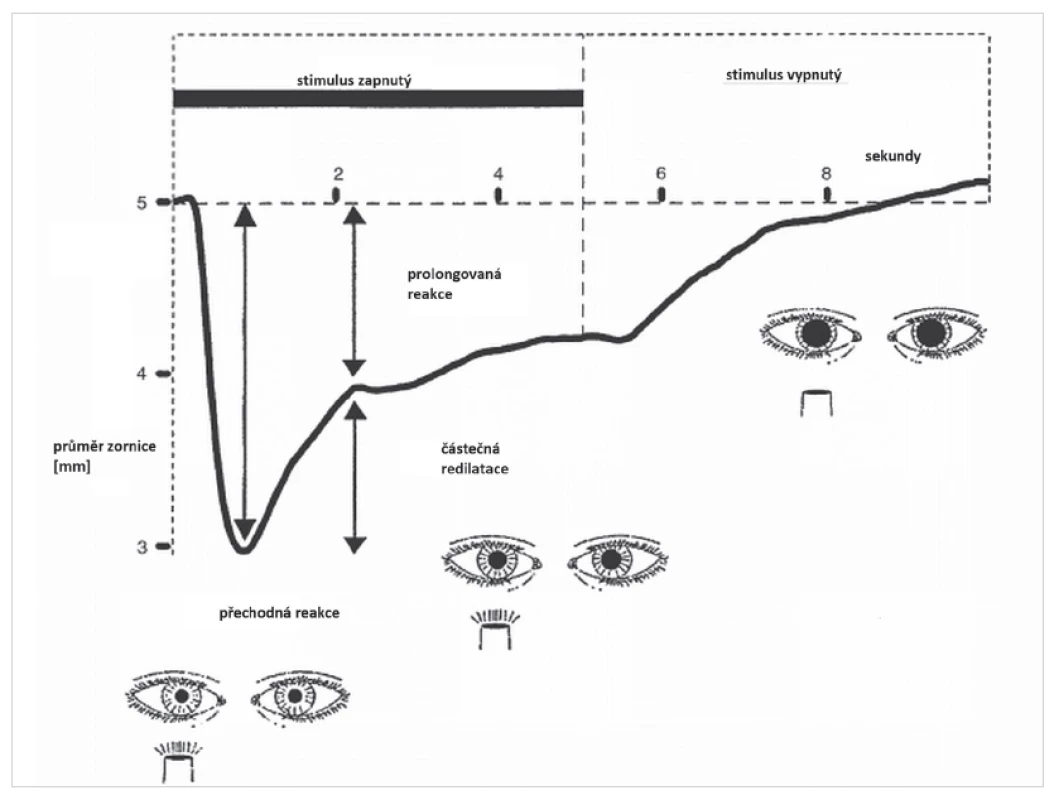
V experimentech na geneticky modifikovaných myších postrádajících buď tyčinky a čípky nebo gen pro melanopsin bylo prokázáno, že ani v jedné skupině zvířat nedošlo k vymizení pupilární reakce na osvit. Tyčinky, čípky i gangliové buňky sítnice s obsahem melanopsinu tedy tvoří aferentní část pupilárního reflexu a navzájem se ve svém fungování doplňují. Poměrné přispění jednotlivých fotoreceptorů ke konstrikci zornice však závisí na parametrech světelné stimulace.
Chromatická pupilografie
Jak již bylo zmíněno, mají jednotlivé typy fotoreceptorů sítnice (tyčinky, čípky i vnitřně fotosenzitivní buňky sítnice s obsahem melanopsinu) jiná absorpční maxima a citlivost na osvit. Bílé světlo, které se při pupilografii nejčastěji používá, zahrnuje široké spektrum vlnových délek, takže dochází k sumaci odpovědí všech fotosenzitivních buněk sítnice. Pomocí světla o různé vlnové délce a jasu lze však selektivně aktivovat jednotlivé receptorové systémy. Podle toho se liší i charakter pupilární reakce a parametry pupilografické křivky. Metoda postavená na tomto principu se nazývá chromatická pupilografie a v současné době jsou v klinických studiích testovány různé protokoly, které by umožnily co nejlépe odděleně stimulovat jednotlivé populace fotoreceptorů sítnice jak u zdravých osob, tak u nemocných s různými očními patologiemi.
Červené světlo aktivuje zejména čípky, modré světlo o nízkém jasu tyčinky a modré světlo o vysokém jasu gangliové buňky sítnice obsahující melanopsin. Při osvitu zornice modrým světlem je amplituda pupilární reakce významně větší a latence do maximálního zúžení zornice významně delší než při působení červeného světla. Při působení modrého světla převažuje prolongovaná („sustained“) kontrakce zornice, zatímco při působení červeného světla přechodná („transient“) kontrakce zornice (obr. 4). Lze se domnívat, že za navýšením amplitudy a prodloužením pupilární kontrakce při působení modrého světla o vysoké intenzitě stojí vnitřní aktivace gangliových buněk s obsahem melanopsinu [12, 16, 21]. Podobně změny v „přechodné“ reakci zornice na červené světlo a modré světlo o nízkém jasu odráží pravděpodobně postižení tyčinek a čípků, zatímco změny v „prolongované“ pupilární reakci onemocnění gangliových buněk sítnice. Vzhledem k tomu, že se tyčinky a čípky nachází v zevní jádrové vrstvě sítnice a gangliové buňky s obsahem melanopsinu ve vnitřní jádrové vrstvě sítnice, nabízí chromatická pupilografie možnost využití pupilární reakce k objektivnímu vyšetření funkce zevní a vnitřní vrstvy sítnice.
4. Průměrná relativní amplituda pupilární reakce (osa y) na červený (horní křivka) a modrý stimulus (dolní křivka) u zdravých osob. Šedý sloupec znázorňuje trvání světelného stimulu. Vertikálami jsou vyznačeny body, ve kterých byla stanovena relativní pupilární amplituda, definovaná jako podíl průměru zornice v daný okamžik a jejího výchozího průměru. A – relativní amplituda 3 s po zapnutí stimulu, B – relativní amplituda při vypnutí stimulu, C – relativní amplituda 3 s po vypnutí stimulu, D – relativní amplituda 7 s po vypnutí stimulu. Při osvitu zornice modrým světlem byla relativní amplituda v každém měřeném okamžiku významně větší a latence do maximálního zúžení zornice významně delší než při působení červeného světla. Při působení modrého světla převažovala prodloužená („sustained“) kontrakce zornice, zatímco při působení červeného světla přechodná („transient“) kontrakce zornice 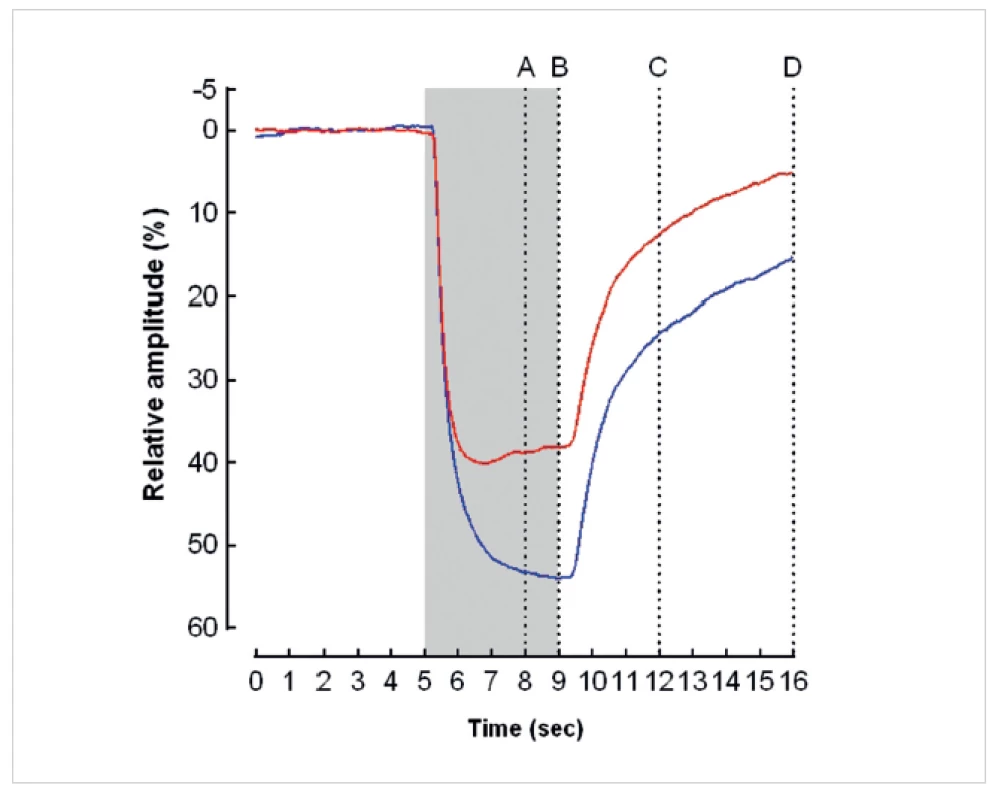
Chromatická pupilografie u pacientů s pigmentovou retinopatií
Pupilární reakce na barevné světelné podněty je zkoumána také u pacientů s různými očními patologiemi, zejména pak u pacientů s pigmentovou retinopatií (RP), kteří jsou díky postižení klasických fotoreceptorů ideálním modelem. U těchto pacientů by se chromatická pupilografie mohla stát pomocnou objektivní metodou při hodnocení funkce zevní vrstvy sítnice nejen při zjišťování progrese onemocnění, ale také například při vyšetření zrakových funkcí po implantaci subretinálního chipu, jehož vývoj a aplikace ve světě úspěšně pokračují.
V řadě studií bylo zjištěno, že u pacientů s pokročilou formou RP je pupilární reakce na modré světlo nízkého a středního jasu (odpověď tyčinek) a reakce na červené světlo (odpověď čípků) ve srovnání se zdravými osobami výrazně snížená [12, 16]. Pupilární odpověď na modré světlo vysokého jasu zprostředkovaná gangliovými buňkami s obsahem melanopsinu byla u některých pacientů s RP normální [12, 14], u jiných snížená [13, 15], přestože by tyto buňky měly teoreticky zůstat intaktní. Tento jev zatím nebyl jednoznačně vysvětlen, nicméně zdá se, že v pokročilých stadiích RP dochází ke snížení počtu a změnám v morfologii také vnitřně fotosenzitivních gangliových buněk, což by mohlo nález vysvětlovat [7]. Důležitým zjištěním řady studií ale bylo, že je pomocí pupilografie možné detekovat aktivitu klasických fotoreceptorů i v pokročilých stadiích onemocnění, kdy je ERG již nevýbavné a neměnné [13, 15].
Přestože se tedy občas ve studiích vyskytnou jisté nesrovnalosti, potvrzuje se v zásadě domněnka, že lze pomocí chromatické pupilografie hodnotit funkci zevní vrstvy sítnice u pacientů s RP. Podobně může pupilografie monitorovat případné zlepšení funkce, je-li u pacienta aplikována léčba.
Chromatická pupilografie při onemocnění zrakového nervu
Ve srovnání s červeným stimulem probíhá redilatace zornice po ukončení modrého stimulu o vysokém jasu déle. Tato prolongovaná pupilární konstrikce je v literatuře označovaná jako PIPR (postillumination pupil response) a je důsledkem protrahované elektrické aktivity fotosenzitivních buněk s obsahem melanopsinu při jejich vnitřní aktivaci [10]. Například u pacientů s glaukomem bylo zjištěno, že se s progresí onemocnění parametr PIPR zkracuje, což potvrzuje úbytek gangliových buněk sítnice u tohoto onemocnění [8, 11]. Překvapivě ale u pacientů s dědičnou neuropatií optiku nebyl ve srovnání se zdravými osobami zjištěn rozdíl v parametrech pupilární reakce odrážejících aktivitu gangliových buněk s obsahem melanopsinu [14]. To lze vysvětlit tak, že některé neuropatie optiku (např. glaukom) způsobují difúzní postižení gangliových buněk sítnice včetně buněk obsahujících melanopsin, jiné choroby (např. hereditární neuropatie optiku) právě tyto buňky ušetří, zatímco ostatní gangliové buňky odumírají [17].
Fotoreceptory pro cirkadiánní rytmus
Pro správné fungování cirkadiánního rytmu je nutná synchronizace vnitřních hodin s 24hodinovým cyklem světla a tmy v okolním prostředí. Hlavní biologické hodiny v nucleus suprachiasmaticus dostávají informace o intenzitě okolního osvětlení právě z retinálních gangliových buněk s obsahem melanopsinu. Existence těchto nových fotoreceptorů vysvětluje, proč zůstává i při absenci tyčinek a čípků zachován normální cirkadiánní rytmus. Při geneticky navozeném chybění melanopsinu u myší je cirkadiánní rytmus sice normální (12 : 12 hodinám), jen při působení modrého světla dochází k jeho fázovému posunu. U myší, kterým oči zcela chybí, však chybí i cirkadiánní rytmus. Pro fungování normálního cirkadiánního rytmu jsou tedy zapotřebí oči, nikoli ale tyčinky a čípky [16, 19, 22].
Výše uvedené rozdíly v postižení gangliových buněk s obsahem melanopsinu u různých neuropatií optiku vysvětlují jejich odlišný dopad na cirkadiánní rytmus a spánek. Například u pacientů s Leberovou hereditární neuropatií optiku, která selektivně šetří gangliové buňky s obsahem melanopsinu, nebývá přes výrazný zrakový hendikep cirkadiánní rytmus postižen [17]. Naopak bylo u zvířat s experimentálně navozeným glaukomem zjištěno, že ve srovnání se zdravými jedinci jim adaptace na posun cyklů světlo – tma trvá významně déle [5]. Pro chronobiologii bylo objevení gangliových buněk s obsahem melanopsinu velmi důležité, odstartovalo celou řadu studií a v blízké době lze jejich klinické výstupy očekávat například v oblasti spánkové medicíny nebo psychiatrie.
Vnitřně fotosenzitivní gangliové buňky sítnice a vidění
Zapojení vnitřně fotosenzitivních gangliových buněk sítnice do procesu vidění je zatím nejasné. Ecker a kol. zjistili, že při absenci tyčinek a čípků byly myši stále schopné rozlišit terčíky s pruhy o vysokém kontrastu a najít cestu z bludiště [6]. Možnou účast gangliových buněk s obsahem melanopsinu při zpracování zrakového vjemu podporují i četné spoje non-M1 buněk k centrálním mozkovým strukturám, které se nepodílí na řízení cirkadiánního rytmu ani pupilárního reflexu [3, 6]. Zda melanopsin nějakým způsobem přispívá k procesu vidění je velmi zajímavá otázka, jejíž zodpovězení může přinést nové šance na restituci vidění u pacientů, kteří oslepli v důsledku onemocnění tyčinek a čípků.
Závěr
Třetí fotoreceptory sítnice – vnitřně fotosenzitivní gangliové buňky sítnice s obsahem melanopsinu, které byly objeveny původně v rámci chronobiologického výzkumu, zásobují „vnitřní hodiny“ informací o světle, významně přispívají k pupilární reakci na osvit a možná i k procesu vidění. Jejich objevení může mít významné důsledky pro řadu oborů včetně oftalmologie. Chromatická pupilografie jistě nemůže nahradit více dostupnou a rozšířenou elektroretinografii, v individuálních případech však může poskytnout detailnější hodnocení funkce zevní vrstvy sítnice než elektroretinografie a uplatnit se ve specializovaných centrech při zavádění nových terapeutických postupů zejména u dědičných dystrofií sítnice. Další studie zabývající se významem vnitřně senzitivních gangliových buněk pro lidský organismus lze jistě očekávat.
Autoři práce prohlašují, že vznik i téma odborného sdělení a jeho zveřejnění není ve střetu zájmu a není podpořeno žádnou farmaceutickou firmou.
MUDr. Karolína Skorkovská, Ph.D.
Klinika nemocí očních a optometrie LF MU
Fakultní nemocnice u sv. Anny
Pekařská 53
656 91 Brno
e-mail: karolina.skorkovska@fnusa.cz
Do redakce doručeno dne 25. 2. 2015
Do tisku přijato dne 10. 4. 2015
Sources
1. Bailes, H.J., Lucas, R.J.: Melanopsin and inner retinal photoreception. Cell Mol Life Sci, 67; 2010 : 99–111.
2. Berson, D.M., Dunn, F.A., Takao, M.: Phototransduction by retinal ganglion cells that set the circadian clock. Science, 295; 2002 : 1070–1073.
3. Dacey, D.M., Liao, H.W., Peterson, B.B. et al.: Melanopsin-expressing ganglion cells in primate retina signal colour and irradiance and project to the LGN. Nature, 433; 2005 : 749–754.
4. Do, M.T., Kang, S.H., Xue, T. et al.: Photon capture and signalling by melanopsin retinal ganglion cells. Nature, 457; 2009 : 281–287.
5. Drouyer, E., Dkhissi-Benyahya, O., Chiquet, C. et al.: Glaucoma alters the circadian timing system. PLoS One, 3; 2008: e3931.
6. Ecker, J.L., Dumitrescu, O.N., Wong, K.Y. et al.: Melanopsin-expressing retinal ganglion-cell photoreceptors: cellular diversity and role in pattern vision. Neuron, 67; 2010 : 49–60.
7. Esquiva, G., Lax, P., Cuenca, N.: Impairment of intrinsically photosensitive retinal ganglion cells associated with late stages of retinal degeneration. Invest Ophthalmol Vis Sci, 54(7); 2013 : 4605–18.
8. Feigl, B., Mattes, D., Thomas, R. et al.: Intrinsically photosensitive (melanopsin) retinal ganglion cell function in glaucoma. Invest Ophthalmol Vis Sci, 52; 2011 : 4362–4367.
9. Hattar, S., Liao, H.W., Tako, M. et al.: Melanopsin-containing retinal ganglion cells: architecture, projections, and intrinsic photosensitivity. Science, 295; 2002 : 1065–1070.
10.Kankipati, L., Girkin, C.A., Gamlin, P.D.: Postillumination pupil response in subjects without ocular disease. Invest Ophthalmol Vis Sci, 51; 2010 : 2764–2769.
11.Kankipati, L., Girkin, C.A., Gamlin, P.D.: The post-illumination pupil response is reduced in glaucoma patients. Invest Ophthalmol Vis Sci, 52; 2011 : 2287–2292.
12. Kardon, R., Anderson, S.C., Damarjian, T.G. et al.: Chromatic pupil responses: preferential activation of the melanopsin-mediated versus outer photoreceptor-mediated pupil light reflex. Ophthalmology, 116; 2009 : 1564–1573.
13. Kardon, R.H., Anderson, S.C., Damarjian, T.G. et al.: Chromatic pupillometry in patients with retinitis pigmentosa. Ophthalmology, 118; 2011 : 376–381.
14. Kawasaki, A., Collomb, S., Léon, L. et al.: Pupil responses derived from outer and inner retinal photoreception are normal in patients with hereditary optic neuropathy. Exp Eye Res, 120; 2014 : 161–166.
15.Kawasaki, A., Crippa, S.V., Kardon, R., Leon, L., Hamel, C.: Characterization of pupil responses to blue and red light stimuli in autosomal dominant retinitis pigmentosa due to NR2E3 mutation. Invest Ophthalmol Vis Sci, 53; 2012 : 5562–5569.
16.Kawasaki, A., Kardon, R.H.: Intrinsically photosensitive retinal ganglion cells. J Neuro-Ophthalmol, 27(3); 2007 : 195–204.
17. La Morgia, C., Ross-Cisneros, F.N., Sadun, A.A. et al.: Melanopsin retinal ganglion cells are resistant to neurodegeneration in mitochondrial optic neuropathies. Brain, 133; 2010 : 2426–2438.
18. Lucas, R.J., Douglas, R.H., Foster, R.G.: Characterization of an ocular photopigment capable of driving pupillary constriction in mice. Nat Neurosci, 4; 2001 : 621–626.
19. Münch, M., Kawasaki, A.: Intrinsically photosensitive retinal ganglion cells; classification, function and clinical implications. Curr Opin Neurol, 26; 2013 : 45–51.
20. Schmidt, T.M., Chen, S., Hattar, S.: Intrinsically photosensitive retinal ganglion cells: many subtypes, diverse functions. Trends Neurosci, 34(11); 2011 : 572–580.
21. Skorkovská, K., Maeda, F., Kelbsch, C. et al.: Pupilární reakce na barevné podněty. Cesk Slov Neurol N, 77; 2014 : 334–338.
22. Wilhelm, B.J.: Das Auge der Inneren Uhr – Pupillenforschung in neuem Licht. Klin Monatsbl Augenheilkd, 227; 2010 : 840–844.
Labels
Ophthalmology
Article was published inCzech and Slovak Ophthalmology

2015 Issue 3-
All articles in this issue
- Functional Magnetic Resonance Imaging in Selected Eye Diseases
- Stereotactic Rediosurgery for Uveal Melanoma; Postradiation Complications
- Intrinsically Photosensitive Retinal Ganglion Cells
- Malignant Choroidal Melanoma in T4 Orbital Stage; Prosthesis of the Orbit
- Treatment of Keratoconus with Corneal Cross-linking – Results and Complications in 2 Years Follow-up
- Surgical Treatment of the Idiopathic Macular Hole by Means of 25-Gauge Pars Plana Vitrectomy with the Peeling of the Internal Limiting Membrane Assisted by Brilliant Blue and Gas Tamponade
- Multifocal Vitelliform Retinal Lesion
- Czech and Slovak Ophthalmology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Intrinsically Photosensitive Retinal Ganglion Cells
- Functional Magnetic Resonance Imaging in Selected Eye Diseases
- Surgical Treatment of the Idiopathic Macular Hole by Means of 25-Gauge Pars Plana Vitrectomy with the Peeling of the Internal Limiting Membrane Assisted by Brilliant Blue and Gas Tamponade
- Malignant Choroidal Melanoma in T4 Orbital Stage; Prosthesis of the Orbit
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

