-
Medical journals
- Career
Ranibizumab v léčbě vlhké formy VPMD – dvouleté výsledky léčby z registru AMADEuS
Authors: V. Matušková 1; P. Kolář 1; D. Vysloužilová 1; E. Vlková 1; L. Dušek 2; V. Kandrnal 2; Jiří Jarkovský 2; M. Uher 2
Authors‘ workplace: Oční klinika LF MU a FN Brno, přednostka prof. MUDr. Eva Vlková, CSc. 1; Institut biostatistiky a analýz, MU Brno ředitel doc. RNDr. Ladislav Dušek, Ph. D 2
Published in: Čes. a slov. Oftal., 68, 2012, No. 5, p. 171-177
Category: Original Article
Overview
Cíl:
Cílem naší studie bylo retrospektivní sledování pacientů s vlhkou formou věkem podmíněné makulární degenerace (VPMD), kteří byli léčeni ranibizumabem po dobu 24 měsíců. Získaná data byla zadána do registru AMADEuS (Age related MAcular DEgeneration in patientS in the Czech Republic) a po jejich vyhodnocení srovnána s výsledky léčby, které byly získány na jiných pracovištích zařazených v projektu AMADEUS či s výsledky některých zahraničních studií.Soubor pacientů a metodika:
Soubor zahrnoval pacienty zařazené do registru od 1. 10. 2008 do 11. 6. 2012, kteří splňovali podmínku 24měsíčního sledovacího období. Jednalo se o 90 očí u 89 pacientů. Všichni nemocní byli komplexně vyšetřeni v makulární poradně FN Brno Bohunice a poté jim byl intravitreálně aplikován ranibizumab Lucentis, Novartis) ve třech úvodních dávkách s měsíčním odstupem. Následně byl ranibizumab aplikován „on demand“. U 43,3 % očí byla přítomna převážně klasická, u 27,8 % okultní a u 28,9 % minimálně klasická choroidální neovakulární membrána (CNV). Vstupní zraková ostrost byla u 3,3 % očí v rozsahu 15–30 písmen ETDRS optotypů (20/500 – 20/200), u 61,1 % očí v rozsahu 31 – 60 písmen (20/200 – 20/63) a zrakovou ostrost více jak 61 písmen ETDRS optotypů (lepší než 20/63) mělo 35,6 % očí.Výsledky:
Průměrná vstupní nejlepší korigovaná zraková ostrost (NKZO) v našem souboru byla 54,2 písmen ETDRS (SD ± 14,4). Na kontrole za 3 měsíce od zahájení léčby byla NKZO 59,6 písmen ETDRS (SD ± 15,0), na kontrole za 6 měsíců 57,3 písmen ETDRS (SD ± 14,7), po 1 roce sledování 54,8 písmen ETDRS (SD ± 16,0), po 18 měsících sledování 53,4 písmen ETDRS (SD ± 16,8) a po 24 měsících sledování od zahájení léčby byla NKZO 51,7 písmen ETDRS (SD ± 16,9). Průměrná hodnota CRT (central retinal thickness) byla při vyšetření OCT (optická koherentní tomografie) na počátku léčby 311,4 μm (SD ± 117,9), po 3 měsících léčby 233,5 μm (SD ± 85,4), po 6 měsících léčby 262,2 μm (SD ± 102,4), po 12 měsících 261 μm (SD ± 88,4), po 18 měsících 254,9 μm (SD ± 70,0) a po 24 měsících 249 μm (SD ± 87,5). Průměrný počet dávek ranibizumabu během sledovacího období byl 5,6. Po 24měsíční sledovací době byl zisk 15 a více písmen ETDRS zaznamenán u 11,1 % pacientů, zisk 1 až 14 písmen ETDRS u 34,4 % pacientů, pokles o méně než 14 písmen ETDRS optotypů jsme pozorovali u 32,2 % pacientů a pokles více jak 15 písmen ETDRS v našem souboru byl u 22,2 % pacientů.Závěr:
Léčba vlhké formy VPMD pomocí ranibizumabu je dosud nejefektivnější dostupná terapie. Registr AMADEuS má při posuzování efektivity terapie vlhké formy VPMD velký význam.Klíčová slova:
VPMD, registr, Amadeus, ranibizumab, vlhká forma, léčbaÚVOD
Věkem podmíněná makulární degenerace (VPMD) je ve vyspělých zemích nejčastější příčinou těžkého postižení centrální zrakové ostrosti u pacientů nad 60 let věku. VPMD způsobuje ztrátu centrální zrakové ostrosti u 20 % osob starších 75 let. Suchá forma postihuje 85 % pacientů, vlhká forma se objevuje u 15 % pacientů [3, 6, 11, 13, 15, 16].
Vlhká forma VPMD je charakterizována přítomností choroidální neovaskulární membrány (CNV). Klíčovou roli v patogenezi CNV hraje vaskulární endoteliální faktor (VEGF).
V léčbě vlhké formy VPMD se dnes rutinně využívá fotodynamická terapie s verteporfinem a intravitreální aplikace anti VEGF látek [2, 12, 14, 17, 18, 19, 22].
Data získaná při léčbě vlhké formy VPMD ranibizumabem na naší klinice byla zadávána do registru pacientů AMADEuS. Projekt AMADEuS (Age related MAcular DEgeneration in patientS in the Czech Republic) je zaměřen na sledování pacientů s vlhkou formou VPMD. Česká oftalmologická společnost ČLS JEP (ČOS JEP) ve spolupráci s Institutem biostatistiky a analýz Masarykovy univerzity (IBA MU) vybudovala celostátní informační systém pro sledování epidemiologie a léčby VPMD. Projekt s názvem AMADEUS je multicentrickou neintervenční observační prospektivní studií s cílem zlepšit péči o pacienty a sjednotit kritéria pro sledování VPMD v reálné klinické praxi ČR. Základním nástrojem projektu je klinický registr, který sbírá parametrická data z 10 specializovaných center. Projekt monitoruje fotodynamickou terapií s verteprofinem (Visudyne) a léčbu preparáty inhibujícími VEGF, tedy pegaptanib (Macugen) a ranibizumab (Lucentis) [5].
Primárním cílem projektu AMADEuS je posouzení dostupné terapie VPMD v běžné klinické praxi. Sekundární cíle jsou zhodnocení adherence ke guidelines doporučených Českou vitreoretinální společností (ČVRS) a ČOS JEP, získání podkladů pro aktualizaci guidelines léčby pacientů s VPMD v České republice, standardizace terapeutických postupů v zapojených centrech, hodnocení bezpečnosti sledovaných přípravků, vytvoření modelu prevalence pacientů s vlhkou formou VPMD v České republice v následujících 3 letech a odhad nákladů na léčbu vlhké formy VPMD v daném období.
Projekt AMADEuS je zastřešen ČOS při ČLS JEP, odborným garantem je doc. MUDr. Šárka Pitrová, CSc., FEBO a doc. MUDr. Jiří Řehák, CSc., FEBO. Technologické zázemí projektu a analýzu dat poskytuje IBA Masarykovy univerzity Brno (doc. RNDr. Ladislav Dušek, Ph.D. a MUDr. Vít Kandrnal). Projekt AMADEUS je podpořen výzkumnými granty společnosti Novartis [8].
SOUBOR PACIENTŮ
Soubor zahrnoval pacienty zařazené do registru od 1. 10. 2008 do 11. 6. 2012, kteří splňovali podmínku 24měsíčního sledování. V našem centru bylo k danému datu vloženo do registru AMADEuS celkem 346 pacientů, 377 očí. Nemocných léčených ranibizumabem s dvouletou sledovací dobou bylo celkem 89 (90 očí). Z této skupiny ženy představovaly 56,20 % a muži 43,8 %. Pacientů mladších 60 let bylo 11,2 %, ve věku 60 až 70 let bylo 21,3 %, ve věku 70 - 80 let 42,7 % a ve věku nad 80 let bylo 24,7 % (graf 1).
Graph 1. Charakteristika souboru dle věku pacientů 
U 43,3 % očí byla přítomna převážně klasická CNV, u 27,8 % okultní CNV a u 28,9 % minimálně klasická CNV (graf 2). Léze menší než 2 papilární diametry (PD) byla popsána u 16,7 % očí, léze velikosti 2–5 PD u 71,1 % očí a léze větší než 5 PD u 12,2 % očí (graf 3). Vstupní zraková ostrost v rozsahu 15–30 písmen ETDRS optotypů se v našem souboru objevila u 3,3 % očí, zrakovou ostrost 31–60 písmen mělo 61,1 % očí a zrakovou ostrost více jak 61 písmen ETDRS optotypů mělo 35,6 % očí (graf 4).
Graph 2. Charakteristika souboru dle typu CNV 
Graph 3. Charakteristika souboru dle velikosti léze 
Graph 4. Charakteristika souboru dle vstupní zrakové ostrosti 
METODIKA
Pacienti s vlhkou formou VPMD, léčení po dobu 24 měsíců ranibizumabem, byli sledováni retrospektivně. Všichni nemocní byli vyšetřeni v makulární poradně Oční kliniky FN Brno Bohunice. Při každém vyšetření jim byla stanovena nejlepší korigovaná zraková ostrost (NKZO) pomocí ETDRS optotypů, změřen nitrooční tlak, byl vyšetřen přední oční segment na štěrbinové lampě (Zeiss SL120) a v arteficiální mydriáze provedena biomikroskopie fundu za pomoci asférických čoček (Ocular Instruments optické mohutnosti +60D nebo +78D). Diagnóza a typ CNV byly stanoveny na základě fluorescenční angiografie (Topcon TRC 50IX s použitím zobrazovacího systému ImageNet 2000).
Všem pacientům bylo při každé návštěvě provedeno vyšetření OCT (optická koherentní tomografie přístrojem Zeiss Stratus III – fast macular scan a 6 mm cross hair scan). Nemocní podstoupili intravitreální aplikaci ranibizumabu na zákrokovém sále Oční kliniky FN Brno. Do spojivkového vaku byla 3x denně 3 dny před IVT injekcí aplikována antibiotika (ofloxacinum opht gtt 3 mg/ml nebo levofloxacinum 5 mg/ml). Kůže víček byla dezinfikována 10 % roztokem povidon jódu (Betadine) a spojivkový vak byl vypláchnut 5 % roztokem povidon jódu. Bylo aplikováno 0,5 mg ranibizumabu (0,05 ml roztoku). Intravitreální aplikace byla provedena za aseptických podmínek pod operačním mikroskopem. Půl hodiny po intravitreální aplikaci léčiva byl pacientovi změřen nitrooční tlak, na štěrbinové lampě zkontrolována vstupní rána a provedena biomikroskopie fundu. Po injekci pacient další 3 dny 3x denně aplikoval lokální antibiotika.
Získaná data byla zadávána do registru AMADEuS (http://amadeus.registry.cz). Při prvním vložení pacienta do registru byl pacient anonymizován a bylo mu přiřazeno číslo ve tvaru (AMD-B-***). Data byla zadávána při zahájení léčby po 3, 6, 12, 18 a 24 měsících léčby. Při vstupní návštěvě byla zadána zdravotní pojišťovna, okres bydliště, délka subjektivních obtíží a datum zahájení léčby (obr. 1). Při vyplnění každého formuláře byla zaznamenána NKZO. Pokud pacient četl ze vzdálenosti 4 metrů na ETDRS optotypech alespoň 20 písmen, byl mu přičten bonus 30 písmen. Pokud pacient četl ze vzdálenosti 4 m méně než 20 znaků (tj. méně než 4 celé řádky), byl posazen do vzdálenosti 1 m od ETDRS optotypů, počet přečtených písmen z 1 m byl přičten k počtu písmen přečtených ze 4 m.
Image 1. Zadání vstupní návštěvy pacienta do registru AMADEuS 
Dále byl zaznamenán do elektronického formuláře typ léze, velikost léze, hodnota nitroočního tlaku, angiografický nález, hodnoty naměřené vyšetřením OCT (centrální tloušťka makuly [μm], objem makuly [mm3]), přítomnost metamorfopsií a míra subjektivních potíží. Dále byly zaznamenány případné nežádoucí účinky (obr. 2).
Image 2. Zadání kontrolní návštěvy do registru AMADEuS 
VÝSLEDKY
Průměrná vstupní NKZO v našem souboru byla 54,2 písmen ETDRS (20/80) (SD ± 14,4), na kontrole za 3 měsíce od zahájení léčby 59,6 (20/63) (SD ± 15,0), na kontrole za 6 měsíců 57,3 (20/63) (SD ± 14,7), po 1 roce sledování 54,8 (20/80) (SD ± 16,0), po 18 měsících sledování 53,4 (20/80) (SD ± 16,8) a po 24 měsících sledování od zahájení léčby byla NKZO 51,7 písmen ETDRS (20/100) (SD ± 16,9) (graf 5).
Graph 5. Vývoj nejlépe korigované zrakové ostrosti (NKZO) během 24 měsíců sledování 
Průměrná hodnota CRT na OCT byla na počátku léčby 311,4 μm (SD ± 117,9), po 3 měsících léčby 233,5 μm (SD ± 85,4), po 6 měsících léčby 262,2 μm (SD ± 102,4), po 12 měsících 261 μm (SD ± 88,4), po 18 měsících 254,9 μm (SD ± 70,0) a po 24 měsících 249 μm (SD ± 87,5) (graf 6).
Graph 6. Vývoj centrální tloušťky sítnice (central retinal thickness – CRT) během 24 měsíců sledování 
Průměrný počet dávek ranibizumabu byl během sledovacího období 5,6. Aplikace 3 dávek ranibizumabu byla nutná u 23,3 % pacientů, u 22,2% jsme aplikovali 4 dávky, u 15,6 % pacientů 5 a 6 dávek, 7 dávek dostalo 4,4 % pacientů, 8 dávek 5,6 %, 9 a 10 dávek 2,2 %, 11 dávek 4,4 % a 13 dávek 1,1 % pacientů.
Po 24 měsíční sledovací době byl zisk 15 a více písmen ETDRS zaznamenán u 11,1% pacientů, zisk 1 až 14 písmen ETDRS u 34,4 % pacientů, pokles o méně než 14 písmen ETDRS optotypů jsme pozorovali u 32,2 % pacientů a pokles více jak 15 písmen ETDRS se v našem souboru objevil u 22,2 % pacientů (graf 7). Reziduální aktivita onemocnění po 2 letech léčby byla pozorována u 24,4 % pacientů.
Graph 7. Nejlépe korigovaná zraková ostrost (NKZO) po 24 měsících sledování 
DISKUSE
Cévní endoteliální růstový faktor (VEGF) je signální protein, který stimuluje novotvorbu cév. Existuje několik základních subtypů molekuly VEGF (VEGF-A, VEGF-B, VEGF-C, VEGF-D). Molekula VEGF A má několik izoforem (VEGF A121, 145, 165, 183, 189, 206), které se od sebe vzájemně liší velikostí molekuly.
Humanizovaná protilátka blokující VEGF-A se jmenuje bevacizumab (Avastin, Roche) a má molekulární hmotnost 148 kD. Původní pokusy s bevacizumabem na zvířecích sítnicích ale ukázaly, že tato protilátka neproniká přes všechny vrstvy sítnice. Proto byly dále vynaloženy velké finanční prostředky na vývoj menší molekuly. Ranibizumab (Lucentis, Novartis) je rekombinantní humanizovaný fragment původní molekuly bevacizumabu, který blokuje všechny izoformy molekuly VEGF-A stejně jako bevacizumab [2, 14, 18, 19].
Genová sekvence pro část molekuly vážící VEGF-A byla vyjmuta z prekurzoru a vložena do vektoru Escherichia coli, aby vytvořila rekombinant lidského fragmentu (rhuFab). Tento proces odstranil Fc části protilátky, čímž se snížil imunogenní potenciál a zmenšila se velikost molekuly. Molekulární hmotnost je 48 kD. Na zvířecích modelech se prokázalo, že zmenšení molekuly usnadnilo penetraci přes všechny vrstvy sítnice [7].
Ranibizumab blokuje tu část molekuly VEGF-A, která slouží k navázání na VEGF receptor 1 v endoteliálních buňkách. Tím redukuje proliferaci endoteliálních buňek, snižuje vaskulární permeabilitu cév a zastavuje tvorbu nových cév. Díky své nízké molekulární hmotnosti je ranibizumab schopen pronikat do všech vrstev sítnice [2].
Biologický poločas ranibizumabu v prostoru sklivce je 10 dní [2]. Některé publikace uvádí kratší biologický poločas 7 dnů [20]. Ranibizumab má rychlou systémovou eliminaci a krátký systémový poločas (~2hodiny) [10].
Účinnost ranibizumabu u minimálně klasických a okultních CNV byla testována v klinické studii MARINA (Ranibizumab for neovascular age-related macular degeneration).
Do studie bylo zahrnuto celkem 716 pacientů. Ve skupině pacientů (n = 238) dostávajících 0,5 mg ranibizumabu měsíčně bylo po 12 měsících dosaženo ztráty méně jak 15 písmen u 94,6 % pacientů. Ve skupině dostávající placebo byla ztráta zrakové ostrosti menší než 15 písmen ETDRS optotypů pozorována u 62,2 % subjektů. Zlepšení zrakové ostrosti o více jak 15 písmen bylo zaznamenáno u 33,8 % pacientů dostávajících 0,5 mg ranibizumabu, ve skupině s placebem bylo toto zlepšení přítomno pouze u 5,0 % pacientů. Průměrný nárůst zrakové ostrosti byl ve skupině léčené ranibizumabem 6,6 písmene ETDRS optotypů. Zisk písmen byl udržen po celou sledovací dobu 24 měsíců. Ve skupině s placebem naopak došlo k poklesu zrakové ostrosti o 10,4 písmen ETDRS optotypů. Průměrný počet dávek 0,5 mg ranibizumabu na jednoho pacienta byl 21,7 [21].
Přínos ranibizumabu v léčbě klasických membrán byl zkoumán ve studii ANCHOR (Anti-VEGF body Antibody for the Treatment od Predominantly Classic Choroidal Neovascularization in Age-Related Macular Degeneration). Ve studii bylo zařazeno 423 pacientů. Ztráta méně jak 15 písmen ETDRS optotypů byla zaznamenána u 96,4 % pacientů dostávajících 0,5 mg ranibizumabu. Zlepšení ZO o více jak 15 písmen ETDRS bylo pozorováno u 40,3 % pacientů. Průměrný zisk písmen ve skupině léčené ranibizumabem byl 11,3 písmene [4].
Zisku více jak 15 písmen bylo dosaženo ve studii Marina u 33,3 % pacientů, ve studii Anchor dokonce u 41,0 % pacientů, v našem souboru jsme daného zlepšení dosáhli u 11 % pacientů. Průměrný zisk písmen ve studii Anchor byl 10,7 písmen ETDRS, ve studii Marina 6,6 písmen a v našem souboru došlo v průměru ke ztrátě o 2,5 písmene. Lepších výsledků v porovnání s našimi bylo dosaženo s největší pravděpodobností díky přísnějším vstupním kritériím obou výše citovaných klinických studií, tj. léze maximálně velikosti 5400 μm, NKZO mezi 20/40 (0,5) a 20/320 (0,06) a nepřítomnost strukturálního postižení ve fovee a pravidelná aplikace ranibizumabu v intervalu 4 týdnů po dobu 2 let. Ve studii Marina 80 % pacientů četlo při vstupní návštěvě více jak 45 písmen ETDRS optotypů.
Náš soubor zahrnoval spektrum odpovídající klinické praxi, tj. větší a agresivnější léze (např. 12,5 % pacientů s lézí větší než 5 PD). Dalším velkým rozdílem je dávkovací schéma ranibizumabu.
Ve studii Marina a Anchor byl ranibizumab podáván měsíčně, v našem souboru „on demand“. Stále zůstává nepopíratelným faktem, že největší efekt na zlepšení NKZO má měsíční podávání ranibizumabu. Vzhledem k vysoké finanční náročnosti této léčby je snaha najít optimální dávkovací schéma podávání ranibizumabu. Efektivnost čtvrtletního podávání ranibizumabu byla hodnocena ve studii PIER (Randomized, double-masked, sham-controlled trial of ranibizumab for neovascular age-related macular degeneration). Ranibizumab byl nejprve po dobu 3 měsíců podáván měsíčně a následně čtvrtletně. Studie zahrnovala 184 pacientů. Po 24 měsících sledování získalo více jak 15 písmen 8,2 % pacientů léčených 0,5 mg ranibizumabu. Během sledovacího období došlo k poklesu o 2,3 písmen ETDRS optotypů ve skupině pacientů dostávající 0,5 mg ranibizumabu [1]. Tento výsledek je ve shodě s našimi poznatky.
Nejvyššího zisku písmen ETDRS bylo dosaženo ve studii Anchor, tj. studie s agresivnějšími lézemi (s převážně klasickými CNV). Na výslednou zrakovou ostrost nemá tedy rozhodující vliv jen typ CNV, ale důležitou roli zde hrají i další faktory (atrofie RPE -retinální pigmentový epitel, procentuální zastoupení fibrotizace, velikost doprovodné subretinální hemoragie a vstupní NKZO). Porovnání našich výsledků s výsledky jednotlivých klinických studií je uveden v tabulce 1.
Table 1. Přehled studií s ranibizumabem v léčbě vlhké formy VPMD 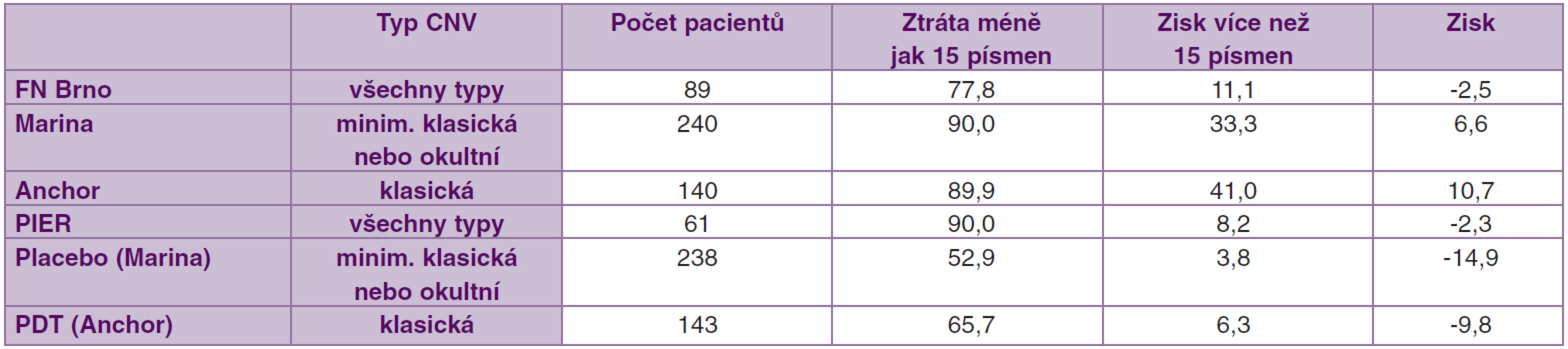
Pokud srovnáme průběh zrakové ostrosti (ZO) v našem souboru a ve výše uvedených studiích, pozorujeme ve všech souborech skokovité zlepšení ZO v prvních 3 měsících léčby. V našem souboru a ve studii PIER po počátečním nárůstu dochází k pozvolnému poklesu ZO, po 12 měsících sledování odpovídá zraková ostrost vstupní hodnotě a během druhého roku sledování je viditelná lehká ztráta písmen ETDRS optotypu.
Při měsíčním podávání ranibizumabu (MARINA, ANCHOR) po počátečním rychlém vzestupu ve třech měsících nastupuje další pozvolný nárůst až do 12 měsíců sledování, během druhého roku sledování lze pozorovat mírný pokles zisku písmen ETDRS.
Průběhu křivky ZO inverzně odpovídá křivce CRT. Maximální pokles v našem souboru vidíme po 3 měsících léčby, pak následuje mírný nárůst CRT v době do 12 měsíců a během druhého roku sledovací doby je pozorovatelný další mírný pokles CRT. Hodnota CRT po počátečním poklesu již nikdy nedosahuje vstupních hodnot. Především během druhého roku sledování je viditelný pokles ZO současně s poklesem CRT, což znamená, že u těchto pacientů pravděpodobně progreguje atrofie RPE nebo dochází k fibrotizaci léze.
Při hodnocení vývoje zrakové ostrosti u pacientů se „shame“ léčbou ve studii Marina je patrný rychlý pokles ZO během sledovacího období. V prvním roce je ztráta 10,4 písmen ETDRS, ve druhém roce je pokles zrakové ostrosti mírnější, na konci dvouletého sledování dosahuje ztráta 15 písmen ETDRS. Při snaze dosáhnout co nejlepších výsledků u pacientů s vlhkou formou VMPD je nutno pamatovat nejen na efektivní a dostatečné dávkování ranibizumabu, ale i na včasné zahájení léčby. Prodleva v zahájení léčby o 6 měsíců představuje pro pacienta ztrátu téměř 7 písmen ETDRS optotypu [21].
V souboru všech pacientů léčených ranibizumabem zadaných v registru AMADEuS k 11. 6. 2012 byla vstupní zraková ostrost v rozsahu 15–30 písmen ETDRS optotypů u 16,7 % očí, 31–60 písmen u 51,3 % a více jak 61 písmen ETDRS optotypů četlo 25,7 % očí [9].
Rozložení vstupní zrakové ostrosti v námi sledovaném souboru je velmi podobné rozložení v souboru pacientů ze všech center registru AMADEuS (viz tabulka 2). Největší rozdíl je v počtu pacientů ve skupině se zrakovou ostrostí 14 a méně písmen ETDRS, 6,3 % versus 2,8 %. Tento fakt může souviset s využíváním dalších léčebných možností u klasických CNV, tj. s PDT (fotodynamická terapie s Visudynem). Na našem pracovišti tuto léčbu stále rutinně využíváme především u rozsáhlých a vysoce aktivních klasických CNV.
Table 2. Srovnání vstupní ZO u našeho souboru a u celého registru Amadeus 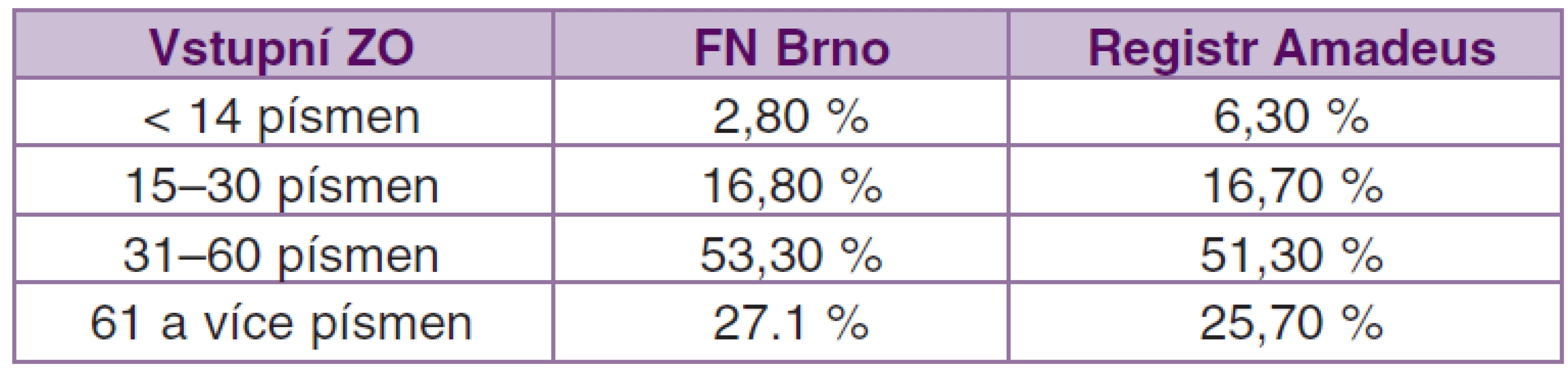
V souboru všech pacientů léčených ranibizumabem zadaných k 11. 6. 2012 v registru AMADEuS s 24měsíční sledovací dobou byl zisk 15 a více písmen ETDRS
pozorován u 11,2 % pacientů, zisk 1 až 14 písmen ETDRS u 29,7 % pacientů, pokles o méně než 14 písmen ETDRS optotypů byl přítomen u 53,3 % pacientů a pokles více jak 15 písmen ETDRS se v celém souboru AMADEuS objevil u 30,8 % pacientů. Aktivita onemocnění byla popisována u 26,4 % pacientů (tab. 3).
Table 3. Změna NKZO po 24 měsíční sledovací době u našeho souboru a u celého registru Amadeus 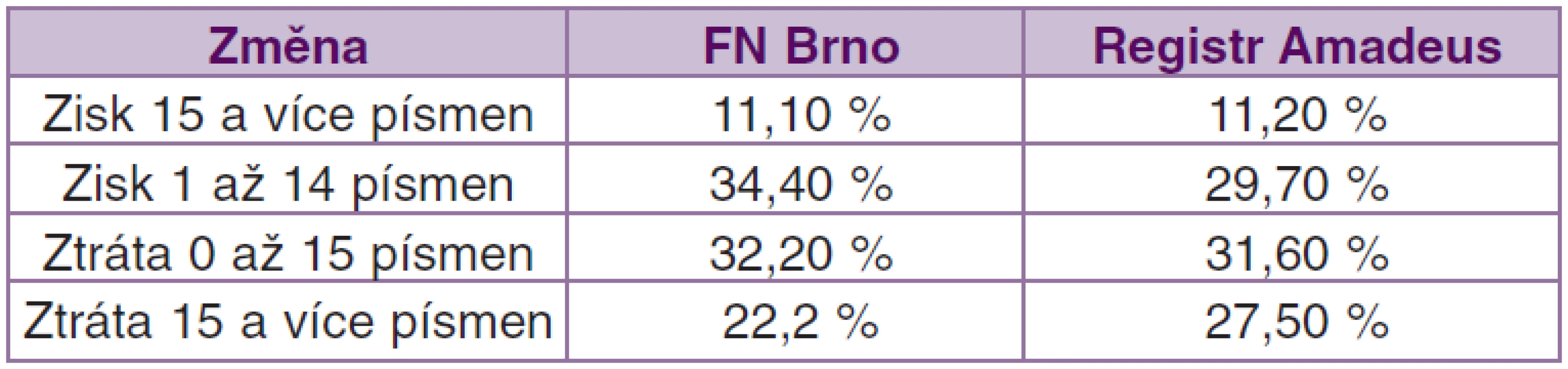
Náš soubor, hodnotící výslednou NKZO, odpovídá svými výsledky celému souboru AMADEuS, mírně lepších výsledků bylo dosaženo ve skupině se ziskem 1 až 14 písmen ETDRS a ve skupině se ztrátou více jak 15 písmen ETDRS. Tato skutečnost může opět souviset s faktem, že k léčbě velmi agresivních lézí byla použita PDT s verteporfinem.
V registru AMADEuS byl průměrný počet dávek ranibizumabu 5,4 za 24 měsíců. Ke stabilizaci či zlepšení onemocnění bylo u 25,6 % pacientů potřeba 3 dávek ranibizumabu, u 22,6 % pacientů byly aplikovány 4 dávky, u 18,5 % pacientů bylo potřeba 5 dávek, u 13,8 % 6 dávek, u 5,1 % 7 dávek a u 4,6 % pacientů bylo potřeba 8 dávek. Ve skupině pacientů, kde došlo k progresi onemocnění (pokles ETDRS o více jak 15 písmen), byly u 23 % aplikovány 3 dávky, u 17, 6 % 4 dávky, u 14,9 % 5 dávek, u 17,6 % 6 dávek, u 14,9 % dávek 7 dávek a u 5,4 % pacientů bylo potřeba 8 dávek. Průměrný počet dávek ranibizumabu v našem souboru byl 5,6 za 24 měsíců, což odpovídá výsledku z celého registru AMADEuS. Je vidět, že rozdíl našeho souboru a souboru celého registru AMADEuS je spíše ve vstupních charakteristikách souboru (počet agresivních lézí, vstupní NKZO) než ve způsobu vedení léčby.
ZÁVĚR
Léčba vlhké formy VPMD pomocí ranibizumabu je v současné době nejefektivnější dostupnou terapií. Při posouzení efektivnosti této léčby je velkým pomocníkem celonárodní registr AMADEuS. Umožňuje zmapovat počet pacientů, stadium jejich nemoci a porovnat efektivnost léčby v jednotlivých centrech. Tyto poznatky vedou ke zlepšení péče o pacienty s vlhkou formou VPMD. V neposlední řadě je registr nápomocen při evidování počtu pacientů s vlhkou formou VPMD a při odhadování finančních nákladů potřebných na tuto léčbu.
Do redakce doručeno dne 8. 11. 2012
Do tisku přijato dne 16. 11. 2012
MUDr. Veronika Matušková, Ph.D, FEBO
Oční klinika FN Brno a LF MU
Jihlavská 20
625 00 Brno
e-mail: v.matuskova@email.cz
Sources
1. Abraham, P., Yue, H., Wilson, L.: Randomized, double-masked, sham-controlled trial of ranibizumab for neovascular age-related macular degeneration, PIER study year 2, Am J Ophthalmol, 150, 2010; 3 : 315–324.
2. Blick, S., Keating, G., Wagstaff, A.: Ranibizumab, Adis Drug Profile, 67, 2007; 8 : 1199–1206.
3. Boguszaková , J., Sklivec a sítnice In Kuchynka P.: Oční lékařství, Praha, Grada, 2007, Praha, s 316–324.
4. Brown, D. M., Michels, M., Kaiser, P., K. et al.: for the ANCHOR Study Group. Ranibizumab versus verteporfin photodynamic therapy for neovascular age-related macular degeneration: Two-year results of the ANCHOR study, Ophthalmology, 116, 2009, 1 : 57–65.
5. Dušek, L., Pitrová, Š., Řehák, J. et al.: Informační zázemí České oftalmologické společnosti ČLS JEP pro monitoring a hodnocení léčby vlhké formy věkem podmíněné makulární degenerace - národní projekt AMADEUS. Čes a Slov Oftalmol, 66, 2010, 3 : 99–109.
6. Ernest, J., Fišer, I., Kolář, P.: Věkem podmíněná makulární degenerace. Praha, Česká vitreoretinální společnost, 2007; 88 s.
7. Ferrara, N., Damico,L., Shams, N. et al.: Development of ranibizumab, an anti-vascular endothelial growth factor antigen binding fragment, as therapy for neovascular age-related macular degeneration, Retina, 26, 2006; 8 : 859–870.
8. http://amadeus.registry.cz.
9. http://amadeus.registry.cz/index. php?pg=vysledky-a-publikace-analyticka-zprava-cerven-2012.
10. Chen, Y., Wiesmann, Ch., Germaine, F. et al.: Selection and Analysis of an Optimized Anti-VEGF Antibody: Crystal Structure of an Affinity-matured Fabin Complex with Antigen, J Mol Biol, 1999; 293, 865 –881.
11. Kolář, P.: Klasifikace a klinický obraz VPMD In Kolář., P: Věkem podmíněná makulární degenerace, Praha, Grada, 2008, s 59–74.
12. Kolář, P., Vlková, E., Vižďová, D.: Fotodynamická terapie s preparátem Visudyne v léčbě vlhké formy věkem podmíněné makulární degenerace – dvouleté výsledky. Čas Lék čes, 145, 2006; 10 : 795 – 800.
13. Kolář, P.: Epidemiologie věkem podmíněné makulární degenerace. Čes a Slov Oftalmol, 66, 2010; 3 : 127–130.
14. Kolář, P.: Ranibizumab u pacientů s vlhkou formou věkem podmíněné makulární degenerace – studie SUSTAIN. Farmakoterapie, 2009; 6 : 579–580.
15. Kolář, P.: Věkem podmíněná makulární degenerace, Čas Lék čes, 144, 2005; 8 : 516–520.
16. Kolář, P.: Věkem podmíněná makulární degenerace, Oftalmochirurgie, 3, 2008; 2 : 9–21.
17. Kolář, P.: Macugen v léčbě vlhké formy věkem podmíněné makulární degenerace, Oftalmochirurgie, 3, 2008; 2 : 37–42.
18. Kolář, P.: Ranibizumab (Lucentis) – nový lék k léčbě vlhké formy věkem podmíněné makulární degenerace. Praktické lékárenství, 2008; 6 : 271–274.
19. Kolář, P.: Ranibizumab. Farmakoterapie. 2007; 5 : 431–434.
20. Krohne, T. U., Liu, Z., Holz, F. G., Meyer, C.: Intraocular Pharmacokinetics of Ranibizumab Following a Single Intravitreal Injection in Humans. Am J Ophthalmol, 2012; 154 : 682–686.
21. Rosenfeld, P. J., Brown, D. M., Heier, J. S., et al.: for the MARINA Study Group: Ranibizumab for Neovascular Age-Related Macular Degeneration The New England Journal of Medicine, 355, 2006; 14 : 1419–1431.
22. Sivaprasad, S., Hykin, P., Saeed, A. et al.: Intravitreal pegaptanib sodium for choroidal neovascularisation secondary to age-related macular degeneration, Pan-European experience. Eye, 5, 2010, 24 : 793–798.
Labels
Ophthalmology
Article was published inCzech and Slovak Ophthalmology

2012 Issue 5-
All articles in this issue
- Ranibizumab v léčbě vlhké formy VPMD – dvouleté výsledky léčby z registru AMADEuS
- Pars plana vitrektómia a kombinovaná liečba pars plana vitrektómia, triamcinolon acetonid intravitreálne a laserkoagulácia makuly pri diabetickom edéme makuly – ročné výsledky
- Klinická rozmanitosť Bestovej choroby
- Súčasný stav evidencie zhubných nádorov oka a očných adnexov (dg. C69) v SR a ČR
- Srovnání metody nastavitelných versus fixních stehů při operaci strabismu u pacientů s endokrinní orbitopatií
- Aplikace Dysportu® – možnost doprovodného vedlejšího efektu na postavení víček (klinicko-histologická studie)
- Transnazální endoskopická chirurgie nádorů očnice
- Czech and Slovak Ophthalmology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Klinická rozmanitosť Bestovej choroby
- Aplikace Dysportu® – možnost doprovodného vedlejšího efektu na postavení víček (klinicko-histologická studie)
- Pars plana vitrektómia a kombinovaná liečba pars plana vitrektómia, triamcinolon acetonid intravitreálne a laserkoagulácia makuly pri diabetickom edéme makuly – ročné výsledky
- Srovnání metody nastavitelných versus fixních stehů při operaci strabismu u pacientů s endokrinní orbitopatií
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

