-
Medical journals
- Career
Současný pohled na diabetický makulární edém
Authors: T. Sosna 1,2; R. Švancarová 2; M. Netuková 3; J. Studnička 4
Authors‘ workplace: Centrum diabetologie IKEM, Praha, přednostka prof. MUDr. Terezie Pelikánová, DrSc. 1; Oční oddělení TN, Praha, primář MUDr. Karel Sedláček 2; FNKV, Praha, přednosta prof. MUDr. Pavel Kuchynka, CSc. 3; Oční klinika FN a LF UK, Hradec Králové, přednosta prof. MUDr. Pavel Rozsíval, CSc., FEBO 4
Published in: Čes. a slov. Oftal., 68, 2012, No. 3, p. 91-97
Category: Comprehensive Report
Úvod
Diabetická makulopatie vzniká následkem zhroucení hematookulární bariéry a ve svém důsledku vede k akumulaci extracelulární tekutiny, sítnicovému edému a obvykle i k ukládání proteinů a lipidů ve formě tvrdých exsudátů v makule nebo v její těsné blízkosti. Makulární edém je obecně definován jako retinální ztluštění, prosáknutí či tvrdé exsudáty v dosahu ± papilárního průměru (1500 mikronů) od centra makuly.
Prvým, kdo popsal diabetické makulární změny, byl Eduard Jaeger, a to již rok po objevu přímého oftalmoskopu v roce 1856. Ve svém atlasu sítnicových chorob jej popsal jako okrouhlé či oválné žlutavé skvrny prostupující částí nebo úplnou tloušťkou sítnice. Největší veličina oftalmologie té doby Albrecht von Graefe jeho pozorování odmítnul s tím, že není kauzální doklad o souvislosti nálezu na očním pozadí s diabetem. Prakticky jediný, kdo stál za Jaegrovým nálezem, byl Luis Desmarres, který v roce 1858 popsal obdobný vztah mezi makulopatií a diabetes mellitus (DM). Až když v roce 1869 publikoval v Americe Henry Noyes svou práci: „Retinitis in glycosuria“, byla souvislost makulopatie a diabetu akceptována celosvětově. Dalším důležitým milníkem v popisu diabetické makulopatie byla práce Edwarda Nettleshipa z Londýna: „On Oedema or Cystic Disease of the Retina“, kde na histopatologických nálezech potvrdil cystoidní degeneraci makuly u diabetiků. V téže době byla publikována důležitá práce sira Stevena Mackensieho: „Glycosuric retinitis“ popisující další důležité patologické změny sítnice diabetiků. Francouz Apollinaire Bouchardat pochopil spojitost diabetu a sítnicových změn a ve své knize: „De la Glycosurie ou diabète sucré“ popisuje akumulaci lipidů a tekutiny v sítnici diabetiků. Kromě přesné kreslené dokumentace popsal i spojitost těchto depozit s poklesem zrakové ostrosti, kterou nazval: „glukózou indukovaná amblyopie“.
Chybný náhled von Graefeho na diabetické sítnicové změny uvedl na pravou míru až jeho německý kolega Theodor Leber, který publikoval množství klinických nálezů a onemocnění nazval retinitis glycosurica.
Velkým krokem v diagnostice diabetické makulopatie (DMP) bylo v prvé polovině minulého století použití zprvu bezkontaktní, později i kontaktní, plano-konkávní -55 dioptrické Hrubyho čočky, která umožňovala vyšetření makuly ve stereoskopickém pohledu v úhlovém zvětšení 5–8 st.
V roce 1959 Hans-Walther Larsen vydává fotografický atlas diabetické retinopatie, ve kterém je diabetický makulární edém (DME) již velmi podrobně zdokumentován.
Základem současného popisu a dělení jsou práce Bresnicka z let 1983 až 1986 a především velká studie Early Treatment Diabetic Retinopathy Study (ETDRS) z let 1984 až 1987.
Epidemiologie DME
Téměř 30 roků stará americká Kleinova „The Wisconsin Epidemiologic Study“ je zatím největší epidemiologickou populační studií sledující prevalenci a incidenci DME. Makulární edém v ní byl standardním způsoben definován především pomocí biomikroskopického vyšetření. Ze studie vyplývá, že se DME u pacientů s počínající diabetickou retinopatií (DR) vyskytuje až v 6 % případů. U pokročilých stadií neproliferativní DR až v 63 % případů a u proliferativní formy DR byl edém nalezen dokonce u 74 % nemocných diabetem. Prevalence DME narůstá s trváním DM. U diabetiků 1. typu se do 5 let od diagnózy nemoci DME prakticky nevyskytuje. Po 20 letech má DME téměř 30 % nemocných. U diabetiků 2. typu léčených inzulinem byl DME častější než u diabetiků na perorální léčbě (15 % / 4 %).
Prevalence edému narůstá s délkou onemocnění, s vyšší hladinou glykovaného hemoglobinu (HbAlc) a proteinurií.
Studie také sledovala čtyřletou incidenci DME. Za toto období se rozvinul edém u diabetiků 1. typu v 8,2 % a u 2. typu v 5,2 %, přičemž opět častěji u pacientů léčených inzulinem (8,4 % / 2,9 %).
Klinicky signifikantní makulární edém se rozvinul u 4,3 % diabetiků 1. typu a u 2,9 % diabetiků 2. typu (znovu častěji u inzulinem léčených – 5,1 % / 1,3 %).
Incidence dále korelovala s pokročilostí DR. U pacientů bez DR se v průběhu 4 roků DME rozvinul pouze v 1 % případů, u počínající formy až v 10 %. U středně pokročilé až ve 20 % případů a u pokročilých forem až ve 24 % případů.
Incidence opět úzce korelovala s délkou onemocnění a hladinou HbAlc. Je důležité uvědomit si fakt, že DME může předcházet i samotnému vzniku diabetické retinopatie.
Evropská epidemiologická data o DME jsou chudá a značně nekonzistentní.
Velmi zajímavá data o DME můžeme očekávat ze studie PREAVAIL. Primárním cílem studie je určit prevalenci diabetických pacientů s diagnostikovaným diabetickým makulárním edémem a DME se sníženou zrakovou ostrostí u diabetické populace v Belgii, Francii, Itálii, Německu, Holandsku, Španělsku a Velké Británii. Druhotný cíl studie je získat sociodemografickou a klinickou charakteristiku pacientů s diagnózou diabetického makulárního edému a DME se sníženou zrakovou ostrostí v těchto zemích v časovém horizontu jednoho roku a určit jeho incidenci. Studie předpokládá 560 pacientů pro každou zemi, z nichž bude 56 pacientů s diabetem 1. typu a 504 2. typu. Velmi zajímavé jsou také sledované proměnné. Především krevní tlak, glykovaný hemoglobin, kreatinin, urea, albuminurie, proteinurie a pro každé postižené oko pak datum a způsob stanovení diagnózy diabetického makulárního edému. Budou sledovány používané vyšetřovací techniky jako je biomikroskopie, OCT, FAG. Bude hodnocen i typ DME – fokální, difuzní, kombinovaný a jeho léčba – laser, vitrektomie, event. farmakoterapie, včetně intravitreální aplikace. Sledována bude i farmakologie diabetu – současná v čase diagnózy DME.
Patofyziologie DME
Zvýšení koncentrace hexózy v krvi diabetika podporuje biochemickou teorii o hyperglykémii jako základním článku vzniku onemocnění. Škodlivý účinek hyperglykémie je charakteristický pro tkáně, v nichž není vstup glukózy závislý na inzulinu. Tyto tkáně nejsou schopny tzv. down – regulace, tedy transportu glukózy při zvýšené koncentraci krevního cukru extracelulárně. Teorie sorbitolové akumulace je založena na předpokladu, že glukóza se při hyperglykémii metabolizuje na sorbitol aldózo-reduktázovým enzymatickým mechanismem, přítomným v pericytech sítnicových kapilár a v buňkách retinálního pigmentového epitelu. Tím lze vysvětlit i časný a izolovaný zánik pericytů sítnicových kapilár. Buněčná membrána je pro sorbitol prakticky neprostupná, což vede k jeho tkáňové akumulaci. Vytvoření dostatečného osmotického gradientu, který by primárně poškodil endotelové buňky sítnicových kapilár, je ale jen málo pravděpodobné.
Nepochybný vliv na rozvoj DME mají pokročilé produkty neenzymatické glykace. Excesivní hromadění pokročilých produktů glykace přispívá také k mikrovaskulárním změnám sítnicových cév, mění jejich rigiditu a poškozuje pojivovou tkáň. In vitro byla prokázána jejich toxicita na pericyty i mitogenní působení na endotelové buňky.
Oxidační stres, který provází hyperglykémii, má za následek nerovnováhu mezi volnými radikály a buněčným antioxidačním obranným mechanismem. Vznikající pseudohypoxie může porušit buněčnou membránu denaturací proteinů, poškozením DNA a přeměnou glukózy na toxický peroxid a oxoaldehyd.
Diacylglycerol spolu s dalšími látkami tvoří komplex aktivující proteinkinázu C. Diacylglycerol je prekurzorem při syntéze prostaglandinů. Jejich enzymová aktivita je zřetelně vyšší u diabetiků. Proteinkináza C významně ovlivňuje nejenom cévní permeabilitu, ale i kontraktilitu mezangiálních buněk specifickým působením na pericyty, krevní průtok i angiogenezi. Působí také na intracelulární adhezivní molekuly a cytokiny jako transformační růstový faktor-β.
Dlouhodobá hyperglykémie vede různými mechanismy k poruše mikrocirkulace. Ta je sledována kapilární hyperpermeabilitou. Hyperglykémie zvyšuje krevní viskozitu a mění koncentraci plazmatických proteinů a stupňuje trombocytární agregaci. Změny rigidity a flexibility erytrocytů vedou k mikrotraumatizaci endotelových buněk kapilár, při které se uvolňuje von Willebrandův faktor, který má přímý agregační vliv. Mechanické poškození je zřejmě výraznější také díky zrychlenému průtoku krve kapilárami, který provází hyperglykémii. Současně ale výrazně klesá oxygenace. Negativní vliv na vznik retinopatie má i snížená schopnost přenosu kyslíku erytrocyty u diabetiků.
Důležitou roli hraje i leukostáza. Velikost leukocytů téměř dosahuje průměru kapilár. Díky své pozoruhodné schopnosti deformace jimi ale u zdravého jedince bez problému procházejí. U diabetiků se zvyšuje jejich adherence k endotelu a mohou tak uvolňovat proteolytické enzymy. Zároveň s narůstající průtokovou rezistencí se uvolňují i kyslíkové radikály. Tyto změny mají za následek kapilární okluzi. Na zvýšenou adhezivitu má zřejmě také vliv Golgiho glykosylovaný enzym. Na tyto patologické pochody je nejcitlivější jemná kapilární síť makuly a jejich důsledkem je tzv. capillary drop-out, vymizení kapilár z perifoveolární oblasti.
Ve chvíli, kdy se diabetická retinopatie vyvinula, snižuje se průtok krve ve střední periferii sítnice. Je to ochranný mechanismus, jímž se zachová normální průtok ve funkčně důležitější makulární oblasti. Teprve následkem dalšího poklesu průtoku krve sítnicí a vznikem rozsáhlejších periferních ischemických oblastí dramaticky klesá průtok krve v makule.
V patogenezi vzniku diabetické retinopatie hraje velmi významnou roli retinální pigmentový epitel, tím více u makuly. U diabetika narůstá koncentrace sorbitolu v retinálním pigmentovém epitelu a mění se osmotický gradient natriových a kaliových iontů. Tímto mechanismem se vysvětluje především porucha metabolismu buněk nervové tkáně, ganglionární i nukleární vrstvy sítnice. Larson s Paulsonem publikovali v roce 1962 práci, ve které prokázali, že hyperglykémie u diabetiků vede k poklesu nitrooční tenze. Tato relativní hypotenze může morfologicky i funkčně měnit strukturu retinálního pigmentového epitelu. Hovoří se o vchlípení plazmatické membrány na bazální ploše RPE buněk, přilehajících k choriokapilaris. Funkční alterace RPE může být jednou z příčin zhroucení zevní, ale i vnitřní hematookulární bariéry, a to zapříčiní vznik edému. Abnormální transport přes porušený RPE umožňuje některým vazoaktivním faktorům snadno pronikat do sklivce a zvyšovat proliferační potenciál oka.
Perfuzní tlak sítnicových cév je definován rozdílem mezi intravaskulárním a intraokulárním tlakem. Snížení intraokulární tenze vede k relativnímu zvýšení perfuzního tlaku, k progresi venózní dilatace a později ke zhroucení autoregulačních systémů. Relativní nárůst perfuzního tlaku také směřuje k další výraznější exsudaci, zeslabení stěn kapilár a spolupůsobí při vzniku mikroaneuryzmat, časných známek retinopatie. Tento mechanismus vysvětluje i vyšší zánik fragilnějších pericytů v sítnici, než jaký je v ostatních orgánech s výjimkou srdce, kde jsou též rozdílné perfuzní tlaky.
Kapilární dilatace je prvou klinicky významnou časnou manifestací retinopatie. Je dobře patrna při fluorescenční angiografii (FAG) dokonce i v době, kdy ještě nejsou jasné histoanatomické změny na endotelových buňkách a bazální membráně.
Pokračující proces se projevuje na kapilárách vymizením pericytů. Rozvolňuje se kontakt mezi buňkami endotelu a pericyty, které přestanou ovlivňovat průtok krve v kapilárách a tím dochází i k postupné involuci cévního řečiště. Kapilární hyperpermeabilita je další změnou, která vzniká patrně následkem změn předchozích. Jedná se o histoanatomické změny bazální membrány kapilár. Následná extravazace – prosakování séra – vede ke vzniku edému sítnice a k jejímu závažnému funkčnímu poškození.
Následujícím projevem poškození makuly u diabetika je vaskulární okluze. Ani příčina tohoto procesu není úplně vysvětlena. Předpokládá se, že podstatou jevu je aktivní hemostáza a zvýšená agregace trombocytů v krvi diabetických pacientů s retinopatií. Vliv leukocytů na kapilární okluzi byl již popsán. Tvorba mikrotrombů je usnadněna změnou fibrinolytické a antitrombotické aktivity poškozených buněk endotelu. Podílí se na tom i zrychlený průtok krve a zvýšená krevní viskozita a další hemorheologické změny (zvýšená koncentrace fibrinogenu, změny plazmatických proteinů apod.). Přímý vliv na kapilární okluzi mají zřejmě i lipoproteiny nízké denzity, inzulin, histamin a uvolněné katecholaminy v průběhu reaktivních hyperglykémií. Okluzívní procesy již přímo vedou ke vzniku ischemických oblastí v sítnici a k následné hypoxii až úplné anoxii přilehlých tkání.
V patofysiologii DME hrají u diabetiků roli i chronické systémové zánětlivé procesy kapilár. V jejich průběhu se uvolňují zánětlivé mediátory, jako je interleukin, tumor necrosis factor-α (TNF-α), intercelulární adhezivní molekuly (ICAM) a angiotentzin II aktivující neurodegenerativní změny nervových a gliálních buněk sítnice. Důsledkem těchto procesů je prohlubující se hypoxie makulární oblasti. Ta zvyšuje produkci vaskulárního endotelového růstového faktoru (VEGF), který je nejenom silným angiogenním faktorem, ale, jak jeho původní název vaskulární permeabilní faktor napovídá, zvyšuje i propustnost kapilár, což vede k akumulaci extracelulární tekutiny. Je 50 000krát účinnější než histamin.
Fyzikálně se vznik makulárního edému řídí dvojicí hydrodynamických principů Starligova a Laplaceova zákona. V průběhu kapiláry se postupně snižuje krevní tlak, ale zvyšuje se onkotický tlak tím, že se filtruje tekutina do intersticia a proteiny se v kapiláře zahušťují. Na konci kapiláry převyšuje onkotický tlak v kapiláře tlak filtrační. Zvýšený hydrostatický tlak vede k dilataci a zvýšené tortuozitě kapilár.
Na buněčné úrovni dochází k zesílení bazální membrány, poruše funkce pericytů, na které navíc negativně působí angiopoetin 2 taktéž indukovaný hyperglykémií, a rozvolnění endotelových buněčných vazeb.
Velmi významnou roli v patogenezi DME hraje sklivec. Podstatné jsou přitom jeho skladba a uspořádání, průběh časného pro diabetiky charakteristického odlučování zadní sklivcové membrány, dále přirozená likvifikace a v neposlední řadě průběh bezprostředního oslabování adhezivní síly. DME může vzniknout nebo přetrvávat v důsledku vitreomakulární trakce.
Klasifikace DME
Diabetická makulopatie tedy vzniká následkem zhroucení hematookulární bariéry a ve svém důsledku vede k akumulaci extracelulární tekutiny, edému přilehlé sítnice a k typickému ukládání lipoproteinů ve formě tvrdých exsudátů.
Klasifikace makulárního edému:
- a) fokální – je charakterizován především diskrétním sáknutím z mikroaneuryzmat a kapilár;
- b) difuzní – je charakterizován výrazným sáknutím především dilatovaných kapilár v perifoveální oblasti a z hlubokého kapilárního řečiště;
- c) cystoidní – doprovází pravidelně difuzní a je charakterizován sáknutím do preformovaných prostor hlubších především nervových vrstev sítnice;
- d) ischemická makulopatie – je charakterizována úbytkem až zánikem perifoveolární kapilární sítě a významným rozšířením foveolární avaskulární zóny (FAZ), výrazně poškozuje zrakovou ostrost;
- e) smíšený – v klinické praxi jsou pozorovány široké škály smíšených forem.
Klinicky signifikantní makulární edém (KSME)
Early Treatment Diabetic Retinopathy Study (ETDRS) používá tento jednoznačně definovaný výraz pro zdůraznění makulárního edému, který bezprostředně ohrožuje foveu a centrální zrakovou ostrost. Tento stav vyžaduje neprodlenou laserovou koagulaci.
Je definován jako:
Edém (ztluštění, prosáknutí) sítnice do vzdálenosti 500 μm od centra makuly.
Tvrdé exsudáty do vzdálenosti 500 μm od centra makuly, jestliže dosahují do oblastí prosáklé sítnice.
Prosáknutí sítnice vetší než je plocha průměru papily (PD), leží-li část tohoto prosáknutí ve vzdálenosti do průměru 1 PD od centra makuly.
Vyšetřovací metody
Kromě standardního vyšetření zrakové ostrosti do dálky i do blízka, patří biomikroskopie k základním vyšetřovacím postupům. Biomikroskopickým vyšetřením jsme s to bezpečně diagnostikovat KSME. K vyšetření můžeme použít bezkontaktní nebo kontaktní čočky.
Parametry běžněji používaných čoček uvádí tabulka 1.
Table 1. Parametry některých základních čoček užívaných při nepřímé oftalmoskopii, biomikroskopii a laserové koagulaci 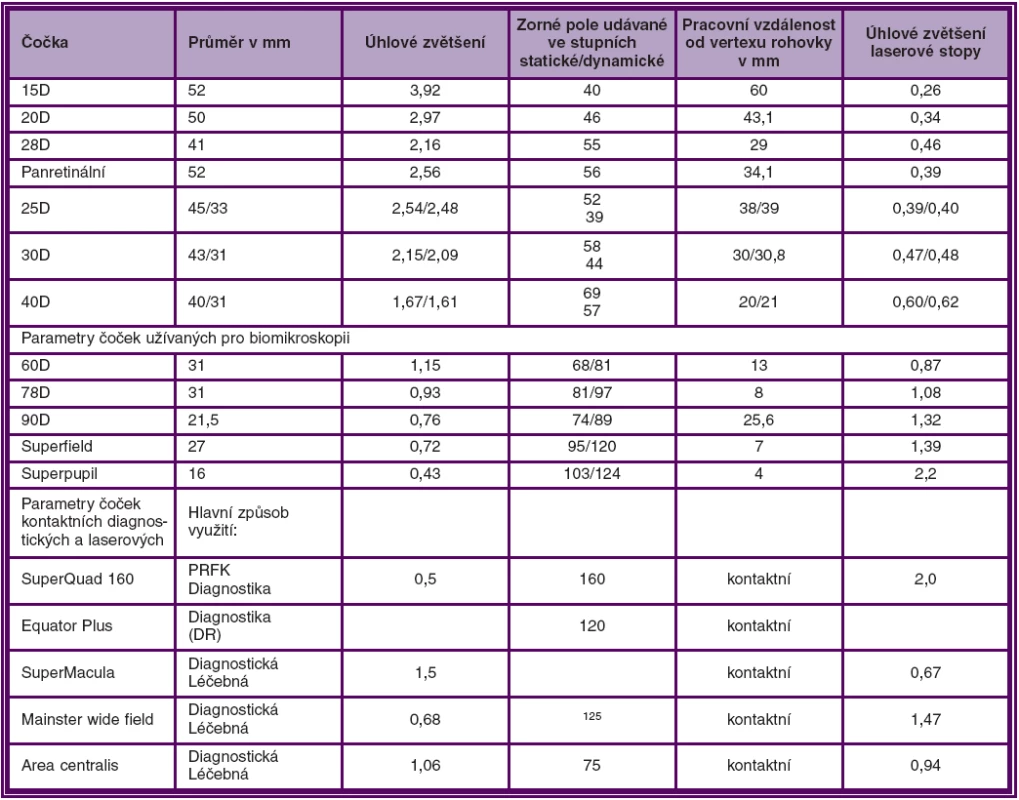
Důležité místo v diagnostice DME má i nadále fluoresceinová angiografie (FAG).
V časné arteriální fázi je možno velmi přesně identifikovat FAZ, jejíž rozšíření a nepravidelný tvar je signifikantní pro počáteční diabetickou makulopatii. Součastně jsou patrné ektaticky změněné napřímené kapiláry, které mnohdy naznačují oblasti budoucí ischémie. Později může být patrné zbarvení – staining kapilár, který signalizuje poruchu hemato-okulární bariéry, která následně přechází do edému. Difúzní, zvolna narůstající hyperfluorescence makulárního edému, mívá v pozdních fázích často typický cystoidní charakter. Identifikace sáknoucích aneuryzmat je dobrým vodítkem při fokální laserové koagulaci. Ačkoliv studie ETDRS nevyžaduje při biomikroskopicky stanovené diagnóze KSME FAG, považujme toto vyšetření za vhodné, zvláště u dubiózních případů.
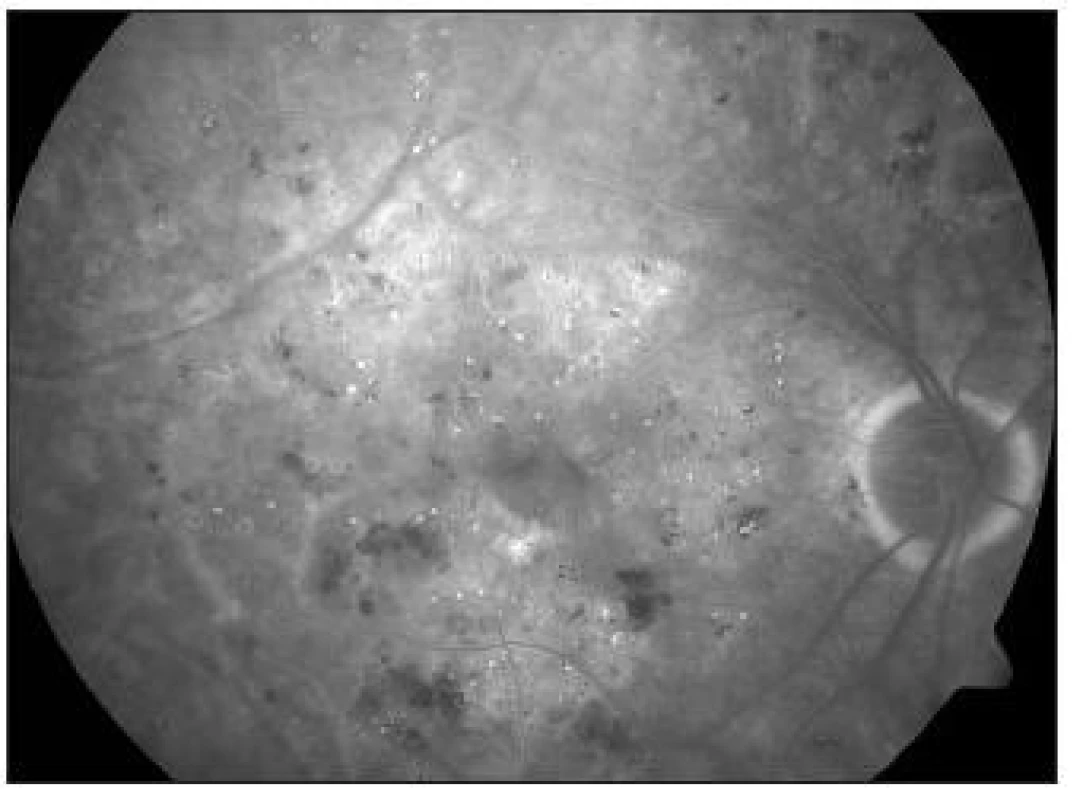
Image 1. KSME – při zahájení mřížkové fotokoagulace 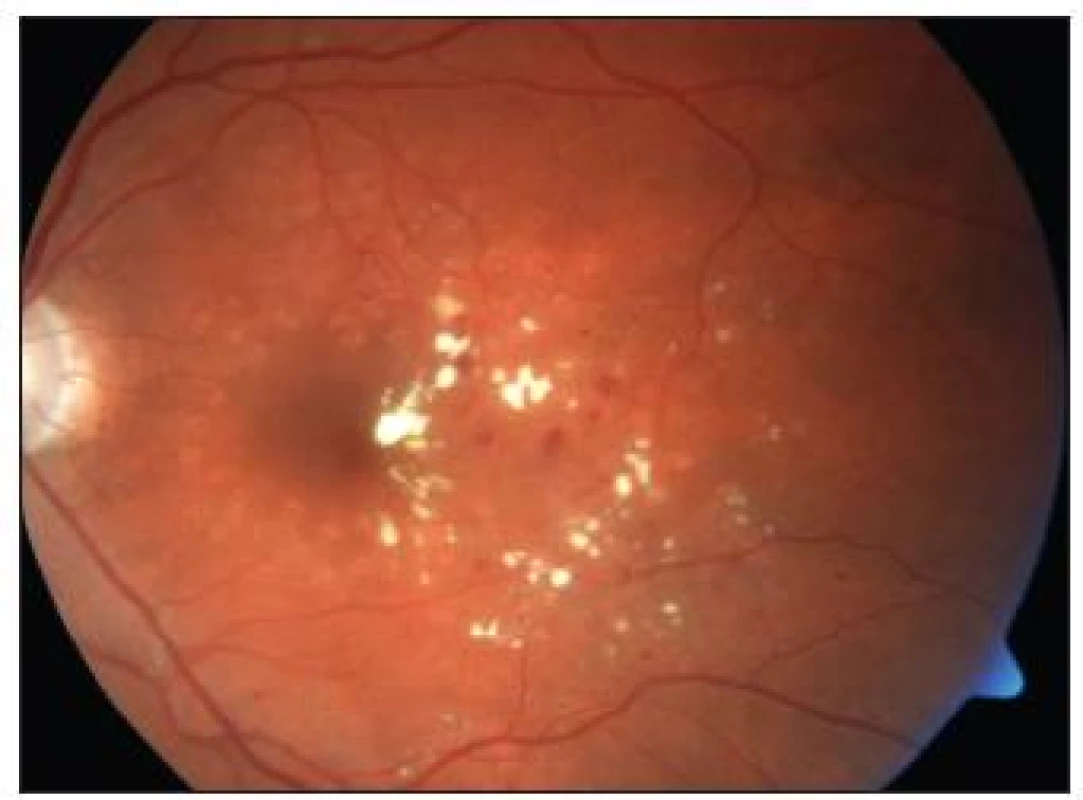
Image 3. OCT KSME – týž pacient jako na obr. 2 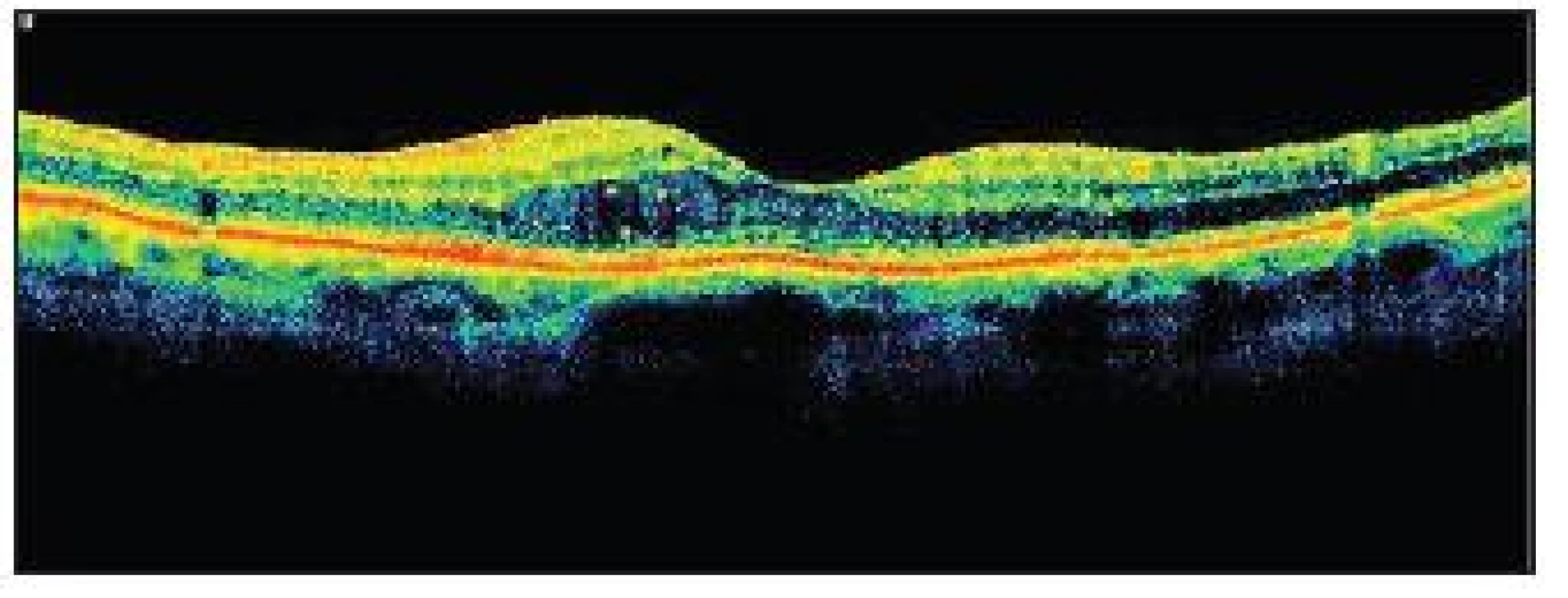
Jako další metodu v diagnostice DR využíváme optickou koherenční tomografii (OCT). Jde o neinvazivní bezkontaktní techniku, která umožňuje zobrazit mikrostruktury biologické tkáně v příčném průřezu ve vysokém rozlišení na základě měření času a intenzity odrazu světelného vlnění na rozhraní dvou opticky odlišných vrstev. U diabetiků najde využití při detekci DME, přesném zhodnocení jeho rozsahu a velikosti a jeho odpovědi na léčbu. Můžeme tak objektivně zhodnotit zlepšení či zhoršení stavu. Nepřekonatelná je tato metoda při zjišťování patologií vitreoretinálního rozhraní, kdy může pomoci odhalit příčinu neúspěchu laserové terapie (např. přítomnost vitreomakulární trakce), a tak nám pomoci rozhodnout se o indikaci k operační léčbě.
Léčba
Ze studií je známo, že u neléčeného DME v průběhu tří roků dochází k výraznému poklesu zraku až u 30 % pacientů, přičemž současná léčba toto riziko o 50 % snižuje.
Kompenzace DM je nejdůležitějším faktorem, který ovlivňuje DME. Za optimální hodnotu HbAlc, i když velmi obtížně dosažitelnou, považujeme hladinu nižší než 4,5 % (IFCC – International Federation of Clinical Chemistry), což je 6,2 % DCCT/NGSP (Diabetes Control and Complications Trial/ National Glycohemoglobin Standardization Program). Od 1. 1. 2012 je zavedena nová jednotka pro vyjadřování výsledků měření glykovaného hemoglobinu HbA1c, která se vyjadřuje v mmol/mol. Přepočtové vztahy pro jednotlivé jednotky uvádíme v tabulce 2.
Table 2. Přepočtové tabulky pro jednotky IFCC a DCCT/NGSP 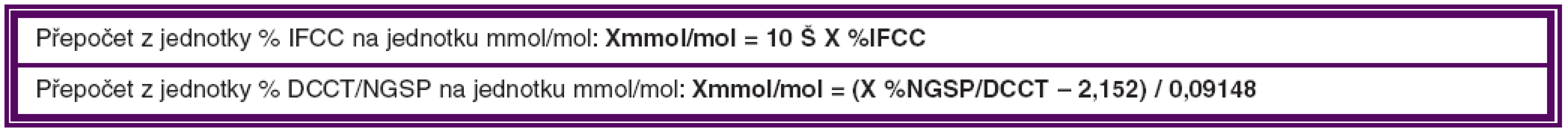
Referenční interval pro zdravou dospělou populaci (95% interval): 20 až 42 mmol/mol.
Kompenzovaný diabetes: 43 až 53 mmol/mol.
Hodnota preprandiální glykémie má být nižší než 6,0 mmol/l, hodinu po jídle pak nižší než 8,0 mmol/l. Výrazným rizikovým faktorem je i hypertenze. Tento fakt podtrhuje i skutečnost, že 30 až 50 % diabetiků evropské populace trpí hypertenzí. Hodnota krevního tlaku nižší než 130/80 mm/Hg by ale neměla negativně DME ovlivnit. Jak se ukazuje, nemá typ antihypertenziv na onemocnění zásadní vliv.
Intervenční studie FIELD (Fenofibrate Intervention and Event Lowering in Diabetes) a ACCORD (Action to Control Cardiovascular Risk in Diabetes) poukazují na příznivý vliv fenofibrátu a statinů v prevenci, ale i léčbě DME. Hypolipidemika působí agonisticky na PPAR-α-receptorech (peroxisome proliferator-activated receptors), které jsou rozhodujícím bodem regulace transkripce během metabolismu lipidů a zánětu. Po navázání fenofibrátu dojde k aktivaci PPAR-α, která má za následek tvorbu heterodimerů PPAR-α a RXR (retinoidní receptor X). Tyto heterodimery se vážou na tzv. „PPAR-α response element“ a následná stimulace via gene vede ke zlepšení lipidových parametrů, zejména ke zvýšení koncentrace HDL-cholesterolu a snížení množství triglyceridových partikulí. To podporuje přeměnu malých denzích LDL-částic na větší, lehčí s menším aterogenním potenciálem. Studie in vitro ukázaly, že fenofibrát také ovlivňuje přežívání endotelových buněk sítnicových kapilár a předchází jejich apoptóze novým mechanismem, který souvisí s aktivitou AMPK (adenine monophosphate-activated protein kinase). Tyto procesy snižují také významně zánětlivou aktivitu kapilár. V dalších studiích byla pozorována inhibice vaskulárního růstového faktoru (VEGF), který je klíčový nejen v procesu tvorby nových cév, ale i v ovlivnění buněčné migrace.
Doporučená je hodnota cholesterolu nižší než 4,5 mmol/l, triacylglycerolů 1,7 mmol/l, LDL 2,5 mmol/l a HDL vyšší než 1,0 u mužů a 1,2 u žen.
Za rizikové jsou považovány i hematologické poruchy, hemodynamické a hemorheologické změny, např. zvýšená spontánní agregace destiček, leukocytóza a zvýšená viskozita krve a hemokoagulační poruchy.
Otázka genetických faktorů je dlouhodobě zkoumána a názory jsou značně kontroverzní.
Existuje úzký vztah mezi DME a diabetickou nefropatií u diabetiků 1. typu. Mikroalbuminurii považujeme za známku rizika vzniku i progrese DME a proliferativní DR. Podobný vztah je i u diabetiků 2. typu. Hovoříme o retino-renálním syndromu.
Laserová terapie diabetické makulopatie
Laserová léčba je v podstatě empirickou, destruktivní metodou a její léčebné principy, ale i účinky jsou stále ve sférách předpokladů i dohadů. Principem působení laserové terapie je absorpce intenzivního světelného záření pigmentovými buňkami a přeměna světelné energie v tepelnou. Teplo pak koaguluje cílové buňky a okolní tkáň.
Laserová léčba je indikována i u difuzního neischemického edému makuly. Mezi dvě základní možnosti ošetření makuly patří fokální a mřížková koagulace. Při fokálním laserovém ošetření makuly je lépe postupovat na podkladě angiogramu získaného při vyšetření FAG. Světlo laseru aplikujeme cíleně do oblasti edému a prosakujících mikroaneuryzmat ve vzdálenosti 500 až 3000 μm od centra makuly. Cílem je koagulační stopa mírné až střední intenzity, což koreluje s šedavým respektive žlutavým zbarvením bodu. Při tomto typu ošetření používáme obvykle velikost koagulační stopy 50–100 μm, dobu pulsu 0,1 s a počáteční intenzitu záření cca 80 mW, kterou postupně upravujeme podle odezvy cílové tkáně. Kontrolní vyšetření indikujeme za 1 až 3 měsíce, při případném přetrvávání edému přistupuje k doplnění laserkoagulace. U cca 1/5 pacientů DME přetrvává i po opakovaných ošetřeních, v těchto případech se již doporučuje v koagulaci nepokračovat, neboť hrozí riziko vytvoření konfluentních laserových stop, které mohou působit subjektivně nepříjemné perifoveolární skotomy. Mřížkovou fokální koagulaci volíme, pokud se u pacienta jedná o difúzní otok makuly, jehož původ je v prosakování retinálních cév. V tomto případě ošetřujeme celou oblast prosakování mezi 500–3000 μm od centra makuly. Volíme velikost stopy 50 μm, čas pulzu 0,05–0,1s, intenzitu 100mW a více a mezi stopami zachováváme rozestup 1-1,5 průměru stopy. I zde nám pomůže angiogram, který přesně zobrazí oblast centrální avaskulární zóny, jíž se musíme při laserování vyhnout. Pokud je v plánu následná panretinální fotokoagulace, měla by tato být provedena 2–3 týdny po ošetření makuly, až budou opět obnoveny oběhové poměry v centrální oblasti.
Nové pohledy a doporučení k léčbě DME přinesla nezávislá americká studie Diabetic Retinopathy Clinical Research Network (DRCR.net). Především ve srovnání s klasickou studií ETDRS byly výsledky laserové terapie lepší, a to nejen co se týče stabilizace DME, ale i zlepšení nejlépe korigované zrakové ostrosti (NKZO). Důvodem jistě je, že za 25 let od zveřejnění prvých doporučení ETDRS studie se technika, ale i technologie laserové koagulace výrazně zlepšila.
Intravitreální léčba
Kortikosteroidy inhibují expresi VEGF a mají zároveň protizánětlivý účinek. Obojí snižuje vaskulární hyperpermeabilitu a následně zmenšuje makulární edém. Kortikosteroidy se podávají buď přímo do sklivce ve formě roztoku (triamcinolon), nebo ve formě implantátu, který se postupně odbourává s pomalým uvolňováním účinné látky dexamethasonu. Další možností je přišití trvalého intravitreálního implantátu ke skléře, kdy se postupně uvolňuje účinná látka fluocinolon acetonid do sklivce. Biodegradabilní implantát postupně uvolňující dexamethasone je již schválen pro léčbu otoků při žilních sítnicových okluzích (Ozurdex, Allergan, Inc.), v současné době probíhá tříletá studie, která má vyhodnotit jeho účinnost a bezpečnost u DME. Výsledky tříleté multicentrické randomizované kontrolované klinické studie s trvalým implantátem pomalu uvolňujícím fluocinolon acetonid prokázaly jeho vysokou účinnost. U 31 % pacientů s DME bylo zjištěno statisticky významné zlepšení NKZO o 3 a více řádků. Zároveň však byl zjištěn horší bezpečnostní profil preparátu, protože v průběhu sledování byla u 91 % léčených pacientů zjištěna katarakta s nutností operace a u více než 60 % pacientů byl zachycen výskyt nitrooční tenze vyšší než 30 torrů. Třetina těchto pacientů musela podstoupit chirurgické řešení (filtrující operaci), u třech pacientů bylo nutné implantát explantovat. Účinnost a bezpečnost triamcinolonu v léčbě DME zjišťovala řada studií. V rámci studie DRCR.net byla zjišťována účinnost triamcinolon acetonidu (Trivaris, Allergan, Inc.) v dávce 1 mg a 4 mg oproti standardní léčbě fotokoagulací sítnice laserem. Do studie bylo zařazeno 840 očí 693 pacientů, kteří byli randomizováni do tří skupin.
Image 4. Stav <sup>1</sup>/<sub>2</sub> roku po provedené fotokoagulaci – týž pacient jako na obr. 1 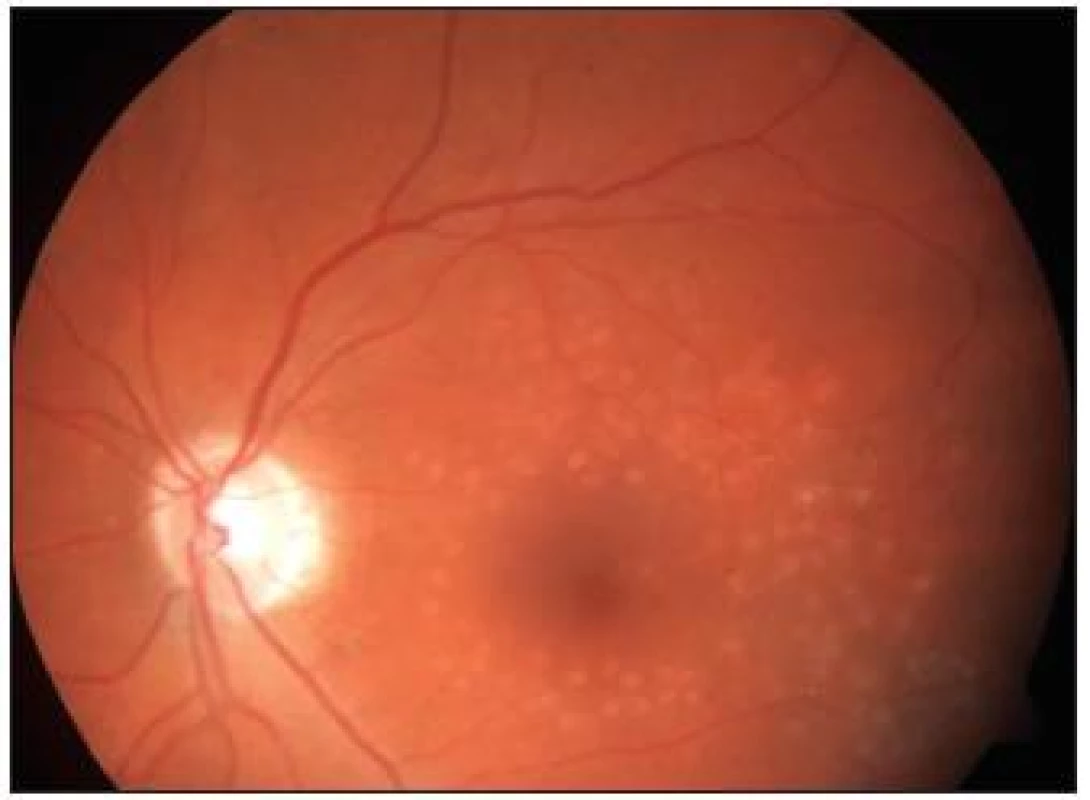
Studie prokázala lepší efekt ošetření DME laserem nežli intravitreální aplikací triamcinolonu při jeho menších vedlejších účincích. V extenzi studie DRCR.net bylo cílem porovnat účinnost fotokoagulace sítnice proti kombinované léčbě laserem s intravitreální aplikací triamcinolonu. V druhých dvou ramenech byla porovnávána účinnost intravitreální aplikace ranibizumabu (Lucentis, Genentech Inc., Novartis Pharma AG) v kombinaci s časnou a odloženou fotokoagulací sítnice laserem.
V případě skupiny pacientů léčených triamcinolonem v kombinaci s fotokoagulací sítnice byla výsledná NKZO stejná jako u skupiny léčené pouze laserem. Při vyhodnocení podskupiny pacientů po operaci katarakty s implantovanou čočkou, byla výsledná NKZO významně lepší a byla srovnatelná s kombinovanou léčbou s ranibizumabem. Důvodem horšího výsledku NKZO byl kataraktogenní efekt kortikoidu. Nežádoucím účinkem byla také elevace nitrooční tenze. Při kombinované léčbě s ranibizumabem byla ve srovnání s ošetřením sítnice laserem významně zlepšena NKZO i centrální retinální tloušťka (CRT) při dobrém bezpečnostním profilu léku.
Mezi blokátory VEGF-A používanými v léčbě DME patří bevacizumab (Avastin, Genentech, Inc., Roche Ltd.) a ranibizumab. Řada studií prokázala účinnost i bezpečnost bevacizumabu v léčbě DME, nicméně jeho užití je stále pouze v režimu off-label. Lékem schváleným pro léčbu DME je ranibizumab. Základními klinickými studiemi, které prokázaly účinnost ranibizumabu u DME, byla studie RESOLVE a RESTORE. Hlavním cílem studie RESOLVE bylo zjistit, zda je ranibizumab účinný u pacientů s DME. Pacienti byli randomizováni do tří větví. V první větvi bylo placebo, v ostatních dvou větvích byl ranibizumab ve dvou různých dávkách 0,3 a 0,5 mg. Ranibizumab byl podáván první tři měsíce po měsíci a potom každý měsíc při splnění příslušných kritérií. Průměrně bylo nutno podat 10 injekcí ranibizumabu za rok. V obou skupinách s ranibizumabem bylo zjištěno významné zlepšení NKZO ve srovnání s placebem. Ve skupině s 0,5 mg ranibizumabu byl zisk + 8,8 písmen, ve skupině s 0,3 mg ranibizumabu + 11,8 písmen. Také pokles CRT byl statisticky významný ve skupině pacientů léčených ranibizumabem. Počet ani charakteristika závažných nežádoucích účinků nebyla odlišná od těch, které se vyskytují při standardní léčbě ranibizumabem u vlhké formy věkem podmíněné makulární degenerace a také procento systémových nežádoucích účinků nebylo odlišné ve skupinách léčených ranibizumabem oproti skupině léčené monoterapií laserem.
Ve studii RESTORE bylo zjišťováno, zda je ranibizumab účinný v monoterapii nebo v kombinaci s laserem ve srovnání s monoterapií laserem. Design studie byl podobný jako u studie RESOLVE, první tři měsíce byla injekce ranibizumabu po měsíci a další injekce byla při splnění příslušných kritérií. Indikace laserového ošetření závisela na rozhodnutí jednotlivých zkoušejících. Výsledkem studie bylo statisticky významné zlepšení NKZO u pacientů v obou větvích s ranibizumabem ve srovnání se standardním ošetřením sítnice laserem. Rozdíl v NKZO mezi monoterapií ranibizumabem a kombinací ranibizumabu s laserem byl minimální. Při léčbě ranibizumabem, ať už v monoterapii nebo v kombinaci s laserem, bylo dosaženo zlepšení NKZO o 3 a více řádků ETDRS optotypů ve 26 %. Pokles CRT byl podobný v obou skupinách s ranibizumabem a byl významně vyšší než u pacientů léčených monoterapií laserem. Průměrný počet aplikací ranibizumabu, ať už v monoterapii nebo při kombinaci laserem, byl 7 injekcí za rok. V celé studii nebyla hlášena žádná endoftalmitida. Na základě výsledků těchto studií vznikla následující doporučení. Ranibizumab je podáván jednou měsíčně do doby, kdy pacientova zraková ostrost je stabilní po tři po sobě jdoucí měsíční vyhodnocení. Jestliže nenastane zlepšení zrakové ostrosti po podání prvních tří injekcí, nedoporučuje se v léčbě pokračovat. Po dosažení stabilizace NKZO je doporučeno její sledování jednou měsíčně. Léčba je znovu zahájena, pokud je při sledování pacienta zjištěno zhoršení zrakové ostrosti vlivem DME.
Závěr
Vedle prevence a těsné kompenzace rizikových faktorů zůstává zlatým standardem léčby DME i nadále fotokoagulace sítnice laserem. Tato léčba umožní především stabilizovat klinický nález. Podle ETDRS studie je zlepšení o více než o tři řádky optotypů možné zhruba u 3 % pacientů. Podle Studie DRCR.net dokonce o 18 % a u laserové větve studie RESTORE o 8 %. V případě difuzního DME, především pokud je spojený s vitreomakulární trakcí, se jeví jako dobrá léčebná metoda PPV, protože zrušením trakce dojde ke zmenšení makulárního edému a ke zlepšení zrakové ostrosti. Z nových léčebných možností jsou používány kortikosteroidy a blokátory VEGF-A. Účinnost triamcinolonu je ovlivněna jeho horším bezpečnostním profilem, jak dokázala studie DRCR net. Fluocinolon acetonid se používá ve formě trvalého implantátu aplikovaného do sklivce. Preparát je účinný, nicméně má horší bezpečnostní profil, více než 90 % pacientů během tří let potřebovalo operaci katarakty, více než 60 % pacientů mělo nitrooční tenzi větší než 30 mmHg alespoň jednou během tříletého sledování a více než 30 % těchto pacientů muselo být řešeno chirurgicky, většinou filtrující operací. Ranibizumab vede ke statisticky významnému zlepšení NKZO u DME. Lék má dobrý bezpečnostní profil, nevede ke vzniku katarakty a nezvyšuje nitrooční tenzi. Na druhé straně jsou výsledky posuzovány zatím jen pro diabetiky v krátkém časovém období. V kombinaci s laserovou fotokoagulací, která sama o sobě dokáže dlouhodobě stabilizovat edém, se ale jeví jako velmi slibný krok v léčbě DME.
Do redakce doručeno dne 2. 5. 2012
Do tisku přijato dne 20. 6. 2012
Doc. MUDr. Tomáš Sosna, CSc.
Oční oddělení TN
Oční ambulance CD IKEM
Vídeňská 800
140 00 Praha 4
e-mail: tomas.sosna@ftn.cz
Sources
1. Aiello, L., Gardner, T., King, G. et al.: Diabetic Retinopathy. Diabetes Care 1998; 21 : 143–156.
2. Arevalo, F.: Retina Angiography and Optical Coherence Tomography. Springer Science USA 2009; 471.
3. Aveleira, C., Lin, C., Abcouwer, S., Ambrosio, A., Antonetti, D.: TNF-alpha signals through PKCzeta/NF-kappaB to alter the tight junction complex and increase retinal endothelial cell permeability. Diabetes, 2010; 59 : 2872–82.
4. Bandello, F.: Seminars in Ophthalmology, 2001, vol. 16, No1. pp. 2–41.
5. Brenick, G.: Diabetic maculopathy: a critical review highlighting diffuse macular edema. Ophthalmology, 1983; 1301–1317.
6. Bresnick, G.: Diabetic macular edema: e review. Ophthalmology, 1986; 93 : 989–997.
7. Dodson, P.: Diabetic Retinopathy. Oxford University Press 2008; 17.2
8. Dodson, P.: Managing Diabetic retinopathy. nowPharma LTD. 2011; 84.
9. Duh, E.: Diabetic Retinopathy. Human press 2008; 494.
10. Diabetic retinopathy Clinical Research Network. A randomized Trial comparing intravitreal triamcinolone acetionicde and focal/grid photocoagulation for diabetic maculoar edema. Ophthalmology, 2008; 115 : 1447–1459.
11. The Diabetic Retinopathy Clinical Research Network. Randomized trial evaluating ranibizumab plus prompt or deferred laser or triamcinolone plus prompt laser for diabetic macular edema. Ophthalmology, 2010; 117(6):1064–1077.
12. Diabetes Control and Complications Trial Research Group (DCCT). The effect of intensive treatment of diabetes on the development and progression of long term complications in insulin-dependent diabetes mellitus. N Engl J Med, 1993; 329 : 977–86.
13. Early Treatment Diabetic Retinopathy Study research group. Photocoagulation for diabetic macular edema. Early Treatment Diabetic Retinopathy Study Report No.1 Arch Ophthalmol.1985; 103 : 1796–1806.
14. Easty, L., Sparrow, J.: Oxford textbook of ophthalmology. New York: Oxford University Press 1999; 1308.
15. Gastinger, M, Kunselman, A, Conboy, E. et al.: Dendrite remodeling and other abnormalities in the retinal ganglion cells of Ins2 Akita diabetic mice. Incest Ophthalmol Vis Sci, 2008; 49 : 2635–42.
16. Gowda, K, Zinnanti, W, LaNoue, K.: The influence of diabetes on glutamate metabolism in retinas. J Neurochem, 2011; 117 : 309–20.
17. Hanas, R., John, G.: On behalf of the International HBA1c Consensus Committee: 2010 Consensus Statement on the Worldwide Standardization of the Hemoglobin A1C: Ann Clin Biochem, July 1, 2010; 47(4): 290–291.
18. Hotamisligil, S.: Inflammation and metabolic disorders. Nature, 2006; 444 : 860–7.
19. Chew E., Klein M., Ferris F., et al.: Association of elevated serum lipid levels with retinal hard exudates in diabetic retinopathy. Arch Ophthalmol, 1996; 114 : 1079–84.
20. Joussen, A., Poulaki, V., Mitsiades, N., et al.: Nonsteroidal anti-inflammatory drugs present early diabetic retinopathy via TNF-alpha suppression. FASEB J 2002; 16 : 438–40.
21. Joussen, A, Poulaki, V, Qin, W, et al.: Retinal vascular endothelial growth factor induces intercellular adhesion molecule-1 and endothelial nitric oxide synthese expression and initiates early diabetic retinal leukocyte adhesion in vivo. Am J Pathol, 2002; 160 : 501–9.
22. Keech, A.C., Mitchell, P., Summanen, P., et al.: Effect of fenofibrate on the need for laser treatment for diabetic retinopathy (FIELD study): a randomized controlled trial. Lancet 2007; 370 : 1687–97.
23. Klein, R., Klein, B., Moss, S., Mets, D.: Is blood pressure a predictor of the incidence or progression of diabetic retinopathy? Arch Int Med, 1989; 149 : 2427 – 2432.
24. Klein, R., Klein, B., Moss, E., Devis, M., De Mets, L.: Glycosilated haemoglobin predicts the incidence and progression diabetic retinopathy. JAMA 1988; 260 : 2864–71.
25. Kuchyňka, P. a kol.: Oční lékařství. Praha: Grada 2007; 768.
26. Larson, H, Polsen, J.: Intraocular tension and blood sugar fluctuation in diabetes. Acta Ophthalmol, 1962; 40 : 580–9.
27. Massin, P., Bandello, F., Garweg, J., et al.: Safety and efficacy of ranibizumab in diabetic macular edema (RESOLVE study): a 12-month, randomized, controlled, doublemasked, multicenter phase II study. Diabetes Care, 2010.
28. Mitchell, P., Bandello, F., Schmidt-Erfurth, U. et al.: Ranibizumab monotherapy or combined with laser versus laser monotherapy for diabetic macula edema. Ophthalmology, 2011; 118 : 615–625.
29. Murphy, R.: Management of diabetic retinopathy. Am Fam Physician, 1995; 51, 4 : 785–796.
30. Pelikánová, T., Bartoš, V.: Praktická diabetologie 5. vyd. Maxdorf 2011; 738.
31. Pickup, J, Williams, G.: Textbook of diabetes, 2nd ed. volume two. Oxford: Blackwell Science Ltd. 1997; n.p.
32. Ryan, J.: Retina. 3rd ed. volume two. St. Louise : Mosby, Inc. 2001; 1847.
33. Scanlon, P., Aldington, S., Wilkinson, Ch. et al.: Practical Manual of Diabetic Retinopathy Management. Wiley-Blackwel 2009; 232.
34. The ACCORD Study Group. Action to Control Cardiovascular Risk in Diabetes (ACCORD) Trial: design and methods. Am J Cardiol, 2007; 99: Suppl: 21-33.
35. The Diabetes Control and Complications Trial Research Group. The effect of intensive treatment of diabetes on the development and progression of long-term complications in insulin-dependent diabetes mellitus. N Engl J Med, 1993; 329 : 977–86.
36. Škrha, J. et al.: Diabetologie. Praha: Galén 2009; 417.
37. UK Prospective Diabetes Study (UKDPS) Group. Tight blood pressure control and risk of macrovascular and microvascular complications in type 2 diabetes: UKDPS 38. B M J 1998; 317 : 703–13.
38. VanGuilder, H., Brucklacher, A., Patel, K. et al.: Diabetes downregulates presynaptic proteins and reduces basal synapsin1 phosphorylation in rat retina. Eur J Neurosci 2008; 28 : 1–11.
39. Wang, J., Xu, X., Elliott, M., Zhu, M., LeYZ.: Müller cell-derived VEGF is Essentials for diabetes-induced retinal inflammation and vascular leakage. Diabetes 2010; 59 : 2297-305.
40. Williams, R, Herman, W, Kinmonth, AL, Wareham, NJ.: The Evidence Base for Diabetes Care. John Wiley & sons, LTD Englad, 2002. pp. 784.
Labels
Ophthalmology
Article was published inCzech and Slovak Ophthalmology

2012 Issue 3-
All articles in this issue
- Současný pohled na diabetický makulární edém
- Léčba vlhké formy věkem podmíněné makulární degenerace fotodynamickou terapií s verteporfinem – dlouhodobé výsledky
- Psychometrická validácia verzie „Dotazníka zrakových funkcií-25“ v podmienkach Slovenska
- Komplikace u nepenetrujících hlubokých sklerektomií
- Srovnání měření tloušťky a zakřivení rohovky pomocí Scheimpflugovy kamery, laserové interferometrie, automatické keratometrie a ultrazvukové pachymetrie
- Stav chirurgie katarakty na Slovensku v rokoch 2008–2010
- Aplázia zrakového nervu
- Czech and Slovak Ophthalmology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Současný pohled na diabetický makulární edém
- Srovnání měření tloušťky a zakřivení rohovky pomocí Scheimpflugovy kamery, laserové interferometrie, automatické keratometrie a ultrazvukové pachymetrie
- Psychometrická validácia verzie „Dotazníka zrakových funkcií-25“ v podmienkach Slovenska
- Komplikace u nepenetrujících hlubokých sklerektomií
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career