-
Medical journals
- Career
Imunohistochemická detekce exprese genu p53 a p21 v buňkách maligního melanomu uvey
Authors: E. Tokošová 1; M. Hermanová 2; R. Uhmannová 3; J. Šmardová 4; Z. Hlinomazová 3
Authors‘ workplace: Oční oddělení Nemocnice Kyjov, primář MUDr. Jindřich Plesník 1; Patologicko-anatomický ústav FN u sv. Anny, Brno, přednosta doc. MUDr. Markéta Hermanová, Ph. D. 2; Oční klinika LF MU a FN Brno Bohunice, přednosta prof. MUDr. Eva Vlková, CSc. 3; Ústav patologie LF MU a FN Brno Bohunice, přednosta prof. MUDr. Jiří Mačák, CSc. 4
Published in: Čes. a slov. Oftal., 64, 2008, No. 4, p. 153-156
Overview
Cíl:
Imunohistochemicky vyšetřit expresi tumor supresorového genu p53 a genu p21 v buňkách maligního melanomu uvey z formol-parafínového materiálu pacientů, kteří byli v letech 2000 až 2006 na Oční klinice FN Brno chirurgicky léčeni pro maligní melanom uvey a výsledky imunohistochemické detekce korelovat s klinickými znaky tumoru u jednotlivých pacientů.Metodika:
Bylo vyšetřeno 29 maligních melanomů uvey s použitím monoklonální protilátky DO-1 firmy Novocastra, metodickým postupem s využitím demaskování epitopu v citrátovém pufru (pH 6,0 při 120 °C), použité ředění 1 : 2000. Dále byla ve všech 29 vzorcích maligního melanomu uvey imunohistochemicky vyšetřena exprese genu p21 monoklonální protilátkou SX 118, firmy DAKO. U imunohistochemicky prokazované exprese genu p53 a p21 jsme hodnotili procento pozitivních jader a intenzitu barvení.Výsledky:
Hodnotitelné výsledky jsme získali u 28 vzorků maligních melanomů, 1 vzorek byl nehodnotitelný pro extrémně vysokou přítomnost melaninového pigmentu. U 3 pacientů byla zjištěna slabá jaderná exprese p53 v 5–15 % buněk, u 1 pacienta byla zjištěna v 5–15 % buněk velmi slabá intenzita barvení. U 3 pacientů byla zjištěna v 5-15 % slabá jaderná exprese p21, u 1 velmi slabá v 5–15 % buněk (ve všech 4 případech se jednalo o pacienty s prokázanou expresí p53). U 1 ze 4 pacientů s expresí p53 se jednalo o maligní melanom iris, u 1 o maligní melanom corpus ciliare a u 2 o maligní melanom choroidey.Závěr:
Exprese genu p53 a exprese genu p21 byla zaznamenána u 4 z 28 pacientů (14,3 %). Z výše uvedených výsledků lze usuzovat, že stabilizující mutace p53 jsou u maligního melanomu uvey vzácné. Prokázaná exprese p53 u 4 pacientů je pravděpodobně výsledkem exprese standardního (funkčního, wild-type) p53 zejména vzhledem ke schopnosti indukovat expresi genu p21. V našem souboru nebyla prokázaná výrazná jaderná akumulace p53, která by naznačovala přítomnost mutace genu p53.Klíčová slova:
maligní melanom uvey, imunohistochemická detekce, nádorový supresor p53, p21Úvod
Maligní melanom uvey je nejčastější primární nitrooční nádor u dospělých. Jeho incidence se pohybuje mezi 0,1–2,3 případů na 100 000 obyvatel (1). Podle lokalizace melanocytů, ze kterých tumor vychází, dělíme maligní melanom uvey na maligní melanom iris, maligní melanom corpus ciliare a maligní melanom choroidey. Nádorové buňky maligního melanomu uvey produkují v různé míře pigmentové barvivo melanin (obr. 1).
Image 1. Maligní melanom uvey v přehledném barvení hematoxylinem- eosinem 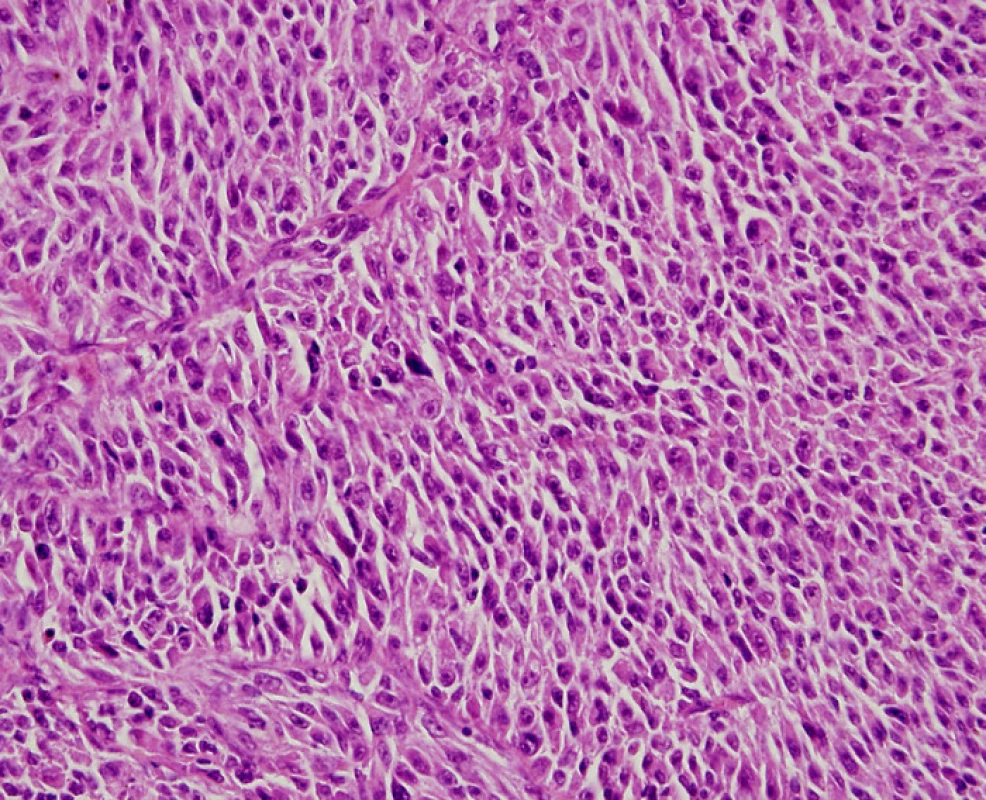
Rizikovými faktory vzniku maligního melanomu uvey jsou genetická predispozice (syndrom dysplastických névů, okulodermová melanocytóza, Recklinghausenova neurofibromatóza), rostoucí věk, bílá rasa, faktory zevního prostředí (expozice UV záření, kouření, působení virů a některých chemických látek) (1, 3, 12).
Současná představa o nádorové transformaci buňky předpokládá vícestupňový proces s postupnou kumulací genetických změn. Ty se odehrávají v určitých skupinách genů jako jsou protoonkogeny, tumor supresorové geny a geny udržující stabilitu genomu (16).
Protoonkogeny. Protoonkogeny tvoří normální vybavení genomu: kódují proteiny, které řídí proliferaci, diferenciaci a přežívání buněk. Dojde-li k mutaci protoonkogenů, mění se na onkogeny a jejich aktivita získává tumorigenní charakter. K přeměně protoonkogenu na onkogen stačí alterace pouze jedné alely genu. Protoonkogeny dělíme do 4 základních skupin: růstové faktory, receptory růstových faktorů a hormonů, intracelulární přenašeče signálu a jaderné transkripční faktory (16).
Tumor supresorové geny. Kromě mutací v protoonkogenech mohou vznikat mutační změny v anti-onkogenech, které jsou nazývány také tumor supresorové geny nebo recesivní onkogeny. Na rozdíl od onkogenů mají jimi kódované proteiny antiproliferační účinek, podporují diferenciaci a apoptózu. V každé buňce je asi 40 tumor supresorových genů. Aby se staly tumorigenními, musí být mutovány obě jejich alely, proto se také nazývají recesivní onkogeny. Mezi nejznámější tumor supresorové geny patří retinoblastomový gen Rb-1, uplatňující se v onkogenezi retinoblastomu a tumor supresorový gen p53 (16).
Nádorový supresor p53 je někdy nazýván strážce genomu, protože jeho normální funkcí je hlídat genom. V případě, že je DNA poškozená, produkt genu p53 zablokuje buněčný cyklus do doby, něž je poškozená DNA reparována. V případě, že reparační proces selže, p53 indukuje apoptózu, tedy programovanou buněčnou smrt. Mutace genu p53 může znamenat úplnou ztrátu reparačních schopností, což může stimulovat nádorovou transformaci buňky. U velkého množství různých nádorů (leukémie, karcinom tlustého střeva, karcinom prsu) je právě přítomnost mutace tumor supresorového genu p53 významným prognostickým faktorem, hrajícím důležitou roli při volbě terapeutického postupu. Protein p53 indukuje expresi p21/CIP, který je mohutným inhibitorem kináz regulujích buněčný cyklus. Produkt mutovaného genu p53 není schopný indukovat transkripci genu p21, proto by v případě mutace genu p53 neměla být imunohistochemicky detekována exprese genu p21.
Vrozená mutace genu p53 se vyskytuje u pacientů s Li-Fraumeniho syndromem, u kterých je popisován hromadný výskyt různých tumorů (sarkomy, karcinom prsu, nádory mozku, leukémie a adrenokortikální karcinom) (10).
Geny udržující stabilitu genomu. Někdy jsou označovány jako mutatorní geny. Produkty těchto genů se uplatňují v opravných mechanismech poškozené DNA. Mutatorní geny ale na rozdíl od onkogenů a tumor supresorových genů neposkytují buňce schopnost nekontrolované proliferace samy o sobě. Jejich mutace vede ke zvýšené frekvenci mutací onkogenů a tumor supresorových genů (16).
Soubor
Soubor tvořilo 29 vzorků maligního melanomu uvey. Jednalo se o formol-parafinové bločky z archivu Ústavu patologie FN Brno, které pocházely od pacientů, kteří byli na Oční klinice FN Brně Bohunicích v letech 2002 až 2006 chirurgicky léčeni pro maligní melanom uvey.
Metodika
29 vzorků maligního melanomu uvey bylo vyšetřeno za použití monoklonální protilátky DO-1 firmy Novocastra, metodickým postupem s využitím demaskování epitopu v citrátovém pufru (pH 6,0 při 120 °C). Použité ředění primární protilátky bylo 1 : 2000 (cíleně jsme zvolili takové ředění primární protilátky, při němž při použití vysoce senzitivního detekčního systému Vectastain Elite Kit, Vector Laboratories již nelze detekovat expresi p53 v normálně proliferující tkáni. Jako referenční normálně proliferující tkáň byl použit exocervikální epitel děložního čípku. Při použití tohoto metodického postupu lze předpokládat, že detekujeme pouze abnormální expresi p53). Dále byla ve všech 29 vzorcích maligního melanomu uvey imunohistochemicky vyšetřena exprese genu p21 monoklonální protilátkou SX 118, firmy DAKO.
Pro hodnocení imunohistochemicky prokazované exprese p53 a p21 jsme zvolili škálu:
Pro hodnocení intenzity barvení jsme zvolili škálu:
Výsledky
Soubor tvořilo 14 mužů a 15 žen průměrného věku 61,6 ± 12 let. U 4 pacientů se jednalo o maligní melanom iris, u 6 o maligní melanom corpus ciliare a u 19 pacientů o maligní melanom choroidey. U všech pacientů byla histologickým vyšetřením potvrzena diagnóza maligního melanomu uvey: dle Callenderovy klasifikace se u 4 pacientů jednalo o maligní melanom vřetenobuněčného typu A, u 20 pacientů o maligní melanom vřetenobuněčného typu B a u 5 pacientů o maligní melanom epiteloidního typu. Vzdálené metastázy se u pacientů v průměrné sledovací době 3 roky (1–7 let) vyskytly u 4 pacientů, z toho u 2 pacientů se jednalo primárně o maligní melanom corpus ciliare a u 2 pacientů se jednalo primárně o maligní melanom choroidey.
V laboratorní části jsme hodnotitelné výsledky získali u 28 vzorků maligních melanomů, 1 vzorek byl nehodnotitelný pro extrémně vysokou přítomnost melaninového pigmentu.
U 3 pacientů byla zjištěna slabá jaderná exprese p53 v 5–15 % buněk (obr. 2), u 1 pacienta byla zjištěna v 5–15 % buněk intenzita imunostainingu velmi slabá.
Image 2. Imunohistochemický průkaz exprese p53 v buňkách maligního melanomu uvey, prokázána mírná akumulace p53 v jádrech některých buněk (původní zvětšení 800krát) 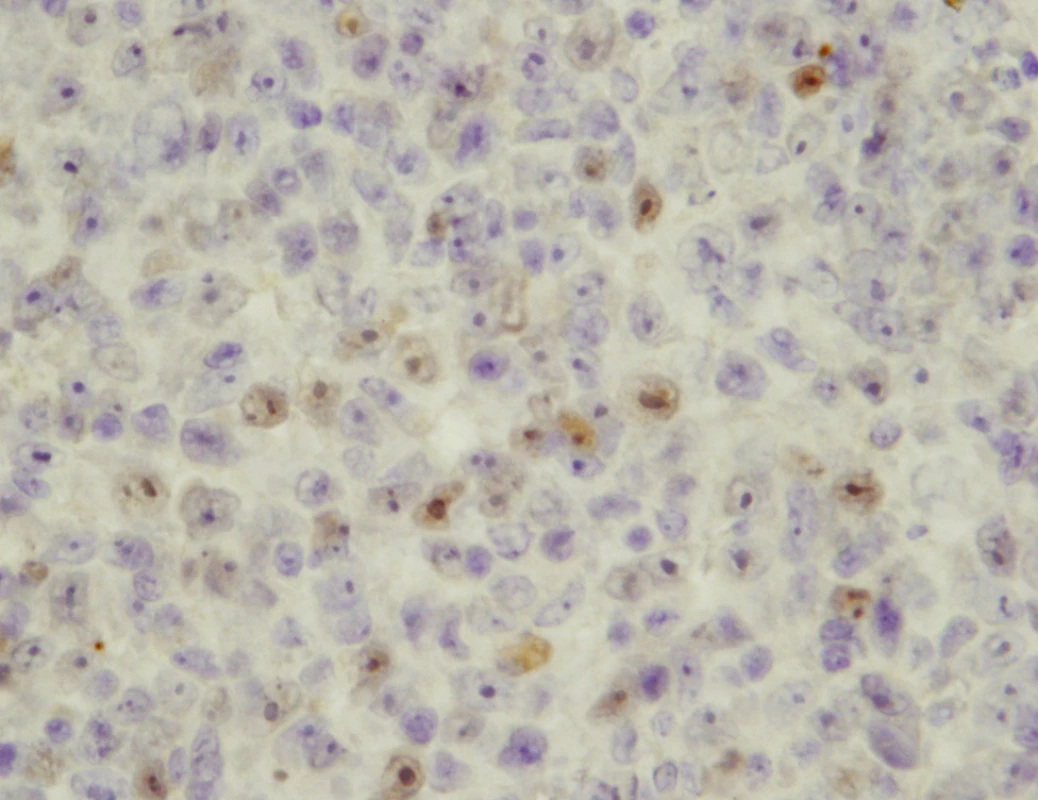
U 3 pacientů byla zjištěna v 5–15% buněk slabá jaderná exprese p21 (obr. 3), u 1 velmi slabá v 5–15 % buněk (ve všech 4 případech se jednalo o pacienty s výše popsanou prokázanou expresí p53).
Image 3. Imunohistochemický průkaz exprese p21 v buňkách maligního melanomu uvey, prokázána akumulace p21 v jádrech některých buněk (původní zvětšení 800krát) 
U 1 ze 4 pacientů s expresí p53 a p21 se jednalo o maligní melanom iris, u 1 o maligní melanom corpus ciliare a u 2 o maligní melanom choroidey. U žádného ze 4 pacientů s výše popsanou zvýšenou expresí genu p53 a p21 nebyly nalezeny vzdálené metastázy, pacienti jsou dodnes v dispenzarizaci Oční kliniky FN Brno a jsou bez známek recidivy základního onemocnění.
Diskuse
Maligní melanom uvey je nádor s těžko předvídatelnou prognózou, která závisí na velkém množství různých faktorů: velikost (baze a výška) tumoru, lokalizace tumoru (iris, corpus ciliare, choroidea), přítomnost ruptury Bruchovy membrány, vaskularita tumoru, mitotická aktivita tumoru, pigmentace tumoru a histologický typ tumoru. Dodnes nejčastěji používanou zůstává Callenderova cytologická klasifikace z roku 1931, která dělí maligní melanom uvey na 4 základní typy: maligní melanom vřetenobuněčného typu A (s nejlepší prognózou), maligní melanom vřetenobuněčného typu B, maligní melanom smíšený a maligní melanom epiteloidního typu (s nejhorší prognózou).
V zahraniční literatuře byly publikovány práce různých autorů popisující genetické abnormality maligního melanomu uvey: monosomie chromosomu 3 (7, 19, 20, 21, 23, 24), multiplikace 8q (20, 23, 24, 25), alterace evolučně starých oblastí chromosomu 1 (26), translokace chromosomů t(1,6), t(3,6), t(4,6), t(5,6), t(6,17) (23), alterace genu pro cyklin D1 a protein MDM2 (5, 18), alterace p16 (8, 14, 15, 17) a alterace tumor supresorového genu p53 (2, 4, 5, 9, 10, 11, 13, 22). Experimentální práce však zatím nepotvrdily, že by byl nález mutace některého z výše uvedených genů v onkogenezi maligního melanomu uvey stěžejní.
V našem souboru byla vysoká hladina proteinu p53 zaznamenána u 4 z 28 pacientů (14,3%). Naše výsledky jsou srovnatelné s výsledky Chowerse (4), který popisuje vysokou hladinu proteinu p53 u 14 z 98 (14,3%) maligních melanomů uvey, která není asociovaná s lokalizací tumoru ani stupněm vaskularity tumoru. Dle Cree (6) je vysoká hladina p53 indikátorem špatné prognózy u kožního maligního melanomu, naopak u maligního melanomu uvey má dobrou prognózu. Dle Jaye (11) je vysoká hladina proteinu p53 v buňkách maligního melanomu detekovaná pouze ve smíšených melanomech. Na rozdíl od našeho souboru Jay (11) detekoval vysokou hladinu p53 v 13 z 18 maligních melanomů (u 2 pacientů v méně než 1% buněk, u 8 pacientů v 1–3 % buněk, a u 3 pacientů ve více než v 4-5 % buněk).
Imunohistochemicky prokázanou vysokou hladinu proteinu p53 můžeme vysvětlit 2 možnostmi: 1. V buňce dochází ke kumulaci nefunkčního proteinu p53, který není odbouráván normální metabolickou cestou prostřednictvím produktu genu MDM2 (který je cílovým genem p53 a tvoří tak zpětněvazebnou kličku) a není ani schopen indukovat expresi genu p21. 2. V buňce se nachází zvýšené množství funkčního, standardního proteinu p53, jakož produktu nemutovaného genu, který je ve zvýšené míře transkribován nebo stabilizován z nějakých fyziologických příčin.
Vzhledem k tomu, že u všech pacientů našeho souboru, u kterých byla prokázána exprese p53, byla zároveň prokázána exprese p21, lze usuzovat, že stabilizující mutace p53 jsou u maligního melanomu uvey vzácné. Námi prokázaná exprese p53 u 4 pacientů je pravděpodobně vzhledem ke schopnosti indukovat expresi genu p21 výsledkem stabilizace funkčního, standardního p53.
Závěr
Vysoká hladina proteinu p53 a p21 byla zaznamenána u 4 z 28 pacientů (14,3 %). Z výše uvedených výsledků vyplývá, že stabilizující mutace p53 jsou u maligního melanomu uvey vzácné. Prokázaná exprese p53 u 4 pacientů je pravděpodobně výsledkem stabilizace funkčního p53 zejména vzhledem ke schopnosti indukovat expresi genu p21. V našem souboru nebyla prokázaná výrazná jaderná akumulace p53, která by naznačovala přítomnost mutace p53.
Práce byla podpořena stipendiem z Programu rektora MU na podporu tvůrčí činnosti studentů 2006 1411 C0003
Práce byla přednesena na XV. výročním sjezdu ČOS v Brně 21.–23. 6. 2007.
MUDr. Elena Tokošová, Ph.D.
Oční oddělení Nemocnice Kyjov
Strážovská 976
697 01 Kyjov
e-mail: etokosova@gmail.com
Sources
1. Baráková, D. et al.: Nádory oka, Praha, Grada Publishing, 2002, 152 s.
2. Brantley, M. A. Jr., Harbour, J. W.: Deregulation of the Rb and p53 pathways in uveal melanoma, Am. J. Pathol., 157, 2000, 6 : 1795-1801.
3. Char, D. H.: Tumors of the eye and ocular adnexa, Hamilton, BC Decker Inc., 2001, 476 p.
4. Chowers, I., Folberg, R., Livni, N. et al.: p53 immunoreactivity, Ki-67 expression, and microcirculation patterns in melanoma of the iris, ciliary body, and choroid, Current Eye Research, 24, 2002, 2 : 105-108.
5. Coupland, S. E., Anastassiou, G., Stang, A. et al.: The prognostic value of cyclin D1, p53, and MDM2 protein expression in uveal melanoma, Journal of pathology, 2000, 191 : 120-126.
6. Cree, I. A.: Cell cycle and melanoma – two different tumours from the same cell type, J. Pathol., 191,2000 : 112-114.
7. Dahlenfors, R., Törnquist, G., Wettrell, K. et al.: Cytogenetical observations in nine ocular malignant melanomas, Anticancer research, 1993, 13 : 1415-1420.
8. Goldstein, A. M., Chan, M., Harland, M. et al.: High-risk melanoma susceptibility genes and pancreatic cancer, neural system tumors, and uveal melanoma across GenoMEL, Cancer Research, 66, 2006 : 9818-9828.
9. Honda, S., Hirai, T., Handa, J. T. et al.: Expression of cell cycle related proteins in a rapidly growing uveal melignant melanoma, Retina, 24, 2004, 4 : 646-649.
10. Jay, M., McCartney, A. C. E., Path, F. R. C.: Familial malignant melanoma of the uvea and p53: a Victorian detective story, Surv. Ophthalmol., 37, 1993, 6 : 457-462.
11. Jay, V., Yi, Q. Hunter, W. S. et al.: p53 expresion in uveal malignant melanomas, Pathology, 28,1996 : 306-308.
12. Kanski, J.J.: Intraocular tumours. In Kanski, J.J., Clinical ophthalmology (fifth edition), Edinburgh, Butterworth Heinemann, 2003, s. 317-347
13. Kishore, K., Ghazvini, S., Char, D. H. et al.: p53 gene and cell cycling in uveal melanoma, Amer. J. Ophthalmol., 121, 1996, 5 : 561-567.
14. Knappskog, S., Geisler, J., Arbesem, T. et al.: A novel type of deletion in the CDKN2A gene identified in a melanoma-prone family, Genes, chromosomes and cancer, 45, 2006 : 1155-1163.
15. Laud, K., Marian, C., Afrik, M. F. et al.: Comprehensive analysis of CDKN2A (p16INK4A/p14ARF) and CDKN2B genes in 53 melanoma index cases considered to be at heightened risk of melanoma, J Med Genet, 43, 2006 : 39-47.
16. Masopust, J.: Patobiochemie buňky, Praha, Univerzita Karlova v Praze, 2003, 345 s.
17. Merbs, S. L., Sidransky, D.: Analysis of p16 (CDKN2/MTS-1/INK4A) alterations in primary sporadic uveal melanoma, IOVS, 3, 1999, 40 : 779-783.
18. Ohta, M., Nagai, H., Shimizu, M. et al.: Rarity of somatic and germline of the cyclin-dependent kinase 4 inhibitor gene, CDK41, in melanoma, Cancer research, 54, 1994 : 5269-5272.
19. Parrella, P., Sidransky, D., Merbs, S. L.: Allelotype of posterior uveal melanoma: implications for a bifurcated tumor progression pathway, Cancer research, 59, 1999 : 3032-3037.
20. Prescher, G., Bornfeld, R., Becher, R.: Two subclones in a case of uveal melanoma: Relevance of monosomy 3 and multiplication of chromosome 8q, Cancer Genet Cytogenet, 77,1994 : 144-146.
21. Prescher, G., Bornfeld, R., Hirche, H. et al.: Prognostic implications of monosomy 3 in uveal melanoma, Lancet, 347,1996 : 1222-1225.
22. Tobal, K., Warren, W., Cooper, C. S., et al.: Increased expression and mutation of p53 in choroidal melanoma, Brit. J. Cancer, 66,1992 : 900-904.
23. Wiltshire, R. N., Exner, V. M., Denis, T. et al.: Cytogenetic analysis of posterior uveal melanoma, Cancer Genet Cytogenet, 66,1993 : 47-53.
24. White, V. A., Chambers, J. D., Courtright, P. D. et al.: Correlation of cytogenetic abnormalities with the outcome of patients with uveal melanoma, Cancer, 83,1998 : 354-359.
25. Yamagata, H., Miki, T., Ogihara, T. et al.: Chromosomal aberrations defining uveal melanoma of poor prognosis, Lancet, 339,1992 : 691-692.
26. Zhang, J., Glatfelter, A. A., Taetle, R. et al.: Frequent alterations of evolutionarily conserved regions of chromosome 1 in human malignant melanoma, Cancer Genet Cytogenet, 111,1999 : 119-123.
Labels
Ophthalmology
Article was published inCzech and Slovak Ophthalmology

2008 Issue 4-
All articles in this issue
- VNÚTROOČNÝ TLAK KRÁLIKOV PO INSTILÁCII ZMESI AMINOKYSELINY ARGINÍNU S DVOJKOMBINÁCIOU ANTIGLAUKOMATÍK (TRUSOPT + XALATAN)
- Verteporfin s ranibizumabem u neovaskulární makulární degenerace
- Zrakové funkce nedonošených dětí po operaci posthemoragického hydrocefalu
- Srovnání fixní kombinace bimatoprostu 0,03% a timololu 0,5% s jinými kombinacemi antiglaukomatik v léčbě glaukomu
- Triamcinolon v léčbě diabetického makulárního edému – roční výsledky
- Imunohistochemická detekce exprese genu p53 a p21 v buňkách maligního melanomu uvey
- Dlouhodobé výsledky anteriorizace a myektomie dolního šikmého svalu u vertikálních deviací
- Czech and Slovak Ophthalmology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Dlouhodobé výsledky anteriorizace a myektomie dolního šikmého svalu u vertikálních deviací
- Imunohistochemická detekce exprese genu p53 a p21 v buňkách maligního melanomu uvey
- Verteporfin s ranibizumabem u neovaskulární makulární degenerace
- Zrakové funkce nedonošených dětí po operaci posthemoragického hydrocefalu
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career



