-
Medical journals
- Career
Analgeticko-myorelaxační infuze v terapii vertebrogenního algického syndromu – technologické a klinické aspekty
Authors: I. Murínová - 1 3; A. Linhartová 1,4; J. Muselík 5; J. Cihlo 1,6; L. Dvířková 1,7; J. Gregorová 8; K. Kroutilová 1,9; K. Langmaierová 1,3,10; L. Polášková 1,2; J. Vedrová 1,11; M. Vodička 1,12
Authors‘ workplace: Pracovní skupina pro ředění a podávání léčiv, Česká odborná společnost klinické farmacie ČLS JEP 1; Oddělení klinické farmacie, ÚVN – VFN, Praha 2; Ústav aplikované farmacie, Farmaceutická fakulta, MU, Brno 3; Oddělení klinické farmacie, Lékárna, Fakultní Thomayerova nemocnice, Praha 4; Ústav farmaceutické technologie, Farmaceutická fakulta, MU, Brno 5; Lékárna Multiscan Pharma, s. r. o. – oddělení přípravy cytostatik, Pardubice 6; Oddělení klinické farmacie, FN Plzeň-Bory 7; Oddělení klinické farmacie, FN Bulovka, Praha 8; Pracoviště klinické farmacie, Ústavní lékárna, MOÚ, Brno 9; Oddělení klinické farmacie, Krajská zdravotní, a. s. – pracoviště Teplice 10; Pracoviště klinické farmacie, Ústav hematologie a krevní transfuze, Praha 11; Pracoviště klinické farmacie, Lékárna, Krajská nemocnice T. Bati, a. s., Zlín 12
Published in: Cesk Slov Neurol N 2021; 84(5): 465-471
Category: Original Paper
doi: https://doi.org/10.48095/cccsnn2021465Overview
Cíl: Cílem práce bylo ozřejmit složení a způsob podávání analgeticko-myorelaxačních infuzí (AMI) běžně používaných v klinické praxi, zhodnotit racionalitu zařazení jednotlivých složek do AMI a zhodnotit kompatibilitu a stabilitu složek nejčastěji používaných AMI. Metodika: Formou dotazníkového průzkumu bylo osloveno 15 náhodně vybraných klinických pracovišť pro získání přehledu spektra AMI používaných v ČR. Racionalita složení AMI byla hodnocena na základě posouzení farmakologických a farmaceutických vlastností léčiv a důkazů pro jejich použití v terapii vertebrogenního algického syndromu (VAS). Dále byla provedena studie kompatibility a stability dvou nejčastěji používaných AMI (směs č. 1: trimekain, metamizol, guaifenesin; směs č. 2: trimekain, metamizol, síran hořečnatý). Výsledky: Bylo zjištěno používání značného množství různých kombinací léčivých přípravků, nejčastěji ze skupiny analgetik, myorelaxancií, kortikosteroidů a lokálních anestetik. Složení AMI se přitom ukázalo být ne vždy zcela racionální, a to jak z farmakoterapeutického (účinnost, bezpečnost, evidence), tak technologického (kompatibilita, stabilita) hlediska. Provedená technologická studie pak prokázala kompatibilitu a stabilitu u dvou nejčastěji používaných směsí. Závěry: Zavedené používání AMI má řadu podstatných nedostatků. V terapii VAS se proto zdá být ve většině případů a v různých ohledech vhodnější perorální podání léčiv. Intravenózní terapie by tak mohla zůstat vyhrazena pro specifické situace.
Klíčová slova:
infuzní terapie – vertebrogenní algický syndrom – analgetika – myorelaxancia – perorální terapie – stabilitní studie
Úvod
Vertebrogenní algický syndrom (VAS) je jednou z nejčastěji řešených diagnóz v ordinaci ambulantního neurologa. Často se jedná o onemocnění s rizikem dalších recidiv. Bolest může být lokalizována v různých oblastech páteře, může být doprovázena neurologickou symptomatologií a limitovat pacienta v pohybu [1].
V roce 2018 byly dorzopatie (kód diagnózy M00–M99 dle Mezinárodní klasifikace nemocí [MKN-10]) příčinou pracovní neschopnosti u 6 886 pacientů / 100 000 pojištěnců a příčinou hospitalizace u 174 298 pacientů, přičemž průměrná doba jedné hospitalizace činila 6,2 dne [2].
V akutní fázi VAS je zásadní rychle ztišit bolest. Navazující dlouhodobá a pravidelná rehabilitace s aktivní účastí pacienta pak představuje účinný nástroj v prevenci rozvoje chronických bolestivých stavů [3].
Jedním z možných řešení akutní fáze VAS jsou intravenózně podávané analgeticko-myorelaxační infuze (AMI). Jedná se o infuzní směsi, které obvykle obsahují složku analgetickou a myorelaxační, v některých případech i protizánětlivou. Od jejich podání je očekáván ústup bolesti a spazmů kosterního svalstva, v ideálním případě s rychlým nástupem a dostatečně dlouhým trváním účinku. Nicméně přesvědčivá data o efektivitě, jakož i jasná doporučení stran indikace, složení a dávkování AMI chybí; jejich použití je postupem off-label.
V ČR mají AMI dlouholetou tradici, proto obsahují i starší parenterální přípravky, které jsou dnes v jiných případech využívány již jen minimálně. Obecně platí, že směsi používané různými pracovišti mají variabilní, a ne vždy zcela racionální složení. Běžným problémem je rovněž neověřená kompatibilita a stabilita složek ve výsledné infuzní směsi.
Nastavení a dohled nad správným použitím infuzních léčiv patří mezi běžné aktivity klinického farmaceuta. V roce 2017 proto byla pod záštitou České odborné společnosti klinické farmacie ČLS JEP založena Pracovní skupina pro ředění a podávání léčiv. Jedním z úkolů, které si pracovní skupina při svém vzniku stanovila, bylo zmapovat a zhodnotit problematiku používání AMI v ČR [4]. Předložený text shrnuje závěry provedeného šetření.
Cíl
Cílem práce bylo:
1. ozřejmit složení a způsob podávání AMI běžně používaných v klinické praxi;
2. zhodnotit racionalitu zařazení jednotlivých složek do AMI, a to z hlediska účinnosti i případných rizik;
3. zhodnotit kompatibilitu a stabilitu složek nejčastěji používaných AMI.
Metodika
Spektrum AMI běžně používaných v ČR bylo zjištěno formou pilotního dotazníkového průzkumu. Osloveno bylo 15 náhodně vybraných klinických pracovišť různého typu (fakultní nemocnice i malé okresní nemocnice, neurologická oddělení i všeobecná interní oddělení apod.). Sledovanými charakteristikami AMI byly složení, objem a délka podávání infuze.
Racionalita složení AMI byla hodnocena na základě posouzení farmakologických a farmaceutických vlastností léčiv a evidence based medicine pro jejich použití v terapii VAS.
Hodnocení chemické stability složek dvou nejčastěji používaných AMI bylo provedeno ve spolupráci s Ústavem farmaceutické technologie Farmaceutické fakulty Masarykovy univerzity Brno.
Složení směsí bylo:
- č. 1: trimekain, metamizol, guaifenesin a 0,9% chlorid sodný;
- č. 2: trimekain, metamizol, síran hořečnatý (MgSO4) a 0,9% chlorid sodný.
K přípravě směsí byly použity komerčně dostupné léčivé přípravky (tab. 1). Příprava proběhla způsobem běžným v klinické praxi, každá směs byla připravena ve dvou vyhotoveních.
Table 1. Složení analyzovaných AMI č. 1 a č. 2. 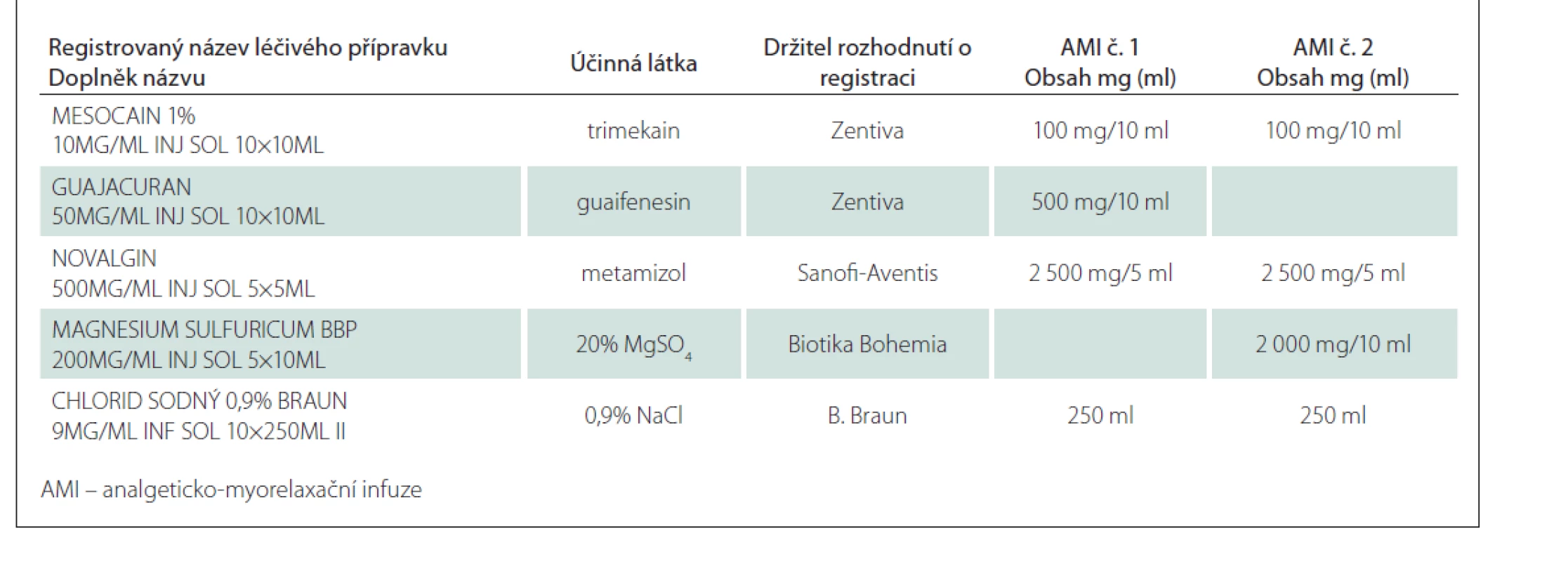
Směsi byly následně skladovány po dobu 2 h (což odpovídá maximální obvyklé délce aplikace AMI v klinické praxi), a to na světle, při teplotě 20 ± 2 °C.
V časech 0, 30, 60, 90 a 120 min byl odebrán 1 ml směsi a doplněn do 10 ml metanolem. Vzorky byly ihned analyzovány metodou high-performance liquid chromatography (HPLC). K analýze byl použit kapalinový chromatograf Agilent Technologies (Agilent 1260, Santa Clara, CA, USA) s kvartérní pumpou, automatickým dávkovačem a detektorem s diodovým polem. K chromatografické separaci byla použita kolona Nucleodur 100-5 CN-RP (Macherey-Nagel Inc., Allentown, USA). Spektra byla snímána při 230 nm. Jako standardy ke kvantitativnímu stanovení byly použity farmaceutické suroviny trimekain hydrochlorid a guaifenesin od firmy Dr. Kulich (Macherey-Nagel Inc., Allentown, USA) a metamizol sodná sůl monohydrát a 4-methylaminoantipyrin (4-MAA) od firmy Sigma Aldrich s. r. o. (St. Louis, USA). Dávkováno bylo 0,5 μl vzorku. Kvantifikace byla provedena na základě kalibračních křivek jednotlivých standardů. Pro stanovení trimekainu a guaifenesinu v infuzní směsi byly použity mobilní fáze metanol (A) a 0,1% triethylamin ve fosfátovém pufru o pH 4,0 (B). Složení mobilní fáze: 15 % (A) a 85 % (B), průtok 1,0 ml/min, teplota kolony 25 °C. Pro stanovení metamizolu a 4-MAA v infuzní směsi byly použity mobilní fáze methanol (A) a 0,1% triethylamin ve fosfátovém pufru o pH 7,0 (B). Složení mobilní fáze: 0–7 min 20 % (A) a 80 % (B), 10–24 min 30 % (A) a 70 % (B), průtok 1,0 ml/min, teplota kolony 25 °C.
Chemická stabilita MgSO4, který byl součástí stanovované směsi č. 2, nebyla hodnocena. Dle literárních zdrojů je MgSO4 v infuzních roztocích stabilní [5].
Výsledky
Výsledky dotazníkového šetření
Bylo zjištěno používání značného množství různých kombinací léčivých přípravků (celkem 53 různých AMI) – nejčastěji se vyskytující kombinace uvádí tab. 2. Mezi léčiva používaná pro účely AMI patří nesteroidní antiflogistika, metamizol, tramadol, kortikosteroidy, myorelaxancia, lokální anestetika, minoritně pak petidin, diazepam, fosforečnan sodný, prokain a kalcium glukonát.
Table 2. Výběr nejčastěji používaných kombinací AMI v ČR. 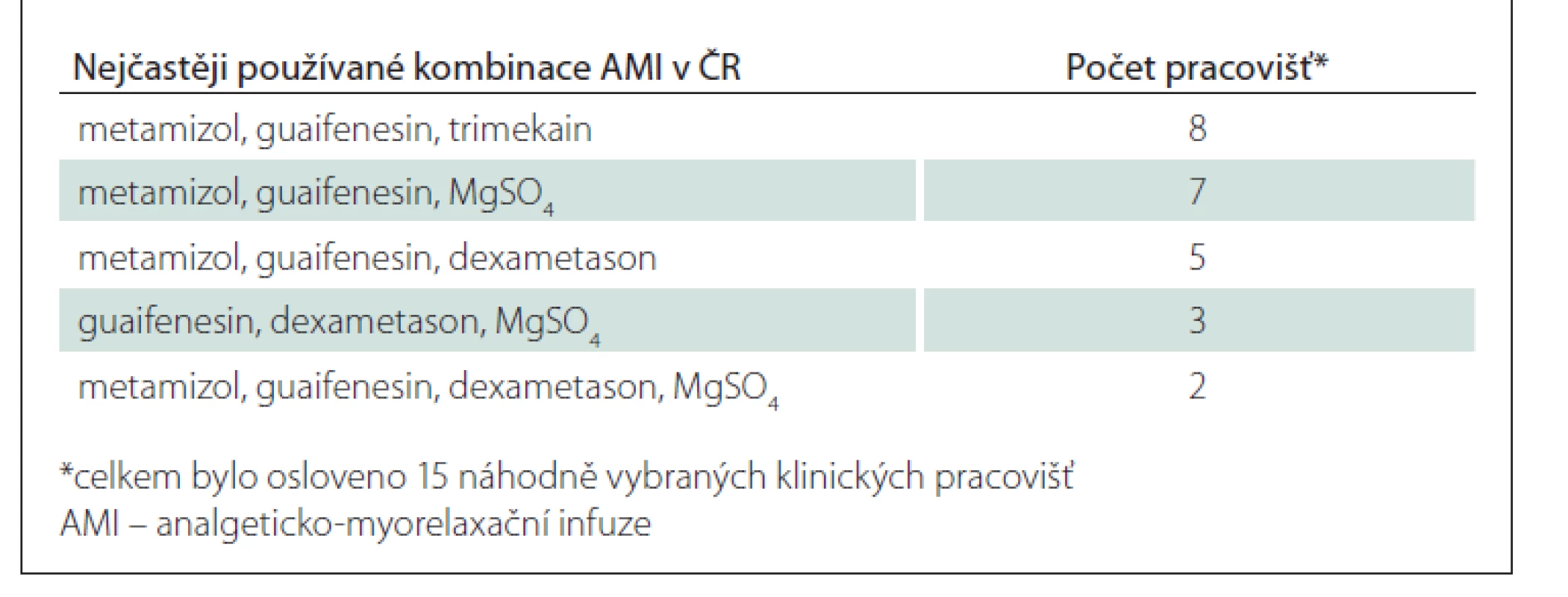
AMI bývají nejčastěji třísložkové (25x), méně často pak čtyřsložkové (16x) či dvousložkové (9x). Ve dvou případech bylo referováno použití pětisložkové AMI.
Jako nosný roztok je nejvíce používán 0,9% chlorid sodný o objemu 250 ml.
Pokud jde o délku infuze, AMI jsou podávány po různě dlouhou dobu (30–120 min), nejčastěji však po dobu 60 min. Obvyklá frekvence podávání AMI je 1x denně.
Výsledky hodnocení léčiv
Byly hodnoceny čtyři nejčastěji používané skupiny léčiv:
- analgetika: nesteroidní antiflogistika (NSA) a metamizol;
- myorelaxancia;
- kortikosteroidy (KS);
- lokální anestetika (LA);
a to v indikaci VAS.
Nesteroidní antiflogistika
Ratio pro zařazení NSA do AMI představuje jejich analgetický a protizánětlivý účinek založený na inhibici cyklooxygenázy a následně inhibici syntézy prostaglandinů.
Přehled NSA, která jsou k dispozici v parenterální formě (a tedy dostupná pro podání infuzí), uvádí tab. 3. Z těchto NSA jsou pro účely AMI běžně využívány natrium salicylát (NS), ibuprofen, ketoprofen a diklofenak. Nejčastěji používaným je NS.
Table 3. Nesteroidní antiflogistika dostupná v parenterální lékové formě v ČR (stav k 8. 3. 2021) [8]. ![Nesteroidní antiflogistika dostupná v parenterální lékové formě v ČR
(stav k 8. 3. 2021) [8].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/6ba0685de78dbbd4ce341c75bf837a3a.png)
Analgetická účinnost ekvipotentních dávek různých NSA je na populační úrovni srovnatelná. Je však známo, že na individuální úrovni existuje vysoká variabilita v odpovědi na léčbu – účinnost konkrétního NSA u konkrétního pacienta přitom nelze předem odhadnout [6].
Pokud jde o nežádoucí účinky (NÚ), NS, ibuprofen, ketoprofen a diklofenak se zásadním způsobem neliší v potenciálu k navození jak gastrointestinálních, tak dalších NÚ typických pro skupinu NSA.
NS, ibuprofen, ketoprofen a diklofenak mají krátký plazmatický poločas (max. 6 h), tj. podání jedné dávky nepokryje účinkem celých 24 h [7].
Metamizol
Metamizol je dalším léčivem s analgetickým účinkem. Kromě toho disponuje ještě účinkem spazmolytickým (a antipyretickým) a podle některých zdrojů i protizánětlivým. Spazmolytický účinek je přitom omezen na hladké svaly – podání metamizolu tedy neovlivňuje spazmy kosterních svalů, které mohou být u VAS přítomny.
Běžně se vyskytujícím NÚ metamizolu je arteriální hypotenze po rychlém intravenózním podání. Vzácným, avšak závažným NÚ pak může být rozvoj agranulocytózy na imunoalergickém podkladě. Výskyt tohoto NÚ není závislý na dávce a může k němu dojít kdykoli během léčby parenterálními i perorálními formami léčiva. Ve srovnání s NSA je výhodou, že metamizol nemá gastrointestinální NÚ.
Délka trvání účinku metamizolu je 4 h.
Z provedeného průzkumu vyplývá, že častou součástí AMI je přípravek Analgin (Biotika Bohemia, spol. s r. o., Praha, ČR), který obsahuje kromě metamizolu ještě další dvě složky – spazmolytika pitofenon a fenpiverin. I tato léčiva uvolňují spazmy pouze hladkých (nikoliv kosterních) svalů – jejich použití v terapii VAS proto nemá racionální podklad.
Myorelaxancia
Ratio pro zařazení myorelaxancií do AMI představuje jejich relaxační účinek na kosterní svalstvo založený na působení v CNS. Hlavní místo účinku tizanidinu je v míše, kde stimulací presynaptických alfa2-receptorů inhibuje uvolňování excitačních aminokyselin, které stimulují N-methyl-D-aspartátové (NMDA) receptory. Zároveň má mírný centrální analgetický účinek. Mefenoxalon snižuje tonus příčně pruhovaného kosterního svalstva tím, že inhibuje polysynaptické reflexní mechanizmy, které způsobují zvýšené napětí. Navíc má i velice slabé centrální anxiolytické účinky [8]. Komplexní účinek se širokým spektrem má orfenadrin; nejen myorelaxační, ale i analgetický (antagonista sodíkových kanálů, antagonista NMDA receptoru, inhibitor reuptake noradrenalinu) [9]. Tlumí tak nejen nociceptivní, ale i neuropatické bolesti. Jsou popisovány i jeho euforizující vlastnosti [10]. Guaifenesin je látka odvozená od propandiolu, která má expektorační a částečně také myorelaxační účinky. Přesný mechanizmus účinku této látky na snížení svalového tonu však není znám. Předpokládá se, že guaifenesin potlačuje nebo blokuje přenos nervových impulzů na úrovni interneuronů v subkortikálních oblastech mozku, mozkového kmene a míchy. Využíván je i pro své anxiolytické účinky. Hořčík jako kofaktor enzymatických systémů působí na neurochemickou transmisi a muskulární excitabilitu. Hořečnaté ionty inhibují uvolňování acetylcholinu z presynaptických nervových zakončení cholinergních nervových vláken a v nervosvalové ploténce svalů kostry [8].
Řada dat publikovaných o myorelaxanciích se týká léčiv, která nejsou v ČR k dispozici (karisoprolol, metocarbamol a další). Výjimkou jsou v tomto směru tizanidin a orfenadrin. Pro typicky česká specifika (mefenoxalon, guaifenesin) pak kvalitní studie zcela chybí.
V rámci Cochranova systematického review byla hodnocena účinnost myorelaxancií v terapii nespecifické bolesti dolních zad – pacientům byla podávána myorelaxancia buď v monoterapii, nebo v kombinaci s jinými terapeutickými postupy [11]. Autoři studie závěrem konstatují, že myorelaxancia poskytují úlevu od bolesti účinněji než placebo. Nicméně výskyt NÚ (ospalost, závratě a další) je vysoký, a proto by myorelaxancia měla být podávána uvážlivě (po zvážení poměru riziko/přínos).
Americká asociace lékařů pak ve svých doporučeních uvádí, že použití myorelaxancií je svou účinností srovnatelné s nefarmakologickou léčbou (cvičení, masáže, teplo, akupunktura). Nefarmakologická léčba by přitom měla být preferována z důvodu výskytu NÚ při podání myorelaxancií [12].
Přehled léčivých látek této skupiny a jejich vybrané farmakokinetické parametry uvádí tab. 4 [8].
Table 4. Přehled myorelaxancií a jejich vybrané farmakokinetické parametry [8]. ![Přehled myorelaxancií a jejich vybrané farmakokinetické parametry [8].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/4a6c649768e3c82bdf39fc53694b628a.png)
Kortikosteroidy
Standardní terapií akutních bolestí dolní části zad jsou NSA. Přidání KS nemá v této indikaci aditivní analgetický efekt [13–16]. Ani konkrétně u akutních lumbosakrálních radikulopatií, které nejsou indikovány k chirurgické intervenci či specifické léčbě, nemá použití KS vliv na úlevu od bolesti. Přesto jsou při nedostatečné odpovědi na NSA KS někdy podávány. Ve studiích byl nejčastěji podáván prednison per os v dávce 60–80 mg po dobu prvních 5 dnů, s postupným vysazováním v průběhu dalších 10 dnů [17].
Vzhledem k četným fyziologickým účinkům KS v organizmu je tato skupina léčiv obecně zatížena mnohými NÚ – jedná se např. o zvýšení krevního tlaku, zhoršení glukózové tolerance, psychické změny, gastrointestinální NÚ, zvýšené riziko infekčních komplikací, zhoršené hojení ran aj. Nezanedbatelná je i četnost výskytu NÚ, která roste s dávkou a délkou terapie. Krátkodobé podávání KS by mělo být relativně bezpečné, přesto je třeba pečlivě monitorovat výskyt NÚ, a to zejména u rizikových skupin pacientů.
V rámci AMI je nejčastěji používán dexametason. Oproti jiným KS postrádá mineralokortikoidní efekt. Jeho plazmatický poločas je krátký (cca 4 h), ale poločas biologického účinku je dlouhý (až 36 h).
Poznámka: V případě lumbální spinální stenózy, jejíž příčinou je zúžení páteřního nebo kořenového kanálu, je použití KS diskutováno ve spojení s epidurálním podáním [18]. U subakutních a chronických bolestí dolních zad je použití KS zmiňováno v rámci periradikulární terapie – i v tomto případě se jedná o epidurální podání [19].
Lokální anestetika
Farmakodynamické ratio pro systémové použití LA představuje ovlivnění sodíkových kanálů, některých receptorů (např. NMDA) a hladin zánětlivých mediátorů. Použití LA v indikaci intravenózní analgezie je vedeno snahou snížit spotřebu opioidů a redukovat tak jejich NÚ. Data jednoznačně potvrzující schopnost LA ovlivnit některé typy bolesti a snížit spotřebu opioidů však zatím chybí. Nejvíce publikovaných zahraničních dat je vztaženo k lidokainu [20–22].
V ČR je pro použití v indikaci intravenózní analgezie schváleno pouze jediné LA – prokain. Použití trimekainu a lidokainu je tedy postupem off-label. Přesto je na základě empirické praxe v rámci AMI rutinně podáván trimekain.
Při podávání LA je třeba mít na paměti i možné riziko výskytu NÚ, zvláště kardiovaskulárních (poruchy rytmu, hypotenze).
Plazmatický poločas LA je v řádu jednotek až desítek minut.
Výsledky stabilitní studie
Výsledky hodnocení stability jsou shrnuty v tab. 5. Je z nich zřejmé, že obsah guaifenesinu a trimekain-hydrochloridu v obou analyzovaných směsích odpovídá teoretickým hodnotám a v čase se nemění (změna relativního obsahu v čase 120 min oproti hodnotě v čase 0 min není větší než 5 %). Obsah metamizolu sodné soli monohydrátu v obou směsích v čase klesá (pokles relativního obsahu v čase 120 min oproti hodnotě v čase 0 min činí průměrně 17,15 %), což souvisí s postupnou tvorbou hydrolyzovaného produktu 4-MAA (obr. 1).
Table 5. Průměrný relativní obsah sledovaných účinných látek ve směsích analgeticko-myorelaxačních infuzí č. 1 a č. 2. 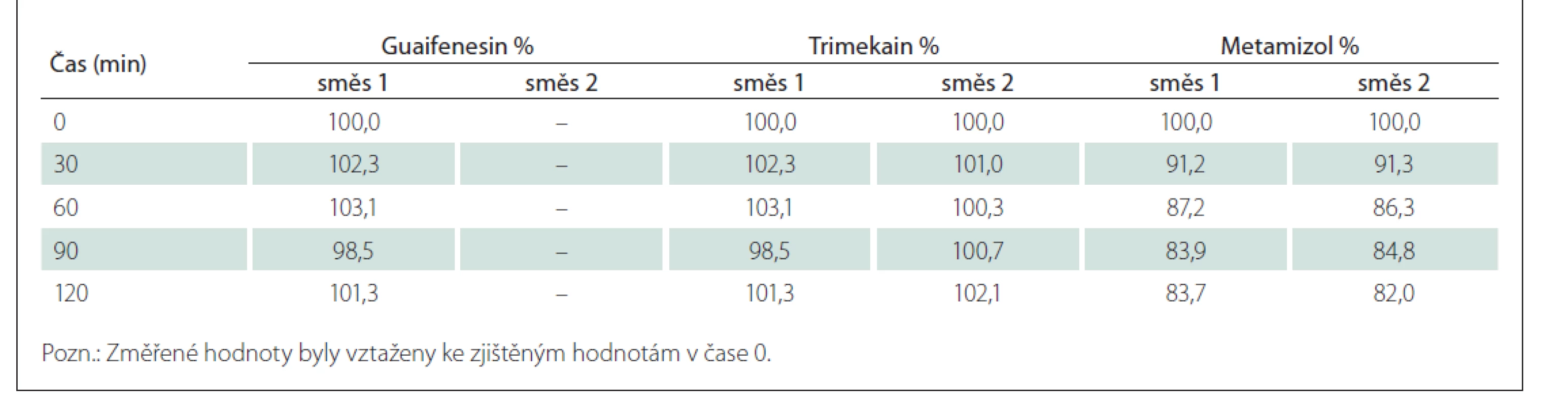
Image 1. Chromatogramy stanovení metamizolu a jeho hydrolyzovaného rozkladného produktu 4-MAA.
Fig. 1. Chromatograms of metamizole and its hydrolyzed degradation product 4-MAA.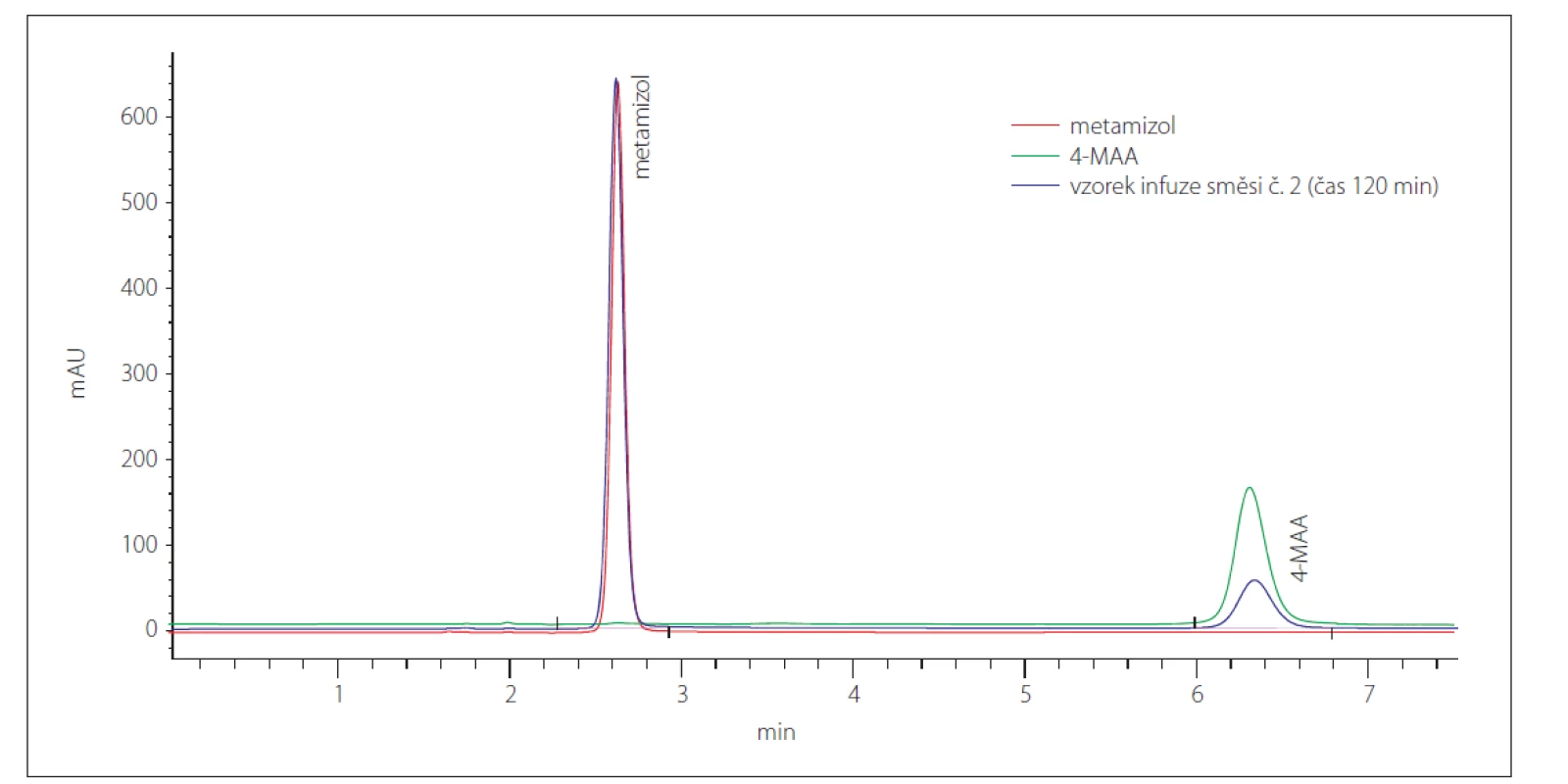
MgSO4 je v infuzních roztocích stabilní, a proto nebyl přímo stanovován. Pokud jde o jeho vliv na ostatní složky směsi č. 2, je jeho působení indiferentní (výsledky stanovení daných analytů ve směsi č. 2 se nelišily od výsledků stanovení stejných analytů ve směsi č. 1).
Diskuze
V následujícím textu bude diskutována rutinní klinická praxe při zacházení s AMI v ČR.
Běžně předepisované AMI jsou směsí několika složek, s čímž souvisí riziko jejich vzájemných inkompatibilit. Většina přípravků používaných pro přípravu AMI není určena pro podání ve směsných infuzích – data o jejich vzájemné kompatibilitě chybí. Hodnocení kompatibility (a stability) směsí přitom nelze omezit pouze na vizuální kontrolu po jejich přípravě. Kompatibilitu a stabilitu lze prokázat pouze kvalitativním a kvantitativním analytickým hodnocením reakčních/rozkladných produktů v čase – tak, jak to bylo provedeno zde u směsí č. 1 a 2. Bohužel v běžných podmínkách komplikuje získání takových dat omezená dostupnost analytického vybavení farmaceutických úseků zdravotnických zařízení, absence dat u léčivých přípravků typických pro ČR a široké spektrum jejich používaných kombinací. Za použití přípravků neschváleným způsobem pak nese plnou odpovědnost předepisující lékař.
AMI jsou obvykle ordinovány jako delší (konkrétně 60min) infuze 1× denně. Intravenózní aplikace zaručuje okamžitou dostupnost léčiva v centrálním kompartmentu, a tím prakticky okamžitý nástup účinku. Míru dosaženého účinku přitom určuje nejen dávka, ale také délka infuze – tzn. čím delší infuze, tím nižší maximální plazmatická koncentrace a nižší maximální možný efekt. Poločas většiny základních léčiv (analgetika a myorelaxancia) používaných v rámci AMI se pohybuje v rozmezí 4–6 h. Podání 1× denně pak nemůže zajistit trvání účinku po dobu celých 24 h.
Mezi další nevýhody AMI patří podmínka žilního přístupu, invazivita aplikace (a tedy nepohodlí pro pacienta), vyšší zátěž pro ošetřovatelský personál a v neposlední řadě také vyšší finanční náklady na léčbu (souhrnně viz tab. 6).
Table 6. Obvyklé ordinace AMI a jejich nevýhody a rizika. 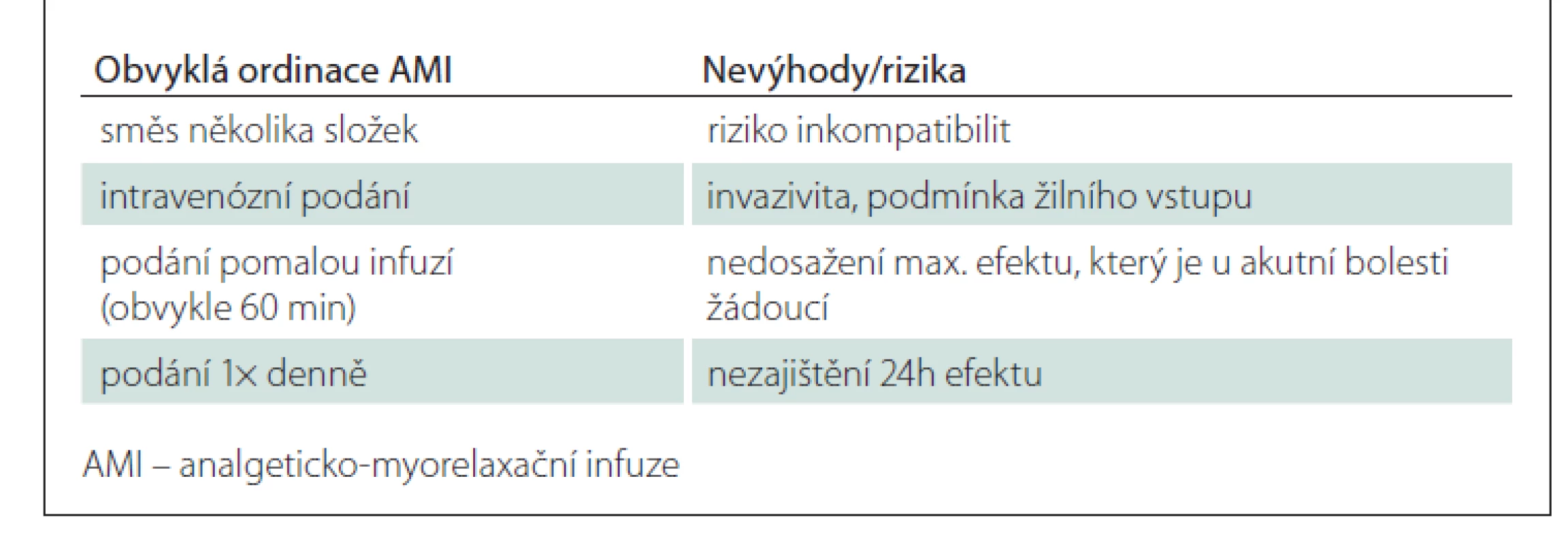
Je tedy racionální otázkou, zda mají intravenózní AMI nějaké zásadní výhody oproti kombinované terapii perorálními formami léčiv, tzn. zda by perorální terapie VAS byla adekvátní alternativou infuzím. Z hlediska jednotlivých lékových skupin:
Použití NSA v terapii VAS je s ohledem na jejich analgetický a protizánětlivý účinek logické.
NS, v rámci AMI nejčastěji používané NSA, nemá perorální variantu. Nicméně oproti ostatním NSA, která jsou k dispozici v perorálních formách, nemá žádné farmakodynamické ani farmakokinetické výhody. V ČR je na trhu široká škála perorálních NSA s výbornou a rychlou absorpcí, která umožňuje dosáhnout maximálních sérových koncentrací už přibližně za 1 h. Léčba perorálními formami NSA je navíc méně nákladná (ceny definovaných denních dávek jsou u perorálních NSA v řádu jednotek Kč vs. celková cena jedné infuze NSA, tj. součet cen léčivého přípravku, nosného roztoku a infuzního setu platných k 8. 3. 2021, se pohybuje mezi 40–55 Kč). Použití NSA v infuzních směsích je ke všemu spojeno s rizikem známých inkompatibilit (viz tab. 7).
Table 7. Inkompatibility nesteroidních antiflogistik [8]. ![Inkompatibility nesteroidních antiflogistik [8].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/587c7f743fc9953e74ec25a8d487d553.png)
O úloze metamizolu v terapii VAS rovněž není pochyb. Sporné je však jeho společné podávání ve směsi s NSA – tento postup přitom není v klinické praxi ojedinělý. Aktuálně jsou na trhu k dispozici kromě injekčního roztoku a perorálních tablet i perorální kapky, které mají oproti tabletám rychlejší nástup účinku (15 vs. 30 min). Výhodou použití perorálních forem metamizolu je snížení pravděpodobnosti výskytu nežádoucí hypotenzní reakce po podání.
Použití myorelaxancií v terapii VAS lze zvážit u pacientů s přítomnými spazmy kosterních svalů. Řada myorelaxancií používaných v klinické praxi má komplexní účinek zahrnující i analgetický, příp. anxiolytický efekt (pozn. právě anxiolýza může být důvodem častého zastoupení guaifenesinu v AMI). Pro optimální efekt léčby je důležité podat myorelaxancia v dostatečné dávce, což bohužel bývá limitováno výskytem NÚ – myorelaxancia by proto měla být používána uvážlivě. Bezpečnou alternativu se srovnatelnou účinností představují nefarmakologické postupy (cvičení, masáže, teplo, akupunktura).
Intravenózní podání myorelaxancií (guaifenesin, MgSO4 a orfenadrin) se vyznačuje rychlým nástupem účinku (v řádu minut). Délka trvání účinku je přitom u prvních dvou jmenovaných léčiv velmi krátká – přibližně pouhých 30 min (pozn. tento problém se netýká orfenadrinu, jehož účinek trvá 6–8 h). Tabletové formy myorelaxancií (guaifenesin, mefenoxalon a tizanidin) mají navzdory perorálnímu podání srovnatelně rychlý nástup účinku (20–30 min), mefenoxalon a tizanidin navíc disponují i dlouhým trváním účinku (6–8 h). Použití perorálních forem podporuje i finanční srovnání – perorální terapie vychází asi na 20 Kč/den, naproti tomu intravenózní podání např. frekventně používaného guaifenesinu je 3× dražší (údaje platné k 8. 3. 2021).
Použití KS v terapii VAS lze zvážit u pacientů s nedostatečnou odezvou na terapii NSA, paracetamolem a slabými opioidy. I v takovém případě je však možné považovat jejich podání pouze za terapeutický pokus.
Biologická dostupnost KS po perorálním podání je vysoká (cca 90 %), a nelimituje tedy využitelnost této cesty podání. Základní cena obou lékových forem dexametasonu je srovnatelná (cca 8–10 Kč za 1 dávku à 8 mg); u infuze je však nutné dále započítat náklady na nosný roztok a infuzní set.
Systémové podání LA v indikaci intravenózní analgezie je vedeno snahou snížit spotřebu opioidů, a redukovat tak jejich NÚ. Z důvodu zatím nedostatečné evidence lze použití LA v terapii VAS zvážit pouze v případě, kdy není možné použít NSA a/nebo opioid nebo pokud pacient přichází s intenzivní (krutou) akutní bolestí.
Perorální podání je v případě LA bezpředmětné.
Perorální podání léčiv v terapii VAS se zdá být ve většině případů a v různých ohledech vhodnější než podání intravenózní. Intravenózní terapie by tak mohla zůstat vyhrazena pro specifické situace (vč. využití placebo efektu injekční aplikace).
V případě nutnosti podat léčiva parenterálně se jako atraktivní řešení jeví hromadně vyráběný přípravek kombinující diklofenak (NSA) a orfenadrin (centrální myorelaxans a analgetikum). Přípravek je určen k podání bez nutnosti předchozí přípravy či úpravy (snižuje se tak riziko chyb při přípravě/úpravě), výrobce přitom deklaruje vzájemnou kompatibilitu obou složek i kompatibilitu této směsi s dalšími léčivými látkami (např. s dexametasonem, lidokainem či metoklopramidem). Výhodou je délka trvání účinku až 12 h, potenciální nevýhodou pak potřeba podání pomalou, 1,5–2h infuzí a vyšší cena.
Alternativou je použití AMI s ověřenou kompatibilitou/stabilitou složek. Příkladem jsou zde testované směsi č. 1 a 2 – z výsledků provedené stabilitní studie je zřejmé, že léčivé látky obsažené v těchto směsích jsou vzájemně kompatibilní a po sledovanou dobu stabilní. V průběhu času došlo k poklesu koncentrace pouze u metamizolu, a to za vzniku jeho hydrolyzovaného produktu 4-MAA. Dle literárních zdrojů se jedná o aktivní metabolit, který vzniká v organizmu i po standardním podání pacientovi (tj. in vivo). [23] Je nutné upozornit na to, že zjištěná příznivá stabilitní data lze vztáhnout pouze na testované směsi, nikoliv obecně na všechny AMI používané v ČR.
Závěr
Racionalizace používání AMI vyžaduje komplexní přístup. Pracovní skupina kriticky zhodnotila složení a způsob podávání AMI s cílem poukázat na slabá místa stávajících preskripčních zvyklostí. Skupina doporučuje zvažovat použití perorálních forem léčiv (v dostatečné dávce). V případě, že bude přistoupeno k podání AMI coby doplňkové terapie, pak s racionálním složením jak ve smyslu terapeutického cíle, tak ve smyslu stability a kompatibility jednotlivých složek, ve vhodném dávkovacím schématu a délce infuze.
Etické aspekty
Pro tento typ odborného sdělení není nutný souhlas etické komise.
Konflikt zájmů
Autoři deklarují, že v souvislosti s předmětem studie nemají žádný konflikt zájmů.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.PharmDr. Irena Murínová
Oddělení klinické farmacie
ÚVN – VFN, Praha
U Vojenské nemocnice 1200
169 02 Praha
e-mail: irena.murinova@uvn.cz
Přijato k recenzi: 22. 3. 2021
Přijato do tisku: 8. 10. 2021
Sources
1. Ambler Z. Základy neurologie. Praha: Galén 2011.
2. Zdravotnická ročenka České republiky 2018. [online]. Dustupné z URL: https: //www.uzis.cz/res/f/008280/zdrroccz-2018.pdf.
3. Hakl M. Léčba bolesti: současné přístupy k léčbě bolesti a bolestivých syndromů. Praha: Mladá fronta 2019.
4. ČOSKF ČLS JEP, Pracovní skupina pro ředění a podávání léčiv. [online]. Dostupné z URL: https: //www.coskf.cz/spolecnost/pracovni-skupiny/pracovni-skupina-pro-redeni-a-podavani-leciv/.
5. Sarver J, Pryka R, Alexander K et al. Stability of magnesium sulfate in 0.9% sodium chloride and lactated ringers solutions. Int J Pharm Compd 1998; 5 (2): 385–388.
6. Solomon D. UpToDate, NSAIDs: Therapeutic use and variability of response in adults, Topic 7993 Version 23.0. [online]. Available from URL: https: //somepomed.org/articulos/contents/mobipreview.htm?19/50/20271? source=see_link.
7. Solomon D. UpToDate, NSAIDs: Pharmacology and mechanism of action, Topic 7989 Version 17.0. [online]. Available from URL: https: //www.uptodate.com/contents/nsaids-pharmacology-and-mechanism-of - action.
8. SÚKL. Databáze léků, Souhrnu údajů o přípravku. [online]. Dostupné z URL: http: //www.sukl.cz/modules/medication/search.php.
9. Vymazal T, Urbánek K. Léčba bolesti fixní kombinací orfenadrinu a diklofenaku. Klin Farmakol Farm 2018; 32 (3): 26–33.
10. UpToDate, orphenadrine: drug information, Lexicomp, Topic 9722 Version 259.0. [online]. Available from URL: https: //somepomed.org/articulos/contents/mobipreview.htm?30/57/31645?source=HISTORY.
11. van Tulder MW, Touray T, Furlan AD et al. Muscle relaxants for non-specific low-back pain. Cochrane Database Syst Rev 2003; 2003 (2): CD004252. doi: 10.1002/1465 1858.CD004252.
12. Qaseem A, Wilt T, McLean R et al. Noninvasive treatments for acute, subacute, and chronic low back pain: a clinical practice guideline from the American College of Physicians. Ann Intern Med 2017; 166 (7): 514–530. doi: 10.7326/M16-2367.
13. Knight L, Deyo A, Staiger O et al. UpToDate, Treatment of acute low back pain, Topic 7780 Version 55.0. [online]. Available from URL: https: //www.scribd.com/document/401441417/Treatment-of-Acute-Low-Back-Pain-UpToDate.
14. Chou R, Deyo R, Friedly J et al. Nonpharmacologic therapies for low back pain: a systematic review for an American College of Physicians Clinical Practice Guideline. Ann Intern Med 2017; 166 (7): 493–505. doi: 10.7326/M16-2459.
15. Friedman B, Holden L, Esses D et al. Parenteral corticosteroids for emergency department patients with non-radicular low back pain. J Emerg Med 2006; 31 (4): 365–370. doi: 10.1016/j.jemermed.2005.09. 023.
16. Eskin B, Shih R, Fiesseler F et al. Prednisone for emergency department low back pain: a randomized controlled trial. J Emerg Med 2014; 47 (1): 65–70. doi: 10.1016/j.jemermed.2014.02.010.
17. Levin K, Hsu P, Armon C. UpToDate, Acute lumbosacral radiculopathy: treatment and prognosis, Topic 5259 Version 31.0. [online]. Available from URL: https: //www.uptodate.com/contents/acute-lumbosacral-radiculopathy-treatment-and-prognosis.
18. Levin K. UpToDate, Lumbar spinal stenosis: Treatment and prognosis, Topic 7781 Version 13.0. [online]. Available from URL: https: //www.uptodate.com/contents/lumbar-spinal-stenosis-treatment-and - prognosis.
19. Chou R. UpToDate, Subacute and chronic low back pain: nonsurgical interventional treatment, Topic 7768 Version 38.0. [online]. Available from URL: https: //www.uptodate.com/contents/subacute-and-chronic-low-back-pain-nonsurgical-interventional-treatment.
20. Firouzian A, Alipour A, Dezfouli H et al. Does lidocaine as an adjuvant to morphine improve pain relief in patients presenting to the ED with acute renal colic? A double-blind, randomized controlled trial. Am J Emerg Med 2016; 34 (3): 443–448. doi: 10.1016/j.ajem.2015.11.062.
21. Loj E, Scherber K, Cabrera D et al. Safety and efficacy of intravenous lidocaine for pain management in the emergency department: a systematic review. Ann Emerg Med 2018; 72 (2): 135–144.e3. doi: 10.1016/j.annemergmed.2017.12.014.
22. Tanen D, Shimada M, Danish D et al. Intravenous lidocaine for the emergency department treatment of acute radicular low back pain, a randomized controlled trial. J Emerg Med 2014; 47 (1): 119–124. doi: 10.1016/j.jemermed.2012.12.014.
23. Giorgi M, Łebkowska-Wieruszewska B, Lisowski A et al. Pharmacokinetic profiles of the active metamizole metabolites after four different routes of administration in healthy dogs. J vet Pharmacol Therap 2018; 41: 428–436. doi: 10.1111/jvp.12484.
Labels
Paediatric neurology Neurosurgery Neurology
Article was published inCzech and Slovak Neurology and Neurosurgery

2021 Issue 5-
All articles in this issue
- Ofatumumab – nová možnost vysoce účinné terapie relabujících forem roztroušené sklerózy
- Hereditární gelsolinová amyloidóza – klinické projevy a molekulárně genetická příčina
- Ovlivňují iniciální klinické symptomy výsledný stav pacientů s ischemickým iktem a rekanalizační léčbou?
- Analgeticko-myorelaxační infuze v terapii vertebrogenního algického syndromu – technologické a klinické aspekty
- Srovnání vlivu první a druhé vlny pandemie COVID-19 na počty hospitalizovaných pacientů s ischemickou cévní mozkovou příhodou, na jejich diagnostiku, léčbu a prognózu
- První zkušenosti s využitím přímé monitorace sluchového nervu u operací vestibulárního schwannomu v České republice
- Ultrasonograficky navigovaný léčebný obstřik sakroilického kloubu
- Fatická porucha u migrény s aurou – videokazuistika
- Syndrom progresivní ataxie a palatálního tremoru u pacienta s mírnou idiopatickou bilaterální hypertrofií olivárního jádra
- Recenze knihy
- Cenu J. E. Purkyně 2021 obdržel neurochirurg prof. MUDr. Eduard Zvěřina, DrSc., FCMA
- Neuroradiologické charakteristiky a klinické výsledky u pacientů intoxikovaných metanolem
- Zpráva o epikraniální arteriovenózní malformaci
- Okluze velkých mozkových tepen u nemocné se svalovou dystrofií Emery-Dreifuss
- Meningeální forma Rosai-Dorfmanovy choroby
- Czech and Slovak Neurology and Neurosurgery
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Analgeticko-myorelaxační infuze v terapii vertebrogenního algického syndromu – technologické a klinické aspekty
- Ofatumumab – nová možnost vysoce účinné terapie relabujících forem roztroušené sklerózy
- Ultrasonograficky navigovaný léčebný obstřik sakroilického kloubu
- Syndrom progresivní ataxie a palatálního tremoru u pacienta s mírnou idiopatickou bilaterální hypertrofií olivárního jádra
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

