-
Medical journals
- Career
Difuzní nízkostupňové gliomy
Authors: D. Konečná; D. Netuka
Authors‘ workplace: Neurochirurgická a neuroonkologická klinika 1. LF UK a ÚVN Praha
Published in: Cesk Slov Neurol N 2020; 83/116(5): 467-490
Category: Minimonography
doi: https://doi.org/10.14735/amcsnn2020467Overview
Difuzní nízkostupňové gliomy (stupeň II) jsou heterogenní neuroepiteliální tumory, které se vyznačují infiltrativním růstem a histologicky nesplňují kritéria pro diagnózu vysokostupňového gliomu (stupeň III, IV). I přes signifikantně nižší incidenci ve skupině primárních mozkových tumorů si zasluhují plnou pozornost z důvodu častého výskytu u mladších pacientů a závažných důsledků plynoucích z růstu tumoru i onkologické léčby na jejich další život. Rozvoj na poli histopatologie, cytogenetiky a zobrazovacích metod postupem času vede ke zpřesňování diagnostiky a individualizaci léčebného postupu. Hlavní léčebnou metodou je v současnosti radikální chirurgické odstranění tumoru s důrazem na minimalizaci rizika vzniku nového neurologického deficitu. I přes zdánlivě dostatečnou šíři resekce bývají do léčebného protokolu zahrnuty další metody, jako jsou radioterapie a/nebo chemoterapie. Načasování a modifikace adjuvantní terapie závisí na specifických molekulárních vlastnostech gliomů v kombinaci s dalšími prognostickými faktory. Dosáhnutí plného vyléčení difuzních nízkostupňových gliomů je však nemožné, a to především z důvodu jejich infiltrativního růstu. Hlavním cílem neurochirurgického výkonu a onkologické léčby je tak oddálit čas do progrese a následné dediferenciace a tím prodloužit život těchto pacientů se snahou co nejvíce zachovat kvalitu jejich života. Článek si dává za cíl shrnout dosavadní poznatky o difuzních nízkostupňových gliomech.
Klíčová slova:
gliom – astrocytom – oligodendrogliom – záchvaty – chirurgie – chemoterapie – radioterapie – kvalita života
Úvod
Difuzní infiltrující nízkostupňové gliomy (diffuse low grade gliomas; dLGG) představují přibližně 5 % všech primárních mozkových nádorů, ve skupině gliových nádorů však až 30 % [1]. Jedná se o heterogenní skupinu neuroepiteliálních tumorů, které vycházejí z podpůrných gliových buněk CNS. Podle původu nádorových buněk zahrnují astrocytom a oligodendrogliom. Klasifikace Světové zdravotnické organizace (World Health Organization; WHO) z roku 2016 aktualizovala definici těchto nádorů a zahrnula jejich molekulární charakterizaci, vč. přítomnosti mutace izocitrátdehydrogenázy (IDH) a 1p/19p kodelece. Rozdělení dLGG na základě molekulárních charakteristik je uvedeno ve schématu (obr. 1). V této nové klasifikaci byl odstraněn histologický subtyp smíšený oligoastrocytom stupně II. Oproti LGG WHO stupně I nelze dLGG WHO stupně II považovat za nádory benigního charakteru. Jejich růst je typicky difuzní a infiltrativní, nádorové buňky prorůstají podél vláken bílé hmoty a nalézají se i 20 mm od zdánlivého okraje tumoru na obrazech T2/FLAIR (fluid attenuated inversion recovery) MR. Vzhledem k popsanému charakteru růstu těchto tumorů je vyloučena kurabilita chirurgické resekce, a to i při resekci totální či supratotální. Primárním cílem tedy nemůže být vyléčení pacienta, ale co možná nejdelší doba bez příznaků a oddálení maligní transformace do vysokostupňového gliomu (high grade glioma; HGG). Tím lze předejít zhoršování neurologických a kognitivních symptomů a v konečném důsledku prodloužit přežívání pacientů za celkově lepší kvality života [1].
Image 1. Molekulární charakteristika difuzních nízkostupňových gliomů.
Molecular characteristics of diff use low grade gliomas.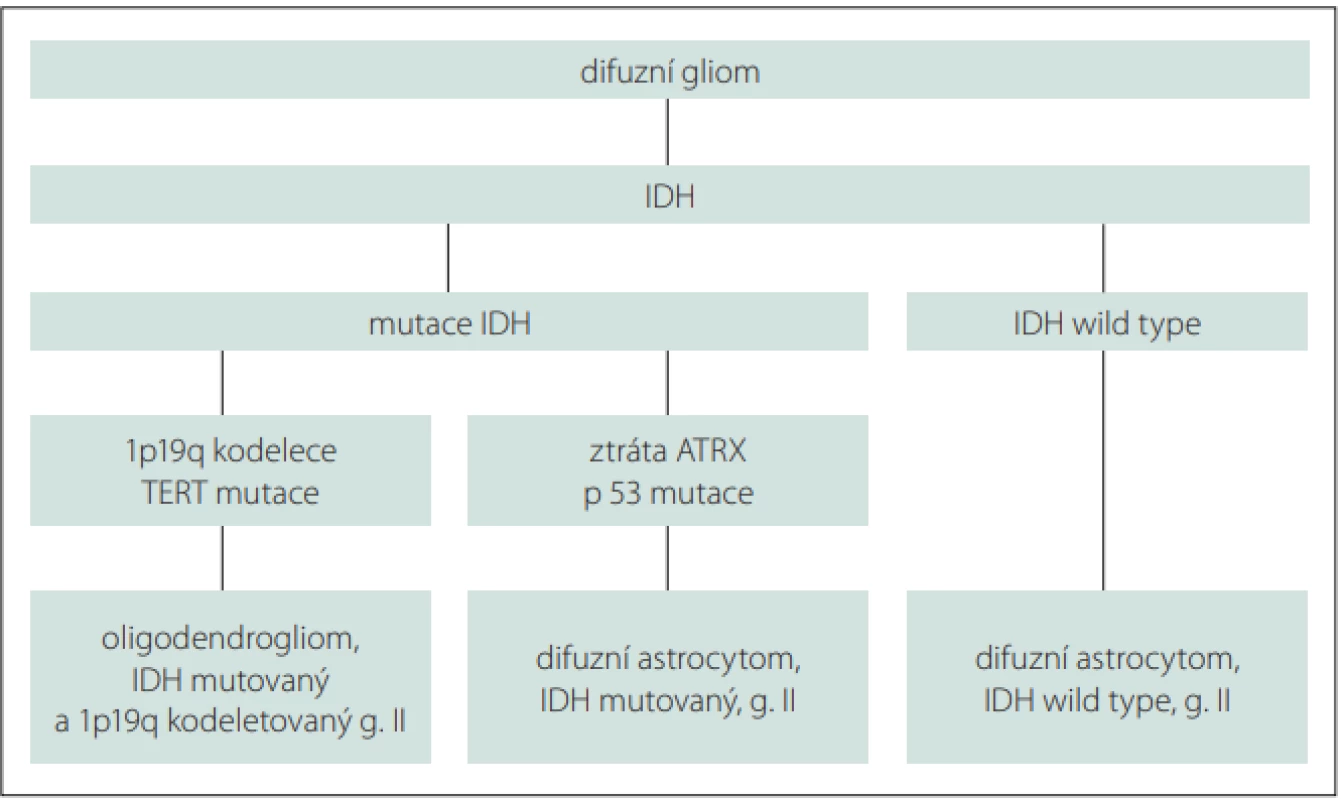
ATRX – gen asociovaný s alfa talasemií/X-vázaným syndromem mentální retardace; IDH – izocitrátdehydrogenáza; TERT – telomerázová reverzní transkriptáza
ATRX – alpha thalassemia/mental retardation syndrome X-linked gene; IDH – isocitrate dehydrogenase; TERT – telomerase reverse transcriptaseDifuzní LGG jsou spojeny s celou řadou příznaků, jako jsou záchvaty, kognitivní poruchy nebo fokální neurologický deficit, nicméně mnoho z nich je v současné době diagnostikováno zcela náhodně v rámci vyšetření mozku ze zcela jiné indikace [2].
Strategie léčby se u dLGG u dospělých v posledních letech změnila a nyní míří na aktivní chirurgický přístup a individualizovanou onkologickou léčbu [1]. Současná doporučení pro následnou léčbu po operaci jsou založena na evidenci střední a nízké úrovni kvality důkazů. Klinické studie, které se zaměřily na význam a načasování radioterapie a chemoterapie, společně hodnotily pacienty s astrocytárními a oligodendrogliálními nádory. Stejně tak nebyly brány v potaz molekulární markery (IDH mutace a 1p/19q kodelece). Tento fakt tak zkomplikoval interpretaci výsledků [2]. Z důvodu relativně dlouhého přežívání pacientů s dLGG je potřeba, aby klinické studie probíhaly dostatečně dlouho k získání validních výsledků. Bylo však již prokázáno, že včasnou, multimodální a personalizovanou terapií může dojít ke zdvojnásobení průměrné doby přežití u těchto pacientů. Ta se momentálně pohybuje mezi 3 a 10 lety od stanovení diagnózy v závislosti na různých prognostických faktorech (věk, velikost tumoru, přítomnost neurologického defektu, dostatečná šíře resekce, histologický typ a přítomnost či absence specifických molekulárních markerů). Tyto prognostické faktory pak ovlivňují následnou léčebnou strategii [1]. Léčebné postupy mohou být optimalizovány pouze spoluprací multidisciplinárního týmu složeného z neurochirurgů, neurologů, klinických onkologů, radiačních onkologů, neuroradiologů, neuropatologů a psychologů, kteří společně vedou léčbu těchto pacientů [2].
Difuzní astrocytom, WHO stupeň II
Nejrozšířenějším typem difuzního astrocytomu WHO stupně II je IDH mutovaný gliom. Jeho variantou je tzv. gemistocytární WHO II astrocytom charakterizovaný přítomností gemistocytů, které by měly být přítomny alespoň ve 20 % všech nádorových buněk [3].
Maximálně radikální resekce je čím dál více považována za základní léčebnou strategii. Observace pacientů s domnělým WHO IIgliomem bez histologické verifikace je prováděna méně často, dokonce i u pacientů s náhodně zjištěnými lézemi. Observace u mladších pacientů (s arbitrárně stanovenou věkovou hranicí 40 let) se záchvaty je vhodná jen po chirurgické resekci, nikoliv jako primární léčebný postup.
Radioterapie by měla být zvážena u pacientů starších 40 let po nekompletní resekci. Pacientům po radioterapii (50 Gy) se prodlouží přežití bez progrese tumoru, avšak nikoli doba celkového přežití [4]. Chemoterapie jako primární léčebná modalita by měla být použita v rámci výzkumných protokolů. Lze ji indikovat i u rozsáhlých nádorů, kde resekce není smysluplná. Přežití bez progrese nádoru je zřejmě kratší než po radioterapii [5].
Studie RTOG 9802 Trial 115 porovnala chemoradioterapii vs. radioterapii po částečné resekci nebo biopsii WHO II gliomu u mladších pacientů (18–39 let) a pacientů nad 40 let. Randomizovaná studie prokázala, že přidání chemoterapie prokarbazinu, lomustinu a vinkristinu k radioterapii (54 Gy) vedla k celkovému přežití 13,3 vs. 7,8 roku u pacientů, kteří podstoupili radioterapii samotnou. Radioterapie následovaná chemoterapií prokarbazinem, lomustinem a vinkristinem by měla představovat nový standard péče, dokud nebudou ukončeny právě probíhající studie. Studie RTOG 9802 taktéž prokázala delší celkové přežití pacientů léčených chemoradioterapií v různých histologických podskupinách. V případě progrese nálezu závisí další postup na klinickém stavu pacienta, rozsahu a typu růstu nádoru [6].
Při progresi tumoru je obvykle indikována reoperace. Poté následuje radioterapie u dříve neozářených pacientů nebo chemoterapie alkylačními cytostatiky. Temozolomid je často preferován oproti prokarbazinu, lomustinu a vinkristinu vzhledem k malému výskytu nežádoucích účinků a snadnému podávání.
Oligodendrogliom, WHO stupeň II
Oligodendrogliomy jsou definovány jako IDH mutované a 1p/19q kodeletované nádory WHO stupně II. Ve vzácných případech, kdy není k dispozici informace o kodeleci, jsou tyto nádory hodnoceny jako oligodendrogliomy NOS (not otherwise specified). Nová klasifikace nedoporučuje použití termínu oligoastrocytom. Používá ho pouze v situaci, kdy není k dispozici informace o IDH mutaci, kodeleci 1p/19q a histologický nález výrazně připomíná smíšený oligoastrocytární nádor [6].
Chirurgická resekce je u tumoru tohoto typu primární léčebnou modalitou. Sledování pomocí MR je vhodné u pacientů po radikální resekci oligodendrogliomu a u mladších pacientů (věk pod 40 let) po parciální resekci. To platí, pokud se u nich vyskytnou nanejvýše záchvaty a nemají neurologický deficit. Pokud je indikována onkologická léčba po resekci tumoru, standardem pro ni je radioterapie s následující chemoterapií prokarbazinem, lomustinem a vinkristinem [6].
IDH-wild type nízkostupňové gliomy
Nízkostupňové gliomy, u kterých chybí mutace IDH (IDH-wild type), tvoří relativně malý podíl všech LGG a mají významně horší prognózu ve srovnání s IDH mutovanými nádory [7]. Tyto tumory mohou progredovat velmi agresivně, u starších pacientů se často chovají obdobně jako glioblastom, ale existují i méně agresivní varianty.
Neexistují žádné randomizované studie, které by se zaměřily na IDH-wild type dLGG. Tyto nádory jsou taktéž nedostatečně zastoupeny ve starších studiích, vč. studie RTOG 9802. Některé z těchto nádorů nesou molekulární změny pozorované u glioblastomů (např. mutace TERT [telomerase reverse transcriptase], ztráta heterozygozity chromozomu 10). U těchto nádorů je vhodná okamžitá onkologická pooperační léčba bez ohledu na rozsah resekce nádoru nebo na jiné prognostické faktory. Není jasné, zda léčit IDH-wild type LGG pomocí radioterapie a chemoterapie za použití PCV (prokarbazin, lomustin, vinkristin) nebo konkomitantní chemoradioterapií s temozolomidem a následným adjuvantním podáváním temozolomidu. Použití stejného protokolu jako u glioblastomů (Stuppův režim) je založeno na skutečnosti, že IDH-wild type astrocytom má velmi podobné biologické chování a prognózu jako primární glioblastom [8].
Diagnostika
Klinické příznaky
Nejčastějším iniciálním příznakem vedoucím k diagnóze LGG je prodělaný epileptický záchvat (viz níže). Dalšími příznaky mohou být fokální neurologické deficity, které jsou však méně obvyklé u pacientů s difuzními astrocytomy, jejich rozvoj trvá roky. Příznaky z nitrolební hypertenze jsou relativně vzácné, častěji se vyskytují u pacientů s tumory v zadní jámě lební nebo s intraventrikulárními nádory [9].
S LGG asociované epileptické záchvaty a jejich léčba
Nízkostupňové gliomy představují nejvíce epileptogenní entity v porovnání s ostatními mozkovými tumory. Celkem 70–90 % pacientů s těmito nádory je diagnostikováno na základě prodělaného epileptického záchvatu, kterému často předcházejí jiné symptomy intrakraniální neoplazie. Mohou být přítomny již ve fázi, kdy lze na MR diferencovat pouze diskrétní patologické změny [9]. Zdá se, že snížení frekvence záchvatů lépe koreluje se sníženým vychytáváním methioninu na PET [11]. Záchvaty přetrvávají až u poloviny pacientů, a to i přes adekvátní léčbu antiepileptiky (antiepileptic drugs; AED) [9]. Nekontrolované záchvaty mohou vést ke zvýšené morbiditě a negativně ovlivnit kvalitu života těchto pacientů [10].
S tumorem asociované epileptické záchvaty (brain tumour related epilepsy; BTRE) se projevují jako jednoduché či komplexní parciální záchvaty se sekundární generalizací i bez ní [11]. Parciální záchvaty se mohou manifestovat motorickými, senzitivními a/nebo senzorickými projevy, komplexní se však od jednoduchých záchvatů liší přítomnou alterací vědomí. Všechny BTRE se sekundární generalizací mají parciální začátek, který však nemusí být klinicky evidentní [12]. Jednoduché parciální záchvaty mají větší tendenci k rozvoji farmakorezistence než záchvaty sekundárně generalizované. Také není vyloučena existence duální patologie, tedy přítomnost mozkového tumoru a např. hipokampální sklerózy [11].
Na jejich manifestaci mohou mít vliv věk pacienta, velikost, lokalizace, histologické vlastnosti a biologické chování tumoru. U pacientů s LGG starších 60 let se záchvaty vyskytly v 47 % oproti 85 % v mladší věkové kategorii [11]. Bylo zjištěno, že LGG větších rozměrů se spíše než jinými symptomy projevují záchvaty, u HGG je tomu právě naopak [11]. Není nicméně zcela jasné, zda velikost tumoru predisponuje ke špatné kontrole záchvatů [9]. Signifikantně vyšší riziko vzniku záchvatů je u gliomů v juxtakortikální lokalizaci oproti hluboko uloženým ložiskům [9]. S tím souvisí i větší četnost paroxysmů u oligodendrogliomů, které častěji zahrnují kortex než astrocytární tumory [11]. Ložiska ve frontálním, temporálním či parietálním laloku se spíše projeví záchvatem než ta, která jsou uložena v laloku okcipitálním nebo infratentoriálně. Pokud zahrnují insulární či mesiotemporální oblast, je zvýšené riziko farmakorezistentních epileptických paroxysmů [9]. Relativně nedávné studie poukázaly na vyšší četnost záchvatů u LGG exprimujících IDH mutaci, v jedné studii konkrétně u 70 % těchto nádorů [12]. Dalším rizikovým faktorem vzniku záchvatů je rychlost růstu nádorů, kdy se u jejich jednotlivých typů různí epileptogenní cesty. U pomalu rostoucích gliomů rozvoj záchvatů souvisí s deaferentací a funkčně s diskonekcí kortikálních oblastí více než s narušením mikrocirkulace nebo přímým poškozením mozkové tkáně [9].
Mechanizmus vzniku záchvatů u těchto pacientů je velmi komplexní a daleko přesahuje rozsah předkládaného textu. V poslední době jsou studovány změny v peritumorální tkáni. Neuronální hustota v hipokampu pacientů s mesiální epilepsií temporálního laloku a gliomy je normální, nicméně peritumorální buňky mají často anomální fenotyp. Morfologické změny zahrnují aberantní migraci s perzistujícími neurony v bílé hmotě a neurony s menším počtem inhibičních a větším počtem excitačních synapsí. Imunohistochemické studie prokázaly změny exprese konexinů v nádorových buňkách a reaktivních astrocytech v perilesionálním kortexu u pacientů s difuzními gliomy a záchvaty. Moderní zobrazovací techniky poskytují důkazy, že peritumorální mikroprostředí se podstatně liší od normální mozkové tkáně: MR spektroskopie prokázala snížené hladiny N-acetylaspartátu (NAA). Různé změny zvyšují rizika generalizace záchvatů. Nádor může mechanicky stlačit okolní prostředí normální tkáně, indukovat ischemii, hypoxii a acidózu. Funkčním následkem nízkého pH je deregulace natria a přítok kalcia přes buněčné membrány. Změny iontových koncentrací mohou přispět k excitabilitě neuronů a fokálnímu narušení hematoencefalické bariéry a tím ke vzniku epileptogenního ložiska. Nádory mozku a peritumorální tkáň mají změněnou expresi neurotransmiterů a jejich receptorů. Větší koncentrace glutamátu, hlavního excitačního neurotransmiteru, byla nalezena u pacientů s epilepsií. Změny v úrovních GABA, hlavního inhibičního neurotransmiteru, mohou též přispívat ke vzniku záchvatů [11].
Při manifestaci LGG epileptickým zá-chvatem je doporučeno podávání AED [11]. U pacientů s ojedinělými záchvaty a difuzním gliomem vede časná léčba AED k prodloužení doby do opakování záchvatů bez zhoršení kvality života nebo zvýšení výskytu vážných komplikací [13]. AED můžeme velmi zjednodušeně rozdělit na léky starší (např. fenobarbital, fenytoin, karbamazepin, valproát, etosuximid) a léky nové generace (např. levetiracetam, lamotrigin, pregabalin, tiagabin, topiramát). Studie zaměřené na efekt starší generace AED na kontrolu záchvatů udávají souhrnně 70% výskyt rekurentních záchvatů u pacientů léčených těmito farmaky [11]. AED nové generace jsou předmětem řady studií, které se ve většině případů zaměřují na efekt levetiracetamu. Toto AED se vyznačuje významným účinkem stran redukce záchvatů. Výhoda levetiracetamu dále spočívá v jeho relativně dobré toleranci s výskytem mírnějších nežádoucích účinků, které mohou zahrnovat únavu či závratě. Důležitou vlastností AED při léčbě BTRE, kterou levetiracetam splňuje, je nízká míra lékových interakcí se souběžně probíhající chemoterapií či kortikoterapií. Starší typy AED mohou cestou indukce řady enzymů zvyšovat či snižovat metabolizmus jiných léků. Např. valproát svými inhibičními vlastnostmi ovlivňuje funkci enzymů hrajících významnou roli v redukci plazmatické koncentrace některých chemoterapeutik (např. nitrosourey). Takový nežádoucí efekt může vést ke zvýšení toxicity protinádorové léčby. Jinými chemoterapeutiky, jejichž farmakodynamika může být ovlivněna podáváním AED, jsou např. paclitaxel, cyklofosfamid nebo topotecan. Dalším příkladem je interakce některých enzym-indukujících AED s metabolizmem kortikoidů. Výsledkem je zvýšený metabolizmus těchto antiedematózních léků s jejich zrychleným odbouráváním vedoucí k neadekvátní kontrole peritumorózního edému. Další nesnází při léčbě BTRE je rozvoj farmakorezistence. V nádorových buňkách gliomů byla zjištěna zvýšená exprese transportních proteinů, které za pomoci aktivního transportu znemožňují řadě lipofilních léčiv přestup přes hematoencefalickou bariéru a tím negativně ovlivňují jejich účinné koncentrace v mozkové tkáni. Tento problém se netýká levetiracetamu či valproátu, které se nejeví jako substrát pro tyto transportéry [11]. Dále byla vznesena otázka, zda je vhodné podávat AED jako profylaxi u pacientů s LGG bez epileptického záchvatu v anamnéze. Vzhledem k možnému negativnímu ovlivnění kvality života těchto déle přežívajících pacientů (hlavně neurokognice) a nejasným výsledkům řady studií není v nynější době profylaktické podávání AED doporučeno [11]. Často se však užívají jako profylaxe perioperačních záchvatů, v případě příznivého průběhu je na místě uvažovat o snížení dávky či úplném vysazení [10].
Většina studií ukazuje na pozitivní korelaci mezi záchvatem jako iniciálním příznakem a délkou přežití pacienta. Je důležité si uvědomit, že přítomnost záchvatů je prediktor příznivého výsledku pouze tehdy, pokud je přítomen jako jediný počáteční příznak. Pokud má pacient mimo záchvat kognitivní deficit nebo není celkově v dobrém klinickém stavu, tak je prognóza spíše nepříznivá. Přítomnost záchvatů, absence neurologických příznaků a/nebo kognitivní deficit a dobrý klinický stav jsou tři vzájemně provázané parametry [9]. Mnohé z dřívějších studií o přežití u pacientů s chronickou epilepsií zahrnovaly histopatologicky velmi benigní léze, jako gangliogliomy, pilocytární astrocytomy a dysembryonální neuroepiteliální nádory [14]. Při analýze přežití pacientů s nádory WHO stupně II je dlouhá anamnéza záchvatů spojena s vyšším rizikem progrese nádoru a smrti. To je v souladu se současným názorem, že maligní transformace nakonec nastane ve většině, ne-li u všech gliomů druhého stupně. Otázkou zůstává, zda spojení mezi dlouhou dobou záchvatů a vyšším rizikem maligní transformace platí pro všechny tyto tumory. Některé histologické podtypy nádorů mohou mít u pacientů s chronickou epilepsií indolentní průběh bez rizika transformace nádoru [15].
S postupujícími znalostmi je stále více evidentní významný přínos protinádorové terapie z hlediska efektivní kontroly BTRE. Redukce četnosti či jejich plné vymizení vede k signifikantnímu benefitu pro pacienty s LGG a týká se jak chirurgické léčby, tak radioterapie a chemoterapie [10]. Na tomto výstupu se také podílí míra předoperační kontroly záchvatů pomocí AED a doba jejich výskytu v anamnéze [11]. Avila et al v roce 2017 publikovali práci podtrhující význam kontroly epilepsie u pacientů s LGG. Kontrola záchvatů má přímý vztah ke kvalitě života pacientů a možnosti provádění běžných každodenních aktivit. Pacienti s dobře zvládnutými záchvaty mají také nižší morbiditu a úmrtnost. Do hodnocení se zdravím související kvality života je nezbytná informace ohledně úspěšnosti kontroly záchvatů a taktéž údaj o užívání AED [12].
Signifikantní kontroly BTRE lze dosáhnout dle řady studií pomocí chirurgické léčby LGG. Touto cestou lze pozitivně ovlivnit i farmakorezistentní případy. Nejlepší výsledky lze dosáhnout po radikální resekci tumoru, kdy dle kontrolní MR došlo k vyjmutí všech nádorových hmot patrných na sekvenci FLAIR [11]. Englot et al publikovali přehled zahrnující 773 pacientů, u kterých identifikovali faktory ovlivňující kontrolu záchvatů po operační léčbě. Nejsilnějším prediktorem pro vymizení záchvatů byla radikální resekce, kde při kontrole po 6 měsících od operace 71 % pacientů bylo bez záchvatů (Engel I) a u 29 % z nich v různé frekvenci záchvaty pokračovaly (Engel II–IV) [16]. Chang et al v sérii 332 pacientů zaznamenali vymizení záchvatů u většiny pacientů i po 12 měsících od operace a pouze 9 % pacientů bylo bez zlepšení nebo se zhoršením [17]. S pooperační kontrolou záchvatů také souvisí přítomnost záchvatů před operací. Pacienti, jejichž záchvaty před operací dobře reagovaly na podávání AED a které trvaly méně než 1 rok, měli jejich lepší kontrolu po operační léčbě. Rozdílný efekt operační léčby nebyl prokázán mezi tumory temporálními či extratemporálními [11]. Z hlediska typu resekce je důležitá znalost epileptogenní zóny, která může často zasahovat extratumorálně, a to hlavně v případě temporálních či paralimbických gliomů. Při resekcích gliomů u pacientů s BTRE, které trvají méně než rok, se na rozdíl od epileptochirurgických výkonů obvykle nevyužívá elektrokortikografie k posouzení epileptogenní zóny. V ostatních případech chronických epileptických záchvatů však může pomoci k rozšíření resekce a zlepšení pooperační kontroly záchvatů [12]. Některé studie porovnávaly efekt prosté lesionektomie oproti lesionektomii kombinované s hipokampektomií u pacientů s farmakorezistentními záchvaty. Bylo pozorováno zlepšení kontroly záchvatů po provedené rozšířené resekci [11,14,18]. Výsledky operační léčby se zde dramaticky zlepšily v důsledku zvýšeného používání vyspělých předoperačních zobrazovacích metod (funkční MR [fMR], DWI [diffusion weighted imaging], DTI [diffusion-tensor imaging]), intraoperačních mapovacích metod, awake operací. Tyto pokročilé postupy umožňují radikálnější resekci bez poškození funkčních oblastí [11].
Reoperace recidivujících LGG je terapeutickou možností, která může zlepšit kontrolu záchvatů. Reoperace v elokventních oblastech pro recidivu gliomu byla dříve považována za příliš rizikovou. Dnes jsou k dispozici údaje o plasticitě mozku po první operaci a s pomocí funkčního testování během operace je možné reoperace nejen provádět s malými riziky pooperačního neurologického deficitu, ale i s vysokou mírou kontroly záchvatů [19].
V kontrole záchvatů u pacientů s LGG hrají významnou roli i radioterapie a chemoterapie. Na toto téma Koekkoek et al publikovali review. Z hlediska radioterapie porovnávali účinky fokálního frakcionovaného ozáření, brachyterapie a stereotaktické radioterapie. Všechny studie zahrnuté v review pozorovaly zlepšení kontroly záchvatů po provedené radiaci. Ve třech studiích docházelo ke snížení frekvence epileptických záchvatů v rozmezí o více než 50–75 % u 72–100 % léčených pacientů [10]. Ve studii EORTC 22845 byl výskyt záchvatů po radioterapii hodnocen jako sekundární „endpoint“. U pacientů bez progrese nádoru 2 roky po zařazení do studie byl analyzován výskyt záchvatů. Lepší kontrola záchvatů byla pozorována u pacientů, kteří podstoupili radioterapii, ve srovnání s pacienty, kteří byli pouze observováni. Protože vstupně byly obě skupiny pacientů obdobné, lze usuzovat na pozitivní efekt radioterapie na redukci výskytu záchvatů [9]. Vymizení záchvatů bylo pozorováno v rozmezí od 20 % pacientů po fokálním ozáření do 80 % pacientů po 6 měsících od brachyterapie [20]. Plathow et al se ve své studii zaměřili na 143 pacientů s LGG léčených stereotaktickou radioterapií. Po zhodnocení míry kontroly záchvatů po 6 týdnech zjistili pokles výskytu záchvatů ze 70 % pacientů na 24 % [20]. Brachyterapií se mimo jiné zabývala studie, ve které bylo pozorováno vymizení záchvatů po 12 měsících u 56 % pacientů iniciálně trpících záchvaty [21].
Role chemoterapie při kontrole záchvatů u pacientů s LGG byla zdůrazněna řadou retrospektivních i prospektivních prací, ačkoli zatím neexistuje kontrolovaná randomizovaná studie na toto téma [12]. Snížení frekvence záchvatů bylo pozorováno bez ohledu na typ podávané chemoterapie (temozolomid, PCV) [12]. Pozitivní efekt této léčby se obvykle projeví klinickým zlepšením, tedy sníženou frekvencí záchvatů, a to i přes stabilní nález či minimální regresi na grafickém zobrazení [11]. Řada prací popisuje snížení četnosti záchvatů po chemoterapii a množství těchto pacientů se pohybovalo v rozmezí 48–100 % (z nich 20–40 % zcela bez záchvatů) mezi jednotlivými studiemi [11]. Dle studie, kterou provedli Brady et al, temozolomid vede ke snížení frekvence záchvatů. Pacienti zařazení do této studie neměli pooperační radioterapii [22]. Je zajímavé, že výrazně lepší kontrola záchvatů při podávání temozolomidu se vyskytuje u nádorů, které se nesytí po podání kontrastní látky [23]. V retrospektivní studii s výhradně paralimbickými LGG léčenými chirurgicky, chemoterapií nebo jejich kombinací bylo prokázáno, že chemoterapie vede k velmi dobré kontrole záchvatů. Pacienti léčení chemoterapií předtím nepodstoupili chirurgickou léčbu, přesto efekt na výskyt záchvatů byl signifikantní. Obdobné výsledky byly pozorovány i ve skupině léčené chirurgickou resekcí. Proto je na místě zvažovat kombinaci operace a chemoterapie i u pacientů s inzulárními gliomy a farmakorezistentní epilepsií [24]. V retrospektivní studii 66 pacientů s LGG a nekontrolovanými záchvaty léčených temozolomidem se u 44 % z nich snížila frekvence záchvatů. Z 66 pacientů jich 41 % dosáhlo vymizení záchvatů po 6 měsících od zahájení chemoterapie [25]. Hildebrand et al publikovali data o 234 po sobě jdoucích ambulantních pacientech léčených chemoterapií pro supratentoriální nádor. Z celkem 93 pacientů s gliomem stupně II jich 84 mělo záchvat jako iniciální příznak. U pacientů s progresí nálezu mělo 31 ze 43 pacientů farmakorezistentní epilepsii [26]. V prospektivní studii Pace et al hodnotili frekvenci záchvatů vždy po provedených 3 cyklech chemoterapie temozolomidem u pacientů s progresivním LGG a nekontrolovanou epilepsií. U 48 % těchto pacientů bylo pozorováno snížení četnosti záchvatů o více než 50 % [23]. Další studie retrospektivně porovnávala skupinu 39 pacientů s LGG léčených temozolomidem s kontrolní skupinou 30 pacientů, kteří byli pouze observováni. Redukce záchvatů o více než 50 % byla pozorována u 59 % pacientů léčených temozolomidem oproti 13 % v kontrolní skupině. Nicméně pouze u 18 % pacientů ze skupiny léčené temozolomidem došlo k tomuto zlepšení nezávisle na optimalizaci terapie AED. V kontrolní skupině žádný z pacientů bez optimalizované terapie AED nedosáhl snížení frekvence záchvatů [27].
Primárním „endpointem“ ve studiích zkoumajících nová léčiva v epilepsii je kontrola záchvatů na rozdíl od studií zaměřujících se na hodnocení efektu protinádorové terapie gliomů. Nekontrolované záchvaty mají velký dopad na funkce pacienta. Léčba nádorů mozku se hodnotí jejím přímým účinkem na přežití a samotnou chorobu dle grafického zobrazení. Radiologická regrese u WHO II gliomů je však obvykle pomalá a často obtížně měřitelná, klinické zlepšení tak často nebývá provázeno pozitivními změnami na MR. Naopak frekvence záchvatů je kvantifikovatelná a může sloužit jako marker efektu léčby. Nedostatečná kontrola záchvatů, dokonce bez radiologické progrese nádoru, začíná být v některých studiích používána za důvod k aktivní léčbě. Opakované záchvaty po počátečním období bez záchvatů po léčbě gliomu mohou být prvními známkami progrese tumoru. Podobně obnovení kontroly záchvatů může být prvním ukazatelem účinnosti terapie. Je tedy důležité zvážit kontrolu záchvatů při posuzování efektu léčby u gliomů jako jeden ze základních parametrů v léčbě LGG [12].
Avila et al ve své práci navrhují následující hodnocení:
- klasifikace záchvatů pomocí modifikované klasifikace International League Against Epilepsy (ILAE);
- frekvence záchvatů s použitím počtu dnů záchvatů od poslední návštěvy;
- hodnocení efektu léčby dle ILAE outcome scale;
- tíže záchvatů, zařazení specifických otázek cílících na záchvaty při posuzování se zdravím související kvality života (the health-related quality of life; HRQOL) u pacientů s gliomy [12].
Závěrem této kapitoly lze říci, že BTRE jakožto nejčastější iniciální příznak dLGG významně ovlivňuje kvalitu života pacientů. V případě jejich výskytu je tedy zcela na místě farmakoterapie AED, která četnost záchvatů prokazatelně snižuje. První volbou je levetiracetam. Není však vhodné podávat tyto léky profylakticky u nemocných bez záchvatů, benefit zde nepřevažuje riziko jejich podávání. Mimo antiepileptická léčiva byl také zaznamenán významný pokles záchvatů v souvislosti s chirurgickou a adjuvantní onkologickou léčbou dLGG. Pacienti by měli být posléze sledováni neurologem, který nastavuje terapii AED a v případě dlouhodobé absence záchvatů může zvážit snižování dávek či plné vysazení z trvalé medikace. Změny v četnosti záchvatů lze s výhodou využít při monitoringu efektu onkologické léčby či včasném záchytu recidivy onemocnění.
Zobrazovací metody
Vzhledem k odlišnému terapeutickému přístupu u gliomů nižšího a vyššího stupně diferenciace je nezbytné jejich rozlišení pomocí různých diagnostických metod. Stanovení definitivní diagnózy je možné pouze po získání vzorku tkáně a její histopatologické a cytogenetické analýze. Odběr vzorku je však možný pouze chirurgicky (biopsie či resekce ložiska) a z toho plynoucím rizikem výkonu. Důraz je tedy v první řadě kladen na neinvazivitu diagnostických metod s co nejmenší zátěží pro onkologické pacienty s využitím zobrazovacích metod. Otázkou je, která z těchto neinvazivních metod (či spíše jejich kombinace) podá nejrelevantnější výsledky, o které lze opřít rozhodnutí o následném terapeutickém postupu. Dále která metoda dokáže co nejdříve identifikovat maligní transformaci dLGG a tím být využita k následnému sledování těchto pacientů [28].
Základními zobrazovacími metodami pro diagnostiku LGG jsou CT a MR, které jsou elementární pro identifikaci ložiskového procesu a určení jeho základních vlastností – anatomické lokalizace a velikosti [29]. CT je metodou volby u symptomatických pacientů, u kterých je nezbytné rychlé zjištění příčiny alterace jejich stavu, a slouží při diferenciální diagnostice např. CMP. Tumorózní proces může být tímto způsobem incidentálně zachycen v rámci vyšetřování pro kraniotrauma [30]. Na CT je difuzní gliom obvykle izodenzní nebo hypodenzní oproti okolnímu mozku. Kalcifikace, které mohou být na CT zachyceny, nejsou běžné (10–20 % případů) a častěji jsou pozorovány u oligodendrogliomů. Také je možné rozeznat hemoragie, které mohou přispět k zúžení diferenciální diagnostiky možných patologických stavů. Nález expanze na CT standardně vede ke zhotovení konvenčních sekvencí MR [29]. Ty bývají prováděny i primárně v rámci vyšetřování pro primozáchyt epileptického záchvatu nebo pro nespecifické příznaky (bolesti hlavy, kognitivní poruchy aj.) [30].
Zobrazovací metody lze dělit v první řadě na radiologické (CT, MR) a metody nukleární medicíny (SPECT [single photon emission computed tomography], PET). Také na metody anatomické (CT; sekvence MR – T2WI [T2 weighted image], FLAIR, T1WI před podáním a po podání kontrastní látky na bázi gadolinia, T2*, SWI [susceptibility weighted imaging]) a neanatomické (sekvence MR – PWI [perfusion-weighted imaging] – DSC [dynamic susceptibility contrast]/DCE [dynamic contrast enhanced]/ASL [arterial spin-labeled], DWI/ADC [apparent diffusion coeficient]/DTI, MRS [MR spektroskopie], fMR; SPECT, PET). Dále na metody konvenční a pokročilé [29].
Konvenční sekvence MR jsou na prvním místě diagnostického procesu a podávají základní morfologické informace o difuzních gliomech. Astrocytomy vyrůstají primárně v bílé hmotě a při dalším růstu infiltrují i okolní kortex. Naopak oligodendrogliomy se častěji nacházejí v kortikální lokalizaci a infiltrace bílé hmoty je pozorována v pozdějších stadiích růstu nádoru. Na anatomických sekvencích jsou dLGG typicky ložiska s nízce definovanými okraji a menším útlakem okolních struktur, a to i přes často větší rozměry. Vyznačují se homogenitou a hyposignalitou na T1WI, typicky bez sycení po podání kontrastní látky a hypersignalitou na T2WI a FLAIR (sekvence, která poskytuje nejlepší kontrast mezi předpokládaným infiltrujícím nádorem a normální mozkovou tkání). Míra hypersignality v T2WI nesouvisí s celularitou nádoru nebo buněčnými atypiemi [29]. Tyto konvenční sekvence MR jsou ukázány na příkladu konkrétního pacienta, který byl léčen na naší klinice (obr. 2). Navzdory významnému přínosu konvenčních morfologických sekvencí MR je nelze samostatně využívat k adekvátnímu odhadu stupně diferenciace gliomů a s výhodou se zde využívá pokročilých zobrazovacích metod [29]. Přesnost standardních sekvencí MR v rozlišení gliomů stupně II a III se udává mezi 30–50 % [31]. Důvodem je časté překrývání obrazu LGG a HGG na konvenčních zobrazovacích metodách. Difuzní LGG mohou někdy imitovat gliomy vyšších stupňů diferenciace a naopak [28]. Je známo, že až 20 % LGG vykazuje sycení po kontrastní látce [32]. Dále se mohou v jejich centru vyskytnout nekrózy nebo někdy působí na okolní mozkovou tkáň peritumorózním edémem. Tyto vlastnosti se typicky vyskytují u HGG, které zde naopak mohou chybět a jsou tak snadno zaměněny za difuzní gliomy nižšího stupně a s tím pak spojenými konsekvencemi [28].
Image 2. Muž (28 let), status epilepticus, histologicky gliom WHO grade II. Předoperační konvenční sekvence MR.
Male (28 years), status epilepticus, histologically confi rmed glioma WHO grade II. Preoperative conventional MRI sequences.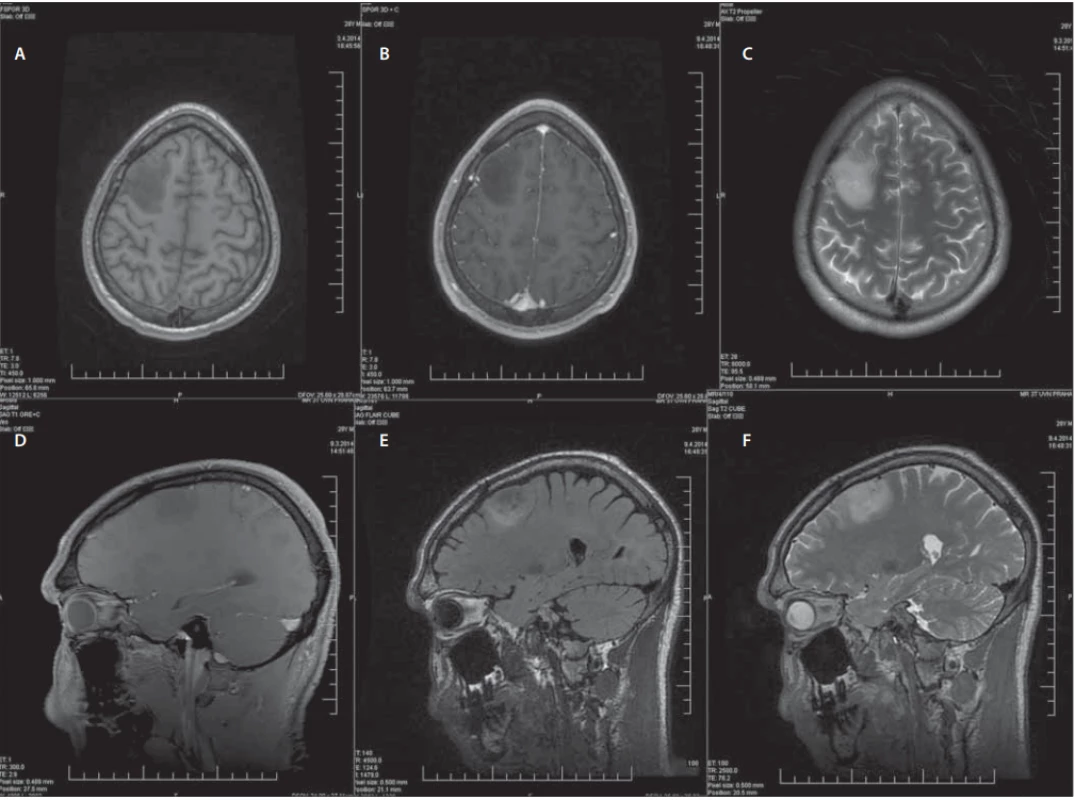
(A–C) Axiální řezy – (A) T1WI bez kontrastu, (B) T1WI s kontrastem, (C) T2WI; (D–F) Sagitální řezy – (D) T1WI s kontrastem, (E) FLAIR, (F) T2WI.
(A–C) Axial plane – (A) T1WI without contrast, (B) T1WI with contrast, (C) T2WI; (D–F) Sagittal plane – (D) T1WI with contrast, (E) FLAIR, (F) T2WI. FLAIR – fl uid attenuated inversion recovery; WHO – World Health OrganizationMimo základní sekvence je vhodné využití i tzv. pokročilých sekvencí MR. Názor na to, co jsou ještě bazální sekvence a co pokročilé, se různí. Mezi tyto sekvence patří PWI, DWI, MR spektroskopie. DTI a fMR přinášejí cenné informace k plánování resekčního výkonu [29]. Tyto sekvence jsou ilustrovány na případu již zmíněného pacienta (obr. 3). Dále lze využít i metod nukleární medicíny – SPECT a PET [29].
Image 3. Muž (28 let), status epilepticus, histologicky gliom WHO grade II. Předoperační pokročilé MR sekvence. Za poskytnutí obrazové dokumentace děkujeme MUDr. Jiřímu Vránovi, Ph.D. z RDG oddělení ÚVN.
Male (28 years), status epilepticus, histologically confi rmed glioma WHO grade II. Preoperative advanced MRI sequences. We would like to thank Jiří Vrána, MD, PhD from the Department od Radiology of the Central Military Hospital for providing these images.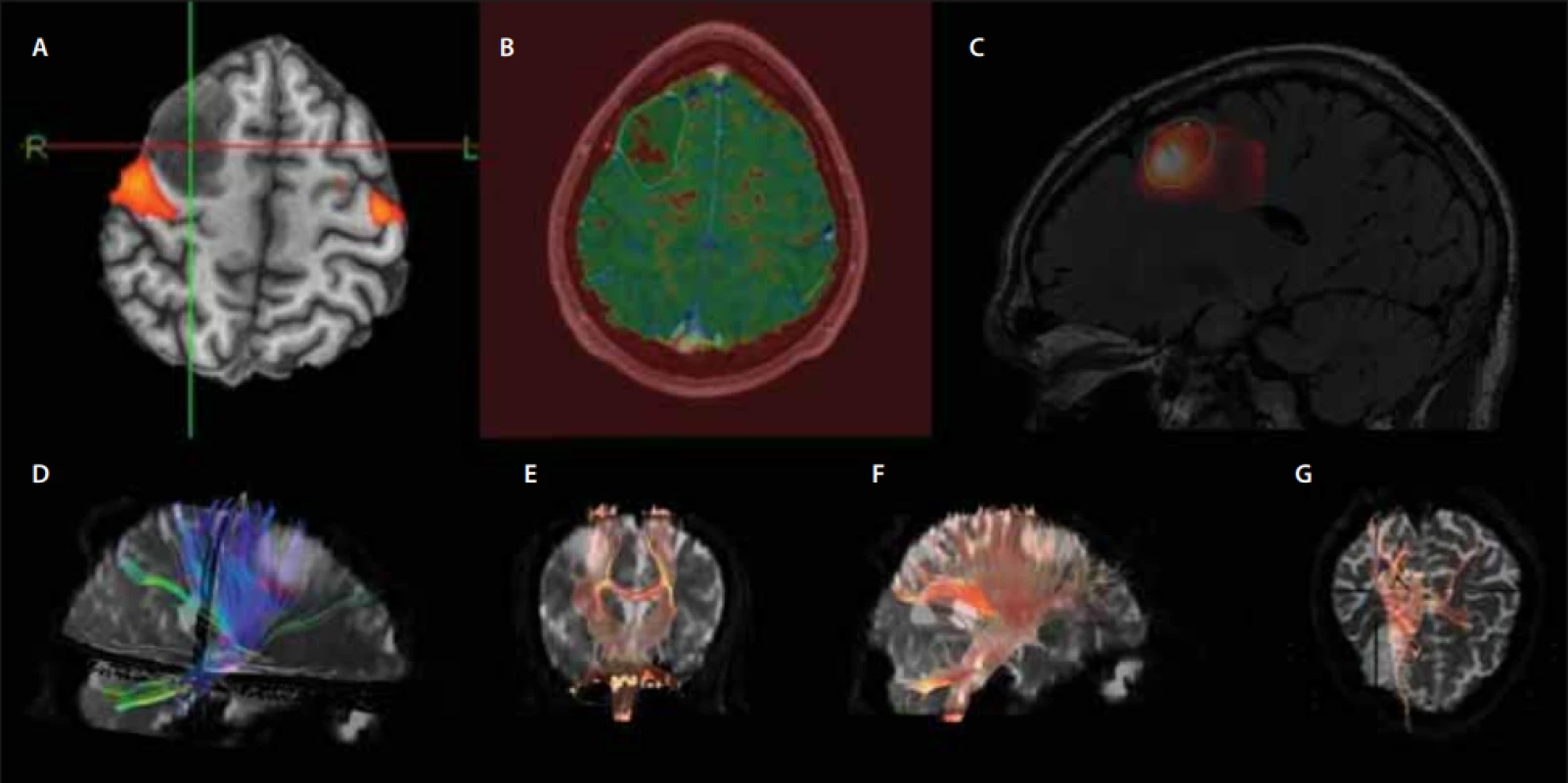
(A) fMR – fúze aktivních oblastí při pohybu prstů levé ruky a T1WI ukazuje vztah ložiska k primární senzorimotorické kůře; (B) PWI – mapa relativního rCBF na T1WI s vyznačeným obvodem ložiska, patrné relativní snížení perfuze v tumoru; (C) MRS – fúze vypočteného spektroskopického parametru poměru cholin/kreatinin a FLAIR sekvence, ložisko vysokého poměru cholinu v místě suspektního upgradingu tumoru; (D–G) DTI – využití traktografi e při hodnocení vztahu tumoru a základních drah, např. pyramidové dráhy. DTI – diff usion-tensor imaging; FLAIR – fl uid attenuated inversion recovery; fMR – fuknční MR; MSR – MR spektroskopie; PWI – perfusion-weighted imaging; rCBF – regional cerebral blood fl ow; T1WI – T1 vážené obrazy; WHO – Světová zdravotnická organizace
(A) fMRI – fusion of the active regions during the movement of the fi ngers of the left hand and T1WI shows the relationship of the tumour to the primary sensorimotor cortex; (B) PWI – map of relative rCBF on T1WI with marked edges of the lesion; relative decrease in the tumour perfusion is apparent; (C) MRS – fusion of the calculated spectroscopic parameter of the choline/creatinine ratio and the FLAIR sequence; a foci of high choline ratio at the site of a suspected tumour upgrade; (D–G) DTI – the use of tractography in the evaluation of the relationship of the tumour and basic tracts, e.g., pyramidal tract. DTI – diff usion-tensor imaging; FLAIR – fl uid attenuated inversion recovery; fMRI – functional MRI; MRS – MRI spectroscopy; PWI – perfusion- -weighted imaging; rCBF – regional cerebral blood fl ow; T1WI – T1-weighted imaging; WHO – World Health OrganizationPWI patří mezi pokročilé sekvence MR, kterými lze vyšetřit perfuzi mozku a zobrazuje řadu parametrů, vč. tzv. relativního objemu mozkové krve (relative cerebral blood volume; rCBV) nebo tzv. transferové konstanty Ktrans, která vyjadřuje změny ve vaskulární permeabilitě. Tyto parametry poskytují odhad mikrovaskulární denzity a agresivity nádoru. Jedná se o detekci abnormálních hemodynamických změn, které souvisejí se zvýšenou angiogenezí a vaskulární permeabilitou v nádorové tkáni. Výsledkem je změna v objemu mozkové krve (cerebral blood volume; CBV), která je vyjádřena poměrem objemu mozkové krve v tumoru oproti normální bílé hmotě. HGG se vyznačují vyššími hodnotami těchto parametrů na perfuzi MR [28]. Mezi PWI sekvence patří DSC, DCE a ASL perfuze MR [29]. Delgado et al publikovali metaanalýzu o významu použití perfuzní MR (DSC) při rozlišení gliomů WHO II a vyššího stupně. Byl nalezen vyšší maximální relativní objem mozkové krve (rCBVmax) u gliomů stupně III ve srovnání se stupněm II (n = 727). Optimální práh rCBVmax mezi LGG a HGG zde byl 2,02. Diagnostická přesnost byla vysoká zejména u astrocytárních nádorů. Bohužel přesnost perfuzní MR je významně nižší u oligodendrogliomů [33]. Law et al se zabývali perfuzí MR hlavně v kontextu spolehlivosti této metody v diagnostice HGG. V jejich skupině byl parametr rCBV vyšší než 1,75 asociován s histologickou diagnózou HGG [34]. Abrigo et al v roce 2018 publikovali obdobnou práci jako Delgado et al. Shromážděná data přinesla široký rozsah odhadů pro senzitivitu vyšetření (rozmezí 66–93 % pro detekci gliomu stupně II) a specificitu (rozsah 9–90 % pro detekci HGG). Jako práh rCBV určili obecně více užívanou hodnotu ≤ 1,75. Na jedné straně 7–34 % pacientů s LGG bude hodnoceno jako HGG, na straně druhé 10–91 % pacientů s HGG jako LGG. Z této práce vyplývá, že v současné době nelze opřít diagnózu jen o výsledky [28].
DWI je další pokročilou zobrazovací metodou, která je využívána v diferenciální diagnostice gliových nádorů. Podstatou je kvantifikace buněčnosti nádoru na základě předpokladu, že difuzivita vody uvnitř extracelulárního prostředí je nepřímo úměrná obsahu intracelulárního prostoru. DWI proto slouží jako marker celularity nádoru a jedná se o model difuze vody, která je ovlivněna změnou ve struktuře mozkové tkáně [32]. Hlavním parametrem DWI je tzv. ADC, který udává průměrné přemístění molekuly vody v určité oblasti za jednotku času (mm2/s). Vyšší hodnota ADC znamená vyšší mobilitu vody, tedy nižší celularitu v oblasti [35]. LGG mají obvykle nízkou míru celularity a nemají známky restrikce difuze. Ta je naopak typická u gliomů vyššího stupně. Zhang et al publikovali v roce 2016 metaanalýzu, ve které srovnávali hodnoty ADC s gliomy nižšího a vyššího stupně diferenciace a zdali lze využít tento parametr v predikci histologického nálezu. Analyzovali 15 studií s celkovým počtem 821 pacientů. Výsledkem byla senzitivita této metody 0,85 (95% CI: 0,80–0,90) a specificita 0,80 (95% CI: 0,71–0,87). Lze tedy říci, že ADC je využíván s vysokou přesností v predikci stupně diferenciace gliomů [32].
DTI je pokročilou zobrazovací metodou, která funguje na principu již popsaného DWI. Standardní vyšetření DWI je založeno na rozsahu a celkové velikosti difuze molekul vody ve tkáni vyjádřené parametrem ADC. DTI detekuje mikropohyb molekul vody v závislosti na směru jejich difuze. Myelinové pochvy axonů bílé hmoty tvoří bariéru pro molekuly vody a ty tak nemohou difundovat v jiném směru než paralelním s průběhem axonů. DTI představuje 3D model směru difuze vody a nepřímo tak zobrazuje průběh vláken bílé hmoty. Parametry DTI jsou FA (fractional anisotrophy) a MD (mean diffusivity). FA udává míru pohybu molekuly vody jedním směrem a nabývá hodnot 0 (všemi směry) až 1 (jedním směrem). MD je ekvivalentem ADC u standardního DWI. Tyto hodnoty lze kódovat do 3D modelu, ve kterém lze vizualizovat a barevně odlišit průběh jednotlivých drah v bílé hmotě. Typicky je pro projekční vlákna rezervovaná modrá, pro asociační zelená a komisurální červená barva. Data DTI a traktografie mohou odhalit integritu mozkové tkáně a vztah mezi nádorem a přilehlou bílou hmotou. Tyto gliomy častěji odtlačují základní mozkové dráhy, někdy je však mohou i invadovat. Další výhodou je možnost odlišení gliomů (hlavně HGG) od jiných lézí s relativně vysokou senzitivitou a specificitou [35]. Wu et al ve své prospektivní randomizované studii srovnávali vliv standardní perioperační neuronavigace a neuronavigace s integrovaným DTI na KPS (Karnofsky Performance Status) u pacientů s gliomy (LGG i HGG) v blízkosti pyramidové dráhy (n = 238). Pacienti ve skupině DTI měli signifikantně vyšší KPS, medián sledování byl 21,3 měsíce. U pacientů s WHO stupně IV byl také sledován vliv na délku přežití, kdy ve skupině DTI byl medián přežití 19,3 vs. 11,2 měsíce v kontrolní skupině. Limitací této studie je absence zahrnutí LGG do analýzy délky přežití [36]. Bello et al zdůraznili benefit kombinace DTI a intraoperační kortikální stimulace u pacientů s tumory v blízkosti oblastí či drah zapojených do řečových funkcí (n = 230). Výsledkem bylo zachování řeči u 96,8 % těchto pacientů [37]. Ius et al publikovali práci zahrnující 190 pacientů s LGG v elokventních oblastech, kteří podstoupili resekci. Rozsah resekce byl signifikantně větší, pokud byly DTI a fMR inkorporovány do neuronavigace (90 %, 77 %) [38]. Výzvou do budoucna je rozvoj tzv. konektomiky, která má za cíl objasnit dopodrobna jednotlivá neuronální spojení [35].
MRS je metoda, kterou lze měřit neinvazivně metabolity v mozku in vivo. Ačkoli není jeden konkrétní metabolit specifický pro jeden konkrétní nádor, poměry metabolitů lze použít k hodnocení buněčné proliferace a mitotické aktivity nádoru. Typicky u LGG nacházíme snížený NAA (N-acetylaspartát), střední hodnoty cholinu, absenci peaku laktátu a zvýšený myo-inositol [39]. Wang et al v roce 2015 publikovali metaanalýzu zaměřenou na význam MRS při rozlišení LGG a HGG. MRS prokazuje střední přesnost při rozlišování HGG od LGG pomocí poměru metabolitů vč. cholin/ kreatinin, cholin/NAA a NAA/kreatinin. Poměr cholin/NAA dosahuje vyšší senzitivity a specificity než ostatní zmíněné poměry. Je doporučeno, aby MRS byla kombinována s jinými pokročilými zobrazovacími metodami pro adekvátní diagnostickou validitu [40]. Tato metoda však může být s výhodou využívána při plánování biopsií. MRS je schopna zobrazit případná anaplastická ložiska a zvýšit tak přesnost a výtěžnost odběru pro histologické vyšetření. Studii na toto téma publikovali v roce 2014 Bradáč et al [41].
Další možností pokročilého zobrazování mozkových nádorů je využití metod nukleární medicíny. K dispozici jsou PET a SPECT. Jejich výstupem je funkční zobrazení ložiskového procesu v mozkové tkáni a doplňují morfologické metody. Ty např. s nedostatečnou specificitou odlišují růst gliomu od reaktivních postterapeutických změn v mozkové tkáni. Pomocí funkčního zobrazení lze identifikovat ložiska vyšší proliferační aktivity. S využitím matematických algoritmů lze provádět fúze dvou tomografických obrazů, a to i v rámci hybridních přístrojů kombinujících morfologické a funkční zobrazování (PET/CT, PET/MR, SPECT/CT atd.). PET má v porovnání se SPECT lepší rozlišení a širší možnosti značení cílících látek, nicméně je nákladnější a někdy je nezbytná současná přítomnost cyklotronu, který radionuklidy produkuje. Cyklotron je důležitý hlavně v případech krátkého poločasu rozpadu radionuklidu [42].
PET s 18F-fluorodeoxyglukózou (FDG) byl prvním pokusem o využití nukleárních metod při diagnostice gliomů či určování stupně jejich diferenciace. Jeho využití v neuroonkologii je omezené z důvodu vysokého vychytávání glukózy v mozkové tkáni i za normální situace. Dalším důvodem je nespecifické vychytávání FDG v benigních zánětlivých lézích, a tedy nízká specificita této metody [42]. Typicky se WHO II gliomy vyznačují nižší mírou vychytávání FDG oproti okolní mozkové tkáni, obraz tedy může být hypo - či izometabolický. Vyšší metabolickou aktivitu vykazují oligodendrogliomy a pilocytární astrocytomy v porovnání s difuzními astrocytomy [42]. I přes zmíněné limitace je pro svou dostupnost tento typ radiofarmaka v ČR nejvíce využíván.
V neinvazivní diagnostice gliomů se s výhodou začalo využívat radionuklidové značení aminokyselin místo FDG. Mezi ně patří především PET s 11C-methioninem (MET) a s 18F-fluoroethyltyrosinem (FET). Dunet et al publikovali v roce 2015 metaanalýzu, ve které se zaměřili na porovnání diagnostické hodnoty FDG-PET a FET-PET u mozkových tumorů. Po zahrnutí pacientů z 5 studií do jedné skupiny (n = 119) srovnávali senzitivitu a specificitu jednotlivých metod. Při odlišení nádorových lézí od nenádorových pomocí FET-PET dosáhli senzitivity 0,94 (95% CI: 0,79–0,98) a specificity 0,88 (95% CI: 0,37–0,99) vs. pomocí FDG-PET se senzitivitou 0,38 (95% CI: 0,27–0,50) a specificitou 0,86 (95% CI: 0,31–0,99). Výsledky tak jednoznačně ukázaly převahu FET-PET nad FDG-PET při hodnocení nově zjištěného mozkového tumoru. V rámci hodnocení stupně diferenciace gliomů obě metody vykazovaly podobné výsledky [43]. Dále lze využít MET-PET. Absorpce methioninu v normální mozkové tkáni je nižší než u FDG, což poskytuje dobrý kontrast k posouzení nádorové infiltrace a také koreluje s proliferační aktivitou nádoru [44]. Oligodendrogliomy vykazují vyšší absorpci než astrocytární nádory a může tak dojít k diagnostickému překryvu oligodendrogliomů a HGG. Roessler et al ve svém článku poukázali na stejnou míru vychytávání 11C u maligních astrocytomů a nízkostupňových oligodendrogliomů při využití MET-PET [45]. Nevýhodou MET-PET je krátký poločas radionuklidu 11C (20 min), což vyžaduje přítomnost cyklotronu v místě klinického pracoviště a zvyšuje tak nákladnost této metody. 18F u FET-PET je v tomto ohledu logisticky výhodnější, poločas rozpadu (110 min) umožňuje jeho širší rozšíření pro klinickou praxi. Z toho důvodu je ekonomicky přijatelnější metodou srovnatelnou s FDG-PET [42,47]. FET-PET je však v ČR mnohem méně rutinní metodou v diagnostice a v další dispenzarizaci pacientů s dLGG. Provedení tohoto vyšetření je možné např. na radiologické klinice v Plzni.
Další okrajovou metodou je PET s 18F-fluorthymidinem (FLT), při kterém dochází k inkorporaci nukleosidu do DNA a lze jej využívat jako marker proliferace tumoru. Přestupuje do mozku v případě porušené hematoencefalické bariéry. Používá se zejména k ozřejmění případné malignizace nádoru [46]. FLT-PET je v rámci ČR využíván méně pro diagnostiku a sledování dLGG. Na většině pracovišť nukleární medicíny je však standardně k dispozici.
FET-PET i MET-PET jsou metody vhodnék odlišení dLGG od nenádorových lézí, dále k cílení případné stereotaktické biopsie, definici objemu nádoru a monitorování efektu léčby. Bylo prokázáno, že diagnostický přínos obou metod je srovnatelný [47]. Několik studií popsalo zvýšené vychytávání aminokyselin u LGG i HGG, u kterých je však s vyšší frekvencí a ve větší míře. Näslund et al ve své publikaci shrnuli data z 28 studií a zvýšené vychytávání aminokyselin bylo prokázáno u 25–92 % následně histologicky potvrzených LGG a u 83–100 % HGG [45]. V diagnostice a určení následné terapie je nezbytný reprezentativní odběr vzorku. Gliomy jsou heterogenní nádory, jejichž biologické chování je určeno jeho nejagresivnější částí s nejnižším stupněm diferenciace. PET s využitím radionuklidy značených aminokyselin je schopna zobrazit tato místa jako tzv. hot spots, na které je posléze možné zacílit odběr vzorku [47]. Kunz et al popsali asociaci mezi těmito místy a vyšším gradem uvnitř tumorů [48]. Zařazením FET-PET do mechanizmu cílených biopsií došlo ke zvýšení jejich přesnosti z 68 na 88 % [47]. Bylo prokázáno, že FET-PET je více senzitivní pro prokázání LGG než využití 5-ALA fluorescence [47]. Diagnostické hodnocení domnělých WHO II gliomů s použitím FET-PET umožňuje specifičtější určení rozsahu nádoru, než je možné za použití standardních sekvencí MR [47]. Dále může PET přispívat k odhadu prognózy u pacientů s gliomy. Kombinací MR a FET-PET lze stratifikovat pacienty do podskupin, u nichž se liší další terapeutický algoritmus [45]. PET lze také využít při následném sledování neuroonkologických pacientů. Sledování probíhá většinou v intervalu 3 měsíců pomocí standardních morfologických zobrazovacích metod (T2WI, FLAIR). Zde bývá složité odlišení reaktivních postterapeutických změn od progrese tumoru. Využitím FET-PET lze s vyšší senzitivitou hodnotit účinnost léčby či případnou progresi. Případná recidiva nádoru je velmi obtížně odlišitelná od tkáňových změn způsobených adjuvantní radiační léčbou při použití konvenčních sekvencí MR. To nejvíce limituje diferenciální diagnostiku při sledování pacientů po proběhlé radiační léčbě. FET-PET lze využít právě pro odlišení radionekrózy od tumoru (kde je vyšší absorpce), a tak pomoci s plánováním dalšího terapeutického postupu. Výhodou je také dřívější hodnocení účinku terapie, protože redukce metabolické aktivity gliomu lze zachytit dříve než jeho morfologickou regresi [47]. Wyss et al v prospektivní studii sledovali 11 pacientů s progresivními LGG WHO II bez patrného sycení po kontrastní látce při vyšetření MR a FET-PET. Po zahájení terapie temozolomidem srovnávali redukci metabolické aktivity s redukcí objemu tumorů. Redukce metabolické aktivity gliomů byla pozorována dříve než regrese objemu na sekvencích FLAIR. Střední doba do maximální redukce byla u FET-PET 8,0 ± 4,4 měsíce, u MR 15,0 ± 3,0 měsíce [49].
Okrajově lze při hodnocení LGG použít i SPECT, ale nepřesné prostorové zobrazení snižuje význam této metody v této indikaci. Vyobrazení je vytvářeno pomocí konvenčních gamma kamer. Výhodou této metody je její rozšíření a dobrá ekonomická dostupnost. Nevýhodou je již zmíněné nepřesné prostorové rozlišení v porovnání s PET, a tak se tato metoda rutinně v klinické praxi nepoužívá [42].
Diagnostický postup s využitím výše uvedených zobrazovacích metod se různí v jednotlivých státech. Freyschlag et el prezentovali průzkum, ve kterém zjišťovali využití jednotlivých sekvencí v různých evropských centrech, která rutinně léčí pacienty s dLGG. Získali celkem 128 odpovědí. Zobrazování v T1WI bez podání kontrastní látky a s jejím podáním a T2WI se používá ve všech zúčastněných centrech. Sekvenci TIRM (turbo inversion resonance magnitude) používá 20 % center, FLAIR 98 % center. Většina center (89 %) provádí DWI u každého pacienta, 80 % rutinně provádí ADC mapu. Téměř dvě třetiny respondentů (61 %) standardně používají PWI. Během sledování pacientů s LGG provádí volumetrickou analýzu v 35 % center, lineární měření (3 osy na MR) v 45 % center a 20 % hodnotilo změnu tvaru nádoru k odhalení progrese. Všechna měření byla provedena neuroradiology (59 %), dále 24 % neurochirurgy a ve 3 % neuroonkology. Ve 14 % středisek se podíleli na měření nádoru všichni členové týmů. MRS byly v rámci center prováděny variabilně. Jedna třetina středisek rutinně získávala data ze singel-voxel spektroskopie, další třetina aplikovala multi-voxel spektroskopii. PET s použitím aminokyselin používá 33 % center. Většina center však používá PET jen jednou a pokud je negativní, tak jej neopakuje. Opakovaně provádí PET jen 9 % center. Celkem 31 % center rutinně používá fMR pro každého pacienta, zatímco resting state fMR je získáván pouze v 7 % center. Polovina center používala fMR pro klinické i výzkumné účely, 42 % výhradně klinicky a 6 % pouze pro výzkum. A 2 % center používají fMR pro didaktické účely ve výcviku studentů [50].
Neurohistopatologie, genetické a molekulární markery
V době velkého rozvoje molekulární genetiky ve všech oblastech medicíny bylo nezbytné zformulovat nový koncept dělení jednotlivých tumorů CNS a jejich subtypů nejen na základě jejich mikroskopických podobností v původu nádorových buněk či stupni buněčné diferenciace, ale vzít v potaz i genetické a molekulární aspekty. V nizozemském Haarlemu se roku 2014 tedy sešla řada odborníků pod záštitou Mezinárodní společnosti pro neuropatologii (International Society of Neuropathology; ISN), aby zde diskutovali o plánované změně WHO klasifikace tumorů CNS z roku 2007. Její nevýhodou bylo např. zařazení veškerých tumorů s astrocytárním fenotypem do jedné skupiny, ačkoli se od sebe jednotlivé subtypy mohly výrazně klinicky odlišovat. Výsledkem setkání se stala nová WHO klasifikace CNS tumorů z roku 2016. Ta změnila dlouhotrvající náhled na původní dělení tumorů CNS tím, že do stávajících histologických parametrů inkorporovala jednotlivé parametry molekulární. Ačkoli některé z genetických změn byly v roce 2007 již známy, využívalo se jich komplementárně při hodnocení prognózy u nádorů, které byly definovány pouze na základě konvenční histologie. Zavedením této klasifikace došlo k zařazení nových nádorových podjednotek či k odstranění některých variant, které již postrádaly dostatečnou diagnostickou relevanci. Kombinace znalosti genotypových a fenotypových parametrů vede ke zvýšení přesnosti při diagnostice tumorů, stanovení jejich prognózy, odpovědi na léčbu a v neposlední řadě umožňuje lepší následné terapeutické postupy u konkrétního pacienta. Jednotlivé skupiny nádorů definované histologicky mají své typické genetické a molekulární změny. V případě jejich vzájemné diskrepance se přednostně přihlíží k výsledku molekulárně genetického vyšetření. I přesto se v nynější době genetická vyšetření neobejdou bez klasické histopatologie už jen proto, že stanovení stupně diferenciace u LGG se opírá o histologická kritéria [3].
Histopatologické vyšetření vzorku je založeno na posuzování buněčné morfologie a tkáňové architektury pod světelným mikroskopem. Výsledkem je zhodnocení diferenciace tumoru na základě přítomných buněčných atypií a mitotické aktivity. Důležité je vyloučit přítomnost mikrovaskulární proliferace či nekróz, které by mohly ukazovat na fenotyp HGG. Pro LGG WHO stupeň II je typická pouze přítomnost buněčných atypií. U oligodendrogliomů jsou typicky přítomny nádorové buňky s perinukleárním haló. Pro dobrou výtěžnost histopatologického vyšetření je nezbytný odběr reprezentativního vzorku nádorové tkáně, nejlépe při chirurgické resekci. Vzorek z biopsie nemusí být vždy průkazný z důvodu fenotypové a genotypové heterogenity difuzních gliomů [51].
Zavedením molekulárních parametrů do histopatologické klasifikace došlo ke změně nomenklatury. Tumory CNS se tak označují histopatologickým názvem, který je následován nalezenými genetickými vlastnostmi (např. difuzní/anaplastický astrocytom, mutace IDH nebo oligodendrogliom, mutace IDH a 1p/19q kodelece). Pokud hledaná genetická alterace nalezena nebyla, lze u některých jednotek použít název „wildtype“ (např. difuzní/anaplastický astrocytom, IDH-wildtype). U ostatních jednotek se při negativním genetickém průkazu použije označení NOS – např. oligodendrogliom, NOS. Zmíněné nespecifické označení se používá také v situaci, kdy není genetické testování provedeno nebo není výsledek průkazný [3].
Nově se všechny difuzní gliomy řadí do jedné skupiny na základě společných genetických mutací, klinického chování a prognózy, nezávisle na původu nádorových buněk. Mezi difuzní gliomy lze dle této klasifikace zařadit WHO stupně II a III astrocytomy, oligodendrogliomy a oligoastrocytomy, dále WHO stupně IV multiformní glioblastomy. Ty se dále dělí podle typické genetické mutace pro IDH (IDH statusu) do tří kategorií na difuzní gliomy s IDH mutací, IDH-wildtype nebo NOS. Společný IDH status koreluje s podobnou prognózou lépe než stupeň diferenciace gliomů. Např. rozdíly v prognóze byly minimální při srovnání WHO stupně II difuzního astrocytomu a WHO stupně III anaplastického astrocytomu, u kterých byla prokázána IDH mutace. Gliomy s mutovaným IDH statusem (převážná většina) vykazují příznivější prognózu než IDH-wild type gliomy, a to nezávisle na stupni diferenciace [1]. IDH wildtype tumory (IDH-wt) jsou asociovány s nepříznivou prognózou a vyznačují se molekulárními podobnostmi s WHO stupně IV glioblastomy. Jejich prevalence v souboru difuzních LGG je kolem 23 %. IDH-wt je asociovaný pouze s astrocytomy, nikoli s oligodendrogliomy. Existují názory, že IDH-wt astrocytom by mohl být incipientním glioblastomem, který zatím nevyvinul jeho typické histopatologické vlastnosti [52]. Dalšími možnostmi zpřesnění diagnostiky je určení přítomnosti mutace ATRX a TP53 či přítomnosti kodelece 1p/19q. Např. diagnostika difuzních astrocytomů je založena na určení statusu IDH a potvrzení přítomnosti mutace v ATRX a TP53. Tím je lze odlišit od WHO stupně II a III oligodendrogliomů, u kterých na rozdíl od difuzních astrocytomů je přítomnost kodelece 1p/19q, ale nikoli mutace v ATRX či TP53. Zvláštním příkladem jsou smíšené oligoastrocytomy, které mohou být na základě genetického testování označeny za astrocytomy i oligodendrogliomy. Z toho důvodu jsou klasifikovány do podskupiny NOS. Z klasifikace vyplývá, že WHO II difuzní astrocytomy a oligodendrogliomy jsou si více nosologicky podobné než difuzní astrocytomy a pilocytární astrocytomy WHO stupně I [1].
Nejdůležitějším molekulárním markerem u difuzních gliomů je přítomnost či absence mutace v genu pro IDH a z ní plynoucí tvorba defektního enzymu. Rozlišují se IDH1 a IDH2 mutace. IDH1 mutace se vyskytují s prevalencí až 60–90 % u WHO grade IItumorů, IDH2 mutace bývají asociovány s oligodendrogliomy a jsou spíše vzácné. Nejčastější je IDH1 R132H mutace, která se vyskytuje u difuzních LGG s vysokou prevalencí. Diagnostikuje se imunohistochemicky za pomocí IDH1 R132H protilátky, která vyloučí jiné nádorové i nenádorové procesy. Vzhledem k vysokému výskytu mutace a relativně snadnému stanovení, které lze provést při běžném histopatologickém vyšetření, se doporučuje jako přídatná modalita pro zpřesnění diagnostiky. Variantou do budoucnosti může být neinvazivní stanovení defektního produktu (2-hydroxyglutarátu) mutovaného IDH pomocí MR spektroskopie. Nevýhodou by byla nemožnost identifikace LGG IDH-wt, stanovení histologického typu nádoru a stupně jeho diferenciace [51].
Další genetickou alterací vyskytující se specificky u oligodendrogliomů je kompletní delece 1p/19q vedoucí ke ztrátě heterozygozity. Na rozdíl od nekompletní delece je spojena s delším celkovým přežitím, predikuje odpověď na chemoterapii a její detekcí lze odlišit astrocytární tumory od oligodendrogliomů. Bylo zjištěno, že tumory s parciální delecí 1p/19q mají horší prognózu v porovnání s tumory s intaktním 1p/19q. Metylace MGMT promotoru (O6-metylguanin-DNA metyltransferáza) je další molekulární abnormalitou vyskytující se u dLGG [51]. Procentuálním stanovením metylace tohoto promotoru lze predikovat odpověď na terapii alkylačními činidly v rámci chemoterapie. MGMT promotor je součástí genu produkujícího stejnojmenný enzym (metylguanin-DNA metyltransferázu), který je za normálního stavu schopen reparace poškozené DNA. Metylací promotoru dochází k zabránění transkripce tohoto genu s následnou translací do funkčního MGMT enzymu, poškozená DNA (např. alkylačními činidly) tak nemůže být opravena. Zvýšená metylace MGMT promotoru tedy předpovídá lepší odpověď tumoru na chemoterapeutika typu temozolomidu [53].
Narůstající znalosti o výše zmíněných genetických markerech hrají významnou roli v lepším porozumění biologickému chování gliomů, umožňují zpřesnění diagnózy a ukazují se jako významné prognostické faktory. Zahrnutím těchto markerů do diagnosticko terapeutického procesu lze podpořit rozhodování o volbě nejvhodnější terapeutické strategie pro specifické subtypy difuzních gliomů. U skupiny difuzních LGG nejsou zcela ucelené názory na nejvhodnější terapeutický postup a řada otázek vzbuzuje kontroverze. Obecně je důležité zvážit vliv terapeutických modalit na kvalitu života pacienta, a to hlavně u tumorů, kde se předpokládá delší dožití. Např. u IDH mutovaných gliomů (lepší prognóza, pomalejší růst) je otázkou, zda je lepší zahájit časnou agresivní multimodální terapii nebo preferovat konzervativní přístup. První varianta má za cíl co nejvíce oddálit rekurenci tumoru za cenu vystavení radio - a chemoterapii, u nichž existuje určité riziko morbidity zhoršující kvalitu života. Na druhou stranu při konzervativním postupu se oddálí toxické působení adjuvantní terapie až do doby rekurence tumoru, která však může nastat dříve [54].
Terapie
Načasování onkologické terapie
Samotná operace nevede k vyléčení pacienta s LGG a další léčba je potřeba téměř u všech pacientů. Optimální načasování další terapie není však zřejmé, a proto stále platí kontroverze, zda indikovat onkologickou léčbu ihned po stanovení diagnózy nebo tuto léčbu rezervovat pro případ recidivy či progrese nádoru [55]. Velmi kvalitní review na toto téma publikovali v roce 2017 Kazda el al [56]. V nynější době je trendem snaha o individualizaci následné terapie zohledňováním molekulárních charakteristik tumorů, jimiž lze stratifikovat skupiny pacientů a lépe tak odhadovat jejich odpověď na léčbu [55].
Pro ulehčení plánování pooperační terapie se pacienti s dLGG dělí dle různých faktorů na nízko - a vysokorizikové. U pacientů s vyšším rizikem nádorové progrese se dá očekávat větší přínos časné terapeutické intervence. Pignatti et al definovali 5 negativních prognostických faktorů: věk nad 40 let, astrocytární histologický subtyp, velikost tumoru nad 6 cm, tumor přesahující střední čáru a přítomnost neurologického deficitu před zahájením terapie. Low-risk pacienti jsou definováni 2 a méně rizikovými faktory, high-risk pacienti 3 a více. Za další rizikové faktory lze považovat parciální resekci tumoru či nepřítomnost 1p/19q kodelece [55].
Nelze však opomenout fakt, že jednotlivé rizikové faktory jsou relativní (vč. věkové hranice 40 let). Ve studii RTOG 9802 bylo 111 pacientů s nízce rizikovým difuzním gliomem (věk ≤ 40 let a MR radikální resekce). Tito pacienti byli indikováni k observaci. Celkové přežití po 2 a 5 letech bylo 99 a 93 %. Naopak jen 48 % pacientů však nemělo progresi nádoru 5 let po operaci [57].
Ve své práci Shaw et al definovali faktory spojené s horší prognózou stran délky období bez progrese onemocnění (progression-free survival; PFS): velikost tumoru (≥ 4 cm), astrocytární nádor nebo oligoastrocytom a reziduální nádor ≥ 1 cm. U pacientů se všemi 3 nepříznivými faktory bylo 2 a 5leté přežití bez progrese onemocnění 60, resp. 13 %. Pokud nebyl přítomen ani jeden nepříznivý faktor, tak 2 a 5leté PFS bylo 100, resp. 70 % [57].
Dle obecného konsenzu je observace vhodným postupem u mladých pacientů (≤ 40 let), pokud byla provedena rozsáhlá resekce nádoru a nádor je IDH mutovaný, zejména pokud molekulární studie ukazují přítomnost 1p/19q kodelece [57].
Operační léčba
Nízkostupňové gliomy představují heterogenní soubor intraaxiálních tumorů CNS, do kterého řadíme podle WHO stupně malignity dvě skupiny lézí. Jedná se o WHO grade I, reprezentovaný zejména pilocytárním astrocytomem, a WHO grade II, tedy difuzní LGG. Oba stupně mají rozdílné biologické chování a prognózu, proto i vývoj terapeutického přístupu k WHO grade I tumorům a dLGG byl zcela odlišný. Zatímco pilocytární astrocytom je dlouhodobě považovaný za nemalignizující tumor, jehož radikální resekcí je pacient vyléčen, dLGG lze označit za chronické onkologické onemocnění, které nevyhnutelně vede k progresi do vyššího stupně malignity a v konečném důsledku ke smrti pacienta. Dříve propagovaná strategie aktivního sledování a neurochirurgické intervence až při známkách progrese dLGG se nyní zdá být obsolentní [58]. Resekce tumoru tak v současnosti představuje stěžejní modalitu v terapii LGG. Základním cílem je prodloužení doby přežití pacienta, avšak vzhledem k tomu, že dLGG jsou diagnostikovány v mladší populaci (nejčastěji 3.–5. dekáda života) s dlouhou předpokládanou dobou dožití, je rovněž zcela zásadní zachování kvality života pacienta.
Chirurgický výkon je nezbytný pro získání tkáně k histologické a molekulárně genetické analýze. Některé záněty, infekce a demyelinizační onemocnění lze obtížně odlišit od difuzních gliomů a histologická verifikace je zde nezastupitelná. Benefity chirurgické terapie oproti aktivnímu sledování jsou v současnosti již jasně literárně doloženy. Známá je např. norská studie, kterou provedli Jakola et al zahrnující celkem 153 pacientů s diagnózou dLGG. Ti byli na základě adresy trvalého bydliště léčeni ve dvou nemocnicích se zcela odlišnou strategií. Zatímco neurochirurgický tým „A“ preferoval biopsii a následné sledování (provedeno u 47 z 66 nemocných), tým „B“indikoval časnou maximální možnou resekci tumoru (provedeno u 75 z 87 nemocných). Střední doba přežití ve skupině „A“ byla 5,8 roku, ve skupině „B“ pak 14,4 roku [59]. Resekce gliomu navíc zasahuje do přirozeného „životního cyklu“ dLGG. Bylo prokázáno, že k malignizaci gliomu může dojít v různých částech tumoru [60]. Redukce objemu nádoru tak vede ke snížení pravděpodobnosti rozvoje nádorového upgradingu. Chirurgická resekce je tedy podle některých studií nezávislým prognostickým faktorem asociovaným s prodloužením období bez maligní progrese tumoru [61–63]. Vzhledem k popsanému biologickému chování by k identickému terapeutickému postupu mělo docházet i ve skupině incidentálních, asymptomatických dLGG. U symptomatických dLGG je v 80 % případů prvním příznakem epileptický záchvat. Kontrola epilepsie je jednou ze základních podmínek dobré kvality života pacienta po operaci. Englot et al v retrospektivní studii zahrnující 1 181 pacientů se sekundární epilepsií pro low grade tumor temporálního laloku porovnávali kontrolu záchvatů po chirurgických výkonech různé radikality. Po subtotální resekci bylo bez záchvatů 43 %, po prosté totální resekci 79 % a po totální resekci v kombinaci s hipokampektomií a/nebo temporální neokortikální resekcí 87 % pacientů. Z uvedeného tedy plyne, že čím větší je rozsah bezpečné resekce, tím lepší je i kontrola pooperační epilepsie [64]. Otázkou současné terapie dLGG tak již není, jestli k operaci přistoupit, nýbrž jak radikální by měla být.
V tomto směru literatura dokládá jasný benefit maximální možné resekce [39,59,61,63, 65–67]. Ta prokazatelně prodlužuje průměrné přežití. Dále, jak bylo uvedeno výše, oddaluje progresi nádorového procesu a zlepšuje kvalitu života pacienta. Nicméně i přes graficky 100% resekci dLGG podle FLAIR MR, s odstupem k progresi onemocnění a malignizaci tumoru dochází. Smith et al udávají dobu do progrese 5,5 roku a dobu do maligní transformace 10,1 roku u nemocných, kterým bylo resekováno více než 90 % nádorové masy [61]. Tento fakt je pravděpodobně zapříčiněný tím, že izolované buňky gliomu pronikají do tkáně okolního zdravého mozku, tedy mimo grafické ložisko dLGG. Studie založené na výsledcích biopsie odhalily, že buňky tumoru mohou být přítomny ve vzdálenosti až 2 cm od signálových změn na FLAIR MR [68]. Někteří autoři proto propagují koncept „supramarginální“ či „supratotální“ resekce, tedy rozšíření resekce i mimo grafické abnormality [69]. Yordanova et al ve své práci porovnávají výsledky po supramarginální resekci s kontrolní skupinou po „pouze“ totální resekci dLGG. V kontrolní skupině byla častější nejen maligní transformace (7/29 vs. 0/15 pacientů), ale i adjuvantní terapie. Limitací práce je však krátký follow-up, proto ani po supratotální resekci nelze rekurentní průběh onemocnění vyloučit [70]. Výsledky supramaximální resekce prezentoval ve své práci i Duffau. V žádném z 16 zaznamenaných případů nedošlo ke smrti či malignizaci při středním follow-up 11 let. Všichni pacienti se navrátili do běžného života a 15 z nich, kteří trpěli sekundární epilepsií před operací, po resekci neprodělali záchvat [71]. Z uvedeného lze vyvodit, že cílem operační léčby by měla být maximální možná resekce při zachování či zlepšení kvality života nemocného. Stejně jako je chirurgická léčba metodou volby u prvotně diagnostikovaného dLGG, recentní studie doporučují opakovanou maximální resekci i při recidivě tohoto chronického onemocnění [72]. Vždy je nutné volumetricky hodnotit rozsah resekce dle předoperačních a pooperačních MR v T2WI, lépe na sekvencích FLAIR [61]. K dosažení zmíněného terapeutického cíle neurochirurgovi dopomáhá řada modalit. Jedná se především o neuronavigaci, peroperační MR či awake kraniotomii s peroperační elektrostimulací.
Právě awake operace s elektrostimulací umožňuje přímou identifikaci oblastí zodpovědných za jednotlivé funkce mozku. Umožňuje tak rozšířit indikace k resekcím v elokventních oblastech. Konvenčně je indikována zejména při operacích gliomů dominantní hemisféry pro mapování řečových funkcí, kdy dochází k identifikaci řečových center a jejich drah. Rozsah využití pro operaci pacienta při vědomí ve své práci diskutuje již zmíněný Duffau [73]. Zde zdůrazňuje, že využití této metody je spojeno s větším rozsahem resekce [74], prodloužením průměrného dožití [75] a signifikantním snížením výskytu permanentního neurologického deficitu po operaci [76]. Dále zmiňuje, že standardní neurologické vyšetření nedokáže vždy zachytit mírný neurologický deficit zejména zrakoprostorových, kognitivních či emočních funkcí. Výskyt mírných pooperačních deficitů tak může být v literatuře podhodnocen. Navrhuje proto významně širší využití awake kraniotomie s peroperační elektrostimulací kortexu i bílé hmoty při resekci dLGG nezávisle na anatomickém umístění tumoru u pacientů s mírným či žádným neurologickým deficitem. Bez povšimnutí nezůstává ani jeho práce s pojmem „plasticita mozku“, která je definována jako kontinuální proces dovolující krátkodobou, střednědobou a dlouhodobou remodelaci neurosynaptických map pro optimalizaci mozkových funkcí [77]. Známé jsou tak kazuistiky dLGG elokventních oblastí, kdy v první době proběhla bezpečná, neúplná resekce a po 10 letech a reorganizaci řečových funkcí mohla být v téže oblasti provedena radikální resekce bez vzniku trvalého neurologického deficitu.
Radikální resekce je v terapii dLGG metodou volby. Úplné vyjmutí tumoru je v případě dLGG spojeno s prodloužením období bez progrese, delším přežitím i zlepšením kvality života pacienta. Supramaximální resekce je předmětem studia recentních prací a míra jejího významu musí být ještě ověřena. Radikalita operace by však nikdy neměla být upřednostněna před kvalitou pooperačního života pacienta.
Intraoperační zobrazovací metody
Radikalita resekce s minimalizací vzniku nového neurologického deficitu je hlavním cílem chirurgické léčby LGG. Peroperačně je však obtížné identifikovat reziduum gliomu a odlišit jej od přilehlé mozkové tkáně. Za tímto účelem byly vyvinuty různé metody intraoperačního zobrazování, které pomáhají zviditelnit zbytkovou nádorovou tkáň a umožňují tak rozšíření resekce se zachováním její bezpečnosti [78].
Intraoperační zobrazovací metody zahrnují neuronavigaci, intraoperační MR (iMR), intraoperační ultrasonografii (iUSG) a fluorescenčně asistovanou resekci (fluorescence guided surgery; FGS) [78]. Každá z těchto modalit má své výhody a limitace, často bývají kombinovány a jejich využití se liší u LGG.
Neuronavigace je standardně používaná výpočetní metoda, která vyobrazuje aktuální prostorovou pozici v reálném čase do předem vytvořených snímků MR. Výhodou je možnost předoperačně identifikovat tumor a přesně lokalizovat a určit rozsah kraniotomie. V dalším kroku slouží k potvrzení šíře resekce [78]. Zde však metoda naráží na fenomén částečného posunu mozkové tkáně v průběhu operace z důvodu její retrakce a úbytku mozkomíšního moku. Předoperační anatomické poměry patrné na předoperačních MR snímcích jsou tímto mechanizmem změněny a neuronavigace se stává nepřesnou [79]. Intraoperační provedení snímků pomocí iMR a jejich využití k aktualizaci neuronavigace tyto obtíže redukuje [78].
Koncept iMR byl prvně zaveden do praxe v roce 1993 [80]. Přístroj byl přímo součástí operačního sálu a neurochirurg operoval mezi dvěma cívkami. Vzdálenost mezi nimi byla pouhých 56 cm, operatér byl tedy limitován v pohybu a v přístupu k operačnímu poli. V dalším vývoji došlo ke vzniku nových konceptů, při kterých se přístroj oddělil od operačního stolu. V prvním případě se jedná o mobilní jednotku MR, kterou lze od pacienta oddálit, pokud právě není používána. Ve druhém případě jde o fixní MR jednotku v přilehlé místnosti, do které lze pacienta v celkové anestezii převézt v kterékoli fázi operace bez narušení sterility operačního pole. Používány mohou být iMR o rozdílné síle magnetického pole. Slabší magnetické pole umožňuje větší kompaktnost přístroje a rychlejší získání snímků, jejichž kvalita je však nižší oproti iMR se silným magnetickým polem (až 3T). Pokud MR není právě využívána pro účely intraoperačního zobrazování, je možné ji využít v rámci diagnostiky pro jiné pacienty [79]. Je však důležité zmínit, že snímky provedené pomocí iMR mají specifika daná např. artefakty od vzduchu či dalšího materiálu v resekční dutině, stejně tak tím, že vyšetření se provádí s „otevřenou“ hlavou, tj. bez sutury tvrdé pleny a bez navrácené kostní ploténky. Provedení časného pooperačního vyšetření MR je indikováno.
Využití MR v průběhu operace slouží ke zhodnocení radikality resekce identifikací možného nádorového rezidua. Na základě těchto zjištění je možné ihned pokračovat v resekci v jedné době [79]. Na příkladu pacienta operovaného na naší klinice je ukázáno srovnání předoperačních, intraoperačních a kontrolních snímků MR několik let po operaci (obr. 4). Další výhodou iMR je včasná identifikace intrakraniálního hematomu či jiných komplikací dříve, než pacient opustí operační sál [79]. Rozsah resekce LGG lze nejlépe posoudit podle sekvence FLAIR, u HGG se používá T1 sekvence s kontrastní látkou. Případná hypersignalita na sekvenci iMR FLAIR nemusí ve všech případech znamenat reziduální tumor. Edjlali et al publikovali retrospektivní analýzu 21 pacientů s LGG, z nichž jedna třetina měla nález lineární FLAIR hypersignality u resekčního okraje dle iMR. Při porovnání nálezů na kontrolní MR za 3–6 měsíců došlo k vymizení těchto abnormalit, což ukázalo na jejich souvislost s operačním výkonem. Oproti tomu nález nodulární FLAIR hypersignality (> 5 mm) byl spojen s perzistencí abnormality na kontrolních snímcích či histopatologickou verifikací reziduálního tumoru [81]. Další studii obdobného typu zveřejnili Pala et al, kteří srovnávali abnormality na iMR, brzkých pooperačních snímcích MR (v rozmezí 24–48 h) a provedených kontrolních snímcích s odstupem 3–4 měsíců od operace u 33 pacientů s LGG. Hodnocení zahrnovalo sekvence T2/FLAIR. Cílem práce bylo zhodnotit, jaké načasování zobrazovacího vyšetření nejpřesněji odráží objem reziduálního tumoru. Signifikantní rozdíl v šíři rezidua byl zaznamenán mezi časnými pooperačními snímky oproti iMR či kontrolními snímky provedenými s odstupem 3–4 měsíců. Pokud je tedy reziduum hodnoceno časně po operaci, může být velikost zbytkové nádorové tkáně nadhodnocena z důvodu vykreslení operačně indukované hypersignality, která však s delším odstupem regreduje. Tato studie dává doporučení k využití iMR a kontrolních snímků MR provedených jednak časně po operaci, jednak s odstupem několika měsíců od operace. Tento postup je nyní standardem při posuzování radikality resekce a případného nádorového rezidua [82].
Image 4. Muž (31 let), jeden epileptický záchvat, histologicky gliom WHO grade II, IDH1 mutovaný, bez 1p19q kodelece.
Male (31 years), one epileptic seizure, histologically confi rmed glioma WHO grade II, IDH1 mutated, without 1p19q codeletion.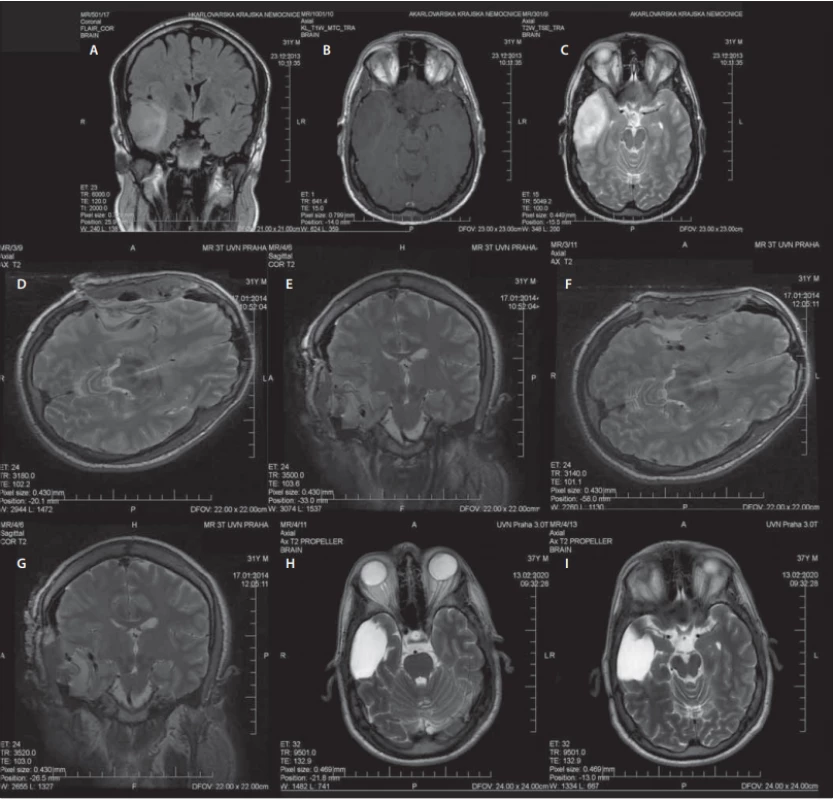
(A–C) předoperační MR – (A) koronární řez, FLAIR, (B) axiální řez, T1WI s kontrastem, (C) axiální řez, T2WI; (D, E) 1. peroperační MR – (D) axiální řez, T2WI, (E) koronární řez, T2WI; (F, G) 2. peroperační MR – (F) axiální řez, T2WI, (G) koronární řez, T2WI; (H, I) kontrolní MR po 6 letech – axiální řezy, T2WI. FLAIR – fl uid attenuated inversion recovery; IDH – izocitrátdehydrogenáza; WHO – Světová zdravotnická organizace
(A–C) preoperative MRI – (A) coronal plane, FLAIR, (B) axial plane, T1WI with contrast, (C) axial plane, T2WI; (D, E) 1st intraoperative MRI – (D) axial plane, T2WI, (E) coronal plane, T2WI; (F, G) 2nd intraoperative MRI – (F) axial plane, T2WI, (G) coronal plane, T2WI; (H, I) control MRI after 6 years – axial planes, T2WI. FLAIR – fl uid attenuated inversion recovery; IDH – isocitrate dehydrogenase; WHO – World Health OrganizationVětšina studií se shodne na přínosu iMR ve zvýšení rozsahu resekce u gliových nádorů, některé však poukazují na nejasný benefit pro celkové přežití u WHO grade IV gliomů a častější pokles skóre dle Karnofského u iMR skupiny pacientů [80]. Proto se data zdají být průkaznější právě pro LGG vs. HGG, u kterých je vliv této modality na radikalitu resekce stále kontroverzní [79]. První studie z roku 1996 poukázala na nález rezidua tumoru dle iMR po předpokládané radikální resekci u třetiny zahrnutých pacientů (n = 49) [83]. Využití iMR u pacientů s HGG plyne z randomizované prospektivní studie Senfta et al z roku 2011, která prokázala vzestup radiologicky radikálního odstranění tumoru (GTR [gross total resection]; 100 %) z 68 % v kontrolní skupině na 96 % ve skupině 0,15T iMR [84]. Wu et al v roce 2014 publikovali obdobnou studii, do které však mimo gliomy WHO stupně III a IV zahrnuli i dLGG. Na rozdíl od předchozí zmíněné studie využívali 3T iMR. Z celkového počtu 87 pacientů s gliomy WHO stupně II–IV bylo 50 pacientů s LGG, kteří byli randomizováni do skupiny iMR (n = 22) a skupiny kontrolní (n = 28). GTR byla dosažena v kontrolní skupině u 12 pacientů (43 %), ve skupině iMR po prvním provedeném intraoperačním zobrazení u 9 pacientů (41 %) a po finálním zobrazení u dalších 9 pacientů. Dohromady tedy dosáhlo radikálního odstranění dLGG 82 % pacientů ve skupině iMR oproti 43 % ve skupině kontrolní. Benefitem pro celkovou délku přežití je rozsah resekce nad 90 %, tato hranice byla překonána u 21 pacientů ve skupině iMR oproti 18 v kontrolní skupině. Dalším výstupem studie bylo srovnání četnosti pooperačního řečového a motorického deficitu mezi skupinami. Nový řečový deficit se časně po operaci vyskytl u dvojnásobku pacientů s LGG a HGG v kontrolní skupině, nicméně po 6 měsících od operace byl v každé skupině pouze jeden pacient s tímto deficitem. Motorický deficit byl zaznamenán u shodného počtu pacientů v obou skupinách. Tato studie přinesla úroveň důkazů Ib a využití iMR při gliomových operacích je tedy plně oprávněno [80]. Další unicentrická prospektivní studie z roku 2018 pochází od Leroye et al. Přinesla srovnání vlivu 1,5T iMR na šíři resekce u pacientů s postkontrastně se sytícími lézemi a s lézemi bez sycení. Práce zahrnovala 53 pacientů, z toho 34 předpokládaných LGG (skupina T2/FLAIR) a 19 předpokládaných HGG (T1 + gadolinium skupina). Z celkového počtu pacientů byly dodatečná resekce a další provedení iMR indikovány u 38 pacientů (72 %). Větší přínos z iMR měla skupina T2/FLAIR, v které došlo k rozšíření resekce z 77,3 na 97,4 % při volumometrickém srovnání snímků z první a poslední iMR [85].
Další metodou intraoperačního zobrazování je FGS spojená s podáním 5-ALA (5-aminolevulové kyseliny; Gliolanu) pacientovi několik hodin před samotným operačním výkonem. Jedná se o prekurzor hemoglobinu metabolizovaný v rychle se dělících tkáních na porfyriny, které lze excitovat a zachycovat jejich emisní spektrum pomocí filtrů, jež jsou součástí operačního mikroskopu. Z toho důvodu je očekávatelné, že 5-ALA nebývá využívána při resekcích LGG z důvodu její malé akumulace v této nádorové tkáni a nižší intenzity fluorescence, než je možné zachytit operačním mikroskopem. V experimentech však může být tato fluorescence detekována pomocí spektroskopických technik [86].
Intraoperační ultrasonografie je na řadě pracovišť rutinně využívána pro zobrazování nádorové tkáně v průběhu operace, a to ve dvou či třídimenzionální formě. Její výhodou je relativní cenová dostupnost, neinvazivnost a možnost frekventního opakování zobrazení. Nevýhodou je nutnost teoretické i manuální zkušenosti pro práci s USG přístrojem [78]. 2D iUSG se zabývala práce Wanga et al z roku 2012 shrnující data o šíři resekce u 137 pacientů (58 LGG a 79 HGG), kteří podstoupili sonograficky asistovanou resekci gliomu. V kontrolní skupině bylo náhodně vybráno 60 pacientů (30 LGG a 30 HGG), u kterých iUSG či jiné metody použity nebyly. GTR byla dosažena u 77 pacientů (69 %) oproti 19 % v kontrolní skupině [87]. Bø et al v roce 2019 publikovali prospektivní studii hodnotící vliv 3D iUSG na šíři resekce u 47 pacientů s dLGG. Efektivita stran rozsahu resekce se zdála být srovnatelná s jinými technikami. Průměrná doba sledování byla 3,8 roku. GTR byla dosažena u 14 pacientů (30 %) a 24 pacientů (51 %) mělo na kontrolních snímcích velmi drobné reziduum (do 10 ml). Průměrná šíře resekce byla 93,4 % (77,6–100 %), u 28 pacientů (60 %) bylo dosaženo odstranění více než 90 % nádorové tkáně, což znamená potenciální přínos pro délku jejich přežití [88]. Vzhledem k široké dostupnosti iUSG napříč evropskými neurochirurgickými pracovišti je kladen důraz na větší erudovanost v rámci sonografického vyšetřování.
V roce 2017 byl proveden průzkum mezi členy EANS (European Association of Neurosurgical Societies) s cílem zjistit distribuci, využití a hodnocení užitečnosti různých intraoperačních zobrazovacích metod. Hodnocení bylo prováděno zvlášť pro LGG a HGG. Celkem bylo získáno 310 odpovědí z 63 zemí. V operativě LGG respondenti nejlépe hodnotili přínos iMR, na druhém místě pak iUSG. Z hlediska gliomů vyššího stupně jsou považovány za nejužitečnější opět iMR, a to v kombinaci s FGS za pomocí aplikace 5-ALA. Dle získaných odpovědí je iMR dostupná pro 58 respondentů (18,6 %), z nichž 42 % využívá 3T iMRI, 41 % 1,5T iMR a 15 % iMR o magnetické indukci nižší než 1T. Peroperační nález LGG je v 52,8 % odpovědí hodnocen pomocí sekvence FLAIR, 24,2 % využívá T2WI a 15,1 % se řídí podle změn na T1WI. V rámci nerutinně prováděných sekvencí 43 % využívá PWI, DWI/DTI 59 % a MRS 21 % respondentů. iUSG je využívána 151 respondenty (48,6 %) [86].
Radioterapie
Radioterapie je součástí standardního managementu difuzních gliomů, a to z důvodu zvýšení lokální kontroly nádorové léze a tím zachování neurologických funkcí. Otázky správného načasování, dávek a jejich rozložení jsou stále předmětem diskuzí [2]. Při rozhodování o indikaci adjuvantní terapie a jejího průběhu je důležitá znalost výsledků histopatologických a cytogenetických vyšetření, která definují typ nádoru, jeho diferenciaci a důležité molekulární markery. Tyto znalosti poté společně s dalšími faktory zahrnujícími věk pacienta, KPS či dosaženou radikálnost resekce vedou k určení prognózy onemocnění. Na základě zmíněných informací rozlišujeme pacienty s dLGG na nízko - a vysokorizikové, u nichž se různí indikace adjuvantní terapie. Nejvíce kontroverzní se zdá být načasování adjuvantní terapie u pacientů s nízce rizikovými LGG, u kterých se předpokládá delší celkové přežívání. Na jedné straně je cílem prodloužit dobu do progrese tumoru za cenu časné radio - či chemoterapie se všemi potenciálními nežádoucími účinky. Na straně druhé je možnost adjuvantní terapii oddálit do doby progrese tumoru, čímž se tyto obtíže eliminují. Avšak doba do progrese je signifikantně kratší, než je tomu u časné adjuvantní terapie. Celková doba přežití u těchto dvou skupin se však neliší [89].
U pacientů s nově diagnostikovaným LGG se zjistilo, že radioterapie prodlužuje dobu do progrese tumoru, a to nezávisle na radikalitě resekce. Časná či oddálená radioterapie však nemá vliv na celkovou délku přežití u těchto pacientů. Klinická studie EORTC 22845 randomizovala 311 pacientů s WHO stupně II gliomem nebo pilocytárním astrocytomem po parciální resekci. Byla prováděna standardní radioterapie (54 Gy za 6 týdnů) buď časně po operaci, nebo při progresi nálezu. Střední doba sledování byla přes 8 let. Časná radioterapie zlepšila PFS (5,3 vs. 3,4 roku; p = 0,0001), ale celková doba přežití byla obdobná (7,4 vs. 7,2 roku; p = 0,872). U pacientů, u kterých byla provedena časná radioterapie, bylo pozorováno méně epileptických záchvatů. Bohužel zde nejsou k dispozici data o kvalitě života pacientů. Základní slabinou této studie je zařazení gliomů WHO I i II do studie a absence analýzy podskupin dle histologie [90]. Karim et al publikovali velmi obdobné výsledky při průběžné analýze, která měla určit význam radioterapie u těchto nádorů [91]. Pokud však byla předchozí resekce subtotální, časné ozáření vedlo k prodloužení celkové doby přežití v porovnání s pacienty, u nichž se čekalo do progrese nálezu [89].
Dalším bodem diskuze je velikost radiační dávky. U pacientů s HGG prospektivní studie dokázaly přímou úměrou lineární nárůst délky přežití, pokud došlo k navýšení dávky z 50 na 60 Gy. Otázka velikosti dávky pro pacienty s LGG se zdá být komplikovanější [92]. Nicméně bylo prokázáno, že pacienti profitují více z nízkodávkové radioterapie (45–50,4 Gy) v porovnání s vysokodávkovou strategií (59,4–64,8 Gy), která je logicky spojená s větší toxickou zátěží. Shaw et al v randomizované studii porovnali 50,4 vs. 64,8 Gy při léčbě 203 pacientů s gliomem WHO stupně II. Celkové přežití bylo vyšší u pacientů léčených nižšími dávkami (94 a 75 % po 2 a 5 letech vs. 85 a 64 %; p = 0,48). Rozdíl však nebyl statisticky signifikantní. Mezi nejčastějšími pozorovanými příznaky radiační toxicity byla dermatitida (31 %), alopecie (24 %), otitida (6 %) či nauzea (3 %). V rámci neurotoxicity se jednalo nejčastěji o letargii, bolesti hlavy, epiileptické paroxysmy a radiační encefalitidu. Závažné, život ohrožující či fatální komplikace se z celého souboru 203 pacientů objevily u 7 z nich (1 z nízkodávkové a 6 z vysokodávkové skupiny), po jednom úmrtí v obou skupinách. Dvouletá incidence závažných radiačních komplikací, vč. radiačních nekróz, byla v nízkodávkové skupině 2,5 vs. 5 % ve vysokodávkové skupině [92]. Studie EORTC 2284 randomizovala 379 pacientů, kteří byli ozářeni buď dávkou 59,4 Gy ve 33 frakcích, nebo 45 Gy ve 25 frakcích. Střední doba sledování byla 74 měsíců. Celkově nebyly zjištěny žádné významné rozdíly v celkové délce přežití nebo přežití bez recidivy nádoru. Vyšší dávka záření však vedla k vyšší toxicitě léčby [93].
Pokud po zvážení všech vstupních faktorů dojde k indikaci časné radioterapie, musejí být brána v potaz všechna rizika s ní spojená. Jedná se hlavně o možné snížení kognitivních schopností, abnormality viditelné na grafických vyšetřeních, metabolické dysfunkce nebo maligní transformace. Pokroky v radiační onkologii vedly cestou redukce objemu ozářené zdravé tkáně a tím zabránění jejího možného poškození. V případě diagnózy dLGG nyní převládají techniky fokusované radioterapie nad celkovým ozářením mozku. Využívají se např. techniky s modulovanou intenzitou radiace či její přesné cílení pomocí zobrazovacích metod, které co nejvíce chrání okolní zdravou tkáň. Další možností je intersticiální brachyterapie nebo protonová léčba, které mohou najít uplatnění u specifických skupin pacientů [89].
Další zmíněnou terapeutickou modalitou je využití protonového ozařování, jehož význam a účinnost v léčbě LGG je v nynější době podkladem řady studií. Shin et al se ve své publikaci zabývali mimo jiné i délkou přežívání pacientů s LGG, kteří byli adjuvantně léčeni protonovým zářením. Medián sledování byl 5,1 roku. Po 5 letech přežívalo 84 % pacientů, bez progrese tumoru jich v té době bylo 40 % [95]. Na práci Bucknera et al, která se zaměřila na totéž u pacientů léčených kombinací chemo - a radioterapie, kdy celkové 5leté přežití u těchto pacientů dosahovalo 72 % a bez progrese tumoru, jich bylo 61 %, lze porovnávat výsledné hodnoty [94]. Současně probíhaly studie zabývající se krátkodobými i dlouhodobými nežádoucími účinky těchto modalit, které mohou negativně ovlivnit kvalitu života těchto stále vyššího věku se dožívajících pacientů. Shin et al publikovali retrospektivní data 20 pacientů s LGG s průměrným věkem 37,5 roku, kteří byli ozáření protony 54 Gy ve 30 frakcích po 6 týdnů. Po 3 měsících se u 100 % z nich projevovala únava, alopecie u 85 %, cefalea u 75 % a lokální erytém u 85 %. Autoři také sledovali dlouhodobé následky u těchto pacientů. Srovnávali neurokognici pacientů před a po léčbě a nezjistili výraznější změny. Před ozářením mělo 11/20 pacientů částečný nebo plný pracovní úvazek, v době poslední kontroly po 5 letech jich bylo 12/20. Nejčastějšími obtížemi byla únava (70 %), cefalea (75 %) a alopecie (60 %) [95]. V neposlední řadě je snaha srovnávat dávkovací schémata protonové terapie oproti konvenčnímu ozařování fotony. Protony mají oproti fotonům příznivější fyzikální vlastnosti stran přesnějšího cílení dávky záření na nádorové ložisko. V závislosti na iniciální energii mají schopnost zastavení v určité hloubce tkáně, a nepoškozují tak nechtěným ozářením přilehlou zdravou mozkovou tkáň. Tyto vlastnosti mohou mít vliv na snížení rizika kortikální či hipokampální atrofie s rozvojem neurokognitivních obtíží. Na druhou stranu však může dojít ke snížení celkového efektu terapie, a to z důvodu nižšího přísunu dávek do blízkého okolí tohoto infiltrujícího nádorového procesu. Z důvodu variability technických parametrů jednotlivých protonových ozařovačů nelze jejich účinky generalizovat a jednoduše tak srovnávat výsledky protonové a fotonové léčby [94]. Na toto téma zaměřila svůj výzkum MRG Oncology research group, když randomizovala 120 pacientů s LGG podstupujících fotonovou nebo protonovou adjuvantní terapii, a plánuje ukončení studie do roku 2022. I přes řadu příznivých výsledků, které jednotlivé studie přinesly, nelze dělat unáhlené závěry z důvodu prozatímního nedostatku dostupných klinických dat [94]. V této době nemáme k dispozici kvalitní srovnávací studii ohledně efektu protonové a fotonové terapie. Protonová terapie by měla být využívána pouze v rámci randomizovaných studií a do běžné klinické praxe by mohla být inkorporována až v případě jejího jasně doloženého benefitu. Je jednoznačné, že v roce 2020 nelze tvrdit, že protonová léčba difuzních gliomů stupně II má lepší onkologický efekt než léčba fotonová. Závěrem tedy lze říci, že terapie fotony je stále primární modalitou pro adjuvantní léčbu dLGG.
Chemoterapie
Zájem o využití chemoterapie jako adjuvantní léčby difuzních LGG vzešla ze studií, které se zabývaly efektem této modality u anaplastických oligodendrogliomů WHO stupně III [97]. Cairncross et al ve svých publikacích poukázali na dobrou odpověď těchto nádorů na chemoterapii [98]. Dříve byli pacienti s difuzními LGG WHO stupně II vystavováni chemoterapii až při rekurenci či progresi onemocnění, zřídka jako adjuvantní terapii navazující ihned po provedené resekci nově diagnostikovaného tumoru. Diskuzí na téma chemoterapie a difuzní LGG je řada. Jedná se např. o výběr vhodného chemoterapeutika a režimu, v němž má být podáváno. Dále je otázkou, jaké skupiny pacientů stratifikovaných na základě molekulárních charakteristik tumorů budou nejvíce profitovat z časné chemoterapie. A v neposlední řadě je-li u jednotlivých skupin výhodnější samotná chemoterapie s odloženou radioterapií při progresi onemocnění, časná konkomitantní chemoradioterapie nebo pouze sledování [97].
Chemoterapeutika pro léčbu veškerých gliomů musejí splňovat kritérium dobré prostupnosti přes hematoencefalickou bariéru a obecně příznivý poměr risk/benefit. V praxi se v zahraničí využívá nejvíce PCV (lomustin – CCNU, prokarbazin a vinkristin). V ČR není tento typ chemoterapie příliš dostupný a využívá se spíše temozolomid. PCV má v porovnání s temozolomidem složitější dávkovací režim (vinkristin je nezbytné podávat intravenózně) a také se vyznačuje vyšším rizikem nežádoucích účinků zahrnujících převážně hematotoxicitu. Např. ve studii RTOG 9802 se vyskytla toxicita stupně 3 a 4 u 64 % takto léčených pacientů. Temozolomid se oproti tomu podává v tabletové formě a je obecně pacienty lépe tolerován [99]. Stupp et al ve své studii zaměřené na terapii glioblastomů udávají hematotoxicitu stupně 3 a 4 u 16 % pacientů a méně než 5 % muselo z důvodu vážných nežádoucích účinků přerušit léčbu [8]. Na druhé straně existují obavy z možné maligní transformace dLGG po terapii tímto alkylačním činidlem, a to nejspíše v důsledku inaktivace reparačních genů [99]. Ve své práci van Thuijl et al porovnávali genotyp nově diagnostikovaných dLGG léčených temozolomidem oproti jejich progresi a výsledkem byl nález hypermutovaného genotypu u 6 tumorů z 10 [100]. Wahl et al pozorovali maligní transformaci dLGG u 33 pacientů ze 120 po iniciální terapii temozolomidem [101]. V nynější době jsou předmětem řady studií nová cílená léčiva, např. inhibitory mutovaného IDH. Jedním z nich je enasidenib cílící na IDH2, který se již využívá v terapii relapsu akutní myeloidní leukemie či její refrakterní formy. Data, která jsou zatím k dispozici u dLGG, nasvědčují jejich možnému inhibičnímu vlivu na růst IDH mutovaných dLGG. Další zkoumané inhibitory cílí na poly (adenosin-5-difosfát) ribózu, IDH mutace totiž může vést k BRCA-like fenotypu. Vliv těchto nových látek na délku přežití pacientů s dLGG zatím není jasný [99].
Další otázkou je správné načasování iniciální chemoterapie. Exaktní doporučení pro zahájení chemoterapie po chirurgickém zákroku neexistuje, nicméně většina studií uvádí časové okno kolem 12 týdnů po operaci [97].
Efekt chemoterapie po radioterapii u dLGG je již prokázán, a to především s využitím PCV. Ve studii RTOG 9802 byla prováděna buď samotná radioterapie, nebo radioterapie s adjuvantní chemoterapií PCV (6 cyklů). Radioterapie byla provedena ve 30 cyklech s celkovou dávkou 54 Gy. Stran histologických nálezů soubor zahrnoval 26 % difuzních astrocytomů, 42 % oligodendrogliomů a 32 % smíšených nádorů. Hlavním sledovaným parametrem bylo celkové přežití. V době první publikace (2012) byl medián sledování 5,9 roku. Byl pozorován trend k delšímu přežití ve skupině radioterapie + chemoterapie (5leté přežití 72 vs. 63 %; HR: 0,72; 95% CI 0,47–1,10). Tehdy však nebyl rozdíl statisticky signifikantní. V roce 2016 byly publikovány dlouhodobé výsledky této studie. Střední doba sledování byla již 11,9 roku. Medián přežití ve skupině radioterapie + chemoterapie byl 13,3 vs. 7,8 roku ve skupině radioterapie bez chemoterapie (HR: 0,59; 95% CI 0,42–0,83; p = 0,003). Tento rozdíl byl již statisticky signifikantní. Medián přežití bez progrese onemocnění ve skupině s chemoterapií byl 10,4 vs. 4,0 roku bez chemoterapie (HR: 0,50; 95% CI 0,36–0,68; p < 0,001). Tyto výsledky jasně ukazují na benefit kombinované adjuvantní léčby dLGG jak stran celkové délky přežití, tak délky života bez progrese onemocnění. Nicméně více komplikací bylo pozorováno ve skupině s chemoterapií a je tedy třeba ji indikovat individuálně s ohledem na pacientovy komorbidity. Hematologická toxicita dosáhla stupně 3 u 51 % pacientů, stupně 4 u 15 % pacientů. Ve skupině bez chemoterapie byla zaznamenána toxicita stupně 3 u 8 % pacientů, stupně 4 u 3 % pacientů. Ve studii však nebylo žádné úmrtí ve spojitosti s touto toxicitou a nebyla ani zaznamenána sekundární leukemie. Příznivý efekt kombinace chemoterapie a radioterapie byl pozorován ve všech histologických skupinách, největší však u oligodendrogliomů. Molekulární analýza v této studii byla dostupná jen u menšího počtu pacientů. Pacienti s mutací IDH1 měli významně delší celkové přežití než bez mutace, bez ohledu na léčbu (p = 0,02). Medián celkového přežití byl 13,1 roku (95% CI 10,1–nedosaženo), u pacientů bez mutace IDH1 medián přežití byl 5,1 roku (95% CI 1,9–11,5). Pacienti s mutací IDH1, kteří byli ve skupině radioterapie + chemoterapie, měli celkově delší dobu přežití než ti, kteří podstoupili pouze radioterapii (HR: 0,42; 95% CI 0,20–0,86; p = 0,02). Počet pacientů bez mutace IDH1 byl příliš malý, což znemožnilo subanalýzu efektu typu onkologické léčby u těchto pacientů [6,102].
Evidence stran použití temozolomidu u gliomů WHO stupně II není rozsáhlá, jak je tomu u HGG. Studie RTOG 0424 nám poskytuje základní data, avšak na úrovni fáze II.Tato studie se zaměřila na gliomy WHO stupně II s vysokým rizikem. Pacienti měli minimálně 3 rizikové faktory, mezi které byly zařazeny věk ≥ 40 let, astrocytární histologie, bihemisférický nález, předoperační průměr tumoru > 6 cm, neurologický deficit před operací. Celkem bylo pomocí radioterapie a temozolomidu léčeno 129 pacientů. Střední doba sledování byla 4,1 roku. Celkové přežití po 3 letech bylo 73 % (95% CI 65,3–80,8), to je více, než uvádějí historická data, kde bylo přežití 54 % (p < 0,001). Medián PFS byl 4,5 roku (95% CI 3,5–NA). Většinu nežádoucích příhod představovaly hematologické komplikace: stupeň 3 u 43 % pacientů a stupeň 4 u 10 % pacientů. V této studii nedošlo k radionekróze nebo rozvoji sekundární malignity [103]. Zmíněná studie je limitována souborem zahrnujícím pouze vysoce rizikové pacienty a poměrně krátkou dobou sledování.
V ČR je v praxi temozolomid v rámci léčby dLGG využíván přednostně před PCV, a to z důvodu lepší dostupnosti, nižšího výskytu nežádoucích účinků, jednodušší cesty podání a dávkovacího schématu. Není však dost důkazů, zda je temozolomid stejně účinný jako PCV. Ačkoli přímé srovnání chybí, některá data připouštějí poněkud nižší efekt temozolomidu. Ve studii RTOG 0424, tj. s temozolomidem, byl PFS 4,5 roku, ve studii RTOG 9802, tj. s PCV, byl medián PFS 10,4 roku. Tříletá PFS byla 59 % ve studii s temozolomidem, ve studii s PCV 75–80 %. Jedná se však o nepřímá porovnání, proto na základě dat nelze tuto otázku definitivně uzavřít [103].
I přes doložený benefit přidání chemoterapie k radioterapii u pacientů s difuzními LGG je otázkou, zdali je prodloužení přežití úměrné riziku následných nežádoucích účinků radioterapie, a to hlavně u pacientů s příznivým klinickým stavem a molekulárními charakteristikami tumoru. Existuje tedy možnost u těchto pacientů začít nejprve s chemoterapií a radioterapii oddálit až dle efektu léčby. Chemoterapie se vyznačuje spíše časnými nežádoucími účinky, které často lze řešit přerušením léčby do doby jejich vymizení. Naproti tomu radioterapie má častěji pozdní důsledky stran zhoršení kognice a celkové se zdravím související kvality života, ty již bývají nevratné [101]. Volba pooperačního postupu je tedy individuální a závisí na evaluaci jednotlivých rizikových faktorů daného pacienta.
Několik studií se právě problematice samotné chemoterapie s odloženou radioterapií věnuje. Wahl et al sledovali 120 pacientů s gliomy stupně II, kteří měli reziduální nález na pooperační MR. Charakterizovali také jejich IDH1 a 1p19q status. Tito pacienti byli léčeni pouze temozolomidem po dobu 1 roku nebo do progrese nádoru a hlavním cílem bylo zjistit míru radiologické odpovědi rezidua. Medián sledování byl 7,5 roku. Ačkoli nebyl zaznamenán případ kompletní odpovědi, stabilní nález se vyskytl u 81 % pacientů. Parciální odpověď byla u 7 pacientů (8 %) a z toho 5 s kodelecí 1p19q. Dále se u nich nevyskytl ani jeden případ progrese, což ukazuje na nízké riziko při oddálení radioterapie u pacientů s touto kodelecí. Medián přežití bez progrese a celkové přežití u těchto pacientů byly 4,9 a 9,7 roku [101]. Nejlepší data na téma chemoterapie bez radioterapie nebo s odloženou radioterapií pocházejí ze studie EORTC 22033–26033. Jednalo se o studii fáze III, která porovnávala u 477 pacientů s gliomem WHO stupně II radioterapii vs. chemoterapii temozolomidem. Pacienti měli alespoň jeden rizikový faktor: věk ≥ 40 let, progredující nádor, velikost nádoru ≥ 5 cm, nádor prorůstající do druhé hemisféry či neurologický deficit. Medián sledování byl 48 měsíců (IQR 31–56). Střední doba PFS byla 39 měsíců (95% CI 35–44) ve skupině s temozolomidem a 46 měsíců (95% CI 40–56) ve skupině radioterapie (HR: 1,16; 95% CI 0,9–1,5; p = 0,22). Medián celkového přežití nebyl dosažen. Medián PFS byl vyšší ve skupině radioterapie (55 vs. 36 měsíců, HR 1,86; 95% CI 1,21–2,87; p = 0,0043) u pacientů s mutací IDH a bez kodelece 1p/19q. Naopak nebyl rozdíl v mediánu PFS u pacientů s 1p/19q kodelecí (62 vs. 55 měsíců) a pacientů bez mutace IDH (19 vs. 24 měsíců) [5]. Z toho plyne, že z radioterapie více profitují IDH mutované astrocytomy. Dalším výstupem této studie bylo porovnání vlivu radioterapie a temozolomidu na globální kognitivní funkce (hodnoceno pomocí Mini-Mental State Examination [MMSE]) a se zdravím související kvalitu života zahrnující jeho fyzické, psychické a sociální aspekty. Medián sledování byl 3 roky. Obecným předpokladem bylo menší negativní ovlivnění kvality života a kognitivních funkcí ve skupině léčené temozolomidem, to se však prokázat nepodařilo. Autoři nicméně poukázali na pokles kvality života u pacientů s dLGG již v době stanovení diagnózy a zahájení terapie. Limitací této studie je krátký medián sledování, jelikož z jiných studií vyplývá, že alterace kognitivních funkcí se nemusejí vyvinout dříve než po 6 letech od dokončení radioterapie. Další limitací může být využití testu Mini-Mental State Examination (MMSE) jako jediného prostředku k hodnocení kognice [104]. Lze tedy říci, že pooperační chemoterapii s odloženou aplikací radioterapie lze použít u pacientů s 1p19q kodelecí, tj. u oligodendrogliomů. Nelze však opomenout fakt, že dlouhodobá data podporující tento postup jsou omezená v porovnání s radioterapií s chemoterapií nebo bez chemoterapie.
Závěrem této kapitoly lze shrnout, že indikace adjuvantní onkologické terapie dLGG se odvíjí na základě určení rizikovosti každého pacienta a s ohledem na molekulární profil jeho tumoru. Z výše uvedených studií vyplývá, že IDH mutované a 1p19q nekodeletované gliomy (tedy astrocytomy) více profitují z radioterapie než ze samotné chemoterapie. Avšak jejich kombinací byl prokázán ještě větší přínos pro celkovou dobu přežití i PFS. U IDH mutovaných a 1p19q kodeletovaných gliomů (tedy oligodendrogliomů) je také možné podat samotnou chemoterapii a radioterapii odložit, čímž lze redukovat nezvratné dopady na kognitivní schopnosti pacientů. V rámci dLGG je lépe prozkoumán efekt chemoterapie PCV než temozolomidu, jehož benefit je mnohem lépe znám ze studií HGG. Srovnání jejich účinnosti na dLGG není zatím spolehlivě popsáno. V ČR se jako chemoterapeutikum první volby používá temozolomid, a to z výše zmíněných důvodů.
Neurokognitivní schopnosti a kvalita života
S postupem času se střední doba přežití u pacientů s LGG prodloužila na 5–15 let nejen v důsledku zdokonalování neurochirurgické techniky, ale i díky pokroku v oblasti radioterapie a chemoterapie [105]. S ohledem na mladší věk pacientů a relativně dlouhou dobu přežívání je vznesen požadavek na zachování kvality života. Nejvíce kontroverzí vzbuzuje otázka optimální terapie u pacientů s low-risk supratentoriálními gliomy stupně II, a to z důvodu závažnosti toxických účinků terapie, které někdy převyšují benefit z oddálení progrese tumoru. Mezi faktory určující prognózu pacientů s dLGG se řadí histologická charakteristika, velikost tumoru a jeho středočárový přesah, přítomnost neurologického deficitu a věk pacienta (> 40 let). Za nízkorizikové jsou považováni ti pacienti, kteří vykazují dva a méně rizikové faktory a oproti high-risk pacientům se třemi či více rizikovými faktory se jejich předpokládaná střední doba přežití může lišit až o 7 let [106].
Dříve se nejvíce pozornosti zaměřovalo na co nejradikálnější resekci tumoru a následnou adjuvantní léčbu bez přílišného přihlížení k možnému negativnímu ovlivnění následné kvality pacientova života. Pozitivním důsledkem takového přístupu byl zjevný nárůst střední doby přežití. Nicméně většina pacientů za svůj prodloužený život zaplatila daň v podobě dlouhodobého kognitivního deficitu [106]. Neurokognitivní funkce by měly být zařazeny do všech studií pacientů s difuzními gliomy. Bohužel je k dispozici jen několik kvalitních studií na toto téma. Tucha et al prokázali předoperační deficity jako zhoršení exekutivních funkcí a paměťové pozornosti u 91 % pacientů [107].
Neurokognice je velmi důležitou součástí HRQOL. Tento parametr je posuzován z pacientovy perspektivy a zahrnuje hodnocení oblasti fyzické, psychické, sociální a spirituální [106]. Neurokognicí se rozumí vyšší nervová činnost zahrnující paměť, udržení pozornosti, řeč a exekutivní funkce. U pacientů s difuzními gliomy jsou často tyto funkce alterovány a tím dochází k výraznému zhoršení jejich HRQOL [108]. Pacienti s gliomem jsou náchylnější ke globálnímu neurokognitivnímu poklesu na rozdíl od pacientů po CMP, kteří mají častěji fokálnější kognitivní deficity [109]. Dále bylo zjištěno, že psychické a kognitivní alterace kvalitu života pacientů zatěžovaly mnohem více než problémy se zdravím fyzickým [96]. Ačkoli se s kognitivními dysfunkcemi častěji setkají pacienti s HGG, důležitost tohoto parametru výrazně narůstá u pacientů s LGG z důvodu jejich mladšího věku a delšího přežívání [110]. Na kognitivní funkce pacientů s dLGG se v přehledovém článku zaměřili Schönová et al [111].
U pacientů s difuzními gliomy může být neurokognice alterována z řady příčin. V první řadě se uplatňuje vliv samotného tumoru, konkrétně jeho lokální růst, ischemizace a exotoxiny uvolněné z nádorových buněk při jejich zániku [110]. Dále se uplatňují s tumorem asociované epileptické záchvaty. Pacienti s vyšší frekvencí záchvatů vykazovali markantnější zhoršení kognitivních funkcí, stejně jako i pacienti léčení AED [108]. Starší AED (fenytoin, karbamazepin, kyselina valproová aj.) mohou zhoršit neurokognitivní funkce negativním ovlivněním pozornosti a paměti [112]. Novější AED (gabapentin, lamotrigin a levetiracetam) mají méně nepříznivých neurokognitivních účinků. Topiramát je spojen s největším rizikem neurokognitivního poklesu [113]. K další alteraci může docházet při progresi onemocnění, psychickém stresu nebo v souvislosti s terapií [106].
Terapeutická strategie gliomů zahrnuje tři modality: chirurgickou léčbu, radioterapii a chemoterapii. Pro indikaci k chirurgickému výkonu musí být posouzen potenciální přínos týkající se délky života vs. možné riziko zhoršení jeho kvality. Také může být složité dosáhnout extenzivní resekce a nezpůsobit přitom nový neurologický deficit [114]. Operace redukcí nádorové tkáně může vést ke zlepšení klinického stavu nebo alespoň k jeho stabilizaci. Nicméně může vést k přechodnému fokálnímu neurokognitivnímu poklesu [115]. V nynější době se rizika vzniku neurologického deficitu minimalizují z důvodu využívání moderních zobrazovacích a navigačních intraoperativních metod, které zahrnují např. iMR, iUSG, fluorescenčně navigované resekce, awake kraniotomie či různé metody neurofyziologické monitorace. Pokud by však došlo k novému deficitu, kvalita života by se razantně snížila. Za nezávislé prediktory, které ovlivňují kvalitu života, jsou považovány nově vzniklý motorický nebo řečový deficit [114]. Pacienti s nádorem v dominantní hemisféře mají více problémů s pamětí a slabší pozornost, slovní plynulost a verbální učení než pacienti s nádory v nedominantní hemisféře a mají menší šanci se po operaci zlepšit [116].
Další terapeutickou modalitou je užití konkomitantní chemoradioterapie. Bylo zjištěno, že intenzifikace radioterapie pomocí PCV chemoterapie nezpůsobila signifikantní změny v kognitivních funkcích (při použití skórovacího systému MMSE) oproti samotné radioterapii. Pacienti s lepší vstupní neurokognitivní a neurologickou funkcí mají lepší výstupní skóre MMSE. Oproti tomu řada studií prokázala mírné alterace kognitivních funkcí po podání chemoterapie, a to hlavně v oblasti exekutivních a řečových funkcí [117]. Závažnost neurokognitivních deficitů po radioterapii kolísá od mírné poruchy pozornosti nebo paměti až po demenci. Douw et al prokázali, že existuje vztah mezi neurokognitivním stavem a mozkovou atrofií leukoencefalopatií. Dále ukázali, že progrese těchto změn je větší u pacientů, kteří podstoupili radioterapii [118].
Hodnocení kognitivních funkcí pomocí testu MMSE je považováno za málo senzitivní prostředek, protože mohou uniknout pacienti s pouze lehkými změnami kognitivních funkcí [117]. Dalšími nástroji jsou např. Stroopův test, Trail Making test a testy verbální a fonemické fluence, které hodnotí jednotlivé parametry neurokognice [105].
V rámci snahy o alespoň částečnou nápravu pacientovy zhoršené kognice může pomoci správně vedená rehabilitace. Randomizovaná studie Gheringa et al prokázala, že kognitivní rehabilitace má blahodárný vliv jak na krátkodobé, tak na dlouhodobé kognitivní problémy a pocit duševní únavy [119].
Souhrn doporučení
Závěrem uvádíme přehled platných doporučení vydaných Španělskou onkologickou společností (SEOM [Spanish Society of Medical Oncology; Sociedad Española de Oncología Médica]) v roce 2017 [120].
Diagnostika a klasifikace
- histologické hodnocení vychází z klasifikace WHO z roku 2016, která integruje molekulární markery do rutinní histologické diagnózy: IDH mutace a 1p/19q kodeleci
- MR je primární zobrazovací modalitou; úroveň důkazů: III; stupeň doporučení: A
Resekce / biopsie nádoru
- primárně indikována resekce, pokud možno co nejradikálnější; úroveň důkazů II; stupeň doporučení: A
- biopsie je indikována, pokud by otevřená resekce byla příliš riziková a nevedla by k jejímu smysluplnému rozsahu: zejména u hlubokých lézí (vč. mozkového kmene) a/nebo multicentrického tumoru nebo v dalších případech, kdy je resekce kontraindikována; biopsie může být stereotaktická nebo otevřená
- u asymptomatických LGG resekce prodlužuje celkové přežití v porovnání s observací; úroveň důkazů: III
Léčba po resekci nádoru
- u mladých pacientů (≤ 40 let), kteří podstoupili kompletní resekci nádoru s příznivými molekulárními rysy (IDH mutace s kodelecí 1p/19q, tj. u oligodendrogliomu), je vhodná observace a další léčba je indikována až v případě progrese onemocnění; úroveň důkazů: III; stupeň doporučení: B
- u pacientů starších 40 let s nádorovým reziduem a jedním či více nepříznivými molekulárními rysy je vhodná pooperační onkologická léčba; úroveň důkazů: I; stupeň doporučení: A
- u pacientů nespadajících do žádné z těchto kategorií závisí další postup na rizikových faktorech; čím více rizikových faktorů, tím je vhodnější časná onkologická léčba
- rizikové faktory spojené s horší prognózou: velikost tumoru (≥ 4 cm), astrocytom nebo oligoastrocytom, reziduum nádoru ≥ 1 cm; úroveň důkazů: III; stupeň doporučení: B
Onkologická léčba
- nižší dávky ozáření jsou ekvivalentní vysokým dávkám (45–50,4 vs. 59,4–64,8 Gy) při léčbě LGG při pooperační radioterapii, nižší dávky ozáření mají menší toxicitu; úroveň důkazů: I; stupeň doporučení: A
- použití šesti cyklů adjuvantní chemoterapie po radioterapii pomocí PCV (prokarbazin, lomustin a vinkristin) prodlužuje celkovou dobu přežití pacientů; úroveň důkazů: I; stupeň doporučení: A
- není zřejmé, zda má temozolomid nahradit PCV, temozolomid však nemusí být stejně účinný jako PCV u LGG; stupeň doporučení: C
- terapeutický algoritmus následující po neurochirurgické intervenci je vyobrazen na schématu (obr. 5)
Image 5. Terapeutický algoritmus difuzních nízkostupňových gliomů při zohlednění rizikových faktorů [121].
Diff use low grade gliomas therapeutic algorithm taking risk factors into account [121].![Terapeutický algoritmus difuzních nízkostupňových gliomů při zohlednění rizikových faktorů [121].<br>
Diff use low grade gliomas therapeutic algorithm taking risk factors into account [121].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/804ead8b2c1b780c8e97b312484d16aa.png)
IDH – izocitrátdehydrogenáza
IDH – isocitrate dehydrogenaseSledování pacientů
- použití sekvencí FLAIR nebo T2WI MR je standardem péče, rutinní sledování by mělo také zahrnovat T1WI před a po podání kontrastní látky k detekci maligní transformace nádoru [120].
Grantová podpora
Podpořeno z programového projektu Ministerstva zdravotnictví ČR (grant č. 15-31379A) a Ministerstva obrany ČR (MO 1012). Veškerá práva podle předpisů na ochranu duševního vlastnictví jsou vyhrazena.
Konflikt zájmů
Autoři deklarují, že v souvislosti s předmětem práce nemají žádný konflikt zájmů.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.
prof. MUDr. David Netuka, Ph.D.
Neurochirurgická a neuroonkologická klinika
1. LF UK a ÚVN
U Vojenské nemocnice 1200
169 02 Praha
e-mail: david.netuka@uvn.cz
Přijato k recenzi: 30. 3. 2020
Přijato do tisku: 27. 8. 2020
Sources
1. Delgado-López PD, Corrales-García EM, Martino J et al.Diffuse low-grade glioma: a review on the new molecular classification, natural history and current management strategies. Clin Transl Oncol 2017; 19 (8): 931–944. doi: 10.1007/s12094-017-1631-4.
2. Weller M, van den Bent M, Tonn JC et al. European Association for Neuro-Oncology (EANO) guideline on the diagnosis and treatment of adult astrocytic and oligodendroglial gliomas. Lancet Oncol 2017; 18 (6): 315–329. doi: 10.1016/S1470-2045 (17) 30194-8.
3. Louis DN, Perry A, Reifenberger G et al. The 2016 World Health Organization Classification of Tumors of the Central Nervous System: a summary. Acta Neuropathol 2016; 131 (6): 803–820. doi: 10.1007/s00401-016-1545-1.
4. van den Bent MJ, Afra D, de Witte O et al. Long-term efficacy of early versus delayed radiotherapy for low-grade astrocytoma and oligodendroglioma in adults: The EORTC 22845 randomised trial. Lancet 2005; 366 (9490): 985–990. doi: 10.1016/S0140-6736 (05) 67070-5.
5. Baumert BG, Hegi ME, van den Bent MJ et al. Temozolomide chemotherapy versus radiotherapy in high-risk low-grade glioma: a randomized phase III Intergroup study by EORTC/NCIC-CTG/TROG/MRC-CTU (EORTC 22033-26033). Lancet Oncol 2016; 17 (11): 1521–1532. doi: 10.1016/S1470-2045 (16) 30313-8.
6. Buckner JC, Shaw EG, Pugh SL. Radiation plus procarbazine, CCNU, and vincristine in low - grade glioma. N Engl J Med 2016; 374 (14): 1344–1355. doi: 10.1056/NEJMoa1500925.
7. Leu S, von Felten S, Frank S et al. IDH/MGMT-driven molecular classification of low-grade glioma is a strong predictor for long-term survival. Neuro Oncol 2013; 15 (4): 469–479. doi: 10.1093/neuonc/nos317.
8. Stupp R, Mason WP, van der Bent MJ et al. Radiotherapy plus concomitant and adjuvant temozolomide for glioblastoma. N Engl J Med 2005; 352 (10): 987–996. doi: 10.1056/NEJMoa043330.
9. Smits A, Duffau H. Seizures and the natural history of World Health Organization grade II gliomas: a review. Neurosurgery 2011; 68 (5): 1326–1333. doi: 10.1227/NEU.0b013e31820c3419.
10. Koekkoek JA, Kerkhof M, Dirven L et al. Seizure outcome after radiotherapy and chemotherapy in low-grade glioma patients: a systematic review. Neuro Oncol 2015; 17 (7): 924–934. doi: 10.1093/neuonc/nov032.
11. Ruda R, Bello L, Duffau H et al. Seizures in low-grade gliomas: natural history, pathogenesis, and outcome after treatments. Neuro Oncol 2012; 14 : 55–64. doi: 10.1093/neuonc/nos199.
12. Avila EK, Chamberlain M, Schiff D et al. Seizure control as a new metric in assessing efficacy of tumor treatment in low-grade glioma trials. Neuro Oncol 2017; 19 (1): 12–21. doi: 10.1093/neuonc/now190.
13. Marson A, Jacoby A, Johnson A et al. Immediate versus deferred antiepileptic drug treatment for early epilepsy and single seizures: a randomised controlled trial. Lancet 2005; 365 (9476): 2007–2013. doi: 10.1016/S0140-6736 (05) 66694-9.
14. Plate KH, Wieser HG, Yasargil MG et al. Neuropathological findings in 224 patients with temporal lobe epilepsy. Acta Neuropathol 1993; 86 (5): 433–438. doi: 10.1007/BF00228577.
15. Áfra D, Osztie E, Sipos L et al. Preoperative history and postoperative survival of supratentorial low-grade astrocytomas. Br J Neurosurg 1999; 13 (3): 299–305. doi: 10.1080/02688699943727.
16. Englot DJ, Berger MS, Barbaro NM et al. Predictors of seizure freedom after resection of supratentorial low-grade gliomas. J Neurosurg 2011; 115 (2): 240–244. doi: 10.3171/2011.3.JNS1153.
17. Chang EF, Potts MB, Keles GE et al. Seizure characteristics and control following resection in 332 patients with low-grade gliomas. J Neurosurg 2008; 108 (2): 227–235. doi: 10.3171/JNS/2008/108/2/0227.
18. Duffau H, Capelle L, Lopes M et al. Medically intractable epilepsy from insular low-grade gliomas: improvement after an extended lesionectomy. Acta Neurochir (Wien) 2002; 144 (6): 563–573. doi: 10.1007/s00701-002-0941-6.
19. Martino J, Taillandier L, Moritz-Gasser S et al. Re-operation is a safe and effective therapeutic strategy in recurrent WHO grade II gliomas within eloquent areas. Acta Neurochir (Wien) 2009; 151 (5): 427–436. doi: 10.1007/s00701-009-0232-6.
20. Plathow C, Schulz-Ertner D, Thilman C et al. Fractionated stereotactic radiotherapy in low-grade astrocytomas: long-term outcome and prognostic factors. Int J Radiat Oncol Biol Phys 2003; 57 (4): 996–1003. doi: 10.1016/S0360-3016 (03) 00738-7.
21. Scerrati M, Montemaggi P, Iacoangeli M et al. Interstitial brachytherapy for low-grade cerebral gliomas: analysis of results in a series of 36 cases. Acta Neurochir 1994; 131 : 97–105. doi: 10.1007/BF01401459.
22. Brada M, Viviers L, Abson C et al. Phase II study of primary temozolomide chemotherapy in patients with WHO grade II gliomas. Ann Oncol 2003; 14 (12): 1715–1721. doi: 10.1093/annonc/mdg371.
23. Pace A, Vidiri A, Galié E et al. Temozolomide chemotherapy for progressive low-grade glioma: clinical benefits and radiological response. Ann Oncol 2003; 14 (12): 1722–1726. doi: 10.1093/annonc/mdg502.
24. Taillandier L, Duffau H. Epilepsy and insular Grade II gliomas: an interdisciplinary point of view from a retrospective monocentric series of 46 cases. Neurosurg Focus 2009; 27 (2): 1–10. doi: 10.3171/2009. 6.FOCUS09102.
25. Koekkoek JA, Dirven L, Heimans JJ et al. Seizure reduction in a low-grade glioma: more than a beneficial side effect of temozolomide. J Neurol Neurosurg Psychiatry 2015; 86 (4): 366–373. doi: 10.1136/jnnp-2014-308136.
26. Hildebrand J, Lecaille C, Perennes J et al. Epileptic seizures during follow-up of patients treated for primary brain tumors. Neurology 2005; 65 (2): 212–215. doi: 10.1212/01.wnl.0000168903.09277.8f.
27. Sherman JH, Moldovan K, Yeoh HK et al. Impact of temozolomide chemotherapy on seizure frequency in patients with low-grade gliomas. J Neurosurg 2011; 114 (6): 1617–1621. doi: 10.3171/2010.12.JNS101602.
28. Abrigo JM, Fountain DM, Provenzale JM et al. Magnetic resonance perfusion for differentiating low-grade from high-grade gliomas at first presentation (Review). Cochrane Database Syst Rev 2018; 1 (1): CD011551. doi: 10.1002/14651858.CD011551.pub2.
29. Fouke SJ, Benzinger T, Gibson D et al. The role of imaging in the management of adults with diffuse low grade glioma: a systematic review and evidence-based clinical practice guideline. J Neurooncol 2015; 125 (3): 457–479. doi: 10.1007/s11060-015-1908-9.
30. Shah AH, Madhavan K, Heros D et al. The management of incidental low-grade gliomas using magnetic resonance imaging: systematic review and optimal treatment paradigm. Neurosurg Focus 2011; 31 (6): 1–9. doi: 10.3171/2011.9.FOCUS11219.
31. Heiss WD, Raab P, and Lanfermann H. Multimodality assessment of brain tumors and tumor recurrence. J Nucl Med 2011; 52 (10): 1585–1600. doi: 10.2967/jnumed.110.084210.
32. Zhang L, Min Z, Tang M et al. The utility of diffusion MRI with quantitative ADC measurements for differentiating high-grade from low-grade cerebral gliomas: evidence from a meta-analysis. J Neurol Sci 2017; 373 : 9–15. doi: 10.1016/j.jns.2016.12.008.
33. Delgado AF, Delgado AF. Discrimination between glioma grades II and III using dynamic susceptibility perfusion MRI: a meta-analysis. Am J Neuroradiol 2017; 38 (7): 1348–1355. doi: 10.3174/ajnr.A5218.
34. Law M, Yang S, Wang H et al. Glioma grading: sensitivity, specificity, and predictive values of perfusion MR imaging and proton MR spectroscopic imaging compared with conventional MR imaging. Am J Neuroradiol 2003; 24 (10): 1989–1998.
35. Abdullah KG, Lubelski D, Nucifora PGP et al. Use of diffusion tensor imaging in glioma resection. Neurosurg Focus 2013; 34 (4): 1–7. doi: 10.3171/2013.1.FOCUS12412.
36. Wu JS, Zhou LF, Tang WJ et al. Clinical evaluation and follow-up outcome of diffusion tensor imaging-based functional neuronavigation: a prospective, controlled study in patients with gliomas involving pyramidal tracts. Neurosurgery 2007; 61 (5): 935–949. doi: 10.1227/01.NEU.0000280087.99113.B0.
37. Bello L, Castellano A, Fava E et al. Intraoperative use of diffusion tensor imaging fiber tractography and subcortical mapping for resection of gliomas: technical considerations. Neurosurg Focus 2010; 28 (2): 1–14. doi: 10.3171/2009.12.FOCUS09240.
38. Ius T, Isola M, Budai R et al. Low-grade glioma surgery in eloquent areas: volumetric analysis of extent of resection and its impact on overall survival. A single-institution experience in 190 patients – clinical article. J Neurosurg 2012; 117 (6): 1039–1052. doi: 10.3171/2012.8.JNS12393.
39. Bulik M, Jancalek R, Vanicek J et al. Potential of MR spectroscopy for assessment of glioma grading. Clin Neurol Neurosurg 2013; 115 (2): 146–153. doi: 10.1016/j.clineuro.2012.11.002.
40. Wang Q, Zhang H, Zhang J et al. The diagnostic performance of magnetic resonance spectroscopy in differentiating high-from low-grade gliomas: a systematic review and meta-analysis. Eur Radiol 2016; 26 (8): 2670–2684. doi: 10.1007/s00330-015-4046-z.
41. Bradac O, Vrana J, Jiru F et al. Recognition of anaplastic foci within low-grade gliomas usingMR spectroscopy. Br J Neurosurg 2014; 28 (5): 631–636.doi: 10.3109/02688697.2013.872229.
42. Minn H. PET and SPECT in low-grade glioma. Eur J Radiol 2005; 56 (2): 171–178. doi: 10.1016/j.ejrad.2005.03.020.
43. Dunet V, Pomoni A, Hottinger A et al. Performance of 18F-FET versus 18F-FDG-PET for the diagnosis and grading of brain tumors: systematic review and meta-analysis. Neuro Oncol 2016; 18 (3): 426–434. doi: 10.1093/neuonc/nov148.
44. Delgado AF, Delgado AF. Discrimination between primary low-grade and high-grade glioma with 11C-methionine PET: a bivariate diagnostic test accuracy meta-analysis. Br J Radiol 2018; 91 : 20170426. doi: 10.1259/bjr.20170426.
45. Näslund O, Smits A, Förander P et al. Amino acid tracers in PET imaging of diffuse low-grade gliomas: a systematic review of preoperative applications. Acta Neurochir (Wien) 2018; 160 : 1451–1460. doi: 10.1007/s00701-018-3563-3.
46. Kim MM, Lawrence TS, Cao Y. Advances in MR and PET imaging: assessing response in the treatment of low grade glioma. Semin Radiat Oncol 2016; 25 (3): 172–180. doi: 10.1016/j.semradonc.2015.02.003.
47. Rapp M, Floeth FW, Felsberg J et al. Clinical value of O - (2-18 F]-fluoroethyl) -L-tyrosine positron emission tomography in patients with low-grade glioma. Neurosurg Focus 2013; 34 (2): 1–8. doi: 10.3171/2012.12.FOCUS12336.
48. Kunz M, Thon N, Eigenbrod S et al. Hot spots in dynamic18FET-PET delineate malignant tumor parts within suspected WHO grade II gliomas. Neuro Oncol 2011; 13 (3): 307–316. doi: 10.1093/neuonc/noq196.
49. Wyss M, Hofer S, Bruehlmeier M et al. Early metabolic responses in temozolomide treated low-grade glioma patients. J Neurooncol 2009; 95 (1): 87–93. doi: 10.1007/s11060-009-9896-2.
50. Freyschlag CF, Krieg SM, Kerschbaumer J et al. Imaging practice in low-grade gliomas among European specialized centers and proposal for a minimum core of imaging. J Neurooncol 2018; 139 (3): 699–711. doi: 10.1007/s11060-018-2916-3.
51. Cahill DP, Sloan AE, Nahed BV et al. The role of neuropathology in the management of patients with diffuse low grade glioma: a systematic review and evidence-based clinical practice guideline. J Neurooncol 2015; 125 (3): 531–549. doi: 10.1007/s11060-015-1909-8.
52. Di Carlo DT, Duffau H, Cagnazzo F et al. IDH wild-type WHO grade II diffuse low-grade gliomas. A heterogeneous family with different outcomes. Systematic review and meta-analysis. Neurosurg Rev 2020; 43 (2): 383–395. doi: 10.1007/s10143-018-0996-3.
53. Kramář F, Minárik M, Belšánová B et al. Genetické a epigenetické faktory podmiňující vznik a prognózu mozkových gliomů – souhrn současných poznatků. Cesk Slov Neurol N 2016; 79/112 (4): 400–405. doi: 10.14735/amcsnn2016400.
54. Taylor JW, Chi AS, and Cahill DP. Tailored therapy in diffuse gliomas: using molecular classifiers to optimize clinical management. Oncology 2013; 27 (6): 504–514.
55. Pignatti BF, van der Bent M, Curran D et al. Prognostic factors for survival in adult patients with cerebral low-grade glioma. J Clin Oncol 2002; 20 (8): 2076–2084. doi: 10.1200/JCO.2002.08.121.
56. Kazda T, Lakomý R, Poprach A et al. Controversy in the postoperative treatment of low-grade gliomas. Klin Onkol 2017; 30 (5): 337–342. doi: 10.14735/amko2017337.
57. Shaw EG, Berkey BMS. Recurrence following neurosurgeon-determined gross-total resection of adult supratentorial low-grade glioma: results of a prospective clinical trial. J Neurosurg 2008; 109 (5). doi: 10.3171/JNS/2008/109/11/0835.
58. Boissonneau S, Duffau H. Identifying clinical risk in low grade gliomas and appropriate treatment strategies, with special emphasis on the role of surgery. Expert Rev Anticancer Ther 2017; 17 (8): 703–716. doi: 10.1080/14737140.2017.1342537.
59. Jakola AS, Skjulsvik AJ, Myrmel KS et al. Surgical resection versus watchful waiting in low-grade gliomas. Ann Oncol 2017; 28 (8): 1942–1948. doi: 10.1093/annonc/ mdx230.
60. van Thuijl HF, Scheinin I, Sie D et al. Spatial and temporal evolution of distal 10q deletion, a prognostically unfavorable event in diffuse low-grade gliomas. Genome Biol 2014; 15 : 1–13. doi: 10.1186/s13059-014-0471-6.
61. Smith JS, Chang EF, Chang SM et al. Role of Extent of resection in the long-term outcome of low-grade hemispheric gliomas. J Clin Oncol 2015; 26 (8): 1338–1345. doi: 10.1200/JCO.2007.13.9337.
62. Capelle L, Fontaine D, Mandonnet E et al. Spontaneous and therapeutic prognostic factors in adult hemispheric World Health Organization Grade II gliomas: a series of 1097 cases. J Neurosurg 2013; 118 (6): 1157–1168. doi: 10.3171/2013.1.JNS121.
63. ChaiChana KL, McGirt MJ, Laterra J et al. Recurrence and malignant degeneration after resection of adult hemispheric low-grade gliomas. Neuro-oncology Surg 2010; 112 (1): 10–17. doi: 10.3171/2008.10.JNS08608.
64. Englot DJ, Berger MS, Barbaro NM et al. Extent of Surgical resection predicts seizure freedom in low-grade temporal lobe brain tumors. Neurosurgery 2012; 70 (4): 921–928. doi: 10.1227/NEU.0b013e31823c3a30.
65. Ahmadi R, Dictus C, Hartmann C et al. Long-term outcome and survival of surgically treated supratentorial low-grade glioma in adult patients. Acta Neurochir (Wien) 2009; 151 : 1359–1365. doi: 10.1007/s00701-009-0435-x.
66. Duffau H, Taillandier L. New concepts in the management of diffuse low-grade glioma: proposal of a multistage and individualized therapeutic approach. Neuro-oncology Surg 2015; 17 (3): 332–342. doi: 10.1093/neuonc/nou153.
67. Schomas DA, Laack NN, Rao RD et al. Intracranial low-grade gliomas in adults: 30-year experience with long-term follow-up at Mayo Clinic. Neuro Oncol 2009; 11 : 437–445. doi: 10.1215/15228517-2008-102.
68. Pallud J, Varlet P, Devaux B et al. Diffuse low-grade oligodendrogliomas extend beyond MRI-defined abnormalities. Neurology 2010; 74 : 1724–1731.
69. Yordanova YN, Duffau H. Supratotal resection of diffuse gliomas – an overview of its multifaceted implications. Neurochirurgie 2017; 63 (3): 243–249. doi: 10.1016/j.neuchi.2016.09.006.
70. Yordanova YN, Moritz-Gasser S, Duffau H. Awake surgery for WHO grade II gliomas within ‘noneloquent’ areas in the left dominant hemisphere: toward a ‘supratotal’ resection – Clinical article. J Neurosurg 2011; 115 (2): 232–239. doi: 10.3171/2011.3.JNS101333.
71. Duffau H. Long-term outcomes after supratotal resection of diffuse low-grade gliomas: a consecutive series with 11-year follow-up. Acta Neurochir (Wien) 2016; 158 : 51–58. doi: 10.1007/s00701-015-2621-3.
72. Uppstrom TJ, Singh R, Hadjigeorgiou GF et al. Repeat surgery for recurrent low-grade gliomas should be standard of care. Clin Neurol Neurosurg 2016; 151 : 18–23. doi: 10.1016/j.clineuro.2016.09.013.
73. Duffau H. Is non-awake surgery for supratentorial adult low-grade glioma treatment still feasible? Neurosurg Rev 2018; 41 (1): 133–139. doi: 10.1007/s10143-017-0918-9.
74. De Benedictis A, Moritz-Gasser S, Duffau H. Awake mapping optimizes the extent of resection for low-grade gliomas in eloquent areas. Neurosurgery 2010; 66 (6): 1074–1084. doi: 10.1227/01.NEU.0000369514.74284.78.
75. Chang EF, Clark A, Smith JS et al. Functional mapping-guided resection of low-grade gliomas in eloquent areas of the brain: Improvement of long-term survival – clinical article. J Neurosurg 2011; 114 (3): 566–573. doi: 10.3171/2010.6.JNS091246.
76. De Witt Hamer PC, Robles SG, Zwinderman AH et al. Impact of intraoperative stimulation brain mapping on glioma surgery outcome : a meta-analysis. J Clin Oncol 2014; 30 (2): 2559–2565. doi: 10.1200/JCO.2011.38.4818.
77. Duffau H. Lessons from brain mapping in surgery for low-grade glioma: insights into associations between tumour and brain plasticity. Lancet Neurol 2005; 4 : 476–486.
78. Jenkinson MD, Barone DG, Bryant A et al. Intraoperative imaging technology to maximise extent of resection for glioma (Review). Cochrane Database Syst Rev 2018; 1 (1): CD012788. doi: 10.1002/14651858.CD012788.pub2.
79. Liang D, Schulder M. The role of intraoperative magnetic resonance imaging in glioma surgery. Surg Neurol Int 2012; 3 : 5320–5327. doi: 10.4103/2152-7806.103029.
80. Wu JS, Gong X, Song YY et al. 3.0-T intraoperative magnetic resonance imaging-guided resection in cerebral glioma surgery: interim analysis of a prospective, randomized, triple-blind, parallel-controlled trial. Neurosurgery 2014; 61 (1): 145–154. doi: 10.1227/NEU.0000000000000372.
81. Edjlali M, Ploton L, Maurage CA et al. Intraoperative MRI and FLAIR analysis: implications for low-grade glioma surgery. J Neuroradiol 2019; S0150-9861 (19) 30448-1. doi: 10.1016/j.neurad.2019.08.005.
82. Pala A, Brand C, Kapapa T et al. The value of intraoperative and early postoperative magnetic resonance imaging in low-grade glioma surgery: a retrospective study. World Neurosurg 2016; 93 : 191–197. doi: 10.1016/j.wneu.2016.04.120.
83. Black PM, Alexander E, Martin C et al. Craniotomy for tumor treatment in an intraoperative magnetic resonance imaging unit. Neurosurgery 1999; 45 (3): 423–433. doi: 10.1097/00006123-199909000-00001.
84. Senft C, Bink A, Franz K et al. Intraoperative MRI guidance and extent of resection in glioma surgery: a randomised, controlled trial. Lancet Oncol 2011; 12 (11): 997–1003. doi: 10.1016/S1470-2045 (11) 70196-6.
85. Leroy HA, Delmaire C, Le Rhun E et al. High-field intraoperative MRI in glioma surgery: a prospective study with volumetric analysis of extent of resection and functional outcome. Neurochirurgie 2018; 64 (3): 155–160. doi: 10.1016/j.neuchi.2018.02.003.
86. Coburger AJ, Nabavi A, König R et al. Contemporary use of intraoperative imaging in glioma surgery: a survey among EANS members. Clin Neurol Neurosurg 2017; 163 : 133–141. doi: 10.1016/j.clineuro.2017.10.033.
87. Wang J, Liu X, Ba YM et al. Effect of sonographically guided cerebral glioma surgery on survival time. J Ultrasound Med 2012; 31 (5): 757–762. doi: 10.7863/jum.2012.31.5.757.
88. Bø HK, Solheim O, Kvistad KA et al. Intraoperative 3D ultrasound–guided resection of diffuse low-grade gliomas: radiological and clinical results. J Neurosurg 2019; 132 (2): 518–529. doi: 10.3171/2018.10.jns181290.
89. Ryken TC, Parney I, Buatti J et al. The role of radiotherapy in the management of patients with diffuse low grade glioma: a systematic review and evidence-based clinical practice guideline. J Neurooncol 2015; 125 (3): 551–583. doi: 10.1007/s11060-015-1948-1.
90. van den Bent M, Afra D, de Witte O et al. Long-term efficacy of early versus delayed radiotherapy for low-grade astrocytoma and oligodendroglioma in adults: the EORTC 22845 randomised trial. Lancet Neurol 2005; 366 : 985–990. doi: 10.1016/S0140-6736 (05) 67070-5.
91. Karim AB, Afra D, Cornu P et al. Randomized trial on the efficacy of radiotherapy for cerebral low-grade glioma in the adult: European Organization for Research and Treatment of Cancer Study 22845 with the Medical Research Council study BRO4: an interim analysis. Int J Radiat Oncol Biol Phys 2002; 52 (2): 316–324. doi: 10.1016/S0360-3016 (01) 02692-X.
92. Shaw E, Arusell R, Scheithauer B et al. Prospective randomized trial of low - versus high-dose radiation therapy in adults with supratentorial low-grade glioma: initial report of a north central cancer treatment group/radiation therapy oncology group/eastern cooperative oncology group study. J Clin Oncol 2002; 20 (9): 2267–2276. doi: 10.1200/JCO.2002.09.126.
93. Karim AB, Maat B, Hatlevoll R et al. A randomized trial on dose-response in radiation therapy of low-grade cerebral glioma: European organization for research and treatment of cancer (EORTC) study 22844. Int J Radiat Oncol Biol Phys 1996; 36 (3): 549–556. doi: 10.1016/S0360-3016 (96) 00352-5.
94. Thurin E, Nyström PW, Smits A et al. Proton therapy for low-grade gliomas in adults: a systematic review. Clin Neurol Neurosurg 2018; 174 : 233–238. doi: 10.1016/j.clineuro.2018.08.003.
95. Shih HA, Sherman JC, Nachtigall LB et al. Proton therapy for low-grade gliomas: results from a prospective trial. Cancer 2015; 121 (10): 1712–1719. doi: 10.1002/cncr.29237.
96. Buckner JC, Pugh SL, Shaw EG et al. Phase III study of radiation therapy (RT) with or without procarbazine, CCNU, and vincristine (PCV) in low-grade glioma: RTOG 9802 with Alliance, ECOG, and SWOG. J Clin Oncol 2014; 32 (15): 2000. doi: 10.1200/jco.2014.32.15_suppl.2000.
97. Ziu M, Kalkanis SN, Gilbert M et al. The role of initial chemotherapy for the treatment of adults with diffuse low grade glioma: a systematic review and evidence-based clinical practice guideline. J. Neurooncol 2015; 125 (3): 585–607. doi: 10.1007/s11060-015-1931-x.
98. Cairncross G, Wang M, Shaw E et al. Phase III trial of chemoradiotherapy for anaplastic oligodendroglioma: long-term results of RTOG 9402. J Clin Oncol 2013; 31 (3): 337–343. doi: 10.1200/JCO.2012.43.2674.
99. Donovan LE, Lassman AB. Chemotherapy treatment and trials in low-grade gliomas. Neurosurg Clin N Am 2019; 30 (1): 103–109. doi: 10.1016/j.nec.2018.08.007.
100. van Thuijl HF, Mazor T, Johnson BE et al. Evolution of DNA repair defects during malignant progression of low-grade gliomas after temozolomide treatment. Acta Neuropathol 2015; 129 (4): 597–607. doi: 10.1007/s00401-015-1403-6.
101. Wahl M, Phillips JJ, Molinaro AM et al. Chemotherapy for adult low-grade gliomas: clinical outcomes by molecular subtype in a phase II study of adjuvant temozolomide. Neuro Oncol 2017; 19 (2): 242–251. doi: 10.1093/neuonc/now176.
102. Shaw EG, Wang M, Coons SW et al. Randomized trial of radiation therapy plus procarbazine, lomustine, and vincristine chemotherapy for supratentorial adult low-grade glioma: initial results of RTOG 9802. J Clin Oncol 2012; 30 (25): 3065–3070. doi: 10.1200/JCO.2011.35.8598.
103. Fisher BJ, Hu C, Macdonald DR et al. Phase 2 Study of temozolomide-based chemoradiation therapy for high-risk low-grade gliomas: preliminary results of radiation therapy oncology group 0424. Int J Radiat Oncol Biol Phys 2015; 91 (3): 497–504. doi: 10.1016/j.ijrobp.2014.11.012.
104. Reijneveld JC, Taphoorn MJ, Coens C et al. Health-related quality of life in patients with high-risk low-grade glioma (EORTC 22033-26033): a randomised, open-label, phase 3 intergroup study. Lancet Oncol 2016; 17 (11): 1533–1542. doi: 10.1016/S1470-2045 (16) 30305-9.
105. van Loon EM, Heijenbrok-Kal MH, van Loon WS et al. Assessment methods and prevalence of cognitive dysfunction in patients with low-grade glioma: a systematic review. J Rehabil Med 2015; 47 (6): 481–488. doi: 10.2340/16501977-1975.
106. Shields LB and Choucair AK. Management of low-grade gliomas: a review of patient-perceived quality of life and neurocognitive outcome. World Neurosurg 2014; 82 (1–2): 299–309. doi: 10.1016/j.wneu.2014.02.033.
107. Tucha O, Smely C, Preier M et al. Cogntive deficits before treatment among patients with brain tumors. Neurosurgery 2000; 47 (2): 324–334. doi: 10.1097/00006123-200008000-00011.
108. McAleer MF, Brown PD. Neurocognitive function following therapy for low-grade gliomas. Semin Radiat Oncol 2015; 25 (3): 210–218. doi: 10.1016/j.semradonc.2015.02.005.
109. Hahn CA, Dunn RH, Logue PE et al. Prospective study of neuropsychologic testing and quality-of-life assessment of adults with primary malignant brain tumors. Int J Radiat Oncol Biol Phys 2003; 55 (4): 992–999. doi: 10.1016/S0360-3016 (02) 04205-0.
110. van Kessel E, Baumfalk AE, van Zandvoort MJ et al. Tumor-related neurocognitive dysfunction in patients with diffuse glioma: a systematic review of neurocognitive functioning prior to anti-tumor treatment. J. Neurooncol 2017; 134 (1): 9–18. doi: 10.1007/s11060-017-2503-z.
111. Schönová K, Weissenberger S, Preiss M et al. Kognitivní funkce u pacientů s nízkostupňovými gliomy – přehledová studie. Cesk Slov Neurol N 2017; 80/113 (4): 396–399. doi: 10.14735/amcsnn2017396.
112. Meador KJ. Cognitive outcomes and predictive factors in epilepsy. Neurology 2002; 58 (8): S21 LP-S26. doi: 10.1212/WNL.58.8_suppl_5.S21.
113. Meador KJ. Cognitive and memory effects ofthe new antiepileptic drugs. Epilepsy Res 2006; 68 (1): 19–94. doi: 10.1016/j.eplepsyres.2005.09.022.
114. Jakola AS, Unsgå G, Solheim O. Quality of life in patients with intracranial gliomas: the impact of modern image-guided surgery. Clinical article. J Neurosurg 2011; 114 (6): 1622–1630. doi: 10.3171/2011.1.JNS101657.
115. Duffau H. Surgery of low-grade gliomas: towards a ‘functional neurooncology. Curr Opin Oncol 2009; 21 (6): 543–549. doi: 10.1097/CCO.0b013e3283305996.
116. Yoshii Y, Tominaga D, Sugimoto K et al. Cognitive function of patients with brain tumor in pre - and postoperative stage. Surg Neurol 2008; 69 (1): 51–61. doi: 10.1016/j.surneu.2007.07.064.
117. Prabhu RS, Won M, Shaw EG et al. Effect of the addition of chemotherapy to radiotherapy on cognitive function in patients with low-grade glioma: secondary analysis of RTOG 98-02. J Clin Oncol 2014; 32 (6): 535–541. doi: 10.1200/JCO.2013.53.1830.
118. Douw L, Klein M, Fagel SS et al. Cognitive and radiological effects of radiotherapy in patients with low-grade glioma: long-term follow-up. Lancet Neurol 2009; 8 (9): 810–818. doi: 10.1016/S1474-4422 (09) 70204-2.
119. Gehring K, Sitskoorn MM, Gundy CM et al. Cognitive rehabilitation in patients with gliomas: a randomized, controlled trial. J Clin Oncol 2009; 27 (22): 3712–3722. doi: 10.1200/JCO.2008.20.5765.
120. Sepúlveda-Sánchez JM, Muňoz-Langa J, Arraéz MÁ et al. SEOM clinical guideline of diagnosis and management of low - grade glioma (2017). Clin Transl Oncol 2018; 20 (1): 3–15. doi: 10.1007/s12094-017-1790-3.
121. Sepúlveda-Sánchez JM, Muňoz-Langa J, Arraéz MÁ et al. SEOM clinical guideline of diagnosis and management of low - grade glioma (2017). Clin Transl Oncol 2018; 20 (1): 3–15. doi: 10.1007/s12094-017-1790-3.
Labels
Paediatric neurology Neurosurgery Neurology
Article was published inCzech and Slovak Neurology and Neurosurgery

2020 Issue 5-
All articles in this issue
- Diffuse low grade gliomas
- Respiratory rehabilitation in patients with amyotrophic lateral sclerosis
- Socio-economic impact of headache disorders –reasons and improvement possibilities
- Neurorehabilitation in patients with amyotrophic lateral sclerosis
- Surgical treatment of degenerative scoliosis
- Functional and structural cortical changes in patients with non-specific low back pain
- Cognitive-motor interference after stroke
- Sonographic evaluation of sciatic nerve in individuals with S1 radicular symptoms
- Taste strips – the method of a self-administered taste function test
- The efficiency of micro-vascular decompression versus micro-vascular decompression with partial sensory rhizotomy for classical trigeminal neuralgia – a retrospective analysis of 58 patients
- Patient with Parkinson‘s disease in data sources of the National Health Information System
- Treatment with intravenous trombolysis out of stroke center
- Decompressive craniectomy in malignant middle cerebral artery infarction – monoinstitutional retrospective analysis of a set of 33 patients
- Consecutive low-flow and high-flow EC-IC bypass in ischemia prevention during internal carotid artery sacrifice in intracavernous aneurysm
- Venous sinus stenting in idiopathic intracranial hypertension
- Posterior reversible encephalopathy syndrome associated with Neisseria elongata meningitis
- Hyperbarická oxygenoterapie & mozek; přehled z výroční konference EUBS 2019
- Amnesia Light and Brief Assessment (ALBA) test – the second version and repeated examinations
- Czech and Slovak Neurology and Neurosurgery
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Diffuse low grade gliomas
- Respiratory rehabilitation in patients with amyotrophic lateral sclerosis
- Amnesia Light and Brief Assessment (ALBA) test – the second version and repeated examinations
- Neurorehabilitation in patients with amyotrophic lateral sclerosis
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

