-
Medical journals
- Career
Komorbidity Alzheimerovej choroby – výsledky multicentrickej prierezovej observačnej štúdie COSMOS v Slovenskej republike
Authors: M. Minár 1; J. Dragašek 2; I. Mátéffy 3; P. Valkovič 1,4
Authors‘ workplace: II. neurologická klinika LF UK a UN Bratislava, Slovensko 1; I. psychiatrická klinika LF UPJŠ Košice, Slovensko 2; Psychiatrická klinika SZU UN Bratislava, Slovensko 3; Ústav normálnej a patologickej fyziológie, Slovenská akadémia vied, Bratislava, Slovensko 4
Published in: Cesk Slov Neurol N 2020; 83(1): 95-99
Category: Original Paper
doi: https://doi.org/10.14735/amcsnn202095Alzheimerova demencia (AD) patrí medzi najviac invalidizujúce ochorenia prevažne staršej populácie. Dáta nasvedčujú, že pridružené komorbidity komplikujú diagnostiku aj liečbu a urýchľujú progresiu AD. Epidemiologické dáta zo strednej Európy chýbajú, preto cieľom projektu COSMOS bolo odhaliť prevalenciu psychiatrických a somatických komorbidít pacientov s AD v slovenskej populácii. V tejto multicentrickej prierezovej observačnej štúdii boli údaje o pacientoch s AD z celého Slovenska získané z 89 pracovísk pomocou on-line dotazníka, ktorý obsahoval demografické a klinické údaje, informácie o všetkých komorbiditách a ich vplyve na adherenciu a účinnosť terapie.
Overview
Cieľ: Alzheimerova demencia (AD) patrí medzi najviac invalidizujúce ochorenia prevažne staršej populácie. Dáta nasvedčujú, že pridružené komorbidity komplikujú diagnostiku aj liečbu a urýchľujú progresiu AD. Epidemiologické dáta zo strednej Európy chýbajú, preto cieľom projektu COSMOS bolo odhaliť prevalenciu psychiatrických a somatických komorbidít pacientov s AD v slovenskej populácii.
Metódy: V tejto multicentrickej prierezovej observačnej štúdii boli údaje o pacientoch s AD z celého Slovenska získané z 89 pracovísk pomocou on-line dotazníka, ktorý obsahoval demografické a klinické údaje, informácie o všetkých komorbiditách a ich vplyve na adherenciu a účinnosť terapie.
Výsledky: Zo všetkých 494 pacientov malo 94,53 % aspoň jednu somatickú komorbiditu, 80,16 % malo aspoň jednu psychiatrickú komorbiditu. So závažnosťou AD korelovali počet somatických (rs = 0,120; p = 0,008) aj psychiatrických (rs = 0,267; p < 0,001) komorbidít. Počet psychiatrických komorbidít (b = –0,021; p = 0,025) a závažnosť AD (b = –0,071; p < 0,001) predikovali horší efekt terapie. Adherentní pacienti mali väčšiu pravdepodobnosť účinnej terapie demencie (OR 5,270; 95% CI 3,061–9,073; p < 0,001).
Záver: Komorbidity pri AD dokázane akcelerujú progresiu základného ochorenia a komplikujú diagnostiku a terapiu. Sú to ale najviac ovplyvniteľné faktory kognitívnej deteriorácie, preto ich aktívne vyhľadávanie, včasná diagnostika a adekvátna terapia môžu zlepšiť adherenciu pacientov a tak zefektívniť manažment AD.
Klíčová slova:
Alzheimerova choroba – komorbidity – psychiatrické – somatické – terapia – adherencia
Úvod
Alzheimerova demencia (AD) je stále považovaná za najčastejšie neurodegeneratívne ochorenie s maximálnym výskytom po 65. roku života. So stúpajúcim vekom však narastá aj počet somatických komorbidít – mortalitu pacientov s AD najviac zvyšujú imobilizácia, malnutrícia, dekubity, diabetes mellitus a kardiovaskulárne ochorenia [1]. Väčšina pacientov má navyše minimálne tri súbežné komorbidity, a ich počet sa zvyšuje s progresiou AD [2]. Pribúdajú predovšetkým neuropsychiatrické komplikácie samotnej demencie – apatia, depresia, anxieta, poruchy spánku a príjmu potravy, halucinácie či delírium [3]. Komorbidity pri AD sú dokázane spojené s rýchlejším kognitívnym úpadkom [4], predlžujú čas hospitalizácie [5] a navyšujú náklady spojené s manažmentom pacientov [6,7]. U pacientov s demenciou s Lewyho telieskami sa udáva vyššia prevalencia depresie (OR = 2,12) či migrény (OR = 3,65) [8]. Vaskulárna demencia je na druhej strane spojená s vyšším výskytom kardiovaskulárnych a cerebrovaskulárnych komplikácií [9]. Hoci majú tieto vyššiu prevalenciu komorbidít, pri výrazne častejšej AD sú ich následky v tomto prípade oveľa výraznejšie.
Epidemiologické údaje o prevalencii a vplyve komorbidít na neurologické a psychiatrické ochorenia v našej populácii v literatúre chýbajú. Navyše údaje z randomizovaných kontrolných štúdií nie celkom odrážajú skutočnosť v reálnej praxi (striktné inklúzne aj exklúzne kritéria aj protokol). Projekt COSMOS (COmorbiditieS in MOst severe neurology and psychiatric disorders in Slovakia) si dal za primárny cieľ odhaliť prevalenciu psychiatrických a somatických komorbidít u najčastejších neurologických a psychiatrických ochorení v slovenskej populácii pacientov. Okrem AD sa sledovala Parkinsonova choroba, depresia, bipolárna afektívna porucha a schizofrénia. Sekundárnym cieľom bolo zistiť vplyv komorbidít na manažment pacientov s AD.
Metódy
Do tejto multicentrickej prierezovej neintervenčnej observačnej štúdie sme zaradili pacientov s klinicky pravdepodobnou AD sledovaných v ordinácii neurológa alebo psychiatra (celkovo bolo zapojených 89 pracovísk – 38 neurologických a 51 psychiatrických).
Pomocou elektronického dotazníka sme zozbierali relevantné demografické a klinické údaje:
- vek,
- pohlavie,
- trvanie AD,
- forma AD,
- závažnosť AD,
- všetky psychiatrické a somatické komorbidity;
a otázky, týkajúce sa:
- adekvátnej liečby komorbidity,
- adherencie pacientov ku farmakoterapii a
- celkovej účinnosti terapie podľa názoru ošetrujúceho lekára.
Dáta boli spracované v štatistickom programe IBM® SPSS Statistics® 23 (IBM, Armonk, NY, USA). Na hodnotenie demografických a klinických údajov boli použité metódy deskriptívnej štatistiky. Parametrické premenné sme porovnali pomocou Studentovho T-testu, neparametrické pomocou Mann-Whitneyho U testu. Vzťah parametrických premenných sme posudzovali pomocou Pearsonovho korelačného koeficientu, pre neparametrické premenné sme použili Spearmanov korelačný koeficient. Na potvrdenie závislosti sme použili lineárnu regresiu v prípade lineárnych vzťahov medzi premennými, v prípade binárnych premenných bola využitá binárna logistická regresia. Hladina významnosti bola p < 0,05.
Výsledky
Celkovo bolo zaradených 494 pacientov. Priemerný vek bol 75,51 ± 8,41 (40–96) rokov, trvanie 3,75 ± 2,58 (1–20) rokov. Ženy tvorili 61,34 %.
Zo všetkých pacientov malo 12,5 % AD so skorým začiatkom, 47,4 % s neskorým začiatkom, 35,4 % malo zmiešanú (atrofickú a vaskulárnu) alebo atypickú formu a 4,7 % nešpecifikovanú formu. Podľa závažnosti bola začínajúca AD u 2,8 %, mierna AD u 18,8 %, stredne ťažká AD u 48,4 %, ťažká AD u 23,7 % a veľmi ťažká u 6,3 %.
Priemerné skóre Mini Mental State Examination (MMSE) bolo 18,52 ± 3,56 (8–26) bodov. CT mozgu absolvovalo 92 % pacientov, 34 % malo aj vyšetrenie MR. U 90 % pacientov bola prítomná atrofia mozgu, u 66 % boli potvrdené aj vaskulárne zmeny.
Zo všetkých 494 pacientov malo aspoň jednu psychiatrickú komorbiditu 80,16 % (obr. 1) a 94,53 % aspoň jednu somatickú komorbiditu (obr. 2).
Image 1. Jednotlivé psychiatrické komorbidity a ich prevalencia.
Fig. 1. Particular psychiatric comorbidities and their prevalence.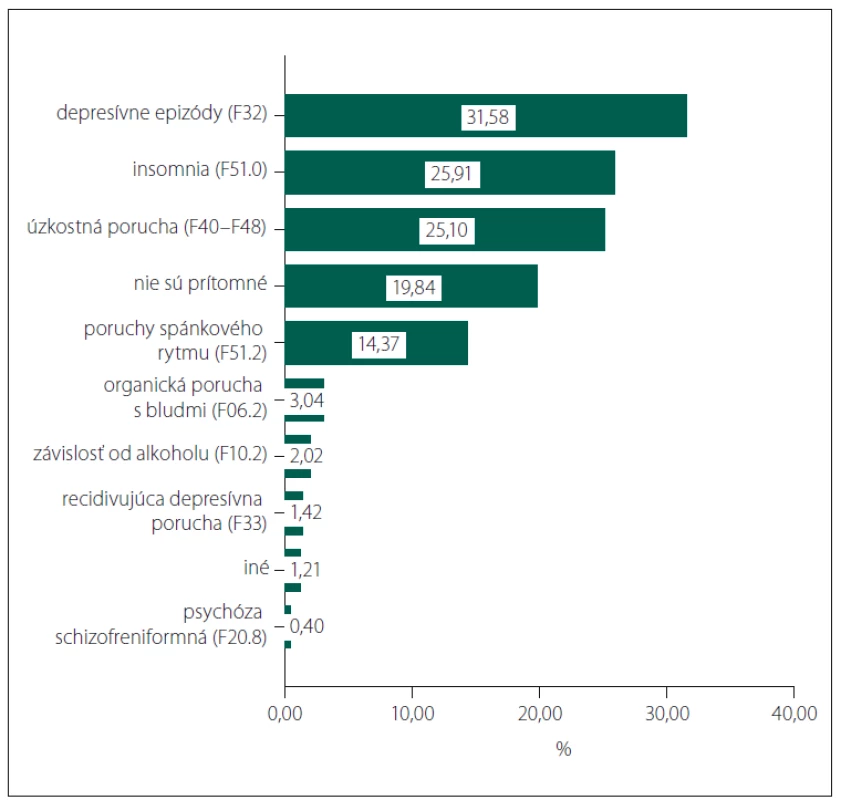
Image 2. Jednotlivé somatické komorbidity a ich prevalencia.
Fig. 2. Particular somatic comorbidities and their prevalence.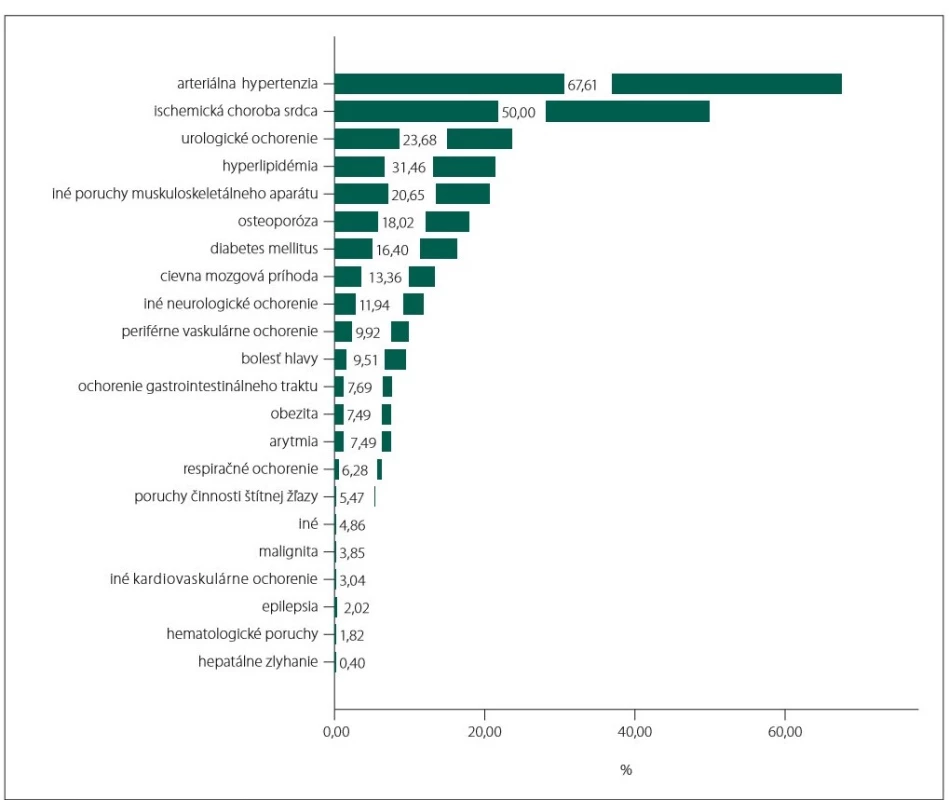
S trvaním AD koreloval počet psychiatrických (r = 0,113; p = 0,012) a nie somatických komorbidít. So závažnosťou AD korelovali počet somatických (rs = 0,120; p = 0,008) aj psychiatrických (rs = 0,267; p < 0,001) komorbidít.
Iba závažnosť AD bola prediktorom vyššieho počtu psychiatrických komorbidít (b = 0,428; p < 0,001) (obr. 3).
Image 3. Vzťah medzi závažnosťou Alzheimerovej demencie a počtom psychiatrických komorbidít (1 – ľahký; 2 – mierny; 3 – stredný; 4 – ťažký; 5 – veľmi ťažký stupeň).
Fig. 3. Relationship between the severity of Alzheimer‘s dementia and the number of psychiatric comorbidities (1 – very mild; 2 – mild; 3 – moderate; 4 – severe; 5 – very severe).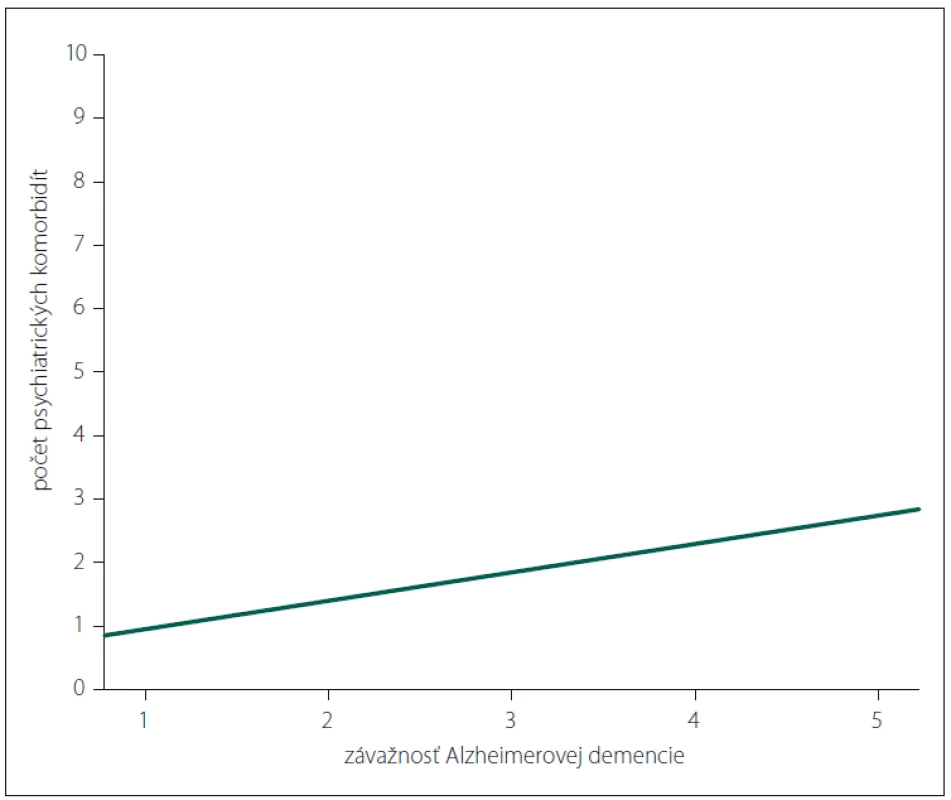
Počet somatických komorbidít predikoval vyšší počet psychiatrických komorbidít (b = 0,407; p < 0,001).
Skóre MMSE korelovalo negatívne s vekom (r = –0,089; p = 0,047), počtom psychiatrických komorbidít (rs = –0,130; p = 0,004) a prítomnosťou vaskulárnych zmien na CT/ MR (rs = –0,139; p = 0,002). Iba prítomnosť vaskulárnych zmien predikovala horšie skóre MMSE (b = –0,856; p=0,006).
Pacienti s vaskulárnymi zmenami mali štatisticky signifikantne horšie skóre MMSE (18,167 ± 3,605, 19,21 ± 3,398; p = 0,002) (obr. 4).
Image 4. Signifi kantný rozdiel v skóre MMSE u pacientov s Alzheimerovou demenciou bez vaskulárnych zmien na CT/MR a u pacientov s Alzheimerovou demenciou s vaskulárnymi zmenami na CT/MR.
MMSE – Mini Mental State Examination
Fig. 4. Signifi cant diff erence in MMSE score in patients with Alzheimeir´s dementia without vascular changes on CT/MRI scans and in patients with Alzheimeir´s dementia with vascular changes on CT/MRI scans.
MMSE – Mini Mental State Examination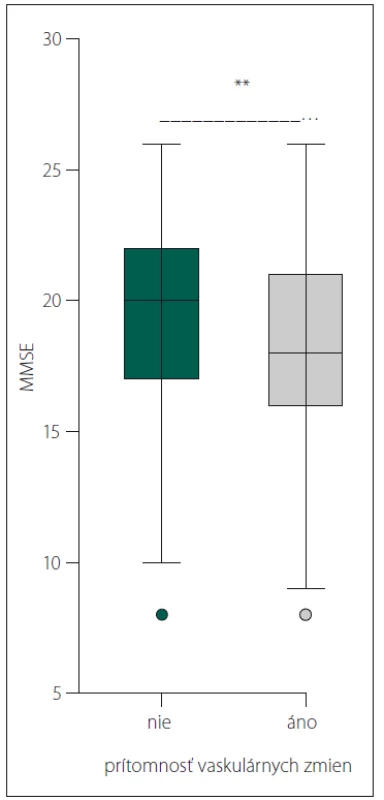
Zo všetkých pacientov malo 97,05 % adekvátne liečené komorbidity (všeobecným lekárom, psychiatrom alebo príslušným špecialistom). Adekvátna liečba komorbidity korelovala s počtom somatických komorbidít (rs = 0,122; p = 0,008), počet somatických komorbidít bol prediktorom adekvátnej liečby (b = 0,009; p = 0,034).
Adherencia korelovala negatívne s trvaním AD (rs = –0,172; p < 0,001), so závažnosťou AD (rs = –0,293; p < 0,001), počtom psychiatrických aj somatických komorbidít (rs = –0,184; p < 0,001, resp. rs = –0,121; p = 0,007).
Počet psychiatrických komorbidít (b = –0,043; p = 0,017) a závažnosť AD (b = –0,173; p < 0,001) predikovali horšiu adherenciu.
Účinnosť terapie korelovala pozitívne s adherenciou (rs = 0,253; p <0,001), negatívne so závažnosťou AD (rs = –0,227; p < 0,001), počtom psychiatrických aj somatických komorbidít (rs = –0,175; p < 0,001, resp. rs = –0,090; p = 0,046).
Len počet psychiatrických komorbidít (b = –0,021; p = 0,025) a závažnosť AD (b = –0,071; p < 0,001) predikovali horší efekt terapie.
Adherentní pacienti mali väčšiu pravdepodobnosť účinnej terapie demencie (OR 5,270; 95% CI 3,061–9,073; p < 0,001).
Diskusia
Získali sme údaje od takmer 500 pacientov s klinicky pravdepodobnou AD so širokým vekovým rozmedzím (40–96 rokov) aj trvaním ochorenia (1–20 rokov) zo všetkých regiónov Slovenska. Zaradení boli pacienti vo všetkých štádiách choroby, s rôznym skóre MMSE (v rozmedzí 8–26 bodov). Hoci stále viac rezonuje význam volumetrie v diagnostike AD [10], len tretina vyšetrených pacientov absolvovala MR mozgu.
Psychiatrické komorbidity
Viac ako 80 % pacientov malo aspoň jednu psychiatrickú komorbiditu. Najčastejšie boli depresívne epizódy prítomné u viac ako 31 % pacientov s AD. Niektoré regionálne epidemiologické štúdie uvádzajú dokonca vyšší výskyt príznakov depresie – 32,3 % na Taiwane, dokonca 78,4 % v USA [11]. V porovnaní s bežnou populáciou je ale vyššia miera depresivity prítomná už pri miernom kognitívnom deficite [12], dokonca aj v predklinickom štádiu AD, kedy negatívne vplýva na celkový kognitívny výkon [13].
Viac ako 25 % pacientov trpelo nespavosťou a takmer 15 % inverziou spánkové rytmu. Oba symptómy sú typické pre AD a často môžu časovo predchádzať rozvoju kognitívneho deficitu. Posledný výskum navyše potvrdzuje, že poruchy spánku pravdepodobne urýchľujú samotnú patológiu AD [14].
Viac ako 25 % pacientov malo anxióznu poruchu, a hoci je úzkosť častým sprievodným symptómom demencií, dáta nasvedčujú, že výraznejšie neovplyvňujú kognitívny úpadok u pacientov [15], no môžu ďalej zhoršovať kvalitu života.
Somatické komorbidity
Takmer 95 % pacientov bolo sledovaných aspoň pre jednu somatickú komorbiditu.
Viac ako dve tretiny pacientov s AD malo arteriálnu hypertenziu a polovica pacientov trpela ischemickou chorobou srdca. Rovnako ako pri depresii aj prevalencia arteriálnej hypertenzie sa líši podľa skúmanej populácie. Wang et al potvrdili 55,1% výskyt u taiwanských pacientov s AD [16], Eldholm et al na nórskej populácii odhalili, že dokonca až 83 % dementných pacientov trpí arteriálnou hypertenziou [17]. Obe štúdie potvrdili vyšší výskyt cerebrovaskulárnych ochorení v porovnaní s populáciou bez AD. Druhá spomenutá štúdia sa navyše snažila nájsť súvislosť medzi progresiou AD a cerebrovaskulárnou morbiditou, no výsledky tento predpoklad nepotvrdili. Naopak, v našej štúdii mali pacienti s vaskulárnymi zmenami na CT alebo MR horšie skóre MMSE (hoci klinicky sa líšili len o 1 bod, rozdiel bol štatisticky signifikantný). Je pravdepodobné, že súbežná vaskulárna patológia zhoršuje kompenzačné mechanizmy a narúša aj kognitívne domény inak bežne pri AD intaktné. Vzhľadom na relatívne efektívnejší manažment vaskulárnych rizikových faktorov je nutné ich ovplyvniť ešte pred rozvojom klinicky relevantného kognitívneho deficitu [18].
Takmer štvrtina pacientov bola sledovaná pre urologické komorbidity, prevalencia inkontinencie akejkoľvek intenzity a frekvencie je dokázane vyššia v porovnaní s populáciou bez AD [19].
Bolestivé ochorenia muskuloskeletálneho aparátu sú časté a dokázane zhoršujú intenzitu depresivity a anxiety u postihnutých pacientov [20]. V našej populácii sa vyskytovala u viac ako 20 %.
Vplyv komorbidít a ich liečba
Somatické ochorenie môže zhoršovať priebeh behaviorálnych a psychiatrických symptómov demencie [21] – v našej populácii väčší počet somatických komorbidít predikoval vyšší výskyt psychiatrických komplikácií. Stúpajúci počet komorbidít tiež pravdepodobne zvyšuje rýchlosť progresie kognitívneho úpadku, a to už v predklinickom štádiu AD [22].
Zo všetkých pacientov malo viac ako 97 % adekvátne liečené komorbidity všeobecným lekárom, psychiatrom alebo príslušným špecialistom. Počet psychiatrických komorbidít a závažnosť AD predikovali tak horšiu adherenciu k liečbe, ako aj nepriaznivejší celkový efekt terapie. Ak však boli pacienti adherentní, mali päťkrát nižšie riziko nedostatočného efektu liečby. Je známe, že adherencia sa zhoršuje vekom aj závažnosťou kognitívneho deficitu [23]. Aktívnym prístupom by sme sa ju však mali snažiť optimalizovať. Navyše sa pacienti s AD signifikantne menej často sťažujú na príznaky, ktoré nesúvisia s poruchou pamäti (gastrointestinálne ťažkosti, bolesti, poruchy zraku apod.) [24]. To komplikuje skorý záchyt a adekvátnu liečbu komorbidít, a tým bráni možnosti spomaliť celkovú deterioráciu pacientov.
Záver
Komorbidity pri AD dokázane akcelerujú progresiu základného ochorenia a komplikujú diagnostiku a terapiu. V súčasnosti nie je možné u pacienta s AD predpovedať, aká rýchla bude jej progresia či efekt liečby. Medzi ovplyvniteľné faktory, ktoré znižujú efekt liečby a pravdepodobne aj urýchľujú kognitívny úpadok, však iste patria psychiatrické aj somatické komorbidity. Ich aktívne vyhľadávanie, včasná diagnostika a adekvátna terapia zlepšia adherenciu pacientov a zefektívnia manažment AD.
Etické princípy
Projekt COSMOS bol 22. 9. 2015 schválený etickou komisiou Košického samosprávneho kraja. Od účastníkov bol získaný informovaný súhlas.
Grantová podpora
Tento projekt bol podporený spoločnosťou Krka Slovensko s.r.o.
Konflikt záujmov
Autori deklarujú, že v súvislosti s predmetom štúdie nemajú žiadny konflikt záujmov.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.
Přijato k recenzi: 1. 5. 2019
Přijato do tisku: 13. 1. 2020
doc. MUDr. Michal Minár, PhD.
II. neurologická klinika
LF UK a UN
Limbová 5
833 05 Bratislava
Slovensko
e-mail: mmminar@gmail.com
Sources
1. Gambassi G, Landi F, Lapane KL et al. Predictors of mortality in patients with Alzheimer’s disease living in nursing homes. J Neurol Neurosurg Psychiatry 1999; 67(1): 59–65. doi: 10.1136/ jnnp.67.1.59.
2. Doraiswamy PM, Leon J, Cummings JL et al. Prevalence and impact of medical comorbidity in Alzheimer’s disease. J Gerontol A Biol Sci Med Sci 2002; 57(3): M173–M177. doi: 10.1093/ gerona/ 57.3.m173
3. García-Alberca JM, Pablo Lara J, González-Barón S et al. Prevalence and comorbidity of neuropsychiatric symptoms in Alzheimer’s disease. Actas Esp Psiquiatr 2008; 36(5): 265–270.
4. Aubert L, Pichierri S, Hommet C et al. Association between comorbidity burden and rapid cognitive decline in individuals with mild to moderate Alzheimer’s disease. J Am Geriatr Soc 2015; 63(3): 543–547. doi: 10.1111/ jgs.13314.
5. Vogelgsang J, Wolff-Menzler C, Kis B et al. Cardiovascular and metabolic comorbidities in patients with Alzheimer’s disease and vascular dementia compared to a psychiatric control cohort. Psychogeriatrics 2018; 18(5): 393–401. doi: 10.1111/ psyg.12338.
6. Taylor DH, Schenkman M, Zhou J et al. The relative effect of Alzheimer’s disease and related dementias, disability, and comorbidities on cost of care for elderly persons. J Gerontol B Psychol Sci Soc Sci 2001; 56(5): S285–S293. doi: 10.1093/ geronb/ 56.5.s285.
7. Hill JW, Futterman R, Duttagupta S et al. Alzheimer’s disease and related dementias increase costs of comorbidities in managed Medicare. Neurology 2002; 58(1): 62–70. doi: 10.1212/ wnl.58.1.62.
8. Fereshtehnejad SM, Damangir S, Cermakova P et al. Comorbidity profile in dementia with Lewy bodies versus Alzheimer’s disease: a linkage study between the Swedish Dementia Registry and the Swedish National Patient Registry. Alzheimers Res Ther 2014; 6(5–8): 65. doi: 10.1186/ s13195-014-0065-2.
9. Koopmans RT, Ekkerink JL, Sirre LG et al. Multi-infarct dementia in nursing home patients; more comorbidity and shorter life expectancy than in Alzheimer’s disease. Ned Tijdsch Geneeskd 1992; 136(45): 2223–2227.
10. Šilhán D, Ibrahim I, Tintěra J et al. Magnetic resonance imaging showing parietal atrophy of the brain in late-onset Alzheimer’s disease. Cesk Slov Neurol N 2019; 82/ 115(1): 91–95. doi: 10.14735/ amcsnn201991.
11. Tractenberg RE, Weiner MF, Patterson MB et al. Comorbidity of psychopathological domains in community--dwelling persons with Alzheimer’s disease. J Geriatr Psychiatry Neurol 2003; 16(2): 94–99. doi: 10.1177/ 089198 8703016002006.
12. Kadlecová A, Laczó J, Vyhnálek M et al. Vztah deprese a rozeznávání emocí z výrazu tváře u pacientů s mírnou kognitivní poruchou. Cesk Slov Neurol N 2013; 76/ 109(1): 52–55.
13. Berger AK, Fratiglioni L, Winblad B et al. Alzheimer’s disease and depression: preclinical comorbidity effects on cognitive functioning. Cortex 2005; 41(4): 603–612.
14. Brzecka A, Leszek J, Ashraf et al. Sleep disorders associated with Alzheimer’s disease: a perspective. Front Neurosci 2018; 12 : 330. doi: 10.3389/ fnins.2018.00330.
15. Breitve MH, Hynninen MJ, Brønnick K et al. A longitudinal study of anxiety and cognitive decline in dementia with Lewy bodies and Alzheimer’s disease. Alzheimers Res Ther 2016; 8(1): 3. doi: 10.1186/ s13195-016-0171-4.
16. Wang JH, Wu YJ, Tee BL et al. Medical comorbidity in Alzheimer’s disease: a nested case-control study. J Alzheimers Dis 2018; 63(2): 773–781. doi: 10.3233/ JAD-170786.
17. Eldholm RS, Persson K, Barca ML et al. Association between vascular comorbidity and progression of Alzheimer’s disease: a two-year observational study in Norwegian memory clinics. BMC Geriatr 2018; 18(1): 120. doi: 10.1186/ s12877-018-0813-4.
18. Urbanová B, Tomek A, Mikulík R et al. Vztah vaskulárních rizikových faktorů a Alzheimerovy choroby. Cesk Slov Neurol N 2012; 75/ 108(6): 694–699.
19. Lee HY, Li CC, Juan YS et al. Urinary incontinence in Alzheimer’s disease. Am J Alzheimers Dis Other Demen 2017; 32(1): 51–55. doi: 10.1177/ 1533317516680900.
20. Tsatali M, Papaliagkas V, Damigos D et al. Depression and anxiety levels increase chronic musculoskeletal pain in patients with Alzheimer’s disease. Curr Alzheimer Res 2014; 11(6): 574–579. doi: 10.2174/ 1567205011666140618103406.
21. Ressner P, Hort J, Rektorová I et al. Doporučené postupy pro di agnostiku Alzheimerovy nemoci a dalších onemocnění spojených s demencí. Cesk Slov Neurol N 2008; 71/ 104(4): 494–501.
22. Bäckman L, Jones S, Small BJ et al. Rate of cognitive decline in preclinical Alzheimer’s disease: the role of comorbidity. J Gerontol B Psychol Sci Soc Sci 2003; 58(4): P228–P236. doi: 10.1093/ geronb/ 58.4.p228.
23. Sinforiani E, Bernini S, Picascia M. Correlations among age, cognitive impairment, and comorbidities in Alzheimer’s disease: report from a center for cognitive disorders. Aging Clin Exp Res 2017; 29(6): 1299–1300. doi: 10.1007/ s40520-017-0807-7.
24. McCormick WC, Kukull WA, van Belle G et al. Symptom patterns and comorbidity in the early stages of Alzheimer’s disease. J Am Geriatr Soc 1994; 42(5): 517–521. doi: 10.1111/ j.1532-5415.1994.tb04974.x.
Labels
Paediatric neurology Neurosurgery Neurology Psychiatry
Article was published inCzech and Slovak Neurology and Neurosurgery

2020 Issue 1-
All articles in this issue
- Poděkování recenzentům
- Role zánětu v etiopatogenezi farmakorezistentní epilepsie a refrakterního status epilepticus
- Kognitivní rehabilitace pacientů s Parkinsonovou nemocí
- Homeostáza mědi jako terapeutický cíl u amyotrofické laterální sklerózy s mutací superoxiddismutázy 1 a sloučenina CuATSM
- Možnosti prevence Alzheimerovy choroby
- Dominantní (Kjerova) atrofie optiku asociovaná s mutacemi v OPA1 genu
- Metodologie měření kognitivního deficitu u depresivní poruchy
- Novorozenecké záchvaty – současný pohled na problematiku
- Polysomnografické nálezy u osob nad 50 let bez subjektivních příznaků poruch spánku
- Neuropsychiatrické symptomy jako časná manifestace Alzheimerovy nemoci
- Efektivita prodlouženého dávkovacího intervalu natalizumabu u pacientů s roztroušenou sklerózou
- Charakteristika aterosklerotického plátu a riziko mozkové ischemie při stentování vnitřní karotidy
- Randomizovaná kontrolovaná studie efektu terapie poruch rovnováhy s využitím audiovizuální zpětné vazby u seniorů
- Primární non-Hodgkinův B-lymfom centrálního nervového systému
- Analýza dat v neurologii
- Vzpomínka na prof. Pavla Petrovického
- Prof. MUDr. Rudolf Malec, CSc. (1924–2019)
- Recenze monografie
- Komorbidity Alzheimerovej choroby – výsledky multicentrickej prierezovej observačnej štúdie COSMOS v Slovenskej republike
- Choroidální tloušťka u asymptomatických pacientů se stenózou karotidy
- Czech and Slovak Neurology and Neurosurgery
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Novorozenecké záchvaty – současný pohled na problematiku
- Možnosti prevence Alzheimerovy choroby
- Primární non-Hodgkinův B-lymfom centrálního nervového systému
- Neuropsychiatrické symptomy jako časná manifestace Alzheimerovy nemoci
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

