-
Medical journals
- Career
Plicní arteriovenózní malformace jako vzácná příčina ischemické cévní mozkové příhody
Authors: L. Trakal 1; P. Malý 1; I. Marušincová 2; M. Šrámek 1,3
Authors‘ workplace: Neurologické oddělení, ÚVN-VFN, Praha 1; Neurologická klinika 2. LF UK a FN Motol, Praha 2; Interní klinika 1. LF a ÚVN-VFN, Praha 2
Published in: Cesk Slov Neurol N 2019; 82(5): 571-573
Category: Letter to Editor
doi: https://doi.org/10.14735/amcsnn2019571Overview
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manu script met the ICMJE “uniform requirements” for biomedical papers.
S rozvojem diagnostických možností, jako jsou dlouhodobé monitorování srdečního rytmu a rutinní provádění transesofageální echokardiografie (TEE), narůstá počet iktů s prokázanou souvislostí s onemocněním srdce. Při dodržení standardního vyšetřovacího protokolu vč. výše uvedených metod můžeme odhalit i některá raritní onemocnění vedoucí ke vzniku CMP. Mezi taková onemocnění patří plicní arteriovenózní malformace (PAVM). Jedná se cévní anomálii umožňující přímou komunikaci mezi plicní arterií vedoucí odkysličenou krev do plic a žílou vedoucí okysličenou krev z plic zpět do srdce. Tato komunikace vede kvůli absenci vmezeřeného kapilárního řečiště ke vzniku vysokoprůtokového a nízkorezistentního pravo-levého zkratu. PAVM tak může být cestou paradoxní embolizace trombů ze žilního řečiště velkého oběhu do CNS nebo přímo místem vzniku trombů. Prevalence PAVM je udávána 1 : 2 630 na základě údajů získaných ze skríningových programů karcinomu plic prováděných za pomoci CT [1]. U pacientů s kryptogenní CMP je udávána prevalence vyšší [2]. Přibližně 80–90 % všech PAVMs je asociováno se syndromem Rendu-Osler-Weber, neboli hereditární hemoragickou teleangiektázíí (HHT), přičemž okolo 15–35 % nemocných s HHT má prokázanou PAVM [3]. Jedná se o fibrovaskulární dysplazii s autozomálně dominantní dědičností a prevalencí přibližně 1 : 5 000 v celosvětovém měřítku [4]. HHT je charakterizována přítomností teleangiektázií a arteriovenózních malformací kůže, sliznic a vnitřních orgánů s familiárně vázaným výskytem [5].
Pro stanovení diagnózy HHT byla v roce 2000 přijata mezinárodní klinická kritéria, která zahrnují pozitivní rodinnou anamnézu, opakované epizody epistaxí, výskyt mnohočetných teleangiektázií a viscerální příznaky (teleangiektázie v gastrointestinální trubici, arteriovenózní malformace v oblasti jater, mozku a míchy). Přítomnost 3 a více příznaků činí diagnózu jednoznačnou. Pokud jsou přítomny jen 2 kritéria, je diagnóza pravděpodobná [4,5].
Podle anatomické charakteristiky uvedené v práci Meek et al jsou PAVMs klasifikovány následovně [6]:
- jednoduché – nejčastěji zastoupené, s jedinou segmentární arterií zásobující malformaci;
- komplexní – jsou zásobeny několika segmentárními arteriemi;
- difuzní – vzácné, charakterizovány stovkami malformací, s kombinací jednoduchých i komplexních.
Pacientka ve věku 38 let byla přivezena na urgentní příjem pro 2 h trvající náhle vzniklou pravostrannou hemiparézu s hypestezií, expresivní fatickou poruchu a centrální lézi n. VII. vpravo, vstupní skóre NIHSS (National Institute of Health Stroke Scale) bylo 11 b. Nativní CT mozku neprokázala čerstvé ložiskové změny, CTA byla bez uzávěru velké tepny nebo stenotického postižení. Po provedení intravenózní trombolýzy došlo k výrazné regresi nálezu, NIHSS s odstupem 2 h od přijetí dosáhlo 5 b. Druhý den provedená MR mozku prokázala ložiska čerstvé ischemie v povodí a. cerebri media vlevo a a. cerebrianterior vpravo. Nález embolizace do více povodí byl suspektní pro extracerebrální zdroj embolizace. TEE neprokázala intrakardiální zdroj embolizace, defekt mezisíňové přepážky ani její aneuryzma. Intravenózně podaná pulmolabilní echokontrastní látka se však přes normální strukturální nález objevila s odstupem cca pěti srdečních cyklů také v levostranných srdečních oddílech (obr. 1). Tento nález budil podezření na přítomnost pravo-levého zkratu v plicním řečišti. Následně provedené CTA plic prokázalo arteriovenózní malformaci v periferii levé plíce prekordiálně s dobře diferencovatelnou přívodnou tepnou kalibru 4 mm i odvodnou žílou a s aneuryzmatickým rozšířením velikosti cca 12 × 10 mm (obr. 2). Vzhledem k vakovitému rozšíření byla malformace nejspíše i místem tvorby trombu, který následně embolizoval do mozku. Možnost paradoxní embolizace touto cestou jsme hodnotili jako velmi nízkou.
Image 1. Sonografický průkaz zkratu pomocí pozitivního echokontrastu – 1. septum síní; 2. pravá síň z větší část vyplněná echo kontrastem; 3. levá síň; 4. aortální chlopeň trojcípá.
Fig. 1. Sonographically prooved shunt by contrast echocardiography – 1. interatrial septum; 2. right atrium mostly filled with echo contrast; 3. left atrium; 4. tricommissural aortic valve.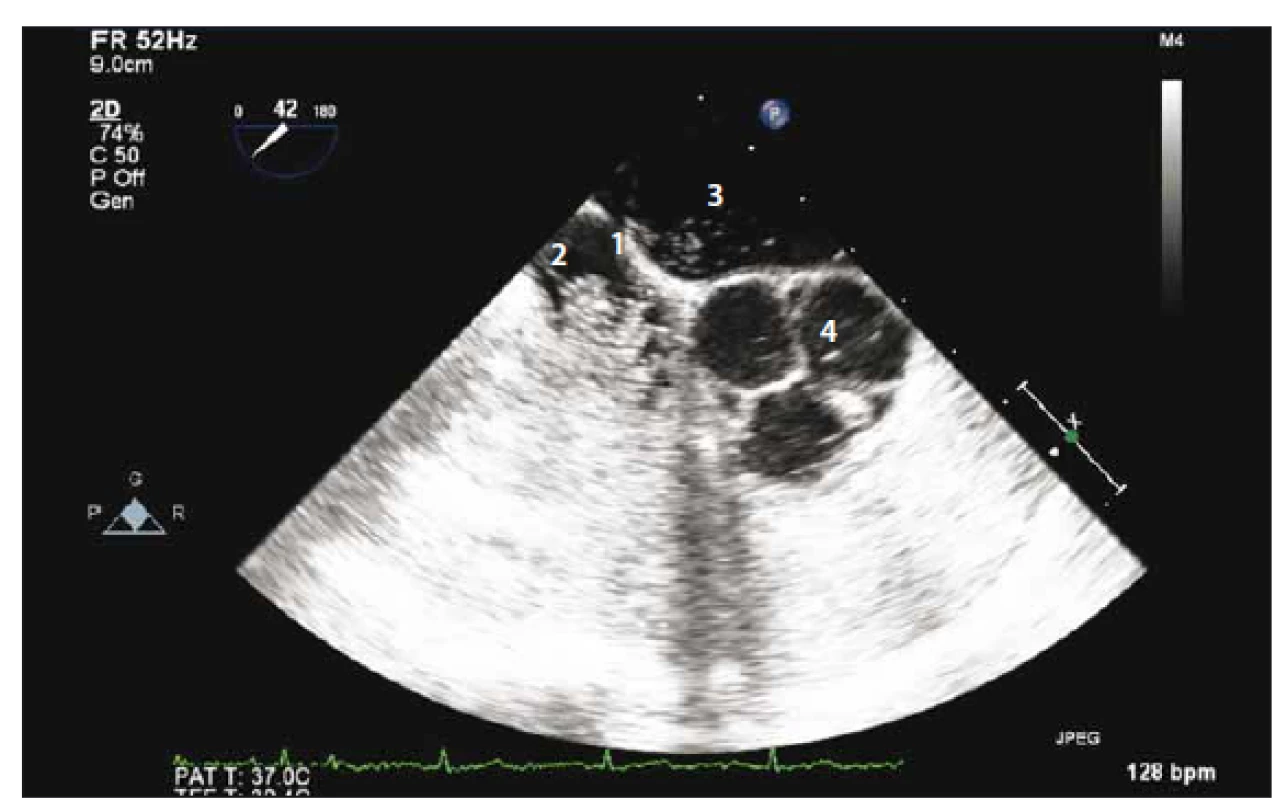
Image 2. Průkaz plicní arteriovenózní malformace pomocí CTA plic.
Fig. 2. Pulmonary arteriovenous malformation prooved via CT pulmonary angiogram.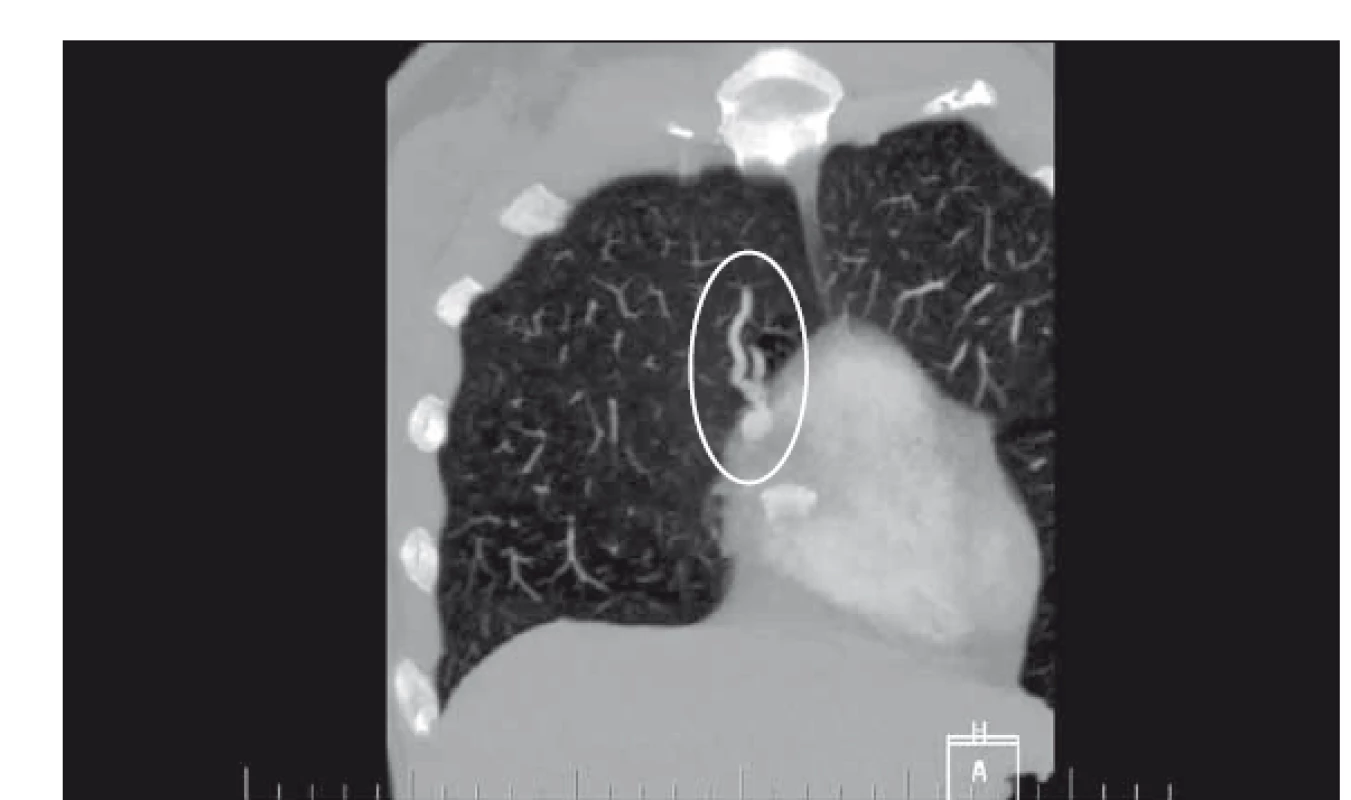
Následně byla PAVM ošetřena endovaskulárně implantací embolizačních spirál. Při výše uvedené velikosti aneuryzmatického vaku bylo spotřebováno celkem 58 cm odpoutatelných spirálek (coils). PAVM byla tímto výkonem vyřazena z oběhu, což bylo ověřeno kontrolním nástřikem při angiografii i následně provedeným transkraniálním dopplerovským (TCD) vyšetřením pravo-levého zkratu s negativním nálezem. Pacientka zůstává v dispenzarizaci našeho oddělení, klinicky přetrvává lehká expresivní fatická porucha a levostranná hemihypestezie. Pacientka je zajištěna antiagregační terapií klopidogrelem. Kontroly pomocí TCD vyšetření pravo-levého zkratu zůstávají negativní. V případě prezentované kazuistiky se jednalo o jedinou PAVM, pacientka tedy nesplňovala mezinárodní kritéria pro HHT [5,6].
Sporadické PAVMs, které nejsou asociovány s HHT, jsou velmi vzácné. V současné literatuře bylo popsáno pouze několik kazuistik ischemické CMP způsobené izolovanou PAVM [7–9]. Klinické důsledky případné PAVM závisí na tíži pravo-levého zkratu. Pacienti mohou být zpočátku asymptomatičtí, ale s postupujícím časem se zvyšuje velikost pravo-levého zkratu a mohou se objevit první klinické obtíže (obvykle okolo 3.–4. dekády). Větší podíl neokysličené krve proudící skrz PAVM se může prezentovat jako hypoxemie, dyspnoe a cyanóza (obvykle u pacientů s rozsáhlými či vícečetnými PAVMs) [2]. V případě vzniku paradoxní embolizace nebo vzniku trombu in situ může dojít ke vzniku tranzitorní ischemické ataky, ischemického iktu či mozkového abscesu. Celkem 46 % všech pacientů s ojedinělou PAVM, 59 % s vícečetnými a skoro 70 % pacientů s difuzními PAVMs v minulosti prodělalo CMP nebo bylo léčeno pro mozkový absces [10].
Terapie PAVMs je možná chirurgická nebo endovaskulární. Účinnost medikamentózní léčby prokázána nebyla. Při endovaskulární léčbě lze trvalého vyřazení PAVMs z oběhu dosáhnout pomocí odpoutatelných spirálek, balónků nebo Amplatzerova okluderu pro větší zkraty [9]. Dle studie Pollak et al je endovaskulární léčba úspěšná u většiny pacientů (83 %). Na špičkových pracovištích jsou komplikace endovaskulárního výkonu vzácné, mezi nejčastější patří distální embolizace, migrace coilů, spontánní deflace balónků, spontánní rekanalizace [11]. Chirurgické řešení je vhodné pro pacienty, kteří mají vícečetné, difuzní nebo rozsáhlé PAVMs, a nejsou tak pro endovaskulární ošetření vhodní.Plicní arteriovenózní malformace patří mezi raritní příčiny CMP. Při dodržení standardního vyšetřovacího algoritmu vč. TEE by však neměla uniknout pozornosti. Mezi terapeutické možnosti patří zejména endovaskulární, případně chirurgická léčba.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
npor. MUDr. Lukáš Trakal
Neurologické oddělení ÚVN-VFN
U Vojenské nemocnice 1200
169 02 Praha
e-mail: lucas.trakal@seznam.cz
Přijato k recenzi: 15. 5. 2019
Přijato do tisku: 13. 8. 2019
Sources
1. Nakayama M, Nawa T, Chonan T et al. Prevalence of pulmonary arteriovenous malformations as estimated by low-dose thoracic CTscreening. Intern Med 2012; 51(13): 1677–1681. doi: 10.2169/internalmedicine.51.7305.
2. Shovlin CL. Pulmonary arteriovenous malformations. Am J Respir Crit Care Med 2014; 190(11): 1217–1228. doi: 10.1164/rccm.201407-1254CI.
3. Lacombe P, Lacout A, Marcy PY et al. Diagnosis and treatment of pulmonary arteriovenous malformations in hereditary hemorrhagic telangiectasia: anoverview. Diagn Interv Imaging 2013; 94(9): 835–848. doi: 10.1016/j.diii.2013.03.014.
4. Faughnan ME, Palda VA, Garcia-Tsao G et al. International guidelines for the diagnosis and management of hereditary haemorrhagic telangiectasia. J Med Genet 2011; 48(2): 73–87. doi: 10.1136/jmg.2009.069013.
5. Shovlin CL. Hereditary haemorrhagic telangiectasia: pathophysiology, diagnosis and treatment. Blood Rev 2010; 24(6): 203–219. doi: 10.1016/j.blre.2010.07.001.
6. Meek ME, Meek JC, Beheshti MV. Management of pulmonary arteriovenous malformations. Semin Intervent Radiol 2011; 28(1): 24–31. doi: 10.1055/s-0031-1273937.
7. Kimura K, Minematsu K, Nakajima M. Isolated pulmonary arteriovenous fistula without Rendu-Osler-Weber disease as a cause of cryptogenic stroke. J Neurol Neurosurg Psychiatry 2004; 75 : 311–313.
8. VeeramReddy SR, Patel VG, Gualano SK. Amplatzer vascular plug IV for occlusion of pulmonary arteriovenous malformations in a patient with cryptogenic stroke. Ann Pediatr Cardiol 2014; 7 : 145–147.
9. Saidman J, Abdou H, Sampath Kumar S. Stroke resulting from an isolated pulmonary arteriovenous malformation. BMJ Case Rep 2017; 2017. pii: bcr-2017-221000. doi: 10.1136/bcr-2017-221000.
10. Moussouttas M, Fayad P, Rosenblatt M et al. Pulmonary arteriovenous malformations: cerebralischemia and neurologic manifestations. Neurology 2000; 55(7): 959–964. doi: 10.1212/wnl.55.7.959.
11. Kucukay F, Ozdemir M, Senol E et al. Large pulmonary arteriovenous malformations: long-term results of embolization with AMPLATZER vascular plugs. J Vasc Interv Radiol 2014; 25(9): 1327–1332. doi: 10.1016/j.jvir.2014.01.031.
12. Pollak JS, Saluja S, Thabet A et al. Clinical and anatomic outcomes after embolotherapy of pulmonary arteriovenous malformations. J Vasc Interv Radiol 2006; 17(1): 35–44. doi: 10.1097/01.RVI.0000191410.13974.B6.
Labels
Paediatric neurology Neurosurgery Neurology
Article was published inCzech and Slovak Neurology and Neurosurgery

2019 Issue 5-
All articles in this issue
- Kompresivní neuropatie jako nemoc z povolání
- Refrakterní myastenia gravis – klinická charakteristika a možnosti biologické léčby
- Úloha pohybovej aktivity v liečbe pacientov s Parkinsonovou chorobou
- Změna struktury paraspinálních svalů u pacientů s chronickými nespecifickými bolestmi dolní části zad
- Léčba nespavosti při neuropatické bolesti
- Rozsáhlý cervikální hematom po minimálním traumatu
- Perinatální paréza brachiálního plexu na podkladě avulze, řešená konzervativně
- Plicní arteriovenózní malformace jako vzácná příčina ischemické cévní mozkové příhody
- Akutní amnestický syndrom při bilaterální lézi hipokampů jako raritní projev CMP
- Perforace jícnu způsobená dislokovanou krční dlahou pět let po operaci krční páteře – vzácná komplikace
- Závažné vaskulopatie u neurofibromatózy typu 1
- Simultánní vícečetné intracerebrální hemoragie
- Význam kolaterální cirkulace u akutní okluze arteria basilaris
- Možnosti stanovení likvorového tripletu tau proteinů a β-amyloidu 42 metodami ELISA a orientační normativní vodítka
- Endoskopické operace výhřezu bederních meziobratlových plotének – první zkušenosti
- Pegylovaný interferon beta 1-a v klinické praxi
- Kongenitální fibróza zevních okohybných svalů u české rodiny a její molekulárně genetická příčina
- Analýza dat v neurologii LXXVII. Korelační analýza vícerozměrných souborů kvantitativních dat – příklady
- Recenze knih
- Jiný pohled na inhibitor agregace krevních destiček klopidogrel – vhodné antiedematikum v předklinickém modelu poranění mozku?
- CRP stanovený vysoce senzitivní metodou u pacientů s ichemickou cévní mozkovou příhodou – od rizikových faktorů po vývoj
- Czech and Slovak Neurology and Neurosurgery
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Léčba nespavosti při neuropatické bolesti
- Kompresivní neuropatie jako nemoc z povolání
- Změna struktury paraspinálních svalů u pacientů s chronickými nespecifickými bolestmi dolní části zad
- Endoskopické operace výhřezu bederních meziobratlových plotének – první zkušenosti
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

