-
Medical journals
- Career
Přehled onemocnění s obrazem restrikce difuze na magnetické rezonanci mozku
Authors: Z. Sedláčková 1; T. Dorňák 2; E. Čecháková 1; S. Buřval 1; M. Heřman 1
Authors‘ workplace: Radiologická klinika LF UP a FN Olomouc 1; Neurologická klinika LF UP a FN Olomouc 2
Published in: Cesk Slov Neurol N 2018; 81(5): 539-545
Category: Review Article
doi: https://doi.org/10.14735/amcsnn2018539Overview
v některých případech a často pak znamená horší prognózu. V diferenciální diagnostice nálezu na MR pomáhá obraz na dalších sekvencích a klinický nález. Cílem tohoto přehledného referátu je výčet a popis onemocnění, které se mohou projevit restrikcí difuze při vyšetření MR. Nejčastěji se restrikce difuze nachází u akutní ischemie, typická je její přítomnost v obsahu abscesu nebo empyému, u lymfomů a Creutzfeldt-Jakobovy choroby. Můžeme ji ale také nalézt u vysoce celulárních tumorů, některých metastáz, u difuzního axonálního poranění, akutní diseminované encefalomyelitidy, encefalitidy, syndromu zadní reverzibilní encefalopatie, Wernickeho encefalopatie, Marchiafavova-Bignamiho syndromu, osmotického demyelinizačního syndromu, hypo-/ hyperglykemie, cyst Rathkeho výchlipky, v akutní fázi Wilsonovy choroby, u otravy oxidem uhelnatým a vzácně i u RS a epilepsie. Restrikci difuze hodnotíme na difuzí vážené sekvenci (diffusion-weighted image; DWI). Restrikci difuze můžeme popsat pouze v případě, že nalezneme hypersignální oblast na DWI obrazech s vyšší hodnotou b (obvykle b = 1 000) a současně ve stejném místě snížený signál na mapách aparentního difuzního koeficientu.
Klíčová slova:
magnetická rezonance – difuzní magnetická rezonance – ischemie mozku – absces mozku – nádory mozkuÚvod
S nálezem restrikce difuze se při vyšetření mozku MR můžeme setkat u celé řady onemocnění (tab. 1). U dětí bývá restrikce difuze přítomna u části diagnóz shodných s dospělými, může se ale objevit i u nemocí dětského věku, jako jsou neonatální adrenoleukodystrofie [1], nemoc Canavanové [2], novorozenecká neketotická hyperglycinemie [3], etylmalonická encefalopatie [4], Alexandrova choroba (neboli fibrinoidní leukodystrofie) [5], Leighův syndrom [6], neurodegenerace asociovaná s pantotenátkinázou (PKAN) [7], která je známa pro svůj typický MR obraz tygřích očí a mitochondrial encephalomyopathy, lactic acidosis, and stroke-like episodes (MELAS) [8].
Table 1. Přehled onemocnění s restrikcí difuze na MR mozku u dospělých. 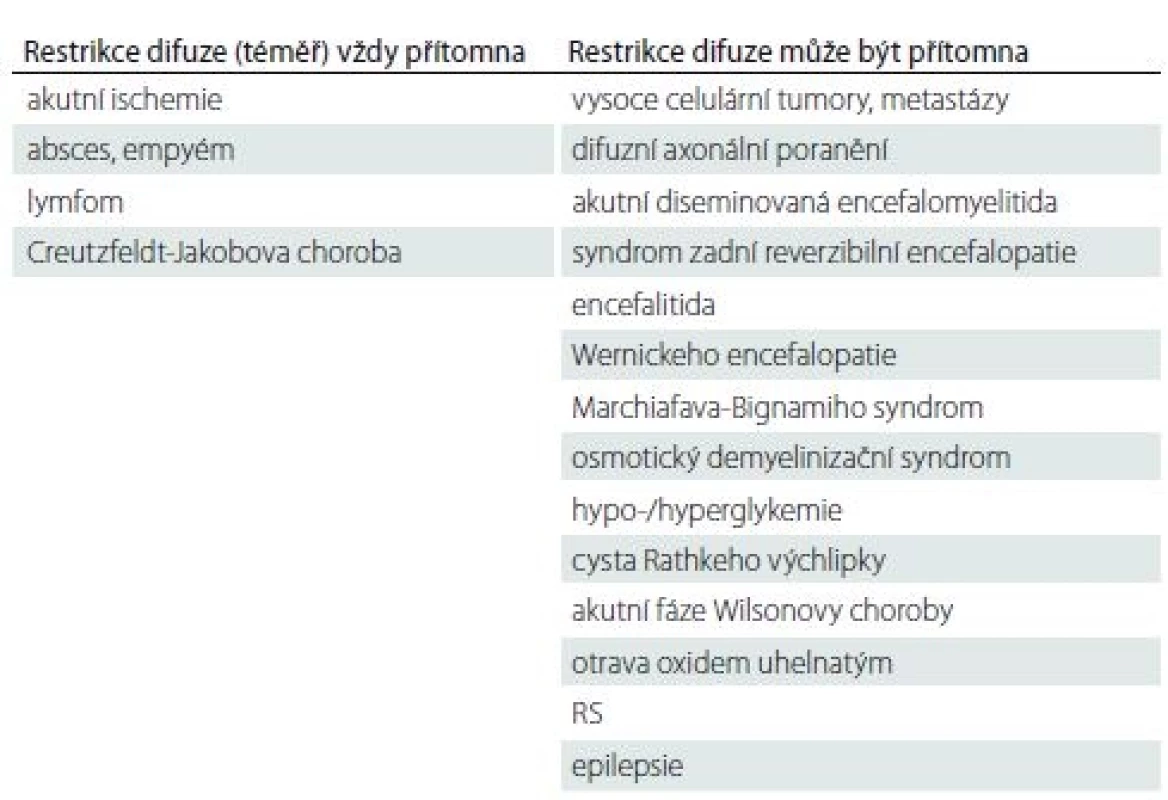
Podkladem restrikce difuze může být cytotoxický edém, kdy dochází k výraznému přesunu vody z extracelulárního do intracelulárního prostoru, dále pak zvýšená celularita. Stejný obraz jako u restrikce difuze můžeme vidět i u hematomů – zde však nejde o restrikci difuze v pravém slova smyslu, ale o stejný obraz vzniklý jiným fyzikálním mechanizmem, který je podmíněn zejména přítomností intracelulárního oxyhemoglobinu v hyperakutní fázi. V některých případech se můžeme setkat s T2 „shine through“ efektem, kdy je na difuzí váženém obraze (diffusion-weighted image; DWI) patrný zvýšený signál, ale intenzita signálu na aparentním difuzním koeficientu (apparent diffusion coefficient; ADC) není snížena, s čímž se můžeme setkat u vysoce T2 hypersignálních patologií (např. u epidermoidníchcyst) [9].
Difuze je definována jako náhodný translační pohyb molekul, jehož zdrojem je tepelná energie [10]. Dochází k ní v tekutém prostředí z míst s vyšší koncentrací do míst s koncentrací nižší [11]. Přestup přes fyziologické membrány difuzi zpomaluje [12]. DWI zobrazují difuzi v biologických tkáních za aplikace silných gradientů magnetického pole [12]. Výsledkem této sekvence je několik druhů obrazů: několik (nejčastěji tři) série DWI získaných při různých hodnotách tzv. b faktoru a z nich vypočítaných map (obrazů) ADC. Aby bylo možné říci, že jde o restrikci difuze, musí mít hypersignální oblast na DWI s vysokým b faktorem (obvykle 1 000 s/ mm2) hyposignální korelát na ADC mapách (obrazech) (obr. 1 – 4).
Image 1. Polymorbidní pacientka ve věku 65 let s kvantitativní poruchou vědomí charakteru až soporu/komatu v terénu demence.
Okcipitálně vlevo okrsek se zvýšeným signálem na DWI a sníženým signálem na ADC odpovídající restrikci difuze (šipky), na FLAIR není patrná změna intenzity signálu. Velmi časná ischemie.
ADC – aparentní difuzní koeficient; DWI – difuzí vážený obraz; FLAIR – inverzní zobrazení s potlačením signálu tekutiny
Fig. 1. A 65-year-old polymorbid woman suffering from dementia with a quantitative disorder of consciousness characterized by stupor/ coma. Located occipitally on the left, an area hypersignal on DWI and hyposignal on ADC corresponds to diffusion restriction (arrows) with no changes on FLAIR. Hyperacute ischemia.
ADC – apparent diffusion coefficient; DWI – diffusion-weighted image; FLAIR – fluid attenuated inversion recovery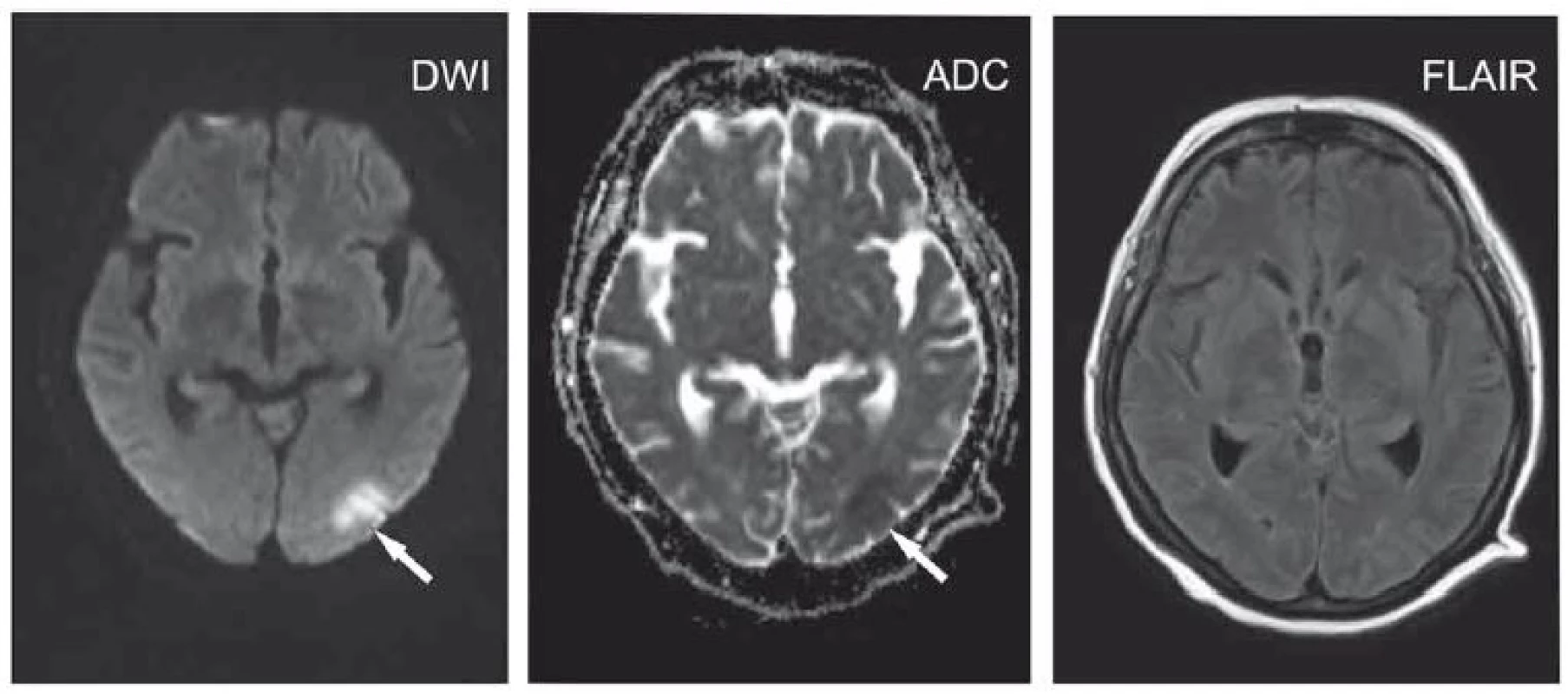
Image 2. Pacientka ve věku 66 let po chemoterapii a radioterapii pro karcinom prsu, nově zmatenost. DWI hypersignální kolekce fronto-parieto- okcipitálně vpravo s hyposignálním korelátem na ADC – empyém (šipky), postkontrastně sycení přilehlých mening. Oválná formace frontálně vpravo, také s restrikcí difuze – absces (hlavička šipky), postkontrastně s prstenčitým sycením, diferenciálně diagnosticky zvažována i metastáza. ADC – aparentní difuzní koeficient; DWI – difuzí vážený obraz ; FLAIR – inverzní zobrazení s potlačením signálu tekutiny; k. l. – kontrastní látka
Fig. 2. A 66-year-old woman after chemotherapy and radiotherapy for breast carcinoma showing recent confusion. DWI hypersignal collection is seen fronto-parieto-occipitally on the right with an ADC hyposignal corresponding area – empyema (arrows), enhancement of surrounding meninges. An oval formation on the front right side, also with restricted diffusion – abscess (arrowhead), ring enhancement; metastasis also included in the differential diagnostic consideration. ADC – apparent diffusion coefficient; DWI – diffusion-weighted image ; FLAIR – fl uid attenuated inversion recovery; k. l. – contrast agent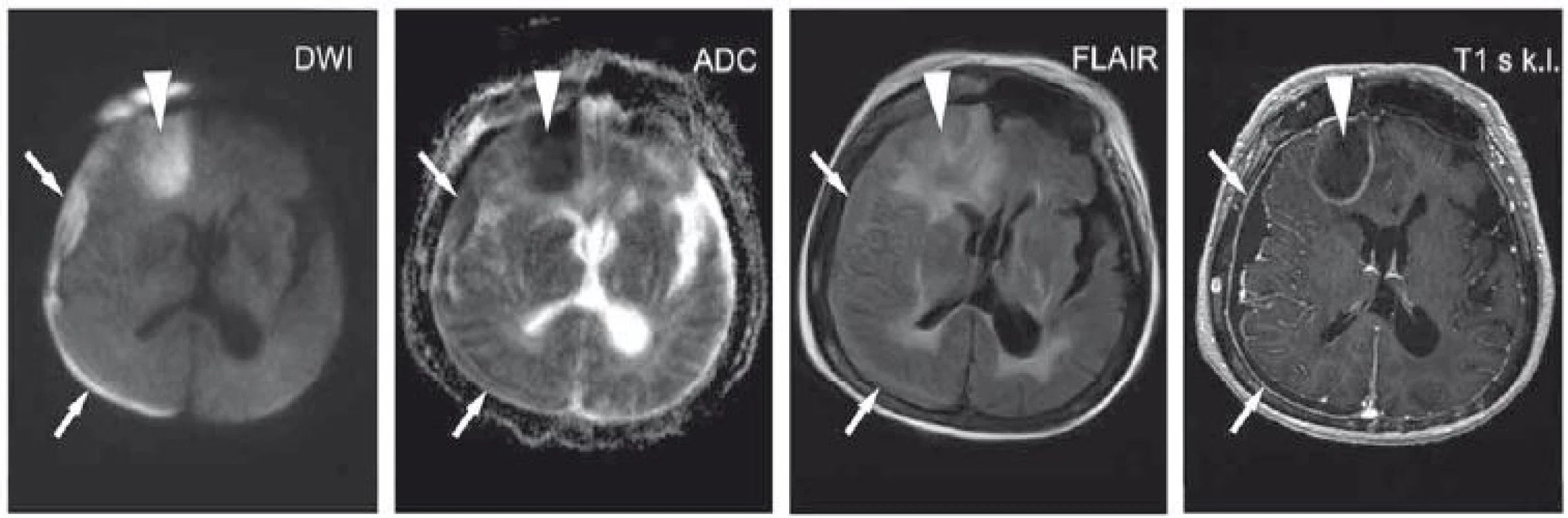
Image 3. Pacientka ve věku 62 let s expresivní afázií, centrální lézí n. VII. vpravo a pravostrannou hemiparézou. V levé mozečkové hemisféře je patrné ložisko (šipky) při IV. komoře, která je mírně dislokována doprava. Je patrný DWI hypersignální okrsek s ADC hyposignálním korelátem. Na FLAIR je ložisko lehce hypersignální s kolaterálním edémem. Po aplikaci kontrastní látky se léze homogenně nasytila. Další obdobné ložisko temporo-parieto-okcipitálně vlevo. Lymfom.
ADC – aparentní difuzní koefi cient; DWI – difuzí vážený obraz; FLAIR – inverzní zobrazení s potlačením signálu tekutiny; k. l. – kontrastní látka
Fig. 3. A 62-year-old woman with expressive aphasia, a central lesion of the seventh cranial nerve on the right side, and right-sided hemiparesis. The lesion is apparent in the left cerebellar hemisphere (arrows) alongside the fourth ventricle that is dislocated slightly to the right. DWI hypersignal area with an ADC hyposignal corresponding area is seen. The lesion is slightly hyper-signal on FLAIR with collateral edema. Homogeneous enhancement was seen after contrast administration. Another similar lesion is temporo-parieto-occipitally on the left. Lymphoma.
ADC – apparent diffusion coefficient; DWI – diffusion-weighted image; FLAIR – fluid attenuated inversion recovery; k. l. – contrast agent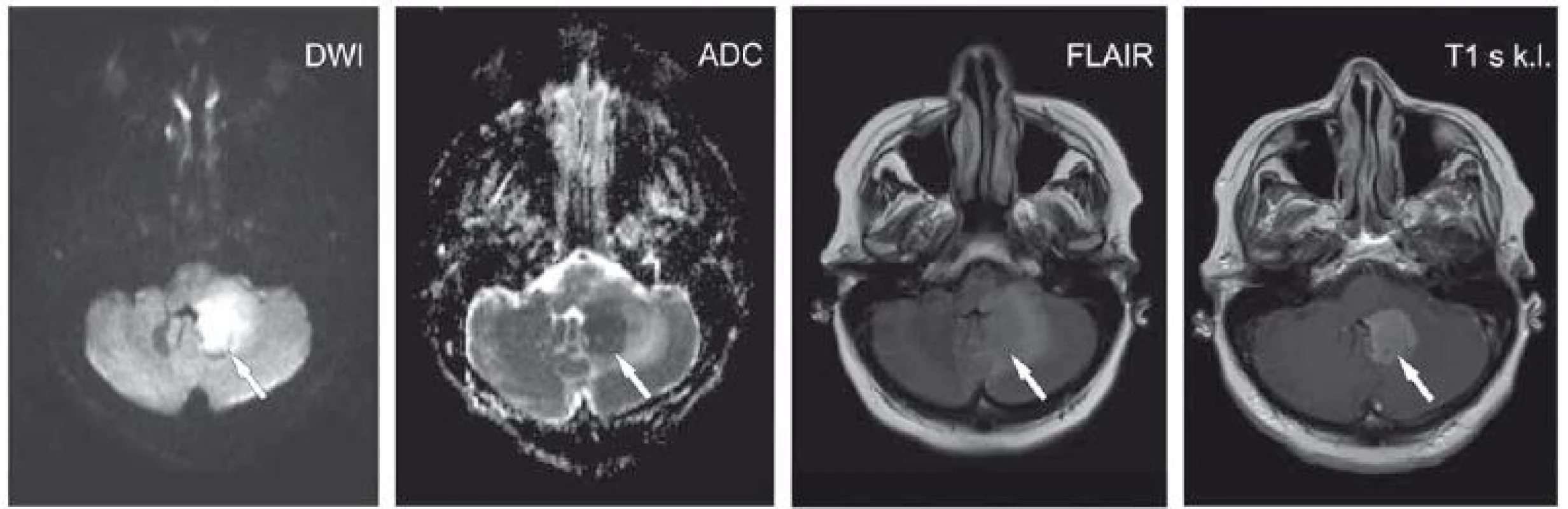
Image 4. Pacient ve věku 24 let, před 3 dny začaly difuzní bolesti hlavy, krční páteře a kašel, poté i horečky a vyrážka na kůži. DWI hypersignální okrsek v corpus callosum s ADC hyposignálním korelátem (šipky). Na FLAIR obraze jen nevýrazné rozšíření corpus callosum beze změny intenzity signálu. Akutní diseminovaná encefalomyelitida.
ADC – aparentní difuzní koeficient; DWI – difuzí vážený obraz; FLAIR – inverzní zobrazení s potlačením signálu tekutiny
Fig. 4. A 24-year-old man with a 3-day history of diffuse headache along with cervical spine pain and cough; afterwards, fever and skin rash developed. DWI hypersignal areas in the corpus callosum with an ADC hyposignal corresponding area (arrows). On FLAIR image, only minimal widening of the corpus callosum is present without signal change. Acute disseminated encephalomyelitis.
ADC – apparent diffusion coefficient; DWI – diffusion-weighted image; FLAIR – fluid attenuated inversion recovery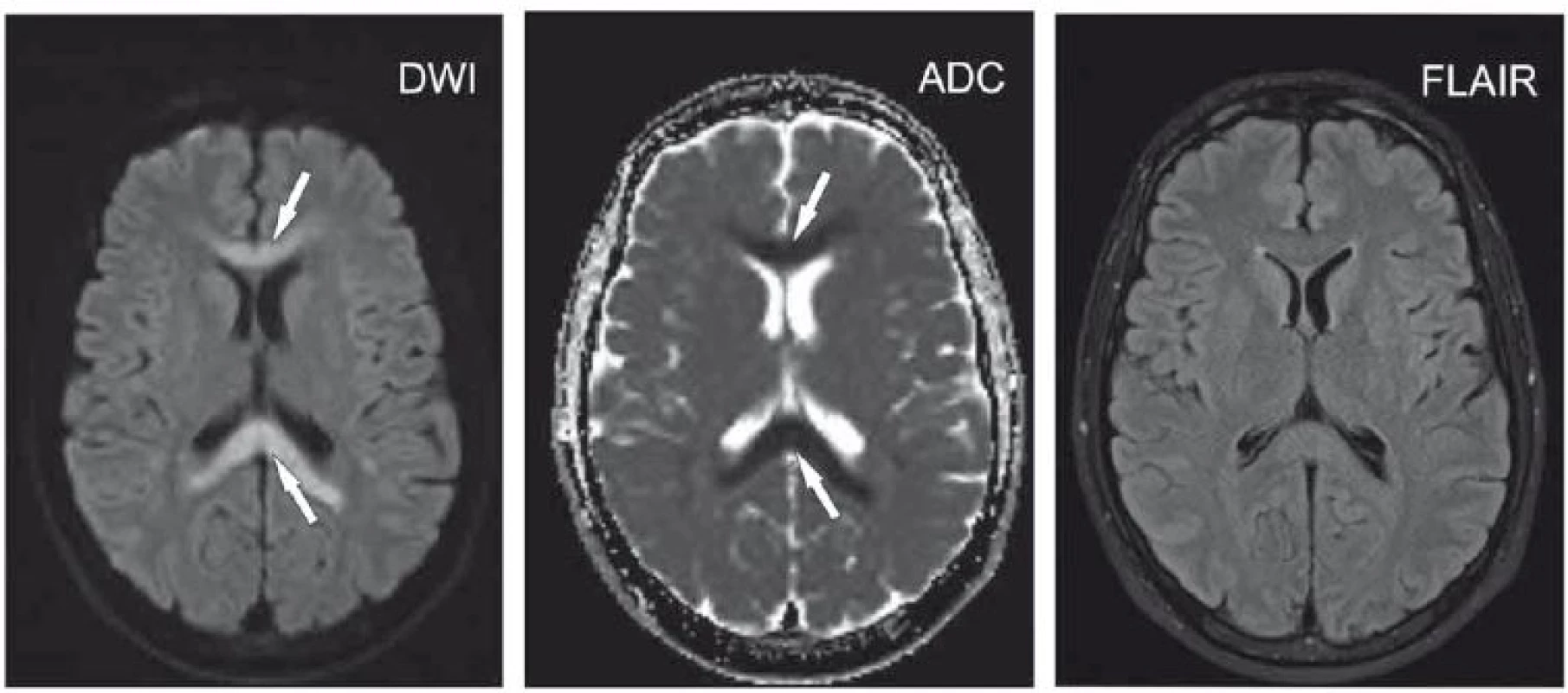
V tomto článku přinášíme přehled onemocnění u dospělých pacientů, u nichž se pravidelně vyskytuje nebo může vyskytnout restrikce difuze (tab. 1).
Patologické stavy, u nichž je restrikce difuze (téměř) vždy přítomna
Akutní ischemie je nejčastější patologie, u které nacházíme restrikci difuze, podkladem je cytotoxický edém. Změny signálu (hyperintenzní na DWI a hypointenzní na ADC) začnou být patrné již v časné hyperakutní fázi (0 – 6 h) a to po několika min od tepenného uzávěru (obr. 1). Tab. 2 ukazuje vývoj ischemie v čase [13].
Table 2. Změny intenzity na MR při ischemii – vývoj v čase. 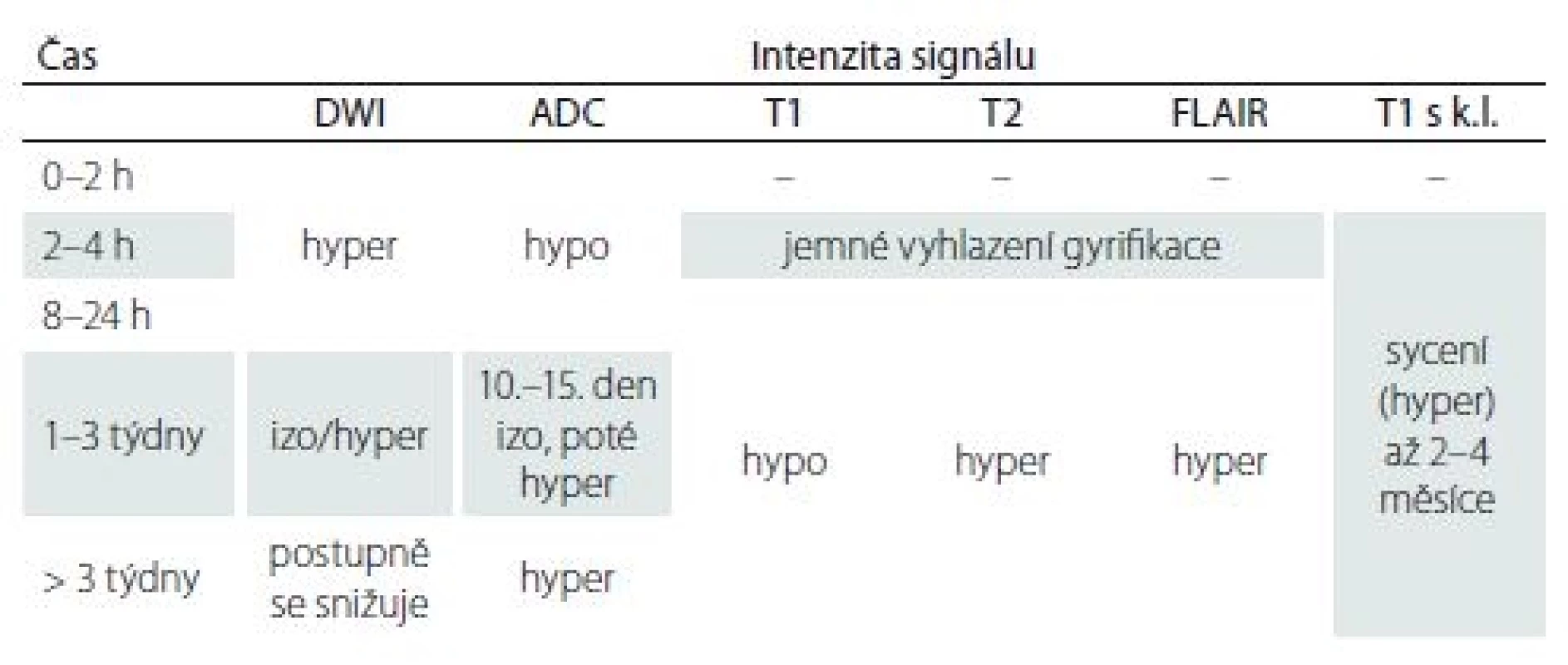
ADC – aparentní difuzní koeficient; DWI – difuzí vážený obraz; FLAIR – fluid attenuated inversion recovery; k. l. – kontrastní látka V akutním stadiu ischemické CMP (iCMP) jsou sekvence T1, T2 a inverzní zobrazení s potlačením signálu tekutiny (fluid attenuated inversion recovery; FLAIR) většinou negativní, změny na FLAIR (cytotoxický edém) se objevují během 3 – 4 h, přičemž následující 1 – 2 dny se stávají lépe viditelnými. Rozdíl na DWI a FLAIR (tzv. mismatch) může být vodítkem při léčbě pacientů s nejasnou dobou vzniku iCMP. Přítomnost rozdílu mezi perfuzí a difuzí váženými obrazy (PWI/ DWI mismatch) u pacienta s akutní iCMP poukazuje na přetrvávání penumbry. Pokud penumbra chybí či zaujímá pouze malou okrajovou část rozsáhlé ischemie, nelze ani v případě úspěšné rekanalizace očekávat výraznou regresi neurologického deficitu. Nicméně použití mismatche PWI/ DWI v indikaci endovaskulární rekanalizace mimo časové okno či při nejisté době vzniku (např. po probuzení) zůstává nadále experimentální metodou [14]. Popsaná kaskáda změn v čase je důležitá pro odlišení akutní a chronické CMP a pro diferenciální diagnostiku, tzn. odlišení CMP od patologických stavů, které napodobují CMP.
K ischemiím dochází převážně z tromboembolických příčin, méně pak z důvodů hemodynamických. Užíváním některých látek se základní riziko ischemie zvyšuje. Byl popsán případ ischemických změn v obou hipokampech a v semioválných centrech v důsledku akutní intoxikace kokainem u pacienta bez vaskulárních rizikových faktorů nebo předchozích hypoxických změn [15]. U venózních infarktů se kombinuje vazogenní a cytotoxický edém (který může předcházet vazogennímu) a obraz na DWI a ADC je pak heterogenní, přičemž změny mohou být reverzibilní [16].
Restrikci difuze též typicky nacházíme, je-li intrakraniálně přítomen hnis, a to z důvodu jeho vysoké viskozity a celularity dané vysokou koncentrací buněk zánětlivého infiltrátu [17]. Převážně jde o mozkový absces, který bývá uložen v mozkové tkáni a je pro něj typické prstenčité sycení, mívá oválný tvar a T2 hyposignální lem. Restrikce difuze většinou bývá centrálně, ale může být patrná i skvrnitá restrikce difuze na periferii [18]. Diferenciální diagnostika lézí s kombinací obrazu restrikce difuze a prstenčitého sycení zahrnuje mimo abscesy i metastázy mozku, multicentrický glioblastom, subakutní ischemii, vstřebávající se hematom, demyelinizační onemocnění [17]. Autoři uvádí tento obraz i u primárního lymfomu u HIV pozitivních pacientů [19]. Dále se můžeme setkat s empyémem (obr. 2), který má podobu extraaxiálně uložené tekutinové kolekce, jež na CT imituje starší hematom. V případě, že jde o parazitární onemocnění (např. toxoplazmózu), může být obraz na DWI variabilní [20].
Lymfomy vykazují poměrně výraznou restrikci difuze (obr. 3), přičemž se uvádí, že čím je signál na ADC nižší, tím horší je prognóza a vyšší riziko recidiv primárních lymfomů CNS [21]. Může být přítomna jen jedna infiltrující léze, ve 30 – 40 % nacházíme více lézí zároveň [22,23]. Léze mohou mít infiltrativní charakter a většinou dosahují okraje mozku [24], často jsou též lokalizované periventrikulárně [22]. Primární lymfomy jsou převážně high-grade a jen zřídla low-grade non-hodgkinské lymfomy, na MR mívají obraz postkontrastně se sytících lézí v kontaktu se subarachnoidálním prostorem, bez známek nekrózy. U low-grade lymfomů s atypickým MR nálezem a mírnými klinickými symptomy hrozí zpoždění diagnostiky či její špatné určení [25]. Úprava obrazu na ADC z hyposignálního na hypersignální vůči okolní tkáni svědčí pro úspěšný efekt terapie lymfomu [26].
S Creutzfeldt-Jakobovou nemocí se setkáváme jen vzácně, nicméně restrikce difuze je u tohoto onemocnění velmi častá. Hypersignální změny na DWI se zvýrazňují s postupem času, perzistující restrikce difuze je nejvíce senzitivní pro záchyt tohoto onemocnění a bývá lokalizována v oblasti bazálních ganglií, v talamu a v kortikálních oblastech (ve kterých se může vyskytovat i samostatně [27,28]). Na tuto diagnózu myslíme u pacientů s psychickými změnami a rychlou progresí demence.
Patologické stavy, u kterých restrikce difuze může být přítomna
Některé tumory, jako jsou např. meningeom, glioblastom, meduloblastom a některé metastázy, mohou vykazovat restrikci difuze díky své vysoké buněčnosti. U meningeomů se restrikce difuze vyskytuje jen zřídka a spíše jen naznačeně. Meningeomy jsou uloženy extraaxiálně a homogenně se sytí [20]. Metastázy tvoří značnou část tumorů v mozku, přičemž uváděné poměry se značně liší (od 20 % nádorů CNS [29], až k 90 % nádorů mozku [12]). Poměr je vyšší u starších osob. Byl publikován článek, kde autoři popsali restrikci difuze u metastáz z plic, prsou, tlustého střeva a teratokarcinomu varlat [30]. U přibližně poloviny pacientů jsou v době diagnózy metastázy mozku solitární a v minoritě případů není ještě znám primární tumor [31].
Difuzní axonální poranění může vykazovat restrikci difuze. Nejčastější lokalizace difuzního axonálního poranění je v místě přechodu šedé a bílé hmoty, hluboko v bílé hmotě, v corpus callosum a v mozkovém kmeni. Může se jednat o změny s hemoragií i bez ní, nápomocné jsou sekvence FLAIR a sekvence susceptibility-weighted images (SWI) a údaj o traumatu v anamnéze [20].
Léze u akutní diseminované encefalomyelitidy (ADEM) mají variabilní signál na DWI i na ADC, většinou se spíše jedná o „shine through“ efekt než o restrikci difuze. Pokud je restrikce difuze přítomna (obr. 4), je známkou horší prognózy [20]. U ADEM bývá patrné sycení, ale není podmínkou [32]. V prvních dnech od počátku klinických příznaků mohou být změny zřejmé pouze na DWI a ADC, zatímco nález mozku na dalších standardních sekvencích (T2, FLAIR, T1) [29] je zcela normální.
Encefalitida mívá variabilní obraz na DWI, signál může být zvýšený, smíšený i snížený. Zvýšení signálu na DWI je většinou méně výrazné než u akutní ischemie či abscesu. Léze bývají hypersignální na T2 [20], ale můžeme se setkat i se změnami vyjádřenými pouze na DWI a ADC [33]. Restrikce difuze byla popsána jak u autoimunní Rasmussenovy encefalitidy [34], tak u některých infekčních encefalitid, a to zejména při infekci virem herpes simplex [35].
U syndromu zadní reverzibilní encefalopatie (PRES) je restrikce difuze málo častá (v jedné z publikací ji autoři našli u 16 % případů [36]). Pokud se objeví, je známkou převahy cytotoxického edému nad vazogenním a prognóza je pak méně příznivá, s častou progresí do dokonané ischemie [37]. Na T2 nacházíme hypersignální okrsky převážně okcipitálně a parietálně [38] a v povodí arteria cerebri media bilaterálně [20]. PRES provází náhle vzniklé neurologické symptomy (bolest hlavy, alterace vědomí, změny vizu a epileptické záchvaty) s vazogenním edémem na zobrazovacích metodách. Rizikové faktory zahrnují infekci, urémii, malignitu, autoimunitní onemocnění, stav krátce před porodem či po porodu a arterální hypertenzi [36].
U Wernického encefalopatie se změny signálu charakteru restrikce difuze nejčastěji nachází při 3. komoře, případně v okolí diencephala. Nález na mapách ADC pomůže určit rozsah cytotoxického postižení, které může pomoci s odhadem míry odpovědi na dlouhodobou léčbu vitaminem B1 [39]. Mamilární tělesa, talamus, hypotalamus a šedá hmota v okolí Sylviova akvaduktu bývají na obou stranách hypersignální v T2 a sytí se po podání kontrastní látky [20]. Postižení bývá častější u chronických alkoholiků.
U Marchiafava-Bignamiho syndromu bývá přítomna demyelinizace corpus callosum, případně i přilehlých oblastí – přední a zadní komisury, středního mozečkového pedunkulu a centrum semiovale a též se u něj někdy můžeme setkat s restrikcí difuze. Jde o vzácné postižení u chronických alkoholiků [40].
Termín osmotický demyelinizační syndrom nahradil dříve používané označení centrální pontinní myelinolýza (který nebyl zcela přesný, vhledem k častému postižení i extrapontinních struktur). Jde o akutní demyelinizaci nejčastěji způsobenou příliš rychlou kompenzací hyponatremie, můžeme se s ním setkat u chronických alkoholiků. V akutní fázi se může vyskytnout restrikce difuze, na T2 jsou patrné hypersignální okrsky v pontu (často tvaru trojzubce [41]) a v bazálních gangliích.
Výkyvy glykemie mohou vyústit ve změny obrazu na MR charakteru restrikce difuze. U hypoglykemie bývají okrsky restrikce difuze okcipitálně a parietálně na obou stranách [20,42], ale mohou být jen unilaterální. Nejčastěji jde o pacienty s diabetem, může se též objevit u novorozenců v prvních dnech po porodu, přičemž rozsah abnormalit závisí na závažnosti a délce hypoglykemie [43].
U hyperglykemie se také někdy mohou objevit oblasti s restrikcí difuze, častěji to bývají změny v oblasti bazálních ganglií (putamen, nucleus caudatus a globus pallidus, putamen může být postiženo i samostatně). V klinickém obraze se vyskytují poruchy pohybu zvané hemichorea-hemiballismus [43].
Cysta Rathkeho výchlipky také může vykazovat restrikci difuze [44]. Jde o kongenitální lézi v (supra)selární oblasti.
V akutní fázi Wilsonovy choroby se též mohou objevit okrsky s restrikcí difuze, ať už z cytotoxického edému nebo zánětu při nadměrném ukládání mědi. V chronické fázi pak již restrikce difuze nebývá přítomna [45].
Při otravě oxidem uhelnatým se můžeme setkat s restrikcí difuze v korových oblastech [46].
Demyelinizace u RS způsobuje restrikci difuze jen vzácně (v jedné z prací uvádí autoři 9,6 %) [47], častější je pouze zvýšení intenzity signálu na ADC [20]. Restrikce difuze může být přítomna u (hyper)akutních plak, nález nemusí korelovat se sycením [12,47], i když v jedné z prací autoři popisují statisticky signifikantní korelaci mezi nižším signálem na ADC a postkontrastním sycením [48].
S restrikcí difuze se můžeme setkat u pacientů s prolongovaným epileptickým záchvatem v akutní a subakutní fázi, nejčastěji se změny objevují v korové oblasti a v hipokampu [20] a restrikce difuze byla popsána i u pacientů s anamnézou radioterapie mozku (před 14 – 20 lety) a epileptickými záchvaty, u kterých byl diagnostikován stroke-like migraine attacks after radiation therapy (SMART) syndrom [49].
Patologické stavy imitující obraz restrikce difuze
Paramagnetické a feromagnetické materiály, kam spadají i degradační produkty hemoglobinu a vápník mohou imitovat restrikci difuze na DWI a ADC [10]. Obraz hematomů je velmi variabilní a v čase se mění, na DWI mohou být hematomy hypersignální i zcela asignální [20]. V těsném okolí hyperakutních hematomů (do 6 h od vzniku) jsou popisovány okrsky s restrikcí difuze, nejspíše podmíněné nižším prokrvením a metabolickými změnami [50]. V hematomech samotných se můžeme setkat se zvýšeným signálem na DWI v hyperakutní fázi, kdy jsou navíc hyposignální na ADC (stadium intracelulárního oxyhemoglobinu), znovu jsou pak DWI hypersignální v pozdní subakutní fázi, na ADC je ale hematom již bez snížení intenzity signálu (extracelulární methemoglobin) [9].
Sekvence DWI (b = 0) je ekvivalentní v kategorizaci intracerebrálních hematomů s nativní CT mozku, spolehlivější je pak sekvence T2* gradient recalled echo (GRE) [51]. Diagnostiku krvácení na MR rovněž usnadňuje sekvence SWI, kde jsou hematomy (i vápník, tedy kalcifikace) asignální. Další možností je korelace s nálezem CT.
Závěr
Při hodnocení pacientů s nálezem restrikce difuze na MR je zapotřebí vzít do úvahy obraz na všech sekvencích a anamnézu pacienta. Ve vztahu k četnosti nálezů začíná diferenciální diagnostika u akutní ischemie, abscesu a tumorózního onemocnění (zejména lymfomu), ale je dobré vědět, že restrikce difuze se může vyskytovat i u dalších onemocnění.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
MUDr. Tomáš Dorňák, Ph.D.
Neurologická klinika LF UP a FN Olomouc
I. P. Pavlova 6
775 20 Olomouc
e-mail: dornaktomas@seznam.cz
Přijato k recenzi: 16. 3. 2018
Přijato do tisku: 7. 8. 2018
Sources
1. Sener RN, Atalar MH. Diffusion-weighted magnetic resonance imaging in the early diagnosis of neonatal adrenoleukodystrophy. J Clin Imaging Sci 2011; 1 : 20. doi: 10.4103/ 2156-7514.78530.
2. Srikanth SG, Chandrashekar HS, Nagarajan K et al. Restricted diffusion in Canavan disease. Childs Nerv Syst 2007; 23(4): 465 – 468. doi: 10.1007/ s00381-006-0238-9.
3. Mohammad SA, Abdelkhalek HS. Nonketotic hyperglycinemia: Spectrum of imaging findings with emphasis on diffusion-weighted imaging. Neuroradiology 2017; 59(11): 1155 – 1163. doi: 10.1007/ s00234-017-1913-0.
4. Bhat MD, Prasad C, Tiwari S et al. Diffusion restriction in ethylmalonic encephalopathy – an imaging evidence of the pathophysiology of the disease. Brain Dev 2016; 38(8): 768 – 771. doi: 10.1016/ j.braindev.2016.02.014.
5. Nam TS, Oh J, Levy M et al. A novel GFAP mutation in late-onset Alexander disease showing diffusion restriction. J Clin Neurol 2017; 13(4): 426 – 428. doi: 10.3988/ jcn.2017.13.4.426.
6. Kumakura A, Asada J, Okumura R et al. Diffusion--weighted imaging in preclinical Leigh syndrome. Pediatr Neurol 2009; 41(4): 309 – 311. doi: 10.1016/ j.pediatrneurol.2009.04.028.
7. Chethan BS, Yugandhara S. Eye of tiger sign in Hallervorden Spatz disease (pantothenate kinase II associated neurodegeneration - PKAN): a rare case report. Journal of Evolution of Medical and Dental Sciences 2013; 2(50): 9641 – 9644.
8. Kim JH, Lim MK, Jeon TY et al. Diffusion and perfusion characteristics of MELAS (mitochondrial myopathy, encephalopathy, lactic acidosis, and stroke-like episode) in thirteen patients. Korean J Radiol 2011; 12(1): 15 – 24. doi: 10.3348/ kjr.2011.12.1.15.
9. Stadnik TW, Demaerel P, Luypaert RR et al. Imaging tutorial: differential diagnosis of bright lesions on diffusion-weighted MR images. Radiographics 2003; 23(1): e7. doi: 10.1148/ rg.e7.
10. Bernstein M, Berger MS. Neuro-oncology: the essentials. 3rd ed. Stuttgart: Thieme Medical Publishers 2014.
11. Žižka J, Tintěra J, Mechl M et al. Protokoly MR zobrazování, pokročilé techniky. Praha: Galén 2015.
12. Seidl Z, Vaněčková M. Diagnostická radiologie. Neuroradiologie. Praha: Grada 2014.
13. Allen LM, Hasso AN, Handwerker J et al. Sequence-specific MR imaging findings that are useful in dating ischemic stroke. Radiographics 2012; 32(5): 1285 – 1297. doi: 10.1148/ rg.325115760.
14. Thomalla G, Simonsen CZ, Boutitie F et al. MRI-guided thrombolysis for stroke with unknown time of onset. N Engl J Med 2018; 379(7): 611 – 622. doi: 10.1056/ NEJMoa1804355.
15. Connelly KL, Chen X, Kwan PF. Bilateral hippocampal stroke secondary to acute cocaine intoxication. Oxf Med Case Reports 2015; 2015(3): 215 – 217. doi: 10.1093/ omcr/ omv016.
16. Osborn AG, Salzman KL, Barkowivich AJ et al. Diag-nostic Imaging: brain. 2nd ed. Salt Lake City: Amirsys 2010.
17. Hartmann M, Jansen O, Heiland S et al. Restricted diffusion within ring enhancement is not pathognomonic for brain abscess. AJNR Am J Neuroradiol 2001; 22(9): 1738 – 1742.
18. Holmes TM, Petrella JR, Provenzale JM. Distinction between cerebral abscesses and high-grade neoplasms by dynamic susceptibility contrast perfusion MRI. AJR Am J Roentgenol 2004; 183(5): 1247 – 1252. doi: 10.2214/ ajr.183.5.1831247.
19. Gerstner ER, Batchelor TT. Primary central nervous system lymphoma. Arch Neurol 2010; 67(3): 291 – 297. doi: 10.1001/ archneurol.2010.3.
20. Osborn AG, Ross JS, Salzman KL et al. ExpertDDx: brain and spine. 1st ed. Salt Lake City: Amirsys 2008.
21. Valles FE, Perez-Valles CL, Regalado S et al. Combined diffusion and perfusion MR imaging as biomarkers of prognosis in immunocompetent patients with primary central nervous system lymphoma. AJNR Am J Neuroradiol 2013; 34 : 35 – 40. doi: 10.3174/ ajnr.A3165.
22. Nasir SS, DeAngelis LM. Update on the management of primary CNS lymphoma. Oncology (Williston Park) 2000; 14(2): 228 – 234.
23. Mansour A, Qandeel M, Abdel-Razeq H et al. MR imaging features of intracranial primary CNS lymphoma in immune competent patients. Cancer Imaging 2014; 14(1): 22. doi: 10.1186/ 1470-7330-14-22.
24. Koubska E, Weichet J, Malikova H. Central nervous system lymphoma: a morphological MRI study. Neuro Endocrinol Lett 2016; 37(4): 318 – 324.
25. Jahnke K, Schilling A, Heidenreich J et al. Radiologic morphology of low-grade primary central nervous system lymphoma in immunocompetent patients. Am J Neuroradiol 2005; 26(10): 2446 – 2454.
26. Aygun N, Shah G, Gandhi D. Pearls and pitfalls in head and neck and neuroimaging: variants and other difficult diagnoses. Cambridge: Cambridge University Press 2013.
27. Huang WY, Wen JB, Wu G et al. Diffusion-weighted imaging for predicting and monitoring primary central nervous system lymphoma treatment response. AJNR Am J Neuroradiol 2016; 37(11): 2010 – 2018. doi: 10.3174/ ajnr.A4867.
28. Meissner B, Kallenberg K, Sanchez-Juan P et al. Isolated cortical signal increase on MR imaging as a frequent lesion pattern in sporadic Creutzfeldt-Jakob disease. Am J Neuroradiol 2008; 29(8): 1519 – 1524. doi: 10.3174/ ajnr.A1122.
29. Saha A, Ghosh SK, Roy C et al. Demographic and clinical profile of patients with brain metastases: a retrospective study. Asian J Neurosurg 2013; 8(3): 157 – 161. doi: 10.4103/ 1793-5482.121688.
30. Duygulu G, Ovali GY, Calli C et al. Intracerebral metastasis showing restricted diffusion: correlation with histopathologic findings. Eur J Radiol 2010; 74(1): 117 – 120. doi: 10.1016/ j.ejrad.2009.03.004.
31. Kumar V, Abbas AK, Fausto N et al. Robbins and Cotran pathologic basis of disease. 7th ed. Philadelphia: Elsevier Saunders 2005.
32. Greenberg MS. Handbook of Neurosurgery. 7th ed. New York: Thieme Medical Publishers 2010.
33. Seidl Z, Vaněčková M, Burgetová A et al. Difuzí vážený obraz (DWI) MR u pacientky s encefalitidou způsobenou herpes simplex virem (HSV). Ces Radiol 2008; 62(4): 381 – 383.
34. Furruqh F, Thirunavukarasu S, Biswas A et al. Complete right cerebral hemispheric diffusion restriction and its follow-up in a case of Rasmussen‘s encephalitis. BMJ Case Rep 2015: pii. doi: 10.1136/ bcr-2015-212256.
35. Sawlani V. Diffusion-weighted imaging and apparent diffusion coefficient evaluation of herpes simplex encephalitis and Japanese encephalitis. J Neurol Sci 2009; 287(1 – 2): 221 – 226. doi: 10.1016/ j.jns.2009.07.010.
36. Schweitzer AD, Parikh NS, Askin G et al. Imaging characteristics associated with clinical outcomes in posterior reversible encephalopathy syndrome. Neuroradiology 2017; 59(4): 379 – 386. doi: 10.1007/ s00234-017-1815-1.
37. Sudulagunta SR, Sodalagunta MB, Kumbhat M et al. Posterior reversible encephalopathy syndrome (PRES). Oxf Med Case Reports 2017; 2017(4): omx011. doi: 10.1093/ omcr/ omx011.
38. Brady E, Parikh NS, Navi BB et al. The imaging spectrum of posterior reversible encephalopathy syndrome: a pictorial review. Clin Imaging 2018; 47 : 80 – 89. doi: 10.1016/ j.clinimag.2017.08.008.
39. Loh Y, Watson WD, Verma A et al. Restricted diffusion of the splenium in acute Wernicke‘s encephalopathy. J Neuroimaging 2005; 15(4): 373 – 375. doi: 10.1177/ 1051228405279037.
40. Parmanand HT. Marchiafava-Bignami disease in chronic alcoholic patient. Radiol Case Rep 2016; 11(3): 234 – 237. doi: 10.1016/ j.radcr.2016.05.015.
41. Venkatanarasimha N, Mukonoweshuro W, Jones J. AJR teaching file: symmetric demyelination. Am J Roentgenol 2008; 191 (Suppl 3): S34 – S36. doi: 10.2214/ AJR.07.7052.
42. Martin TD, Canepa C. Forgetting to remember: hypoglycaemic encephalopathy. BMJ Case Rep 2016; pii: bcr2016217954. doi: 10.1136/ bcr-2016-217954.
43. Bathla G, Policeni B, Agarwal A. Neuroimaging in patients with abnormal blood glucose levels. Am J Neuroradiol 2014; 35(5): 833 – 840. doi: 10.3174/ ajnr.A3486.
44. Sivaraju L, Anantha Sai Kiran N, Rao AS et al. Giant multi-compartmental suprasellar Rathke‘s cleft cyst with restriction on diffusion weighted images. Neuroradiol J 2017; 30(3): 290 – 294. doi: 10.1177/ 1971400916682512.
45. Yousaf M, Kumar M, Ramakrishnaiah R et al. Atypical MRI features involving the brain in Wilson‘s desease. Radiol Case Rep 2009; 4(3): 312. doi: 10.2484/ rcr.v4i3.312.
46. Sener RN. Acute carbon monoxide poisoning: diffusion MR imaging findings. Am J Neuroradiol 2003; 24(7): 1475 – 1477.
47. Foroughi AA, Salahi R, Nikseresht A et al. Comparison of diffusion-weighted imaging and enhanced T1-weighted sequencing in patients with multiple sclerosis. Neuroradiol J 2017; 30(4): 347 – 351. doi: 10.1177/ 1971400916678224.
48. Abdoli M, Chakraborty S, MacLean HJ et al. The evaluation of MRI diffusion values of active demyelinating lesions in multiple sclerosis. Mult Scler Relat Disord 2016; 10 : 97 – 102. doi: 10.1016/ j.msard.2016.09.006.
49. Jaraba S, Puig O, Miró J et al. Refractory status epilepticus due to SMART syndrome. Epilepsy Behav 2015; 49 : 189 – 192. doi: 10.1016/ j.yebeh.2015.05.033.
50. Schneider T, Frieling D, Schroeder J et al. Perihematomal diffusion restriction as a common finding in large intracerebral hemorrhages in the hyperacute phase. PLoS One 2017; 12(9): e0184518. doi: 10.1371/ journal.pone.0184518.
51. Renou P, Sibon I, Tourdias T et al. Reliability of the ECASS radiological classification of postthrombolysis brain haemorrhage: a comparison of CT and three MRI sequences. Cerebrovasc Dis 2010; 29(6): 597 – 604. doi: 10.1159/ 000312867.
Labels
Paediatric neurology Neurosurgery Neurology
Article was published inCzech and Slovak Neurology and Neurosurgery

2018 Issue 5-
All articles in this issue
- Anestezie a nervosvalová onemocnění
- Nejlepší postup v terapii motoricky pokročilé Parkinsonovy nemoci je INTRADUODENÁLNÍ LEVODOPA
- Nejlepší postup v terapii motoricky pokročilé Parkinsonovy nemoci je APOMORFINOVÁ INFUZE
- Najlepší postup v terapii motoricky pokročilej Parkinsonovej nemoci je HLBOKÁ MOZGOVÁ STIMULÁCIA
- Cervikální vertigo – fikce či realita?
- Péče o pacienty s dysfagií po cévní mozkové příhodě v České republice
- Matematické modelování hemodynamiky mozkových aneuryzmat a možný přínos v klinické praxi z pohledu neurochirurga
- Přehled onemocnění s obrazem restrikce difuze na magnetické rezonanci mozku
- Nové poznatky v diagnostice a léčbě amyotrofické laterální sklerózy
- Léčba recidivy či rezidua multiformního glioblastomu pomocí stereotaktické radiochirurgie gama nožem – společně hodnocený soubor dvou neurochirurgických pracovišť
- Validace dotazníku pro pacienty s myotonií – česká verze Myotonia Behaviour Scale
- První dokumentovaný případ japonské encefalitidy importované do České republiky
- Časná komplikace ošetření disekujícího intrakraniálního aneuryzmatu ve vertebrobazilárním povodí flow-diverterem
- Harvey Cushing jako kandidát Nobelovy ceny
- Svalová dystopie ve Fallopiově kanálu
- Tichý akútny a subakútny mozgový infarkt u pacientov pred koronárnou intervenciou
- Vztah mezi epidemiologií a subjektivním vnímáním bolesti u pacientů se syndromem karpálního tunelu
- Zrozumiteľnosť reči a klinické parametre u pacientov s Parkinsonovou chorobou
- Umístění bifurkace bazilární tepny ve vztahu k dorsu sellae
- Spinální schwannom v oblasti hrudní páteře s masivním intratumorálním krvácením
- Czech and Slovak Neurology and Neurosurgery
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Nové poznatky v diagnostice a léčbě amyotrofické laterální sklerózy
- Přehled onemocnění s obrazem restrikce difuze na magnetické rezonanci mozku
- Cervikální vertigo – fikce či realita?
- Anestezie a nervosvalová onemocnění
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

