-
Medical journals
- Career
Lehké řetězce neurofilament v séru a mozkomíšním moku a stav hematolikvorové bariéry u vybraných neurologických onemocnění
Authors: L. Fialová 1; A. Bartoš 2,3; J. Švarcová 4
Authors‘ workplace: Ústav lékařské biochemie a laboratorní diagnostiky, 1. LF UK a VFN v Praze 1; Národní ústav duševního zdraví, Klecany 2; Neurologická klinika 3. LF UK a FN Královské Vinohrady, Praha 3; Ústav lékařské chemie a klinické biochemie, 2. LF UK a FN Motol, Praha 4
Published in: Cesk Slov Neurol N 2018; 81(2): 185-192
Category: Original Paper
doi: https://doi.org/10.14735/amcsnn2018185Overview
Cíl:
Cílem studie bylo posoudit vztah mezi permeabilitou hematolikvorové bariéry (HLB) hodnocené albuminovým kvocientem (Qalb) a hladinami lehkých řetězců neurofilament (NFL) v séru a mozkomíšním moku u několika skupin pacientů s neurologickými onemocněními, u nichž je porušení HLB vyjádřeno s rozdílnou intenzitou.Soubor a metodika:
Soubor o celkovém počtu 137 pacientů zahrnoval 50 nemocných s RS vč. klinicky izolovaného syndromu, 24 pacientů s Alzheimerovou nemocí, 17 pacientů s aseptickými neuroinfekcemi, 36 pacientů s různými nezánětlivými neurologickými onemocněními a 10 symptomatických kontrol. Metodou ELISA byly stanoveny hladiny NFL v séru a mozkomíšním moku pacientů a imunonefelometricky hladiny albuminu, z nichž byl vypočítán Qalb.Výsledky:
U žádné ze sledovaných skupin nebyla prokázána pozitivní korelace mezi hladinami NFL v séru a hodnotou Qalb. Hladiny NFL v likvoru pozitivně korelovaly s hodnotou Qalb u pacientů s aseptickými neuroinfekcemi a pacientů s nezánětlivými neurologickými onemocněními. Ve skupině pacientů s aseptickými neuroinfekcemi byla nalezena pozitivní korelace mezi hladinami NFL v séru a v likvoru, stejně tak při hodnocení souboru pacientů jako celku.Závěry:
Zdá se, že sérové hladiny NFL nejsou přímo ovlivněny permeabilitou HLB posuzované Qalb u neurodegenerativních onemocnění a neuroinfekcí. Naopak na vztah mezi likvorovými hladinami NFL a Qalb může mít vliv charakter neuropatologických změn u jednotlivých neurologických onemocnění.Klíčová slova:
albuminový kvocient – Alzheimerova nemoc – cytoskelet – hematolikvorová bariéra – roztroušená skleróza – neuroinfekce – neurofilamentaÚvod
Neurofilamenta reprezentují podstatnou součást neurocytoskeletálních struktur přítomných v tělech i ve výběžcích neuronů centrálního a periferního nervového systému. Heteropolymerní struktura neurofilament je tvořena třemi základními podjednotkami, kterými jsou lehké (NFL), střední (NFM) a těžké řetězce (NFH) označované jako neurofilamentový triplet. Nejhojnější součást neurofilament představují NFL, která jsou přítomna v každém neurofilamentu společně s NFH nebo NFM a jsou soustředěna zejména do oblasti axonů [1].
Při poškození axonů se mohou jednotlivé řetězce neurofilament uvolňovat do extracelulárního prostoru. Hladiny řetězců neurofilament v biologických tekutinách jsou studovány jako biomarkery vypovídající o narušení axonálních struktur, které doprovází různá neurologická onemocnění. Řada studií ukázala, že hladiny jednotlivých neurofilamentových řetězců mohou mít klinický význam u RS, demencí, cévních mozkových příhod a dalších neurologických chorob [2 – 5].
Pozornost kliniků se soustřeďuje zejména na NFL a NFH. NFL mají z neurofilamentového tripletu nejmenší molekulovou hmotnost. To usnadňuje jejich časnější průnik do mozkomíšního moku (cerebrospinal fluid; CSF) ve srovnání s většími NFH [6]. První klinicky zaměřené studie se orientovaly na stanovení hladin jednotlivých řetězců neurofilament v mozkomíšním moku [7]. Zavedení citlivějších imunoalytických metod umožnilo sledovat hladiny neurofilamentových řetězců i v séru/ plazmě, v nichž jsou koncentrace podstatně nižší [8 – 11].
V našich předchozích analýzách jsme hodnotili hladiny NFL v séru a mozkomíšním moku z hlediska jejich změn u pacientů s některými onemocněními doprovázenými poškozením axonů – RS a Alzheimerovou nemocí (AN) [5,12].
Roztroušená skleróza je chronické demyelinizační onemocnění, na němž se podílí autoimunitní zánět společně s neurodegenerativními procesy [4,13]. Poškození axonů se dostavuje již v časných fázích onemocnění a přispívá k progresi onemocnění [14]. Náhlý vznik prvních ložiskových neurologických příznaků, které mohou, ale nemusí progredovat do stavu definitivní RS, se označuje jako klinicky izolovaný syndrom (CIS) [15]. RS vč. CIS je jedním z onemocnění, u kterého se pozornost výzkumníků soustřeďuje na stanovení NFL v séru [5,8,16]. Z dřívějších studií, které analyzovaly hladiny NFL v mozkomíšním moku, vyplývá, že tyto struktury neurocytoskeletu se jeví jako vhodné časné biomarkery poškození axonů [5,17]. Jejich zvýšení je pozorováno již ve fázi CIS, zejména u pacientů, kteří konvertují do klinicky definitivní RS [6]. Řada novějších prací, které se již orientují na stanovení NFL v séru, naznačuje, že i sérové hladiny NFL odrážejí narušení axonů v časné i rozvinuté fázi RS a že sérové hladiny reagují na účinnost terapie [8,16].
Alzheimerova nemoc je další závažná neurodegenerativní choroba. Hlavními neuropatologickými projevy AN je vznik extracelulárně uložených amyloidových senilních plaků tvořených β-amyloidem a intracelulárních neurofibrilárních klubek. Na jejich vzniku se nejen podílí hyperfosforylované τ-proteiny, ale předpokládá se i zapojení neurofilament [18,19]. V diagnóze AN se kromě hodnocení kognitivních funkcí mohou uplatnit i některé likvorové biomarkery, kterými je tzv. likvorový triplet zahrnující celkový a fosforylovaný τ-protein společně s β-amyloidem [20]. Kromě likvorového tripletu diferencuje pacienty s AN od kontrol i hladina NFL [21]. Zvýšení hladin NFL je prokazováno jak v likvoru, tak i v plazmě/ séru [9]. Novější studie naznačují, že NFL v plazmě by mohla představovat neinvazivní biomarker neurodegenerace vč. AN [9,22].
Problém při stanovení proteinů mozkového původu v séru může představovat skutečnost, že jejich hladiny v krvi mohou být ovlivněny poškozením hematolikvorové bariéry (HLB) nebo hematoencefalické bariéry (HEB), které doprovází některá neurologická onemocnění [23,24]. V nedávné práci bylo ukázáno, že sérové hladiny NFL nekorelují s hodnotami Qalb [25].
Cílem naší studie bylo navázat na výsledky práce Kalma et al [25] a u pacientů z našich předchozích výzkumů posoudit vztah mezi permeabilitou HLB a hladinami NFL v séru a mozkomíšním moku. K pacientům s RS vč. CIS a AN byli přiřazeni i nemocní s aseptickými neuroinfekcemi tak, aby byli zastoupeni i pacienti s výrazněji porušenou HLB.
Osoby a metodika
Soubor
Náš soubor tvořilo 137 pacientů sledovaných na Neurologické klinice 3. LF UK a FN Královské Vinohrady pro různá onemocnění. Pacienti byli rozděleni na skupinu pacientů s RS společně s CIS (n = 50; věk 34 ± 9 let; 38 žen, 12 mužů), skupinu pacientů s AN (n = 24; věk 73 ± 7; 21 žen, 3 muži), skupinu pacientů s aseptickými neuroinfekcemi (n = 17; věk 70 ± 8; 10 žen, 7 mužů), skupinu pacientů s neurologickými nezánětlivými onemocněními (n = 36; věk 53 ± 18; 17 žen; 19 mužů) a skupinu symptomatických kontrol (n = 10; věk 34 ± 7; 7 žen, 3 muži). Diagnózu u pacientů zařazených do studie určoval zkušený neurolog.
Skupina RS zahrnovala jednak pacienty s diagnózou definitivní RS (n = 18) a jednak pacienty s CIS po první klinické epizodě (n = 32) na základě McDonaldových diagnostických kritérií platných v době lumbální punkce [26]. Do skupiny nemocných s AN byli zařazeni pacienti splňující kritéria NIA-AA (National Institute on Aging-Alzheimer‘s Association) [27]. Kognitivní funkce byly posuzovány pomocí české verze testu ACE-R (Addenbrooke‘s Cognitive Examination Revised), který hodnotí kognitivní funkce detailněji než test MMSE (Mini-Mental State Examination) [28 – 30]. Pro vyloučení intrakraniální patologie a určení velikosti hipokampu bylo provedeno u všech pacientů s AN vyšetření MR nebo CT v případech, kde vyšetření MR nebylo možné [31,32]. Další osoby jsme rozdělili na více skupin podle mezinárodní dohody [33]. Skupina pacientů se zánětlivými neurologickými onemocněními zahrnovala pacienty s aseptickými záněty, především neuroboreliózou a herpetickými infekcemi. Do skupiny pacientů s neurologickým onemocněním nezánětlivého původu byli zařazeni pacienti s různými diagnózami s normálním počtem elementů v mozkomíšním moku. Skupinu symptomatických kontrol tvořili pacienti s neurologickými příznaky, ke kterým nebyly prokázány objektivní klinické nebo paraklinické nálezy vztahující se ke konkrétnímu neurologickému onemocnění. V mozkomíšním moku byl normální počet elementů a hodnoty Qalb korigovaného na věk nepřevyšovaly referenční meze [33 – 35].
Vzorky mozkomíšního moku a krve odebírané v souladu s odpovídajícími doporučeními byly po odběru centrifugovány, alikvotovány po 0,5 – 1,0 ml do polypropylenových zkumavek a během 1,5 h v průměru uloženy při – 80 °C [36]. Potřebné alikvoty byly rozmrazovány před analýzou.
Pacienti zařazení do studie podepsali informovaný souhlas. Výzkum byl schválen etickou komisí FN Královské Vinohrady.
Analytické metody
Pro stanovení hladin NFL v séru a mozkomíšním moku byla použita komerční ELISA souprava NF-Light® Neurofilament ELISA (UmanDiagnostics, Umeå, Švédsko) určená pro výzkumné účely. Souprava byla zpracována podle instrukcí výrobce. Standardy i neznámé vzorky byly analyzovány v dubletu. Hodnoty NFL neznámých vzorků byly odečítány z šestibodové kalibrační křivky v její lineární části. Detekční limit byl 31 ng/ l. V případě velmi nízkých hladin NFL v séru, které ležely pod detekčním limitem, byla pro statistické účely použita hodnota rovna detekčnímu limitu (31 ng/ l). Dle údajů výrobce diagnostické soupravy hodnoty variačních koeficientů pro reprodukovatelnost v sérii pro tři různé hladiny koncentrací NFL (nízké, střední a vysoké) byly méně než 6 % a mezi sériemi méně než 9 %.
Koncentrace albuminu v séru a likvoru byla stanovena imunonefelometricky (IMMAGE imunochemický systém, Beckman Coulter, Inc., Fullerton, CA, USA). Z hodnot koncentrací albuminu v likvoru a séru (S) byl vypočítán albuminový kvocient (Qalb = CSF-albu-min/ S-albumin).
Pro nedostatek biologického materiálu nemohly být v některých vzorcích stanoveny oba analyty (NFL a albumin).
Statistické metody
Vzhledem k tomu, že koncentrace NFL v séru a mozkomíšním moku v jednotlivých diagnostických skupinách nevykazovaly normální rozdělení, byl k hodnocení studovaných vztahů mezi různými proměnnými použit Spearmanův korelační koeficient. Statistické hodnocení bylo provedeno pomocí software Statistica, verze 12.0 (StatSoft CR s.r.o. Praha, ČR).
Výsledky
Hodnotili jsme vztahy mezi parametry hematolikvorové bariéry (Qalb a albumin v mozkomíšním moku) a hladinami NFL v mozkomíšním moku nebo v séru u jednotlivých skupin pacientů. Dále jsme provedli podobné analýzy poté, co jsme celý soubor rozdělili podle hodnoty Qalb na skupinu s hodnotou Qalb × 103 < 10 a na skupinu s hodnotou Qalb × 103 > 10. Při volbě hraniční hodnoty pro Qalb jsme vyšli z práce Kalma et al [25]. Uvedené vztahy byly analyzovány i v celém souboru jako celku.
Skupiny pacientů podle diagnóz
Hodnoty příslušných korelačních koeficientů a p hodnoty jsou uvedeny v tab. 1. V žádné skupině pacientů jsme neprokázali pozitivní korelaci mezi hladinami NFL v séru a hodnotou Qalb. Podobně nebyla zjištěna korelace mezi NFL v séru a albuminem v mozkomíšním moku. Ve skupině symptomatických kontrol jsme měli možnost vyšetřit hladiny NFL v séru pouze u pěti pacientů a hladiny NFL ležely pod detekčním limitem použité metody ELISA. Proto je zapotřebí k posuzování příslušných hodnot korelačních koeficientů (S-NFL vs. Qalb/ CSF-albumin/ CSF-NFL) uvedených v tab. 1 přistupovat s opatrností.
Table 1. Korelace mezi hladinami lehkých řetězců neurofilament a albuminovým kvocientem u jednotlivých skupin pacientů s neurologickým onemocněním. 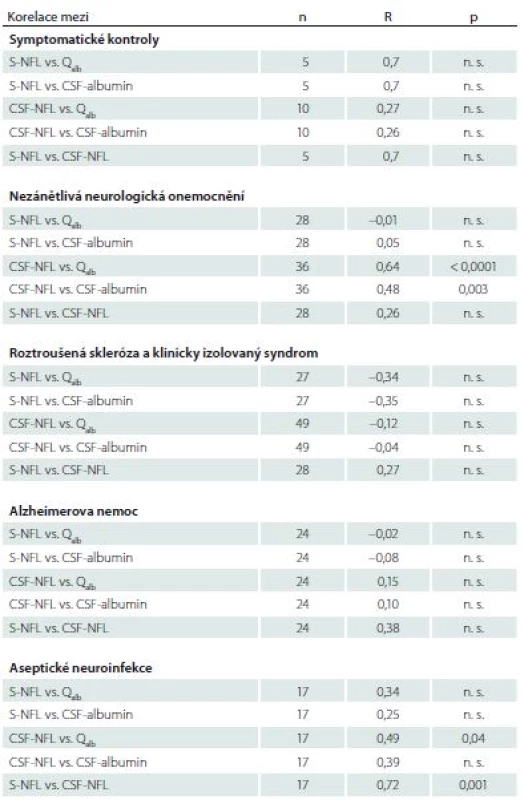
CSF NFL – hladiny lehkých řetězců neurofilament v mozkomíšním moku; CSF-albumin – hladiny albuminu v mozkomíšním moku; n – počet pacientů; n. s. – není signifikantní; p – hladina významnosti; Qalb – albuminový kvocient; R – Spearmanův korelační koeficient; S-NFL – hladiny lehkých řetězců neurofilament v séru; vs. – versus Jiné výsledky se týkaly nálezů v likvoru. Nalezli jsme souvislost mezi koncentrací NFL v likvoru a Qalb ve skupině pacientů s nezánětlivými neurologickými onemocněními a skupině pacientů s neuroinfekcemi (graf 1A,B). Mezi pacienty s nezánětlivými neurologickými onemocněními byla jedna 78letá žena s výrazně zvýšenými hodnotami hladin NFL v likvoru. Měla cervikální myelopatii a klinicky němé meningeomy (CSF-NFL 18 000 ng/ l, S-NFL 720 ng/ l). Ve skupině pacientů s neuroinfekcí korelovaly hladiny NFL v séru a mozkomíšním moku (graf 2).
Graf 1A. Korelace mezi albuminovým kvocientem a hladinami lehkých řetězců neurofilament v mozkomíšním moku u nezánětlivých neurologických onemocnění. CSF-NFL – hladiny lehkých řetězců neurofilament v mozkomíšním moku; Q<sub>alb</sub> – albuminový kvocient Graph 1A. Relationship between albumin quotient and neurofilament light chain levels in the cerebrospinal fluid in patients with non-infl ammatory neurological diseases. CSF-NFL – neurofilament light chain levels in cerebrospinal fluid; Q<sub>alb</sub> – albumin quotient 
Graf 1B. Korelace mezi albuminovým kvocientem a hladinami lehkých řetězců neurofilament v mozkomíšním moku u pacientů s aseptickými neuroinfekcemi. CSF-NFL – hladiny lehkých řetězců neurofilament v mozkomíšním moku; Q<sub>alb</sub> – albuminový kvocient Graph 1B. Relationship between albumin quotient and neurofilament light chain levels in the cerebrospinal fluid in patients with aseptic neuroinfections. CSF-NFL – neurofilament light chain levels in cerebrospinal fluid; Q<sub>alb</sub> – albumin quotient 
Graph 1. Korelace mezi hladinami lehkých řetězců neurofilament v mozkomíšním moku a séru u pacientů s aseptickými neuroinfekcemi. CSF-NFL – hladiny lehkých řetězců neurofilament v mozkomíšním moku; S-NFL – hladiny lehkých řetězců neurofilament v séru Graph 2. Relationship between levels of neurofilament light chains in cerebrospinal fluid and serum in patients with aseptic neuroinfections. CSF-NFL – neurofilament light chain levels in cerebrospinal fluid; S-NFL – neurofilament light chain levels in serum 
Skupiny pacientů podle hodnoty Qalb
Při rozdělení pacientů podle hodnoty Qalb nekorelovaly sérové hladiny NFL s hodnotou Qalb nebo s albuminem v mozkomíšním moku ani ve skupině s hodnotou Qalb × 103 < 10, ani s hodnotami Qalb × 103 > 10. Ve skupině s hodnotami Qalb × 103 < 10 byla nalezena pozitivní korelace mezi hladinami NFL v likvoru a Qalb. Shodně v obou skupinách byla prokázána pozitivní korelace mezi hladinami NFL v séru a v mozkomíšním moku (tab. 2).
Table 2. Korelace mezi hladinami lehkých řetězců neurofilament v séru nebo mozkomíšním moku a albuminovým kvocientem u skupin pacientů s Qalb × 103 < 10 nebo s Qalb × 103 > 10. 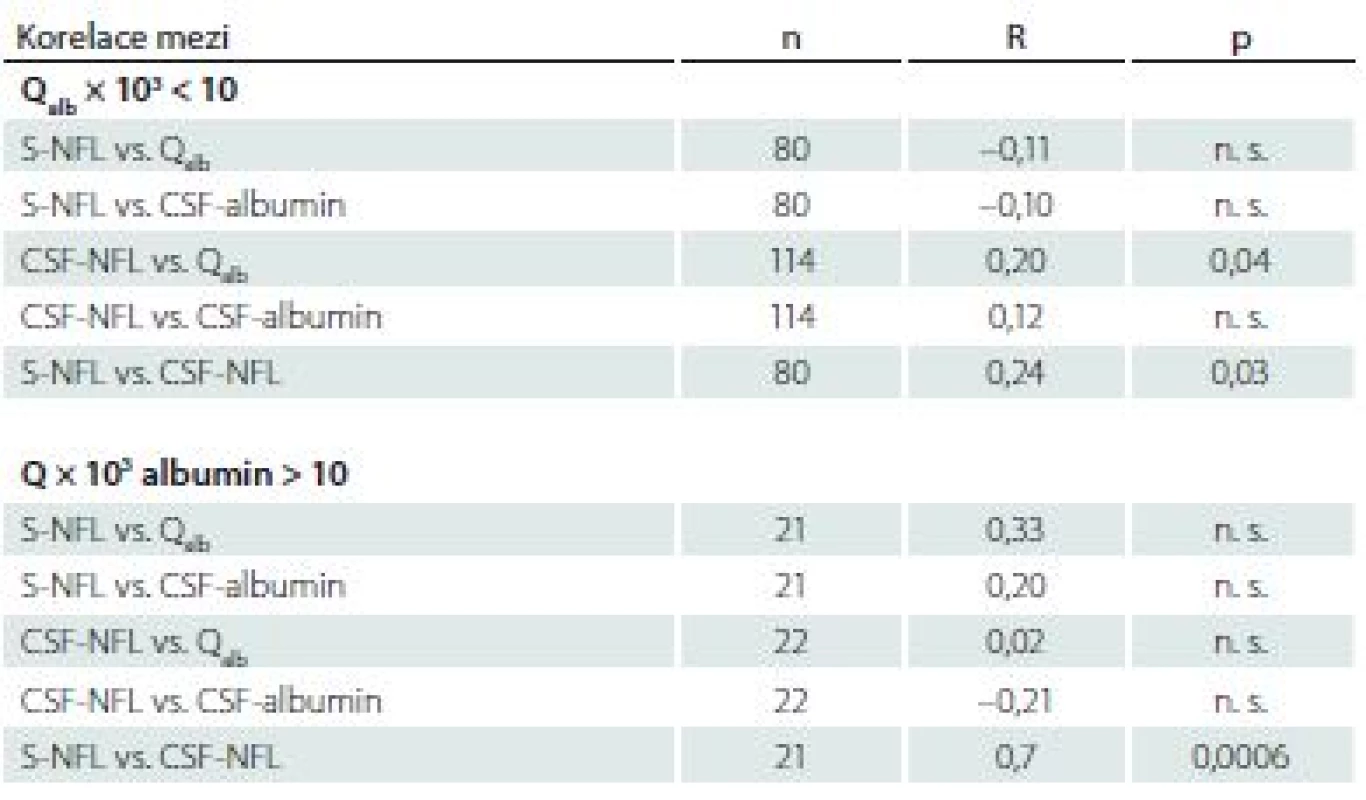
CSF-NFL – hladiny lehkých řetězců neurofilament v mozkomíšním moku; CSF-albumin – hladiny albuminu v mozkomíšním moku; n – počet pacientů; n. s. – není signifikantní; S-NFL – hladiny lehkých řetězců neurofilament v séru; Qalb – albuminový kvocient; p – hladina významnosti; R – Spearmanův korelační koeficient Soubor pacientů jako celek
Při hodnocení souboru pacientů jako celku byla potvrzena absence vztahu mezi sérovými hladinami NFL a Qalb, popř. hladinami albuminu v mozkomíšním moku, a naopak výrazně byl vyjádřen vztah mezi hladinami NFL v mozkomíšním moku a Qalb nebo albuminem v mozkomíšním moku. Při analýze celého souboru byla pozorována pozitivní korelace mezi hladinami NFL v séru a mozkomíšním moku (tab. 3).
Table 3. Korelace mezi hladinami lehkých řetězců neurofilament a albuminovým kvocientem v celém souboru pacientů. 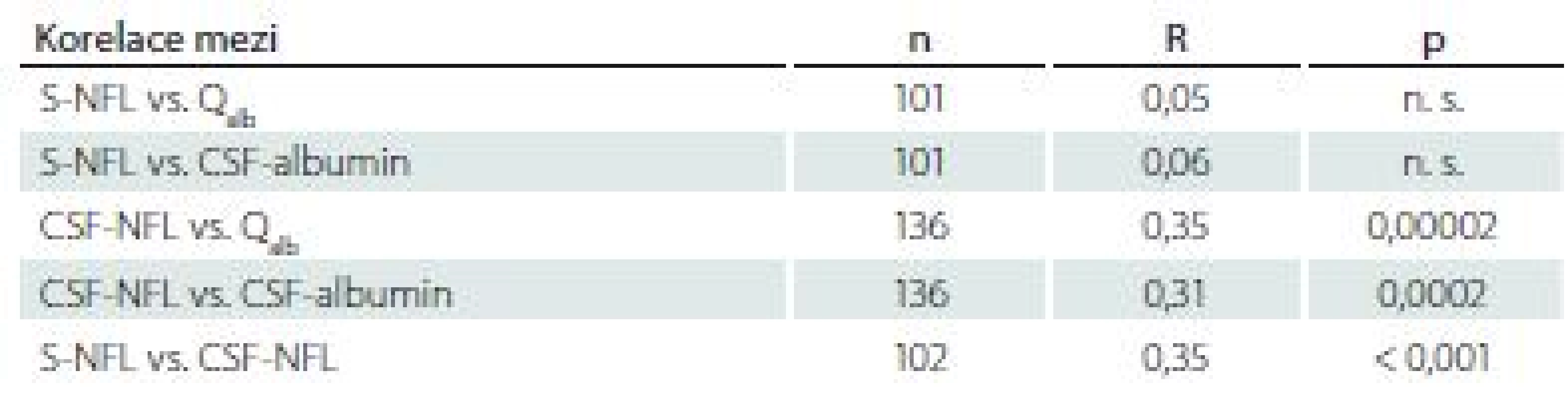
CSF-NFL – hladiny lehkých řetězců neurofilament v mozkomíšním moku; CSF-albumin – hladiny albuminu v mozkomíšním moku; n – počet pacientů; n. s. – není signifikantní; S-NFL – hladiny lehkých řetězců neurofilament v séru; Qalb – albuminový kvocient; p – hladina významnosti; R – Spearmanův korelační koeficient Hodnoty hladin NFL v séru a mozkomíšním moku jsou uvedeny v tab. 4. Analýza hladin NFL v séru a mozkomíšním moku u AN a časných stádií RS byla předmětem samostatných publikací [5,12].
Table 4. Hladiny lehkých řetězců neurofilament v mozkomíšním moku a v séru u jednotlivých skupin pacientů. 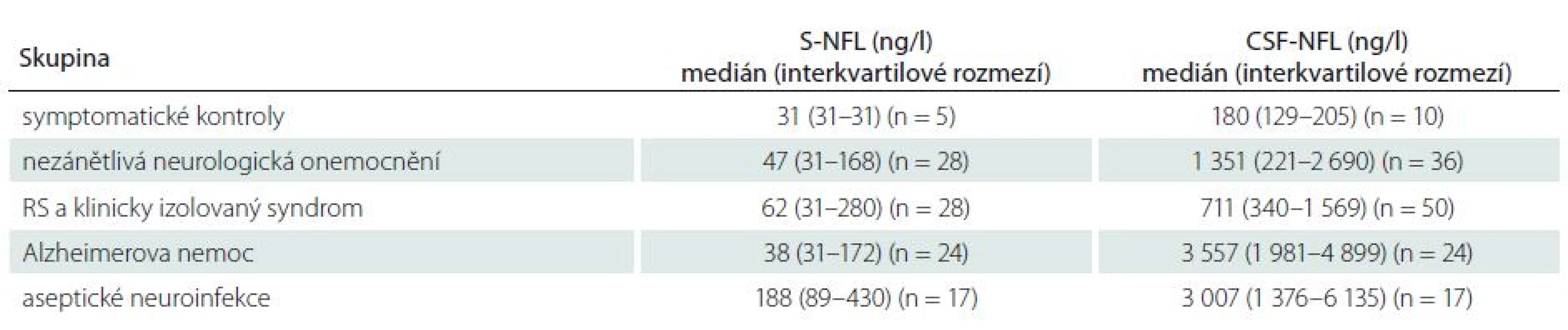
CSF-NFL – hladiny lehkých řetězců neurofilament v mozkomíšním moku; n – počet pacientů; S-NFL – hladiny lehkých řetězců neurofilament v séru Diskuze
Moderní způsob testování biomarkerů původem z mozkové tkáně směřuje k jejich vyšetřování v séru, které by nahradilo stanovení v mozkomíšním moku. Tento trend je pro neurologické pacienty přínosný, neboť se nemusí podrobovat invazivní lumbální punkci. Určitou nevýhodou může být, že hodnoty některých biomarkerů v séru mohou být ovlivňovány i stavem bariér v nervovém systému. Výsledky naší studie naznačují, že u vybraných neurologických onemocnění propustnost hematolikvorové bariéry nepředstavuje problém při vyšetření NFL v séru. Potvrdili jsme a doplnili tak výsledky Kalma et al [25], kteří ve své práci zkoumali vztah mezi hladinami NFL a hodnotou Qalb bez souvislosti s konkrétním neurologickým onemocněním.
V předkládané studii nebyla u vybraných neurologických onemocnění prokázána pozitivní korelace mezi sérovými hladinami NFL a Qalb jako ukazatelem stavu HLB, popř. izolovanými hodnotami albuminu v likvoru. U RS mohou být hladiny albuminu v mozkomíšním moku nebo Qalb zvýšeny u 12 – 23 % pacientů [37]. Předpokládá se, že poškození bariér nervového systému u RS je přechodného rázu, které se může opakovat ve stejných nebo odlišných oblastech CNS [38]. Byla popsána i souvislost mezi vyššími hladinami Qalb při nástupu onemocnění a atrofií mozku společně s vyšší mírou funkčního omezení [39]. Dalším sledovaným onemocněním, u něhož jsme nenalezli vztah mezi sérovými NFL a Qalb, byla AN. Změny v HLB nejsou typickým nálezem u AN a jsou popisovány pouze u některých pacientů. Metaanalýza 20 studií prokázala mírné statisticky významné zvýšení Qalb u AN ve srovnání s kontrolami [21]. Izolovaná porucha HLB je nespecifickým projevem demencí bez ohledu na jejich etiologii [24]. Na rozdíl od AN představují neuroinfekce skupinu onemocnění, u nichž porucha HLB je typický nález [40]. Signifikantní korelace s hladinami NFL v séru nebyla nalezena ani u této skupiny, v níž byl zastoupen největší počet zvýšených hodnot Qalb. Pozitivní korelace mezi sérovými NFL a Qalb chybí nejen u jednotlivých skupin pacientů podle diagnóz, ale ani při rozdělení pacientů podle závažnosti porušení HLB nebo při hodnocení souboru jako celku nebyla zjištěna souvislost mezi Qalb a NFL v séru.
Přítomnost NFL jako neuronálně specifického proteinu a jeho přestup do krve může být vysvětlován různými mechanizmy. Jednou z možností je transport proteinů mozkového původu z mozkomíšního moku jeho resorpcí do žilní krve a může se uplatňovat i glymfatický systém [41]. Ze studií Reibera et al [42,43] ale vyplývá, že změny koncentrace proteinů pocházejících z mozkové tkáně v krvi nelze vysvětlit změnami jejich koncentrací v mozkomíšním moku. Nabízí se i možnost přímého přestupu z mozku do krve přes HEB. V mozku jsou popisovány oblasti v tzv. cirkumventrikulárních orgánech, kde takový průnik je v omezeném množství možný, nebo v lokalitách, kde je porušena neurovaskulární jednotka [23,41,44]. Nelze vyloučit difuzi molekul dokonce i přes intaktní HEB v některých oblastech vyššího hematolikvorového gradientu. Přestup mozkových proteinů bezprostředně do krve bez účasti likvorového kompartmentu by mohl být jedním z vysvětlení chybějící korelace mezi sérovými hladinami NFL a Qalb.
Vztah mezi hladinami NFL v likvoru a Qalb nebyl u jednotlivých diagnostických skupin uniformní. Pozitivní korelace byla zřejmá ve skupině pacientů s nezánětlivými neurologickými onemocněními a dále, i když méně vyjádřena ve skupině pacientů s aseptickými neuroinfekcemi, kde převažovaly vyšší hodnoty Qalb. Podobný vztah byl nedávno prokázán i u HIV pozitivních pacientů jak neuroasymptomatických neléčených, tak neurosymptomatických léčených pacientů a stejně i u HIV negativních kontrol [45]. Na prokázané korelaci mezi hodnotami Qalb a koncentracemi NFL v mozkomíšním moku těchto pacientů se může podílet porucha HLB i současné poškození neuronů, aniž mezi oběma patologickými mechanizmy existuje přímá spojitost. Souvislost mezi hladinami NFL v likvoru a Qalb, popř. albuminem v likvoru nebyla prokázána u našich pacientů s onemocněními s projevy neurodegenerace, kde předpokládáme, že probíhají procesy směřující k narušení axonálních struktur. Naše výsledky naznačují, že vztah mezi likvorovými hladinami NFL a Qalb může být modifikován odlišností neuropatologických změn charakteristických pro jednotlivá neurologická onemocnění. Míra poškození HLB a axonů se u různých neurologických onemocnění vyvíjí v rozdílné intenzitě. Pozitivní korelace mezi likvorovými hladinami a Qalb je popisována u NFL i u některých dalších specifických mozkových proteinů a naopak se můžeme setkat i s absencí tohoto vztahu [46 – 48].
Vztah mezi hladinami NFL v séru a mozkomíšním moku je v literatuře popisován opakovaně. V dosud publikovaných studiích převažují nálezy pozitivní korelace hladin NFL mezi oběma biologickými tekutinami [16,22,49], ale objevují se i nálezy negativní, kde vztah není prokázán [49]. V souboru našich pacientů hodnoceném jako celek sérové i likvorové hladiny NFL spolu korelovaly. Rovněž při analýze, kde kritériem byla výše Qalb, byla asociace mezi likvorovými a sérovými hladinami NFL pozorována. Ve skupině s hodnotami Qalb × 103 > 10 i přes nižší počet pacientů vykazovala mnohem těsnější vztah ve srovnání se skupinou s hodnotami Qalb × 103 < 10. Při rozdělení pacientů podle diagnóz nebyl výsledek tak jednoznačný. Hodnocení vztahu mezi hladinami NFL v séru a likvoru u skupin pacientů s vybranými neurologickými onemocněními prokázalo signifikantní korelaci pouze ve skupině aseptických neuroinfekcí. Chybějící vztah mezi hladinami v séru a likvoru by mohl být vysvětlen i použitou metodikou. V této studii jsme hladiny NFL v mozkomíšním moku i v séru vyšetřovali stejnou komerčně dostupnou soupravou, která pro stanovení v séru má omezenou citlivost. V nejnovějších studiích používali autoři k analýze séra citlivějších metod na bázi Simoa (single-molecule array), pomocí nichž jsou zejména v oblasti nižších koncentrací NFL v séru získávány přesnější výsledky [9,11]. Uvedené metody u nás nejsou běžně dostupné a vzhledem k finanční náročnosti budou zatím těžko využitelné pro rutinní stanovení. Použitím citlivějších metod, jako je Simoa, popř. elektrochemiluminiscence, pro stanovení NFL je dosahováno vyšších hodnot korelačních koeficientů pro srovnání hladin NFL v séru a mozkomíšním moku [11].
Závěr
Naše studie naznačuje, že sérové hladiny NFL nejsou přímo ovlivněny permeabilitou HLB posuzované Qalb u neurodegenerativních onemocnění a neuroinfekcí. Naopak na vztah mezi likvorovými hladinami NFL a hodnotou Qalb nebo sérovými hladinami NFL může mít vliv charakter neuropatologických změn u jednotlivých neurologických onemocnění. U onemocnění s účastí neurodegenerace nebyl pozorován vztah mezi hladinami CSF NFL a Qalb, zatímco u heterogenní skupiny pacientů se zánětlivými nebo nezánětlivými neurologickými onemocněními oba parametry pozitivně korelovaly.
Práce byla podpořena projekty: PROGRES Q25 a Q35; „Udržitelnost pro Národní ústav duševního zdraví“, č. LO1611; MŠMT v rámci Národního programu udržitelnosti I (NPU I); MZ ČR – RVO VFN 64165, VFN v Praze a MZ ČR – RVO „Národní ústav duševního zdraví – NUDZ, IČ: 00023752“.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Přijato k recenzi: 12. 9. 2017
Přijato do tisku: 10. 1. 2018
MUDr. Lenka Fialová, CSc.
Ústav lékařské biochemie a laboratorní diagnostiky 1. LF UK a VFN
Kateřinská 32
121 08 Praha 2
e-mail: lfial@lf1.cuni.cz
Sources
1. Gotow T. Neurofilaments in health and disease. Med Electron Microsc 2000; 33(4): 173 – 199.
2. Hjalmarsson C, Bjerke M, Andersson B et al. Neuronal and glia-related biomarkers in cerebrospinal fluid of patients with acute ischemic stroke. J Cent Nerv Syst Dis 2014; 6 : 51 – 58. doi: 10.4137/ JCNSD.S13821.
3. Fialova L, Malbohan I. Neuronal cytoskeleton components in cerebrospinal fluid in selected neurological diseases. In Slavik V, Dolezal T (eds). Cerebrospinal fluid: functions, composition and disorders. New York: Nova Science Publishers 2012; 65 – 86.
4. Piťha J. Biomarkery roztroušené sklerózy – současné možnosti a perspektivy. Cesk Slov Neurol N 2015; 78/ 111(3): 269 – 273.
5. Fialova L, Bartos A, Svarcova J et al. Serum and cerebrospinal fluid light neurofilaments and antibodies against them in clinically isolated syndrome and multiple sclerosis. J Neuroimmunol 2013; 262(1 – 2): 113 – 120. doi: 10.1016/ j.jneuroim.2013.06.010.
6. Teunissen CE, Iacobaeus E, Khademi M et al. Combination of CSF N-acetylaspartate and neurofilaments in multiple sclerosis. Neurology 2009; 72(15): 1322 – 1329. doi: 10.1212/ WNL.0b013e3181a0fe3f.
7. Norgren N, Rosengren L, Stigbrand T. Elevated neurofilament levels in neurological diseases. Brain Res 2003; 987(1): 25 – 31.
8. Disanto G, Adiutori R, Dobson R et al. Serum neurofilament light chain levels are increased in patients with a clinically isolated syndrome. J Neurol Neurosurg Psychiatry 2016; 87(2): 126 – 129. doi: 10.1136/ jnnp-2014-309690.
9. Mattsson N, Andreasson U, Zetterberg H et al. Association of plasma neurofilament light with neurodegeneration in patients with Alzheimer disease. JAMA Neurol 2017; 74(5): 557 – 566. doi: 10.1001/ jamaneurol.2016.6117.
10. Kuhle J, Barro C, Disanto G et al. Serum neurofilament light chain in early relapsing remitting MS is increased and correlates with CSF levels and with MRI measures of disease severity. Mult Scler 2016; 22(12): 1550 – 1559.
11. Kuhle J, Barro C, Andreasson U et al. Comparison of three analytical platforms for quantification of the neurofilament light chain in blood samples: ELISA, electrochemiluminescence immunoassay and Simoa. Clin Chem Lab Med 2016; 54(10): 1655 – 1661. doi: 10.1515/ cclm-2015-1195.
12. Fialova L, Bartos A, Svarcova J. Neurofilaments and tau proteins in cerebrospinal fluid and serum in dementias and neuroinflammation. Biomed Pap MedFac Univ Palacky Olomouc Czech Repub 2017; 161(3): 286 – 295. doi: 10.5507/ bp.2017.038.
13. Havrdová E. Roztroušená skleróza. Cesk Slov Neurol N 2008; 71/ 104(2): 121 – 132.
14. Friese MA, Schattling B, Fugger L. Mechanisms of neurodegeneration and axonal dysfunction in multiple sclerosis. Nat Rev Neurol 2014; 10(4): 225 – 238. doi: 10.1038/ nrneurol.2014.37.
15. Mareš J. Význam časné diagnostiky a terapie v životní perspektivě pacientů s roztroušenou sklerózou. Med praxi 2013; 10(4): 149 – 153.
16. Disanto G, Barro C, Benkert P et al. Serum Neurofilament light: a biomarker of neuronal damage in multiple sclerosis. Ann Neurol 2017; 81(6): 857 – 870. doi: 10.1002/ ana.24954.
17. Khalil M, Enzinger C, Langkammer C et al. CSF neurofilament and N-acetylaspartate related brain changes in clinically isolated syndrome. Mult Scler 2013; 19(4): 436 – 442. doi: 10.1177/ 1352458512458010.
18. Rektorová I. Neurodegenerativní demence. Cesk Slov Neurol N 2009; 72/ 105(2): 97 – 109.
19. Yuan A, Nixon RA. Specialized roles of neurofilament proteins in synapses: Relevance to neuropsychiatric disorders. Brain Res Bull 2016; 126(Pt 3): 334 – 346. doi: 10.1016/ j.brainresbull.2016.09.002.
20. Bartoš A, Čechová L, Švarcová J et al. Likvorový triplet (tau proteiny a beta-amyloid) v diagnostice Alzheimerovy-Fischerovy nemoci. Cesk Slov Neurol N 2012; 75/ 108(5): 587 – 594.
21. Olsson B, Lautner R, Andreasson U et al. CSF and blood biomarkers for the diagnosis of Alzheimer‘s disease: a systematic review and meta-analysis. Lancet Neurol 2016; 15(7): 673 – 684. doi: 10.1016/ S1474-4422(16)00070-3.
22. Bacioglu M, Maia LF, Preische O et al. Neurofilament light chain in blood and CSF as marker of disease progression in mouse models and in neurodegenerative diseases. Neuron 2016; 91(2): 494 – 496. doi: 10.1016/ j.neuron.2016.07.007.
23. Piťha J. Bariéry nervového systému za fyziologických a patologických stavů. Cesk Slov Neurol N 2014; 77/ 110(5): 553 – 559.
24. Brettschneider J, Claus A, Kassubek J et al. Isolated blood-cerebrospinal fluid barrier dysfunction: prevalence and associated diseases. J Neurol 2005; 252(9): 1067 – 1073.
25. Kalm M, Boström M, Sandelius A et al. Serum concentrations of the axonal injury marker neurofilament light protein are not influenced by blood-brain barrier permeability. Brain Res 2017; 1668 : 12 – 19. doi: 10.1016/ j.brainres.2017.05.011.
26. Polman CH, Reingold SC, Edan G et al. Diagnostic criteria for multiple sclerosis: 2005 revisions to the „McDonald Criteria“. Ann Neurol 2005; 58(6): 840 – 846.
27. McKhann GM, Knopman DS, Chertkow H et al. The diagnosis of dementia due to Alzheimer‘s disease: recommendations from the National Institute on Aging-Alzheimer‘s Association workgroups on diagnostic guidelines for Alzheimer‘s disease. Alzheimers Dement 2011; 7(3): 263 – 269. doi: 10.1016/ j.jalz.2011.03.005.
28. Mioshi E, Dawson K, Mitchell J et al. The Addenbrooke‘s Cognitive Examination Revised (ACE-R): a brief cognitive test battery for dementia screening. Int J Geriatr Psychiatry 2006; 21(11): 1078 – 1085.
29. Bartoš A, Raisová M and Kopeček M. Amendment of the Czech Addenbrooke’s cognitive examination (ACE-CZ). Cesk Slov Neurol N 2011; 74/ 107(6): 681 – 684.
30. Bartoš A, Raisová M and Kopeček M. Důvody a průběh novelizace české verze Addenbrookského kognitivního testu (ACE-CZ). Cesk Slov Neurol N 2011; 74/ 107(6): e1 – e5.
31. Scheltens P, Leys D, Barkhof F et al. Atrophy of medial temporal lobes on MRI in „probable“ Alzheimer‘s disease and normal ageing: diagnostic value and neuropsychological correlates. J Neurol Neurosurg Psychiatry 1992; 55(10): 967 – 972.
32. Bartoš A, Zach P, Diblíková F et al. Visual rating of medial temporal lobe atrophy on magnetic resonance imaging in Alzheimer’s disease. Psychiatrie 2007; 11 (Suppl 3): 49 – 52.
33. Teunissen C, Menge T, Altintas A et al. Consensus definitions and application guidelines for control groups in cerebrospinal fluid biomarker studies in multiple sclerosis. Mult Scler 2013; 19(13): 1802–1809. doi: 10.1177/ 1352458513488232.
34. Zima T. Laboratorní diagnostika. 3. doplněné a přepracované vydání. Praha: Galén 2013.
35. Deisenhammer F, Bartos A, Egg R et al. Guidelines on routine cerebrospinal fluid analysis. Report from an EFNS task force. Eur J Neurol 2006; 13(9): 913 – 922.
36. Teunissen CE, Petzold A, Bennett JL et al. A consensus protocol for the standardization of cerebrospinal fluid collection and biobanking. Neurology 2009; 73(22): 1914 – 1922. doi: 10.1212/ WNL.0b013e3181c47cc2.
37. LeVine SM. Albumin and multiple sclerosis. BMC Neurol 2016; 16 : 47. doi: 10.1186/ s12883-016-0564-9.
38. Schenk GJ, de Vries HE. Altered blood-brain barrier transport in neuro-inflammatory disorders. Drug Discov Today Technol 2016; 20 : 5 – 11. doi: 10.1016/ j.ddtec.2016.07.002.
39. Uher T, Horakova D, Tyblova M et al. Increased albumin quotient (QAlb) in patients after first clinical event suggestive of multiple sclerosis is associated with development of brain atrophy and greater disability 48 months later. Mult Scler 2016; 22(6): 770 – 781. doi: 10.1177/ 1352458515601903.
40. Bednarova J. Cerebrospinal-fluid profile in neuroborreliosis and its diagnostic significance. Folia Microbiol (Praha) 2006; 51(6): 599 – 603.
41. Kawata K, Liu CY, Merkel SF et al. Blood biomarkers for brain injury: What are we measuring? Neurosci Biobehav Rev 2016; 68 : 460 – 473. doi: 10.1016/ j.neubiorev.2016.05.009.
42. Reiber H. Dynamics of brain-derived proteins in cerebrospinal fluid. Clin Chim Acta 2001; 310(2): 173 – 186.
43. Reiber H. Proteins in cerebrospinal fluid and blood: barriers, CSF flow rate and source-related dynamics. Restor Neurol Neurosci 2003; 21(3 – 4): 79 – 96.
44. Shaw G. The use and potential of pNF-H as a general blood biomarker of axonal loss: an immediate application for CNS injury. In: Kobeissy FH. Brain neurotrauma: molecular, neuropsychological, and rehabilitation aspects. Boca Raton (FL): CRC Press/ Taylor & Francis, 2015.
45. Anesten B, Yilmaz A, Hagberg L et al. Blood-brain barrier integrity, intrathecal immunoactivation, and neuronal injury in HIV. Neurol Neuroimmunol Neuroinflamm 2016; 3(6): e300.
46. Sussmuth SD, Reiber H, Tumani H. Tau protein in cerebrospinal fluid (CSF): a blood-CSF barrier related evaluation in patients with various neurological diseases. Neurosci Lett 2001; 300(2): 95 – 98.
47. Liguori C, Olivola E, Pierantozzi M et al. Cerebrospinal-fluid Alzheimer‘s disease biomarkers and blood-brain barrier integrity in a natural population of cognitive intact Parkinson‘s disease patients. CNS Neurol Disord Drug Targets 2017; 16(3): 339 – 345. doi: 10.2174/ 1871527316666161205123123.
48. Kuhle J, Leppert D, Petzold A et al. Neurofilament heavy chain in CSF correlates with relapses and disability in multiple sclerosis. Neurology 2011; 76(14): 1206 – 1213. doi: 10.1212/ WNL.0b013e31821432ff.
49. Gaiottino J, Norgren N, Dobson R et al. Increased neurofilament light chain blood levels in neurodegenerative neurological diseases. PLoS One 2013; 8(9): e75091. doi: 10.1371/ journal.pone.0075091.
Labels
Paediatric neurology Neurosurgery Neurology
Article was published inCzech and Slovak Neurology and Neurosurgery

2018 Issue 2-
All articles in this issue
- Syndrom GLUT-1 deficience – expandující klinické spektrum léčitelného onemocnění
- Syndrom karpálního tunelu v kontextu funkčních poruch pohybového systému
- Identifikace dětských pacientů s farmakorezistentní epilepsií a výběr kandidátů nefarmakologické terapie
- Lehké řetězce neurofilament v séru a mozkomíšním moku a stav hematolikvorové bariéry u vybraných neurologických onemocnění
- Fyzioterapie u Parkinsonovy nemoci v České republice – demografická studie
- Follow-up pacientů s idiopatickou poruchou chování v REM spánku – fenokonverze do parkinsonského syndromu a demence
- Pilotní studie Edinburské kognitivně-behaviorální zkoušky pro amyotrofickou laterální sklerózu na české populaci
- Akutní myelitida u dětí – soubor 20 pacientů
- Nádor z granulárních buněk stopky hypofýzy
- Biopsie mozku v deseti bodech – co může neurolog očekávat od neurochirurga a neuropatologa?
- Ataxie
- Antikoagulačná liečba u pacientov s fibriláciou predsiení a cerebrálnou amyloidovou angiopatiou
- Antikoagulační léčba u pacientů s fibrilací síní a cerebrální amyloidovou angiopatií
- Antikoagulačná liečba u pacientov s fibriláciou predsiení a cerebrálnou amyloidovou angiopatiou
- Fabryho choroba, přehled problematiky a nejčastější neurologické projevy
- Je amyloid podstatný pro senilní demenci?
- Hladiny anti-Mülleriánského hormonu v séru při roztroušené skleróze – multicentrická případová kontrolní studie
- Invazivní primarně intracerebrální infekce u žen způsobené Streptococcus intermedius a manifestující se jako purulentní meningitida a intracerebrální absces
- Maligní melanotický schwannom obratlového těla u pacienta s Carneyho komplexem
- Czech and Slovak Neurology and Neurosurgery
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Ataxie
- Biopsie mozku v deseti bodech – co může neurolog očekávat od neurochirurga a neuropatologa?
- Fabryho choroba, přehled problematiky a nejčastější neurologické projevy
- Syndrom GLUT-1 deficience – expandující klinické spektrum léčitelného onemocnění
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

