-
Medical journals
- Career
Identifikace dětských pacientů s farmakorezistentní epilepsií a výběr kandidátů nefarmakologické terapie
Authors: P. Hanáková; O. Horák; M. Ryzí; H. Ošlejšková
Authors‘ workplace: Klinika dětské neurologie LF MU a FN Brno, Centrum pro epileptologii a epileptochirurgii LF MU, Brno
Published in: Cesk Slov Neurol N 2018; 81(2): 180-184
Category: Original Paper
doi: https://doi.org/10.14735/amcsnn2018180Overview
Cíl:
Cílem studie bylo provést audit dětských pacientů s farmakorezistentní epilepsií sledovaných dlouhodobě na našem pracovišti a z nich vybrat kandidáty potenciálně vhodné k nefarmakologické léčbě (k epileptochirurgii, ketogenní dietě či její modifikaci).Metodika:
Jedná se o retrospektivní studii, v níž jsme zhodnotili dokumentaci 129 pacientů (0 – 19 let) s refrakterní epilepsií vyšetřených na Klinice dětské neurologie v období od ledna 2014 do ledna 2015. Dle typu záchvatů, epilepsie, etiologie, nálezu na MR a PET mozku lékaři doporučili edukační pohovor týkající se nemedikamentózní terapie nebo indikovali setrvání při užívání antiepileptik. U druhé skupiny pacientů byl zároveň uveden důvod, proč je nefarmakologická léčba nevhodná. Provedli jsme matematické hodnocení dat.Výsledky:
Ze 129 refrakterních pacientů jich bylo k edukačnímu pohovoru indikováno 47 (36,4 %) alespoň jedním a 39 (30,2 %) dvěma lékaři. Z 39 dětí byl shodně zvažován resekční výkon u 15 pacientů, diskonekční u jednoho, implantace vagového stimulátoru u 31 a ketogenní dieta u 26 pacientů. U 82 dětí (63,6 %) nebyl pohovor indikován.Závěr:
Identifikovali jsme nekompenzované pacienty s farmakorezistentní epilepsií na naší klinice a vhodné kandidáty nasměrovali k edukačnímu pohovoru o nefarmakologické terapii. Na studii navážeme prospektivní částí, ve které bude realizován konkrétní léčebný postup.Klíčová slova:
farmakorezistentní epilepsie – refrakterní epilepsie – epileptochirurgie – ketogenní dieta – stimulace nervus vagusÚvod
Definice refrakterní epilepsie je splněna při selhání účinku dvou tolerovaných a správně zvolených antiepileptik (antiepilectic drugs; AED) užívaných samostatně či v kombinaci. U dětí vychází dle Mezinárodní ligy proti epilepsii (International League Against Epilepsy; ILAE) mimo jiné z výsledků prospektivní studie publikované v roce 2004. V ní méně než 5 % dětí z těch, které užívaly dvě a více AED, dosáhlo remise na déle než 12 měsíců [1 – 2]. Vždy se snažíme o včasné efektivní řešení, jež je důležité nejen u epileptických encefalopatií. Farmakorezistence může výrazně ovlivnit vyvíjející se a dozrávající mozkové struktury, dráhy a funkce. Příliš dlouhé vyčkávání s razantní terapií vede v některých případech k nevratnému poškození určitých oblastí a vzniku sekundárních epileptických ložisek [3]. Proces progresivní (sekundární) epileptogeneze byl prozatím prokázán na animálních modelech [4]. U pacientů s nekompenzovanou epilepsií dále dochází ke zvýšení frekvence a intenzity záchvatů [5] s následnou deteriorací nejen psychomotorického vývoje, ale také kognitivních funkcí [6].
Obecně u epilepsií platí, že procento bezzáchvatovosti se po užití prvního AED pohybuje mezi 45 a 55 % a s použitím druhého léku šance na bezzáchvatovost strmě klesá k 10 – 15 %. Třetí AED snižuje úspěšnost k 5 – 1 % a klesající tendence dále pokračuje [2,7 – 9].
V projektu se zaměřujeme na nefarmakologickou léčbu a poukazujeme na prokazatelně vyšší procento respondérů ve srovnání s pokračující konzervativní léčbou.
Recentně publikované práce mapující změny a trendy v dětské epileptochirurgii v posledních třech dekádách shodně poukazují na přesun epileptochirurgických výkonů do mladších věkových kategorií, proporcionální pokles temporálních resekcí a nárůst výkonů u pacientů s epilepsií na podkladě fokální kortikální dysplazie II. typu. K zmíněnému trendu přispívá lepší terapeutický management febrilních křečí, minimalizace rizikových faktorů vzniku meziotemporální sklerózy, současně kvalitnější zobrazovací vyšetření, extenze stereoelektroencefalografie [10 – 13] a v neposlední řadě také odvážnější strategie epileptologických center.
Z chirurgických resekčních zákroků dosahují nejlepších výsledků operace temporálního laloku. Dosažení bezzáchvatovosti je udáváno u 70 – 80 % nemocných [14 – 15]. U zákroků extratemporálních se úspěšnost pohybuje mezi 30 – 70 % [16 – 19]. Významným prediktivním faktorem pooperační úspěšnosti u extratemporálních zákroků je radiologický či histologický průkaz epileptogenní léze [16,20].
K příkladům efektivní paliativní léčby patří implantace stimulátoru nervus vagus (VNS) a ketogenní dieta (KD). Tři měsíce po zavedení VNS je procento respondérů (redukce záchvatů nad 50 %) 39 – 59 % [21 – 22], 12 měsíců po výkonu 37 – 68 % [23 – 25]. Současná literatura uvádí srovnatelnou účinnost u dospělých a dětí pod 12 let. Nebyl prokázán rozdílný výsledek s ohledem na jednotlivé typy epileptických záchvatů či syndromů, mírně vyšší benefit vykazují pacienti s četnějšími záchvaty a unifokální epilepsií [26]. Metaanalýza 11 klinických studií autorů Lefevra a Aronsona (2000) poukazuje na signifikantní redukci frekvence záchvatů po zavedení KD. Stoprocentní bezzáchvatovosti dosáhlo 16 % pacientů a u 32 % pacientů byla zaznamenána redukce větší než 90 %. U 56 % sledovaných bylo dokumentováno snížení počtu záchvatů minimálně na polovinu [27].
Náš projekt se zaměřuje na brzkou identifikaci farmakorezistentních dětských pacientů, kteří nejsou dosud z různých důvodů zařazeni do epileptochirurgického programu.
Metodika
Z nemocničního informačního systému Kliniky dětské neurologie jsme získali data 1 032 pacientů ve věku 1,5 měsíce až 19 let diagnostikovaných dle Mezinárodní klasifikace nemocí (MKN 10) jako G40.0 – 40.9 (epilepsie) a G41.1 – 41.2, G41.8 – 41.9 (status epilepticus). Všichni podstoupili minimálně jedno vyšetření v období od ledna 2014 do ledna 2015. Vyloučili jsme pacienty s benigním a věkově vázaným epileptickým syndromem (s výjimkou nekompenzovaných dětských a juvenilních absencí – CAE a JAE, epilepsie s kontinuálními hroty a vlnami v pomalém spánku CSWS) – a farmakorezistentní, kteří jsou více než 6 měsíců od poslední kontroly bez záchvatů nebo jsou již předáni do péče dospělého neurologa. Extrahovali jsme data 141 pacientů, kteří užívají/ užívali minimálně dvě antiepileptika (samostatně či v kombinaci v maximálně tolerovaných dávkách) a v posledních 6 měsících prodělali alespoň jeden záchvat. V následujícím kroku jsme vyřadili 12 pacientů, kteří mají méně než jeden parciální záchvat za měsíc či jeden generalizovaný za 3 měsíce. Dokumentace vybraných 129 pacientů byla analyzována separátně dvěma neurology. Každý lékař rozhodoval, zda je daný pacient indikován či neindikován k edukačnímu pohovoru o nemedikamentózní terapii, a to na základě typu záchvatů, epilepsie, etiologie, nálezu na MR a event. PET mozku. Lékař specifikoval, jaké terapeutické modality lze dle jeho názoru zvažovat, přičemž mohl uvést jednu, dvě i více možností (resekční výkon, diskonekční výkon - resp. kalosotomie/ hemisferotomie, implantace VNS, KD). Důraz byl kladen na kurativní terapii, paliativní postupy byly uvedeny jako alternativa. U neindikovaných pacientů určil hodnotící lékař důvod, proč nedoporučuje nefarmakologickou léčbu. Přehled metodického postupu popisuje obr. 1.
Image 1. Přehled metodického postupu. Uveden počet pacientů (procenta). Fig. 1. The overview of the methodological process. Displayed in number of patients (percentages). 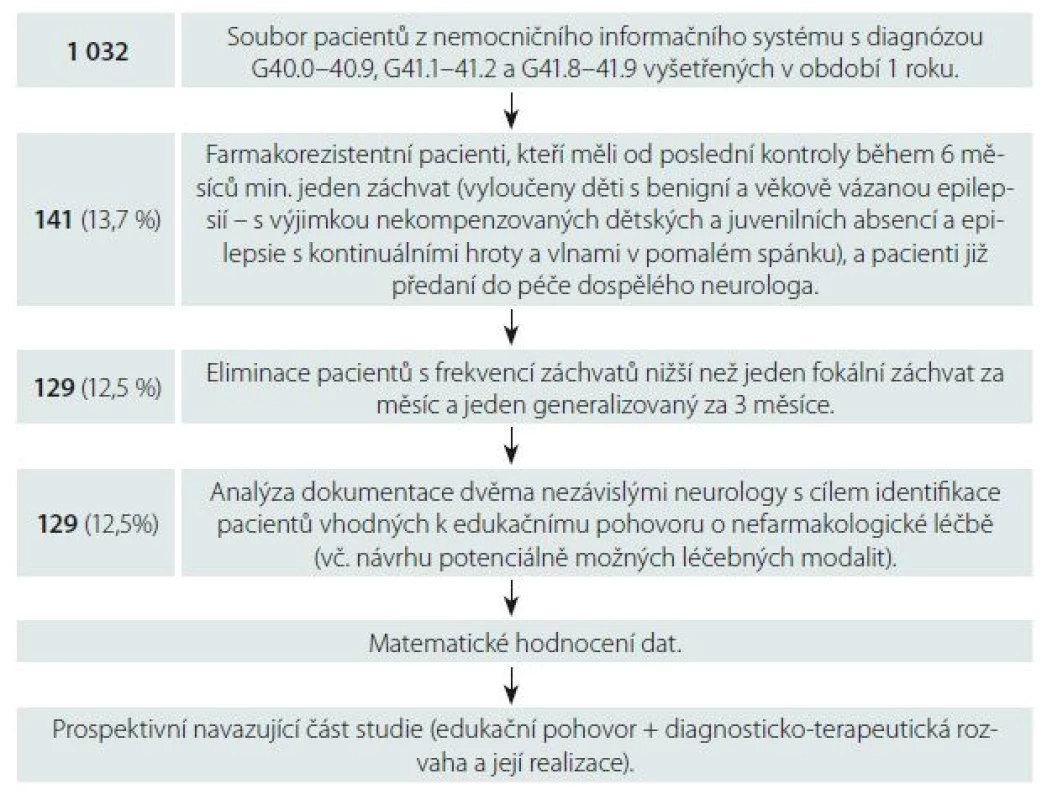
Posoudili jsme počet shod/ neshod lékařů a data matematicky zhodnotili pomocí jednoduché deskriptivní statistiky.
Výsledky
Analyzovali jsme dokumentaci 129 pacientů (66 chlapců, 63 dívek; věkový průměr 8,05 ± 4,92 let) kteří užívali 2 – 12 antiepileptik. Přehled sledovaných charakteristik souboru je souhrnně uveden v grafech 1 – 3. Ve skupině pacientů se strukturální epilepsií převažovaly vrozené vývojové vady mozku a vaskulární léze (graf 2).
Graph 1. Klasifikace epilepsie dle etiologie sledovaného souboru 129 pacientů (počet pacientů; procenta). Etiologie strukturální (= MR-pozitivní), genetická, infekční (etiologické agens cytomegalovirus a Toxoplasma gondii) a nejasná; imunitní a metabolická definitivně neprokázána prozatím u žádného pacienta. Graph 1. The etiological classification of epilepsy in the observed group of 129 patients (displayed in number of patients; percentages). Structural etiology (= MRI-positive), genetic, infectious (etiological agents Cytomegalovirus and Toxoplasma gondii) and unknown etiology; immune and metabolic etiology has not been definitely proven in any patient. 
Graph 2. Etiologické spektrum MR-pozitivních pacientů (n = 72). Nálezy jsou rozděleny do šesti skupin a zobrazeny v počtech pacientů. Mezi léze nejasného původu byly zařazeny cysty, pseudocysty a atrofie nejasné etiologie. FCD – fokální kortikální dysplazie; DNET – dysembryoplastický neuroepiteliální tumor (jeden pacient již po resekci, jeden zařazen v epichirurgickém programu); PVL – periventrikulární leukomalacie. Graph 2. Etiological spectrum of MRI-positive patients (n = 72). Findings are divided into six groups and displayed in number of patients. The group of the lesions of unknown origin includes cysts, pseudocysts and atrophy of unknown etiology. FCD – focal cortical dysplasia; DNET – dysembryoplastic neuroepithelial tumor (one patients after resective epilepsy surgery; one included in the epilepsy surgery program me); PVL – periventricular leukomalacia. 
Graph 3. Rozdělení 129 pacientů s farmakorezistentní epilepsií dle zóny počátku záchvatu (počet pacientů; procenta). Graph 3. Distribution of 129 patients with pharmacoresistant epilepsy according to localization of the seizure onset zone (displayed in number of patients; percentages). 
Celkem 39 pacientů (30,2 %) bylo oběma lékaři jednoznačně indikováno k edukačnímu pohovoru. Alespoň jedním lékařem bylo doporučeno 47 pacientů (36,4 %). Dvacet (51,3 %) z nich již v minulosti konzultaci podstoupilo a rodiče nefarmakologickou léčbu prozatím odmítli. Soustředili jsme se na určení dalšího léčebného postupu. Shodně jsme zvažovali resekci jako jednu z možností u 15 z 39 pacientů (38,5 %), diskonekční výkon u 1 z 39 pacientů (2,6 %). Implantace VNS byla vybrána jako jedna z možností léčby v 31 (79,5 %) a KD ve 26 případech (66,7 %). Výsledky shrnuje tab. 1.
Table 1. Terapeutické modality ve skupině pacientů indikovaných k edukačnímu pohovoru oběma hodnotícími lékaři (n = 39). 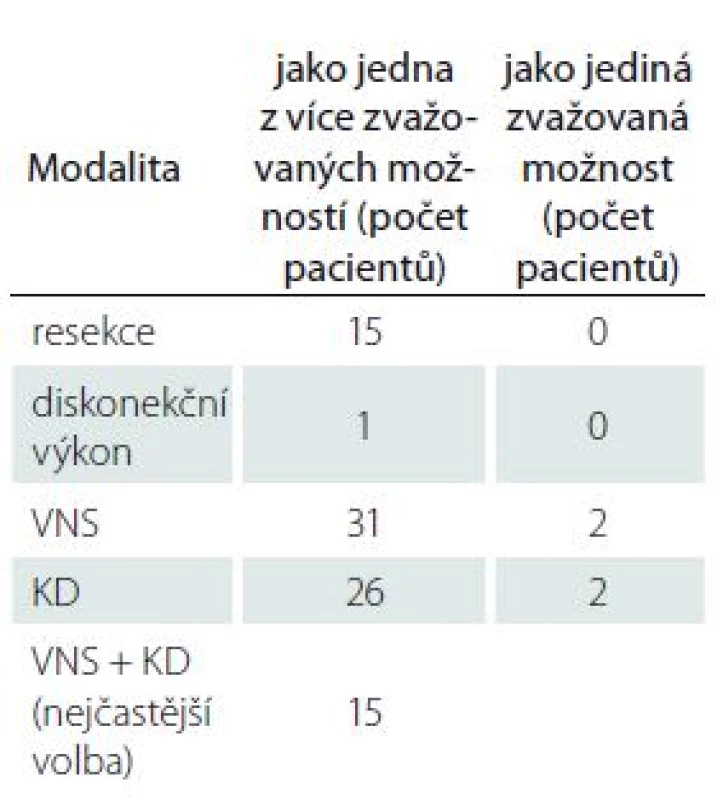
KD – ketogenní dieta; n – počet pacientů; VNS – stimulace nervus vagus Neshodli jsme se v případě možnosti resekce u dvou pacientů, u VNS i KD u třech pacientů. Z počtu 82 dětí (63,6 %) neindikovaných k edukačnímu pohovoru je již 10 (12,2 %) směrováno k epileptochirurgii či KD a další edukační pohovor tak není nutný. Ostatním pacientům z této skupiny byla doporučena i nadále pouze farmakologická léčba. Plná kompenzace či velmi nízká frekvence záchvatů byla (méně než jeden záchvat fokální za měsíc a generalizovaný za 3 měsíce) během finálního hodnocení určena u 51 dětí (62,2 %) a nevhodnost nemedikamentózní terapie z důvodu přidružených onemocnění u 14 pacientů (17,1 %) – jmenovitě (samostatně či v kombinaci) těžká mentální retardace, těžká kvadruspasticita, malnutrice, hydrocefalus s implantovaným ventrikulo-peritoneálním shuntem a maligní onkologické onemocnění s komplikacemi. Jiné důvody byly shledány u 7 z nich (8,5 %) – 5 pacientů bylo vyřazeno pro změnu dispenzárního pracoviště, 1 pro exitus letalis a 1 kojenec zůstal dispenzarizován pro dosud blíže neobjasněnou metabolickou vadu s možným progresivním průběhem.
Diskuze
Projekt umožnil zmapovat situaci týkající se refrakterní epilepsie na naší klinice.
Z 1 032 pacientů sledovaných pro epileptické záchvaty jich bylo do studie dle kritérií z metodiky zařazeno 12,5 %. Jsme si vědomi, že celkový počet farmakorezistentních pacientů dispenzarizovaných na našem pracovišti je vyšší a odpovídá literárním údajům [28 – 29]. K účelu projektu bylo nutné vybrat pacienty s refrakterní epilepsií, kteří v daném okamžiku nejsou vhodnými kandidáty nefarmakologické terapie (aktuálně velmi nízká frekvence záchvatů, plná kompenzace, benigní typ epilepsie, pravidelná observace v jiném epileptologickém centru a jiné – viz Metodika).
Ukazuje se, že více než 30 % sledovaných pacientů by mělo podstoupit (poprvé či opětovně) komplexní edukační pohovor o benefitech i úskalích chirurgické léčby a KD. Při pozitivní motivaci pacienta (resp. zákonného zástupce) by mělo následovat zařazení do epileptochirurgického programu s cílem indikace konkrétní léčebné modality a její brzké realizace. Počet doporučených dětí se zdá relativně vysoký. Klademe si otázku, zda bychom měli k dalšímu kroku přistoupit dříve. Celosvětově se doba od počátku epilepsie do přijetí pacienta k operačnímu výkonu pohybuje okolo 20 let a bohužel se tento dlouhý interval zatím výrazně nemění [13,30]. U 51 % indikovaných dětí v našem souboru již v minulosti rozhovor proběhl, ale vzhledem k negativnímu postoji rodičů zůstalo dítě nadále v dispenzární péči bez dalšího extenzivního došetření. Zde spatřujeme také důležitou oblast našeho působení. Je zřejmé, že zařazení do programu by bylo pro řadu pacientů s benefitem. Berg et al (2012) ve studii poukazují na nutnost agresivní brzké léčby a časné dosažení bezzáchvatovosti zejména u kojenců a malých dětí [31]. Ve studii Hoei-Hansena et al (2017) popisují pouze 13 dětí s významným zlepšením bez operačního výkonu ze 173 pacientů již zařazených do epileptochirurgického programu. Bezzáchvatovost přetrvávala po dobu dalších 3 let u 6 z nich [32]. Vyšší procento dosažení bezzáchvatovosti bez operace referují Bien et al (2006). V jejich studii bylo shledáno ve skupině označených jako nevhodní kandidáti chirurgické terapie 24 % pacientů bez záchvatu [33]. V našem souboru jsme při finální evaluaci potvrdili 39,5 % pacientů, kteří v mezidobí dosáhli úplné kompenzace či významné redukce počtu záchvatů při medikamentózních změnách. Výsledky nejsou s výše uvedenými studiemi srovnatelné vzhledem k rozdílné metodice (limitací je především příliš krátký hodnotící interval a zahrnutí ne plně kompenzovaných pacientů). Prokázalo se, že přes statisticky významnou efektivnost nefarmakologické terapie je stále mnoho pacientů s refrakterní epilepsií léčeno v ambulantní péči bez zařazení do epileptochirurgického programu, nebo jinou léčbu podstoupí až v pokročilé fázi nemoci. Nedostatečně využité možnosti chirurgické léčby (poddimenzování) potvrzují i jiné současné vědecké práce [34 – 35]. Jedním z důvodů se zdá být snaha vyzkoušet všechny dostupné léky (i přes známý klesající účinek každého dalšího AED) a přispívat bude rovněž nedostatečná informovanost. Epileptochirurgie zcela jistě nesmí být v léčebném algoritmu „ultimum refugium“.
V naší studii byla u 15 pacientů doporučena resekce jako jedna z možností léčby. Je nutné poznamenat, že se jednalo o nelezionální, multilezionální či do této doby neuzavřené etiologie. Odvažujeme se tvrdit, že zcela jednoznačně indikované kurativní resekce (např. benigní tumor v kombinaci s epilepsií) nám neunikají. Nejčastěji jsme doporučovali paliativní procedury (VNS a KD byly často považovány za relativní alternativy léčby). Přispívajících faktorů může být hned několik. Hrají zde svou roli nejen ekonomické aspekty, ale také stále se rozšiřující spektrum indikace těchto modalit (zejména implantace VNS). V neposlední řadě nás ovlivňuje tradice, resp. zvyklosti pracoviště (např. lehce konzervativní přístup některých lékařů, zvláště s dlouholetou praxí). Zhodnotili jsme neshody lékařů v indikaci k edukačnímu pohovoru. Ve 12 případech nebylo doporučení jednoznačné. Po komplexní evaluaci bylo u všech rozhodnuto o pozvání k pohovoru. K rozporům docházelo z několika důvodů. Studie nebyla dvojitě zaslepená (dokumentace obsahovala personální údaje pacienta), hrála zde svou roli subjektivita, osobní znalost pacienta a jeho rodičů. Rozhodnutí je značně individuální, neboť stále nejsou k dispozici doporučení pro dětské pacienty, která by jednoznačně definovala podmínky zařazení do chirurgického programu. Naše výsledky potvrzují, že vytvoření striktních doporučení bude vždy velmi složité, až nereálné, neboť individuálnost a osobitost dětského pacienta je neuchopitelná.
Závěr
Výstupem projektu je identifikace vhodných kandidátů nefarmakologické léčby z řad našich pacientů, kteří dosud další exploraci z různých důvodů unikají. Jejich zařazení do epileptochirurgického programu s následnou terapií by mohlo vést k dosažení bezzáchvatovosti či významné redukci počtu záchvatů. Naším dalším významným cílem je převést poznatky ze studie do reálné praxe (navazující prospektivní část) a časně realizovat konkrétní léčbu.
Práce byla podpořena výzkumným projektem MUNI/ A/ 1356/ 2016.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Přijato k recenzi: 24. 10. 2017
Přijato do tisku: 1. 3. 2018
MUDr. Petra Hanáková
Klinika dětské neurologie LF MU a FN Brno
Dětská nemocnice
Černopolní 9
613 00 Brno
e-mail: hanakova.petra@fnbrno.cz
Sources
1. Kwan P, Arzimanoglou A, Berg AT et al. Definition of drug resistant epilepsy: consensus proposal by the ad hoc task force of the ILAE commission on therapeutic strategies. Epilepsia 2010; 51(6): 1069 – 1077. doi: 10.1111/ j.1528-1167.2009.02397.x.
2. Arts WFM, Brouwer OF, Peters ACB et al. Course and prognosis of childhood epilepsy: 5-year follow-up of the Dutch study of epilepsy in childhood. Brain 2004; 127(8): 1774 – 1784. doi: 10.1093/ brain/ awh200.
3. Shields WD. Catastrophic epilepsy in childhood. Epilepsia 2000; 41 (Suppl 2): S2 – S6.
4. Ben-Ari Y, Dudek FE. Primary and secondary mechanisms of epileptogenesis in the temporal lobe: there is a before and an after. Epilepsy Curr 2010; 10(5): 118 – 125. doi: 10.1111/ j.1535-7511.2010.01376.x.
5. Brázdil M, Hadač J. Definice farmakorezistentní epilepsie, příčiny intraktability. In Brázdil M, Hadač J, Marušič P (eds). Farmakorezistentní epilepsie. Praha: Triton 2004 : 13 – 22.
6. Thompson PJ, Duncan JS. Cognitive decline in severe intractable epilepsy. Epilepsia 2005; 46(11): 1780 – 1787. doi: 10.1111/ j.1528-1167.2005.00279.x.
7. Brázdil M. Léčba epilepsie – update. Med praxi 2011; 8(11): 478 – 480.
8. Brodie MJ, Kwan P. Staged approach to epilepsy management. Neurology 2002; 58 (8 Suppl 5): S2 – S8. doi: 10.1212/ WNL.58.8_suppl_5.S2.
9. Holland KD, Glauser TA. Response to carbamazepine in children with newly diagnosed partial onset epilepsy. Neurology 2007; 69(6): 596 – 599. doi: 10.1212/ 01.wnl.0000267274.69619.f3.
10. Lamberink HJ, Boshuisen K, Rijen PC et al. Changing profiles of pediatric epilepsy surgery candidates over time: a nationwide single-center experience from 1990 to 2011. Epilepsia 2015; 56(5): 717 – 725. doi: 10.1111/ epi.12974.
11. Barba C, Specchio N, Guerrini R et al. Increasing volume and complexity of pediatric epilepsy surgery with stable seizure outcome between 2008 and 2014: A nationwide multicenter study. Epilepsy Behav 2017; 75 : 151 – 157. doi: 10.1016/ j.yebeh.2017.08.010.
12. Bien CG, Raabe AL, Schramm J et al. Trends in presurgical evaluation and surgical treatment of epilepsy a tone centre from 1988 – 2009. J Neurol Neurosurg Psychiatry 2013; 84(1): 54 – 61. doi: 10.1136/ jnnp-2011-301763.
13. Brázdil M. Proměny epileptochirurgie ve 21. století. Neurol praxi 2015; 16(2): 77 – 79.
14. Téllez-Zenteno JF, Dhar R, Wiebe S. Long-term seizure outcomes following epilepsy surgery: a systematic review and meta-analysis. Brain 2005; 128(5): 1188 – 1198. doi: 10.1093/ brain/ awh449.
15. Kuba R, Brázdil M, Novák Z et al. Dlouhodobá účinnost resekčních epileptochirurgických zákroků 5 let od operace. Neurol praxi 2008; 9(3): 166 – 170.
16. Hanáková P, Brázdil M, Novák Z et al. Long-term outcome and predictors of resective surgery prognosis in patients with refractory extratemporal epilepsy. Seizure 2014; 23(4): 266 – 273. doi: 10.1016/ j.seizure.2013.12.003.
17. Jeha LE, Najm I, Bingaman W et al. Surgical outcome and prognostic factors of frontal lobe epilepsy surgery. Brain 2007; 130(2): 574 – 584. doi: 10.1093/ brain/ awl 364.
18. Spencer SS, Berg AT, Vickrey BG et al. Initial outcomes in the multicenter study of epilepsy surgery. Neurology 2003; 61(12): 1680 – 1685.
19. D‘Argenzio L, Colonnelli MC, Harrison S et al. Seizure outcome after extratemporal epilepsy surgery in childhood. Dev Med Child Neurol 2012; 54(11): 995 – 1000. doi: 10.1111/ j.1469-8749.2012.04381.x.
20. Téllez-Zenteno JF, Ronquillo LH, Moien-Afshari Fet al. Surgical outcomes in lesional and non-lesional epilepsy: a systematic review and meta-analysis. Epilepsy Res 2010; 89(2 – 3): 310 – 318. doi: 10.1016/ j.eplepsyres.2010.02.007.
21. Bodin E, Le Moing AG, Bourel-Ponchel E et al. Vagus nerve stimulation in the treatment of drug resistant epilepsy in 29 children. Eur J Paediatr Neurol 2016; 20(3): 346 – 351. doi: 10.1016/ j.ejpn.2016.01.011.
22. Rychlicki F, Zamponi N, Trignani R et al. Vagus nerve stimulation: clinical experience in drug-resistant pediatric epileptic patients. Seizure 2006; 15(7): 483 – 490. doi: 10.1016/ j.seizure.2006.06.001.
23. Orosz I, McCromick D, Zamponi N et al. Vagus Nerve stimulation for drug-resistant epilepsy: a European long-term study up to 24 months in 347 children. Epilepsia 2014; 55(10): 1576 – 1584. doi: 10.1111/ epi.12762.
24. Ryzí M, Brázdil M, Novák Z et al. Long-term vagus nerve stimulation in children with focal epilepsy. Acta Neurol Scand 2013; 127(5): 316 – 322. doi: 10.1111/ ane.12009.
25. Alexopoulos AV, Kotagal P, Loddenkemper T et al. Long-term results with vagus nerve stimulation in children with pharmacoresistant epilepsy. Seizure 2006; 15(7): 491 – 503. doi: 10.1016/ j.seizure.2006.06.002.
26. Brázdil M, Hadač J, Marusič P et al (eds). Farmakorezistentní epilepsie. 2. vyd. Praha: Triton 2011.
27. Lefevre F, Aronson N. Ketogenic diet for the treatment of refractory epilepsy in children: a systematic review of efficacy. Pediatrics 2000; 105(4): E46.
28. Laxer KD, Trinka E, Hirsch LJ et al. The consequences of refractory epilepsy and its treatment. Epilepsy Behav 2014; 37 : 59 – 70. doi: 10.1016/ j.yebeh.2014.05.031.
29. Picot MC, Baldy-Moulinier M, Daurès JP et al. The prevalence of epilepsy and pharmacoresistant epilepsy in adults: a population-based study in a western European country. Epilepsia 2008; 49(7): 1230 – 1238. doi: 10.1111/ j.1528-1167.2008.01579.x.
30. Choi H, Carlino R, Heiman G et al. Evaluation of duration of epilepsy prior to temporal lobe epilepsy surgery during the past two decades. Epilepsy Res 2009; 86(2 – 3): 224 – 227. doi: 10.1016/ j.epilepsyres.2009.05.014.
31. Berg AT, Zelko FA, Levy SR et al. Age at onset of epilepsy, pharmacoresistance, and cognitive outcomes. A prospective cohort study. Neurology 2012; 79(13): 1384 – 1391. doi: 10.1212/ WNL.0b013e31826c1b55.
32. Hoei-Hansen CE, Mathiasen R, Uldall P. Unexpected marked seizure improvement in paediatric epilepsy surgery candidates. Seizure 2017; 45 : 70 – 73. doi: 10.1016/ j.seizure.2016.11.020.
33. Bien CG, Schulze-Bonhage A, Soeder BM et al. Assessment of the long-term effects of epilepsy surgery with three different reference groups. Epilepsia 2006; 47(11): 1865 – 1869. doi: 10.1111/ j.1528-1167.2006.00813.x.
34. Ryvlin P, Cross JH, Rheims S. Epilepsy surgery in children and adults. Lancet Neurol 2014; 13(11): 1114 – 1126. doi: 10.1016/ S1474-4422(14)70156-5.
35. Pestana Knight EM, Schiltz NK, Bakaki PM et al. Increasing utilization of pediatric epilepsy surgery in the United States between 1997 and 2009. Epilepsia 2015; 56(3): 375 – 381. doi: 10.1111/ epi.12912.
Labels
Paediatric neurology Neurosurgery Neurology
Article was published inCzech and Slovak Neurology and Neurosurgery

2018 Issue 2-
All articles in this issue
- Syndrom GLUT-1 deficience – expandující klinické spektrum léčitelného onemocnění
- Syndrom karpálního tunelu v kontextu funkčních poruch pohybového systému
- Identifikace dětských pacientů s farmakorezistentní epilepsií a výběr kandidátů nefarmakologické terapie
- Lehké řetězce neurofilament v séru a mozkomíšním moku a stav hematolikvorové bariéry u vybraných neurologických onemocnění
- Fyzioterapie u Parkinsonovy nemoci v České republice – demografická studie
- Follow-up pacientů s idiopatickou poruchou chování v REM spánku – fenokonverze do parkinsonského syndromu a demence
- Pilotní studie Edinburské kognitivně-behaviorální zkoušky pro amyotrofickou laterální sklerózu na české populaci
- Akutní myelitida u dětí – soubor 20 pacientů
- Nádor z granulárních buněk stopky hypofýzy
- Biopsie mozku v deseti bodech – co může neurolog očekávat od neurochirurga a neuropatologa?
- Ataxie
- Antikoagulačná liečba u pacientov s fibriláciou predsiení a cerebrálnou amyloidovou angiopatiou
- Antikoagulační léčba u pacientů s fibrilací síní a cerebrální amyloidovou angiopatií
- Antikoagulačná liečba u pacientov s fibriláciou predsiení a cerebrálnou amyloidovou angiopatiou
- Fabryho choroba, přehled problematiky a nejčastější neurologické projevy
- Je amyloid podstatný pro senilní demenci?
- Hladiny anti-Mülleriánského hormonu v séru při roztroušené skleróze – multicentrická případová kontrolní studie
- Invazivní primarně intracerebrální infekce u žen způsobené Streptococcus intermedius a manifestující se jako purulentní meningitida a intracerebrální absces
- Maligní melanotický schwannom obratlového těla u pacienta s Carneyho komplexem
- Czech and Slovak Neurology and Neurosurgery
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Ataxie
- Biopsie mozku v deseti bodech – co může neurolog očekávat od neurochirurga a neuropatologa?
- Fabryho choroba, přehled problematiky a nejčastější neurologické projevy
- Syndrom GLUT-1 deficience – expandující klinické spektrum léčitelného onemocnění
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

