-
Medical journals
- Career
Statiny indukovaná nekrotizující autoimunitní myopatie
Authors: T. Horák 1; S. Voháňka 1; E. Tvrdíková 2; M. Horáková 1; J. Bednařík 1
Authors‘ workplace: Neurologická klinika LF MU a FN Brno 1; Ústav patologie, LF MU a FN Brno 2
Published in: Cesk Slov Neurol N 2017; 80/113(5): 569-577
Category: Original Paper
doi: https://doi.org/10.14735/amcsnn2017569Overview
Cíl:
Léčba statiny může být ve vzácných případech asociována s tvorbou specifických autoprotilátek proti 3-hydroxy-3-metylglutaryl koenzym A reduktáze (anti-HMGCR), pletencovou svalovou slabostí, zvýšenou hladinou kreatinkinázy (CK) a nekrózou myofibril ve svalové biopsii. Přítomnost těchto znaků tvoří hlavní kritéria nově definované nozologické jednotky označované jako statiny indukovaná nekrotizující myopatie (Statin Induced Necrotizing Autoimmune Myopathy; SINAM). Předpokládaná autoimunitní etiopatogeneze opodstatňuje použití kombinované imunosupresivní terapie. Klinický průběh, diagnostická kritéria i terapeutická účinnost imunosupresivní léčby jsou u SINAM obdobné jako u imunitně zprostředkované nekrotizující myopatie (Immune Mediated Necrotizing Myopathy; IMNM) bez asociace s léčbou statiny.Soubor a metodika:
Je prezentován soubor 7 nemocných se SINAM, který vznikl diagnostickým přehodnocením skupiny 30 nemocných s diagnózou autoimunitní myopatie na základě stanovení anti-HMGCR protilátek, strukturovaného kvantitativního přehodnocení svalové biopsie a zpřesnění anamnézy (potvrzující chronickou léčbu statiny).Výsledky:
Celkem 12 pacientů ze 30 testovaných subjektů s původní diagnózou dermatomyozitida, polymyozitida nebo IMNM bylo anti-HMGCR pozitivních (5× IMNM, 7× PM) a 7 z nich užívalo v předchorobí statiny. Těchto 7 nemocných bylo překlasifikováno na SINAM. V jejich svalových biopsiích byla ve všech případech nalezena nekróza myofibril a u 5 pacientů také zánětlivá celulizace. Všichni tito pacienti měli na počátku onemocnění výrazně zvýšenou hladinu CK (> 10násobně). Kombinovaná imunosuprese vedla k remisi klinické symptomatiky a normalizaci či výraznému poklesu CK u všech nemocných.Klíčová slova:
myopatie – statiny – autoimunita – nekróza – protilátky – anti-HMGCRÚvod
Statiny prokazatelně snižují riziko vzniku kardiovaskulárních chorob. Jedná se o léčiva s výborným bezpečnostním profilem a i díky tomu patří dlouhodobě mezi pět nejčastěji předepisovaných lékových skupin v USA [1], v celosvětovém meřítku [2] i v České republice [3]. Postižení svalů označované jako statinová myopatie je nejčastější a nejzávažnější nežádoucí účinek léčby statiny. Spektrum její klinické manifestace je široké od asymptomatické elevace kreatinkinázy (CK) v séru přes převážně nezávažné myalgie, svalovou slabost až po závažné, ale vzácné rabdomyolýzy [4]. Projevy myopatie vyvolané toxickým působením statinů po jejich vysazení spontánně vymizí [5]. Ve velmi vzácných případech se pletencová svalová slabost rozvíjí po dlouhodobém podávání statinů (v řádech měsíců až let) a přetrvává i po jejich vysazení. V těchto případech je svalová slabost doprovázena elevací CK, přítomností nekrotických myofibril ve svalové biopsii a pozitivitou autoprotilátek proti 3-hydroxy-3 metylglutaryl koenzym A reduktáze (anti-HMGCR). Ty jsou společně s autoprotilátkami proti Signal Recognition Particle (SRP) specifické pro imunitně zprostředkované nekrotizující myopatie (IMNM) (obr. 1) [6]. Teprve v roce 2015 byla jednotka s pozitivitou anti-HMGCR a návazností na užívání statinů pojmenována jako SINAM (Statin Induced Necrotizing Autoimmune Myopathy) [7], přestože o asociaci autoimunitně podmíněné myopatie s užíváním statinů je diskutováno už celou dekádu [8]. Histologický obraz je charakteristický, ale nespecifický. Etiopatogenetické mechanizmy zůstávají neobjasněny a léčba zatím není ověřena. Cílem této práce je shrnutí současných poznatků o SINAM a prezentace klinických a laboratorních charakteristik vlastního souboru sedmi pacientů splňujících diagnostická kritéria této klinické jednotky.
Image 1. Vennův diagram podjednotek IMNM. Anti-HMGCR+, SINAM, anti-SRP+ a skupina bez přítomnosti protilátek – klasifikace na základě serologie a terapie statiny v předchorobí. Fig. 1. Venn diagram of IMNM subunits. Anti-HMGCR+, SINAM, anti-SRP+, and the group without the presence of antibodies – classification based on serology and statin therapy medical history. 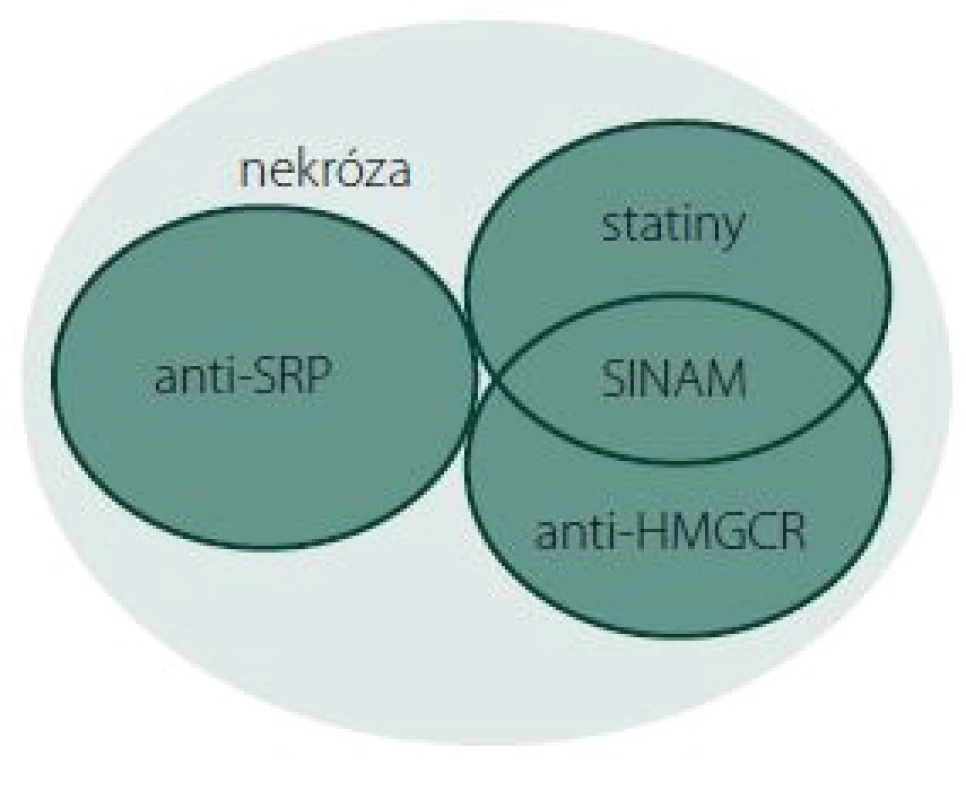
Klinický obraz
K rozvoji SINAM dochází nejdříve měsíc od započetí terapie statiny. U většiny pacientů se však postižení rozvíjí až po několika letech terapie. Mezi nejčastější klinické projevy patří bolest svalů a symptomy proximální svalové slabosti, jako obtížné vstávání ze židle, problémy s chůzí do schodů nebo zvedání těžkých břemen [9–11]. Na rozdíl od toxické myopatie se u statiny indukované autoimunitní myopatie tyto symptomy po vysazení medikace zpravidla nezmírní a případně se progresivně zhoršují [12,13]. Svalové oslabení bývá ve většině případů mírné až středně těžké, byly však zaznamenány i případy těžké proximální svalové slabosti. V některých případech se objevují také bulbární příznaky [12]. SINAM je primárně onemocněním kosterních svalů, avšak vzácně se může objevit také mírná bolest kloubů či kožní vyrážka [14,15].
Epidemiologie
Imunitou zprostředkovaná myopatie při podávání statinů je velmi vzácné onemocnění. Dle posledních studií se SINAM rozvíjí u 2 – 3 případů na 100 000 pacientů léčených statiny za rok [16] (po vyloučení cerivastatinu z prodeje pro zvýšenou incidenci rabdomyolýzy [17]).
Etiopatogeneze
Předpokládaná etiopatogeneze je autoimunitní. Existuje však několik možných vysvětlení autoimunitních mechanizmů u SINAM a řada aspektů dosud nebyla objasněna.
- Alely HLA II. třídy s označením DRB1*11 : 01 jsou silně asociovány s tvorbou protilátek anti-HMGCR i u pacientů, u kterých není známa expozice statinům [18,19].
- Exprese HMGCR je nízká ve většině tkání, ale je signifikantně zvýšena, když jsou svalové, ale i jiné buňky vystaveny působení statinů [20].
- Regenerující svalové buňky exprimují vysoké hladiny proteinu HMGCR [21,22], který je potřebný pro normální diferenciaci svalové buňky [22 – 24]. To je zřejmě hlavní mechanizmus, který udržuje stále aktivní zdroj autoantigenu navzdory vysazení statinu.
Předpokládá se, že zvýšená exprese HMGCR u geneticky predisponovaných pacientů spustí autoimunitní reakci proti HMGCR. Vazba statinu na HMGCR může změnit konformaci tohoto proteinu a odkrýt pozměněné epitopy, vůči kterým není imunitní systém tolerantní [16]. Vysvětlením pro následné udržování imunitní reakce může být i obecný mechanizmus, který se vyskytuje u celé řady autoimunitních onemocnění – fenomén šíření epitopů (epitope spreading) [25]. Autoimunitní reakce zaměřená proti jedné konkrétní oblasti antigenu (v tomto případě pozměněnému epitopu HMGCR) vede k poškození tkáně a pozměnění nebo odkrytí dalších epitopů. Imunitní buňky vystavené působení prozánětlivých cytokinů pak i vůči těmto dalším epitopům prolomí toleranci a autoimunitní reakce se stává chronickou.
Diagnostika
V klinickém obraze dominuje u pacientů se SINAM symetrická proximální svalová slabost s akutním (týdny) nebo subakutním (< 6 měsíců) rozvojem, která vzniká průměrně 3 roky od započetí terapie statiny (v rozmezí 1 měsíc až 10 let) [13]. V laboratorních výsledcích nacházíme více než 10násobnou elevaci CK (až 250 μkat/l). Důležitým diagnostickým nástrojem je svalová biopsie (viz níže) s dominancí nekrotických a regenerujících myofibril s přítomností pouze minimální zánětlivé infiltrace. Na EMG vyšetření zaznamenáváme myogenní vzorec v jehlové EMG se změnami parametrů potenciálů motorické jednotky (tedy snížením jejich amplitudy a trvání a zvýšeným výskytem polyfázií), předčasným náborem motorických jednotek a abnormální spontánní aktivitou [12,13]. Magnetickou rezonancí (MR) pak lze prokázat edém svalů, jejich atrofii, zánět fascií a tukovou degeneraci [6,14]. Užitečné jsou zejména v sekvence Short Tau Inversion Recovery (STIR), tříbodový DIXON, T2 vážené obrazy případně měření alterace T1 relaxačních časů [6,26].
Protilátky
Protein HMGCR je farmakologickým cílem statinů. Protilátky proti tomuto proteinu jsou specifické pro klinickou jednotku anti-HMGCR pozitivních autoimunitních myopatií [6], z nichž se dále vyčleňuje SINAM (obr. 1). Tyto protilátky zatím nebyly nalezeny u pacientů s toxickou statinovou myopatií nebo u osob bez známek myopatie [27] a jejich pozitivita je asociována s užíváním statinů mezi 44 [10] a 92 % [22].
Komerční enzymatické imunitní testy ELISA pro anti-HMGCR autoprotilátky, které jsou běžně dostupné i v České republice, mohou mít míru falešně pozitivních výsledků cca 0,7 % [27]. Pro snížení rizika falešné pozitivity anti-HMGCR je mezi kritéria SINAM navrženo zvýšení hladiny CK v séru > 10násobek normy (viz dále). Důležitým zjištěním je, že hladina autoprotilátek anti-HMGCR koreluje s hladinou CK a tíží proximální svalové slabosti [10,15,28]. Vhodný diagnostický postup při podezření na SINAM je znázorněn na obr. 2.
Image 2. Schéma vhodného diagnostického algoritmu u podezření na statiny indukovanou myopatii. Fig. 2. Diagram of an eligible diagnostic algorithm for suspected statin induced myopathy. 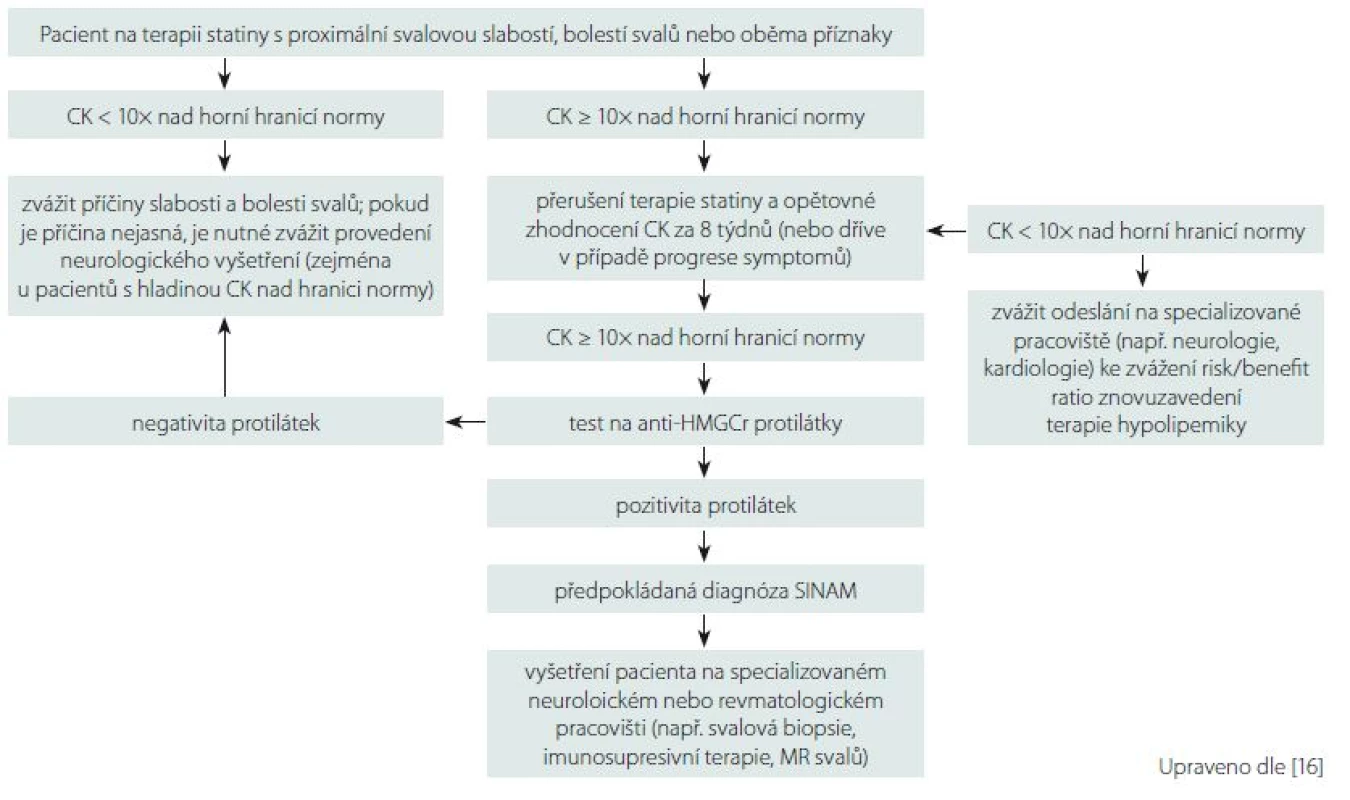
Rovněž byla prokázána zvýšená incidence malignit u anti-HMGCR pozitivních pacientů [29], což může být vysvětleno zapojením imunitní odpovědi proti nádorovým buňkám do autoimunitního procesu [30]. Podstata této asociace je zatím předmětem výzkumu.
Mikroskopický obraz
Biopsie svalů je jedním ze stěžejních vyšetření a bývá nejčastěji prováděna z relativně jednoduše dostupných svalů, jako jsou m. deltoideus, m. vastus lateralis, m. gluteus medius nebo m. iliopsoas [13,31].
Mikroskopický obraz u pacientů s diagnózou SINAM je značně nespecifický, obecně nejčastěji odpovídající zánětlivé myogenní svalové lézi. Obdobný obraz může být přítomen i u některých dalších neuromuskulárních onemocnění. Proto je vždy nutná pečlivá klinicko-patologická korelace.
Mikroskopicky pozorujeme velikostní kolísání průměrů svalových vláken. Obvykle jsou přítomna nekrotická svalová vlákna, která bývají infiltrována makrofágy, jež se podílí na reparaci svalové tkáně [12,13,32,33]. Dále jsou zastiženy drobné bazofilní regenerující myofibrily s vezikulárním, centrálně lokalizovaným jádrem. V rámci reparativních změn bývá při delším průběhu onemocnění rozšířeno intersticium.
Častá je přítomnost zánětlivé celulizace, která je lokalizována převážně endomyziálně či intersticiálně. V některých případech nacházíme i zánětlivou infiltraci nenekrotických svalových vláken. Imunohistochemicky lze prokázat, že je zánětlivý infiltrát tvořen převážně CD4+ T lymfocyty a CD8+ T lymfocyty, dále jsou v menší míře zastiženy CD20+ B lymfocyty a CD68+ makrofágy.
Pozorována bývá také Up-regulace HLA1, která je patrná sarkoplazmaticky, často i sarkolematicky.
Dalšími nálezy mohou být: exprese membrany atakujici komplex (MAC) v endoteliích kapilár, zvýšená aktivita kyselé fosfatázy, která bývá vázána převážně na ložiska zánětlivé celulizace, a Up-regulace N-utrofinu (obr. 3).
Image 3. Příčný řez svalovou tkání. a) zelená šipka označuje nekrotické svalové vlákno, oranžová šipka znázorňuje kulatobuněčnou zánětlivou celulizaci, lokalizovanou intersticiálně (H&E 400×), b) nekrotická svalová vlákna infiltrovaná makrofágy (H&E 400×), c) zelená šipka označuje nekrotické svalové vlákno, žlutá šipka směřuje k regenerujícímu svalovému vláknu s lehce bazofilní cytoplazmou a naznačeně vezikulárním, centrálně lokalizovaným jádrem, modré šipky znázorňují infiltraci rozpadlých nekrotických svalových vláken makrofágy (H&E 400×), d) disperzně patrná overexprese HLA1 sarkolematicky i sarkoplazmaticky (Imunohistochemie, HLA1 200x), e) zvýšená aktivita kyselé fosfatázy vázaná převážně na ložiska zánětlivé celulizace (kyselá fosfatáza 200×),f) A: CD8 pozitivní T lymfocyty, B: CD4 pozitivní T lymfocyty (Imunohistochemie, CD8, CD4 200×). Fig. 3. Cross section of muscle tissue. a) green arrow indicates the necrotic muscle fiber, the orange arrow shows the round cell inflammatory cellulization, located interstitial (H & E 400×), b) necrotic muscle fibers infiltratedby macrophages (H & E 400×), c) green arrow indicates the necrotic muscle fiber, the yellowarrow points to the regenerating muscle fiber with a slightly basophilic cytoplasm and a marked vesicular centrally located nucleus, blue arrows illustrates the infiltration of disintegrated necrotic muscle fibers of the macrophage (H & E 400×), d) dispersionaly located HLA1 overexpression in sarcolema and sarcoplasma (Immunohistochemistry, HLA1 200x), e) increasedactivity of acid phosphatase bound predominantly on deposits of inflammatory cellulization (acidic phosphatase 200×), f) A: CD8 positive T lymphocytes, B: CD4 positive T lymphocytes (Immunohistochemistry, CD8, CD4 200×). 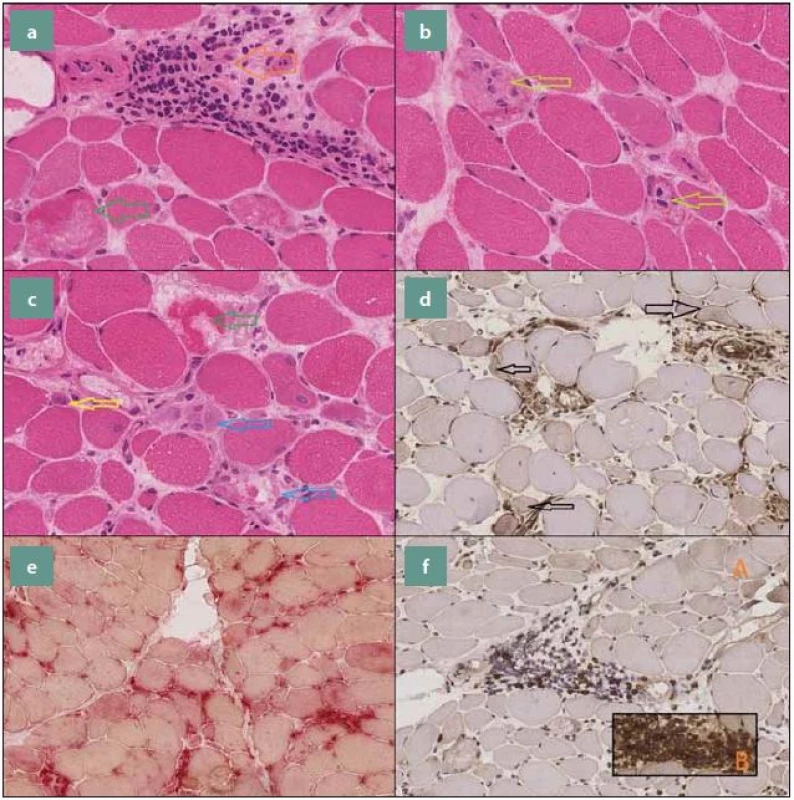
Léčba
Okamžité vysazení statinů je doporučováno u pacientů s proximální svalovou slabostí a zvýšením hladiny CK > 10×. Přestože nebyly zatím provedeny žádné klinické studie terapie této klinické jednotky, dle dosavadních zkušeností je ve většině případů nutné zahájit imunosupresivní terapii. Ve vzácných případech velmi mírné svalové slabosti není vyloučena ani spontánní úprava zdravotního stavu po vysazení statinů a je možné zvážit pečlivou observaci, hodnocení svalové síly a kontrolu CK s odstupem [10]. U pacientů s přetrvávající či horšící se svalovou slabostí a v případě středně těžkých svalových příznaků je vhodné začít terapii perorálním prednizonem v dávce 1 mg/kg/den. U těžké svalové slabosti pak v kombinaci s metotrexátem [13], azatioprinem či mykofenolát mofetilem. Ve velmi závažných případech svalové slabosti a u pacientů refrakterních k dosavadní kombinaci imunosupresiv po dvou až třech měsících terapie je vhodné přidat do léčby intravenózní imunoglobuliny v plné dávce [34], případně jiná léčiva (např. rituximab) a zahájit tak kombinovanou imunomodulační terapii. Ta je dle dostupných zkušeností nezbytná až v polovině případů SINAM [9,10,28,35,36]. Účinnost terapie IVIG zatím nebyla u IMNM prokázána v randomizovaných studiích a v klinické praxi je ve většině případů rezervována pro pacienty rezistentní k dvojkombinaci imunosupresiv či při závažných relapsech onemocnění nebo bulbárních nebo dechových příznacích. V literatuře je také popisována monoterapie IVIG [34,37] a její zahájení je možné jako první volba v případě preexistujícího diabetu, imunodeficience [38], závažné patologické reakce na imunosupresiva nebo během těhotenství a kojení [39]. Další terapeutickou možností je plazmaferéza. Po úspěšném nastavení imunosupresivní léčby obvykle dochází k normalizaci hladiny CK a myoglobinu společně s obnovou plné svalové síly. V některých případech však následkem dlouhotrvajícího aktivního onemocnění (např. při nedostatečné terapii) nastává trvalé poškození svalů tukovou degenerací a důsledkem je přetrvávání svalové slabosti. Toto permanentní poškození svalů může být verifikováno pomocí MR svalů (viz výše). V některých případech naopak dochází k návratu svalové síly a přetrvává zvýšená hladina CK [9,14,37]. Je to pravděpodobně dáno tím, že při stále aktivním autoimunitní procesu je paralelně probíhající regenerace svalů rychlejší než jejich poškození.
Vlastní soubor
Vyšetřili jsme soubor 30 pacientů, kteří splňovali klinická, laboratorní (CK), EMG a histopatologická kritéria PM, DM nebo IMNM (s výjimkou jednoho nemocného s asymptomatickou hyper-CK-emií > 10násobek normy). Klinické projevy dermatomyozitidy (DM) a polymyozitidy (PM), tedy akutní (dny až týdny) nebo subakutní (< 6 měsíců) rozvoj symetrické proximální svalové slabosti, odpovídají klinickým projevům IMNM. Elevace CK je také společným znakem těchto tří jednotek a rovněž jejich histopatologický obraz se může překrývat.
Provedli jsme stanovení protilátek anti-HMGCR, v dokumentaci dohledali hodnoty CK a myoglobinu v průběhu celého onemocnění a vyšetřili aktuální hladinu CK, myoglobinu. Dále jsme doplnili detailní anamnézu se zaměřením na terapii statiny a věk vzniku. Byla provedena strukturovaná revize uložených vzorků svalových biopsií a standardizované klinické vyšetření. Pro statistické srovnání kvantitativních proměnných byl použit Mannův-Whitneyho test. SINAM byla klasifikována na základě splnění všech následujících kritérií:
- pozitivita autoprotilátek anti-HMGCR;
- elevace hladiny CK > 10× před vysazením statinů a případným započetím imunosuprese;
- anamnéza užívání statinů s přetrvávající svalovou slabostí i po jejich vysazení;
- nález nekrotizujících a regenerujících myofibril s pouze minimální nebo žádnou přítomností buněčného infiltrátu ve svalové biopsii.
Výsledky
Ze 30 testovaných pacientů bylo 12 anti-HMGCR pozitivních (tab. 1, 2). Sedm pacientů z tohoto souboru užívalo v předchorobí statiny, ve svalové biopsii byla prokázána nekróza myofibril a současně měli zvýšenou hladinu CK > 10×. Splnili tak všechna hlavní kritéria pro SINAM. Průměrný věk v souboru byl 70 let (min. 57, max. 80 let) s převahou žen (šest pacientů ze sedmi).
Table 1. Výsledky revize bioptických vzorků v souboru. 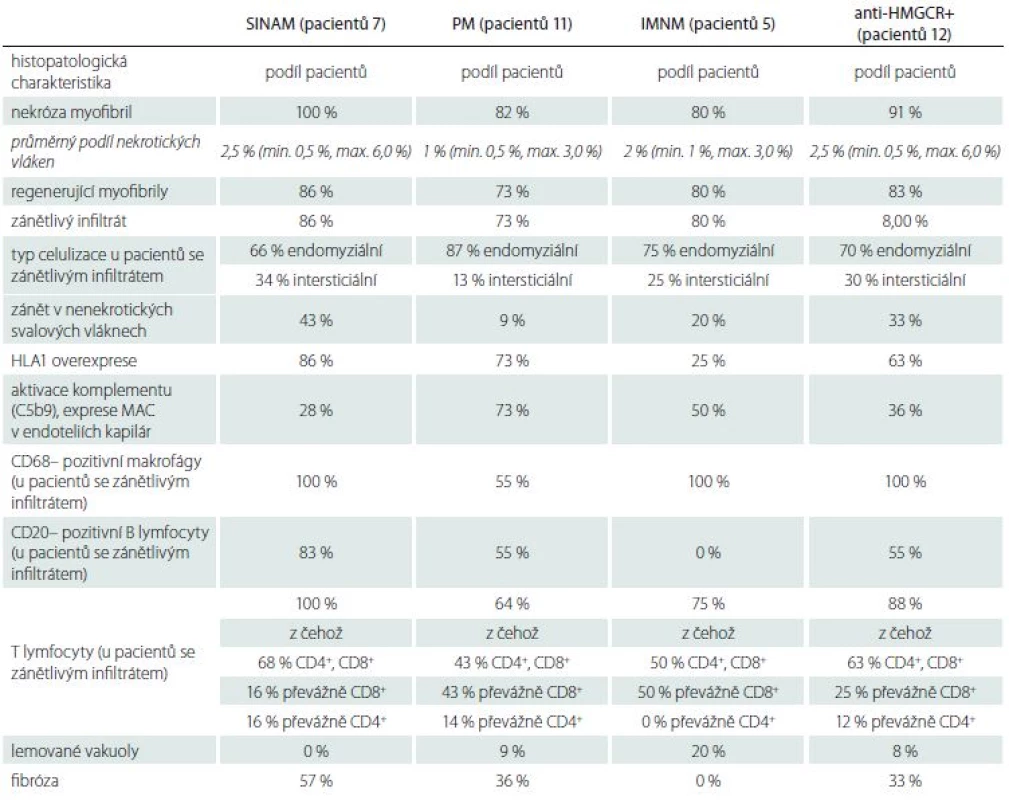
Table 2. Porovnání vybraných výsledků pacientů SINAM a anti-HMGCR+. 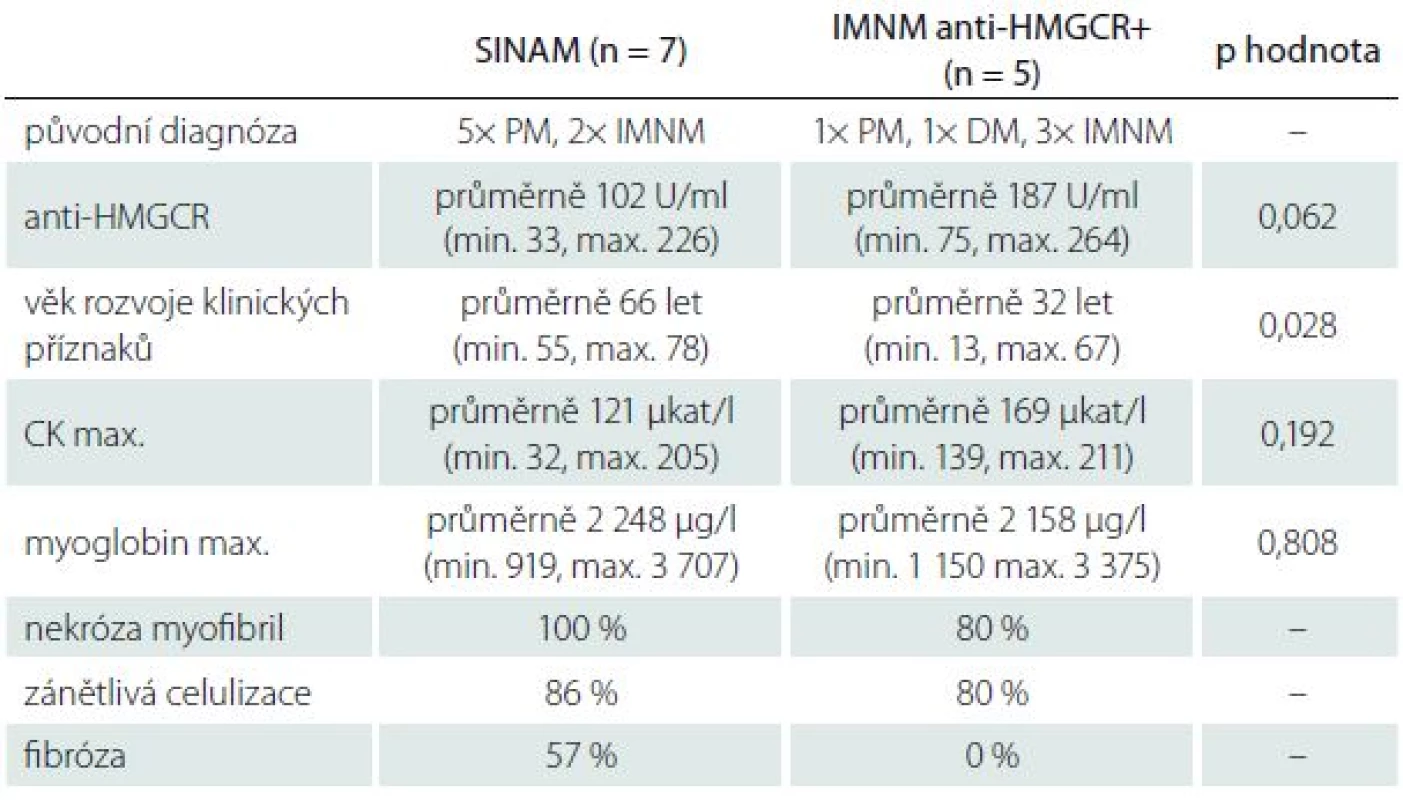
Ze zbývající pětice nemocných bez expozice statiny, ale s pozitivitou anti-HMGCR splňovali čtyři pacienti všechna hlavní kritéria IMNM a pouze u jednoho pacienta nebyla svalovou biopsií potvrzena nekróza myofibril. Šlo o 17letého muže, sportovce, kdy zvýšení CK > 10násobek bylo zjištěno v rámci preventivní prohlídky a MR svalů vykazovalo nespecifickou změnu signálů v oblasti pletencových svalů a histopatologickým nálezem CD68 pozitivních makrofágů, bez známek nekrózy a zánětlivé celulizace.
Průměrná délka užívání statinů před rozvojem klinických příznaků byla 30 měsíců (min. 24, max. 36 měsíců). Ty se začaly objevovat v průměrném věku 65 let (min. 55, max. 78 let). Maximální titr protilátek anti-HMGCR byl v našem souboru v průměru 101 U/ml (min. 32,5, max. 225,7 U/ml). Zajímavostí je, že všichni pacienti v souboru užívali atorvastatin (Tulip®).
Při srovnání sedmi pacientů anti-HMGCR pozitivních s pozitivní anamnézou užívání statinu a zbývajících pět pouze anti-HMGCR pozitivních pacientů byl titr těchto protilátek v průměru o 85 U/ ml vyšší u pacientů bez medikace statinů v předchorobí, ale vzhledem k nízkému počtu pacientů tento rozdíl nebyl statisticky signifikantní (p = 0,062) (tab. 2).
Ve vyšetřovaném souboru pacientů byl prováděn také odběr anti-SRP protilátek. Ty byly pozitivní ve dvou případech. U žádného z pacientů v souboru nebyla zjištěna současně pozitivita anti-SRP a anti-HMGCR protilátek.
Vzhledem k popisovanému častému výskytu malignit u pacientů s anti-HMGCR pozitivitou [40] byl kromě expozice statinům sledován také tento parametr. V našem souboru nebyla u žádného z IMNM pacientů pozitivní anamnéza nádorových onemocnění a zároveň nebyla zjištěna malignita během sledování.
Kreatinkináza, myoglobin
Jedním z diagnostických kritérií SINAM je zvýšení hladiny CK v séru na více než 10násobek normy. Maximální hladiny CK dosahovaly průměrně 121 μkat/l (min. 32, max. 205 μkat/l). Pouze u dvou pacientů měla hladina CK od započetí imunosupresivní terapie čistě klesající charakter bez známek exacerbace. U pěti sledovaných pacientů došlo k relapsu onemocnění, který se projevil zvýšenou hladinou CK, ve třech případech dokonce vyšší než v době záchytu onemocnění. Nejkratší doba, za kterou došlo k normalizaci hladiny CK, byla okolo 200 dní od započetí imunosupresivní terapie (obr. 4). Maximální průměrná hladina myoglobinu byla naměřena 2248 μg/l (min. 919, max. 3 700 μg/l).
Image 4. Graf vývoje hladiny CK v čase u pacientů se SINAM. Retrospektivně získané hodnoty koncentrace CK u 7 pacientů klasifikovaných jako SINAM. Jednotlivé křivky znázorňují vývoj hladiny CK v čase u jednotlivých pacientů (označení A–G). Fig. 4. Graph of CK development in SINAM patients over the time. Retrospectively obtained CK concentrations in 7 patients classified as SINAM. The individual curves represent the development of CK over time in individual patients (A–G). 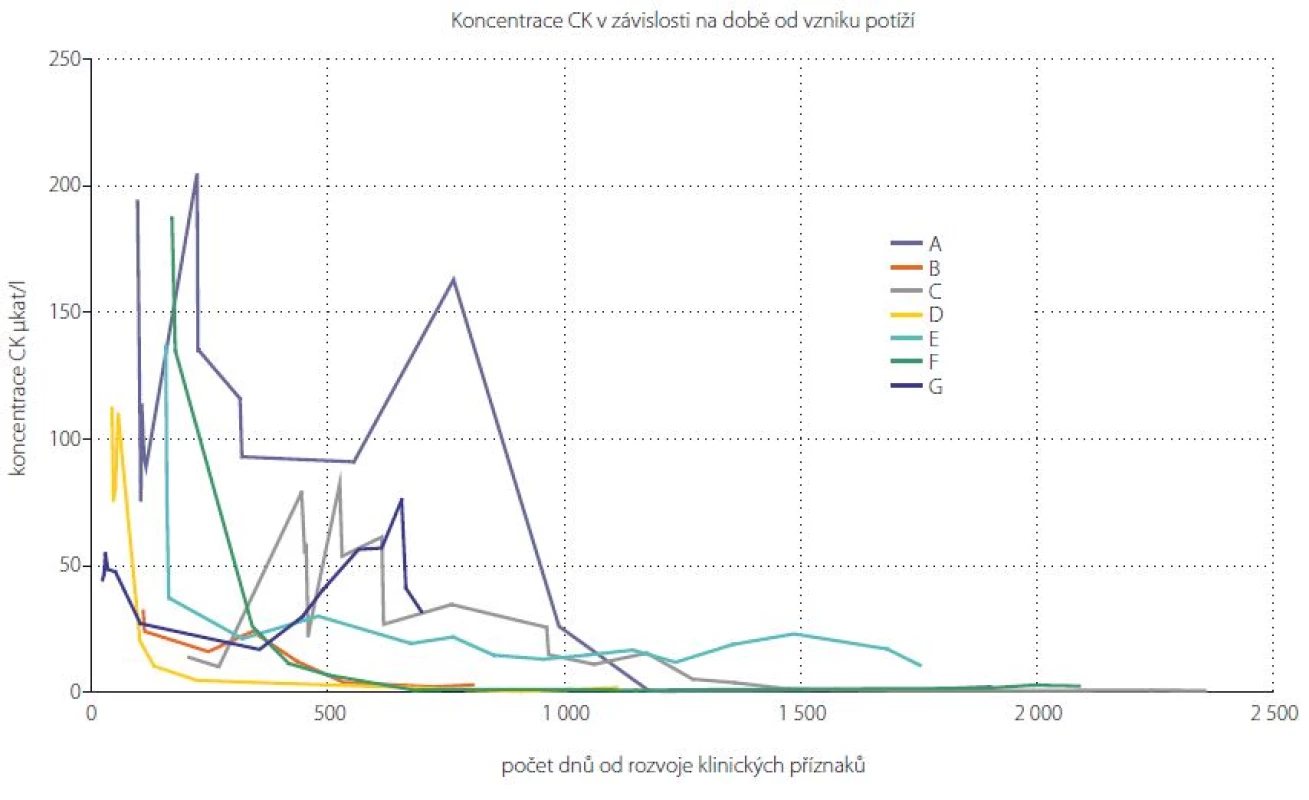
Revize biopsií
U všech sedmi pacientů v souboru SINAM byla v bioptickém materiálu přítomna nekrotická svalová vlákna v průměrném procentuálním zastoupení 2,5 % (min. 0,5 %, max. 6 %). U šesti pacientů byly v testovaném vzorku nalezeny regenerující myofibrily. Zánětlivý infiltrát byl zastižen u šesti pacientů, a to ve čtyřech případech lokalizovaný endomyziálně a ve dvou intersticiálně. Infiltrát ve všech případech obsahoval makrofágy a T lymfocyty, v pěti případech B lymfocyty. Exprese MAC v kapilárách byla v rozporu s publikovanými poznatky (tab. 3) nižší u SINAM a IMNM pacientů oproti PM. Může se jednat o netypický nález způsobený příliš malým souborem vyšetřených vzorků. Podrobněji v tab. 1 a obr. 3.
Table 3. Klinické, sérologické a patologické charakteristiky IMNM, PM a DM. Upraveno dle [34,40]. ![Klinické, sérologické a patologické charakteristiky IMNM, PM a DM. Upraveno dle [34,40].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/8c1566ce85adda597fae74a0582fbe11.jpg)
Přehodnocení diagnózy, klinický průběh a efekt léčby
Z celkem 12 nemocných s pozitivitou HMGCR a splňujících kritéria INMN byla tato diagnóza stanovena před možností stanovení anti-HMGCR u pěti nemocných (dva z nich splňovali kritéria SINAM), zatímco u sedmi byla původní diagnóza polymyozitida (u pěti se SINAM) (tab. 2).
Klinický průběh SINAM v našem souboru nemocných je možné charakterizovat jako převážně relaps remitentní s jasnou tendencí k normalizaci hladiny CK při správně vedené imunosupresivní terapii. K normalizaci hladiny CK však došlo nejdříve za 7 měsíců a u většiny pacientů je nutné počítat s několika lety. U jednoho pacienta je průběh onemocnění chronický s trvalou hladinou CK okolo 25 μkat/l.
Část pacientů našeho souboru byla původně diagnostikována, a tedy i léčena jako polymyozitida. U nemocných s IMNM je doporučovaný léčebný algoritmus podobný jako u PM a bylo tomu tak i u našich pacientů. Náš soubor je malý na zobecnění, avšak zaznamenali jsme u několika nemocných nevýraznou či žádnou odpověď na kortikoterapii. U většiny nemocných jsme byli nuceni zavést kombinovanou imunosupresi a část nemocných reagovala velmi dobře na léčbu IVIG.
Diskuze
Informace získané ze souboru našich pacientů korelují se současnými poznatky a ukazují zejména na diagnostickou výtěžnost stanovení anti-HMGCR autoprotilátek u nemocných se svalovou slabostí a léčených statiny. Před jejich stanovením byla významná část nemocných s IMNM (ať už asociované s medikací statiny či bez této expozice) klasifikována jako idiopatická polymyozitida. Je to pochopitelné, protože klinická manifestace je obdobná a histopatologická kritéria PM a INMN se překrývají (tab. 3) [34,41]. Dosavadní poznatky ukazují na specificitu anti-HMGCR protilátek zejména pro SINAM, neboť nebyly nalezeny u jiných myopatií typu PM, DM nebo myozitidy s inkluzními tělísky (ani v případě současné medikace statiny) či u IMNM s přítomností anti-SRP anebo anti-syntetázových protilátek. Anti-HMGCR protilátky můžeme výjimečně nalézt u jedinců léčených statiny bez klinických symptomů či u projevů myotoxického působení statinů („self-limited“ statinové myopatie) [7]. V souladu s recentními poznatky je také informace o počtu anti-HMGCR pozitivních IMNM pacientů s negativní anamnézou užívání statinů. Jak již bylo popsáno na větších souborech, průměrně 1/3 pacientů s pozitivitou protilátek anti-HMGCR statiny prokazatelně nikdy neužívala [10,21,22,28]. Tato skupina pacientů se od nemocných se SINAM významně liší nižším věkovým průměrem a horší terapeutickou odpovědí [28]. V testovaném souboru jsme takových subjektů zaznamenali pět (40 %), z toho tři pacienti byli mladší 19 let (13, 15 a 18 let). Věkový rozdíl byl i statisticky signifikantní (p = 0,028) (tab. 2). I proto někteří autoři zpochybňují souvislost s tvorbou anti-HMGCR protilátek s užíváním statinů a naznačují možnost pouhé koincidence vzhledem ke skutečnosti, že ve věku nad 50 – 65 let užívá statiny 30–45 % populace [42]. Hypotéza, že statiny působí jako spouštěč zvýšené exprese HMGCR, který se pak stává imunogenním, zatím nebyla doložena. Dle dosavadních poznatků je však velmi pravděpodobná. Pro toto tvrzení svědčí také skutečnost, že statiny nejsou pouze produktem farmaceutického průmyslu a bývají obsaženy v potravinových doplňcích a přírodních zdrojích (hlíva ústřičná, červená rýže, čaj puerh) a negativní anamnéza užívání statinů nemusí vždy znamenat, že se s nimi organizmus pacienta nikdy nesetkal.
Všichni pacienti, kteří byli v našem souboru klasifikováni jako SINAM, v předchorobí užívali atorvastatin (Tulip®). Pravděpodobným vysvětlením je fakt, že atorvastatin je nejčastěji užívaná účinná látka ze skupiny statinů na světě [1,2] i v České republice (v roce 2010, kdy bylo do České republiky dodáno téměř 3,9 milionů kusů balení s léčivou látkou atorvastatin z celkových 6,5 milionů kusů balení statinů) [3]. Dalším vysvětlením je, že pacienti s DM II léčeni atorvastatinem mají větší riziko rozvoje IMNM oproti pacientům léčeným jinými hypolipemiky (rosuvastatin, simvastatin). V souladu se prací Basharada [43] bylo více než 70 % pacientů léčeno pro diabetes mellitus 2. typu.
U jednoho pacienta v souboru (věk rozvoje 18, anti-HMGCR 230 U/ ml, CK 160 μkat/l, negativní statinová anamnéza) nebyla histologicky prokázána nekróza svalových vláken. To ukazuje na možnost časné přítomnosti anti-HMGCR předcházející rozvoji klinické manifestace a typického histopatologického obrazu, chybnou volbu svalu pro biopsii, případně na možnost pozitivity i u jiných jednotek.
Data bude nutno ověřit na větším souboru pacientů a určitou limitací této práce je, že velká část informací byla získána retrospektivně. Ovlivněn je především údaj o anamnéze užívání statinů. Ten bývá z klinické dokumentace často obtížně zjistitelný, případně si na užívání statinů pacient nevzpomíná, což může zapříčinit nerozpoznání této jednotky.
Závěr
SINAM je relativně nová vzácná nozologická jednotka, na kterou je nutno pomýšlet v klinické praxi při terapii statiny, i když její existenci, resp. souvislost rozvoje INMN s déledobou medikací statiny, bude nutné ještě definitivně potvrdit. I při potvrzení její existence však zůstávají statiny bezpečnou skupinou léčiv.
V případě rozvoje svalové slabosti v souvislosti s déledobou léčbou statiny je nutné zvážit, zda se nejedná o SINAM a je na místě přerušit terapii hypolipemiky. Dále provést test na anti-HMGCR protilátky a v případě pozitivity zahájit imunosupresivní/imunomodulační terapii, která má ve většině případů dobrý efekt se zvýšením svalové síly.
Stanovení anti-HMGCR se jeví užitečné nejenom v diagnostice této jednotky, ale i v diferenciaci dalších autoimunitních myopatií (zejména PM a IMNM anti-HMGCR+) a je vhodné je indikovat jak při podezření na SINAM, tak i při nálezu nekrotizující myopatie se známkami regenerace a reparace ve svalové biopsii. Na souboru pacientů s autoimunitními myopatiemi je patrný diagnostický překryv SINAM s jinými jednotkami, které se manifestují podobnými klinickými příznaky a elevací CK (PM a IMNM) (obr. 1).
Seznam použitých zkratek
anti-HMGCR – protilátky proti 3-hydroxy-3metylglutaryl-koenzym A reduktáze
anti-SRP – protilátky proti signál rozpoznávajícím částicím
CD – diferenciační skupina
CK – kreatinkináza
DM – dermatomyozitida
ELISA – Enzyme-Linked ImmunoSorbent Assay
EMG – elektromyografie
H&E – hematoxilin-eosin
HLA – hlavní histokompatibilní komplex
INMN – imunitou zprostředkovaná nekrotizující myopatie
IVIG – intravenózní imunoglobuliny
MAC – membrány atakující komplex
MHC – hlavní histopatologický komplex
MR – magnetická rezonance
PM – polymyozitida
SINAM – statiny indukovaná nekrotizující myopatie
STIR – Short Tau Inversion RecoveryTato publikace vznikla na Masarykově univerzitě v rámci projektu MUNI/ A/ 1072/ 2015 podpořeného z prostředků účelové podpory na specifický vysokoškolský výzkum, kterou poskytlo MŠMT v roce 2016. Podpořeno MZ ČR – RVO (FNBr, 65269705).
Autoři práce děkují za spolupráci Revmatologickému ústavu v Praze.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
MUDr. Tomáš Horák
Neurologická klinika LF MU a FN Brno
Jihlavská 20
625 00 Brno
e-mail: horak.tomas@fnbrno.cz
Přijato k recenzi: 24. 5. 2017
Přijato do tisku: 10. 8. 2017
Sources
1. IMS Health. Medicines Use and Spending in the U.S. – A Review of 2015 and Outlook to 2020. [accessed 12 Dec 2016]. Dostupné z URL: http://www.imshealth.com/sites/en/thought-leadership/ims-institute/reports/medicines-use-and-spending-in-the-us-a-review-of-2015-and-outlook-to-2020.
2. Visiongain. Statins: World Market Outlook 2011-2021. [accessed 12 Dec 2016]. Dostupné z URL: https://www.visiongain.com/Report/581/Statins-World-Market-Outlook-2011-2021.
3. Státní ústav pro kontrolu léčiv. Hodnocení vývoje distribuce vybrané skupiny léčivých přípravků – 2. čtvrtletí 2013 – léčivé přípravky pro léčbu poruch tukového metabolismu – dodávky v letech 2002 – 2012 (fibráty, ezetimib, statiny). Dostupné z URL: http://www.sukl.cz/lecive-pripravky-pro-lecbu-poruch-tukoveho-metabolismu.
4. Bednařík J, Vlčková E, Horák T. Statinová myopatie. Neurol Praxi 2017;18(1):15 – 19.
5. Echaniz-Laguna A, Mohr M, Tranchant C. Neuromuscular symptoms and elevated creatine kinase after statin withdrawal. N Engl J Med 2010;362 : 564 – 5. doi: 10.1056/ NEJMc0908215.
6. Basharat P, Christopher-Stine L. Immune-MediatedNecrotizing Myopathy: Update on Diagnosis and Man-agement. Curr Rheumatol Rep 2015;17 : 72. doi: 10.1007/ s11926-015-0548-6.
7. Babu S, Li Y. Statin induced necrotizing autoimmune myopathy. J Neurol Sci 2015;351 : 13 – 7. doi: 10.1016/ j.jns.2015.02.042.
8. Needham M, Fabian V, Knezevic W, et al. Progressive myopathy with up-regulation of MHC-I associated with statin therapy. Neuromuscul Disord NMD 2007;17 : 194 – 200. doi: 10.1016/ j.nmd.2006.10.007.
9. Grable-Esposito P, Katzberg HD, Greenberg SA, et al. Immune-mediated necrotizing myopathy associated with statins. Muscle Nerve 2010;41 : 185 – 90. doi: 10.1002/ mus.21486.
10. Allenbach Y, Drouot L, Rigolet A, et al. Anti-HMGCR autoantibodies in European patients with autoimmune necrotizing myopathies: inconstant exposure to statin. Medicine (Baltimore) 2014;93 : 150 – 7. doi: 10.1097/ MD.0000000000000028.
11. Klein M, Mann H, Pleštilová L, et al. Increasing incidence of immune-mediated necrotizing myopathy: single-centre experience. Rheumatol Oxf Engl 2015;54 : 2010 – 4. doi: 10.1093/ rheumatology/ kev229.
12. Patel S, Rohatgi A, Gupta P. Statin-triggered immune-mediated necrotizing myopathy. Neurol India 2016;64 : 562 – 4. doi: 10.4103/ 0028-3886.181571.
13. McGrath NM, Turner CP. Isolated gluteal and paravertebral muscle weakness due to anti-3-hydroxy-3-methylglutaryl-coenzyme a reductase antibody-associated necrotizing autoimmune myopathy. Muscle Nerve 2016;54 : 150 – 2. doi: 10.1002/ mus.25130.
14. Christopher-Stine L, Casciola-Rosen LA, Hong G, et al. A novel autoantibody recognizing 200-kd and 100-kdproteins is associated with an immune-mediated necrotizing myopathy. Arthritis Rheum 2010;62 : 2757 – 66. doi: 10.1002/ art.27572.
15. Alshehri A, Choksi R, Bucelli R, et al. Myopathy with anti-HMGCR antibodies: Perimysium and myofiber pathology. Neurol Neuroimmunol Neuroinflammation 2015;2:e124. doi: 10.1212/ NXI.0000000000000124.
16. Mammen AL. Statin-Associated Autoimmune Myopathy. N Engl J Med 2016;374 : 664 – 9. doi: 10.1056/ NEJMra1515161.
17. Zeitlinger M, Müller M. [Clinico-pharmacologic explanation models of cerivastatin associated rhabdomyolysis]. Wien Med Wochenschr 2003;153 : 250 – 4.
18. Limaye V, Bundell C, Hollingsworth P, et al. Clinical and genetic associations of autoantibodies to 3-hydroxy-3-methyl-glutaryl-coenzyme a reductase in patients with immune-mediated myositis and necrotizing myopathy. Muscle Nerve 2015;52 : 196 – 203. doi: 10.1002/ mus.24541.
19. Mammen AL, Gaudet D, Brisson D, et al. Increased frequency of DRB1*11 : 01 in anti-hydroxymethylglutaryl-coenzyme A reductase-associated autoimmune myopathy. Arthritis Care Res 2012;64 : 1233 – 7. doi: 10.1002/ acr.21671.
20. Morikawa S, Murakami T, Yamazaki H, et al. Analysis of the global RNA expression profiles of skeletal muscle cells treated with statins. J Atheroscler Thromb 2005;12 : 121 – 31.
21. Watanabe Y, Suzuki S, Nishimura H, et al. Statins and myotoxic effects associated with anti-3-hydroxy-3-methylglutaryl-coenzyme A reductase autoantibodies: an observational study in Japan. Medicine (Baltimore) 2015;94:e416. doi: 10.1097/ MD.0000000000000416.
22. Mammen AL, Chung T, Christopher-Stine L, et al. Autoantibodies against 3-hydroxy-3-methylglutaryl-coenzyme A reductase in patients with statin-associated autoimmune myopathy. Arthritis Rheum 2011;63 : 713 – 21. doi: 10.1002/ art.30156.
23. Martini C, Trapani L, Narciso L, et al. 3-hydroxy 3-methylglutaryl coenzyme A reductase increase is essential for rat muscle differentiation. J Cell Physiol 2009;220 : 524 – 30. doi: 10.1002/ jcp.21810.
24. Trapani L, Segatto M, La Rosa P, et al. 3-hydroxy 3-meth-ylglutaryl coenzyme A reductase inhibition impairs muscle regeneration. J Cell Biochem 2012;113 : 2057 – 63. doi: 10.1002/ jcb.24077.
25. Vanderlugt CL, Miller SD. Epitope spreading in immune-mediated diseases: implications for immunotherapy. Nat Rev Immunol 2002;2 : 85 – 95. doi: 10.1038/ nri724.
26. Wattjes MP, Fischer D. Neuromuscular imaging. New York: Springer-Verlag 2013.
27. Mammen AL, Pak K, Williams EK, et al. Rarity of anti-3-hydroxy-3-methylglutaryl-coenzyme A reductase antibodies in statin users, including those with self-limited musculoskeletal side effects. Arthritis Care Res 2012;64 : 269 – 72. doi: 10.1002/ acr.20662.
28. Werner JL, Christopher-Stine L, Ghazarian SR, et al. Antibody levels correlate with creatine kinase levels and strength in anti-3-hydroxy-3-methylglutaryl-coenzyme A reductase-associated autoimmune myopathy. Arthritis Rheum 2012;64 : 4087 – 93. doi: 10.1002/ art.34673.
29. Allenbach Y, Keraen J, Bouvier A-M, et al. High risk of cancer in autoimmune necrotizing myopathies: usefulness of myositis specific antibody. Brain J Neurol 2016;139 : 2131 – 5. doi: 10.1093/ brain/ aww054.
30. Joseph CG, Darrah E, Shah AA, et al. Association of the autoimmune disease scleroderma with an immunologic response to cancer. Science 2014;343 : 152 – 7. doi: 10.1126/ science.1246886.
31. Liang C, Needham M. Necrotizing autoimmune myopathy. Curr Opin Rheumatol 2011;23 : 612 – 9. doi: 10.1097/ BOR.0b013e32834b324b.
32. Chung T, Christopher-Stine L, Paik JJ, et al. The composition of cellular infiltrates in anti-HMG-CoA reductase-associated myopathy. Muscle Nerve 2015;52 : 189 – 95. doi: 10.1002/ mus.24642.
33. Tidball JG. Mechanisms of muscle injury, repair, and regeneration. Compr Physiol 2011;1 : 2029 – 62. doi: 10.1002/ cphy.c100092.
34. Needham M, Mastaglia FL. Immunotherapies for Immune-Mediated Myopathies: A Current Perspective. Neurother J Am Soc Exp Neurother 2016;13 : 132 – 46. doi: 10.1007/ s13311-015-0394-2.
35. Ramanathan S, Langguth D, Hardy TA, et al. Clinical course and treatment of anti-HMGCR antibody-associated necrotizing autoimmune myopathy. Neurol Neuroimmunol Neuroinflammation 2015;2:e96. doi: 10.1212/ NXI.0000000000000096.
36. Watad A, Soriano A, Vaknine H, et al. Immune Mediated Myopathy following Long-Term Statin Therapy. Isr Med Assoc J IMAJ 2015;17 : 128 – 9.
37. Mammen AL, Tiniakou E. Intravenous Immune Glo-bulin for Statin-Triggered Autoimmune Myopathy. N Engl J Med 2015;373 : 1680 – 2. doi: 10.1056/ NEJMc1506163.
38. Dalakas MC. Controlled studies with high-dose intravenous immunoglobulin in the treatment of dermatomyositis, inclusion body myositis, and polymyositis. Neurology 1998;51:S37 – 45.
39. Mosca M, Strigini F, Carmignani A, et al. Pregnant patient with dermatomyositis successfully treated with intravenous immunoglobulin therapy. Arthritis Rheum 2005;53 : 119 – 21. doi: 10.1002/ art.20913.
40. Kadoya M, Hida A, Hashimoto Maeda M, et al. Cancer association as a risk factor for anti-HMGCR antibody-positive myopathy. Neurol Neuroimmunol Neuroinflammation 2016;3:e290. doi: 10.1212/ NXI.0000000000000290.
41. Allenbach Y, Benveniste O. Acquired necrotizing myopathies. Curr Opin Neurol 2013;26 : 554 – 60. doi: 10.1097/ WCO.0b013e328364e9d9.
42. Dalakas MC. Necrotising autoimmune myopathy (NAM): antibodies seem to be specific markers in aiding diagnosis. J Neurol Neurosurg Psychiatry 2016;87 : 1037. doi: 10.1136/ jnnp-2016-313418.
43. Basharat P, Lahouti AH, Mammen AL, et al. Diabetes and Atorvastatin Are Potential Risk Factors for Statin-associated Myopathy with Autoantibodies Against 3-hydroxy-3-methylglutaryl-coenzyme a Reductase. Arthritis Rheumatol 2014;66:S554.
Labels
Paediatric neurology Neurosurgery Neurology
Article was published inCzech and Slovak Neurology and Neurosurgery

2017 Issue 5-
All articles in this issue
- Terapia pokročilých štádií Parkinsonovej choroby invazívnymi postupmi
- Neurorehabilitace chůze po cévní mozkové příhodě
- Esenciální tremor – vzniká nový nozologický koncept?
- Leberova hereditární neuropatie optiku
- Funkce lícního nervu po mikrochirurgické léčbě vestibulárního schwannomu
- Prevalence kouření u středoevropských pacientů s narkolepsií s kataplexií, narkolepsií bez kataplexie a idiopatickou hypersomnií
- Zhodnocení dlouhodobého prospívání pacientů po operaci intramedulárního kavernomu
- Statiny indukovaná nekrotizující autoimunitní myopatie
- Elektrostimulace suprahyoidních svalů u pacientů po cévní mozkové příhodě s dysfagií
- Intraventrikulární meningiomy – retrospektivní studie 19 případů
- Varianta p.Val66Met v genu pro mozkový neurotrofní faktor (BDNF) v české populaci
- Dva případy atypického teratoidního rhabdoidního tumoru CNS a přehled literatury
- Teplotní management u pacientů podstupujících plánovaný spondylochirurgický výkon v pronační poloze – prospektivní randomizovaná studie
- Aminoguanidin podávaný subchronicky intrahipokampálně zlepšuje u diabetických potkanů plnění úkolů pasivního vyhýbání a expresi genů z rodiny Bcl-2
- Kazuistika meningitidy dospělých způsobená bakterií Escherichia coli
- Czech and Slovak Neurology and Neurosurgery
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Esenciální tremor – vzniká nový nozologický koncept?
- Leberova hereditární neuropatie optiku
- Statiny indukovaná nekrotizující autoimunitní myopatie
- Terapia pokročilých štádií Parkinsonovej choroby invazívnymi postupmi
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

