-
Medical journals
- Career
Kognitivní funkce u pacientů s nízkostupňovými gliomy – přehledová studie
Authors: K. Schönová 1; S. Weissenberger 2; M. Preiss 3; P. Harsa 2
Authors‘ workplace: Dětská psychiatrická nemocnice Louny 1; Psychiatrická klinika 1. LF UK a VFN v Praze 2; Národní ústav duševního zdraví, Klecany 3
Published in: Cesk Slov Neurol N 2017; 80/113(4): 396-399
Category: Review Article
doi: https://doi.org/10.14735/amcsnn2017396Overview
Přehledový článek přibližuje a shrnuje problematiku kognitivních funkcí u pacientů s nízkostupňovými gliomy. Gliomy samotné i jejich léčba mají negativní vliv na kognitivní funkce pacientů. Poškození kognitivních funkcí u pacientů s nízkostupňovými gliomy ovlivňuje také kvalitu jejich života, která koreluje s délkou předpokládaného přežití. Jedná se o poměrně novou oblast zkoumání, ale ukazuje se její důležitost, kterou odráží počet publikovaných prací. Hlavním záměrem tohoto článku je přiblížit a zdůraznit danou problematiku a podílet se tak na rozvoji a zkvalitnění odborné péče o pacienty s nízkostupňovými gliomy.
Klíčová slova:
nízkostupňové gliomy – kognitivní funkce – rehabilitace kognitivních funkcí – kvalita životaČlenění gliomů a jejich léčba
Gliomy jsou nádory pocházející z buněk podpůrné mozkové tkáně – neuroglií. Patří tedy mezi primární nitrolebeční nádory [1].
Gliomy tvoří největší skupinu neuroepitelových nádorů. Zahrnují astrocytomy, oligendrogliomy a ependymomy [2].
V etiologii tumorů hrají roli genetické predispozice i environmentální faktory. U velkého počtu tumorů byly identifikovány strukturální změny na chromozomech a genetické alterace [3].
Mezi nejčastější symptomy mozkových nádorů náleží bolesti hlavy, křeče, hemiparéza a mentální poruchy [1]. Ve výjimečných případech se mohou objevit psychotické projevy, které jsou farmakorezistentní [4].
Gliomy jsou stejně jako další tumory rozděleny na základě histologických charakteristik od stupně 1 do stupně 4. Korelace mezi histologickým vzhledem a biologickým chováním nádoru často variuje. Nádory mají tendenci k maligní transformaci. Průměrná doba přežití s nádorem druhého stupně je 5 – 10 let, s nádorem čtvrtého stupně 1 – 1,5 roku [3].
Přesně určený postup léčby nízkostupňových gliomů neexistuje. Nejpodstatnější je chirurgický zákrok, v rámci kterého dochází k odebrání vzorku a určení přesné diagnózy a gradingu. V současné době bývá nejčastějším zákrokem maximální bezpečná resekce nádoru, která snižuje možnost budoucí maligní transformace. Sporná bývá otázka radioterapie, a to zejména v ohledu jejího načasování [2].
Změny a vývoj v přístupech léčby, stejně jako potíže, se kterými se pacienti při léčbě potýkají, odráží výzkum [5], jenž ukázal, že pacienti, kteří se s nízkostupňovými gliomy léčili během let 1960 – 1989, měli častěji záchvaty, bolesti hlavy a motorické či senzorické poškození než pacienti, kteří prodělali léčbu mezi roky 1990 a 2011.
Kognitivní funkce pacientů s nízkostupňovými gliomy
S pokroky a změnami v léčbě se pozornost odborníků více věnuje kognitivním funkcím pacientů s nízkostupňovými gliomy. Počet výzkumů na téma gliomy a kognitivní funkce v posledních letech prudce vzrostl. Mnohým publikacím však musíme vytknout opomíjení lokalizace tumoru a malý počet participantů.
Kognitivní funkce jsou předpokladem adaptivního fungování člověka. Řadí se k nim pozornost, paměť, rychlost zpracování, ale i funkce exekutivní, které řídí lidské konání. Exekutivní funkce jsou mentální procesy sloužící přiměřenému, cílenému a plánovitému konání člověka. Jedná se např. o iniciaci konání, flexibilitu, inhibici, průběžné sledování vlastních kognitivních výkonů (monitoring), řešení problémů, plánování, regulaci chování, jakož i emocionality [6]. Poškození kognitivních funkcí má negativní efekt na sebeobsluhu, soběstačnost i mezilidské vztahy a odráží se na kvalitě života.
Procento pacientů, které poškození kognitivních funkcí postihuje, se mezi jednotlivými studiemi výrazně liší (27 – 83 %) [7 – 9]. Takto velké rozpětí lze vysvětlit rozdíly v metodologii studií vč. rozdílného vymezení pojmu kognitivní deficit, dále použitím odlišných neuropsychologických metod a zaměřením na různé kognitivní domény. Pro ukázku rozmanitosti výzkumů uvádíme tab. 1.
Table 1. Míra poškození kognitivních funkcí u pacientů s nízkostupňovými gliomy ve vybraných publikacích. 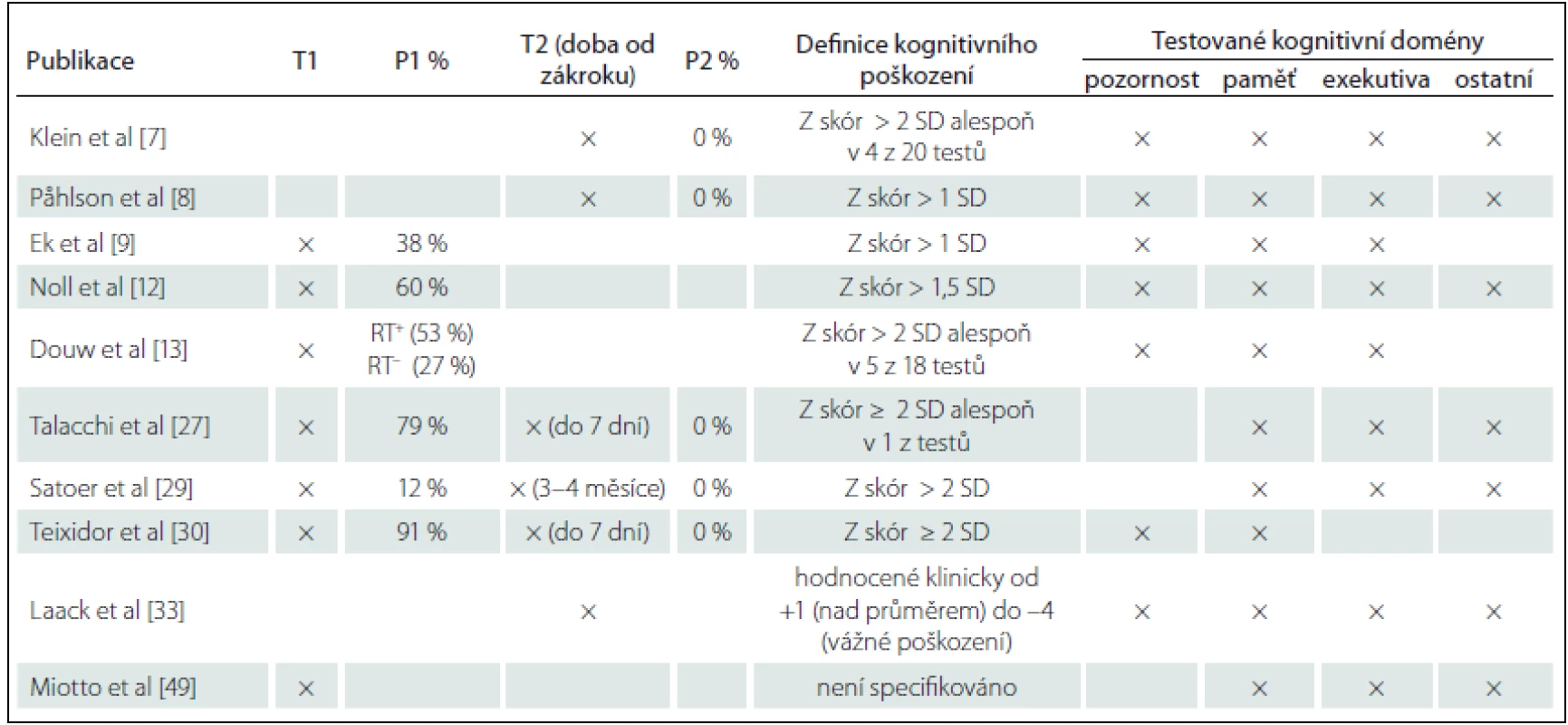
× – přítomno, T1 – testování před zákrokem, T2 – testování po zákroku, P1 % – procento pacientů s poškozením kognitivních funkcí před zákrokem P2 % – procento pacientů s poškozením kognitivních funkcí po zákroku, RT+ – pacienti, kteří podstoupili radioterapii, RT– – pacienti, kteří nepodstoupili radioterapii. Etiologie kognitivních deficitů je komplexní. Kromě neurologického poškození způsobeného gliomem samotným má vliv zvolený způsob terapie a délka trvání onemocnění, medikace a další léčba [10 – 13]. Ačkoli tyto deficity nebývají vážné, negativně ovlivňují kvalitu života pacientů. Navíc subjektivně vnímané deficity kognitivních funkcí patří mezi nejčastější problémy pacientů s mozkovým tumorem [14 – 16].
Míra kognitivního poškození, zejména deficity exekutivních funkcí a paměti, korelují s délkou přežití [17].
Úbytek kognitivních funkcí můžeme pozorovat ještě před zjistitelnými biologickými změnami. Meyers et al hodnotili skupinu 56 pacientů s opakovanými mozkovými tumory [18]. Zaměřovali se na kognitivní funkce, kvalitu života a schopnost vykonávat každodenní aktivity. Všimli si, že pokles kognitivních funkcí zjistitelný neuropsychologickými metodami nastal 6 týdnů před tím, než byly změny rozpoznatelné radiograficky.
Poškození kognitivních funkcí v závislosti na charakteristikách a lokalizaci tumoru
Poškození kognitivních funkcí se liší v závislosti na gradingu. Pacienti s gliomy nižších stupňů mívají obvykle deficity mírnější. Není to však pravidlo. Poškození kognitivních funkcí může být přítomno i u raného stadia nemoci [9].
Tucha et al dokumentovali výskyt kognitivního zhoršení u pacientů s mozkovým tumorem frontálních nebo temporálních laloků ihned po diagnóze, před započetím léčby [19]. Poškození klasifikovali jako výsledek pod úrovní 10. percentilu. Více než 90 % pacientů vykazovalo poškození minimálně v jedné oblasti kognice. Poškození více oblastí kognitivních funkcí bylo pozorováno u 78 % pacientů, poškození paměti a pozornosti bylo pozorováno u více než 60 % pacientů. Vztah mezi testovými výsledky a odhady samotných pacientů byl pouze slabý.
Vliv lokalizace tumoru je zřetelný zejména u pacientů s mírným poškozením kognitivních funkcí, kde se deficit objevuje v jednotlivých doménách. U pacientů s vážně poškozenými kognitivními funkcemi pozorujeme deficit ve většině kognitivních domén [20].
Mnoho výzkumů odráží rozdílné poškození kognitivních funkcí u pacientů s gliomem v levé a pravé mozkové hemisféře.
Lokalizace tumoru v levé mozkové hemisféře je spjata s vážnějším poškozením kognitivních funkcí. Jedná se zejména o zhoršení paměti, verbálního učení, pozornosti a exekutivních funkcí. Pacienti s levostranně orientovaným gliomy hůře rozeznávají hněv ve výrazu osob. Rozdíly v rozeznání dalších emocí nebyly ve srovnání s kontrolní skupinou statisticky významné [15]. V normě je u pacientů s levostranným gliomem rychlost zpracování informací, vizuálně-prostorové schopnosti a motorické funkce [7,9,21].
Poškození motorických schopností, které se objevuje zvláště u pacientů s tumorem lokalizovaným pravostranně, pravděpodobně souvisí s větší zranitelností nedominantní hemisféry [21].
Epilepsie, jež se s nízkostupňovými gliomy často pojí, s sebou přináší zhoršení kognitivních funkcí i kvality života. Na poškození kognitivních funkcí má vliv její závažnost – u těžších forem se vyskytují deficity výraznější [22].
Vliv léčby na kognitivní funkce u pacientů s nízkostupňovými gliomy
Vliv léčby na míru specifického poškození kognitivních funkcí je sporný [23 – 25].
Ukazuje se, že resekce gliomu z krátkodobého hlediska kognitivní funkce zhoršuje, avšak z dlouhodobé perspektivy má na kognitivní funkce pozitivní efekt [25 – 29]. Teixidor et al tvrdí, že resekce gliomů blízko jazykových oblastí zvyšuje riziko mírných kognitivních deficitů, které jsou déletrvající [30].
Použití radioterapie je v léčbě nízkostupňových gliomů kontroverzní zejména kvůli její toxicitě, která se může projevit i s postupem času. Radioterapie může vyvolat encefalopatii způsobující deficity kognitivních funkcí [31,32].
Douw et al zkoumali kognitivní abnormality u pacientů, kteří se v minulosti léčili s nízkostupňovými gliomy (průměr 12 let od první diagnózy) [13]. Srovnávali pacienty, kteří podstoupili radioterapii, s těmi bez ní. Pacienti, kteří nepodstoupili radioterapii, měli stabilní radiologický a kognitivní stav. Ti, kteří radioterapii absolvovali, vykazují progresivní pokles v pozornosti.
Ve výzkumu realizovaném Laackem et al byl kognitivní stav pacientů s nízkostupňovými gliomy, kteří prodělali radiologickou léčbu, stabilní [33]. Kognitivní funkce pacientů byly po 3 letech mírně lepší, zlepšení však nebylo statisticky významné. Možnost zlepšení kognitivních funkcí potvrzují i další výzkumy [34].
Negativní vliv na pozornost a paměť má léčba antiepileptiky, a to zejména při vysokém dávkování či polyterapii. Větší riziko kognitivního deficitu je při léčbě antiepileptiky pro starší osoby a děti [22,35].
Subjektivně vnímané poškození kognitivních funkcí
Subjektivně vnímané deficity kognitivních funkcí patří mezi nejčastější problémy pacientů s mozkovým tumorem [14 – 16] a mají negativní vliv na jejich život.
Nejčastější stížnosti pacientů se týkají vybavení si nově získaných informací, narušení soustředění, mentální únavy, pomalého myšlení, obtíží v převzetí iniciativy, problémy s rozdělováním pozornosti [36].
Ukazuje se, že míra subjektivně vnímaného poškození kognitivních funkcí se od objektivního poškození může velmi lišit [19]. Při subjektivním posouzení hrají roli také osobnostní charakteristiky pacienta či míra úzkostnosti. Negativně zde působí i dlouhé trvání nemoci a užívání antiepileptik [7].
Kognitivní trénink pomocí počítačových programů a další intervence mající vliv na větší kvalitu života
Pozitivní efekt na objektivní i subjektivní stav kognice by pravděpodobně měla rehabilitace kognitivních funkcí, která se využívá u pacientů s různými kognitivními poškozeními [37].
Rehabilitaci kognitivních funkcí lze v širší pojetí chápat jako opětovnou adaptaci na situace každodenního života. V užším pojetí chápeme kognitivní trénink jako systematické úsilí o zlepšení kognitivních funkcí [37].
S rozvíjejícím se využíváním počítačových simulací roste i počet studií zkoumajících vliv a efekt kognitivního tréninku pomocí počítačových programů a internetových intervencí (např. [38 – 44]). Tyto programy by mohly přispět nejen ke zlepšení kognitivních funkcí, ale i redukci negativních emocí, které pacienti prožívají. To by přispělo ke zkvalitnění a prodloužení jejich života [45 – 48].
Závěr
Primárním cílem této práce bylo přiblížit problematiku deficitů kognitivních funkcí u pacientů s nízkostupňovými gliomy. V poslední době roste počet prací, které se tímto tématem zabývají. Jejich výsledky jsou často velmi odlišné. Příčinami může být např. nejednotnost používaných neuropsychologických testů či rozdílné vymezení kognitivního deficitu. Na kognitivní deficit má vliv grading nádoru, kdy u vyššího gradingu shledáváme větší poškození kognitivních funkcí [9]. Odlišnosti v poškození kognitivních funkcí vidíme také na základě lateralizace. Lokalizace tumoru v levé mozkové hemisféře je spjata s vážnějším poškozením kognitivních funkcí. Poškození motorických schopností se objevuje zejména u pacientů s gliomem v pravé hemisféře [7,9,15,21]. Na kognitivní funkce může mít vliv i radioterapie, a to zvláště kvůli toxicitě způsobující encefalopatii [31,32]. Negativní vliv má též komorbidně se vyskytující epilepsie [22] a její léčba [22,35]. Vliv samotné resekce je sporný [30].
Na kognitivní funkce pacientů s nízkostupňovými gliomy by pravděpodobně pozitivní vliv rehabilitace kognitivních funkcí. Její efekt je nutno výzkumně ověřit.
Podpořeno grantem PRVOUK P03/ LF1/ 9.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Mgr. Kateřina Schönová
Dětská psychiatrická nemocnice Louny
Rybalkova 1400
440 01 Louny
e-mail: katerinaschonova@gmail.com
Přijato k recenzi: 1. 6. 2016
Přijato do tisku: 9. 5. 2017
Sources
1. Klener P, Abrahámová J, Fait V, et al. Klinická onkologie. Praha: Galén 2000.
2. Šlampa P. Gliomy: současná diagnostika a léčba. Praha: Maxdorf 2013.
3. Haberland C. Clinical neuropathology: text and color atlas. New York: Demos Medical Publishing 2007.
4. Singh D, Kapoor A, Khadda S, et al. Psychotic manifestations as an initial presentation in glioma: two case reports and review of literature. Neuropsychiatria i Neuropsychologia 2013;9(1):1 – 3.
5. Youland RS, Schomas DA, Brown PD, et al. Changes in presentation, treatment, and outcomes of adult low-grade gliomas over the past fifty years. Neuro Oncol 2013;15(8):1102 – 10. doi: 10.1093/ neuonc/ not080.
6. Kulišťák P, et al. Případové studie z klinické neuropsychologie. Praha: Karolinum 2011.
7. Klein M, Heimans JJ, Aaronson NK, et al. Effect of radiotherapy and other treatment-related factors on mid-term to long-term cognitive sequelae in low-grade gliomas: a comparative study. Lancet 2002;360(9343):1361 – 8.
8. Påhlson A, Ek L, Ahlström G, et al. Pitfalls in the assessment of disability in individuals with low-grade gliomas. J Neurooncol 2003;65(2):149 – 58.
9. Ek L, Almkvist O, Kristoffersen Wiberg M, et al. Early cognitive impairment in a subset of patients with presumed low-grade glioma. Neurocase 2010;16(6):503 – 11. doi: 10.1080/ 13554791003730634.
10. Lilja AM, Portin RI, Hämäläinen PI, et al. Short-term effects of radiotherapy on attention and memory performances in patients with brain tumors. Cancer 2001;91(12):2361 – 8.
11. Correa DD, DeAngelis LM, Shi W, et al. Cognitive functions in low-grade gliomas: disease and treatment effects. J Neurooncol 2007;81(2):175 – 84.
12. Noll KR, Sullaway C, Ziu M, et al. Relationships between tumor grade and neurocognitive functioning in patients with glioma of the left temporal lobe prior to surgical resection. Neuro-Oncol 2015;17(4):580 – 7. doi: 10.1093/ neuonc/ nou233.
13. Douw L, Klein M, Fagel S, et al. Cognitive and radiological effects of radiotherapy in patients with low-grade glioma: long-term follow-up. Lancet Neurol 2009;8(9):810 – 8. doi: 10.1016/ S1474-4422(09)70204-2.
14. Gehring K, Aaronson N, Gundy C, et al. M. Predictors of Neuropsychological Improvement Following Cognitive Rehabilitation in Patients with Gliomas. J Int Neuro-psychol Soc 2011;17(2):256 – 66. doi: 10.1017/ S135561771000 1530.
15. MuY, Huang L, Li S, et al. Working memory and the identification of facial expression in patients with left frontal glioma. Neuro Oncol 2012;14(4):81 – 9. doi: 10.1093/ neuonc/ nos215.
16. Reijneveld J, Sitskoorn M, Klein M, et al. Cognitive status and quality of life in patients with suspected versus proven low-grade gliomas. Neurology 2001;56(5):618 – 23.
17. Johnson DR, Sawyer AM, Meyers CA, et al. Early measures of cognitive function predict survival in patients with newly diagnosed glioblastoma. Neuro Oncol 2012;14(6):808 – 16. doi: 10.1093/ neuonc/ nos082.
18. Meyers CA, Hess KR. Multifaceted end points in brain tumor clinical trials: cognitive deterioration precedes MRI progression. Neuro Oncol 2003;5(2):89 – 95.
19. Tucha O, Smely C, Preier M, et al. Cognitive deficits before treatment among patients with brain tumors: methodological issues and results. Neurosurgery 2000;47(2):69 – 90.
20. Ek L, Smits A, Påhlson A, et al. Analysis of Cognitive Dysfunction in Patients with Low-Grade Glioma. J Clin Psychol Med Settings 2005;12(2):165 – 73.
21. Noll KR, Ziu M, Weinberg JS, et al. Neurocognitive functioning in patients with glioma of the left and right temporal lobes. J Neurooncol 2016;128(2):323 – 31. doi: 10.1007/ s11060-016-2114-0.
22. Klein M, Engelberts NH, van der Ploeg HM, et al. Epilepsy in low-grade gliomas: The impact on cognitive function and quality of life. Ann Neurol 2003;54(4):514 – 20.
23. Plaza M, Capelle L, Maigret G, et al. Strengths and weaknesses of multimodal processing in a group of adults with gliomas. Neurocase 2013;19(3):302 – 12. doi: 10.1080/ 13554794.2012.667128.
24. Boone M, Roussel M, Chauffert B, et al. Prevalence and profile of cognitive impairment in adult glioma: a sensitivity analysis. J Neurooncol 2016;129(1):123 – 30. doi: 10.1007/ s11060-016-2152-7.
25. Duffau, H, Capelle, L, Denvil, D, et al. Usefulness of intraoperative electrical subcortical mapping during surgery for low-grade gliomas located within eloquent brain regions: functional results in a consecutive series of 103 patients. J Neurosurg 2003;98(4):764 – 78.
26. Raysi DS, Mariano M, Mazza M, et al. Cognitive deficits in patients with low and high-grade gliomas. J Neurosurg Sci 2013;57(3):259 – 66.
27. Talacchi A, Santini B, Savazzi S, et al. Cognitive effects of tumour and surgical treatment in glioma patients. J Neurooncol 2011;103(3):541 – 9. doi: 10.1007/ s11060-010-0417-0.
28. Sanai N, Mirzadeh Z, Berger MS. Functional outcome after language mapping for glioma resection. N Engl J Med 2008;358(1):18 – 27. doi: 10.1056/ NEJMoa067819.
29. Satoer D, Vork J, Visch-Brink E, et al. Cognitive functioning early after surgery of gliomas in eloquent areas: clinical article. J Neurosurg 2012;117(5):831 – 8. doi: 10.3171/ 2012.7.JNS12263.
30. Teixidor P, Gatignol P, Leroy M, et al. Assessment of verbal working memory before and after surgery for low-grade glioma. J Neurooncol 2007;81(3):305 – 13.
31. Chan MD. Recent technical advances and indications for radiation therapy in low-grade glioma. Semin Radiat Oncol 2015;25(3):189 – 96. doi: 10.1016/ j.semradonc.2015.02.001.
32. Brown PD, Jaeckle K, Ballman KV et al. Effect of radiosurgery alone vs radiosurgery with whole brain radiation therapy on cognitive function in patients with 1 to 3 brain metastases: a randomized clinical trial. JAMA 2016;316(4):401 – 9. doi: 10.1001/ jama.2016.9839.
33. Laack, NN, Brown, PD, Ivnik, RJ et al. Cognitive function after radiotherapy for supratentorial low-grade glioma: a North Central Cancer Treatment Group prospective study. Int J Radiat Oncol Biol Phys 2005;63(4):1175 – 83.
34. Brown PD, Buckner JC, O’Fallon JR, et al. Effects of radiotherapy on cognitive function in patients with low-grade glioma measured by the folstein mini-mental state examination. J Clin Oncol 2003;21(13):2519 – 24.
35. Ortinski P, Meador KJ. Cognitive side effects of anti-epileptic drugs. Epilepsy Behav 2004;5 : 60 – 5.
36. Edvardsson T, Ahlström G. Illness-related problems and coping among persons with low-grade glioma. Psychooncology 2005;14(9):728 – 37.
37. Kulišťák P. Neuropsychologie. Praha: Portál 2003.
38. Elgamal S, McKinnon M, Ramakrisnan K, et al. Success-ful computer-assisted cognitive remediation therapy in patients with unipolar depression: a proof of principle study. Psychol Med 2007;37(9):1229 – 38.
39. Peretz C, Korczyn A, Shatil E, et al. Computer-based, personalized cognitive training versus classical computer games: a randomized double-blind prospective trial of cognitive stimulation. Neuroepidemiology 2011;36(2):91 – 9. doi: 10.1159/ 000323950.
40. Alvarez LM, Sotres JFC, León SO, et al. Computer program in the treatment for major depression and cognitive impairment in university students. Comput Human Behav 2008;24(3):816 – 26.
41. Andersson G, Cuijpers P. Internet-based and other computerized psychological treatments for adult depression: a meta-analysis. Cogn Behav Ther 2009;38(4): 196 – 205. doi: 10.1080/ 16506070903318960.
42. Čermáková R, Rodriguez M, Preiss M. Rehabilitace kognitivních funkcí on-line: možnosti programu cognifit. Psychiatrie 2010;14(3):76 – 9.
43. Chmelařová D, Ambler Z, Dostál M, et al. Rehabilitace kognitivních funkcí u pacientů s roztroušenou sklerózou. Cesk Slov Neurol N 2014;77/ 110(6):677 – 83.
44. Boele FW, Leeuw IMV, Cuijpers P, et al. Internet-based guided self-help for glioma patients with depressive symptoms: design of a randomized controlled trial. BMC Neurol 2014;14 : 81. doi: 10.1186/ 1471-2377-14-81.
45. Boullaya V, Plazab M, Perraulta A, et al. Atypical crossmodal emotional integration in patients with gliomas. Brain Cogn 2014;1(92):92 – 100. doi: 10.1016/ j.bandc.2014.10.003.
46. Hahn C, Dunn R, Logue P, et al. Prospective study of neuropsychologic testing and quality-of-life assessment of adults with primary malignant brain tumors. Int J Radiat Oncol Biol Phys 2003;55(4):992 – 9.
47. Pringle A, Taylor R, Whittle I. Anxiety and depression in patients with an intracranial neoplasm efore and after tumour surgery. Br J Neurosurg 1999;13(1):46 – 51.
48. Mainio A, Tuunanen S, Hakko H, et al. Decreased quality of life and depression as predictors for shorter survival among patients with low-grade gliomas: a follow-up from 1990 to 2003. Eur Arch Psychiatry Clin Neurosci 2006;256(8):516 – 21.
49. Miotto EC, Junior AS, Silva CC, et al. Cognitive impairments in patients with low grade gliomas and high grade gliomas. Arq Neuropsiquiatr 2011;69(4):596–601.
Labels
Paediatric neurology Neurosurgery Neurology
Article was published inCzech and Slovak Neurology and Neurosurgery

2017 Issue 4-
All articles in this issue
- Ataxie
- Pacient s hemiplegií má být vezen přímo do KCC
- Pacient s hemiplegií nemá být vezen přímo do KCC
- Má být pacient s hemiplegií vezen přímo do KCC?
- Kognitivní funkce u pacientů s nízkostupňovými gliomy – přehledová studie
- Klinický přínos radiologických parametrů u lumbální spinální stenózy
- Neurosonologické markery predikce kognitivní deteriorace
- Český národní registr Guillainova-Barrého syndromu
- Možné využití spánkové endoskopie pro zvýšení efektivity léčby (operační i neoperační) u pacientů s obstrukční spánkovou apnoí
- Poranění periferních nervů při suprakondylických zlomeninách humeru u dětí
- Systematická evaluace center provádějících mechanické trombektomie u akutního mozkového infarktu v České republice za rok 2016
- Klinický pohled otorinolaryngologa a radiologa na klasifikaci zlomenin spánkové kosti
- Zkušenosti s použitím thuliového laseru RevoLix Jr při resekci glioblastomu – kazuistiky
- Disekce všech čtyř přívodných mozkových tepen v terénu fibromuskulární dysplazie – kazuistika
- Intravenózní trombolýza po zrušení účinku dabigatranu specifickým antidotem idarucizumabem
- Doporučený postup České pneumologické a ftizeologické společnosti a České společnosti dětské pneumologie pro dlouhodobou domácí léčbu poruch expektorace pomocí přístroje CoughAssist
- Prevalence Martin-Gruberovy anastomózy – elektrofyziologie studie
- Predikce úmrtnosti na neurochirurgické jednotce intenzivní péče
- Vliv různých technik pracovních terapií na pacienty po mozkové mrtvici
- Comment of Article The Effect of Different Occupational Therapy Techniques on Post-stroke Patients
- Czech and Slovak Neurology and Neurosurgery
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Český národní registr Guillainova-Barrého syndromu
- Klinický pohled otorinolaryngologa a radiologa na klasifikaci zlomenin spánkové kosti
- Doporučený postup České pneumologické a ftizeologické společnosti a České společnosti dětské pneumologie pro dlouhodobou domácí léčbu poruch expektorace pomocí přístroje CoughAssist
- Poranění periferních nervů při suprakondylických zlomeninách humeru u dětí
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

