-
Medical journals
- Career
Myxovirus resistance protein A v terapii interferony-β u pacientů s roztroušenou sklerózou a algoritmus sledování účinnosti léčby
Authors: J. Libertínová 1; E. Meluzínová 1; E. Havrdová 2; D. Horáková 2; I. Kovářová 2; E. Hynčicová 1; P. Lišková 1; E. Houžvičková 1; V. Maťoška 3; M. Zajac 4; A. Tomek 1; M. Bojar 1; P. Marusič 1
Authors‘ workplace: Neurologická klinika 2. LF UK a FN v Motole, Praha 1; Neurologická klinika a Centrum klinických neurověd, 1. LF UK a VFN v Praze 2; Laboratoř molekulární diagnostiky, Nemocnice Na Homolce, Praha 3; Ústav lékařské mikrobiologie, 2. LF UK a FN v Motole, Praha 4
Published in: Cesk Slov Neurol N 2016; 79/112(5): 547-551
Category: Original Paper
Overview
Úvod:
Interferony-β (IFNβ) patří mezi léky první volby v terapii roztroušené sklerózy. Myxovirus resistance protein A (MxA) je považován za marker účinnosti IFNβ. Odpovídavost na léčbu IFNβ může být snížena přítomností neutralizačních protilátek (NAbs).Soubor a metodika:
Ve skupině pacientů zahajujících léčbu IFNβ jsme po dobu 24 měsíců prospektivně sledovali výskyt NAbs a expresi mRNA MxA. mRNA MxA byla vyšetřována real-time PCR každé tři měsíce, při opakovaném poklesu následoval MxA indukční test. NAbs byly stanovovány každých šest měsíců pomocí metody cytopatického efektu. Pacienti byli pravidelně sledováni klinicky i pomocí MR.Výsledky:
Do sledování bylo zařazeno 119 pacientů, z nichž 99 jej dokončilo. Pozitivita NAbs se objevila u 17 pacientů, nejčastěji v měsíci 12 a 18, u 10 pacientů (10 %) zůstala trvale. Při NAbs v titru 20–100 TRU/ml kleslo MxA pod cut-off v 85 % případů, při titru > 100 TRU/ml ve 100 %. Opakovaný pokles MxA pod cut-off jsme zaznamenali u 19 (19 %) pacientů – u všech pacientů s trvalou NAbs pozitivitou (10 pacientů), u některých s přechodnou pozitivitou NAbs (u třech z pěti takových pacientů) a také u šesti pacientů bez NAbs. MxA indukční test byl nedostatečný u všech pacientů s trvalou NAbs pozitivitou. Nedostatečný byl navíc i u dvou pacientů s poklesem MxA bez NAbs. Pokles MxA předcházel obecně vzniku NAbs ve 40 % případů.Závěr:
MxA se stává hlavním laboratorním ukazatelem účinnosti IFNβ, neboť zachytí pacienty s podezřením na ztrátu účinnosti IFNβ i v případech, kdy NAbs nevznikají. K ověření reaktivity na IFNβ je nezbytné doplnit MxA indukční test.Klíčová slova:
interferon-β – MxA indukční test – myxovirus resistance protein A – neutralizační protilátky – roztroušená sklerózaÚvod
Interferony-β (IFNβ) se řadí mezi léky první volby používané v léčbě pacientů s klinicky izolovaným syndromem (CIS) s vysokým rizikem rozvoje roztroušené sklerózy (RS) a/nebo v léčbě pacientů s relaps-remitentní formou RS (RR RS). Díky jejich imunomodulačnímu účinku dochází ke snížení aktivity zánětlivého procesu v centrálním nervovém systému [1]. Pacienti, kteří neodpovídají na léčbu IFNβ, bývají v literatuře děleni do dvou skupin [2]:
- patogeneticky podmínění nonrespondenti, u nichž léčba IFNβ nedokáže dostatečně ovlivnit vysokou aktivitu onemocnění;
- imuno-farmakologicky podmínění nonrespondenti, u nichž IFNβ selhává v důsledku vzniku neutralizačních protilátek (NAbs), které jeho biologickou účinnost snižují.
Podávání IFNβ může způsobit tvorbu NAbs u 2–42 % pacientů [2].
Myxovirus resistance protein A (MxA), který lze v podobě mRNA MxA detekovat metodou PCR (Polymerase Chain Reaction), je obecně považován za spolehlivý marker účinnosti léčby IFNβ [3]. Při poklesu mRNA MxA pod určitou hodnotu (cut-off) vzniká podezření na ztrátu účinnosti IFNβ [3,4].
Zatím nebylo jednoznačně stanoveno, zda pro sledování účinnosti léčby IFNβ je vhodnějším markerem stanovení hladiny NAbs nebo mRNA MxA [5,6].
Cílem naší práce bylo sledovat dynamiku mRNA MxA po zahájení léčby IFNβ, stanovit vzájemnou souvislost hladiny MxA a klinického vývoje onemocnění a v případě pozitivity NAbs pak časový vztah a souvislost hodnoty MxA s titrem NAbs.
Metodika
Prospektivní, observační, nerandomizovaná studie probíhala v letech 2010–2015 paralelně v RS centrech Neurologické kliniky 1. LF UK a VFN v Praze a Neurologické kliniky 2. LF UK a FN v Motole. Zařazeni byli všichni dosud neléčení pacienti indikovaní k zahájení terapie IFNβ s diagnózou CIS nebo RR RS stanovené dle McDonaldových kritérií [7]. Protokol studie byl schválen etickou komisí FN v Motole a všichni pacienti podepsali při vstupu do studie informovaný souhlas.
Sledování trvalo 24 měsíců. V rámci pravidelných tříměsíčních kontrol byly prováděny standardní krevní odběry (krevní obraz vč. diferenciálu, základní biochemie), byl hodnocen klinický stav a sledovány nežádoucí vedlejší účinky IFNβ.
MxA bylo vyšetřováno v podobě mRNA MxA pomocí real-time PCR každé tři měsíce. Množství detekované mRNA MxA je vztahováno k mRNA genu GAPDH (glyceraldehyd-3-fosfát-dehydrogenáza), jehož exprese na stimulaci IFNβ nereaguje a zůstává stabilní. Výsledný poměr tak umožňuje interindividuální srovnání. Jako hraniční (cut-off) byla stanovena hodnota 160 – ta odpovídá 95. percentilu hodnot mRNA MxA získaných vyšetřením 100 pacientů s RR RS, kteří nebyli léčeni IFNβ [8].
Při opakovaném poklesu hodnot mRNA MxA pod cut-off byl u pacientů při následující kontrole proveden MxA indukční test – po týdenní periodě, kdy pacient IFNβ neaplikuje („wash out“), je odebrána krev před aplikací IFNβ a 4 hod po ní. Za účinnou je terapie považována v případě minimálně trojnásobného vzestupu nebo při hodnotě mRNA MxA nad cut-off ve vzorku odebraném po 4 hod [9].
Hladina NAbs byla stanovena každých šest měsíců pomocí metody cytopatického efektu. Za pozitivní byly považovány hodnoty ≥ 20 TRU/ml.
Vyšetření mozku magnetickou rezonancí (MR) proběhlo v době zahájení sledování (měsíc 0) a dále v měsíci 6, 12 a 24. Všechna vyšetření byla na obou pracovištích prováděna na stejném přístroji – MR 1,5T a ve stejném protokolu – axiální FLAIR, tloušťka řezů 1,5 mm a axiální T1 vážené obrazy, tloušťka řezu 1 mm.
Za klinicky stabilizovaného byl považován pacient bez relapsu, se stabilní hodnotou EDSS. Relapsy byly hodnoceny pomocí „relapse rate“ – četnosti atak za 12 měsíců. K analýze klinického průběhu v rámci celého souboru byla použita veličina „time to next relapse“ vyjadřující dobu, která u jednotlivých pacientů uplynula k první atace. Tíže neurologického postižení byla stanovována dle škály EDSS, za zhoršení byla považována konfirmovaná progrese EDSS, tj. vzestup hodnoty EDSS nejméně o 1 bod (pokud je vstupní EDSS ≥ 1,0) a o 1,5 (pokud je vstupní EDSS = 0) přetrvávající po dobu minimálně 6 měsíců.
Pacient s diagnózou CIS konvertoval do klinicky definitivní RR RS při prokázané klinické aktivitě (výskyt další ataky) či při progresi na MR (nárůst o ≥ 1 nové ložisko).
Statistické analýzy byly provedeny v softwaru IBM SPSS Statistics 22, (IBM Corporation, Armonk, New York, USA). K výpočtu rizika relapsu (Hazard Ratio; HR) byl použit Coxův model poměrných rizik s 95% konfidenčními intervaly, jako čas byl stanoven čas k relapsu. Výsledky byly považovány za statisticky signifikantní v případě p < 0,05.
Výsledky
Do sledování bylo zařazeno celkem 119 pacientů, 43 mužů a 76 žen, v době zařazení medián věku 33 let (rozpětí 19–65 let) s diagnózou CIS (54 pacientů) či RR RS (65 pacientů). Vstupní EDSS se pohybovalo od 0 do 4,5 (medián 2,0).
U 38 pacientů byla zahájena léčba IFNβ-1a i. m., u 42 pacientů IFNβ-1a s.c. a 39 pacientů bylo léčeno preparátem IFNβ-1b s.c. Léčba byla volena individuálně dle klinické rozvahy ošetřujícího lékaře.
Dvouleté sledování dokončilo 99 pacientů, 20 pacientů léčbu předčasně ukončilo, důvody jsou detailně uvedeny v tab. 1.
Table 1. Důvody předčasného ukončení léčby IFNβ a doba setrvání ve studii do ukončení sledování u jednotlivých pacientů. 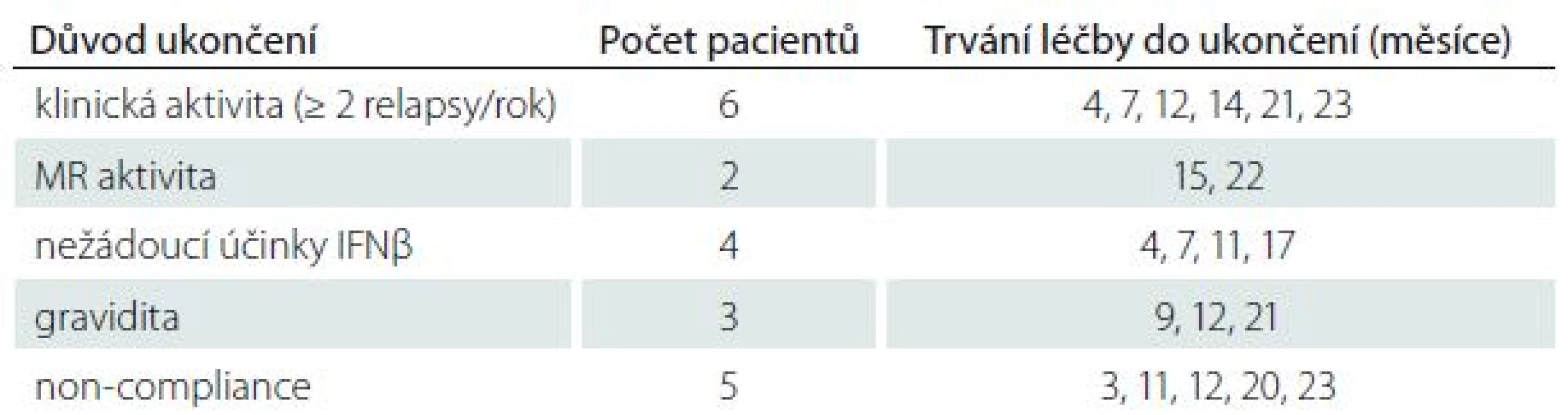
MxA
Hodnoty MxA se před zahájením terapie IFNβ a po třech měsících léčby významně lišily, léčbou IFNβ došlo k nárůstu průměrně o 610,7 (95 % CI 544,8–676,7; p < 0,001).
V průměru zůstávala během léčby IFNβ hodnota MxA trvale nad cut-off hodnotou.
U jednotlivých pacientů jsme však zachytili jak přechodné poklesy (s hodnotou MxA při další kontrole již nad cut-off), tak poklesy trvalé.
K trvalému poklesu MxA pod cut-off hodnotu v průběhu léčby IFNβ došlo u 19 pacientů (19 %, tab. 2). U 10 pacientů s poklesem MxA se současně trvale vyskytovala NAbs pozitivita. U třech pacientů s trvalým poklesem MxA se NAbs objevily jen přechodně. U šesti pacientů se MxA od určité kontroly trvale pohybovalo pod cut-off bez současného výskytu NAbs.
Table 2. Podezření na pokles účinnosti IFNβ. Pacienti NAbs+ a/nebo s poklesem MxA pod cut-off hodnotu. 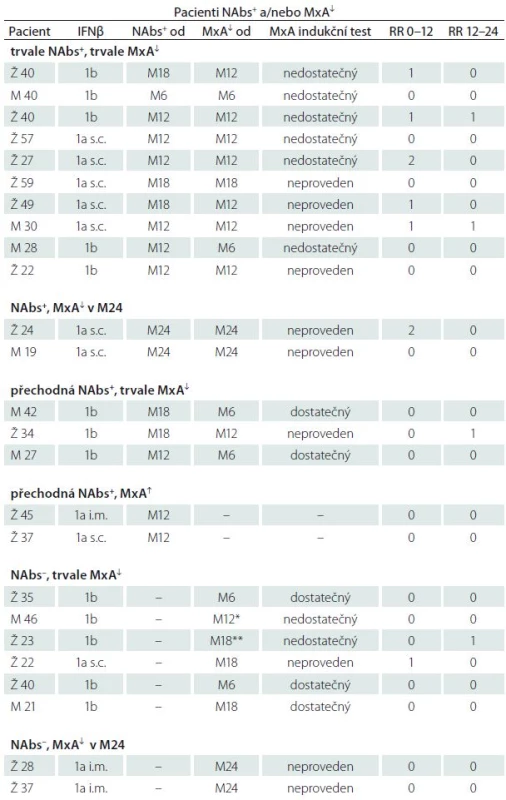
Tabulka zachycuje mj. i časový výskyt a posloupnost vzniku abnormit obou laboratorních parametrů. S ohledem na možnost časového srovnání poklesu MxA s výskytem NAbs jsou zohledněny pouze náběry MxA prováděné paralelně s vyšetřením NAbs, tj. à 6 měsíců. V 1. sloupci je uveden věk a pohlaví v době zahájení studie (Ž – žena, M – muž). Sloupec „NAbs+ od“ udává návštěvu, při které byla poprvé zachycena NAbs pozitivita, nebo od které pak již byla pozitivita trvalá. „MxA↓ od“ udává návštěvu, kdy došlo poprvé k poklesu MxA, nebo od které byl již pokles trvalý. NAbs+ – NAbs pozitivita, NAbs– – NAbs negativita, MxA↓ – pokles MxA pod cut-off hodnotu (< 160), MxA ↑ – MxA nad cut-off (≥ 160), RR – relaps rate. *vyřazen M15 pro progresi na MR, **vyřazena M22 pro progresi na MR. NAbs a jejich vztah k MxA
Pozitivita NAbs se v průběhu studie objevila celkem u 17 pacientů (17 %).
U 10 pacientů (10 %) byla NAbs pozitivita trvalá, tzn. po první detekci přetrvávala i při dalších kontrolách. U všech těchto pacientů došlo i k trvalému poklesu MxA pod cut-off hodnotu (graf 1).
Graph 1. Porovnání hodnoty mRNA MxA v závislosti na NAbs pozitivitě. NAbs pozitivita na ose X: 0 – NAbs negativní, 1 – NAbs pozitivní. 
U pěti pacientů se jednalo o přechodnou NAbs pozitivitu – MxA kleslo pod cut-off hodnotu jen u třech z nich, u dvou bylo dostatečné.
U dvou pacientů se NAbs objevily poprvé až v posledním, 24. měsíci sledování a o jejich přetrvávání v čase se není možné vyjádřit (tab. 2).
Jinými slovy, v případě přítomnosti NAbs v titru 20–100 TRU/ml kleslo MxA pod cut-off v 85 % případů, při titru NAbs > 100 TRU/ml kleslo MxA ve 100 %.
Trvale NAbs pozitivní pacienti byli léčeni IFNβ-1a s.c. (pět pacientů) a IFNβ-1b s.c. (pět pacientů). Oba pacienti, u kterých se NAbs poprvé objevily v 24. měsíci léčby, užívali IFNβ-1a s.c. Pacienti s jednorázovým výskytem NAbs a pacienti s izolovaným poklesem MxA bez NAbs byli léčeni různými přípravky (tab. 2).
Výskyt NAbs a pokles MxA v čase
V šesti případech z 15 (40 %), kdy se objevila NAbs pozitivita i kleslo MxA, předcházel pokles MxA vzniku NAbs pozitivity. U devíti pacientů kleslo MxA pod cut-off až při kontrole, kdy byl současně poprvé zaznamenán výskyt NAbs. Situaci, že by NAbs pozitivita předcházela poklesu MxA, jsme nezaznamenali.
U pacientů s přechodnou pozitivitou NAbs a poklesem MxA (pokud k němu došlo) přetrvával pokles MxA i po normalizaci hladiny NAbs, po celou dobu studie.
MxA indukční test
Pokud byl u pacientů s trvalou pozitivitou NAbs a poklesem MxA proveden MxA indukční test, byl vždy s nedostatečnou odpovědí. Byl-li ale proveden MxA indukční test u pacientů s přechodnou pozitivitou NAbs, reaktivita MxA (i přes pokles v předchozích vyšetření MxA) v něm byla pokaždé zachována. MxA indukční test u pacientů s poklesem MxA bez NAbs pozitivity byl nedostatečný jen u dvou z nich – tito pacienti byli posléze vyřazeni pro významnou progresi nálezu na MR, čtyři zbývající měli reaktivitu v indukčním testu zachovanou.
Uvedené spektrum hodnot MxA a NAbs umožňuje z hlediska pravděpodobné účinnosti IFNβ rozdělit pacienty do následujících skupin:
- Biologičtí respondenti jsou pacienti bez NAbs, s hodnotou MxA nad cut-off hodnotou – 74 pacienti.
- Pravděpodobní biologičtí respondenti definovaní jako:
- a) pacienti s NAbs pozitivitou, ale s dostatečným MxA indukčním testem – v našem souboru se jednalo o pět pacientů s přechodnou NAbs pozitivitou, tři z nich měli sice MxA pod cut-off hodnotou, nicméně byl-li proveden MxA indukční test, reaktivita na IFNβ byla v normě;
- b) pacienti s poklesem MxA bez NAbs, ale s dostatečným MxA indukčním testem – čtyři pacienti.
- Biologičtí nonrespondenti, mezi kterými lze opět odlišit dvě podkategorie:
- a) NAbs pozitivní pacienti s poklesem MxA a nedostatečným MxA indukčním testem – takových pacientů jsme zachytili 10 (ne u všech byl proveden MxA indukční test);
- b) pacienti s opakovaným poklesem MxA a nedostatečným MxA indukčním testem, ale bez NAbs – dva pacienti.
- Pacienti, u nichž k výskytu NAbs či poklesu MxA došlo poprvé při ukončení studie (měsíc 24), a k dynamice abnormit se proto není možné vyjádřit – čtyři pacienti.
Klinický průběh
Do studie bylo zařazeno 54 pacientů s CIS, z nichž 51 (94 %) v průběhu následujících 24 měsíců konvertovalo do klinicky definitivní RR RS dle klinické nebo MR aktivity.
U šesti pacientů, u nichž byla léčba IFNβ ukončena pro klinickou aktivitu (tab. 1), jsme nedetekovali NAbs pozitivitu ani pokles MxA.
Pacienti s přítomnými NAbs (NAbs+) tvoří spolu s pacienty s poklesem MxA (MxA¯) skupinu, u kterých máme podezření na pokles účinnosti IFNβ (souhrnně v tab. 2). V průběhu našeho sledování se riziko rozvoje relapsu v této skupině ve srovnání s ostatními pacienty nelišilo (HR = 1,032 (95% CI 0,493–2,162; p = 0,933)).
U dvou pacientů byla léčba a sledování ukončeno pro aktivitu na MR. Jednalo se o pacienty s poklesem MxA i nedostatečnou reaktivitou v MxA indukčním testu.
Konfirmovanou EDSS progresi dosáhlo ve studii celkem 11 pacientů. Tři z nich patřili do skupiny pacientů NAbs+/MxA¯, nárůst postižení vždy souvisel iniciálně s atakou. Ostatních osm pacientů s konfirmovanou progresí EDSS mělo hladinu MxA nad cut-off a NAbs u nich byly negativní.
Ukončení léčby IFNβ u NAbs pozitivních pacientů vycházelo z doporučení skupiny expertů Evropské federace neurologických společností (EFNS) [10], nověji konzorcia odborníků sdružených v rámci NABINMS (Neutralising AntiBodies on Interferon beta in Multiple Sclerosis) [5] a z rozhodnutí ošetřujícího lékaře. Nebylo závislé na klinické aktivitě onemocnění pacienta – léčba IFNβ byla ukončena u šesti NAbs pozitivních pacientů. Pacienti byli dále sledováni.
Z důvodu izolovaného poklesu pouze hodnoty MxA (bez NAbs pozitivity) nebyla léčba při současné klinické a MR stabilizaci ukončena u žádného z pacientů.
Diskuze
Prokázali jsme, že kromě pacientů, kteří na léčbě IFNβ selhávají z důvodu aktivity onemocnění, může být pokles účinnosti IFNβ způsoben různými patofyziologickými mechanizmy – u části pacientů tvorbou NAbs, v jiných případech ale mechanizmy na NAbs nezávislými.
MxA odráží biologickou odpověď na léčbu IFNβ, jeho hladina po zahájení terapie významně stoupá a při účinné léčbě se po celou dobu sledování udržuje nad cut-off hodnotou. U jednotlivých pacientů však může hladina MxA nárazově kolísat. Interkurentní, i subklinicky probíhající infekt způsobí nárůst hodnot mRNA MxA [11], naopak nesprávná aplikace, nedostatečná compliance, nebo přechodná saturace receptoru při aplikaci několikrát týdně (IFNβ-1a s.c., IFNβ-1b s.c.) mohou způsobit jednorázový pokles MxA pod cut-off hodnotu [12,13].
Nejčastější příčinou trvalého poklesu MxA je tvorba NAbs. V našem souboru se NAbs trvale vyskytly v 10 % případů, což je v souladu s literárními údaji [3]. Zachyceny byly v průběhu celé studie, nejčastěji v měsíci 12 (šest pacientů) a 18 (tři pacienti). V literatuře se udává možnost jejich vzniku od 6. do 24. měsíce po zahájení terapie IFNβ [2]. I v rámci našeho sledování jsme zachytili pacienty, u kterých byla pozitivita NAbs detekována poprvé až ve 24. měsíci léčby.
U šesti pacientů s pozitivitou NAbs předcházel jejich detekci pokles MxA pod cut-off (tab. 2). Situaci, kdy by se nejprve izolovaně objevily NAbs a teprve poté kleslo MxA pod cut-off, jsme nezachytili. Jistě to ale neznamená, že k takovému vývoji nemůže dojít. NAbs jsou nepřímým markerem účinnosti a jejich přítomnost svědčí pouze o možnosti inaktivace IFNβ. U některých pacientů vede NAbs pozitivita k významnému poklesu aktivity IFNβ, zatímco u jiných může při srovnatelných (zejména při pouze mírně zvýšených) titrech zůstávat IFNβ ještě dostatečně účinný [6]. U dvou pacientů s jednorázovou pozitivitou NAbs (titry 20 a 67 TRU/ml) zůstal MxA nad cut-off (336 a 836). Souhrnně při NAbs v titru 20–100 TRU/ml kleslo v našem souboru MxA pod cut-off v 85 % případů, při titru > 100 TRU/ml ve 100 %.
Pokud MxA klesá pod cut-off opakovaně, je doporučováno provedení MxA indukčního testu.
U všech našich pacientů s trvalou pozitivitou NAbs a poklesem MxA pod cut-off potvrdil následně provedený MxA indukční test ztrátu účinnosti IFNβ. Jeho doplnění je tedy v takových případech možné, ale s ohledem na rozhodnutí o dalším postupu nepřínosné. Naopak v případě jen přechodného výskytu NAbs pozitivity doprovázené poklesem MxA a zejména pak v případě izolovaného poklesu MxA bylo provedení indukčního testu zásadní. V klinické praxi by provedení MxA indukčního testu mělo předcházet vyšetření NAbs (schéma 1). Pokud prokáže indukční test zachovanou reaktivitu na IFNβ, je možné v léčbě pokračovat. To byl i případ všech našich pacientů s jednorázovou pozitivitou NAbs.
Schéma 1. Monitoring účinnosti IFNβ pomocí MxA a NAbs v klinické praxi. *Je možné v tuto chvíli pátrat po příčině poklesu MxA a testovat přítomnost NAbs, ale k rozhodnutí o ukončení terapie není tato informace nutná. **Situaci MxA ≥ cut-off (160) a NAbs pozitivní považujeme za nepravděpodobnou. 
Pokud je reaktivita v indukčním testu nedostatečná, je indikována změna terapie. Ze šesti pacientů s izolovaným poklesem MxA v našem souboru byl MxA indukční test nedostatečný u dvou z nich. V průběhu sledování jsme NAbs u těchto pacientů nezachytili a vzhledem k následné progresi na MR (plus ≥ 2 nová ložiska/rok) byli pacienti převedeni na jinou medikaci. Je možné spekulovat, zda by se u těchto pacientů NAbs pozitivita objevila později.
Riziko vzniku relapsu ve skupině pacientů s podezřením na pokles účinnosti IFNβ (tab. 2) bylo srovnatelné s rizikem pacientů bez NAbs a s hladinou MxA nad cut-off. Výhodou laboratorní detekce pacientů s podezřením na ztrátu účinnosti IFNβ je ale právě časový předstih, a tedy možnost optimalizovat terapii, dříve než dojde k reálnému klinickému zhoršení [3]. K ověření této skutečnosti by bylo nutné sledovací období delší než 24 měsíců [14].
V klinické praxi lze na základě našich výsledků doporučit u všech pacientů monitoring účinnosti IFNβ pomocí mRNA MxA vzhledem k jednoduchosti jeho stanovení, rychlosti získávání výsledků a jejich snadné interpretaci. Sledováním hodnot MxA zachytíme situace, kdy je za ztrátu účinnosti odpovědná tvorba NAbs. Můžeme ale navíc zachytit i ztrátu účinnosti v případě, kdy NAbs nevznikají. Důležité je, že jednorázový pokles MxA nelze považovat za průkaz ztráty účinnosti léčby IFNβ, a vyšetření je nutné v takovém případě opakovat a doplnit indukčním testem (schéma 1).
MxA se stává hlavním laboratorním ukazatelem účinnosti IFNβ, vyšetření NAbs ho může významně doplnit. Vzhledem k tomu, že jsme v našem souboru zachytili pokles MxA (doprovázený vznikem NAbs) až na konci sledovacího období, bylo by v klinické praxi vhodné prodlou
Práce byla podpořena výzkumným projektem IGA MZ ČR NT/12385-5 a programem PRVOUK-P26/LF1/4.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
MUDr. Mgr. Jana Libertínová
Neurologická klinika
2. LF UK a FN v Motole
V Úvalu 84
150 06 Praha
e-mail: jana.libertinova@fnmotol.cz
Přijato k recenzi: 19. 1. 2016
Přijato do tisku: 18. 3. 2016
Sources
1. Loleit V, Biberacher V, Hemmer B. Current and future therapies targeting the immune system in multiple sclerosis. Curr Pharm Biotechnol 2014; 15 (3): 276–96.
2. Hesse D, Sorensen PS. Using measurements of neutralizing antibodies: the challenge of IFN-beta therapy. Eur J Neurol 2007; 14 (8): 850–9.
3. Bertolotto A, Granieri L, Marnetto F, et al. Biological monitoring of IFN-β therapy in multiple sclerosis. Cytokine Growth Factor Rev 2015; 26 (2): 241–8. doi: 10.1016/j.cytogfr.2014.12.002.
4. Malucchi S, Gili F, Caldano M, et al. Predictive markers for response to interferon therapy in patients with multiple sclerosis. Neurology 2008; 70 (13): 1119–27. doi: 10.1212/01.wnl.0000304040.29080.7b.
5. Polman CH, Bertolotto A, Deisenhammer F, et al. Recommendations for clinical use of data on neutralizing antibodies to interferon-β therapy in multiple sclerosis. Lancet Neurol 2010; 9 (7): 740–50. doi: 10.1016/S1474-4422 (10) 70103-4.
6. Libertínová J, Meluzínová E, Maťoška V, et al. Neutralizační protilátky a Myxovirus resistence protein A při sledování biologické účinnosti interferonu β. Cesk Slov Neurol N 2014; 77/110 (5): 638–41.
7. Polman CH, Reingold S, Banwell B, et al. Diagnostic criteria for multiple sclerosis: 2010 revisions to the McDonald criteria. Ann Neurol 2011; 69 (2): 292–302. doi: 10.1002/ana.22366.
8. Libertínová J, Kumstýřová T, Meluzínová E, et al. mRNA MxA jako marker biologické účinnosti léčby interferonem-β u pacientů s RS v ČR. Cesk Slov Neurol N 2009; 72/105 (Suppl 2): S120.
9. Voort van der LF, Kok A, Visser A, et al. Interferon-β bioactivity measurement in multiple sclerosis: feasibility for routine clinical practice. Mult Scler 2009; 15 (2): 212–8. doi: 10.1177/1352458508096877.
10. Sorensen PS, Deisenhammer F, Duda P, et al. Guidelines on use of anti-IFN-β antibody measurements in multiple sclerosis: report of an EFNS Task Force on IFN-β antibodies in multiple sclerosis. Eur J Neurol 2005; 12 (11): 817–27.
11. Roers A, Hochkeppel HK, Horisberger MA, et al. MxA gene expression after live virus vaccination: a sensitive marker for endogenous type I interferon. J Infect Dis 1994; 4 (4): 807–813.
12. Bertolotto A, Sala A, Malucchi S, et al. Biological activity of interferon betas in patients with multiple sclerosis is affected by treatment regimen and neutralising antibodies. J Neurol Neurosurg Psychiatry 2004; 75 (9): 1294–9.
13. Serana F, Imberti L, Amato MP, et al. MxA mRNA quantification and disability progression in interferon beta-treated multiple sclerosis patients. PLoS One. 2014; 9 (4): e94794. doi: 10.1371/journal.pone.0094 794.
14. Voort van der LF, Visser A, Knol DL, et al. Lack of interferon-beta bioactivity is associated with the occurence of relapses in multiple sclerosis. Eur J Neurol 2009; 16 (9): 1049–52. doi: 10.1111/j.1468-1331.2009.02 649.x.
Labels
Paediatric neurology Neurosurgery Neurology
Article was published inCzech and Slovak Neurology and Neurosurgery

2016 Issue 5-
All articles in this issue
- Rasmussenova encefalitída
- Léky navozená spánková endoskopie – cesta k lepším chirurgickým výsledkům při léčbě syndromu obstrukční spánkové apnoe
- Současná kortikoterapie u nádorů mozku
- Individualizovaný přístup k léčbě roztroušené sklerózy
- Aktuální pohled na management nízkostupňových gliových nádorů centrálního nervového systému
- Detekce pravolevých zkratů u mladých pacientů po ischemické cévní mozkové příhodě – pilotní studie
- Idiopatická hypertrofická kraniální pachymeningitida – dvě kazuistiky
- Myxovirus resistance protein A v terapii interferony-β u pacientů s roztroušenou sklerózou a algoritmus sledování účinnosti léčby
- Myasténia gravis asociovaná s tymómom – súbor pacientov v Slovenskej republike (1978–2015)
- Bezpečnost karotického stentingu – srovnání protekčních systémů
- Průkaz boreliové DNA u pacientů s neuroboreliózou
- Vztah likvorových hladin IL-6 ke změnám parciálního tlaku kyslíku v mozku a k rozvoji vazospazmů u pacientů po subarachnoidálním krvácení z ruptury aneuryzmatu mozkové tepny
- Stereotaktické biopsie mozkových patologií systémem Varioguide – zkušenosti ze 101 výkonů
- Myasthenia Gravis Composite – validace české verze
- Pilotní studie využití tenzometrické plošiny v domácí terapii poruch rovnováhy
- Neurofyziologická vyšetření u traumatických lézí brachiálního plexu
- Paroxyzmálna kinezigénna dystónia ako primomanifestácia roztrúsenej sklerózy – kazuistika
- Czech and Slovak Neurology and Neurosurgery
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Současná kortikoterapie u nádorů mozku
- Rasmussenova encefalitída
- Neurofyziologická vyšetření u traumatických lézí brachiálního plexu
- Průkaz boreliové DNA u pacientů s neuroboreliózou
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

