-
Medical journals
- Career
Funkční poruchy hybnosti
Authors: T. Serranová; E. Růžička; J. Roth
Authors‘ workplace: Neurologická klinika a Centrum klinických neurověd, 1. LF UK a VFN v Praze
Published in: Cesk Slov Neurol N 2014; 77/110(3): 270-286
Category: Minimonography
Podpořeno Univerzitou Karlovou v Praze, PRVOUK P26/LF1/4.
Overview
Funkční (psychogenní) poruchy hybnosti jsou v ambulancích neurologů časté. Jejich patofyziologie je ovšem stále málo známa a také v klinických názorech na jejich diagnostiku a léčbu dosud existuje řada nejasností. Klinicky jsou funkční poruchy hybnosti charakterizovány především měnlivými a obvykle nestálými příznaky, které se neshodují s typickými projevy hybné poruchy způsobené organickým neurologickým onemocněním. V tomto přehledu uvádíme terminologii, definice, výskyt a typické projevy funkčních poruch hybnosti i jejich jednotlivých forem a diagnostická klinická kritéria. Dále přinášíme nové poznatky o jejich patofyziologii, které zpochybňují v minulosti zdůrazňovanou kauzální roli psychických faktorů a nasvědčují neurobiologickému modelu vzniku příznaků. Diagnóza funkčních poruch hybnosti by měla spočívat na nálezu charakteristických klinických projevů a nikoliv pouze na vyloučení organických příčin. Z hlediska prognózy je rozhodující časné stanovení diagnózy a její přijetí pacientem. Léčebné postupy zahrnují multimodální přístup s dominantní úlohou neurologa, jenž stanovuje a sděluje diagnózu a řídí léčebný postup.
Klíčová slova:
funkční poruchy hybnosti – psychogenní poruchy hybnosti – inkonzistence – inkongruence – Hooverův testÚvod
Funkční (psychogenní) poruchy hybnosti (FPH) patří mezi časté důvody návštěv v ambulancích neurologů [1]. Pro nejasný původ a mechanizmus vzniku jejich příznaků jsou ale dosud špatně definovanou skupinou onemocnění, což se odráží v nejednotné terminologii a protikladných názorech na přístup k pacientům s FPH. Ti se často ocitají v bludném kruhu mezi odborníky, kteří jsou sice schopni rozpoznat „neorganický“ původ obtíží, avšak již se nepovažují za kompetentní sdělit jasně diagnózu a řídit léčebný postup, a dalšími lékaři, kteří zpochybňují diagnózu FPH, perseverují podezření na organické onemocnění a opakováním již provedených nebo prováděním dalších zcela zbytečných vyšetření prohlubují nejistotu pacienta a zatěžují zdravotnický systém. Výsledkem je, že FPH mají pověst jedněch z nejobtížněji diagnostikovatelných a léčitelných onemocnění a pacienti s FPH obvykle obtížně hledají odbornou pomoc. V posledních dvou desetiletích nicméně vznikla řada prací zabývajících se diagnostickými i léčebnými metodami FPH a ukazuje se, že při správně vedeném postupu může být péče o pacienty s FPH úspěšná. K rozšíření znalostí došlo i v oblasti patofyziologie. V minulosti zdůrazňovaná role psychických faktorů byla v řadě recentních prací zpochybněna; v současné době dochází k posunu od psychologického modelu k neurobiologickému, který u pacientů s FPH zohledňuje zejména doložené abnormality v mechanizmech pozornosti, v procesech senzorického vnímání a v percepci volního jednání.
Funkční neurologické poruchy, mezi které se řadí i FPH, jsou součástí širokého spektra funkčních tělesných symptomů. Funkční symptomy a syndromy jsou definovány jako tělesné obtíže (resp. přetrvávající vzorce obtíží), u nichž přiměřená vyšetření neodhalí vysvětlující strukturální nebo jinou specifickou patologii. Většina medicínských oborů má svůj funkční syndrom (tab. 1) a pacienti s jedním funkčním syndromem často zároveň splňují kritéria i pro jiný funkční syndrom (např. pacient s FPH může mít obtíže charakteru dráždivého tračníku) [2]. Široké spektrum funkčních syndromů v neurologii zahrnuje neepileptické záchvaty, různé bolestivé syndromy, funkční parézy a senzorické poruchy, mohou sem spadat i funkční kognitivní poruchy a únavové syndromy.
Table 1. Funkční symptomy v různých medicínských oborech (upraveno podle [2]). ![Funkční symptomy v různých medicínských oborech (upraveno podle [2]).](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/eed97f20be9c1273537bca00ffa2af6c.png)
V tomto přehledu se z funkčních neurologických syndromů budeme zabývat pouze FPH. Cílem je přispět k novému pohledu na tuto problematiku, která, jak se zdá, je stále zatížena řadou předsudků, jež mohou bránit jak správné diagnostice FPH, tak jejich účinné léčbě. FPH budeme stále v našich ambulancích vídat, a je proto lepší se o ně zajímat a pokusit se jim porozumět, než se jimi nechat frustrovat.
Definice a terminologie
Ustálená a všeobecně přijatá definice ani terminologie FPH v současné době neexistuje. Donedávna byly funkční poruchy hybnosti (většinou označované jako psychogenní) definovány jako poruchy, které nejsou způsobeny neurologickou nemocí, ale spíše psychologickou či psychiatrickou příčinou. Kauzální role psychických faktorů se však v poslední době zpochybňuje a převahu získává klinická definice FPH jako poruchy hybnosti, jejíž projevy jsou nestálé, mění se významně odvedením pozornosti či nefyziologickými manévry (včetně výrazné placebové reakce) a neshodují se s obrazem poruchy hybnosti na podkladu známého neurologického onemocnění [3,4]. Recentní práce navíc k této definici dodávají, že ačkoli FPH mohou mít charakteristiky volních pohybů, pacient je nemá pod kontrolou a vnímá je jako mimovolní [4].
Nejednotné názory na původ a mechanizmus vzniku FPH jsou zdrojem mnoha termínů, kterými bývají tyto poruchy označovány (tab. 2). Přitom platí, že jak široká veřejnost, tak lékaři mají tendenci pokládat za vážnější onemocnění s dobře definovanou strukturální lézí než ta bez jasného anatomického substrátu nebo bez známého příčinného děje [5]. Diagnostické nálepky tak ovlivňují sociální statut nemocného, oprávněnost jeho případného zneschopnění či invalidizace, ale také přijatelnost diagnózy pro nemocného a jeho adherenci k léčbě. V souvislosti s abnormálními pohyby se dosud nejběžněji užívá termín „psychogenní“ [6]. Ten ovšem v rozporu se současnými výzkumnými poznatky automaticky předjímá etiologii související s psychickými faktory. Navíc spolu s dalšími termíny, jako jsou „medicínsky nevysvětlené“, „psychosomatické“, „hysterické“, představuje diagnostické nálepky, které jsou ztotožňovány s „vymýšlením si“ nebo „psychickou poruchou“, „blázněním“, a jsou tedy nejen nepřesné, ale také pro pacienty obtížně přijatelné. Termín „funkční“, který v tomto přehledu používáme, odkazuje spíše na mechanizmus vzniku příznaků než na jejich příčinu, a pro pacienty je mnohem přijatelnější. Proto se v současné době termín FPH upřednostňuje nejen v komunikaci s pacienty, ale i v odborné literatuře [7,8].
Table 2. Názvosloví poruch (upraveno podle [3]). ![Názvosloví poruch (upraveno podle [3]).](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/0502be72d76d673e497edbabade2dcf3.png)
FPH ovšem nejsou vedeny jako diagnostická jednotka v 10. revizi Mezinárodní klasifikace nemocí (MKN ‑ 10). Zřejmě jim nejbližší diagnóza MKN ‑ 10 je disociativní motorická porucha (F44.4) patřící do skupiny disociativních (konverzních) poruch. Další potenciálně relevantní jednotka ze skupiny somatoformních poruch je somatizační porucha (F45.1). Ta se vyznačuje opakovanými stížnostmi na tělesné symptomy spolu s trvalým vyžadováním lékařského vyšetřování i přes opakované negativní nálezy a ujišťování lékaře‚ že obtíže nemají fyzickou podstatu [9]. Nejbližší definovaná jednotka diagnostického a statistického manuálu duševních chorob (DSM ‑ 5), který je nejrozšířenější nomenklaturou užívanou pro klasifikaci duševních poruch, je motorická konverzní porucha [10].
U pacientů s FPH se nepředpokládá vědomá produkce příznaků, jež je charakteristická pro faktitivní poruchu, u níž jsou vědomě vytvářené příznaky zdrojem psychologického zisku (např. pozornosti), nebo pro simulaci, tj. vědomou produkci příznaků za účelem materiálního zisku či získání výhod [11]. Argumentem proti vědomé produkci příznaků u pacientů s FPH je přetrvávání obtíží a invalidity během dlouhodobého sledování, ochota podstupovat často náročná vyšetření, užívat léky i přes jejich nežádoucí účinky [12]. Odlišit, zda se jedná o vědomou nebo nevědomou produkci příznaků, je ovšem v klinických podmínkách obtížné. Různé neurofyziologické a funkčně zobrazovací metody, které mohou být využity k detekci lži, poskytují falešně pozitivní i negativní výsledky a navíc ani nejsou u FPH běžně dostupné a etablované [13]. Podezření na simulaci mohou vyvolat výrazné rozpory v anamnestických údajích ze zpráv od různých lékařů nebo v informacích od příbuzných a od pacienta, anebo výrazná inkonzistence tíže obtíží (např. když pacient, který je při vyšetření na vozíku, je jindy viděn, jak hraje tenis), či zjištění, že pacient lhal o některých minulých událostech a vyhýbal se vyšetření [11]. Předpokládá se nicméně, že jen malé procento pacientů s FPH své obtíže simuluje [14].
Epidemiologie
Epidemiologická data o FPH mohou být zkreslena dvěma faktory. Jedním z nich je problematické vymezení případů s FPH – na jedné straně mohli být zařazeni všichni pacienti s poruchami hybnosti, u kterých chybělo patofyziologické vysvětlení, a na straně druhé mohli být zařazeni na základě v minulosti platných kritérií jen pacienti s přidruženými psychologickými faktory. Další faktor, jenž omezuje provedení velkých komunitních studií, je nutnost podrobného neurologického vyšetření k určení diagnózy, tedy ke zjištění případů s FPH. Epidemiologické studie tak zůstávají omezeny na pacienty neurologických ambulancí.
Podle dostupných údajů se incidence „konverzní poruchy“ pohybuje mezi 4 a 12 na 100 000 obyvatel ročně a odhadovaná prevalence vycházející z „population based case registers“ je kolem 50/ 100 000 [15]. Funkční neurologické poruchy představují až 16 % pacientů odesílaných k vyšetření na neurologická pracoviště [1]. Ve specializovaných centrech zaměřených na abnormální pohyby je prevalence FPH odhadována mezi 3,3 a 20 % [16].
FPH nejčastěji vznikají mezi 20. a 50. rokem věku, 2 – až 4krát častěji u žen než u mužů [16 – 18]. Jen vzácně se popisuje vznik FPH u dětí do 10 let a v seniu [19,20]. Funkční třes (FT) je nejčastější forma FPH, představuje až 40 % případů. Funkční dystonie (FD) je po třesu nejčastější a tvoří asi 30 % FPH. Funkční myoklonus (FM) představuje asi 10 %, funkční parkinsonský syndrom (FP) je vzácný, vyskytuje se jen asi v 5 % FPH. Funkční poruchy chůze se často kombinují s jinými FPH a dominují asi v 10 % FPH. Funkční chorea a tiky jsou extrémně vzácné [21].
Patofyziologie
Klasické teorie předpokládají, že klíčovým etiologickým faktorem „medicínsky nevysvětlitelných symptomů“ bývá narušení původně normálních mentálních funkcí (disociace) traumatickou událostí nebo transformace traumatického afektu (konverze). Asociace s psychologickými faktory či přítomnost zjevné psychiatrické poruchy byly také součástí původních kritérií pro klinicky stanovenou diagnózu psychogenní poruchy hybnosti (tab. 3) [22].
Výskyt traumatických událostí, jako jsou fyzické či sexuální zneužívání, se ovšem týká jen menší části pacientů s funkčními symptomy a řada kontrolovaných studií častější výskyt těchto traumatických událostí v dětství u pacientů s FPH vůbec nezjistila [23,24]. Recentně dokonce nebyly u FPH zjištěny ani významné rozdíly v osobnostních rysech, psychiatrické komorbiditě, sociálním přizpůsobení či tendenci k disociaci proti zdravým kontrolám a pacientům s organickou dystonií [25]. Precipitační události charakteru psychosociálního stresu i sekundární zisk mohou hrát důležitou roli v rozvoji a udržování symptomatiky FPH, nicméně zdá se, že totéž platí i pro organická postižení [26 – 31]. Tyto nálezy tedy významně zpochybňují validitu konverzní teorie, přesto ale tento koncept, starý více než století, dosud ovlivňuje naše chápání funkčních příznaků a také způsob, jakým jsou tyto poruchy klasifikovány a léčeny.
V posledních dvou desetiletích dochází k odklonu od psychologického modelu FPH a příklonu k modelu neurobiologickému. Neurofyziologické studie u FPH prokázaly normální aktivaci primárních senzorických a motorických drah jako při volních pohybech [13]. Funkčně zobrazovací studie u FPH a funkčních paréz (přes četné metodické nedostatky a nízkou statistickou sílu výsledků) naznačují, že by důležitou roli mohly hrát abnormity ležící mimo primární motorický systém, zejména v prefrontální oblasti, na úrovni plánování nebo exekuce pohybu, anebo v limbických oblastech [32 – 35]. U pacientů s FPH byly ve vztahu k afektivním podnětům nalezeny změny ve fyziologické reaktivitě limbických oblastí (pravé amygdaly) a také jejich zvýšená konektivita s premotorickými oblastmi (zejména se suplementární motorickou areou), které se podílejí na iniciaci pohybu a též na automatické inhibici nevhodné aktivity. Tímto neurálním mechanizmem by tedy afektivní podněty nebo fyziologické stresory mohly spouštět anebo zhoršovat projevy FPH (buď přímo iniciací pohybu, nebo poruchou inhibice abnormálních pohybů) [32]. Další významné nálezy funkčně zobrazovacích a neurofyziologických studií se týkají:
- pozornostních procesů vztažených k hybné kontrole [36 – 38],
- predikcí (očekávání) hybných a senzorických stavů [39] a
- procesů souvisejících s percepcí volního jednání [34,40,41].
Tyto nálezy byly shrnuty v nově navrženém biologickém modelu FPH [4]. Tento model je založen na předpokladu, že funkční příznaky vznikají na podkladě změn v procesech spojených s očekáváním určitých senzorických vjemů včetně vnímání vlastních pohybů a jejich interakcí s pozornostními mechanizmy. Výsledkem je narušení normální percepce a volní motoriky. Příkladem toho, že očekávání ovlivňují percepci, může být ovlivnění percepce bolesti. Kromě známého analgetického efektu placeba bylo prokázáno, že naopak očekávání bolestivějšího podnětu vede přes jeho nezvýšenou intenzitu nejen k vyššímu subjektivnímu hodnocení bolesti, ale i k vyšší aktivitě sekundárního somatosenzorického kortexu v magnetoencefalografickém záznamu [42]. Podobně jako změna predikce vede ke změně vnímání bolesti, mohou následky abnormálních predikcí zahrnovat i přítomnost abnormálního pohybu nebo ztrátu funkce (parézu, anestezii). Jinými slovy, chorobný příznak je vnímán jako reálný a vznikající nezávisle na vůli pacienta, ať je jeho podkladem organická porucha nebo „jen“ abnormální predikce. Při vzniku abnormálních predikcí týkajících se onemocnění i zvýšené pozornosti k symptomům může hrát roli celá řada predisponujících faktorů. Často bývá rozvoj funkčních příznaků předcházen fyzickým precipitačním faktorem, jako je drobné poranění končetiny. Typickým příkladem u FPH je menší úraz, který vyvolá bolest a imobilizaci končetiny, poté vznikne fixní dystonie [43]. Dalším faktorem potenciálně formujícím vznik abnormálních predikcí a očekávání vztažených k nemoci může být výskyt nemoci u pacienta samotného nebo v jeho okolí [44], práce ve zdravotnictví [45], zprávy o zdravotním ohrožení v médiích či mezi kolegy [46,47]. Pokud se abnormální predikce zesílí pozorností zaměřenou na daný stav anebo na určitou část těla, mohou abnormální očekávání převážit a zvýraznit aktuální senzorické vstupy natolik, že výsledkem je abnormální vjem nebo pohyb. Příkladem může být spuštění příznaků FPH během vyšetření nefyziologickými manévry, jako je např. vyvolání třesu přiložením ladičky na končetinu. Pokud se abnormální predikce vytvoří na intermediální úrovni motorického či senzorického systému (tj. v kortiko ‑ subkortikálních okruzích), vyšší (kortikální) úrovně vzniklý vjem nebo pohyb nepredikují, a ten je vnímán jako mimovolní, tedy jako chorobný příznak. Je‑li pozornost odkloněna, abnormální očekávání na intermediální úrovni již nemá dostatečnou sílu a příznaky se mírní [48].
Klinická charakteristika a jednotlivé fenotypy
FPH se klinicky vyznačují především inkonzistencí příznaků a jejich inkongruencí s hybnou poruchou danou známým neurologickým onemocněním. Inkonzistencí příznaků rozumíme jejich variabilitu, tj. nestálost a měnlivost, kolísání tíže v čase, mírnění při odvedení pozornosti (a naopak horšení při zaměření pozornosti). Podle typu hybného projevu bývá patrná variabilita tělesné distribuce, frekvence, amplitudy nebo směru pohybů. Inkongruence s příznaky známého onemocnění znamená, že hybná porucha se neshoduje s obrazem „organického“ postižení, je často až bizarního rázu, s projevy, jež jsou neobvyklé samy o sobě či ve své kombinaci, neodpovídající anatomicko‑fyziologickým zákonitostem, tudíž těžko topicky interpretovatelné. Významným rysem FPH také je, že ačkoli mohou mít charakteristiky volních pohybů, pacient je nemá pod kontrolou a vnímá je jako mimovolní.
Některé typické anamnestické údaje a objektivní nálezy jsou společné všem FPH bez ohledu na konkrétní formu. Neznamenají každý sám o sobě jednoznačný důkaz, že se jedná o FPH, ale jejich zjištění může ke stanovení diagnózy FPH přispět (tab. 3). Je ovšem třeba mít na paměti, že ani bizarní pohybový vzorec, ani normální nálezy pomocných vyšetření ještě samy o sobě neznamenají FPH. Navíc projevy i průběh některých organických onemocnění projevujících se poruchami hybnosti (např. geneticky podmíněné dystonie, paroxyzmální dyskineze) mohou mít značně bizarní charakter.
Table 3. Typické společné nálezy u funkčních poruch hybnosti. 
Společné rysy všech FPH
Společné rysy všech FPH zahrnující jak anamnestické údaje, tak klinické nálezy ukazuje tab. 4.
Table 4. Praktická doporučení – anamnéza. 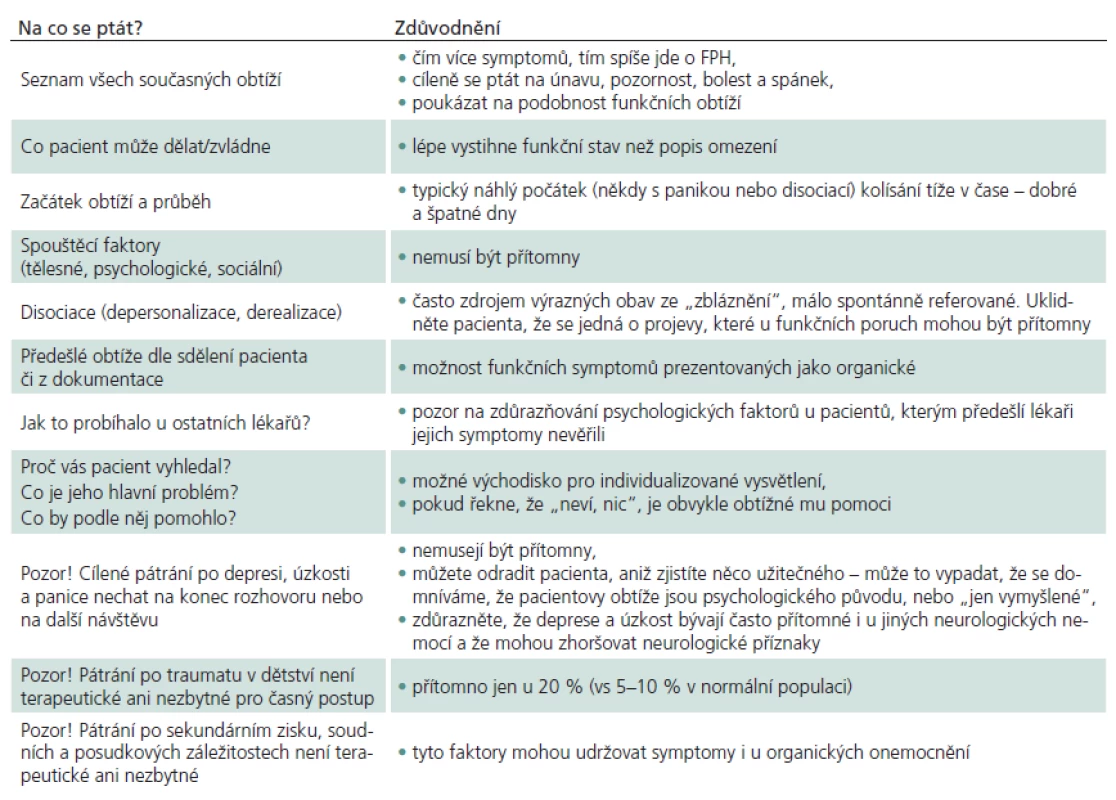
Anamnéza
Pacienti často popisují náhlý vznik nebo rychlý rozvoj příznaků, někdy v časové souvislosti s úrazem, nemocí nebo jiným tělesným spouštěčem. Mnohdy jsou příznaky na počátku nejtěžší nebo mohou rychle progredovat a následně být setrvalé, zatímco pomalá progrese, která je typická pro většinu poruch hybnosti u extrapyramidových onemocnění, je vzácná. Typický je údaj o kolísání tíže příznaků (v řádu dní i delších časových intervalů, období úplných remisí a náhlých relapsů). V průběhu času může rovněž docházet k atypickým změnám hybných vzorců a může se objevit jiný typ abnormálního pohybu. Při cíleném dotazování se v anamnéze pacientů s FPH často najdou i další obtíže možného funkčního původu [16,18,22]. Bývají to různé bolestivé syndromy a senzorické poruchy (výpadky čití nebo parestezie), syndrom dráždivého tračníku nebo měchýře, únava, nauzea, poruchy spánku, závratě, neepileptické záchvaty a poruchy vědomí, poruchy zraku, poruchy řeči, dysfonie, poruchy sluchu a poruchy paměti (bez objektivního kognitivního zhoršení) [49,50].
Odběr anamnestických údajů může být velmi náročný, zvláště u pacientů přicházejících s dlouhotrvajícími projevy funkčních poruch a s množstvím lékařských zpráv o předchozích vyšetřeních a léčebných pokusech. Přesto je zapotřebí anamnézu odebrat a cíleně se vyptat na skutečnosti, které by jinak mohly uniknout pozornosti (tab. 4). Rozhovor při odběru anamnestických údajů má význam nejen pro stanovení diagnózy, ale i pro navození vzájemné důvěry a možné využití získaných údajů pro terapii.
Klinický nález
Abnormální pohyby u FPH jsou typicky inkonzistentní, měnlivé v čase. Mění frekvenci a amplitudu, směr i distribuci. Na rozdíl od „organických“ poruch FPH vyžadují pozornost k tomu, aby se projevily, a naopak při odvedení pozornosti se FPH zmírňují nebo mizí [51,52]. Zmírnění po odvedení pozornosti bývá patrné zejména u funkčního třesu a myoklonu, naopak obvykle málo na změny zaměření pozornosti reaguje funkční dystonie. K odvedení pozornosti používáme jednak provádění motorické úlohy na nepostižené/ nevyšetřované končetině (např. střídavé pronačně supinační pohyby nebo rychlé sekvenční pohyby 2. – 5. prstu proti palci), jednak případně používáme kognitivní úlohu (např. sériové odčítání 100 – 7, měsíce v roce pozpátku). Během vyšetření může být nápadná značná vizuální pozornost zaměřená k abnormálním pohybům a často také bývá patrný horší hybný výkon (např. provádění rytmické úlohy) na nepostižené části těla.
Funkční omezení může být selektivně vázáno jen na určité úlohy nebo přítomno pouze během vyšetřování. Abnormální pohyby bývají inkongruentní s projevy známých organických onemocnění. Často bývají patrny smíšené dyskineze různých typů nebo obtížně klasifikovatelné bizarní pohyby, někdy paroxyzmální. Hybné vzorce jsou mnohdy generovány s výrazným úsilím, mohou být extrémně pomalé a i přes značnou energetickou náročnost prováděných pohybů nedochází k projevům únavy. Přítomna může být přehnaná, opožděná úleková reakce na různé podněty. Je možné pozorovat sugestibilitu, kdy nefyziologickým manévrem, např. přiložením ladičky na končetinu, dojde ke zmírnění projevů třesu [16,18].
Někdy se u pacientů během vyšetření setkáme s výrazem, který se zdá neadekvátně veselý nebo lhostejný vzhledem k tíži příznaků či naopak s projevy extrémního utrpení. Tzv. la belle indifferénce (neadekvátní lhostejnost k příznakům) nicméně dle cíleného průzkumu není častější u pacientů s FPH než u pacientů s organickým onemocněním (21 vs 29 %) [53]. Zdá se navíc, že lékaři nejsou schopni dobře posoudit pacientův vlastní postoj k příznakům. Bylo zjištěno, že pacienti, kteří vyjadřují lhostejnost ke svým příznakům, mohou ve skutečnosti zažívat značnou úzkost [54,55]. Zrovna tak je třeba opatrnosti v interpretaci projevů výrazného utrpení provázeného bolestivými grimasami v obličeji (facies martyrea) nebo zesílení příznaků během vyšetřování a zaměření pozornosti k postižené části těla. Spíše se jedná o snahu pacienta přesvědčit lékaře o závažnosti a skutečnosti problému než o pokus ho podvést. Tato snaha přesvědčit okolí o závažnosti obtíží nemusí být volního původu a zesiluje se stejně jako abnormální hybné projevy v kontextu vyšetřování. U pacienta s FPH ani u pacienta s organickým onemocněním se tedy nemusí jednat o úmyslné přehánění, když jej vidíme oblékat se nebo odcházet z ordinace s podstatně menšími příznaky anebo projevy bolesti, než jaké byly patrné během vyšetřování.
Závěrem zdůrazněme, že při vyšetření s podezřením na FPH je velmi přínosné pozorovat pacienta i před začátkem vlastního vyšetření a po jeho skončení – jak přichází, jak se svléká, přesouvá na lůžko. Pozitivní známky (efekt odvedení pozornosti a další projevy inkonzistence poruchy) není třeba před pacientem tajit, nevymizí, ani když na ně pacienta upozorníme, ale pomohou nám jako doklad toho, že nervový systém je neporušený, a tyto prvky hybnosti mohou být využity při rehabilitaci.
Psychiatrická komorbidita
Pacienti s FPH často trpí úzkostí (až cca 40 % pacientů) a depresí (až cca 70 % pacientů), i když není zcela jasné, do jaké míry je psychiatrická komorbidita častější než v běžné populaci nebo u pacientů s organickými poruchami hybnosti [50]. U pacientů s FPH mohou být přítomny projevy disociace: depersonalizace (pocit odcizení nebo oddělení od vlastního těla) a derealizace (pocit, že okolí je „nereálné“, „odpojené“ nebo „vzdálené“). Jsou častější u pacientů s neepileptickými záchvaty a také u pacientů se záchvatovitými FPH nebo mohou být spojeny s panickými záchvaty [56]. Pacienti disociativní projevy referují spontánně jen málokdy, částečně proto, že je těžké je popsat, ale nejspíše také z obavy, aby nebyly interpretovány jako projevy „bláznění“. Je třeba mít na paměti, že psychiatrické komorbidity jsou sice u pacientů s FPH časté, ale nejsou nutnou průvodní známkou ani příčinou FPH. Mohou být přítomny i u pacientů s organickým onemocněním, ať už jako komorbidita, či přímo jako součást klinického obrazu organického extrapyramidového onemocnění. To, že pacient má zjevnou psychiatrickou komorbiditu, tedy neznamená, že jeho problém je funkční. Naopak ani to, že někdo vypadá zcela normálně, ještě neznamená, že jeho problém nemůže být funkční.
Komorbidita s organickým onemocněním
Někdy může být funkční porucha přítomna současně s organickou, případně FPH může organickou poruchu maskovat. Na rozdíl od dobře známé koexistence funkčních neepileptických záchvatů a epilepsie jsou údaje o komorbiditě FPH s organickým neurologickým onemocněním nebo přímo s organicky podmíněnými poruchami hybnosti omezené. Byla popsána u 7 – 17 % pacientů s organickým třesem, dystonií, dyskinezemi a Parkinsonovou nemocí [57 – 60]. Dojem funkčního onemocnění může vyvolat i bezděčná či vědomá agravace příznaků organické poruchy hybnosti s cílem přesvědčit lékaře o závažnosti problému. Potom může být také patrný inkonzistentní charakter poruchy hybnosti (amplitudy, frekvence, distribuce, selektivní disability), změny rázu a tíže obtíží vlivem pozornosti a rovněž se mohou objevovat falešné senzorické a motorické symptomy. Pozitivní známky FPH (inkonzistence, inkongruence) tedy svědčí pro přítomnost funkčního problému, nicméně nevylučují organické onemocnění.
Jednotky FPH
Funkční třes
Třes je definován jako rytmická oscilační aktivita částí těla [61]. Třes může být charakterizován svou frekvencí, amplitudou a rovněž podle toho, zda se objevuje v klidu nebo při činnosti (posturální a kinetický). Funkční třes (FT) bývá většinou vyjádřen ve všech složkách: klidové, posturální i kinetické. Může postihnout kteroukoli část těla (jen izolovaný třes prstů je u FT vzácný) a má často tendenci generalizovat se. Na rozdíl od organicky podmíněných forem třesu bývá u FT značná variabilita frekvence i amplitudy. Významným rysem FT je, že může měnit své charakteristiky nebo mizet při odvedení pozornosti [62]. Použití kognitivních úloh však k odvádění pozornosti u FT není příliš vhodné [63]. Vhodnější jsou pohybové manévry a zkoušky. Např. v testu přejímání frekvence pacienta vyzveme, aby prováděl rychlý rytmický pohyb (rychlostí odlišnou od frekvence třesu) na části těla nepostižené třesem (třeba aby držel postiženou horní končetinu v poloze, kde se třese, a přitom na druhé, nepostižené ruce rychle rytmicky klepal ukazovákem proti palci). U FT třes na postižené části těla typicky přebírá frekvenci rytmického volního pohybu nebo se naopak na nepostiženou končetinu přenáší rytmus funkčního třesu. Případně pacient vůbec není schopen správně vykonávat rytmický pohyb jinak nepostiženou končetinou. Často při této zkoušce pozorujeme, že už při přebírání instrukce a nácviku vyžádaného pohybu se odvedením pozornosti třes na postižené končetině změní nebo zcela vymizí. Všechny tyto varianty odpovědi lze brát jako pozitivní projevy FT. Při zaměření pozornosti na postiženou končetinu, při pokusu o imobilizaci třesu nebo při zatížení končetiny závažím naopak dochází k nárůstu amplitudy FT [62]. U organických třesů (u Parkinsonovy nemoci nebo u esenciálního třesu) k přejímání frekvence nedochází, odvedením pozornosti či pohybem druhostranné končetiny se většinou třes spíše akcentuje, a zatížením končetiny se amplituda třesu snižuje.
Klinické vyšetření třesu je možné zpřesnit přístrojovým vyšetřením, jež je indikováno zejména při důvodném podezření na FT, kdy efekty manévrů na odvedení pozornosti nemusejí být při klinickém vyšetření spolehlivě prokazatelné či při potřebě získat laboratorní nález typický pro FPH, a usnadnit tím pacientovi přijetí diagnózy. Ve vyšetření třesu se používá povrchové EMG z agonistů a antagonistů nebo registrace pohybu akcelerometrem. Lze tak dokumentovat a kvantifikovat variabilitu frekvence nebo přejímání frekvence při příslušném manévru [64]. Podobně jako těmito laboratorními metodami lze provést frekvenční analýzu a prokázat variabilitu či přejímání frekvence třesu z běžného videozáznamu i u nás vyvinutým nástrojem TremAn (volně ke stažení na adrese http:/ / cmp.felk.cvut.cz/ ~uhrikz1/ treman/ ) [65]. Pomocí akcelerometru je navíc možné dokumentovat variabilitu amplitudy a eventuálně i její nárůst po zatížení končetiny s FT závažím. Výzkumné laboratorní práce dále ukázaly např. koaktivaci extenzorů a flexorů při nástupu FT na rozdíl od střídání kontrakcí extenzorů a flexorů u organicky podmíněného třesu [62] či koherenci oscilací FT na různých částech těla na rozdíl od třesů organických (s výjimkou ortostatického) [66]. Při provádění rychlých balistických pohybů nepostižené končetiny je možné na záznamu akcelerometru pozorovat tranzientní přerušení unilaterálního FT [67]. Použití baterie těchto testů má výbornou senzitivitu a specificitu k odlišení FT od organického [68]. Jednotlivé testy a neurofyziologické nálezy u funkčního a organického třesu jsou shrnuty v tab. 5.
Table 5. Typické nálezy pro funkční třes ve srovnání s organickým. 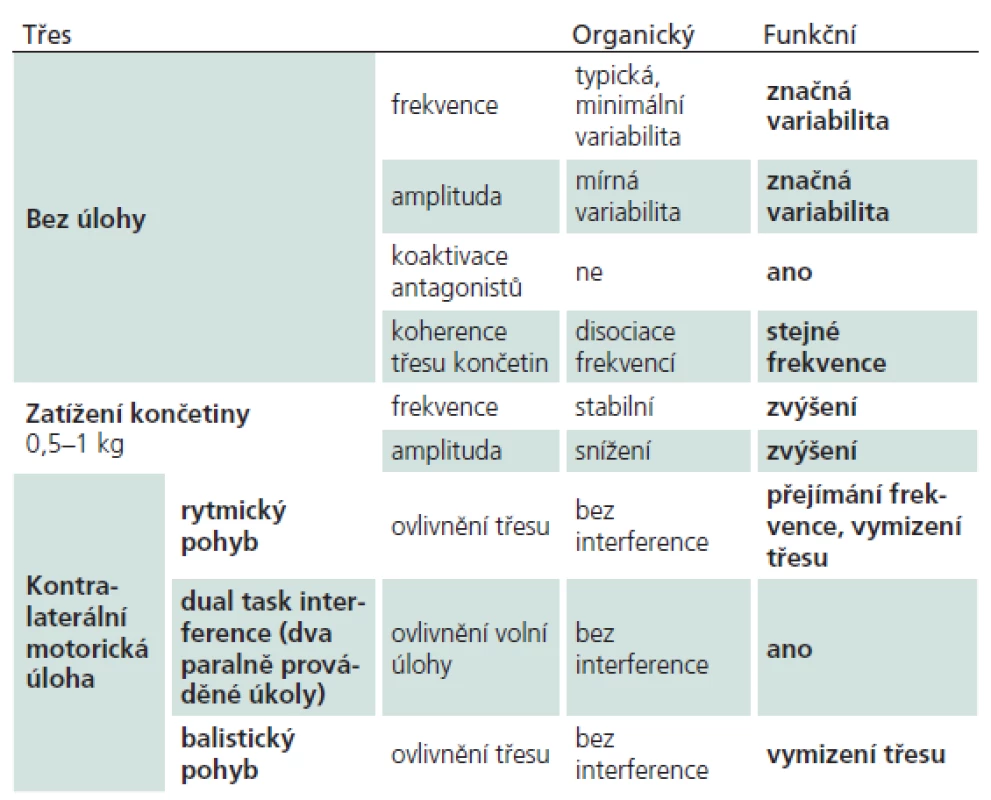
Funkční dystonie
Dystonie je charakterizována abnormálními kroutivými pohyby a abnormálními posturami na podkladě protrahovaných svalových kontrakcí [69]. Funkční dystonie (FD) je ze všech FPH nejobtížněji odlišitelná od organického protějšku. Organické dystonie také často budí bizarní dojem a zároveň mohou připomínat volní pohyby. Podobně jako FPH může být u organické dystonie vazba na specifické úlohy a matoucí může být i anamnéza spontánních remisí. Stejně jako u jiných FPH je nástup FD často náhlý a také může být paroxyzmální. Klinické odlišení mezi organicky podmíněnou a funkční dystonií má jen několik dobrých vodítek. Jedním z nejtypičtějších rysů FD je fixní charakter, a to již od počátku onemocnění. Zatímco organická dystonie na počátku bývá spíše mobilní, vyvolaná pohybem, u FD se jedná o fixní držení typicky s rukou sevřenou v pěst a/ nebo plantárně flektovanou a invertovanou nohou. Fixní dystonie se většinou vyskytuje u žen, často je v anamnéze drobný úraz. Někdy také bývá přítomna výrazná bolest a bolestivost postižené části těla (obvykle ruky, méně často nohy) a někteří z pacientů splňují diagnostická kritéria komplexního regionálního bolestivého syndromu typu 1 (CRPS1). Ten je charakterizován chronickou bolestí (hyperalgezií a alodynií) v kombinaci se senzorickými, autonomními, trofickými a motorickými abnormitami (nejčastěji fixní dystonie, slabost a třes) [43].
Samostatným problémem jsou funkční mimovolní pohyby v obličeji, které většinou nejspíše splňují definiční kritéria pro dystonii. Objevují se izolovaně nebo v kombinaci s jinými FPH. Mohou mít charakter fázických i tonických svalových spazmů. Nejčastěji se projeví fixním stahem rtů (obvykle na jedné straně, směrem dolů, často s vychýlením dolní čelisti), současně může být přítomen ipsilaterální nebo kontralaterální stah víčka a kontrakce m. platysma. Výskyt obličejových spazmů v hemidistribuci (s výjimkou typického a těžko zaměnitelného obrazu lícního hemispazmu) již sám o sobě musí vést k podezření na FPH. Střídání stran výskytu obličejových spazmů pak jistě nelze vysvětlit organickou příčinou, a jedná se tedy prakticky vždy o FPH [70].
Dalším vodítkem v odlišení FD od organické může být atypická lokalizace vzhledem k věku (primární idiopatické dystonie např. DYT 1 s časným počátkem typicky začínají na končetinách a generalizují, zatímco dystonie s počátkem v dospělosti postihují spíše kraniocervikální oblast a většinou negeneralizují) [71]. Při vyšetření s odvedením pozornosti (např. sériové odečítání 7 od 100) se zpravidla nepodaří fixní držení odstranit, ale někdy je možné zachytit zmírnění síly svalového stahu (kdežto dystonie organického původu se obvykle při mentální úloze zhorší). Elektrofyziologické studie mají v diferenciální diagnostice organické a FD jen omezený význam. Chybění koaktivace agonistů a antagonistů, která je v EMG obraze typická pro organické dystonie, může podporovat podezření na FD [13].
Funkční myoklonus
Funkční myoklonus (FM) může vypadat jako náhlý, jednoduchý, rychlý pohyb, stejně jako organický myoklonus [72]. Obvykle je ale FM trochu komplexnější, objevují se u něj vícečetné komponenty a stahy delšího trvání, jež nezapadají do obrazu organických myoklonických syndromů. Stejně jako u organického myoklonu se mohou záškuby objevovat spontánně nebo být vyvolány pohybem či zevním podnětem (reflexní myoklonus na zvukový nebo somatosenzorický podnět). Reflexní záškub však u FM často nastane, i když k očekávanému podnětu nedojde (kladívko se zastaví těsně před dopadem na šlachu) [13] a je pro něj typická variabilní latence odpovědi odpovídající reakčnímu času volních pohybů [73]. Mírnění s odvedením pozornosti může být u intermitentních projevů obtížně prokazatelné. Pro diagnostiku FM je tak zásadní neurofyziologické vyšetření, protože některá kritéria, jako latence reflexního záškubu nebo délka trvání záškubů a také časování náboru jednotlivých svalů v myoklonickém záškubu, je prostým okem obtížně hodnotitelné [74]. U vyšetření myoklonu používáme současnou elektromyografickou registraci z více svalů (poly ‑ EMG). Zatímco pro organicky podmíněný kortikální myoklonus jsou typické záškuby trvání kratšího než 75 ms, u FM se vyskytují záškuby delšího trvání (ovšem záškuby mohou být delšího trvání i u některých subkortikálních myoklonů) a typický je variabilní nábor svalů v jednotlivých záškubech. Další diagnostická metoda FM je EEG se zpětným zprůměrněním několika desítek až 100 úseků EEG záznamu časově vázaných na elektromyograficky registrovaný svalový záškub, což umožní studovat kortikální aktivitu krátce předcházející pohybu. Tento tzv. přípravný potenciál (Readiness Potential neboli Bereitschaftspotenzial) je generován premotorickými oblastmi kortexu a předchází svalovému záškubu o 1 – 2 s, je typický pro volní pohyb nebo pro FM a u organického myoklonu se nevyskytuje [75]. Nález přípravného potenciálu vedl ke stanovení diagnózy FPH u řady pacientů s domnělým idiopatickým spinálním segmentálním a propriospinálním myoklonem, vyznačujícím se flekčními spazmy trupu se záškuby břišní stěny [76,77]. Typické neurofyziologické nálezy v diferenciální diagnostice funkčního a organického myoklonu uvádí tab. 6.
Table 6. Řada NF nálezů je specifických u myoklonu pro funkční etiologii (upraveno podle [13]). ![Řada NF nálezů je specifických u myoklonu pro funkční etiologii (upraveno podle [13]).](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/f3d8377f69172bdca85818a00feb2390.png)
Funkční poruchy chůze
Funkční poruchy chůze izolovaně tvoří asi 10 % FPH, nicméně často se vyskytují společně s jinou FPH [21,78]. Na rozdíl od organicky podmíněných poruch hybnosti jsou funkční poruchy chůze většinou variabilní, mnohdy bizarní, nicméně mohou být klasifikovány do několika typických vzorců vyskytujících se samostatně nebo v kombinacích [79,80]. Jejich společným rysem bývá, že pacienti nejsou schopni svůj problém při chůzi účinně kompenzovat (například instabilitu při chůzi rozšířením báze), a naopak používají kompenzační mechanizmy (třeba neekonomické postury, překřižování DK při chůzi), které objektivně jejich problém spíše zhoršují [81]. Mezi typické vzorce funkčních poruch chůze patří:
- chůze s poruchou rovnováhy (o nepřiměřeně široké bázi, často s paradoxním zlepšením při zkoušce tandemové chůze, případně spontánní provazochodecká chůze nebo chůze rázu astázie ‑ abázie),
- pseudoparetická chůze (kde postižená končetina je tažena za pacientem často ve výrazné externí rotaci) nebo
- extrémní zpomalení chůze se zaujímáním bizarních energeticky náročných poloh, často s hezitacemi a přimrzáním v nákroku vpřed [82].
Funkční parkinsonský syndrom
Parkinsonský syndrom je charakterizován bradykinezí a alespoň jedním z dalších tří projevů – rigiditou, klidovým třesem a/ nebo posturální instabilitou [83]. Jako funkční parkinsonský syndrom (FP) bývá nejčastěji chybně označován funkční tremor bez ostatních rysů parkinsonského syndromu, který je však jen výjimečně izolovaný klidový. U některých pacientů pozorujeme extrémní pomalost, jež může být spojena s výraznou energetickou náročností prováděných pohybů. Bradykineze u FP na rozdíl od Parkinsonovy nemoci nevykazuje dekrement (postupné snižování amplitudy repetitivních pohybů). U FP není přítomna typická rigidita. Lokálně nebo generalizovaně může být zvýšené svalové napětí, které má ovšem na rozdíl od organicky podmíněné rigidity tendenci k ústupu při aktivačních manévrech (nejčastěji klasický Fromentův manévr, kdy při střídavé pronaci ‑ supinaci kontralaterální ruky dochází k zesílení rigidity na vyšetřované končetině, nebo kognitivní úloha – sériové odčítání 100 – 7). Postižení u FP bývá na rozdíl od Parkinsonovy nemoci častěji symetrické, porucha chůze mnohdy s extrémním zpomalením nebo nápadnou nerovnováhou budící bizarní dojem. Synkineze horní končetiny při chůzi může chybět pro těsné připažení. Při pull testu (strhnutí nazad) je výrazná tendence k pádu nazad „jako prkno“, bez obranné reakce. Chybí odpověď nebo se objevují bizarní reakce na dopaminergní léčbu. Z pomocných vyšetření mohou být v analýze třesu u FP užitečné neurofyziologické metody (viz výše). Vyšetření hustoty dopaminových transportérů pomocí SPECT (DaTscan) nebo PET je u FP na rozdíl od Parkinsonovy nemoci normální [84].
Paroxyzmální FPH
FPH se mohou vyskytovat i paroxyzmálně a potom může být obtížné jejich odlišení od organických paroxyzmálních kinezigenních a non‑kinezigenních dyskinezí. Paroxyzmální dyskineze (primární i sekundární) jsou heterogenní skupina charakterizovaná náhlými krátkými epizodami nebo delšími záchvaty mimovolných pohybů (dystonických, choreatických, balistických), jež mohou být spouštěny různými faktory, často specifickými pro daný typ paroxyzmální dyskineze. Recentní práce prokázaly, že organicky podmíněné paroxyzmální dyskineze vznikají nejvíce na podkladu geneticky podmíněných poruch membránového přenosu vzruchů [85]. Tyto paroxyzmální pohyby bývají tak bizarní, že jsou často považovány za funkční poruchy. Proto je u paroxyzmálních poruch hybnosti nutno – kromě hledání charakteristických známek FPH – vždy pomýšlet na přítomnost organické paroxyzmální dyskineze.
Pokud jde o FPH paroxyzmálního rázu, nejběžnějším typem abnormálního pohybu je dystonie, nicméně může se jednat i o paroxyzmy třesu či myoklonu a případně i o jejich kombinaci nebo komplexní vzorce pohybů. Stejně jako jiné FPH jsou inkonzistentní, mění se s odvedením pozornosti, a neodpovídají fenotypu primárních paroxyzmálních dyskinezí. Trvání jednotlivých epizod je různé, ale na rozdíl od organických paroxyzmálních dyskinezí bývá u jednoho pacienta variabilní [86]. Někdy mohou být považovány za funkční neepileptické záchvaty. Důležitá diagnostická pomůcka v analýze záchvatových projevů je pořízení domácího videozáznamu a k odlišení epileptické etiologie je případně nutný EEG monitoring.
Funkční slabost a poruchy čití
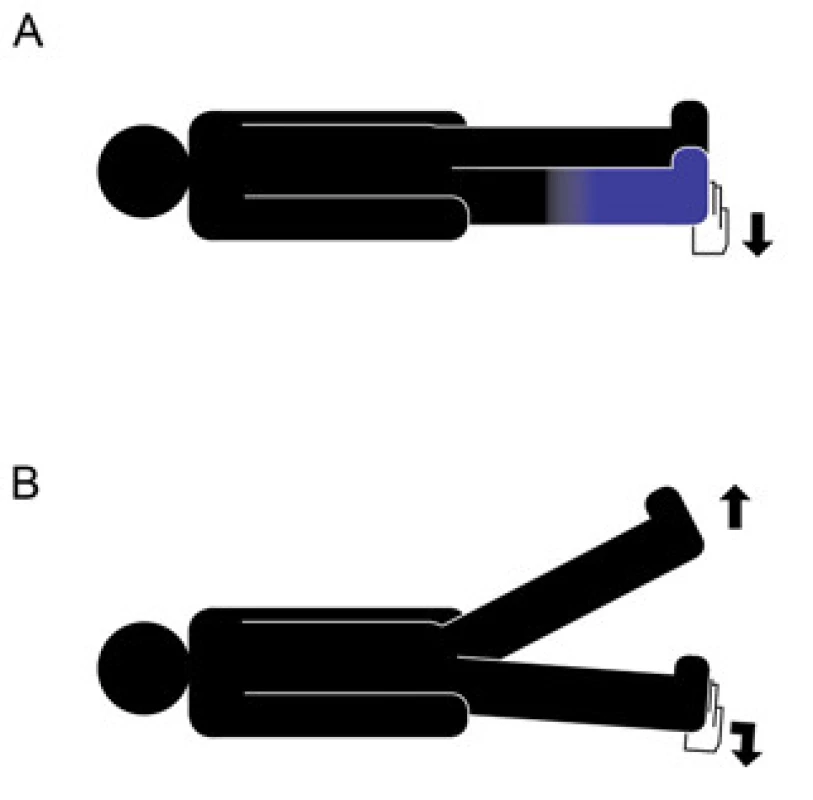
Kromě abnormálního pohybového vzorce může být přítomna funkční slabost nebo funkční porucha čití. Na končetinách může funkční slabost mít charakter „kolabující slabosti“, při které se po krátké výdrži najednou zcela ztratí svalová síla a končetina spontánně či na lehký dotyk padá z výchozí pozice (např. předpažení). Tento projev je typicky inkonzistentní v čase a stejné svalové skupiny u téhož pacienta prokáží po chvíli dobrou sílu a setrvalou výdrž při jiném úkonu (třeba při testování diskriminačního čití na předpažených horních končetinách). Někdy je možné přechodně dosáhnout normální svalové síly buď na pobídku, nebo postupným navyšováním síly vyvíjené na končetinu. Funkční slabost bývá často provázena kokontrakcemi antagonistů, končetina tedy klade odpor při pasivních pohybech, tzv. Gegenhalten – např. při vyšetřování svalové síly flexorů lokte zachytíme při nečekaném provedení pasivního pohybu směrem do flexe odpor způsobený přetrvávající kontrakcí m. triceps. Nejužitečnější test u funkční slabosti na dolních končetinách je vyšetření Hooverova znamení [87]. Spočívá ve fyziologickém jevu, kdy při flexi kyčle na jedné straně (proti váze končetiny či proti odporu) dochází k extenzi kyčle kontralaterálně. U funkční slabosti pozorujeme diskrepanci ve svalové síle mezi volní extenzí kyčle (je oslabená při cíleném vyšetření extenze) a mimovolní extenzí (projeví se normální silou extenze při testování flexe na druhé končetině, ke které je i napřená pozornost) (obr. 1). Výsledky tohoto vyšetření ovšem mohou být falešně pozitivní u bolesti nebo kortikálního neglectu [27,88].
U FPH mohou být zároveň přítomny poruchy čití. Typicky je jejich distribuce neanatomická např. u hemihypestezií s hranicí čití přesně ve střední čáře (ta může teoreticky být nalezena i u thalamických lézí), poruchy čití na končetinách končící u třísel nebo ramen. U vyšetření čití se ovšem doporučuje neohrozit důvěru a spolupráci pacienta tím, že budeme používat testy, které se ho snaží „nachytat“, jako je zkouška typu „Řekněte, ANO, když ucítíte dotyk, a NE, když ho neucítíte“ [89].
Diagnostický postup
Diagnóza FPH je založena primárně na průkazu typických známek funkční poruchy (inkonzistence a inkongruence s projevy organického onemocnění) a teprve sekundárně na vyloučení projevů organicky podmíněného neurologického onemocnění v objektivním nálezu a v pomocných vyšetřeních. Jak již bylo řečeno, ke stanovení diagnózy FPH mohou přispět i typické anamnestické údaje a přítomnost dalších funkčních projevů. Základní diferenciálně diagnostické rozdíly jednotlivých typů FPH a jejich organických protějšků, hlavní klinické testy a užitečná pomocná vyšetření uvádí tab. 7.
Table 7. Diferenciální diagnostika organických a funkčních poruch hybnosti. 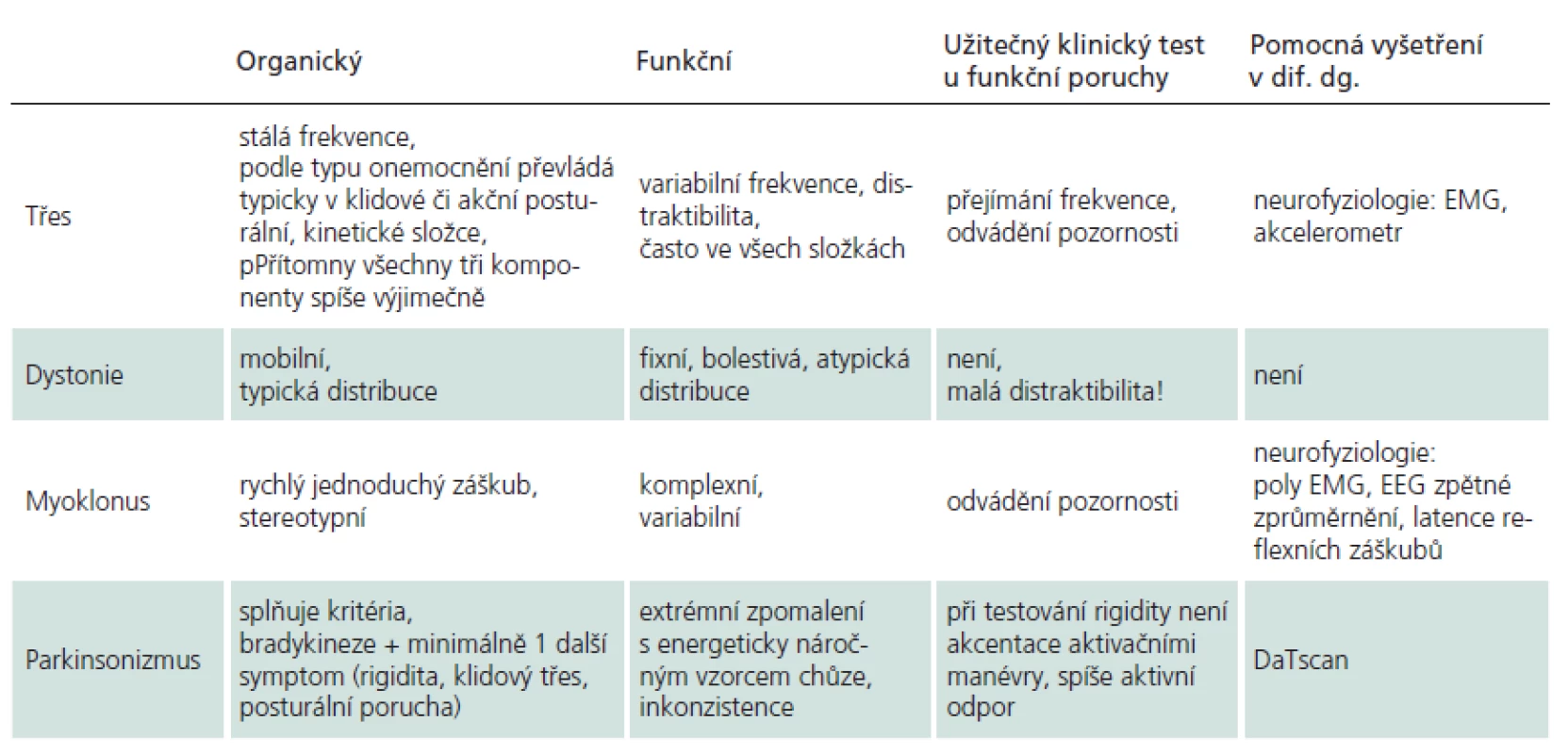
Zkušený neurolog by měl být schopen stanovit diagnózu FPH na základě nálezu neurologického vyšetření včetně výše uvedených specifických pozitivních známek a manévrů pro průkaz FPH. Pomocná vyšetření k potvrzení diagnózy FPH (především klinicko‑neurofyziologická u funkčního třesu a myoklonu) jsou indikována, nejsme‑li si jisti diagnózou např. u chronických FPH, u nichž je abnormální pohyb natolik „integrován“, že je v podstatě konzistentní a může být těžké ho ovlivňovat třeba odvedením pozornosti. Pomocná vyšetření jsou též indikována, když se domníváme, že pacient spíš přijme diagnózu a vyhledá léčbu, pokud bude mít objektivní důkaz z testu, který podporuje naše klinické závěry. A konečně je indikujeme v případě, že máme podezření na koexistenci FPH a organického onemocnění.
Pokud je potřeba vyloučit možnou organickou příčinu (tj. příčinu reálně připadající v úvahu dle příznaků a průběhu onemocnění), mělo by se tak stát jednorázově provedenými standardními diagnostickými vyšetřeními. Je třeba mít na paměti, že extenzivní a opakovaná vyšetřování „pro jistotu“, k vyloučení (nereálné či již dříve vyloučené) organické příčiny pacienty s FPH poškozují tím, že oddalují konečné stanovení diagnózy a zahájení vhodného léčebného postupu. Náhodné nálezy přitom mohou pacienta utvrzovat v přesvědčení, že se jedná o organické onemocnění, a ztížit pacientovi jeho vyrovnání se s diagnózou FPH (přitom např. náhodný nález drobné hyperintenzity v T2 obrazu MR nebo pozitivita anamnestických boreliových protilátek v krvi rozhodně nevysvětlí distraktibilní třes anebo funkční slabost s pozitivním Hooverovým znamením). Provádění dalších a dalších vyšetření implikuje podezření na různá závažná onemocnění, a pacienti tak navštěvují další a další odborníky. Všemi peripetiemi senzibilizovaný a nejednou důkladně laicky medicínsky vyškolený pacient ovšem snadno vycítí lékařovu bezradnost a může reagovat přecitlivěle, zvláště když se navíc setká se zpochybňováním závažnosti svých obtíží, přestože je jimi značně invalidizován. Pacient tak osciluje mezi obavami z toho, že lékař přehlíží jeho závažné onemocnění, a pocitem, že se sám „zbláznil“. A může tak sekundárně dojít k rozvoji úzkostné nebo depresivní symptomatiky a k dalšímu zhoršení příznaků FPH, které jsou psychickým stavem pacienta ovlivněny stejně jako jakékoli jiné příznaky.
Diagnostická kritéria FPH
První diagnostická kritéria FPH navrhli Fahn a Williams v roce 1988. Přestože tato kritéria představovala významný pokrok v poznání FPH a umožnila významné zlepšení jejich diagnostiky, v souladu s dalším vývojem byla nedávno navržena jejich revize podle Gupty a Langa. Podle ní ke stanovení klinicky definitivní diagnózy FPH stačí klinický nález inkonzistence příznaků a jejich inkongruence s projevy pohybové poruchy u organicky podmíněného extrapyramidového onemocnění, bez nutnosti nálezu jiných přídatných funkčních příznaků, mnohočetných somatizací nebo zřejmé psychiatrické poruchy. Nově byla přidána kategorie laboratorně podpořené definitivní diagnózy FPH, spočívající na pozitivních elektrofyziologických nálezech u funkčního třesu a myoklonu [22,51]. Původní i revidovaná kritéria jsou shrnuta v tab. 8. Ke změnám došlo recentně i v definici motorické konverzní poruchy. Podle poslední revize DSM ‑ 5 již pro diagnózu motorické konverzní poruchy není nutné zjištění psychologických faktorů předcházejících rozvoj nebo exacerbaci hybných projevů, a tak se kritéria motorické konverzní poruchy přiblížila současné definici FPH [10,90].
Table 8. Původní a nově navržená diagnostická kritéria FPH. 
Sdělení diagnózy a terapeutické postupy u psychogenních poruch
Diagnóza FPH musí být stanovena a sdělena pacientovi co možná nejdříve, jakmile jsou splněna diagnostická kritéria. Pokud se sdělení diagnózy odkládá a dochází k jejímu opakovanému ověřování, hrozí ztráta důvěry pacienta v lékaře, vyhledávání dalších odborníků, opakování již provedených a dalších zcela zbytečných, často nákladných a zatěžujících vyšetření. Dochází také k nasazování chybně indikovaných léků s rizikem nežádoucích účinků či dokonce ke zbytečným chirurgickým výkonům. Výsledkem takových postupů je, že pacient upevní své přesvědčení o tom, že trpí závažným organickým onemocněním, a zároveň se snižuje šance na účinnost správně cíleného léčebného postupu. Zdá se přitom, že časné vysvětlení problému, přijetí diagnózy FPH pacientem a pacientova důvěra v lékaře mohou příznivě ovlivnit prognózu u funkčních motorických příznaků [50,91,92].
Pokud pacient není v dané chvíli schopen přijmout diagnózu funkčního postižení, je v případě klinicky pravděpodobné či stanovené diagnózy nutno sepsat zprávu s jasným diagnostickým závěrem a dle možnosti informovat další ošetřující lékaře, aby se předešlo opakovanému vyšetřování a oddalování vhodného léčebného postupu.
V posledních letech se objevují kromě kazuistik i první kontrolované práce hodnotící efekt různých léčebných přístupů. Široké spektrum terapeutických přístupů zahrnuje fyzioterapii, psychoterapii, hypnózu, antidepresivní medikaci, neinvazivní stimulační techniky.
Vzhledem k chybění dat z kvalitně navržených studií s dostatečnou statistickou silou bývá doporučován multimodální přístup. Doporučený praktický postup je z velké části založen na zkušenostech převzatých ze specializovaných pracovišť a také na zkušenosti s funkčními symptomy z jiných oborů [12,88]. Praktická doporučení z nich vycházející jsou uvedena v tab. 9. U léčby funkčních symptomů obecně platí, že non‑farmakologické prostředky, které zahrnují aktivní účast pacienta, jako je např. kognitivně‑behaviorální terapie (KBT) nebo aktivní cvičení, jsou účinnější než pasivní postupy, jakými jsou operace nebo podávání injekcí. Také platí (podobně jako u léčby chronické bolesti), že farmakologické prostředky působící na centrální nervový systém (antidepresiva, antiepileptika aj.) jsou účinnější než léky ovlivňující periferní dysfunkci [93].
Table 9. Léčebný přístup k pacientovi s FPH. 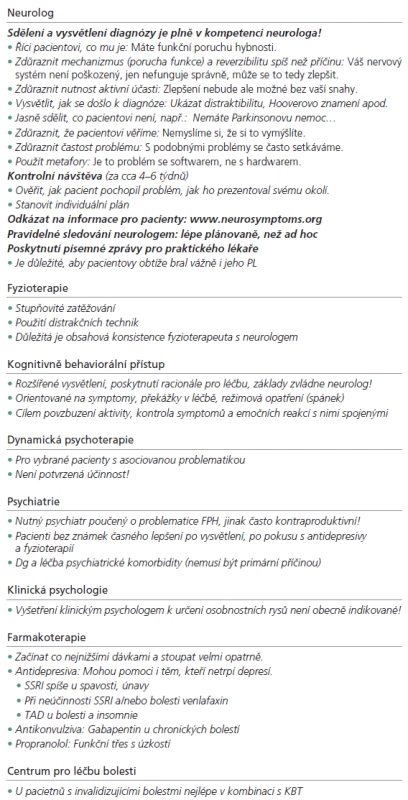
Přijatelnost jednotlivých léčebných přístupů a jejich dostupnost musí být v každém jednotlivém případě zvážena individuálně. U pacientů s FPH je třeba respektovat , že mnoho z nich nepovažuje roli psychologických faktorů v souvislosti se svými FS za důležitou, a proto nebudou dobře akceptovat léčbu spočívající pouze na psychoterapii či kognitivně‑behaviorální terapii (KBT). Zlepšení pak mohou přinést u lehčích případů prosté vysvětlení podstaty FPH a sledování na bázi pravidelných plánovaných kontrol u neurologa, dále fyzioterapie či KBT zaměřená na symptomy.
Sledování neurologem
Pacienti s FPH by měli být primárně sledováni neurologem, který řídí léčebný postup. Bylo prokázáno, že kontrolní návštěvy u neurologa, jež jsou pravidelné, předem plánované a ne jen vázané na případná zhoršení stavu, mají pozitivní vliv na vývoj onemocnění [50]. Zdá se, že příznaky FPH mohou příznivě odpovídat na terapii antidepresivy [94], jejichž účinnost byla prokázána i u somatoformních poruch a medicínsky nevysvětlených symptomů [95].
Při kontrolní návštěvě také můžeme předat pacientovi informaci o FPH na letáku či odkaz na českou anebo anglickou verzi stránek www.neurosymptoms.org, které byly sestaveny dr. J. Stonem z Edinburghu. Pacientovi i jeho blízkým mohou pomoci pochopit mechanizmus funkčních symptomů a rovněž poskytují řadu praktických návodů k samostatnému aktivnímu přístupu v jejich zvládání.
Fyzioterapie
Zejména u pacientů, u kterých není role psychologických faktorů zřejmá nebo není z osobních důvodů přijatelná, by měla hrát fyzioterapie v léčbě FPH primární úlohu [96]. Ačkoli dosud byla provedena jediná kontrolovaná studie [97], podle systematické analýzy dosud publikovaných kazuistických sdělení a malých otevřených studií se zdá, že fyzioterapie může být účinná se zlepšením u 60 – 70 % pacientů [98].
Důležitou součástí, v podstatě nutným předpokladem úspěchu fyzioterapie, je vysvětlit pacientovi, jak je možné pomocí rehabilitace dosáhnout zmírnění symptomů. Tady je zásadní, aby vysvětlení fyzioterapeuta souhlasilo s vysvětlením, které podává neurolog. Je tedy vhodné znovu demonstrovat efekty odvedení pozornosti a další manévry, jimiž se funkční symptomy zmírňují. Na nich pak fyzioterapeut může stavět vlastní techniky a návody ke cvičení pro pacienta. První postupy, které může pacient sám vyzkoušet, tedy zahrnují odvádění pozornosti (například provádění motorických úkonů nepostiženou končetinou – práce s míčem, rytmické pohyby prsty ruky, psaní SMS na telefonu), facilitace automatických posturálních a rovnovážných reakcí (sed na míči), běžných denních, sportovních a rekreačních aktivit [98]. Následuje postupné zvyšování fyzické zátěže nebo náročnosti úloh. Na počátku se doporučuje stanovení minimálního výkonu, který nevede k únavě a je bez problémů zvládnutelný, a vyvarování se excesů, jež obvykle zhoršují symptomy. Tyto postupy může pacient pak dále provádět individuálně bez kontinuálního odborného vedení [12]. Je možné použít kombinaci motorického nácviku (re‑learning) spolu s behaviorálním přístupem (podpořit správné pohybové vzorce oceněním a současně ignorovat abnormální pohyby a maladaptivní chování).
Psychiatrická a psychologická intervence
Psychiatrické vyšetření zvažujeme u pacientů bez známek časného zlepšení po vysvětlení a po pokusu s antidepresivy a fyzioterapií. Zkušený psychiatr může pomoci při rozpoznání a léčbě základních psychiatrických problémů u FPH, tj. úzkosti, deprese, panických atak. Psychiatr může většinou této problematice věnovat větší časový prostor, než jaký je k dispozici v ambulanci neurologa, a může cíleněji indikovat psychoaktivní medikaci s ohledem na její možné žádoucí i nežádoucí účinky. Psychiatr může také pomoci v diagnostice a léčbě dalších psychiatrických komorbidit, jako jsou obsedantně‑kompulzivní porucha, posttraumatická stresová porucha, bipolární porucha atp. Platí, že pacienti s FPH by měli být posíláni ke specialistům, kteří se těmito poruchami zabývají. Odeslání k psychiatrovi bez zkušenosti s funkčními poruchami může být kontraproduktivní, traumatizující pro pacienta a při nepřítomnosti jasné psychiatrické problematiky může vést ke zpochybnění diagnózy FPH. Ze stejného důvodu není u FPH obecně indikováno vyšetření klinickým psychologem k určení osobnostních rysů. Jistě se ovšem setkáme i s pacienty, kde již z neurologického vyšetření vyplývá přítomnost psychopatologie, která si v rámci individuálního přístupu vyžádá brzkou psychologickou či psychiatrickou intervenci.
Psychoterapeutické přístupy a další léčebné metody
Obecný problém s posouzením efektu psychoterapie vyplývá z její podstaty, která nedovoluje klasické dvojitě zaslepené ověření účinnosti. Druhý problém spočívá v tom, že práce sledující účinky psychoterapie obvykle vycházejí z klasických diagnostických kategorií psychogenních či somatoformích poruch a není zřejmé, nakolik by zařazení pacienti splnili nová diagnostická kritéria FPH. Některé z klasických psychoterapeutických postupů však prokázaly nepochybné efekty v otevřených studiích či v souborech kazuistik pacientů s těmito poruchami.
Kognitivně‑behaviorální terapie se zaměřuje na ovlivnění způsobu myšlení, emočních reakcí a chování vzhledem k funkčním příznakům. Hlavním cílem kognitivně‑behaviorálního přístupu je změnit jakékoliv vzorce, které by byly ve vztahu k onemocnění maladaptivní. Účinnost KBT nebyla zkoumána u FPH. Podle systematické analýzy randomizovaných kontrolovaných studií je však KBT nejlépe podložená terapeutická metoda u řady somatoformních onemocnění a jiných medicínsky nevysvětlených příznaků [95]. Rovněž byla prokázána účinnost KBT u psychogenních neepileptických záchvatů [99].
Dynamická psychoterapie bývá tradičně považovaná za vhodný léčebný přístup u psychogenních poruch. Počet randomizovaných kontrolovaných studií efektu dynamické psychoterapie je ale velmi omezený a navíc jsou bez konzistentních výsledků [95,100]. V klinické praxi se nicméně dosti často setkáváme s případy FPH, u kterých se role psychodynamických a psychosociálních faktorů zdá být významná. Potom může být užitečné pokusit se tyto faktory léčebně ovlivnit vhodným psychoterapeutickým přístupem.
Ojedinělé práce prokázaly u pacientů se somatoformními poruchami účinnost hypnózy využívající strategii orientovanou na symptomy a náhled [101,102].
Transkraniální magnetická stimulace (TMS) může rovněž pozitivně ovlivnit motorické symptomy při FPH, avšak zatím není jasné, do jaké míry má TMS účinek na neuromodulaci a do jaké míry se jedná o placebo efekt [103].
Prognóza a invalidita
Data týkající se prognózy FPH jsou velmi omezená, pocházejí většinou z retrospektivních studií. Celková prognóza FPH se zdá být nepříznivá. Podle systematické analýzy dosavadních studií podíl pacientů, kteří dosáhli kompletní remise, činil cca 20 %, zatímco asi 40 % pacientů bylo po delším sledování postiženo stejně nebo hůře [50]. Pacienti vykazovali vysokou míru závislosti, invalidity a pracovní neschopnosti. Pacienti s funkční dystonií a funkčním třesem mají horší prognózu než pacienti s funkční slabostí.
Krátké trvání symptomů před stanovením diagnózy bylo konzistentně spojeno s lepšími výstupy. Psychiatrická komorbidita (úzkost a deprese) ve většině studií naopak predikovala horší výsledky. Věk na prognózu nejspíše nemá vliv. Překvapivě ale prognózu negativně neovlivňují probíhající soudní spory, ale spíše pobírání zdravotních finančních dávek.
FPH pacienty často značně invalidizují a vedou k pracovní neschopnosti nejméně stejnou měrou jako organická neurologická onemocnění. Zdá se ovšem, že na rozdíl od pacientů s organickými onemocněními jsou FPH spojeny s větším emočním stresem než jejich organické protějšky [104,105]. Je pravděpodobné, že FPH představují značnou ekonomickou zátěž, a to nejen pro zdravotnický systém. Ve Velké Británii byly odhadované náklady spojené s funkčními poruchami u pacientů v produktivním věku srovnatelné s úhrnnými náklady spojenými s demencí ve všech věkových skupinách [3].
Závěry pro praxi
FPH představují nezanedbatelnou část naší práce. Diagnóza FPH je plně v kompetenci neurologa. Měla by spočívat především na průkazu pozitivních klinických nálezů charakteristických pro FPH (inkonzistence příznaků a inkongruence s organickým onemocněním) a nikoli pouze na vyloučení všech organických příčin.
Kauzální role psychologických faktorů byla zpochybněna a dogmatické pátrání po vyvolávajícím psychologickém traumatu, stejně jako po sekundárním zisku nebo jiných udržovacích faktorech běžných i u organických onemocnění, může být zavádějící a neužitečné. Pomocná vyšetření mají být provedena rychle a s jasným upozorněním, že budou pravděpodobně normální, nebo mohou být prokázány nespecifické nálezy, kterými nelze vysvětlit aktuální problémy. Vysvětlení funkční podstaty obtíží (pozitivní diagnóza) by mělo mít přednost před vysvětlováním, o jaký problém se nejedná (negativní diagnóza). Z hlediska prognózy je rozhodující časné stanovení diagnózy a její přijetí pacientem. Pacient by měl obdržet lékařskou zprávu s jasným závěrem pro něj i jeho ošetřujícího lékaře. V případě diagnostických či terapeutických nejasností by pacienti s FPH měli být odesláni do specializovaných center.
Léčebný přístup je multimodální s dominantní úlohou neurologa, který stanovuje a sděluje diagnózu a řídí léčebný postup. Vhodná je spolupráce s psychiatrem a psychologem se zkušenostmi s touto problematikou, nicméně tato spolupráce nebude vždy dostupná. Pacienti s FPH si vzhledem k míře invalidizace vyvolané často dlouhodobě přetrvávajícími obtížemi zaslouží naši pozornost stejně jako pacienti s patologicky definovanými nemocemi.
MUDr. Tereza Serranová, Ph.D.
V roce 1997 absolvovala 1. LF UK v Praze a od té doby pracuje na Neurologické klinice VFN a 1. LF UK, postupně jako sekundární lékařka, vědecká pracovnice a odborná asistentka. V roce 2005 získala 2. atestaci z neurologie a v roce 2012 titul Ph.D. obhajobou dizertační práce na téma „Změny emočních a motivačních procesů u pacientů s Parkinsonovou nemocí léčených hlubokou mozkovou stimulací subthalamického jádra“. V roce 2007 absolvovala stáž na jednotce Movement Disorders v Hospital Clinic v Barceloně, a následně v letech 2008 – 2011 strávila v tamější neurofyziologické laboratoři několik výzkumných pobytů zaměřených na studium subkortikální motorické přípravy u extrapyramidových onemocnění. Jejími subspecializacemi v neurologii jsou extrapyramidová onemocnění a funkční poruchy. Absolvovala krátkodobou stáž zaměřenou na praktický management funkčních poruch v neurologii v Edinburghu a spravuje českou verzi webových stránek pro pacienty s funkčními a disociativními poruchami www.neurosymptoms.org. V současnosti jsou jejími hlavními výzkumnými zájmy změny v emočních a motivačních procesech u extrapyramidových onemocnění a patofyziologie funkčních poruch hybnosti.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
MUDr. Tereza Serranová, Ph.D
Neurologická klinika
1. LF UK a VFN
Kateřinská 30
128 08 Praha 2
e-mail: tereza.serranova@vfn.cz
Recenzenti
doc. MUDr. Jiří Hovorka, CSc.
doc. MUDr. Klára Látalová, Ph.D.
MUDr. Katarína Oberreignerů
Přijato k recenzi: 15. 1. 2014
Přijato do tisku: 31. 3. 2014
Sources
1. Stone J, Carson A, Duncan R, Roberts R, Warlow C, Hibberd C et al. Who is referred to neurology clinics? – the diagnoses made in 3781 new patients. Clin Neurol Neurosurg 2010; 112(9): 747 – 751. doi: 10.1016/ j.clineuro.2010.05.011.
2. Wessely S, Nimnuan C, Sharpe M. Functional somatic syndromes: one or many? Lancet 1999; 354(9182): 936 – 939.
3. Edwards MJ, Bhatia KP. Functional (psychogenic) movement disorders: merging mind and brain. Lancet Neurol 2012; 11(3): 250 – 260. doi: 10.1016/ S1474 - 4422(11)70310 - 6.
4. Edwards MJ, Fotopoulou A, Pareés I. Neurobiology of functional (psychogenic) movement disorders. Curr Opin Neurol 2013; 26(4): 442 – 447. doi: 10.1097/ WCO.0b013e3283633953.
5. Album D, Westin S. Do diseases have a prestige hierarchy? A survey among physicians and medical students. Soc Sci Med 2008; 66(1): 182 – 188.
6. Espay AJ, Goldenhar LM, Voon V, Schrag A, Burton N, Lang AE. Opinions and clinical practices related to diagnosing and managing patients with psychogenic movement disorders: an international survey of movement disorder society members. Mov Disord 2009; 24(9): 1366 – 1374. doi: 10.1002/ mds.22618.
7. Stone J, Wojcik W, Durrance D, Carson A, Lewis S, MacKenzie L et al. What should we say to patients with symptoms unexplained by disease? The “number needed to offend”. BMJ 2002; 325(7379): 1449 – 1450.
8. Edwards MJ, Stone J, Lang AE. From psychogenic movement disorder to functional ovement disorder: It’s time to change the name. Mov Disord 2013. In press. doi: 10.1002/ mds.25562.
9. MKN ‑ 10. Mezinárodní statistická klasifikace nemocí a přidružených zdravotních problémů. 2013 [online]. Available from: http:/ / www.uzis.cz/ cz/ mkn/ F40 – F48.html.
10. American Psychiatric Association. Diagnostic and statistical manual of mental disorders. 5th ed. Arlington, VA: American Psychiatric Publishing 2013.
11. Sharpe M. Distinguishing malingering from psychiatric disorders. In: Halligan PW, Bass C, Oakley DA (eds). Malingering and Illness Deception. Oxford, UK: Oxford University Press 2003 : 156 – 170.
12. Stone J, Carson A, Sharpe M. Functional symptoms in neurology: management. J Neurol Neurosurg Psychiatry 2005; 76 (Suppl 1): i13 – i21.
13. Hallett M. Physiology of psychogenic movement disorders. J Clin Neurosci 2010; 17(8): 959 – 965. doi: 10.1016/ j.jocn.2009.11.021.
14. Halligan PW, Bass C, Oakley DA. Wilful deception as illness behaviour. In: Halligan PW, Bass C, Oakley DA (eds). Malingering and Illness Deception. Oxford, UK: Oxford University Press 2003; 3 – 28.
15. Akagi H, House A. The epidemiology of hysterical conversion. In: Halligan PW, Bass C, Marshall JC (eds). Contemporary approaches to the study of hysteria: clinical and theoretical perspectives. Oxford: Oxford University Press 2001; 73 – 87.
16. Factor SA, Podskalny GD, Molho ES. Psychogenic movement disorders: frequency, clinical profile and characteristics. J Neurol Neurosurg Psychiatry 1995; 59(4): 406 – 412.
17. Cubo E, Hinson VK, Goetz CG, Garcia Ruiz P, Garcia de Yebenes J, Marti MJ et al. Transcultural comparison of psychogenic movement disorders. Mov Disord 2005; 20(10): 1343 – 1345.
18. Williams DT, Ford B, Fahn S. Phenomenology and psychopathology related to psychogenic movement disorders. Adv Neurol 1995; 65 : 231 – 257.
19. Schwingenschuh P, Pont ‑ Sunyer C, Surtees R, Edwards MJ, Bhatia KP. Psychogenic movement disorders in children: a report of 15 cases and a review of the literature. Mov Disord 2008; 23(13): 1882 – 1888. doi: 10.1002/ mds.22280.
20. Batla A, Stamelou M, Edwards MJ, Parees I, Saifee TA, Fox Z et al. Functional movement disorders are not uncommon in the elderly. Mov Disord 2013; 28(4): 540 – 543. doi: 10.1002/ mds.25350.
21. Lang A. General overview of psychogenic movement disorders: epidemiology, diagnosis, and prognosis. In: Hallett M, Fahn S, Jankovic J, Lang AE, Cloninger CR, Yudofsky SC (eds). Psychogenic movement disorders. Philadelphia: Lippincott Williams & Wilkins 2006; 35 – 41.
22. Fahn S, Williams DT. Psychogenic dystonia. Adv Neurol 1988; 50 : 431 – 455.
23. Sharpe D, Faye C. Non ‑ epileptic seizures and child sexual abuse: a critical review of the literature. Clin Psychol Rev 2006; 26(8): 1020 – 1040.
24. Roelofs K, Keijsers GP, Hoogduin KA, Naring GW, Moene FC. Childhood abuse in patients with conversion disorder. Am J Psychiatry 2002; 159(11): 1908 – 1913.
25. Kranick S, Ekanayake V, Martinez V, Ameli R, Hallett M, Voon V. Psychopathology and psychogenic movement disorders. Mov Disord 2011; 26(10): 1844 – 1850. doi: 10.1002/ mds.23830.
26. Chabrol H, Peresson G, Clanet M. Lack of specificity of the traditional criteria for conversion disorders. Eur Psychiatry 1995; 10(6): 317 – 319. doi: 10.1016/ /0924 - 9338(96)80314 - 2.
27. Gould R, Miller BL, Goldberg MA, Benson DF. The validity of hysterical signs and symptoms. J Nerv Ment Dis 1986; 174(10): 593 – 597.
28. Raskin M, Talbott JA, Meyerson AT. Diagnosis of conversion reactions. Predictive value of psychiatric criteria. JAMA 1966; 197(7): 530 – 534.
29. Sharma P, Chaturvedi SK. Conversion disorder revisited. Acta Psychiatr Scand 1995; 92(4): 301 – 304.
30. Bishop ER jr, Torch EM. Dividing “hysteria”: a preliminary investigation of conversion disorder and psychalgia. J Nerv Ment Dis 1979; 167(6): 348 – 356.
31. Roelofs K, Spinhoven P, Sandijck P, Moene FC, Hoogduin KA. The impact of early trauma and recent life ‑ events on symptom severity in patients with conversion disorder. J Nerv Ment Dis 2005; 193(8): 508 – 514.
32. Voon V, Brezing C, Gallea C, Ameli R, Roelofs K, LaFrance WC jr et al. Emotional stimuli and motor conversion disorder. Brain 2010; 133(5): 1526 – 1536. doi: 10.1093/ brain/ awq054.
33. Voon V, Brezing C, Gallea C, Hallett M. Aberrant supplementary motor complex and limbic activity during motor preparation in motor conversion disorder. Mov Disord 2011; 26(13): 2396 – 2403. doi: 10.1002/ mds.23890.
34. Voon V, Gallea C, Hattori N, Bruno M, Ekanayake V, Hallett M. The involuntary nature of conversion disorder. Neurology 2010; 74(3): 223 – 228. doi: 10.1212/ WNL.0b013e3181ca00e9.
35. Browning M, Fletcher P, Sharpe M. Can neuroimaging help us to understand and classify somatoform disorders? A systematic and critical review. Psychosom Med 2011; 73(2): 173 – 184. doi: 10.1097/ PSY.0b013e31820824f6.
36. Pareés I, Kassavetis P, Saifee TA, Sadnicka A, Davare M,Bhatia KP et al. Failure of explicit movement control in patients with functional motor symptoms. Mov Disord 2013; 28(4): 517 – 523. doi: 10.1002/ mds.25287.
37. Roelofs K, van Galen GP, Eling P, Keijsers GP, Hoogduin CA. Endogenous and exogenous attention in patients with conversion paresis. Cogn Neuropsychol 2003; 20(8): 733 – 745. doi: 10.1080/ 02643290342000069.
38. Schrag AE, Mehta AR, Bhatia KP, Brown RJ, Frackowiak RS, Trimble MR et al. The functional neuroimaging correlates of psychogenic versus organic dystonia. Brain 2013; 136(3): 770 – 781. doi: 10.1093/ brain/ awt008.
39. Pareés I, Saifee TA, Kassavetis P, Kojovic M, Rubio ‑ Agusti I, Rothwell JC et al. Believing is perceiving: mismatch between self ‑ report and actigraphy in psychogenic tremor. Brain 2012; 135(1): 117 – 123. doi: 10.1093/ brain/ awr292.
40. Edwards MJ, Moretto G, Schwingenschuh P, Katschnig P, Bhatia KP, Haggard P. Abnormal sense of intention preceding voluntary movement in patients with psychogenic tremor. Neuropsychologia 2011; 49(9): 2791 – 2793. doi: 10.1016/ j.neuropsychologia.2011.05.021.
41. Kranick SM, Moore JW, Yusuf N, Martinez VT, LaFaver K, Edwards MJ et al. Action ‑ effect binding is decreased in motor conversion disorder: implications for sense of agency. Mov Disord 2013; 28(8): 1110 – 1116. doi: 10.1002/ mds.25408.
42. Lorenz J, Hauck M, Paur RC, Nakamura Y, Zimmermann R, Bromm B et al. Cortical correlates of false expectations during pain intensity judgments – a possible manifestation of placebo/ nocebo cognitions. Brain Behav Immun 2005; 19(4): 283 – 295.
43. Schrag A, Trimble M, Quinn N, Bhatia K. The syndrome of fixed dystonia: an evaluation of 103 patients. Brain 2004; 127(10): 2360 – 2372.
44. Hotopf M, Mayou R, Wadsworth M, Wessely S.Childhood risk factors for adults with medically unexplained symptoms: results from a national birth cohort study. Am J Psychiatry 1999; 156(11): 1796 – 1800.
45. Crimlisk HL, Bhatia K, Cope H, David A, Marsden CD,Ron MA. Slater revisited: 6 year follow up study of patients with medically unexplained motor symptoms. BMJ 1998; 316(7131): 582 – 586.
46. Stewart DE. The changing faces of somatization. Psychosomatics 1990; 31(2): 153 – 158.
47. Ismail K, Lewis G. Multi‑symptom illnesses, unexplained illness and Gulf War Syndrome. Philos Trans R Soc Lond B Biol Sci 2006; 361(1468): 543 – 551.
48. Edwards MJ, Adams RA, Brown H, Parees I, Friston KJ. A Bayesian account of ‘hysteria’. Brain 2012; 135(11): 3495 – 3512. doi: 10.1093/ brain/ aws129.
49. Heintz CE, van Tricht MJ, van der Salm SM, van Rootselaar AF, Cath D, Schmand B et al. Neuropsychological profile of psychogenic jerky movement disorders: importance of evaluating non‑credible cognitive performance and psychopathology. J Neurol Neurosurg Psychiatry 2013; 84(8): 862 – 867. doi: 10.1136/ jnnp ‑ 2012 - 304397.
50. Gelauff J, Stone J, Edwards M, Carson A. The prognosis of functional (psychogenic) motor symptoms: a systematic review. J Neurol Neurosurg Psychiatry 2014; 85(2): 220 – 226. doi: 10.1136/ jnnp ‑ 2013 - 305321.
51. Gupta A, Lang AE. Psychogenic movement disorders. Curr Opin Neurol 2009; 22(4): 430 – 436. doi: 10.1097/ WCO.0b013e32832dc169.
52. van Poppelen D, Saifee TA, Schwingenschuh P, Katschnig P, Bhatia KP, Tijssen MA et al. Attention to self in psychogenic tremor. Mov Disord 2011; 26(14): 2575 – 2576. doi: 10.1002/ mds.23911.
53. Stone J, Smyth R, Carson A, Warlow C, Sharpe M. La belle indifférence in conversion symptoms and hysteria: systematic review. Br J Psychiatry 2006; 188 : 204 – 209.
54. Lader M, Sartorius N. Anxiety in patients with hysterical conversion symptoms. J Neurol Neurosurg Psychiatry 1968; 31(5): 490 – 495.
55. Rice DG, Greenfield NS. Psychophysiological correlates of la belle indifference. Arch Gen Psychiatry 1969; 20(2): 239 – 245.
56. Carson AJ, Brown R, David AS, Duncan R, Edwards MJ,Goldstein LH et al. Functional (conversion) neurological symptoms: research since the millennium. J Neurol Neurosurg Psychiatry 2012; 83(8): 842 – 850. doi: 10.1136/ jnnp ‑ 2011 - 301860.
57. Feinstein A, Stergiopoulos V, Fine J, Lang AE. Psychiatric outcome in patients with a psychogenic movement disorder: a prospective study. Neuropsychiatry Neuropsychol Behav Neurol 2001; 14(3): 169 – 176.
58. Kim YJ, Pakiam AS, Lang AE. Historical and clinical features of psychogenic tremor: a review of 70 cases. Can J Neurol Sci 1999; 26(3): 190 – 195.
59. Onofrj M, Bonanni L, Manzoli L, Thomas A. Cohort study on somatoform disorders in Parkinson disease and dementia with Lewy bodies. Neurology 2010; 74(20): 1598 – 1606. doi: 10.1212/ WNL.0b013e3181df09dd.
60. Pareés I, Saifee TA, Kojovic M, Kassavetis P, Rubio ‑ Agusti I, Sadnicka A et al. Functional (psychogenic) symptoms in Parkinson’s disease. Mov Disord 2013; 28(12): 1622 – 1627. doi: 10.1002/ mds.25544.
61. Deuschl G, Raethjen J, Lindemann M, Krack P. The pathophysiology of tremor. Muscle Nerve 2001; 24(6): 716 – 735.
62. Deuschl G, Koster B, Lucking CH, Scheidt C. Diagnostic and pathophysiological aspects of psychogenic tremors. Mov Disord 1998; 13(2): 294 – 302.
63. Kenney C, Diamond A, Mejia N, Davidson A, Hunter C,Jankovic J. Distinguishing psychogenic and essential tremor. J Neurol Sci 2007; 263(1 – 2): 94 – 99.
64. Zeuner KE, Shoge RO, Goldstein SR, Dambrosia JM, Hallett M. Accelerometry to distinguish psychogenic from essential or parkinsonian tremor. Neurology 2003; 61(4): 548 – 550.
65. Uhríková Z, Růzicka E, Hlavác V, Nugent CD. TremAn: a tool for measuring tremor frequency from video sequences. Mov Disord 2010; 25(4): 504 – 506. doi: 10.1002/ mds.22904.
66. McAuley J, Rothwell J. Identification of psychogenic, dystonic, and other organic tremors by a coherence entrainment test. Mov Disord 2004; 19(3): 253 – 267.
67. Kumru H, Begeman M, Tolosa E, Valls ‑ Sole J. Dual task interference in psychogenic tremor. Mov Disord 2007; 22(14): 2077 – 2082.
68. Schwingenschuh P, Katschnig P, Seiler S, Saifee TA,Aguirregomozcorta M, Cordivari C et al. Moving toward “laboratory ‑ supported” criteria for psychogenic tremor. Mov Disord 2011; 26(14): 2509 – 2515. doi: 10.1002/ mds.23922.
69. Fahn MC, Calne B. Classification and investigation of dystonia. In: Movement disorders. London: Butterworth 1987; 332 – 358.
70. Fasano A, Valadas A, Bhatia KP, Prashanth LK, Lang AE, Munhoz RP et al. Psychogenic facial movement disorders: clinical features and associated conditions. Mov Disord 2012; 27(12): 1544 – 1551. doi: 10.1002/ mds.25190.
71. Albanese A, Asmus F, Bhatia KP, Elia AE, Elibol B, Filippini G et al. EFNS guidelines on diagnosis and treatment of primary dystonias. Eur J Neurol 2011; 18(1): 5 – 18. doi: 10.1111/ j.1468 - 1331.2010.03042.x.
72. Fahn S, Marsden CD, Van Woert MH. Definition and classification of myoclonus. Adv Neurol 1986; 43 : 1 – 5.
73. Thompson PD, Colebatch JG, Brown P, Rothwell JC, Day BL, Obeso JA et al. Voluntary stimulus ‑ sensitive jerks and jumps mimicking myoclonus or pathological startle syndromes. Mov Disord 1992; 7(3): 257 – 262.
74. Brown P, Thompson PD. Electrophysiological aids to the diagnosis of psychogenic jerks, spasms and tremor. Mov Disord 2001; 16(4): 595 – 599.
75. Terada K, Ikeda A, Van Ness PC, Nagamine T, Kaji R,Kimura J et al. Presence of Bereitschaftspotential preceding psychogenic myoclonus: clinical application of jerk ‑ locked back averaging. J Neurol Neurosurg Psychiatry 1995; 58(6): 745 – 747.
76. Esposito M, Edwards MJ, Bhatia KP, Brown P, Cordivari C. Idiopathic spinal myoclonus: a clinical and neurophysiological assessment of a movement disorder of uncertain origin. Mov Disord 2009; 24(16): 2344 – 2349. doi: 10.1002/ mds.22812.
77. van der Salm SM, Koelman JH, Henneke S, van Rootselaar AF, Tijssen MA. Axial jerks: a clinical spectrum ranging from propriospinal to psychogenic myoclonus. J Neurol 2010; 257(8): 1349 – 1355. doi: 10.1007/ s00415 - 010 - 5531 - 6.
78. Baik JS, Lang AE. Gait abnormalities in psychogenic movement disorders. Mov Disord 2007; 22(3): 395 – 399.
79. Lempert T, Brandt T, Dieterich M, Huppert D. How to identify psychogenic disorders of stance and gait. A video study in 37 patients. J Neurol 1991; 238(3): 140 – 146.
80. Keane JR. Hysterical gait disorders: 60 cases. Neurology 1989; 39(4): 586 – 589.
81. Jordbru AA, Smedstad LM, Moen VP, Martinsen EW. Identifying patterns of psychogenic gait by video ‑ recording. J Rehabil Med 2012; 44(1): 31 – 35.
82. Růžička E, Serranová T. Psychogenní poruchy chůze. Neurol Prax 2013; 14(4): 182 – 184.
83. Hughes AJ, Daniel SE, Kilford L, Lees AJ. Accuracy of clinical diagnosis of idiopathic Parkinson’s disease: a clinico ‑ pathological study of 100 cases. J Neurol Neurosurg Psychiatry 1992; 55(3): 181 – 184.
84. Benaderette S, Zanotti Fregonara P, Apartis E, Nguyen C, Trocello JM, Remy P et al. Psychogenic parkinsonism: a combination of clinical, electrophysiological, and [(123)I] – FP ‑ CIT SPECT scan explorations improves diagnostic accuracy. Mov Disord 2006; 21(3): 310 – 317.
85. Bhatia KP. Paroxysmal dyskinesias. Mov Disord 2011; 26(6): 1157 – 1165. doi: 10.1002/ mds.23765.
86. Ganos C, Aguirregomozcorta M, Batla A, Stamelou M,Schwingenschuh P, Münchau A et al. Psychogenic paroxysmal movement disorders – clinical features and diagnostic clues. Parkinsonism Relat Disord 2014; 20(1): 41 – 46. doi: 10.1016/ j.parkreldis.2013.09.012.
87. Ziv I, Djaldetti R, Zoldan Y, Avraham M, Melamed E. Diagnosis of “non‑organic” limb paresis by a novel objective motor assessment: the quantitative Hoover’s test. J Neurol 1998; 245(12): 797 – 802.
88. Stone J, Carson A, Sharpe M. Functional symptoms and signs in neurology: assessment and diagnosis. J Neurol Neurosurg Psychiatry 2005; 76 (Suppl 1): i2 – i12.
89. Stone J, Zeman A, Sharpe M. Functional weakness and sensory disturbance. J Neurol Neurosurg Psychiatry 2002; 73(3): 241 – 245.
90. American Psychiatric Association. Highlights of Changes from DSM ‑ IV ‑ TR to DSM ‑ 5. American Psychiatric Association [online]. Available from: http:/ / www.psychiatry.org/ File Library/ Practice/ DSM/ DSM5/ Changes ‑ from ‑ DSM ‑ IV ‑ TR - to ‑ DSM ‑ 5.pdf.
91. Carton S, Thompson PJ, Duncan JS. Non ‑ epileptic seizures: patients’ understanding and reaction to the diagnosis and impact on outcome. Seizure 2003; 12(5): 287 – 294.
92. Jankovic J, Vuong KD, Thomas M. Psychogenic tremor: long‑term outcome. CNS Spectr 2006; 11(7): 501 – 508.
93. Henningsen P, Zipfel S, Herzog W. Management of functional somatic syndromes. Lancet 2007; 369(9565): 946 – 955.
94. Voon V, Lang AE. Antidepressant treatment outcomes of psychogenic movement disorder. J Clin Psychiatry 2005; 66(12): 1529 – 1534.
95. Kroenke K. Efficacy of treatment for somatoform disorders: a review of randomized controlled trials. Psychosom Med 2007; 69(9): 881 – 888.
96. Edwards MJ, Stone J, Nielsen G. Physiotherapists and patients with functional (psychogenic) motor symptoms: a survey of attitudes and interest. J Neurol Neurosurg Psychiatry 2012; 83(6): 655 – 658. doi: 10.1136/ jnnp ‑ 2011 - 302147.
97. Czarnecki K, Thompson JM, Seime R, Geda YE, Duffy JR, Ahlskog JE. Functional movement disorders: successful treatment with a physical therapy rehabilitation protocol. Parkinsonism Relat Disord 2012; 18(3): 247 – 251. doi: 10.1016/ j.parkreldis.2011.10.011.
98. Nielsen G, Stone J, Edwards MJ. Physiotherapy for functional (psychogenic) motor symptoms: a systematic review. J Psychosom Res 2013; 75(2): 93 – 102. doi: 10.1016/ j.jpsychores.2013.05.006.
99. Goldstein LH, Chalder T, Chigwedere C, Khondoker MR, Moriarty J, Toone BK et al. Cognitive ‑ behavioral therapy for psychogenic nonepileptic seizures: a pilot RCT. Neurology 2010; 74(24): 1986 – 1994. doi: 10.1212/ WNL.0b013e3181e39658.
100. Kompoliti K, Wilson B, Stebbins G, Bernard B, Hinson V. Immediate vs. delayed treatment of psychogenic movement disorders with short term psychodynamic psychotherapy: randomized clinical trial. Parkinsonism Relat Disord 2014; 20(1): 60 – 63. doi: 10.1016/ j.parkreldis.2013.09.018.
101. Moene FC, Spinhoven P, Hoogduin KA, van Dyck R.A randomised controlled clinical trial on the additional effect of hypnosis in a comprehensive treatment programme for in‑patients with conversion disorder of the motor type. Psychother Psychosom 2002; 71(2): 66 – 76.
102. Moene FC, Spinhoven P, Hoogduin KA, van Dyck R.A randomized controlled clinical trial of a hypnosis‑based treatment for patients with conversion disorder, motor type. Int J Clin Exp Hypn 2003; 51(1): 29 – 50.
103. Pollak TA, Nicholson TR, Edwards MJ, David AS. A systematic review of transcranial magnetic stimulation in the treatment of functional (conversion) neurological symptoms. J Neurol Neurosurg Psychiatry 2014; 85(2): 191 – 197. doi: 10.1136/ jnnp ‑ 2012 - 304181.
104. Anderson KE, Gruber ‑ Baldini AL, Vaughan CG, Reich SG, Fishman PS, Weiner WJ et al. Impact of psychogenic movement disorders versus Parkinson’s on disability, quality of life, and psychopathology. Mov Disord 2007; 22(15): 2204 – 2209.
105. Carson A, Stone J, Hibberd C, Murray G, Duncan R, Coleman R et al. Disability, distress and unemployment in neurology outpatients with symptoms ‘unexplained by organic disease’. J Neurol Neurosurg Psychiatry 2011; 82(7): 810 – 813. doi: 10.1136/ jnnp.2010.220640.
Labels
Paediatric neurology Neurosurgery Neurology
Article was published inCzech and Slovak Neurology and Neurosurgery

2014 Issue 3-
All articles in this issue
- Funkční poruchy hybnosti
- Přehled méně častých primárních bolestí hlavy
- Spasticita po iktu jako projev maladaptivní plasticity a její ovlivnění botulotoxinem
- Méně obvyklé indikace hluboké mozkové stimulace
- Fluorescencí navigovaná resekce vysokostupňových gliomů mozku
- Neurologické hypotézy u panické poruchy
- Účinky intoxikace metanolem na kognitivní funkce
- Možnosti kontinuálního monitoringu průtoku krve mozkem v detekci vazospazmů u pacientů po těžkém subarachnoidálním krvácení
- Pupilární reakce na barevné podněty
- Naše zkušenosti s mobilní náhradou krčního disku Mobi‑ C – výsledky studie s intervalem sledování pět let
- Neuromodulace sakrálních nervů při řešení inkontinence stolice
- Kombinovaný paramediánní supracerebellární‑ transtentoriální a miniinvazivní subokcipitální přístup při resekci gliomu celé délky mediobazální temporální oblasti
- Selektivní denervace karpu při řešení artrotického postižení zápěstí
- Flekční cervikální myelopatie (Hirayamova choroba) – skutečnost, nebo mýtus? Dvě kazuistiky
- Simultánní výskyt leptomeningeálních a intramedulárních metastáz glioblastoma multiforme – kazuistika
- Blister aneuryzma arteria carotis interna – kazuistika a přehled literatury
- Klíšťová encefalitida, průběh a komplikace – naše poznatky z let 2009– 2012
- Czech and Slovak Neurology and Neurosurgery
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Funkční poruchy hybnosti
- Přehled méně častých primárních bolestí hlavy
- Neurologické hypotézy u panické poruchy
- Neuromodulace sakrálních nervů při řešení inkontinence stolice
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career