-
Medical journals
- Career
Vývoj technik PLIF a TLIF
Authors: J. Šrámek 1,2; V. Jirsák 3; M. Barna 4; P. Nesnídal 4
Authors‘ workplace: Klinika ProSpine, Bogen, Spolková republika Německo2Fakulta biomedicínského inženýrství ČVUT, Kladno 1; Fakulta stavební ČVUT v Praze 3; Spondylochirurgické oddělení, FN v Motole, Praha 4
Published in: Cesk Slov Neurol N 2010; 73/106(5): 492-496
Category: Review Article
Overview
PLIF (posterior lumbar interbody fusion) a TLIF (transforaminal lumbar interbody fusion) jsou operační techniky používané u degenerativního postižení bederní páteře zahrnující operační přístup do oblasti meziobratlové ploténky bederní páteře, její resekci a následnou aplikaci biokompatibilního materiálu za účelem meziobratlové fúze. Metoda PLIF byla poprvé publikována v roce 1944 Briggsem a Milliganem, kteří do intervertebrálního prostoru vložili drť kostních štěpů. Dále techniku vložení štěpů rozvíjel zejména Cloward. Od uvedení válcovité klece Bagbyho a Kuslicha z antikorozní oceli v 80. letech a Brantiganovy kvádrové klece ze semikrystalického polymeru polyéteréterketonu (PEEK) vyztuženého karbonovými vlákny v 90. letech došlo k vývoji množství implantátů jak z hlediska tvarů, tak materiálů. Dominující snahou v dnešní době je vývoj samostojné (stand-alone) klece bez nutnosti doplňující zadní stabilizace. Přestože jsou techniky PLIF a TLIF známé a vyzkoušené, při nedodržení biomechanických zásad může dojít k selhání fúze a vzniku nestability.
Klíčová slova:
zadní bederní mezitělová fúze – transforaminální bederní mezitělová fúzeÚvod
PLIF (posterior lumbar interbody fusion) a TLIF (transforaminal lumbar interbody fusion) jsou operační techniky zahrnující operační přístup do oblasti meziobratlové ploténky bederní páteře, její resekci a následnou aplikaci biokompatibilního materiálu za účelem meziobratlové fúze. Hlavní indikací je degenerativní postižení bederní páteře [1]. Počet fúzovaných segmentů není omezen.
Nejprve je proveden zadní operační přístup k bederní páteři – buď standardní ve střední čáře, nebo paramediální transmuskulární, následně jsou v případě PLIF ozřejmeny laminy obratlů indikovaných k fúzi a mezi laminami je resekován žlutý vaz. Resekce je provedena v rozsahu minimálně výšky meziobratlové ploténky, někdy je nutné pro přehlednější přístup resekovat i část lamin. Poté je durální vak retrahován mediálně, je obnažen zadní podélný vaz a provedena kompletní či inkompletní diskektomie. V případě techniky TLIF je přístup do intervertebrálního prostoru veden laterálněji, přes intervertebrální fasetový kloub a následně foramen.
Historie
V mnoha vědeckých pracích jsou jako autoři techniky PLIF uváděni Jaslow [2] nebo Cloward [3], nicméně již v roce 1944 publikovali Briggs a Milligan [4] uložení drtě kostních štěpů do intervertebrálního prostoru ze zadního přístupu v rámci techniky interlaminární fúze pomocí drtě kostních štěpů. Ve zkoumaném vzorku se jim však nepodařilo dosáhnout mezitělové fúze. Cloward prezentoval svoji techniku na výročním setkání zdravotní asociace na Havaji již v roce 1945, ale výsledky souboru 321 pacientů publikoval až v roce 1953 [3]. K fúzi užíval kortikospongiózní štěp z lopaty kyčelní, a to jak autoštěp, tak z odběru u kadaverů. Podařilo se mu dosáhnout fúze v 85 %. Clowardovu techniku v 80. letech dále rozvíjel zejména Lin [5,6], který zkoušel implantovat různé počty a tvary štěpů. Pokusy s implantací bovinních štěpů nebyly úspěšné [7].
Na počátku 80. let Bagby [8,9] rozvinul Clowardovu metodu přední fúze krční páteře [10] pomocí odvrtání ploténky a přilehlých částí obratlových těl za vzniku kruhového otvoru tím, že nahradil Clowardem užívaný štěp za klec. Jednalo se o dutý válcovitý implantát (cylindrical cage) z antikorozní oceli [11], peroperačně plněný štěpy a Bagby metodu zpočátku užíval u dostihových koní. Dal tím vzniknout řadě dalších klecí, známých pod názvem BAK (Bagbyho a Kuslichova klec). Během dalšího vývoje byly klece opatřeny závitem. Od roku 1992 začaly být používány jako PLIF klece, většinou ve dvojici jako samostojné (stand-alone). Po zašroubování do intervertebrálního prostoru se BAK klece závitem částečně zanořují přes krycí plotny, což zamezuje translačnímu pohybu a zvyšuje stabilitu. Jsou však zatíženy rizikem úplného zanoření, nebo naopak migrace (obr. 1) a jejich závit může poté poškodit okolní tkáně [12,13].
Image 1. Předozadní rtg projekce migrace BAK klece. Publikováno s laskavým svolením J. K. Burkuse, MD. 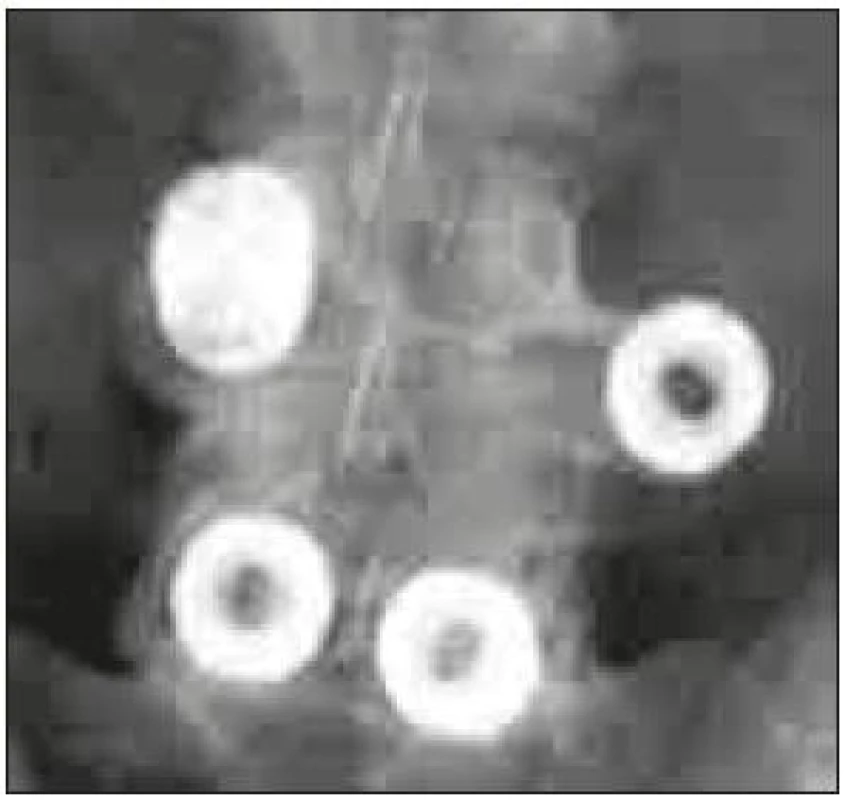
V roce 1991 prezentovali autoři Brantigan et al [14] klece tvaru kvádru (rectangular cage) s dutinou pro vložení štěpů vyrobené ze semikrystalického polymeru polyéteréterketonu (PEEK) vyztuženého karbonovými vlákny (carbon fiber-reinforced polymer, CFRP), které kombinovali se Steffeeho transpedikulární stabilizací [15]. PEEK (obr. 2) byl vyvinut na přelomu 70. a 80. let firmou Imperial Chemical Industries (ICI) a uveden v roce 1981 na trh pod názvem Victrex [16]. Je užíván v řadě průmyslových odvětví a je vhodný k výrobě medicínských implantátů, neboť je vysoce odolný proti chemickým i fyzikálním vlivům, je dokonce odolnější než antikorozní ocel (tab. 1) [17]. Hrabálek et al [18] nicméně udávají při užití klecí samostojných z PEEKu větší incidenci kostních cyst obratlů a progresi Modicových změn oproti titanovým klecím. Z PEEKu se postupně začaly vyrábět klece všech tvarů včetně BAK klecí (například Vista firmy Zimmer).
Image 2. Vzorec polyéteréterketonu (PEEKu). 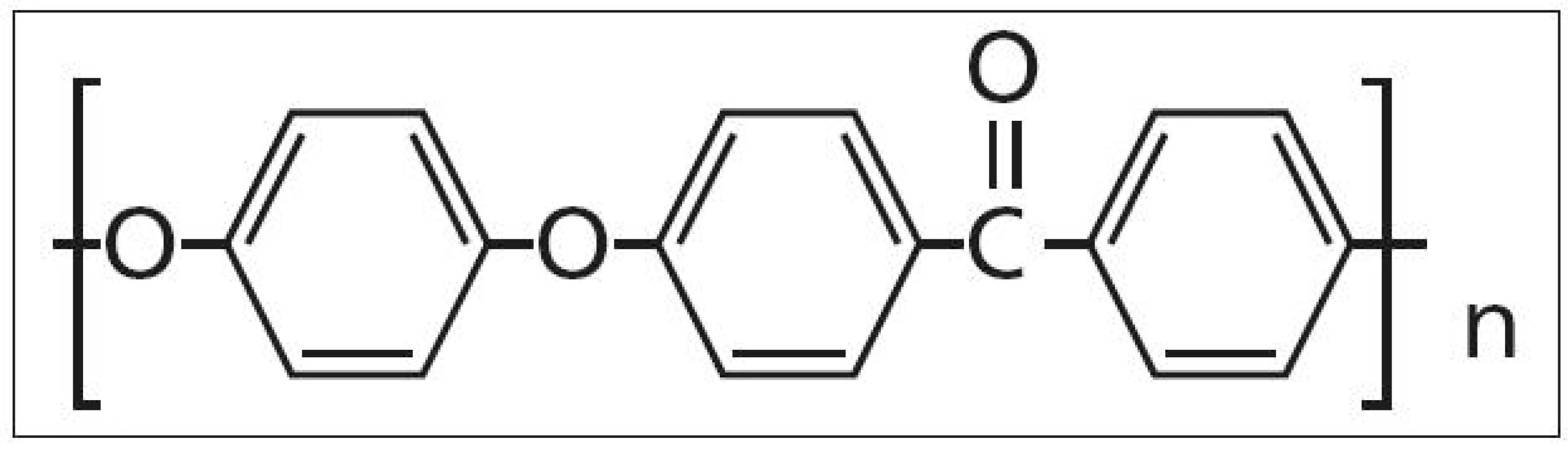
Table 1. Srovnání odolnosti PEEKu a antikorozní oceli vůči chemickým vlivům. 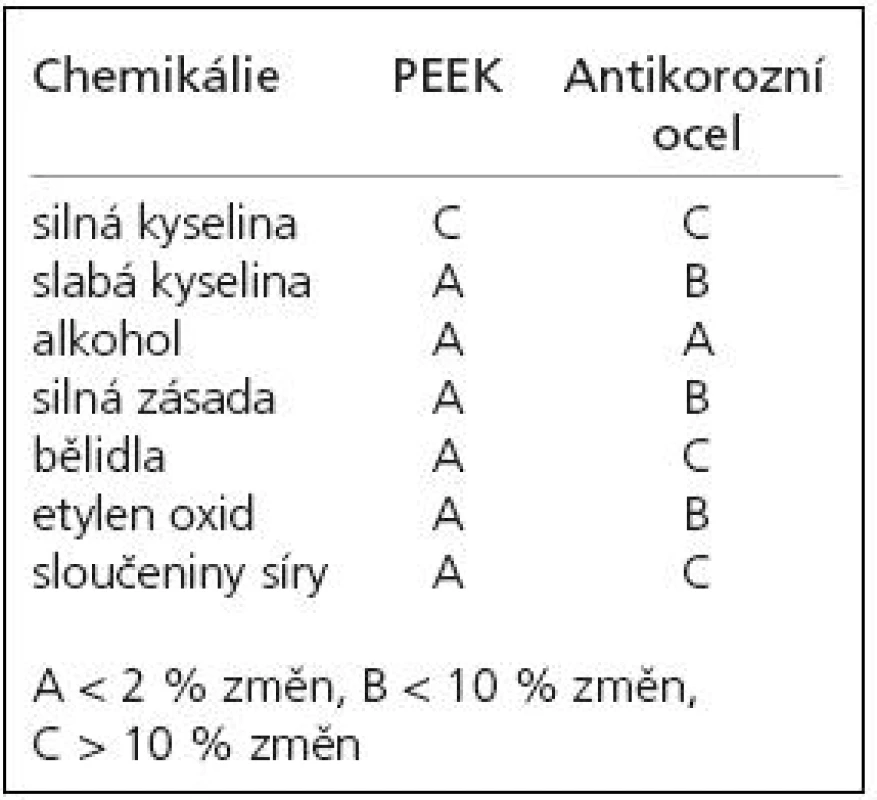
Stejně intenzivně jako tvarový a materiálový vývoj klecí probíhalo i hledání optimálního operačního přístupu do intervertebrálního prostoru. Blume [19] v 80. letech prezentoval unilaterální přístup s resekcí dvou třetin intervertebrálního kloubu vedený z větší části přes foramen. Tento přístup pojmenoval U-PLIF. Technika označená jako TLIF s přístupem vedeným transforaminálně byla celosvětově popularizována Harmsem et al [20–22], kteří roku 1998 prezentovali soubor 191 pacientů operovaných mezi lety 1993 a 1996. Výhodou byla možná dekomprese foraminální stenózy a také eliminace epidurálního jizvení. Harms implantoval do intervertebrálního prostoru dvě kovové klece v kombinaci s transpedikulární stabilizací. Rozmach techniky TLIF vedl i ke vzniku jedné z dnes nejpoužívanějších klecí – tvaru válce, jehož podstava je ohraničena křivkou banánovitého tvaru („banana“ shaped, semilunar, curved cage). Klec po zavedení rotuje dlouhou osou o 90°, a tím získá v intervertebrálním prostoru symetrickou pozici, není tedy zapotřebí implantovat klece dvě (např. Travios firmy Synthes).
U implantátů pro užití ve dvojici došlo také od Brantiganovy přísně pravoúhlé klece k rozvoji tvarů umožňujících jednodušší zavedení do intervertebrálního prostoru, např. zkosením přední části. Krycí plotny obratlů jsou konkávní, proto bikonvexní tvar klecí (např. Capstone firmy Medtronic) napomáhá k centraci klece. Vzhledem k tomu, že PEEK není rtg kontrastní, jsou do implantátů inkorporovány kontrastní značky k vizualizaci optimálního umístění klece v intervertebrálním prostoru (obr. 3).
Image 3. Předozadní a bočná rtg projekce zahnuté („banana“ shaped, semilunar, curved cage) PLIF klece v optimálním postavení. 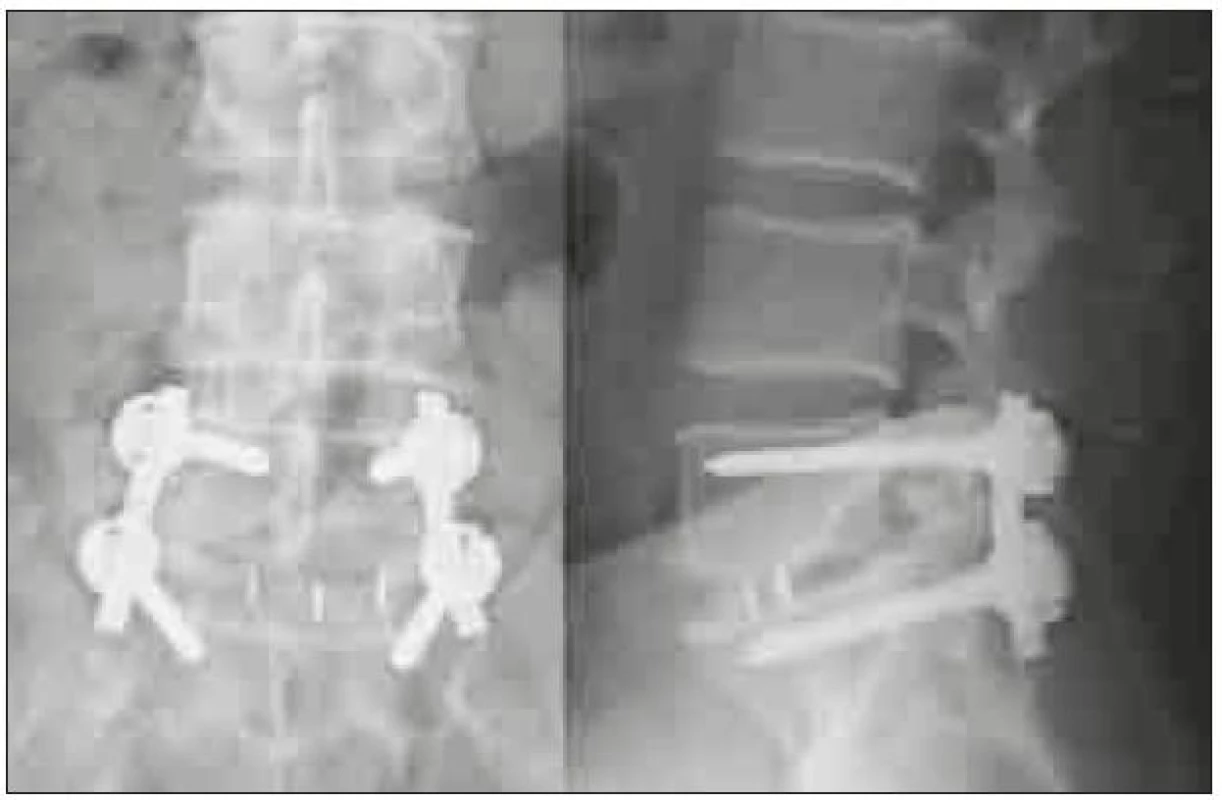
Další alternativou jsou klece, jejichž mikrostruktura tvořená porézní prostorovou trámčinou z tantalu (např. Trabecular Metal TM-500 firmy Zimmer) je podobná spongiózní kosti [23,24]. Klece z keramických materiálů se standardně nevyrábějí.
Současné směry vývoje
Nadále probíhá intenzivní vývoj klecí jak materiálový, tak tvarový. Materiálové složení má zajistit vznik novotvorby kosti, která by vytvořila co nejpevnější fúzi v co nejkratší době. Z hlediska osteoinduktivních materiálů je hlavním směrem využití a vývoj dalších typů BMP (bone morphogenic protein) [25–27], dále mohou být klece na povrchu opatřeny materiálem na bázi kalciumfosfátu nebo speciální povrchovou úpravou (např. Prospace firmy B. Braun s povrchem Plasmacore).
Z hlediska tvaru je dominující snahou doplnění přídatného mechanizmu ke zlepšení stability samostojných kvádrových klecí (rectangular cages). Může se jednat o pevný kýl, který však zvyšuje průřez klece v koronární rovině, a tím představuje riziko poranění nervových kořenů při manipulaci s klecí v oblasti páteřního kanálu, například Invadur firmy Pina (schematicky na obr. 4a). Dále existují klece, jejichž stabilizační mechanizmus se vysune až po zavedení, což je sice bezpečnější, ale velikost výsuvné plochy, a tím i stabilita je limitována maximálním přesahem plochy vzniklé rotací zadní části klece, např. HRL cage firmy Eurospine (schematicky na obr. 4b). Dostupné jsou i samostojné klece zcela nového mechanizmu, např. B-twin firmy Disc-O-Tech Medical Technologies Ltd. [28], která má před aplikací tvar válce o malém průměru a po zavedení je klec pomocí závitu uvnitř válce podélně stažena, čímž vznikne několik výběžků zvětšujících průměr klece přibližně na trojnásobek (schematicky na obr. 4c).
Image 4. a–c. Různé typy samostojných PLIF klecí Obr. 4d. PLIF klec s nastavením v sagitální rovině. 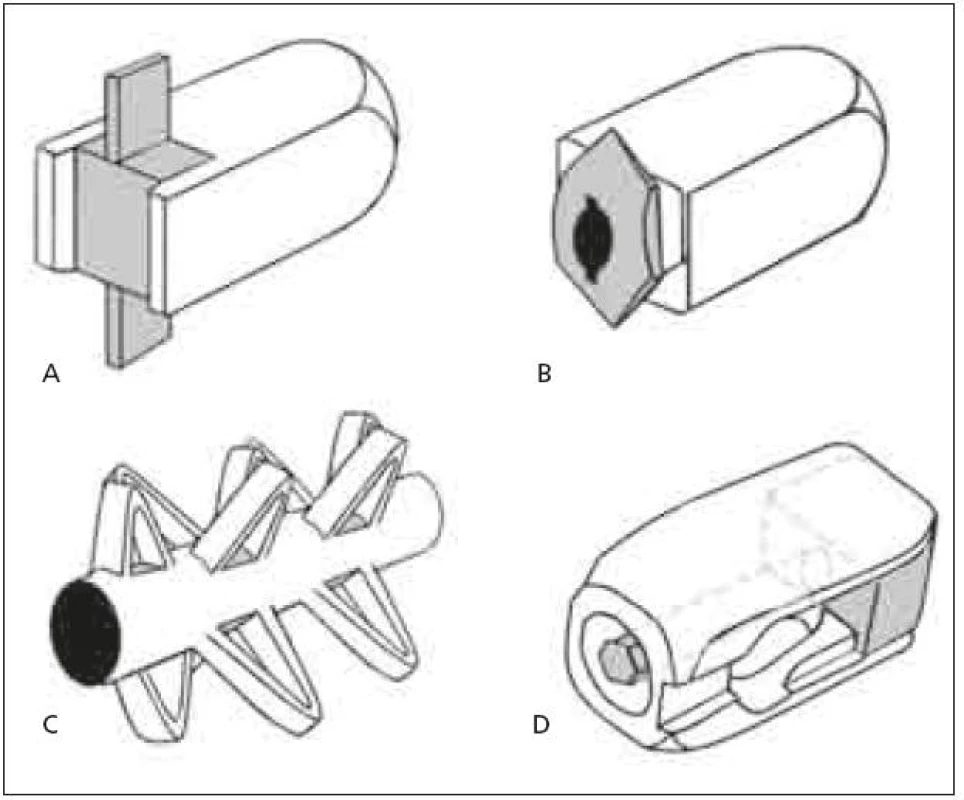
Další možností je inkorporování mechanizmu, který sice markantně nezvýší stabilitu klece, ale umožní dodatečnou korekci lordózy, event. kyfózy. Klece jsou opatřeny podélným nářezem v transverzální rovině, do něhož je vložen klín opatřený závitem. Uvnitř klínu je závitový dřík, s nímž je možno po zavedení klece manipulovat, a tím měnit polohu klínu, například Dynamic Plif firmy Pina Eurospine (schematicky na obr. 4d). Stejný mechanizmus je možno inkorporovat i do válcové klece na bázi BAK, například Tyche lumbar expandable cage firmy Kyungwon Medical Co Ltd. [29]. Všechny výše zmíněné klece je nutné zavádět vždy ve dvojici z bilaterálního přístupu. Válcová klec s podstavou ohraničenou křivkou banánovitého tvaru („banana“ shaped, semilunar, curved cage) se stabilizačním mechanizmem nebyla doposud prezentována.
Na pomezí technik PLIF a TLIF se nachází některé typy implantace náhrad nucleus pulposus [30]. Existují sice náhrady tvarově podobné klecím, např. Prosthetic Disc Nucleus firmy Raymedica, nicméně využívají pouze operačního přístupu technik PLIF a TLIF, ale účelem implantace není dosažení fúze. Injekční implantace biomateriálů do oblasti nukleus pulposus již nemá s technikami PLIF a TLIF nic společného. Jiná nefúzní technika – arteficiální náhrada meziobratlové ploténky se standardně provádí z předního přístupu [31]. Ačkoli existují návrhy na implantát zaváděný technikou PLIF (například patent US20050033431), implantace je náročnější a rizikovější, neboť šířka arteficiální náhrady je výrazně větší než standardní PLIF klec. V případě implantátu Inlign TMS firmy Disc Motion Technologies je kloubní plocha arteficiální náhrady rozdělena mezi dvě klece, je tedy nutná vysoká přesnost implantace.
Možné chyby při provádění technik PLIF a TLIF
Chyby lze rozdělit na indikační a chyby operační techniky. Základní chybou indikační je výběr postupu nezajišťující dostatečnou stabilitu páteře ke vzniku fúze. Při užití samostojné klece je bez výjimky nutné a při užití klece v kombinaci se zadní instrumentací vhodné do intervertebrálního prostoru vložit materiál indukující kostní novotvorbu, nejlépe autogenní spongiózní štěpy. K zadní stabilizaci lze užít různé instrumentace, nicméně standardní transpedikulární implantát se šrouby a tyčemi zajistí nejlepší stabilitu [32].
Chybou operační techniky je poranění nervových struktur při operačním přístupu a dále chybné umístění klece v operovaném prostoru. Umístění klece příliš laterálně (obr. 5) může vést k migraci a nezajistí podmínky pro vznik fúze. Při užití příliš vysoké klece nebo při agresivní manipulaci s klecí v intervertebrálním prostoru může dojít k poškození kortikální kosti krycích ploten a k zanoření klece do obratlových těl. Naopak při užití příliš nízké klece, nezaručující stabilní postavení v operovaném segmentu, nebo při uložení klece v příliš malé vzdálenosti od zadní hrany může dojít k nejnebezpečnější komplikaci – stenóze při dislokaci klece do páteřního kanálu (obr. 6). Studie Faundeze et al [33] neprokázala rozdíl ve stabilitě segmentu mezi uložením v přední a zadní části intervertebrálního prostoru v kombinaci s transpedikulární fixací. Experimentální studie Grantové et al [34] prokázala nejvyšší mechanickou odolnost krycích ploten v segmentech L3, 4, 5 v jejich zadní části a snížení odolnosti ve středu a v přední části krycí plotny. Naopak u krycí plotny sakra byla zjištěna odolnost zvyšující se směrem dopředu. Vzhledem k výše zmíněnému riziku dislokace do páteřního kanálu se ale i u segmentů L3, 4, 5 jako optimální jeví umístění klecí v intervertebrálním prostoru anteromediálně, což vyplývá i z klinické studie Abbushiho et al [35].
Image 5. Předozadní a bočná rtg projekce excentricky zavedené TLIF klece, která nezajistila dostatečnou stabilitu pro vznik symetrické fúze a nedostatečná fúze vedla ke zlomení šroubu. Operace nebyla provedena na pracovištích autorů. 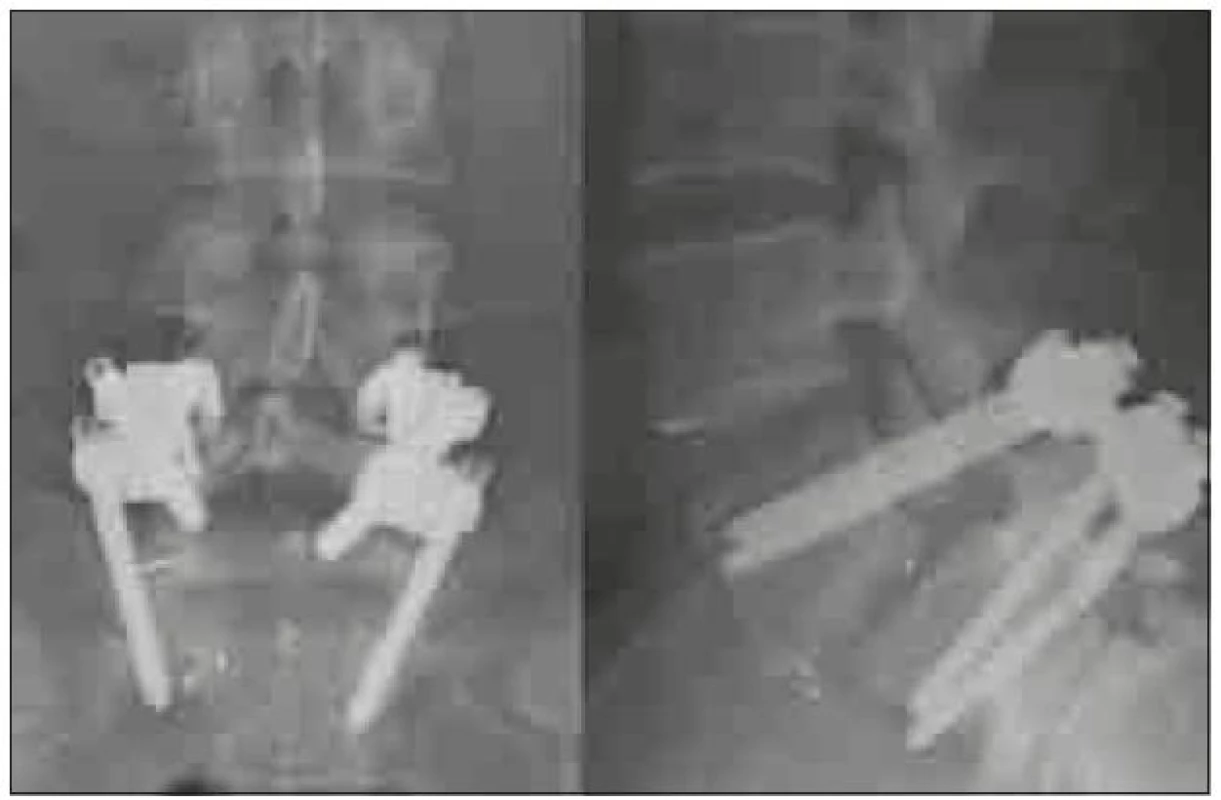
Image 6. CT rekonstrukce v sagitální rovině a MR T2 vážený obraz v sagitální rovině PLIF klece prominující do páteřního kanálu. Operace nebyla provedena na pracovištích autorů. 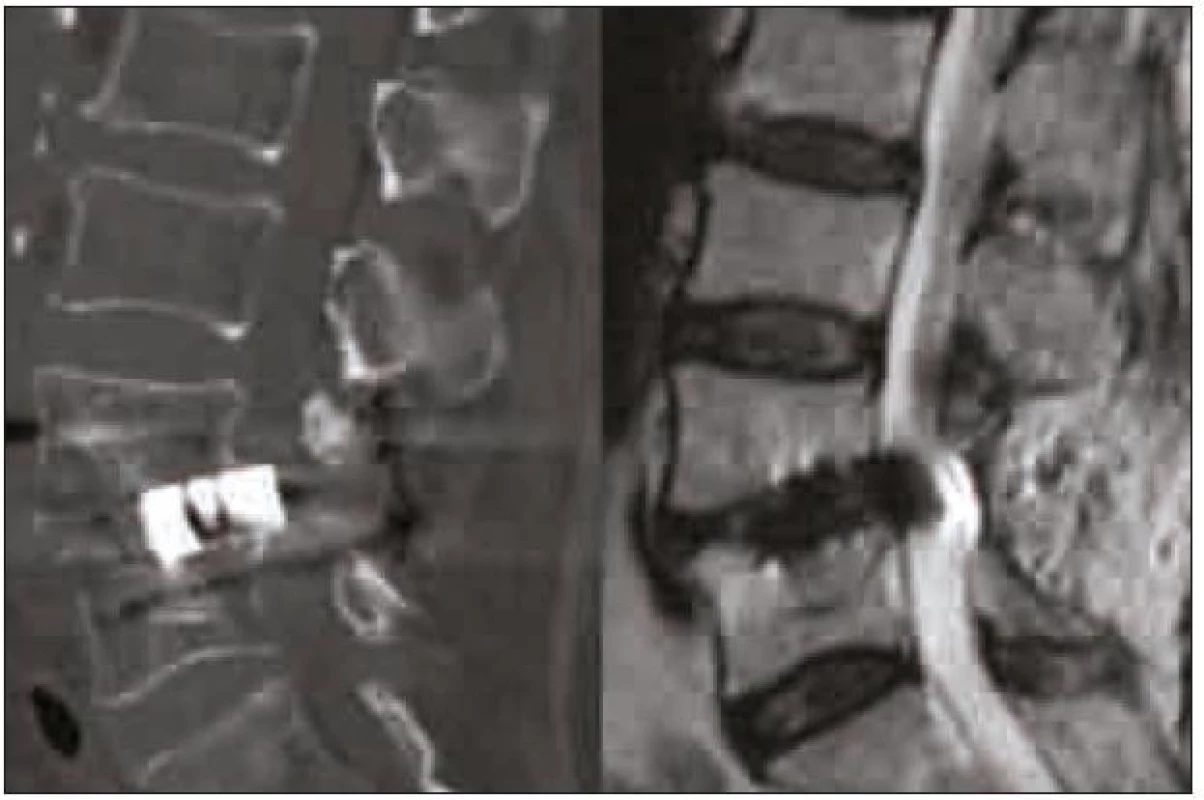
Velmi dobré výsledky vzniku fúze prezentovali Perrin [36] a Wendsche [37] při užití semirigidního systému ISOLOCK, avšak otázka použití kombinace PLIF/TLIF klecí s dynamickými stabilizacemi se jeví jako kontroverzní. Ty jsou primárně koncipovány jako motion preservation techniky, navíc je zde riziko zanoření klece a vzniku neoarthrosu (obr. 7).
Image 7. Předozadní a bočná rtg projekce kombinace PLIF klece s dynamickou stabilizací, klec zanořena do obratlového těla, okolo klece zřejmá skleróza při neoarthrosu. Operace nebyla provedena na pracovištích autorů. 
Závěr
PLIF a TLIF jsou dynamicky se rozvíjející techniky s možností výběru ze širokého spektra implantátů. Přesto nesmí být zapomenuto na jejich podstatu – zabezpečení vzniku pevné fúze spolu s dostatečnou dekompresí nervových struktur.
MUDr. Jiří Šrámek
Untere Bergstr. 42
943 27 Bogen
e-mail: jiri.sramek@spinesurgery.czPřijato k recenzi: 19. 2. 2010
Přijato do tisku: 31. 3. 2010
Sources
1. Voháňka S, Mičánková Adamová B. Lumbální spinální stenóza a neurogenní klaudikace. Cesk Slov Neurol N 2009; 72/105(5): 405–417.
2. Jaslow IA. Intercorporal bone graft in spinal fusion after disc removal. Surg Gynecol Obstet 1946; 82 : 215–222.
3. Cloward RB. The treatment of ruptured lumbar intervertebral discs by vertebral body fusion I. Indications, operative technique, after care. J Neurosurg 1953; 10(2): 154–168.
4. Briggs H, Milligan PR. Chip fusion of the low back following exploration of the spinal canal. J Bone Joint Surg 1944; 26A: 125–130.
5. Lin PM, Cautilli RA, Joyce MF. Posterior lumbar interbody fusion. Clin Orthop Relat Res 1983; 180: 154–168.
6. Lin PM. Posterior lumbar interbody fusion technique: complications and pitfalls. Clin Orthop Relat Res 1985; 193 : 90–102.
7. Lin GY, Wang YC, Young AY, Chao DY, Wang FH, Lin PJ. Bovine bone in posterior lumbar interbody fusion. Acta Neurol Sin 1993; 2 : 134–137.
8. Kuslich SD, Ulstrom CL, Griffith SL, Ahern JW, Dowdle JD. The Bagby and Kuslich method of lumbar interbody fusion. History, technique, and 2-year follow-up results of a United States prospective, multicenter trial. Spine 1998; 23(11): 1267–1279.
9. Brislin B, Vaccaro AR. Advances in posterior lumbar interbody fusion. Orthop Clin North Am 2002; 33(2): 367–374.
10. Cloward RB. The anterior approach for removal of ruptured cervical disks. J Neurosurg 1958; 15(6): 602–617.
11. Kurtz SM, Edidin AA. Intervertebral body cages: Cervical and lumbar. In: Kurtz SM, Edidin AA. Spine technology handbook. USA: Elsevier 2006 : 194–195.
12. Burkus J, Foley K, Haid R, Lehuec JC. Surgical interbody research group – radiographic assessment of interbody fusion devices: fusion criteria for anterior lumbar interbody surgery. Neurosurg Focus 2001; 10(4): E11.
13. Wood KB, Schwender JD. Lumbar intervertebral cages: Limitations and complications. Operat Tech Orthop 2000; 10(4): 320–324.
14. Brantigan JW, Niedre A, Toohey JS. The Lumbar I/F Cage for posterior lumbar interbody fusion with the variable screw placement system: 10-year results of a Food and Drug Administration clinical trial. Spine J 2004; 4(6): 681–688.
15. Steffee AD, Brantigan JW. The variable screw placement spinal fixation system: report of a prospective study of 250 patients enrolled in Food and Drug Administration clinical trials. Spine 1993; 18(9): 1160–1172.
16. Béland S. Polyketones. In: Béland S (ed). High performance thermoplastic resins and their composites. USA: Noyes publications 1990 : 33–36.
17. Groeger R. Victrex, high performance PEEK polymers for medical components and instrumentation [online]. Dostupné z URL: http://www.victrex.com/docs/literature-docs/Medical_Flyer_en.pdf
18. Hrabálek L, Rešková I, Bučil J, Vaverka M, Houdek M. Použití titanových a PEEKových implantátů při ALIF stand-alone u degenerativního onemocnění lumbosakrální páteře – prospektivní studie. Cesk Slov Neurol N 2009; 72/105(1): 38–44.
19. Blume HG. Unilateral posterior lumbar interbody fusion: simplified dowel technique. Clin Orthop Relat Res 1985; 193 : 75–84.
20. Harms J, Jeszenszky D. The unilateral, transforaminal approach for posterior lumbar interbody fusion. Operat Orthop Traumatol 1998; 6 : 88–99.
21. Moskowitz A. Transforaminal lumbar interbody fusion. Orthop Clin North Am 2002; 33(2): 359–366.
22. Vaněk, P Saur K. Transforaminální lumbo-sakrální mezitělová fúze (TLIF) s instrumentací: prospektivní studie s minimálně 20měsíčním sledováním. Cesk Slov Neurol N 2007; 70/103(5): 552–557.
23. Matějka J, Zeman J, Belatka J. Střednědobé výsledky 360° lumbální spondylodézy s použitím tantalové náhrady ploténky. Acta Chir Orthop Traum Cech 2009; 76 : 388–393.
24. Bobyn JD, Stackpool G, Toh KK. Characteristics of bone ingrowth and interface mechanics of a new porous tantalum biomaterial. J Bone Joint Surg 1999; 81(5): 907–914.
25. Taylor BA, Riew KD. Clinical application of bone morphogenic protein in the spine. In: Kim DH, Vaccaro AR, Fessler RG (eds). Surgical techniques of spinal instrumentation: New York: Thieme Medical Publishers 2005 : 1239–1249.
26. Meisel HJ, Schnöring M, Hohaus C, Minkus Y, Beier A, Ganey T et al. Posterior lumbar interbody fusion using rhBMP-2. Eur Spine J 2008; 17(12): 1735–1744.
27. Blumenthal SL, Ohnmeiss DD. Intervertebral cages for degenerative spinal diseases. Spine J 2003; 3(4): 301–309.
28. Folman Y, Shabat S, Gepstein R. B-twin expandable spinal spacer for posterior lumbar interbody stabilization: mechanical testing. J Surg Orthop Adv 2006; 15(4): 203–208.
29. Kim JW, Park HC, Yoon SH, Oh SH, Roh SW, Rim DC. Multi-center clinical study of posterior lumbar interbody fusion with the expandable stand-alone cage (Tyche cage) for degenerative lumbar spinal disorders. J Korean Neurosurg Soc 2007; 42(4): 251–257.
30. Leckie S, Wang J. Recent advances in nucleus pulposus replacement technology. Curr Orthop Pract 2009; 20(3): 222–226.
31. Errico TJ. Lumbar disc arthroplasty. Clin Orthop Relat Res 2005; 435 : 106–117.
32. Schleicher P, Beth P, Ottenbacher A, Pflugmacher R, Scholz M, Schnake KJ et al. Biomechanical evaluation of different asymmetrical posterior stabilization. J Neurosurg Spine 2008; 9(4): 363–371.
33. Faundez AA, Mehbod AA, Wu C, Wu W, Ploumis A, Transfeldt EE. Position of interbody spacer in transforaminal lumbar interbody fusion: effect on 3-dimensional stability and sagittal lumbar contour. J Spinal Disord Tech 2008; 21(3): 175–180.
34. Grant JP, Oxland TR, Dvorak MF. Mapping the structural properties of the lumbosacral vertebral endplates. Spine 2001; 26(8): 889–896.
35. Abbushi A, Cabraja M, Thomale UW, Woiciechowsky C, Kroppenstedt SN. The influence of cage positioning and cage type on cage migration and fusion rates in patients with monosegmental posterior lumbar interbody fusion and posterior fixation. Eur Spine J 2009; 18(11): 1621–1628.
36. Perrin G. Treatment of lumbar spondylolisthesis and related unstable spinal lesions: the usefulness of PLIF with cages and dynamic interpedicular posterior fixation for circumferential arthrodesis and prevention of adjacent level degeneration. Proceedings of the 3rd World spine meeting; 2005 Jul 31-Aug 3; Rio de Janeiro, Brasil. Versailles: La fourmi a epsilon 2005.
37. Wendsche P. Restabilization in lumbar spine with the semirigid ISOLOCK device: mid-term results. Proceedings of the International 23rd course for percutaneous endoscopic spinal surgery and complementary minimal invasive techniques; 2005 Jan 27–28; Zurich, Switzerland. Zurich: Editiones Orthopaedicae Bethania 2005.
Labels
Paediatric neurology Neurosurgery Neurology
Article was published inCzech and Slovak Neurology and Neurosurgery

2010 Issue 5-
All articles in this issue
- Cievna mozgová príhoda a ischemická choroba srdca
- Konkomitantní chemoradioterapie a cílená biologická léčba u glioblastoma multiforme
- Syndrom útlaku ulnárního nervu v oblasti lokte – přehled operačních technik a srovnání jejich výsledků
- Analýza „default mode“ sítě u zdravých dobrovolníků
- Úloha predoperačného časového intervalu pri liečbe diskogenného syndrómu caudae equinae
- Výskyt psychogénnych porúch v neurológii
- Behaviorálne poruchy u pacientov s Parkinsonovou chorobou – anamnestický skríning za pomoci špecializovaného dotazníka
- Přítomnost tzv. typických MR nálezů u multisystémové atrofie a progresivní supranukleární paralýzy – retrospektivní pilotní studie
- Endoskopická transnazální chirurgie hypofýzy – výhody spolupráce otorinolaryngologa a neurochirurga
- Střelná poranění hlavy a mozku
- Hemangioblastom kaudy – kazuistika
- Neuralgie nervus pudendalis – kazuistika
- Bodná poranění míchy a míšních kořenů – kazuistiky
- Morbus Lhermitte-Duclos – kazuistika
- Vývoj Národní sady klinických standardů a ukazatelů zdravotní péče a první výsledky v oboru neurologie
- Standard pro léčbu pacientů s autoimunitními nervosvalovými onemocněními intravenózním lidským imunoglobulinem a plazmaferézou
- Antikoagulační terapie v prevenci a léčbě ischemických iktů
- Vývoj technik PLIF a TLIF
- Czech and Slovak Neurology and Neurosurgery
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Neuralgie nervus pudendalis – kazuistika
- Vývoj technik PLIF a TLIF
- Syndrom útlaku ulnárního nervu v oblasti lokte – přehled operačních technik a srovnání jejich výsledků
- Střelná poranění hlavy a mozku
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

