-
Medical journals
- Career
Využití regionální mozkové oxymetrie jako neinvazivní metody ke sledování pacientů v neurointenzivní péči
: J. Habalová 1; M. Kanta 1; E. Ehler 2; J. Náhlovský 1; M. Bartoš 1
: Neurochirurgická klinika LF UK a FN Hradec Králové 1; Neurologická klinika, Pardubická krajská nemocnice, a. s. 2
: Cesk Slov Neurol N 2010; 73/106(3): 285-293
: Short Communication
Tato práce se zabývá teoretickými a praktickými zkušenostmi s použitím neinvazivního kontinuálního měření regionální mozkové oxygenace pomocí infračervené spektroskopie (near ‑ infrared spectroscopy, NIRS) u pacientů v neurochirurgii. Autoři shrnují literárně uváděné indikace ke sledování regionální mozkové oxymetrie pomocí infračervené spektroskopie a hodnotí je z hlediska praktického využití u neurochirurgických pacientů. Prezentují vlastní zkušenosti s použitím této jednoduché, neinvazivní metody při sledování pacientů s poškozením mozku. Pomocí rozboru tří krátkých kazuistik (případ s těžkým kontuzním poraněním mozku, řízení terapie nemocné po subarachnoidálním krvácení z aneuryzmatu a sledování pacienta se spontánním intracerebrálním krvácením) jsou dokumentovány výhody uvedené metody. Obecným cílem u pacientů v neurointenzivní péči je udržení dostačující oxygenace ohrožených oblastí mozku. Regionální mozková oxymetrie se pro sledování mozkového poškození v neurointenzivní péči jeví jako použitelná metoda. Je neinvazivní, kontinuální a pohotová. Zdá se vhodná k časné diagnostice a průběžnému vedení léčby nejen v neurointenzivní péči, ale i pro další klinické aplikace.
Klíčová slova:
traumatické poškození mozku – infračervená spektroskopie – regionální cerebrální oxymetrie – nitrolební tlak – vazospazmy – mozková ischemiePodporováno grantem MZO 00179906
Úvod
Přístup ke sledování pacientů s poškozením mozku je v současnosti komplexní a multimodální. Novým trendem v monitorování na všeobecných i specializovaných jednotkách intenzivní péče je sledování nejen vitálních funkcí a vnitřního prostředí pacienta, ale také mozkových funkcí a mozkové oxygenace a perfuze [1]. Velkého pokroku doznávají možnosti sledovat centrální nervovou soustavu (CNS) pomocí fyzikálních, biochemických a metabolických parametrů mozkové tkáně kontinuálně přímo u lůžka pacienta. V současné neurointenzivní péči je v závislosti na zvyklostech pracoviště používáno k monitorování pacientů s poškozením mozku několik různých metod (tab. 1). Každá z nich má své výhody i omezení a teprve kombinací metod lze dosáhnout určité úrovně bezpečného monitorování [2 – 7]. Na kyslíku (O2) jsou závislé všechny mozkové funkce a udržení dostatečné kapilární oxygenace v mozkové tkáni je pro zachování její funkce a vitality životně důležité [8]. Kyslíková rezerva v mozkovém parenchymu je nízká, což klinicky dobře prokazuje okamžitá ztráta vědomí při náhlé úplné zástavě průtoku krve mozkem. Nastává rychlý pokles tkáňové saturace O2 v mozku, vzestup anaerobního metabolizmu buněk, vzestup laktátu i toxických metabolitů, acidóza, porucha funkce membrán, jejich rozpad a konečným důsledkem je buněčná smrt neuronů.
1. Možnosti multimodálního monitorování při poškození mozkové tkáně. 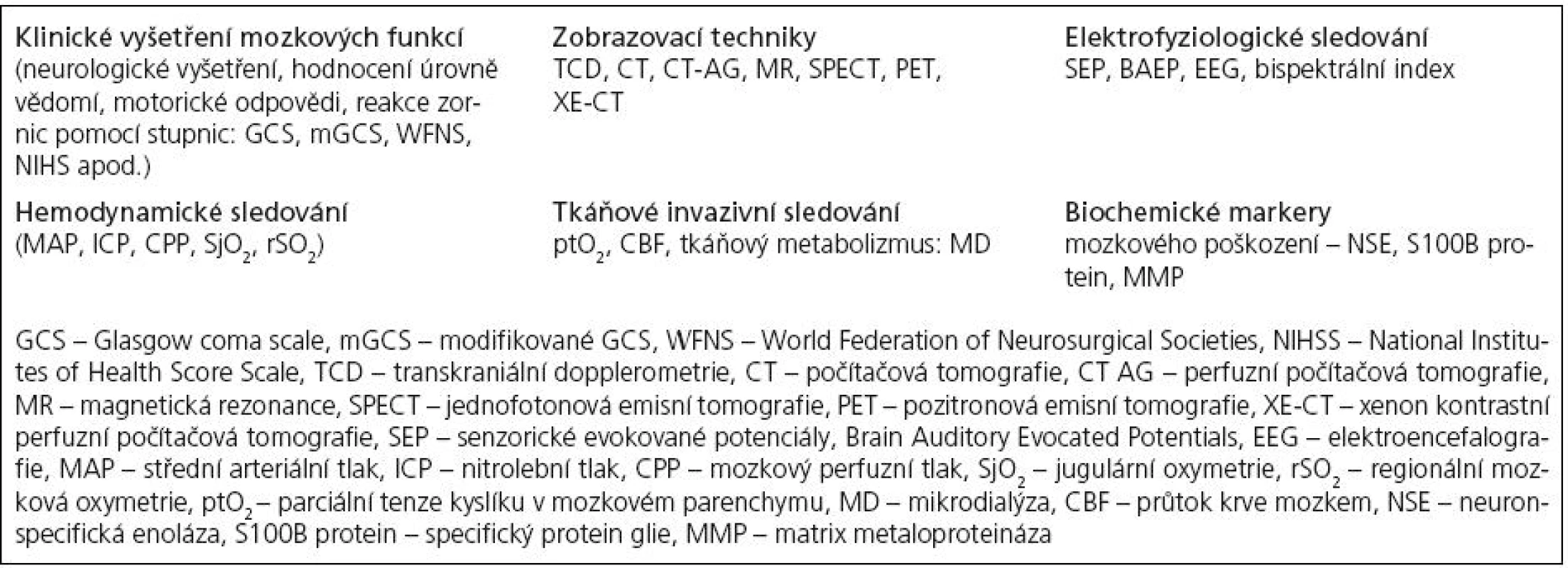
Primární trauma je vstupní nevratná strukturální léze mozkové tkáně a nelze ji ovlivnit léčbou. Naopak sekundární poškození vzniká až jako důsledek některých následných dějů a systémových poruch (hypotenze, hypoxie, koagulační poruchy, vznik reaktivních kyslíkových radikálů apod.) s lokálním dopadem na zvětšení krvácení a edému v kontuzní oblasti [9,10]. V praxi to znamená progresi traumatických kontuzí či spontánního intracerebrálního krvácení v prvních 24 – 48 hod. Při vzniku spontánní mozkové cévní léze je pozorována expanze krvácení u 26 – 36 % pacientů do 3 hod a u 12 % pacientů během dalších 20 hod [11,12]. Sekundární poranění je zčásti ovlivnitelné léčbou, pokud jsme schopni včas zachytit počátek vzniku ischemického inzultu. Za práh ischemie s následnou poruchou funkce je všeobecně považován pokles průtoku krve mozkem pod 18 – 20 ml/ 100 g/ min [9]. Snaha najít způsob sledování mozkové oxygenace, a nepřímo tedy i mozkové perfuze, nás přivedla k využití regionální mozkové oxymetrie pomocí přístroje INVOS Cerebral Oximeter (in vivo optical spectroscopy). Přístroj pomocí spektrální absorpce vyhodnocuje regionální mozkovou saturaci hemoglobinu kyslíkem (rSO2), a poskytuje tak nepřímou informaci o kvalitě kapilárního prokrvení [9,13]. Citlivost spektrofotometrie na snížení CBF byla potvrzena pomocí paralelního vyšetřování mozkového průtoku semikvantitativní metodou SPECT [14,15]. Regionální saturace mozkové tkáně kyslíkem (rSO2) může být sledována neinvazivně a kontinuálně u lůžka pacienta. Podmínkou úspěšné léčby poškození mozku je včas zachytit každou vznikající poruchu perfuze mozkové tkáně. Atributy ideálního způsobu monitorování jsou minimální invazivita, dobrá výpovědní hodnota pro všechny typy poškození mozku, minimální nežádoucí účinky a nízké ekonomické náklady.
Technický princip regionální mozkové oxymetrie
Regionální mozková saturace kyslíkem (rSO2, ScO2) je měřena na principu infračerveného světla. Technickou podstatou NIRS (near infrared spectroscopy), jak je dále vysvětleno, je spektroskopie. Metoda, která tuto techniku pro klinické účely využívá, se nazývá optická spektrometrie (INVOS) nebo podle některých autorů také transkraniální mozková oxymetrie (TCCO, transcranial cerebral oximetry). Vlastní monitorovací přístroje s nastavitelným alarmem pro zobrazení hodnot a trendů jsou např. INVOS Cerebral Oximeter ‑ 5100 (Somanetics, USA) nebo NIRO ‑ 200 (Hatmamatsu, Japan). Součástí přístroje jsou samolepicí sondy velikosti 9 × 4 cm. Tyto se připevní na pacientovo čelo (obr. 1), případně jsou ještě fixovány pružným obinadlem. Poloha obou sond je symetrická vzhledem ke střední čáře vedené středem glabely, aby nebyl zastižen sinus sagitalis superior, a přibližně 2 cm nad obočím, aby se signál vyhnul frontálním dutinám. Emitované světelné paprsky o definované vlnové délce 730 a 810 nm pronikají přes kůži nad čelem a kostěné struktury do hloubky asi 4 cm v mozkovém parenchymu, kde se částečně odráží. Fotodioda pak měří intenzitu odraženého světla.
1. Ilustrační fotografie pacienta s aplikovanou měřicí sondou a monitorem INVOS při oboustranném kontinuálním sledování regionální cerebrální saturace (rSO<sub>2</sub>). 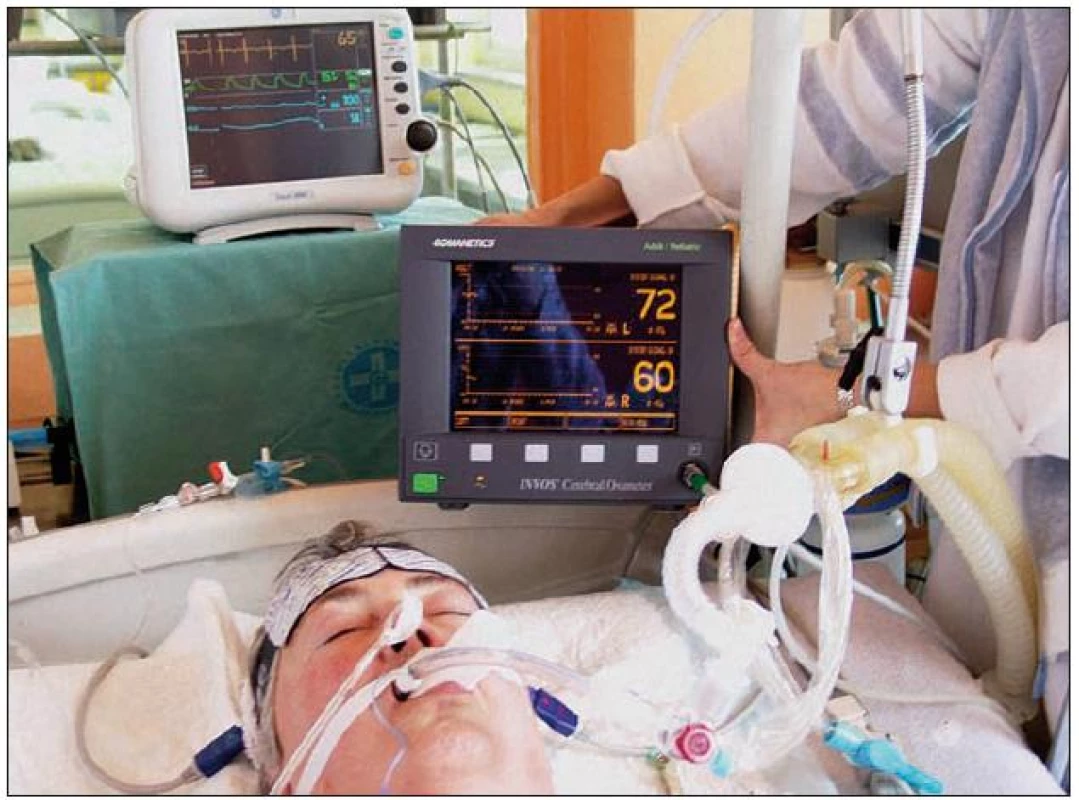
Měřením kvantity odražených fotonůjako funkce vlnové délky lze odvodit spektrální absorpci v mozkovém parenchymu a stanovit tak jeho průměrnou oxygenaci, tzn. hladinu oxyHb a deoxyHb (oxygenovaný hemoglobin a deoxygenovaný hemoglobin) ve venózní, arteriolární a kapilární krvi [16]. Měření probíhá transkutánně oboustranně v oblasti fronto ‑ parietální a zachycuje orientačně rozhraní mezi povodím přední a střední mozkové arterie. Světelný signál je vysílán jednou nebo dvakrát za minutu, dle nastavení přístroje. Normální hodnoty rSO2 u většiny populace jsou 55 – 75 % a každá změna o 7 – 10 % v obou směrech znamená hrozbu ischemie či hyperemie pro sledovanou tkáň [13,17 – 20]. Terapeutické intervence, které lze použít při poklesu rSO2, představují zvýšení perfuzního mozkového tlaku pomocí podpory systémového tlaku (vazopresorické léky nebo zvýšení srdečního výdeje inotropiky). Lze použít také změnu pH a parciálního tlaku oxidu uhličitého (pCO2) v arteriální krvi úpravou ventilačních parametrů, nebo snížení nitrolebního tlaku různými metodami antiedémové terapie. Zvýšení rSO2 dosáhneme také zvýšením hladiny Hb. Použitelné jsou i různé postupy ke snížení spotřeby kyslíku v mozku pomocí minimalizace nároků mozkové tkáně na kyslík (sedace pacienta až burst suppression vzorec na EEG, hypotermie). Při třesu a svalových křečích je kromě léčby příčiny možná i relaxace svalstva.
Přehled možností využití metody infračervené spektroskopie mozku v současné medicíně
Z literatury je patrné, že měření rSO2 je používáno v různých indikacích při hrozícím mozkovém poškození. V následujícím textu se na využití sledování mozkové oxygenace pokusíme podívat z praktického medicínského hlediska. Pro úplnost se zmíníme o roli regionální mozkové oxymetrie v různých klinických oborech, podrobněji se budeme věnovat možnostem použití v neurointenzivní péči a neurochirurgii.
Kardiochirurgické výkony
Význam kontinuálního sledování mozkové perfuze v průběhu kardiochirurgických výkonů v mimotělním oběhu je vyzdvihován pro možnost včasného zavedení neuroprotektivních postupů a prevence následné neurologické deteriorace [21]. Tento aspekt nabývá na významu v populaci pacientů vyššího věku [22]. Běžně se užívá perioperačně u kardiochirurgických výkonů se zástavou cirkulace v hluboké hypotermii [23 – 25]. Některé práce popisují využití rSO2 ke sledování průtoku krve mozkem v časné pooperační fázi po kardiochirurgických výkonech na velkých cévách [26].
Pediatrie
Pediatrická kardiologie a kardiochirurgie využívá neinvazivního sledování rSO2 ke zvýšení bezpečnosti při invazivních výkonech na srdci a velkých cévách. Práce autorů Robertse et al se zabývá etiologií mozkového edému s neurologickou deteriorací při diabetické ketoacidóze u dětí. Výsledné zjištění vysokých až hyperemických hodnot rSO2 poukázalo na možnost vzniku vazogenního edému mozku na podkladě poruchy autoregulace a hyperperfuze mozku [27]. Již u kojenců lze pomocí sledování rSO2 prokázat změny oxygenace mozku v souvislosti s percepční stimulací (některé práce).
Alternativní metody
Je zajímavé, že pomocí měření rSO2 byly také ověřeny účinky některých alternativních metod, jako např. akupunktury. Při stimulaci akupunkturních bodů je dokumentováno mírné snížení nebo zvýšení rSO2 a významné zvýšení rychlosti toku krve v magistrálních cévách průkazné na TCD [28,29]. Lze tedy mluvit o jakési kvantifikaci dosud objektivně málo potvrzených postupů alternativní medicíny při jejich nezpochybnitelném klinickém účinku.
Anesteziologie
Hodnota rSO2 velmi dobře reflektuje změny mozkové oxygenace při systémových poruchách, jako např. hypotenze, hypoxie nebo hyperkapnie [30]. Měření rSO2 lze všeobecně užít při náročných chirurgických výkonech v celkové anestezii s předpokládaným vysokým rizikem perioperačního mozkového poškození pro operovaného (možnost hypotenze, krevní ztráty, stará populace apod.).
Psychiatrie
Jen několik prací se zatím zabývalo aplikací rSO2 ke studiu neurokognitivních procesů spojených s psychickými nemocemi (schizofrenie, poruchy chování, deprese apod.) nebo neurologickými poruchami, jako je Alzheimerova nemoc, Parkinsonova nemoc, epilepsie apod. [31]. V této oblasti se jeví slibně funkční NIRS jako metoda, která na principech NIRS detekuje hemodynamické změny mozkového kortexu po motorické, senzorické nebo kognitivní aktivaci.
Neurologie
Už práce Villingera et al u zdravých dobrovolníků prokázala, že rSO2 odráží změny mozkové perfuze spojené s aktivací mozku senzorickými (vizuálními) a kognitivními podněty, a přitom vyloučila podíl kožních změn. Pomocí měření rSO2 lze prokázat účast kolaterál zevního karotického řečiště na intrakraniálním zásobení při stenóze či okluzi vnitřní karotidy [32,33].
Rehabilitace
Byla potvrzena validita použití rSO2 ke sledování změn mozkové oxygenace a změn v objemu krve během aktivity motorických funkcí mozku [34]. Možná úloha rSO2 v rehabilitačních a specializovaných neurorehabilitačních postupech se teprve ujasňuje, ale zde se hlavně cení neinvazivita a pohotovost měření. Metoda má potenciál se uplatnit u pacientů s následky po těžkém poškození mozku, s poruchami komunikace i u nemocných s minimálním stavem vědomí, kdy je schopna prokázat aktivitu kortexu.
V neurochirurgii je popisováno použití regionální cerebrální oxymetrie perioperačně u dezobliterace karotid jako alternativa jiných způsobů monitorování. Podle literárních informací představuje perioperační sledování rSO2 nenáročný, pohotový a technicky bezproblémový způsob. Senzitivita pro záchyt ischemie se jeví stejná jako při použití evokovaných potenciálů (EP) nebo kontinuální transkraniální dopplerometrie (TCD). V některých studiích bylo provedeno také srovnání s elektroencefalografickým (EEG) monitorováním v průběhu operace. Protože stav individuální cerebrovaskulární rezervy je u každého pacienta odlišný, osvědčilo se hodnotit procentuální změnu rSO2 proti vstupní naměřené hodnotě [35,36]. Dosud existující práce potvrzující vysokou citlivost metody při peroperačním sledování u operací karotických cév v celkové anestezii, protože dobře koreluje s EEG predikcí cerebrální ischemie a potřebou shuntování. Toto monitorování pomůže peroperačně odhalit také hyperemii a hyperperfuzi, která pooperačně komplikuje průběh manifestací hyperperfuzního syndromu [36]. Hodnota rSO2 se zdá dokonce citlivější, protože EEG nezachytí např. jemné funkční deficity a při použití hypotermie je EEG ploché. Tímto způsobem lze časně odhalit ohrožené oblasti a také i tak nízký stupeň hypoperfuze, který ještě nezpůsobí neurologický deficit, avšak následně u pacienta dochází k prokazatelnému kognitivnímu poškození mozku [37].
Je všeobecně známo, že u vysokého procenta pacientů po subarachnoidálním krvácení (SAK) se vyvíjí arteriospazmy. Tyto nemocné je potřeba sledovat i po úspěšném ošetření aneuryzmatu, protože jsou ohroženi vznikem pozdního ischemického deficitu. Jako rizikové období je uváděn interval mezi 4 – 21 dny po vzniku krvácení. Stav vědomí pacienta může dlouhodobě kolísat od plného vědomí přes různě vyjádřené kvantitativní a kvalitativní poruchy vědomí až k bezvědomí. Při běžném neurologickém sledování je obtížné vždy včas zachytit symptomatologii ischemie při vazospazmech a monitorování rSO2 se nabízí jako neinvazivní kontinuální metoda k odhalení hrozícího deficitu i sledování léčebného efektu. V dalším textu je uveden příklad časného záchytu a úspěšné terapie mozkové ischemie při vazospazmech u pacientky po SAK.
Dosud v literatuře vzácně uváděné využití rSO2 je možnost sledování pacientů pospontánním intracerebrálním krvácenído mozkového parenchymu. U většiny takových pacientů je přítomna systémová hypertenze až hypertenzní krize, která představuje terapeutický problém. Pokud není systémový tlak korigován, může ve svém konečném dopadu způsobit další progresi krvácení. Je prokázáno, že u více než 30 % pacientů s ICH dochází během prvních 24 hod ke zvětšení krvácení [11,12]. Ideálním postupem se v takových případech jeví možnost sledovat neinvazivním kontinuálním způsobem saturaci kyslíku přímo v mozkovém parenchymu pomocí rSO2 a systémový tlak se snažit udržet v bezpečných mezích, ale nesnížit přitom úroveň oxygenace mozkové tkáně.
Oblast endovaskulárních výkonů na mozkových cévách se v současnosti významně rozvíjí. Bezprostředně po úspěšně provedeném endovaskulárním výkonu je žádoucí minimálně 24hodinové sledování na specializované jednotce intenzivní péče [38]. U některých typů endovaskulárních výkonů (např. endovaskulární embolizace mozkové AVM) je doporučena hypotenze zavedená v průběhu zákroku a v pooperačním průběhu jako účinná prevence vzniku krvácení i jiných komplikací. Sledování rSO2 v průběhu umělého snižování systémového tlaku výrazně zlepší bezpečnost tohoto postupu a omezí riziko vzniku ischemie mozkové tkáně z důvodu nedostatečné perfuze.
Vyšetření a krátké sledování rSO2 lze použít při zhodnocení indikace k provedení mozkové cévní anastomózy (EC ‑ IC bypass) v rámci zátěžových testů spolu s perfuzním scintigrafickým vyšetřením. Také v této roli se jeví metoda jako pohotová, opakovatelná a nenáročná pro nemocného a personál.
Monitorování pomocí NIRS u bezvědomých pacientů s těžkou kontuzí mozku simultánně s ICP měřením lze využít ve všech časových fázích po poranění. Mozková mikrocirkulace je při vzniku edému a při zvýšených hodnotách ICP prokazatelně poškozena a hodnoty rSO2 se snižují [39]. V akutní fázi (přibližně do demarkace nekrózy a stabilizace krvácení), která představuje asi 48 hod a v některých případech až 5 – 7 dní, lze využít této důležité informace k vedení léčby nitrolební hypertenze.
Účelnost využití měření regionální mozkové saturace kyslíkem v neurointenzivní péči dokumentujeme v následujících kazuistikách.
Ilustrační kazuistika 1
29letý pacient s těžkým kraniocerebrálním poraněním (KCP) při nehodě na motocyklu byl přijat na naši kliniku za hodinu a půl od inzultu. Vstupní GCS 3, umělá plicní ventilace, izokorie zornic. Nález na vstupním CT mozku (obr. 2) naznačoval mnohočetné kontuzní poškození mozku a difuzní edém. Instalovali jsme ICP monitoring. Současně bylo zahájeno oboustranné sledování rSO2 a nasazena intenzivní terapie nitrolební hypertenze, protože již v prvních 24 hod od přijetí ICP převýšil 20 torrů. Antiedémová terapie byla vedena podle doporučení Evropské rady pro trauma mozku (EBIC). ICP je korigovatelné na hodnoty kolem 20 torrů, CPP udržován na 60 – 70 torrech, rSO2 oboustranně ukazuje hodnoty mezi 50 – 55 %. Po vyčerpání konzervativních terapeutických možností zhruba 44 hod od přijetí nastává situace, kdy dochází k poklesu hodnot rSO2 bilaterálně až na 42 %. ICP se pohybuje s intenzivní léčbou kolísavě na 20 – 25 torrech, CPP stále mezi 60 – 70 torry. Jsou nasazeny neuroprotektivní postupy, mírná hypotermie, thiopentalové kóma. Při jednostranně nízké rSO2 vpravo (45 %), která se nezvyšovala ani po 60 min konzervativní léčby, jsme provedli CT mozku (obr. 3). Prokázalo nepochybné známky mozkového edému, spotřebovaný komorový systém a progresi posunu středočárových struktur. Hodnoty ICP intermitentně dosahovaly až 40 torrů, perfuzní tlak (CPP) se dařilo udržet na 50 – 60 torrech. Rozhodli jsme se provést dekompresivní kraniektomii (ve 46. hod od poranění). Efekt zevní a vnitřní dekomprese na nitrolební tlak i na hodnoty regionální oxymetrie byl okamžitý a v dalším průběhu se daří udržovat obojí v normálních mezích. Třináctý den je stav nemocného stabilizován, ICP monitorování ukončeno, pacient je odtlumen a odpojen od ventilátoru. 21. den byl pacient předán do následné péče k rehabilitaci GOS při propuštění bylo stanoveno na 2 (vigilní kóma). Stav se však zlepšoval a za šest měsíců od traumatu při ambulantní kontrole bylo již GOS hodnoceno jako 5 a dle modifikované Rankinovy škály bylo skóre stanoveno mezi 0 – 1. Byla provedena reimplantace kosti. Pacient je schopen normálních aktivit v běžném životě, vrací se do práce.
2. Vstupní CT vyšetření mozku u pacienta 1. Prokazuje naznačené mnohočetné kontuze a edém mozku. 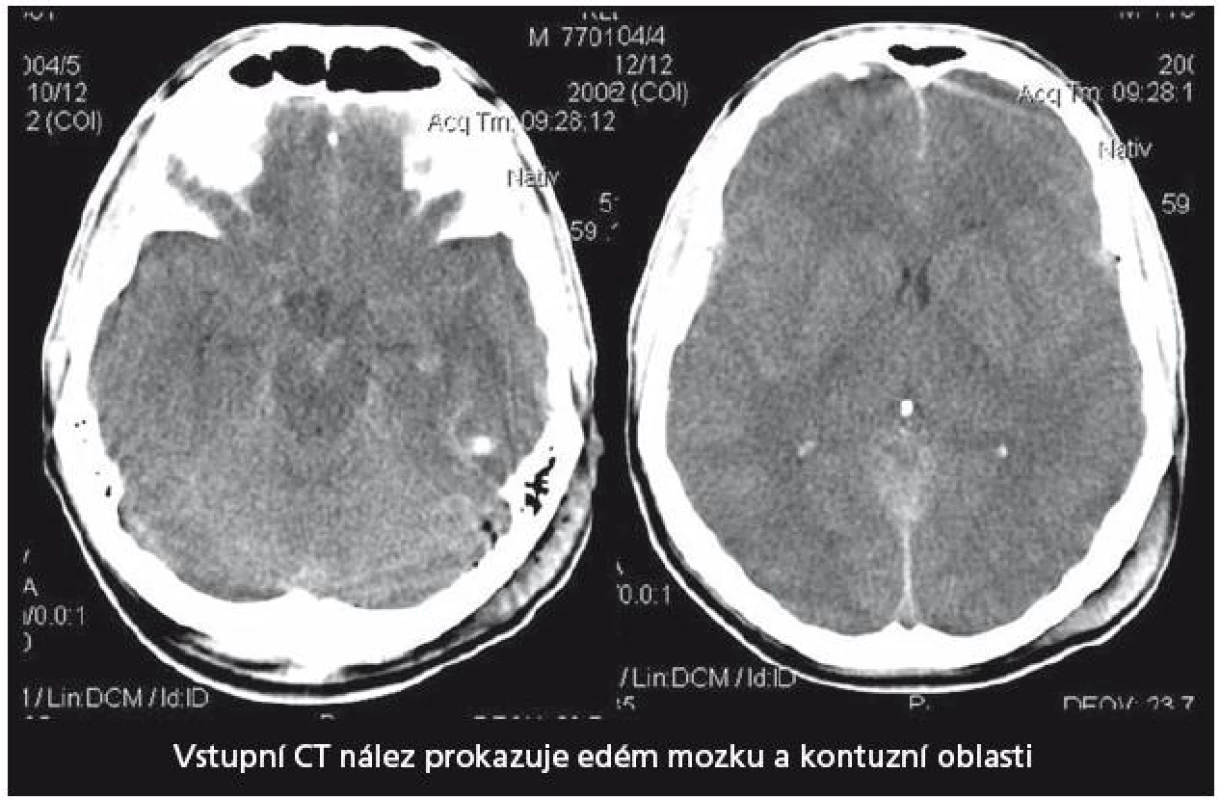
3. Kontrolní CT mozku u pacienta 1 při vzestupu ICP. 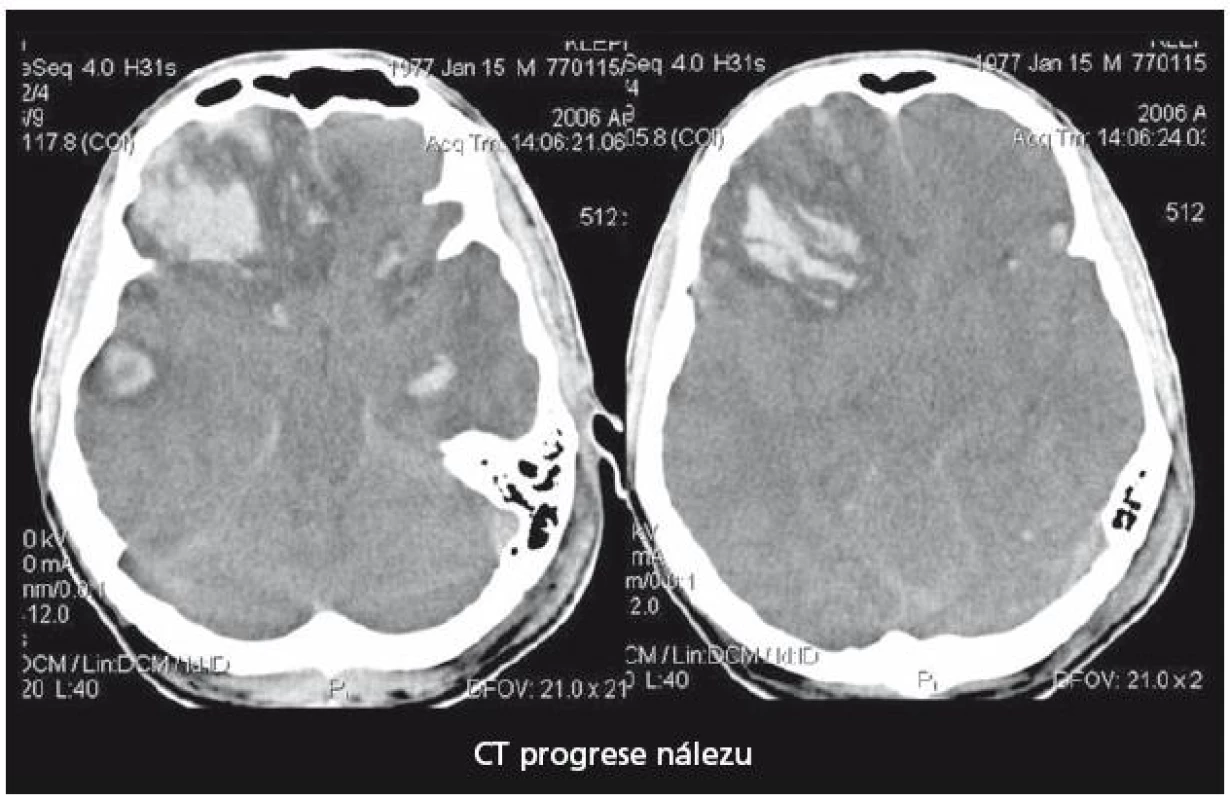
Ilustrační kazuistika 2
48letá žena byla přijata na kliniku po atace SAK z aneuryzmatu na arteria communicans arterior, Hunt ‑ Hess stupeň I, Fisher 1. Bylo provedeno zaklipování krčku aneuryzmatu z pterionální kraniotomie. V dalším průběhu byla nemocná kontrolována na CT mozku, sledována denně pomocí TCD, klinicky hodnocena bez neurologického deficitu. Třetí den zahájeno monitorování rSO2 pomocí INVOS Cerebral Oximeter s hodnotami nad 70 % oboustranně. Devátý den po SAK začaly silné bolesti hlavy, pro které musely být podány opiáty. Nemocná trpěla amentními stavy a pro nespolupráci nebyl možný kvalitní klinický neurologický monitoring ani kontinuální měření TCD. Hodnoty rSO2 klesly na levé straně až na 45 % a postupně se objevuje pravostranná hemiparéza se smíšenou fatickou poruchou. TCD vyšetření potvrdilo arteriospazmy vlevo, zrychlení toku na arteria cerebri media bylo až 320 cm/ s v systole. Po vyloučení grafických známek ischemie a hydrocefalu (CT mozku) byla zahájena léčba s řízenou hypertenzí a volumoterapií. V průběhu hodin se daří zvýšit rSO2 vlevo na 55 % a udržet oxygenaci v celém dalším průběhu. Následovalo zlepšování neurologického nálezu během hodin, nejdéle přetrvávala lehká fatická porucha. Od 14. dne byl registrován ústup spazmů dle TCD, postupně mohla být vysazena řízená hypertenze, aniž docházelo k poklesu hodnot rSO2 pod 50 % nebo ke zhoršení neurologického stavu. Pacientka je propuštěna 24. den po vzniku krvácení, orientovaná, soběstačná, bez neurodeficitu, schopná běžných denních aktivit v normálním životě (GOS 5).
Ilustrační kazuistika 3
Na kliniku byl přijat 69letý muž se spontánním intracerebrálním krvácením (intracerebral haemorrhage, ICH), které bylo lokalizováno podkorově v parietální oblasti pravé mozkové hemisféry. Velikost krvácení dle CT byla změřena na 4 × 6 × 3 cm (obr. 4). Pacient byl při přijetí při vědomí, měl levostrannou hemiplegii a byl dezorientován. Z anamnézy pacienta byla zjištěna hypertenzní nemoc dlouhodobě léčená jednou denní dávkou betablokátoru. Při přijetí k hospitalizaci se manifestovala hypertenzní krize se systolickým krevním tlakem až 220 torrů. Zahájili jsme oboustranné sledování mozkové regionální oxygenace. Hodnoty rSO2 se pohybovaly kolem 55 – 60 %. Kombinovanou intravenózní antihypertenzní léčbou jsme stabilizovali systémový tlak. Když však došlo k poklesu středního arteriálního tlaku na 75 torrů, objevily se nízké hodnoty rSO2 oboustranně. Dochází k poklesu až na 38 – 41 %, reagujeme okamžitě snížením dávek antihypertenziv a systémový střední arteriální tlak se stabilizuje na 90 – 100 torrech, podáváme oxygenoterapii, mírnou sedaci a hodnoty rSO2 se po uvedené léčbě zvyšují na 55 – 58 %. V dalším průběhu se ještě několikrát opakují epizody poklesu rSO2 až na 40 %, vždy se úspěšně daří ji do 30 min zvýšit (snížení dávek antihypertenziv, analgetika, antiedémové léky). Po indikační rozvaze (velikost krvácení a expanzivní projevy, korová lokalizace) byla provedena stereotaktická evakuace krvácení. Pacient je propuštěn z kliniky po 19 dnech od ataky krvácení, je schopen krátké chůze v chodítku i jednoduché komunikace.
4. CT s nálezem spontánního intracerebrálního krvácení u pacienta 3. 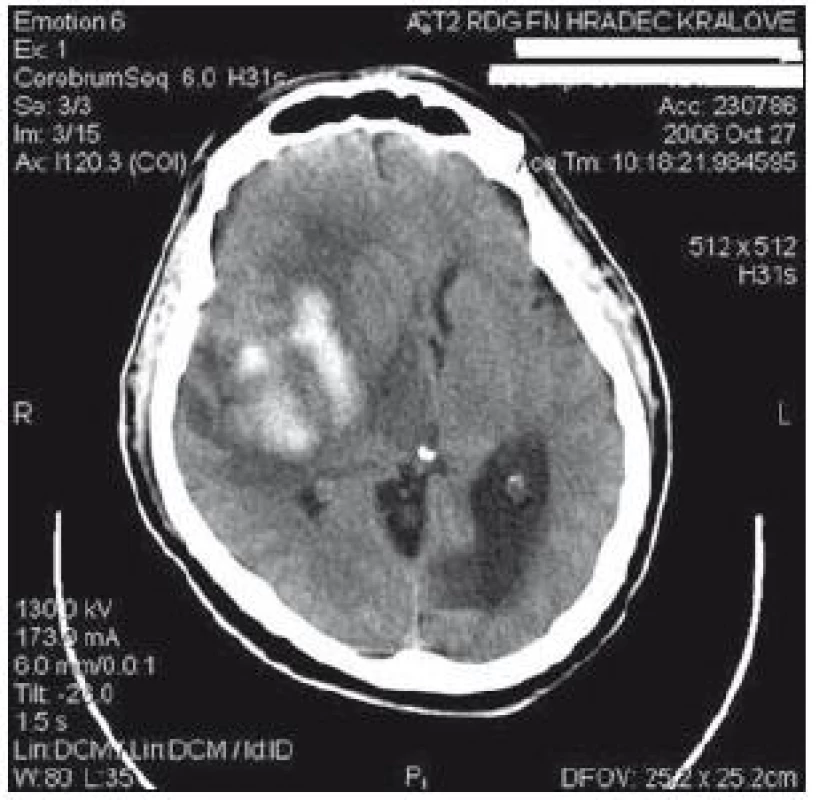
Komentáře k uvedeným kazuistikám
Prvním cílem naší práce bylo prokázat účelnost sledování rSO2 u pacientů po KCP, kteří jsou zároveň monitorováni obvyklým způsobem (ICP monitoring). Záměrem bylo zjistit, do jaké míry hodnoty regionální mozkové oxymetrie měřené pomocí neinvazivní spektrofotometrické metody u pacientů s těžkým poškozením mozku korelují s hodnotami perfuzního mozkového tlaku a nitrolebního tlaku. Kazuistika 1 demonstruje častou klinickou situaci, kdy léčíme pacienta po mozkovém traumatu s těžkou nitrolební hypertenzí. Při větším rozsahu kontuzí dochází během několika hodin k progresi edému a postupně jsou vyčerpány konzervativní možnosti terapie. Praktické zkušenosti poukazují na opakované podcenění situace a provedení kraniektomie až v čase nezadržitelného vzestupu ICP s následným špatným klinickým výsledkem. Prezentovaná kazuistika popisuje možnost využití monitorování rSO2 k včasné indikaci operační léčby. Chirurgická léčba (dekompresivní kraniektomie) je v současné době široce diskutované téma a dosud doporučovanou orientační indikací je nitrolební hypertenze s ICP nad 25 torrů, která nereaguje na konzervativní postupy. S touto nepřesnou indikací je spojeno i nejasné načasování kraniektomie. Často se váhá s výkonem příliš dlouho a narůstající ICP je již známkou dekompenzace stavu. Pokud dojde k vyčerpání compliance intrakraniálního prostoru, vzniká velmi rychle (v intervalu několika málo desítek minut) nevratné poškození tkáně herniačním mechanizmem mozku. Druhým extrémem je předčasná indikace k dekompresivní kraniektomii a nemocný je pak vystaven zbytečnému operačnímu zákroku se všemi možnými doprovodnými komplikacemi (infekce, protrahovaná hospitalizace, epidurální krvácení po reimplantaci kosti apod.). Sledování rSO2 by mohlo v této skupině pacientů přinést novou informaci pro správné a včasné rozhodnutí. Změny ve smyslu snížení rSO2 se v popisované kazuistice začaly projevovat ve 44. hod od poranění. Ke vzestupu ICP dochází ve 46. hod a po grafickém zhodnocení nálezu (CT mozku) je už bez váhání provedena dekompresivní operace (graf 1). Sledování rSO2 poskytuje užitečné informace i v dalším průběhu léčby, zejména ve fázi probouzení pacienta, kdy je již invazivní sledování ICP zpravidla zrušeno a nelze rozlišit vliv sedativ od neurologických projevů poškozené funkce mozku. Ani v této fázi není vyloučen vznik sekundárního traumatu, které stále ještě může celkový výsledek léčby zásadně zhoršit. V našem případě jsme pomocí INVOS zachytili pokles rSO2 sedmý den po KCP. Při terapeutickém úsilí zvýšit hodnotu rSO2 a udržet ji aspoň na dolní hranici se nejlépe osvědčila řízená hypertenze. V uvedeném případě po intervenci došlo k efektivnímu zvýšení rSO2. Využití neinvazivního sledování rSO2 se tedy nabízí v přechodném období před zavedením ICP čidla, po jeho zrušení, při léčebných, diagnostických nebo rehabilitačních procedurách apod. Pro tato krátká období je charakteristická nestabilita pacienta a vulnerabilita ve smyslu vzniku sekundárního mozkového poškození.
1. Průběh a vztah nitrolebního tlaku (ICP) při oboustranném měření regionální saturace mozkové tkáně (rSO<sub>2</sub> dx., rSO<sub>2</sub> sin.), sledování prvních 48 hod po inzultu. 
Druhým cílem bylo ověřit v praxi možnost záchytu počínajících vazospazmů a schopnost léčby s bezprostřední kontrolou výsledku. Hodnoty rSO2 vykazovaly pokles při nástupu psychické a neurologické deteriorace, nárůst rychlostí průtoku v arteria cerebri media pomocí transkraniální dopplerometrie (TCD) potvrdil vazospazmy. Po účinném zvýšení mozkové perfuze se hodnoty rSO2 upravují a klinicky je současně potvrzena úprava neurologického deficitu. Případ 48leté ženy se SAK (kazuistika 2) reprezentuje klinickou situaci častou na jednotkách neurointenzivní péče. Vazospazmy se mohou manifestovat zprvu nepozorovaně (noční hodiny, překrytí poruchou vědomí), ale rychle progredují do nevratné ischemické léze. Terapie představuje řízenou hypertenzi v kombinaci s antiedémovými a neuroprotektivními postupy a sledování rSO2 umožní kontrolovat účinnost léčby.
Třetím cílem bylo ověřit možnost korigovat reaktivní hypertenzi u pacientů po vzniku ICH v mezích bezpečných pro pacienta. V klinických situacích existuje reálné riziko další progrese spontánního intracerebrálního krvácení. Pokud však léčbou snížíme systémový tlak k hodnotám doporučeným pro běžnou populaci, můžeme v daném případě způsobit ischemii mozku. U nemocného s dlouhodobou arteriální hypertenzí platí, že má odlišné prahové nastavení cévní mozkové autoregulace. Pomocí ilustračního případu prokazujeme možnost individuální neinvazivní kontroly bezpečného systolického tlaku pomocí NIRS (graf 2). Při poklesu rSO2 jsou využity kombinace všech postupů vedoucích ke zvýšení oxygenace mozkové tkáně, a tak je uchováno maximální množství funkční tkáně v okolí krvácení (penumbra), které je v akutní fázi ohroženo sekundárním poškozením. V popisované kazuistice se mám podařilo zabránit progresi hematomu i vzniku ischemie.
2. Průběh změn regionální mozkové symetrie na pravé a levé straně (rSO<sub>2</sub> dx., rSO<sub>2</sub> sin.) v závislosti na výšce středního krevního tlaku (MAP) u pacienta s korekcí hypertenzní krize při vzniku spontánního intracerebrálního krvácení. 
Všichni tři nemocní v uvedených kazuistikách byli po terapii a půlročním sledování v dobrém stavu, dle GOS 3 a více. Grafická vyšetření a dobrý klinický stav pacientů potvrzují úspěšné dosažení léčebného cíle a dokumentují, že nedošlo ke vzniku sekundárního poškození.
Diskuze
Měření rSO2 je považováno za neinvazivní techniku pro kontinuální měření hemodynamických a oxygenačních parametrů mozkového kortexu v určených oblastech zájmu. Metoda má vysokou senzitivitu a specificitu k intrakraniálním změnám [40] a byla srovnávána s jugulární venózní oxymetrií a s tlakem kyslíku v mozkovém parenchymu u pacientů s KCP [41].
Ke zkreslení výsledků rSO2 dochází při nedostatečném zastínění fotodiod (např. odchlípení lepicí sondy), při dislokaci sondy a při vzorcích snímaných ze svalu a sliznice frontální dutiny. Tento relativní vliv extrakraniálních tkání je minimalizován separací elektrod a korekcí pro extrakraniální příměs. Někteří z autorů se přímo zabývali otázkou, zda a s jakou přesností rSO2 aplikovaná cerebrálně dokáže rozlišit mezi koncentrací oxygenovaného HbO2 v kůži, ve svalu a kosti (tedy extracerebrálně) a v mozkovém parenchymu (intracerebrálně) [42]. Germon et al prokazují ovlivnění rSO2 při ischemii frontálních oblastí skalpu navozených turniketem, tato klinická situace však může být vyloučena a představuje kontraindikaci pro validní sledování rSO2 [43]. Před aplikací sondy lze dobře kontrolovat kožní změny, přítomnost hematomu ve sledované oblasti apod. Technická úprava přístroje a sondy je aktivně zaměřena na minimalizaci extrakraniální příměsi. Fotodiody, které slouží jako detektor, jsou umístěny na senzoru ve dvou vzdálenostech, 30 a 40 mm od světelného zdroje. Měření je tak možné simultánně v různé hloubce (tkáňové vrstvě). Detektor vzdálenější od přístroje (distální) měří saturaci O2 ve všech tkáních, kterými světelný paprsek proniká (kůže, sval, lebeční kost, mozkový parenchym). Proximální (blíže k přístroji uložený) detektor snímá saturaci hlubší mozkové tkáně. Světelný paprsek musí projít přes skalp a lebeční kost, vzhledem k tomu, že obsah krve je větší v mozkovém kortexu než v ostatních uvedených vrstvách, je rSO2 reprezentativní pro kortex. Vliv přirozeného pigmentu melatoninu a vody má na spektroskopickou analýzu mozkové oxygenace zanedbatelný vliv, zatímco bilirubin a některá další barviva ovlivňují rSO2 významně [44,45].
Nevýhodou také zůstává, že měřená hodnota vypovídá o omezeném regionu mozkové tkáně. Je však možné zvýšení výpovědní hodnoty pomocí kombinace této metody s dalšími monitorovacími systémy a grafickým vyšetřením. Přibližně byly stanoveny mezní hodnoty, ale je doporučeno sledovat trendové odchylky [46]. Některé práce navrhují hodnotit proto jako relevantní až odchylku od základní (vstupní) linie více než o 7 – 10 %. Za nespornou výhodu transkraniální oxymetrie je považována možnost neinvazivního kontinuálního sledování u lůžka nemocného a okamžitou kontrolu terapeutické intervence. Metoda je bezpečná pro pacienta a snadno aplikovatelná školeným personálem.
Poskytuje okamžitou informaci i grafické trendy v kontinuálním sledování, má vysokou senzitivitu. Interpretace výsledků je jednoduchá a rychlá, při hodnocení změn není nutný čas k další analýze. Pacienti a personál nejsou vystaveni radiační zátěži, nebyly popsány žádné komplikace pro nemocného z důvodů aplikace metody. Žádná dosud známá jediná metoda nedokáže se 100% senzitivitou a 100% specificitou zachytit a přesně v prostoru a čase lokalizovat hrozící mozkovou ischemii. Protože existují značné rozdíly v tzv. cerebrovaskulární rezervě u jednotlivých pacientů (dané např. vytvořeným kolaterálním zásobením, věkem, kondicí, stavem cévní stěny apod.), představuje metoda sledování rSO2 výhodu individuálního trendového zhodnocení. Použití regionální mozkové oxymetrie reprezentuje atraktivní metodu pro pracoviště, která disponují touto technologií. Hlavní výhodou je neinvazivita sledování, možnost okamžité dostupnosti informace a zpětná vazba při hodnocení terapeutického efektu.
Demonstrované případy ale potvrzují, že pro dosažení dobrých výsledků léčby je nutné pro účely speciálního sledování v neurointenzivní péči kombinovat jednotlivé metody a výsledky hodnotit vždy individuálně.
Závěr
Zkoumaná metoda měření rSO2 pomocí NIRS je neinvazivní a jednoduchá.
Použití metody u pacientů v neurointenzivní péči má své konkrétní indikace demonstrované na uvedených ilustračních případech. Je nutné další zkoumání na větších počtech pacientů k potvrzení spolehlivosti této metody při sledování nemocných s mozkovým poškozením.
Seznam použitých zkratek
CNS centrální nervová soustava KCP kraniocerebrální poranění ICP intracerebral pressure (nitrolební tlak) O2 kyslík rSO2 regionální saturace krve kyslíkem v mozkové tkáni NIRS near ‑ infrared spectroscopy (infračervená spektroskopie) INVOS in vivo optical spectroscopy (metoda optické spektrometrie) TCCO transcranial cerebral oximetry (transkraniální mozková oxymetrie) SAK subarachnoidální krvácení TCD transkraniální dopplerometrie EEG elektroencefalogram EP evokované potenciály CPP cerebral perfusion pressure (mozkový perfuzní tlak) CBF cerebral blood flow (průtok krve mozkem) SAP systolic arterial pressure (systolický arteriální tlak) CT computer tomography (počítačová tomografie) SPECT single photon emission CT (jednofotonová emisní tomografie) AVM arteriovenózní malformace Hb hemoglobin ICH intracerebral haemorrhage (spontánní intracerebrální krvácení) GCS Glasgow coma scale (všeobecně používaná hodnoticí škála při poruše vědomí) GOS Glasgow outcome score (všeobecně používaná hodnoticí škála pro výsledný stav po léčbě) EBIC European brain injury consortium EC ‑ IC bypass, extrakraniální ‑ intrakraniální cévní anastomóza MUDr. Jiřina Habalová
Neurochirurgická klinika LF UK a FN Hradec Králové
Sokolská 581
500 05 Hradec Králové
e-mail: j.habalova@seznam.czPřijato k recenzi: 1. 7. 2009
Přijato do tisku: 18. 2. 2010
Sources
1. Habalová J, Schreiberová J. Anestezie a intenzivní péče v neurochirurgii. In: Náhlovský J et al (eds). Neurochirurgie. Praha: Galén Karolinum 2006 : 25.
2. Bullock R, Marmarou A. Neuromonitoring in brain injury. Acta Neurochirurgica 1999; 75 (Suppl): 70.
3. Otevřel F, Smrčka M, Kuchtičková Š, Mužík J. Korelace ptiO2 a apoptózy u fokální mozkové ischemie a vliv systémové hypertenze. Cesk Slov Neurol N 2007; 70/ 103(2): 168 – 173.
4. Smrčka M, Ďuriš K, Juráň V, Neuman E, Kýr M. Peroperační monitoring tkáňové oxymetrie a peroperační užití hypotermie v chirurgii mozkových aneuryzmat. Cesk Slov Neurol N 2009; 72/ 105(3): 245 – 249.
5. Hejčl A, Bolcha M, Procházka J, Sameš M. Multimodální monitorace mozku u pacientů s těžkým kraniocerebrálním traumatem a subarachnoidálním krvácením v neurointenzivní péči. Cesk Slov Neurol N 2009; 72/ 105(4): 383 – 387.
6. Ungerstedt U, Rostami E. Microdialysis in neurointensive care. Curr Pharm Des 2004; 10(18): 2145 – 2152.
7. Martens P, Raabe A. Serum S ‑ 100 and neuron ‑ specific enolase for prediction of regaining conciousnes after global cerebral ischemia. Stroke 1998; 29(11): 2363 – 2366.
8. Rasmussen P, Dawson EA, Nybo L, Van Lieshout JJ, Secher NH. Gjedde A. Capillary ‑ oxygenation ‑ level ‑ dependent near ‑ infrared spectrometry in frontal lobe of humans. J Cereb Blood Flow Metab 2007; 27(5): 1082 – 1093.
9. Zauner A, Daugherty WP, Bullock MR, Warner DS. Brain oxygenation and energy metabolism: part I ‑ biological function and pathophysiology. Neurosurgery 2002; 51(2): 289 – 302.
10. Paolin A, Nardin L, Gaentani P, Rodriguez Y, Baena R, Pansarasa O et al. Oxidative damage after severe head injury and its relationship to neurological outcome. Neurosurgery 2002; 51(4): 949 – 954.
11. Brott T, Broderick JP, Khoteri R, Barsan W, Tomsick T,Sauerbeck L e t al. Early haemorrhage growth in patients with intracerebral haemorrhage. Stroke 1997; 28(1): 1 – 5.
12. Kazui S, Naritomi H,Yamamoto H, Sawada T, Yamaguchi T. Enlargement of spontaneous intracerebral hemorrhage. Incidence and time course. Stroke 1996; 27(10): 1783 – 1787.
13. Kaminogo M, Ichikura A. Shibata S, Toba T. Yonekura M. Effect of acetazolamide on regional cerebral oxygen saturation and regional cerebral blood flow. Stroke 1995; 26(12): 2358 – 2360.
14. Ohmae E, Ouchi Y, Oda M, Suzuki T, Nobesawa S, Kanno T et al. Cerebral hemodynamic evaluation by near ‑ infrared time ‑ resolved spectroscopy: correlation with simultaneous positron emission tomography measurements. Neuroimage 2006; 29(3): 697 – 705.
15. Kaminogo M, Ochi M, Onizuka M, Takahata H, Shibata S. An additional monitoring of regional cerebral oxygen saturation to HMPAO SPECT study during balloon test occlusion. Stroke 1999; 30(2): 407 – 413.
16. McCormick PW, Steward M. Intracerebral penetration of infrared light. Technical note. J Neurosurg 1992; 76(2): 315 – 318.
17. Moritz S, Kasprzak P, Arlt M. Taeger K, Metz C. Accuracy of cerebral monitoring in detecting cerebral ischemia during carotid endarterectomy: a comparison of transcranial Doppler sonography, near ‑ infrared spectroscopy, stump pressure, and somatosensory evoked potentials. Anesthesiology 2007; 107(4): 563 – 569.
18. Vespa P. What is the optimal treshold for cerebral perfusion pressure following traumatic brain injury. Neurosurgery Focus 2003; 15(6): E4.
19. Habalová J, Kanta M, Dostálová V, Zadrobílek K. Jak monitorovat pacienty po subarachnoidálním krvácení a včas zachytit hrozící komplikace? Neurol Pro Praxi 2005; (Suppl A): 13 – 14.
20. Habalová J. Regionální sledování mozkového kyslíku v neurointenzivní péči. In: Zazula R et al (eds). Ročenka intenzivní medicíny. Praha: 1. LF UK ARK 2006 : 128 – 130.
21. Razumovsky AY, Gugino LD, Owen JH. Advanced neurologic monitoring for cardiac surgery. Curr Cardiol Rep 2006; 8(1): 17 – 22.
22. Yu Q, Sun L, Chang Q, Sun G, Liu J. Monitoring of antegrade selective cerebral perfusion for aortic arch surgery with transcranial Doppler ultrasonography and near ‑ infrared spectroscopy. Chin Med J 2001; 114(3): 257 – 261.
23. Fearn SJ, Pole R, Wesnes K, Faragher EB, Hooper TL, McCollum CN. Cerebral injury during cardiopulmonary bypass: emboli impair memory. J Thorac Cardiovasc Surg 2001; 121(6): 1150 – 1160.
24. Edmonds HL jr, Rodriguez RA, Audenaert SM, Austin EH jr, Pollock SB jr, Ganzel BL. The role of neuromonitoring in cardiovascular surgery. J Cardiothorac Vasc Anesth 1996; 10(1): 15 – 23.
25. Kussman BD, Gauvreau K, DiNardo JA, Newburger JW, Mackie AS, Booth KL et al. Cerebral perfusion and oxygenation after the Norwood procedure: comparison of right ventricle ‑ pulmonary artery conduit with modified Blalock ‑ Taussig shunt. J Thorac Cardiovasc Surg 2007; 133(3): 648 – 655.
26. de Vries JW, Hoorntje TM, Sreeram N. Neurophysiological effects of pediatric balloon dilatation procedures. Pediatric Cardiology 2000; 21(5): 461 – 464.
27. Roberts JS, Vavilala MS, Schenkman KA, Shaw D, Martin LD, Lam AM. Cerebral hyperemia and impaired cerebral autoregulation associated with diabetic ketoacidosis in critically ill children. Crit Care Med 2006; 34(8): 2217 – 2223.
28. Schwarz G, Litscher G, Sandner ‑ Kiesling A. Pseudoparadoxical dissociation of cerebral oxygen saturation and cerebral blood flow velocity after acupuncture in a woman with cerebrovascular dementia: a case report. Neurol Res 2004; 26(6): 698 – 701.
29. Litscher G, Schwarz G, Sandner ‑ Kiesling A, Hadolt I, Eger E. Effects of acupuncture on the oxygenation of cerebral tissue. Neurol Res 1998; 20 (Suppl 1): S28 – S32.
30. Krakow K, Ries S, Daffertshofer M, Hennerici M. Simultaneous assessment of brain tissue oxygenation and cerebral perfusion during orthostatic stress. Eur Neurol 2000; 43(1): 39 – 46.
31. Irani F, Platek SM, Bunce S, Ruocco A, Chute D.Functional near infrared spectroscopy (fNIRS): an emerging neuroimaging technology with important applications for the study of brain disorders. Clin Neuropsychol 2007; 21(1): 9 – 37.
32. Villinger A, Plancka J, Hockb C, Schleinkoferc L, Dirnagla U. Near infrared spectroscopy (NIRS): a new tool to study hemodynamic changes during activation of brain function in human adults. Neurosci Lett 1993; 154(1 – 2): 101 – 104.
33. Fearn SJ, Picton AJ, Mortimer AJ, Parry AD, McCollum CN. The contribution of the external carotid artery to cerebral perfusion in carotid disease. J Vasc Surg 2000; 31(5): 989 – 993.
34. Bhambhani Y, Maikala R, Farag M, Rowland G. Reliability of near infrared spectroscopy measures of cerebral oxygenation and blood volume during handgrip exercise in nondisabled and traumatic brain‑injured subjects. J Rehabil Res Dev 2006; 43(7): 845 – 856.
35. Vets P, ten Broecke P, Adriaensen H, Van Schil P, De Hert S. Cerebral oximetry in patients undergoing carotid endarterectomy: preliminary results. Acta Anaesthesiol Belg 2004; 55(3): 215 – 220.
36. Ogasawara K, Konno H, Yukawa H, Endo H, Inoue T, Ogawa A. Transcranial regional cerebral oxygen saturation monitoring during carotid endarterectomy as a predictor of postoperative hyperperfusion. Neurosurgery 2003; 53(2): 309 – 314.
37. Ogasawara K, Inoue T, Kobayashi M, Fukuda T, Komoribayashi N, Saitoh H et al. Cognitive impairment associated with intraoperative and postoperative hypoperfusion without neurologic deficits in a patient undergoing carotid endarterectomy. Surg Neurol 2006, 65(6): 577 – 580.
38. Hernandez ‑ Avila G, Dujovny M, Slavin KV, Luer MS, Nijensohn E, Geremia G et al. Use of transcranial cerebral oximetry to monitor regional cerebral oxygen saturation during neuroendovascular procedures. Am J Neuroradiol 1995; 16(8): 1618 – 1625.
39. Kampfl A, Pfausler B, Denchev D, Jaring HP, Schmutzhard E. Near infrared spectroscopy (NIRS) in patients with severe brain injury and elevated intracranial pressure. A pilot study. Acta Neurochir Suppl 1997; 70 : 112 – 114.
40. Al ‑ Rawi PG, Smielewski P, Kirkpatrick PJ. Evaluation of a near ‑ infrared spectrometer (NIRO 300) for detection of intracranial oxygenation changes in the adult head. Stroke 2001; 32(11): 2492 – 2500.
41. McLeod AD, Igielman F, Elwell C, Cope M, Smith M.Measuring cerebral oxygenation during normobaric hyperoxia: a comparison of tissue microprobes, near infrared spectroscopy and jugular venous oximetry in head injury. Anesth Analg 2003; 97(3): 851 – 856.
42. Germon TJ, Young AE, Manara AR, Nelson RJ. Extracerebral absorption of near infrared light influences the detection of increased cerebral oxygenation monitored by near infrared spectroscopy. J Neurol Neurosurg Psychiatry 1995; 58(4): 477 – 479.
43. Germon TJ, Kane NM, Manara AR, Nelson RJ. Near ‑ infrared spectroscopy in adults: effects of extracranial ischaemia and intracranial hypoxia on estimation of cerebral oxygenation. Br J Anaesthesia 1994; 73(4): 503 – 506.
44. Schwarz G, Litscher G, Kleinert R, Jobstmann R. Cerebral oximetry in dead subjects. J Neurosurg Anesthesiol 1996; 8(3): 189 – 193.
45. Litscher G, Schwarz G. Transcranial cerebral oximetry: is it clinically useless at this moment to interpret absolute values obtained by the INVOS 3100 cerebral oximeter? Biomed Tech (Berl) 1997; 42(4): 74 – 77.
46. Al ‑ Rawi PG, Kirkpatrick PJ. Tissue oxygen index: thresholds for cerebral ischemia using near infrared spectroscopy. Stroke 2006; 37(11): 2720 – 2725.
Labels
Paediatric neurology Neurosurgery Neurology
Article was published inCzech and Slovak Neurology and Neurosurgery

2010 Issue 3-
All articles in this issue
- Thoracolumbar Disc Injury – Indication for Anterior Disc Replacement Using Magnetic Resonance Imaging
- Comparison of Aphasia Severity in Dementia and Stroke Using MASTcz, and Aphasia in Relation to Severity of Cognitive Deficit
- Standardization of the Czech Version of The Confusion Assessment Method for the Intensive Care Unit (CAM‑ICUcz)
- Changes in Perfusion Computed Tomography after Conventional Extra‑ Intracranial Bypass Surgery
- Fractures of the Fifth Lumbar Vertebra
- Sexual Dysfunction and its Incidence in Patients with Epilepsy
- The Use of Regional Cerebral Oximetry as a Non‑ invasive Method to Monitor Neurointensive Care Patients
- The Assessment of Outcome in Carotid Artery Operations Performed in the Period 1997– 2009
- Surgical Treatment of Neuroepithelial Tumours of the Central Surface of the Sacrum – Case Reports
- Complicated Herpetic Necrotising Meningoencephalitis Requiring Neurosurgical Intervention – a Case Report
- Spondylotic Cervical Myelopathy
- Nuclear Medicine Examination of Cerebrovascular Reserve Capacity and Other Complementary Methods
- Thunderclap Headache
- Complete Hearing Restoration in Vestibular Schwannoma with Repeated Sudden Hearing Loss
- Czech and Slovak Neurology and Neurosurgery
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Spondylotic Cervical Myelopathy
- Fractures of the Fifth Lumbar Vertebra
- Standardization of the Czech Version of The Confusion Assessment Method for the Intensive Care Unit (CAM‑ICUcz)
- Complicated Herpetic Necrotising Meningoencephalitis Requiring Neurosurgical Intervention – a Case Report
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

