-
Medical journals
- Career
Srovnání karotické endarterektomie a stentingu – výsledky jednoho pracoviště
Authors: V. Beneš 1; D. Netuka 1; F. Charvát 2; M. Mohapl 1; F. Kramář 1; S. Ostrý 1; J. Mašková 2; J. Lacman 2
Authors‘ workplace: Neurochirurgická klinika 1. LF UK, IPVZ a ÚVN Praha 1; Radiodiagnostické oddělení ÚVN Praha 2
Published in: Cesk Slov Neurol N 2008; 71/104(4): 400-404
Category: Review Article
Podpořeno IGA MZCR NR/9435-3.
Overview
Úvod:
Karotická endarterektomie (Carotid Endarterectomy, CEA) má své pevné místo ve spektru výkonů pro aterosklerotické postižení vnitřní krkavice. Karotický stenting (Carotid Artery Stenting, CAS), jako metodika novější, své indikace stále hledá. Pohled na CAS se během posledních let vyvíjí. Autoři srovnávají výsledky obou modalit.Materiál a metodika:
Karotickou endarterektomii provádí tým autorů od roku 1982. Do roku 1997 autoři textu realizovali CEA v nemocnici v Ústí nad Labem, od roku 1997 v Ústřední vojenské nemocnici Praha (ÚVN). Do července 2007 byl tento výkon proveden celkem v 1 271 případě. Od roku 1999 se na Radiodiagnostickém oddělení ÚVN vykonává karotický stenting. Celkem byl proveden v 363 případech.Výsledky:
30denní morbidita/mortalita (M/M) činila 2,04 % po CEA, resp. 4,68 % po CAS. Tranzitorní ischemická ataka (TIA) do 30 dní od výkonu se vyskytla ve skupině CEA v 1,49 %, ve skupině CAS v 7,43 %. Lokální komplikace byly zaznamenány v 6,29 % případů po CEA, v 7,98 % případů po CAS. Poškození hlavových nervů bylo zaznamenáno pouze ve skupině CEA, a to v 3,93 % případů. Revize rány po CEA byla nutná v 2,98 % případů. Malé komplikace byly zaznamenány v 10,07 % po CEA, v 17,63 % po CAS.Závěr:
V našem materiálu byla 30denní M/M a výskyt TIA po výkonu nižší ve skupině CEA. Vzhledem k dosaženým výsledkům nadále doporučujeme CEA jako metodiku první volby, CAS pro aterosklerotické postižení krkavice doporučujeme provádět v rámci mezinárodních registrů a randomizovaných studií.Klíčová slova:
vnitřní krkavice – stenóza – endarterektomie – stentingÚvod
V České republice provádí karotickou endarterektomii (CEA) většina neurochirurgických pracovišť. Jsme tak jednou z mála zemí Evropy, kde se této problematice nevěnují výhradně cévní chirurgové (spolu s námi CEA provádějí někteří neurochirurgové ve Velké Británii). Toto téma je pro neurochirurga atraktivní a je jen málo relevantních sjezdů a sympozií v ČR, kde by někdo z naší společnosti na téma endarterektomie nepřednášel. Tento fakt jistě měl i zásadní vliv na zavádění stentingu. Endovaskulární techniky v neurochirurgii mají velmi široké pole působnosti a neurochirurgové u nás je vždy přijímali dosti vstřícně a byli a jsou nejen jejich uživateli, ale i propagátory. Nikdy jsme se necítili novými metodikami ohroženi, ani odborně, ani ekonomicky (to na rozdíl od některých jiných evropských zemí a zejména na rozdíl od USA, které Evropa nepochybně v této oblasti předběhla).
Nové metody však nemohou být přijímány pouze emotivně a empiricky. Po prvotním nadšení a růstu je třeba kriticky metodu zhodnotit, dovolit jí, aby své využití prokázala v čase a aby se její použití vyrovnalo na reálných hladinách. V této minireview shrnujeme poznatky z literatury. Tu si však mohou všichni přečíst v originálním vydání. Za nezbytné považujeme vlastní zkušenosti. Teprve kombinací obojího si může nejen čtenář, ale i autoři vytvořit kompletní představu o dané problematice. Vlastní zkušenosti předkládáme v následujících odstavcích a považujeme je za nedílnou součást minireview.
Materiál a metodika
Karotické endarterektomie jsme prováděli od července 1982 v nemocnici v Ústí nad Labem [1]. Do roku 1989 byl však počet operací zanedbatelný, cca 5 až 10 operací ročně. Na počátku 90. let jsme uskutečnili cca 40–50 operací ročně, od roku 1996 počet operací fluktuuje mezi 70–110 výkony ročně. Od roku 1997 tyto operace provádíme v ÚVN Praha. Během let se též vyvíjela metodika monitorování při operacích a tím se nejen měnilo procento použití intraluminálních shuntů, ale i zvyšovala bezpečnost operace. První pacienti byli operováni s obligatorním zavedením shuntu, poté jsme používali měření tlaku v uzavřené vnitřní krkavici (stump pressure), později jsme přistoupili ke transkraniálnímu doppleru (TCD). Paralelně s aplikací těchto technik klesalo procento použití intraluminálního shuntu. V první polovině 90. let jsme shunt používali v cca 50 %. Od roku 1997 přibylo rutinní monitorování pomocí somatosenzorických evokovaných potenciálů, od roku 2001 též používáme spektrální analýzu EEG. Při aplikaci těchto technik zavádíme intraluminální shunt v cca 5 % případů [2]. Všechny CEA byly provedeny mikrotechnikou, při níž máme k dispozici dostatek stěny tepny, záplatu jsme proto nepoužili ani jednou. Kritickým místem je distální konec endarterektomie, kde může vzniknout stenóza a disekce. Této oblasti tedy vždy věnujeme největší pozornost a také peroperačně ji kontrolujeme ultrazvukem. Při sebemenší nejistotě neváháme revidovat.
Celkem jsme do července 2007 CEA provedli 1 271 operaci, věkový průměr pacientů byl 64 let.
Od roku 1999 je v naší nemocnici k dispozici též karotický stenting (CAS, od dubna 2001 obligatorně s použitím cerebrální protekce). Pacienti jsou připraveni duální antiagregační terapií (tři dny před výkonem, standardně Plavix, Sanofi Pharma, Francie, a Anopyrin, Zentiva a. s., SR), kterou ponecháváme minimálně 30 dní po výkonu, poté přecházíme na monoterapii. Celkem byl zaveden stent v 363 případech, věkový průměr pacientů byl 72 let. Použity byly tyto typy cerebrální protekce: FilterWire, Boston Scientific Corporation, USA (v 76 % případů), Spider, ev3 Neurovascular, USA (8,6 %), Accunet, Abbott Vascular, USA (7,7 %), Angioguard, Cordis Corporation, USA (3,9 %), Emboshield, Abbott Vascular, USA (3,2 %), Interceptor, Medtronic, USA (0,6 %). V našem souboru byly implantovány tyto stenty: Wallstent, Boston Scientific Corporation, USA (53,4 %), Precise, Cordis Corporation, USA (16,2 %), Acculink, Abbott Vascular, USA (8,8 %), OptiMed Sinus, OptiMed Medizinische Instrumente, Německo (7,1 %), Exponent, Medtronic, USA (4,1 %), Xact, Abbott Vascular, USA (3,0 %), jiné (7,4 %). Stenting je prováděn při vědomí, premedikace není používána.
Podle klinické symptomatologie jsme naše nemocné rozdělili do tří skupin: striktně asymptomatičtí pacienti bez jakékoliv neurologické symptomatologie v anamnéze (130 pacientů ve skupině CEA, 75 ve skupině CAS), nemocné asymptomatické v daném povodí, ale s jinou neurologickou symptomatologií (402 pacienti ve skupině CEA, 78 ve skupině CAS) a nemocné se symptomy odpovídajícími dané tepně (739 pacientů ve skupině CEA, 210 ve skupině CAS). CT vyšetření bylo obligatorní, MRI fakultativní. Proto jsme se při rozdělení do výše uvedených skupin řídili klinickým obrazem, nikoliv obrazem na MRI.
Za standardní průběh po CEA považujeme nekomplikovaný operační výkon, včetně úvodu a vyvedení z celkové anestezie, pobyt na jednotce intenzivní péče maximálně 24. hod po výkonu, vertikalizace pacienta první pooperační den, dimise pacienta do čtvrtého pooperačního dne. Za standardní průběh po CAS považujeme nekomplikovaný endovaskulární výkon, pobyt na jednotce intenzivní péče maximálně 24 hod po výkonu, vertikalizace pacienta první pooperační den, dimise pacienta do druhého dne po výkonu. Cokoliv odlišné od tohoto průběhu pokládáme za komplikaci, v naprosté většině případů malou (např. přechodné bolesti hlavy, hypertenze vyžadující medikaci, nauzea, poruchy srdečního rytmu atd.). Do celkového čísla malých komplikací jsou započteny i lokální komplikace.
Klinické hodnocení pacientů prováděl závislý neurolog, nikoliv operatér, nebo intervenční neuroradiolog.
K statistickému porovnání výsledků byl ve všech případech použit chí-kvadrát test.
Výsledky
Celkové výsledky
30denní M/M byla ve skupině CEA 2,04 % (26 z 1 271 pacienta), ve skupině CAS 4,68 % (17/363), p = 0,0074. Mortalita po CEA byla 1,10 % (14/1 271), po CAS 1,37 % (5/363). TIA byla zaznamenána do 30 dní od výkonu ve skupině CEA v 1,49 % (19/1 271), ve skupině CAS v 7,43 % (27/363), p < 0,0001. Malé komplikace byly zaznamenány v 10,07 % po CEA (128/1 271), v 17,63 % po CAS (54/363), p = 0,0233. Celkové procento všech komplikací (malé komplikace a 30denní M/M) bylo 12,1 % (154//1 271) po CEA a 22,3 % (81/363) po CAS, p < 0,0001.
Lokální komplikace
Jsou již započteny výše, zde doplňujeme pouze pro úplnost. Lokální komplikace byly zaznamenány v 6,29 % případů po CEA (80/1 271), v 7,98 % případů po CAS (29/363), p = 0,2878. Poškození hlavových nervů bylo logicky nalezeno pouze ve skupině CEA, a to v 3,93 % případů. Revize rány po CEA byla nutná v 2,98 % případů (38/1 271).
Na následujících řádcích popisujeme specifické skupiny nemocných, u kterých byla role CEA a CAS hodnocena.
Starší nemocní
Ve skupině pacientů nad 75 let jsou výsledky 30denní M/M následující: 1,62 % (2/123) ve skupině CEA, 4,38 % (6/137) ve skupině CAS, p = 0,2129.
Kontralaterální okluze
Též jsme hodnotili rizika výkonu v situaci kontralaterální okluze krkavice. 30denní M/M byla v podskupině CEA pouze 2,53 % (4/158), ve skupině CAS bylo toto riziko 4,44 % (2/45), p = 0,5185. Výsledky jsou shrnuty v tab. 1.
Table 1. Porovnání CEA a CAS na našem pracovišti. 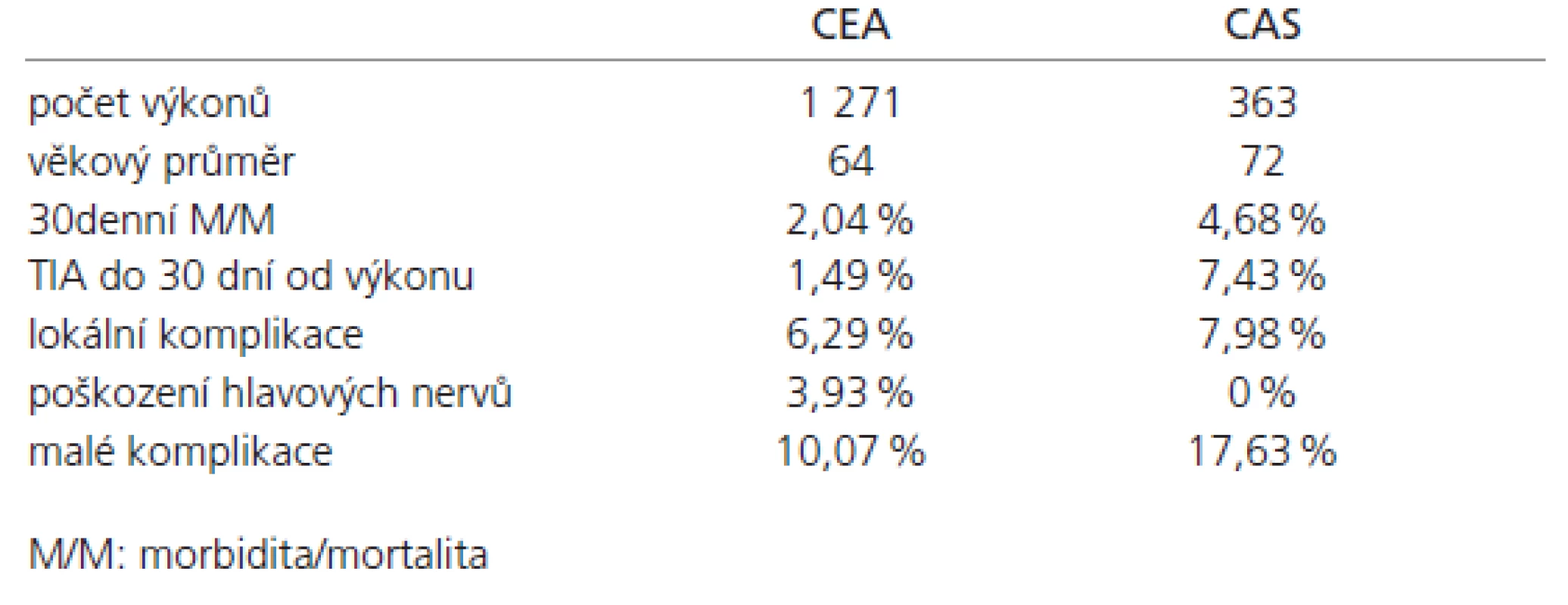
Všechny zaznamenané statisticky významné rozdíly byly ve prospěch CEA.
Symptomatologie
Výsledky 30denní M/M dle klinické symptomatologie pacienta: asymptomatický pacient, asymptomatická stenóza 0,7 % po CEA, 4 % po CAS, symptomatický pacient, asymptomatická stenóza 1,7 % po CEA, 4 % po CAS, symptomatický pacient, symptomatická stenóza 2,5 % po CEA, 2,4 % po CAS (tab. 2).
Table 2. 30denní M/M dle symptomatologie pacienta. 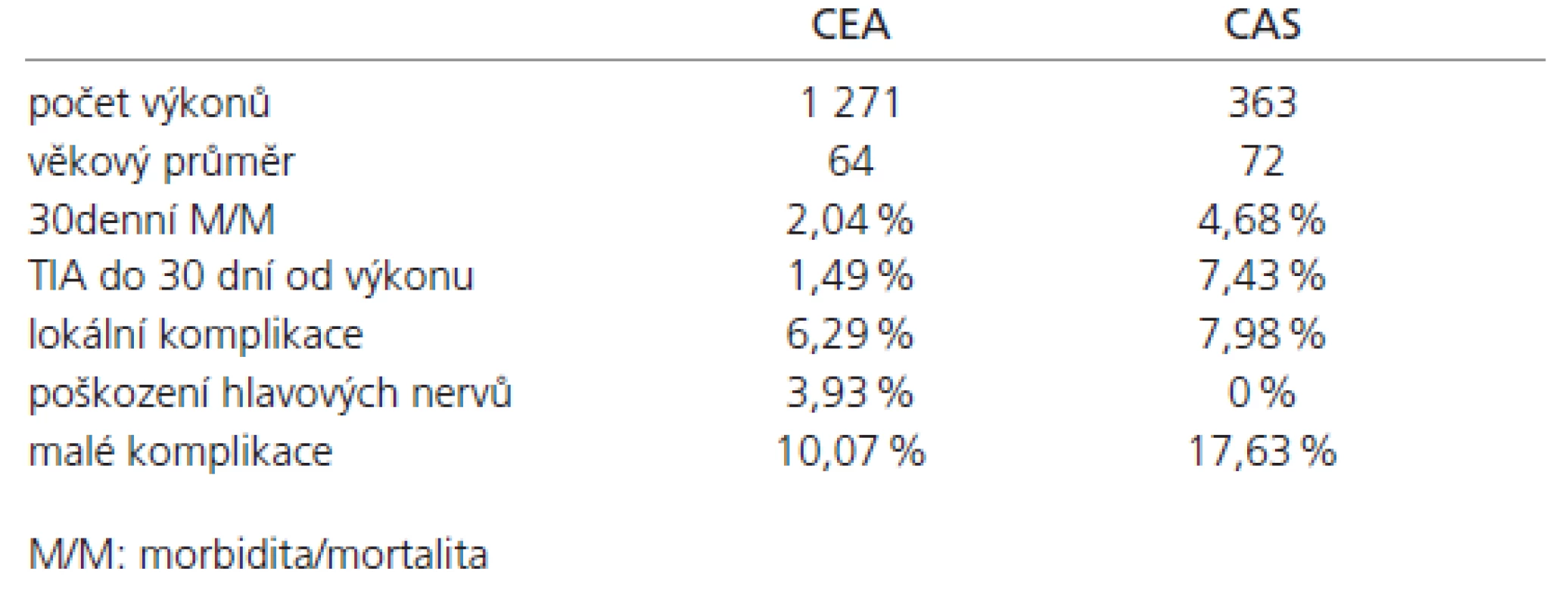
Diskuze
Procento všech komplikací je na první pohled vysoké. Nelze však zapomínat na to, že ve výsledcích se obvykle uvádí 30denní M/M (v naší sérii 2,04 v. 4,68 %). Nezávažné komplikace, již i proto, že nezanechávají následky, se prakticky nikde neuvádějí. My jsme do tohoto čísla započítali i všechny přechodné a/nebo zcela minimální komplikace. Kupříkladu zvýšenou teplotu, bolesti hlavy atd., de facto vše, co nemocného zdrželo v nemocnici déle než dva dny po CAS či 3–4 po CEA. Myslíme si, že je na místě uvádět nejen 30denní M/M, ale i jakékoliv jiné komplikace. Význam to má při informování nemocného před zákrokem, kdy ho musíme upozornit nejen na závažná rizika, ale i na drobnější možné nepříjemnosti.
Hertzer et al publikovali výsledky 2 228 CEA provedených v Clevelandu (USA) v letech 1989–1995 [3]. 30denní M/M v této skupině pacientů byla 2,3 %. Sérii celkem 5 425 CEA z Milána publikovali Chiesa et al [4]. Neurologická M/M dosahovala 1,3 %. Naše výsledky jsou srovnatelné i s těmito studiemi.
Přibáň et al publikovali v roce 2008 srovnání CEA a CAS na jejich pracovišti [5]. 30denní neurologická M/M po CEA činila 1,8 %, po CAS 2,2 %. Ve studii SPACE [6] je tento poměr 1 : 1 a v EVA-3S [7] skoro 1 : 3.
Naše výsledky odpovídají tomu, co bylo publikováno v metaanalýzách [8,9] a prokázáno v randomizovaných studiích [6,7,10–15]. CEA je stále zlatým standardem a CAS je nutno prozatím považovat za alternativní a doplňkovou metodu. K finálnímu hodnocení je třeba vyčkat na výsledky probíhajících studií a mezitím lze hledat podskupiny nemocných, které by byly vhodné pro tu kterou metodu. Jasné indikační okruhy pro CAS jsme popsali v minireview. Dalšími specifickými skupinami jsou starší nemocní a nemocní s kontralaterální okluzí krkavice.
Naše zkušenosti podporují fakt, který byl pozorován například ve studii NASCET a ECST [16]. Při zvážení všech anesteziologických a interních rizik u konkrétního pacienta není CEA nebezpečnější u pacientů nad 75 let. V našem souboru zde 30denní M/M dosahovala 1,62 %, ve skupině CAS byla M/M 4,38 %.
Naše výsledky nejsou v souladu s mezinárodními studiemi a se závěry přehledného článku autorů Kastrup et al ve vztahu k riziku CEA u pacientů s kontralaterální okluzí krkavice [8]. Autoři tohoto článku došli k závěru, že riziko CEA v případě kontralaterální okluze je vyšší než v situaci, kdy kontralateralní krkavice není uzavřena. V naší sestavě jsme zaznamenali jen velmi mírně vyšší riziko CEA v případě kontralaterální okluze, tj. 2,53 % (v celé skupině CEA byla M/M 2,04 %). 30denní M/M CAS u této podskupiny pacientů u nás činilo 4,44 %.
Ve studiích srovnávajících CEA a CAS bylo relativně málo prostoru věnováno klinické symptomatologii nemocných. Vysvětlením by mohlo být to, že CAS převzala indikační kritéria od CEA, kde je zásadním bodem symptomatologie. V případě asymptomatických stenóz pak CAS obvykle nesplňuje požadavek na 3% M/M. Podle velkých registrů a i v našem materiálu však CAS odpovídá požadavku platícímu pro symptomatické stenózy, tj. 6% MM. Jsou-li pak výsledky prezentovány jako jedna skupina, jsou přijatelné.
Klinický obraz pacienta stále považujeme za rozhodující. Ve všech studiích byli asymptomatičtí nemocní definováni jako ti, kteří buď neměli žádné příznaky, nebo měli příhodu déle než před šesti měsíci v relevantním povodí nebo kdykoliv v povodí jiném. My jsme rozdělili naše soubory do výše uvedených tří skupin. Rozdíly nejsou statisticky významné, ale trend je patrný. Pokud by se tyto rozdíly potvrdily na větším souboru a dosáhly by statistické významnosti, bylo by asi nutné přehodnotit indikační kritéria i požadavky na M/M u obou skupin nemocných dosud označovaných za asymptomatické. Ve vztahu k CAS jsou naše výsledky překvapující. U symptomatických nemocných byla M/M stejná u CAS a CEA, naopak u obou skupin asymptomatických nemocných byla M/M CAS vyšší nežli M/M CEA. Vzhledem k těmto výsledkům nedoporučujeme CAS u asymptomatických pacientů, CAS u těchto pacientů lze provést v rámci randomizovaných studií (např. ACST-2).
Jsme si plně vědomi toho, že obě naše skupiny jsou jen obtížně srovnatelné. Nemocní, u nichž jsme indikovali CAS, mají průměrný věk o 10 let vyšší, zaznamenali jsme u nich i více rizikových faktorů (ICHS, hypertenze, diabetes mellitus), nejedná se o randomizovanou studii.
Přesto se domníváme, že i naše výsledky mají určitou vypovídací hodnotu. Naše indikační kritéria se měnila spolu s doporučeními AHA [17–21], publikací randomizovaných studií [6,7,10–15] a i na podkladě vlastních zkušeností. CAS jsme zavedli v roce 1999 a brzy jsme začali tuto techniku nabízet nemocným starším (důvodem byl selský rozum), pacientům více interně nemocným (opět selský rozum a SAPPHIRE [15]) a nemocným obézním a s vysoko uloženou bifurkací krkavice (CEA je svízelnější). Ale jasná kritéria jsme neměli a v některých případech to bylo na doporučení anesteziologa (CEA v naší praxi v celkové anestezii, CAS v lokální). Počty CAS nám postupně rostly, byť jsme spíše získávali více nemocných, protože roční počty CEA se příliš neměnily (tab. 3).
Table 3. Poměr CEA a CAS na našem pracovišti. 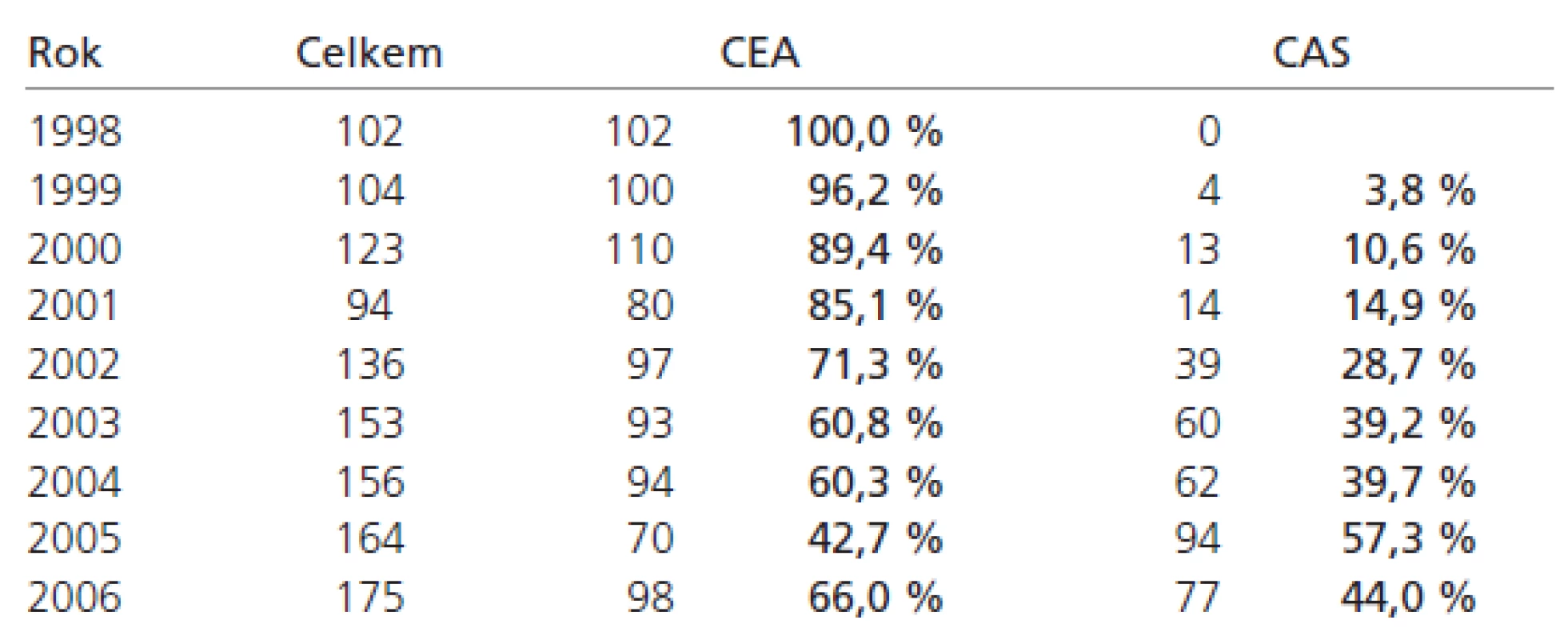
Teprve po publikaci EVA-3S a ve světle vlastních výsledků jsme začali tlumit indikace CAS a dnes dáváme přednost CEA.
Pokud probíhající studie nepřinesou zásadní nové poznatky, bude naším úkolem v budoucnu najít a jasně definovat podskupiny nemocných, u nichž bude CAS indikován.
Závěr
Z publikovaných i našich výsledků vyplývá, že v současné době není CAS lepší metodikou než CEA. Dle studie EVA-3S je dokonce CAS více rizikový než CEA. Ta je bezpečnější, efektivnější a také časem mnohem více prověřená. Nejde o těžkou operaci, vlastní CEA může provádět pod dozorem i neatestovaný neurochirurg. Důležitý je však tým, jeho souhra a rutinní přístup. Opravdu dobrých výsledků lze dosáhnout pouze na pracovištích s velkým objemem nemocných. Totéž však platí i pro CAS.
prof. MUDr. Vladimír Beneš, DrSc.
Neurochirurgická klinika 1. LF UK, IPVZ a ÚVN
U vojenské nemocnice 1200
169 02 Praha 6
e-mail: vladimir.benes@uvn.cz
Přijato k recenzi: 13. 2. 2008
Přijato do tisku: 25. 6. 2008
Sources
1. Beneš V, Mohapl M, Zoul J. Karotická endarterektomie z pohledu neurochirurga. Cesk Slov Neurol N 1998; 61/94(1): 27–36.
2. Stejskal L, Kramár F, Ostrý S, Benes V, Mohapl M, Limberk B. Experience of 500 cases of neurophysiological monitoring in carotid endarterectomy. Acta Neurochir (Wien) 2007; 149(7): 681–688.
3. Hertzer NR, O‘Hara PJ, Mascha EJ, Krajewski LP, Sullivan TM, Beven EG. Early outcome assessment for 2228 consecutive carotid endarterectomy procedures: the Cleveland Clinic experience from 1989 to 1995. J Vasc Surg 1997; 26(1): 1–10.
4. Chiesa R, Melissano G, Castellano R, Frigerio S, Catenaccio B. Carotid endarterectomy: experience in 5425 cases. Ann Vasc Surg 2004; 18(5): 527–534.
5. Přibáň V, Fiedler J, Baránková L, Bombic M, Štěrba L. Komplementarita stentingu a endarterektomie karotid: tříleté zkušenosti. Cesk Slov Neurol N 2008; 71/104(1): 75–80.
6. Ringleb PA, Allenberg J, Brückmann H, Eckstein HH, Fraedrich G, Hartmann M et al (SPACE Collaborative Group). 30 day results from the SPACE trial of stent–protected angioplasty versus carotid endarterectomy in symptomatic patients: a randomised non-inferiority trial. Lancet 2006; 368(9543): 1239–1247.
7. Mas JL, Chatellier G, Beyssen B, Branchereau A, Moulin T, Becquemin JP et al (EVA-3S Investigators). Endarterectomy versus stenting in patients with symptomatic severe carotid stenosis. N Engl J Med 2006; 355(16): 1660–1671.
8. Kastrup A, Gröschel K. Carotid endarterectomy versus carotid stenting: an updated review of randomized trials and subgroup analyses. Acta Chir Belg 2007; 107(2): 119–128.
9. Luebke T, Aleksic M, Brunkwall J. Meta-analysis of randomized trials comparing carotid endarterectomy and endovascular treatment. Eur J Vasc Endovasc Surg 2007; 34(4): 470–479.
10. Naylor AR, Bolia A, Abbott RJ, Pye IF, Smith J, Lennard N et al. Randomized study of carotid angioplasty and stenting versus carotid endarterectomy: a stopped trial. J Vasc Surg 1998; 28(2): 326–334.
11. Alberts MJ. Results of a multicenter prospective randomized trial of carotid artery stenting vs. carotid endarterectomy. Stroke 2001; 32 : 325.
12. Brooks WH, McClure RR, Jones MR, Coleman TC, Breathitt L. Carotid angioplasty and stenting versus carotid endarterectomy: randomized trial in a community hospital. J Am Coll Cardiol 2001; 38(6): 1589–1595.
13. Brooks WH, McClure RR, Jones MR, Coleman TL, Breathitt L. Carotid angioplasty and stenting versus carotid endarterectomy for treatment of asymptomatic carotid stenosis: a randomized trial in a community hospital. Neurosurgery 2004; 54(2): 318–324.
14. Endovascular versus surgical treatment in patients with carotid stenosis in the Carotid and Vertebral Artery Transluminal Angioplasty Study (CAVATAS): a randomised trial. Lancet 2001; 357(9270): 1729–1737.
15. Yadav JS, Wholey MH, Kuntz RE, Fayad P, Katzen BT, Mishkel GJ et al (Stenting and Angioplasty with Protection in Patients at High Risk for Endarterectomy Investigators). Protected carotid-artery stenting versus endarterectomy in high-risk patients. N Engl J Med 2004; 351(15): 1493–1501.
16. Rothwell PM, Eliasziw M, Gutnikov SA, Warlow CP, Barnett HJ (Carotid Endarterectomy Trialists Collaboration). Endarterectomy for symptomatic carotid stenosis in relation to clinical subgroups and timing of surgery. Lancet 2004; 363(9413): 915–924.
17. Moore WS, Mohr JP, Najafi H, Robertson JT, Stoney RJ, Toole JF. Carotid endarterectomy: practice guidelines. Report of the Ad Hoc Committee to the Joint Council of the Society for Vascular Surgery and the North American Chapter of the International Society for Cardiovascular Surgery. J Vasc Surg 1992; 15(3): 469–479.
18. Moore WS, Barnett HJ, Beebe HG, Bernstein EF, Brener BJ, Brott T et al. Guidelines for carotid endarterectomy: a multidisciplinary consensus statement from the Ad Hoc Committee, American Heart Association. Circulation 1995; 91(2): 566–579.
19. Biller J, Feinberg WM, Castaldo JE, Whittemore AD, Harbaugh RE, Dempsey RJ et al. Guidelines for carotid endarterectomy: a statement for healthcare professionals from a Special Writing Group of the Stroke Council, American Heart Association. Circulation 1998; 97(5): 501–509.
20. Albers GW, Hart RG, Lutsep HL, Newell DW, Sacco RL. AHA Scientific Statement. Supplement to the guidelines for the management of transient ischemic attacks: A statement from Ad Hoc Committee on Guidelines for the Management of Transient Ischemic Attacks, Stroke Council, American Heart Association. Stroke 1999; 30(11): 2502–2511.
21. Sacco RL, Adams R, Albers G, Alberts MJ, Benavente O, Furie K et al. Guidelines for prevention of stroke in patients with ischemic stroke or transient ischemic attack: a statement for healthcare professionals from the American Heart Association/American Stroke Association Council on Stroke: co-sponsored by the Council on Cardiovascular Radiology and Intervention: the American Academy of Neurology affirms the value of this guideline. Stroke. 2006; 37(2): 577–617.
Labels
Paediatric neurology Neurosurgery Neurology
Article was published inCzech and Slovak Neurology and Neurosurgery

2008 Issue 4-
All articles in this issue
- Výsledky operační léčby ne uromuskulárních deformit páteře
- Tuberózní skleróza: optimalizace postupu její DNA di agnostiky
- Cerebelární mutizmus po resekci meduloblastomu u dítěte – kazuistika
- Léky navozený systémový lupus erythematodes při terapii interferonem beta‑1b – kazuistika
- Doporučené postupy pro di agnostiku Alzheimerovy nemoci a dalších onemocnění spojených s demencí
- Stenóza vnitřní krkavice – endarterektomie nebo stent?
- Srovnání karotické endarterektomie a stentingu – výsledky jednoho pracoviště
- Patofyziologie kompresivní radikulopatie
- Timing karotické endarterektomie
- Přínos statické počítačové posturografie ke skríningovému vyšetření kvantifikace posturální rovnováhy
- Botulotoxin v léčbě detruzorové hyperaktivity u pacientek s roztroušenou sklerózou
- Výskyt epileptických záchvatů a/ nebo epileptiformní EEG abnormity u dětí s dětským a atypickým a utizmem
- Sedace kombinací dexmedetomidin-ketamin- midazolam pro endovaskulární léčbu mozkových arteri ovenózních malformací a stenóz karotických tepen
- Vývoj adaptace rovnovážného systému po operacích vestibulárního schwannomu
- Komplikace léčby těžké spasticity implantabilními pumpovými systémy
- Analýza souboru pacientů s kraniocerebrálním poraněním léčených na Pracovišti dětské medicíny FN Brno v období let 2000–2007
- Czech and Slovak Neurology and Neurosurgery
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Stenóza vnitřní krkavice – endarterektomie nebo stent?
- Výskyt epileptických záchvatů a/ nebo epileptiformní EEG abnormity u dětí s dětským a atypickým a utizmem
- Léky navozený systémový lupus erythematodes při terapii interferonem beta‑1b – kazuistika
- Timing karotické endarterektomie
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

