-
Medical journals
- Career
Epilepsie a cyklus spánku a bdění
Authors: MUDr. Evžen Nešpor
Authors‘ workplace: Neurologická klinika VFN a 1. LF UK, Praha
Published in: Cesk Slov Neurol N 2007; 70/103(2): 129-135
Category: Review Article
Overview
Práce je věnována vzájemnému ovlivnění epilepsie a spánku. Tato interakce se uplatňuje na úrovni cirkadiálního cyklu spánku a bdění, následně na úrovni spánkové makrostruktury a konečně na úrovni mikrostruktury spánku. Na úrovni spánkové mikrostruktury je významný vztah epileptických iktálních i interiktálních fenoménů k cyklickému alternujícímu vzorci (cyclic alternating pattern, CAP). Fyziologický význam CAP spočívá v cyklickém střídání excitace a útlumu v NREM spánku. Jeho morfologie je odlišná podle hloubky NREM spánku. V REM spánku se CAP neprojevuje.
Ve speciální části je popsána interakce spánku a jednotlivých typů epilepsie.Samostatně jsou zmíněny věkově vázané spánkové epileptické syndromy. Ve skupině generalizovaných epilepsií je zvlášť významný vztah juvenilní myoklonické epilepsie a příbuzných syndromů ke spánkové deprivaci. Významnou a častou vazbu na spánek mohou mít všechny typy frontálních záchvatů, obligatorně pak autozomálně dominantní noční frontální epilepsie.Klíčová slova:
epilepsie, spánek, cyklický alternující vzorec, autozomálně dominantní noční frontální epilepsieÚvod
Vzájemné ovlivnění epilepsie a spánku je známo od nepaměti. Předmětem odborného zájmu se však stalo až Gowersovi [1], který koncem devatenáctého století první popsal distribuci velkých záchvatů v závislosti na denním cyklu. Longdon-Down a Brain [2] rozdělili epilepsie na denní, spánkové a difuzní .Systematicky se vztahem epilepsie a spánku zabýval Janz, který také popsal epilepsie se záchvaty vázanými na probuzení [3]. Od doby Janzovy se datuje exponenciální nárůst poznatků týkajících se vztahu jednotlivých epileptických syndromů a spánkového cyklu, který vedl i k poznání nových epileptických syndromů, hlavně epilepsie s trvalým SW rytmem ve spánku a Landauova-Kleffnerova syndromu. Poznání REM a NREM spánku umožnilo Gibbsovi a Gibbsové [4] a později například Billiardovi [5] přesněji určit distribuci záchvatů ve vztahu ke spánkovým stadiím. Terzano [6] pak v 80. letech 20. století formuloval pojem CAP (cyclic alternating pattern) a zkoumal vztah epilepsie k mikrostruktuře spánku. Vztah mezi epilepsií a cyklem spánku a bdění je vzájemný a komplexní. Epilepsie ovlivňuje spánek a spánek ovlivňuje epilepsii. Horší kvalita spánku má vliv na úroveň bdělosti. Antiepileptika ovlivňují jak epilepsii, tak spánek a úroveň bdělosti. Kvalita spánku má pak spolu s úspěšností léčby epilepsie velký význam pro kvalitu života nemocných.
Epilepsie a cirkadiální rytmus spánku a bdění
Rytmus spánku a bdění je regulován dvěma základními mechanizmy, cirkadiálním a homeostatickým. Cirkadiální regulační mechanizmus je lokalizován v hypotalamu a slouží k časování spánku a bdění během 24hodinového cyklu [7–8]. Je zajímavé, že tendence k usnutí, subjektivně pociťovaná jako ospalost, koreluje s cirkadiálními oscilacemi křivky tělesné teploty [9]. Tendence k usnutí však není jen funkcí střídání dne a noci, závisí i na množství spánku v předešlém období. Spánková deprivace nástup spánku urychluje. Naroste rovněž procentuální zastoupení delta spánku [10].
Griffiths a Fox provedli již v roce 1938 pilotní studii zkoumající vztah epilepsie (nezávisle na typu epileptického syndromu) a cyklu spánku a bdění. Studie prokázala od té doby mnohokrát potvrzenou skutečnost, že distribuce epileptických záchvatů v cirkadiálním cyklu není nahodilá, ale podléhá statisticky významným oscilacím. Během spánku záchvatů přibývá od půlnoci k ránu. Časné ranní maximum je následováno poklesem v dopoledních hodinách. K menšímu nárůstu dochází po obědě, významnější se objeví až ve večerních hodinách [11]. Jiné studie prokázaly, že epileptické záchvaty se spíše objeví v situacích, kdy je úroveň vigility nízká (relaxace, ospalost), nebo kolísavá [12]. Vliv spánkové deprivace na provokaci epileptických fenoménů iktálních i interiktálních je dlouhodobě znám z kliniky i z experimentu a využívá se i diagnosticky.
Epilepsie a REM – NREM cyklus
Cyklus střídání REM a NREM fází není pouze inherentním fenoménem spánku, ale jde o manifestaci obecnějšího mechanizmu (basic rest activity cycle), který se ve spánku projeví jako NREM - REM cyklus, v bdělosti pak jako cyklické kolísání úrovně vigility a spontánní motility [13]. Polygrafické studie spánku epileptiků prokázaly, že epileptické fenomény jsou výrazně četnější v NREM spánku než v REM [14-15]. NREM spánek rovněž podporuje sekundární generalizaci fokálních výbojů. Charakter mozkové elektrogeneze během NREM spánku má tendenci k synchronizaci, která usnadňuje šíření elektroencefalografických paroxyzmálních abnormit.
Pokud jde o epilepsie temporálního laloku, většina prací prokazuje maximum výskytu iktálních fenoménů ve 2. stadiu NREM, zatímco nejvyšší frekvence interiktálních fenoménů je ve 3. a 4. stadiu [16-17].
Epilepsie a spánková mikrostruktura
NREM spánek není homogenní stav. Lze v něm elektroencefalograficky rozlišit poměrně jednotvárné pozadí a fázické fenomény. Výskyt fázických fenoménů podléhá časové periodicitě. Na základě pozorování této periodicity formuloval v 80. letech minulého století Terzano koncept CAP [6].
Cyklický alternující vzorec je dán střídavým výskytem 2 stereotypních vzorců: fáze A a fáze B. Fáze A je charakterizována výskytem fázických fenoménů s průměrným trváním mezi 8-12 s a zaujímá asi 40 % celého CAP cyklu. Je výrazem vyšší úroveň aktivace než fáze B a je spojena s nárůstem neurovegetativní aktivity a svalového tonu. Morfologie fáze A se liší podle dosažené hloubky spánku. V prvním stadiu je dána sekvencí vertexových ostrých vln nebo intermitentní alfa aktivitou, ve druhém sekvencí dvou nebo více K-komplexů a ve třetím výboji delta, které převyšují amplitudu pozadí alespoň o jednu třetinu (obr 1). Ve všech stadiích pak k A fázi řadíme elektroencefalografické známky probouzecí reakce. Spánková vřeténka jsou ze skórování vyloučena [6,18,19]. REM spánek tímto způsobem skórovat nelze.
Image 1. Ukázka polygrafického záznamu NREM II, šipkami označená sekvence dvou K-komplexů, hodnocená jako A fáze CAP. 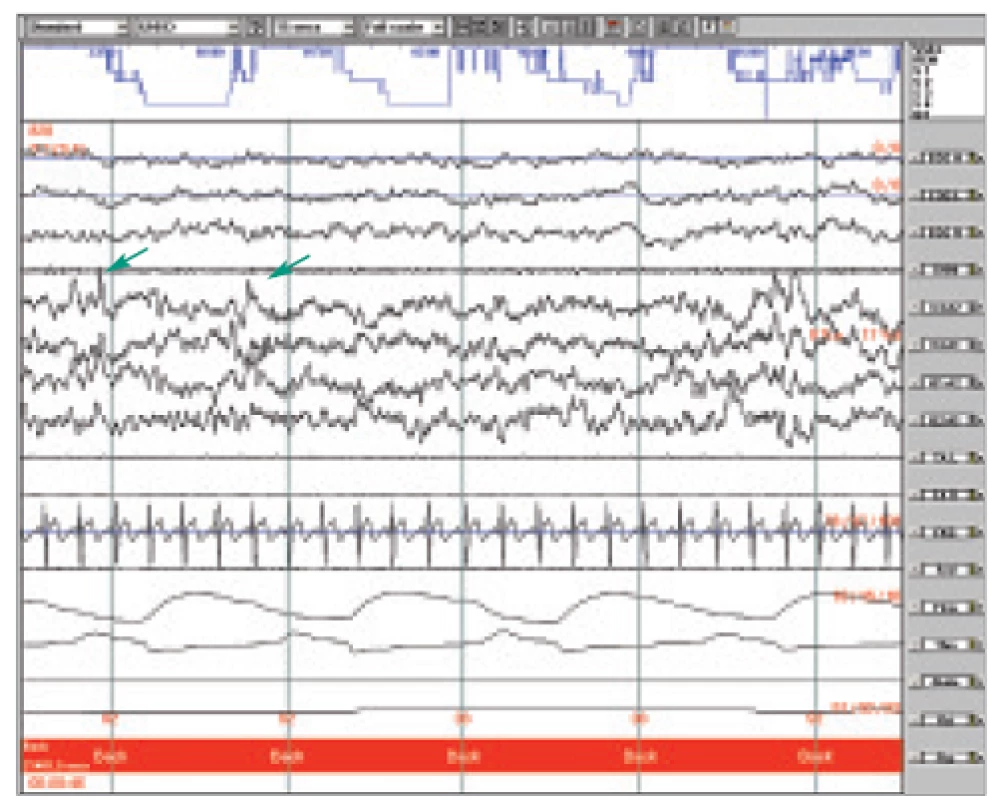
Fáze B je návrat k vlastní aktivitě pozadí, trvá průměrně 16-20 s a zaujímá asi 60 % CAP cyklu (obr 2). Fyziologicky odpovídá přechodnému snížení úrovně aktivace. S tím souvisí pokles svalového tonu a neurovegetativní aktivity [20].
Image 2. Ukázka polygrafického záznamu NREM II s poměrně jednotvárnou aktivitou pozadí. Úsek hodnocen jako B fáze CAP. 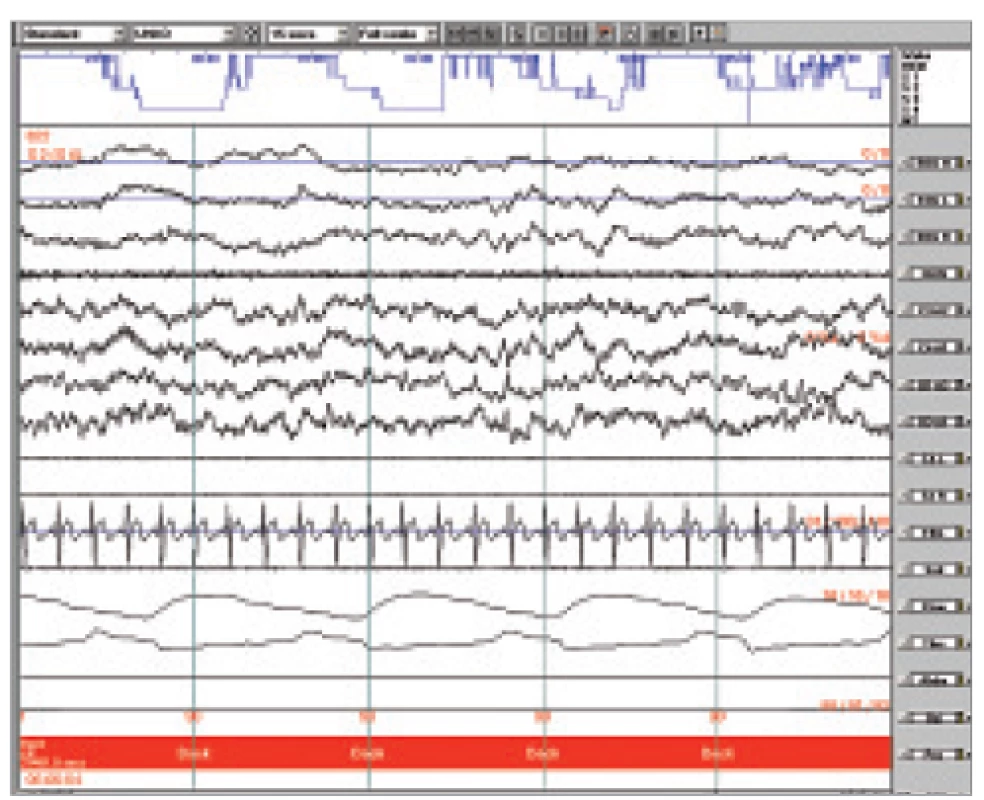
Rytmus CAP je zachován i při přechodu mezi jednotlivými stadii NREM spánku, mění se ale morfologie fáze A. Ta je v každém stadiu vyjádřena jinak. Pokud po sobě následují alespoň dvě sekvence dané střídáním A a B fáze, je daný úsek hodnocen jako CAP. Pokud je však interval mezi dvěma A fázemi delší než 60 s, je úsek hodnocen jako NCAP (non cyclic alternating pattern).
Procentuální zastoupení CAP se pohybuje mezi 30 a 50 % a v průběhu života se mění. Křivka vyjadřující procentuální podíl CAP v závislosti na věku má U tvar, od 40 % u dospívajících klesne ve středním věku asi na 30 %, aby plynule stoupala ke stáru až přes 50 %. Podíl CAP koreluje se subjektivním hodnocením spánku, čím je vyšší, tím bývá spánek hodnocen hůře. Na podíl CAP lze tedy pohlížet jako na numerické vyjádření míry spánkové instability [20-22].
Obecně platí, že ve fázi A se častěji vyskytují epileptické fenomény, zatímco fáze B potencuje výskyt vegetativních událostí (apnoe, arytmie). Zevní podnět, který ještě nevyvolá probuzení, vede k reaktivaci fáze A. Střídání obou fází je tedy výrazem kolísání aktivace a útlumu, kdy k aktivaci dochází jednak vlastním vnitřním rytmem, jednak i vlivem zevních podnětů [19].
Vztah cyklického alternujícího vzorce a epilepsie
Nejvíce je tento vztah vyjádřen u primárně generalizovaných epilepsií, při kterých jsou interiktální výboje výrazně aktivovány v CAP úsecích, a to převážně v A fázi. Zároveň lze u primárně generalizovaných epilepsií prokázat vyšší procentuální podíl CAP, ovlivnění je tedy vzájemné [23]. U epileptiků jsou úseky CAP, ve kterých se v A fázi objeví alespoň jeden interiktální hrot, signifikantně delší než úseky bez hrotu. Toto zjištění podporuje hypotézu, že oba fenomény sdílejí společné modulační struktury. Cyklický alternující vzorec (hlavně pak jeho A fáze ) jako fyziologický fenomén usnadní výskyt patologického interiktálního výboje. Větší výskyt interiktálních výbojů naopak může vést k aktivaci A fáze. Dnešní úroveň poznání vztahu mezi epilepsií a CAP jako výrazem spánkové mikrostruktury lze zjednodušeně formulovat tak, že jak fyziologické fázické fenomény příslušné probouzecí reakci, tak interiktální výboje používají společné neuronální struktury. Zároveň se vzájemně vyhledávají a potencují. Podobný vztah je mezi CAP a klinickými záchvaty [20-22].
Speciální otázky vztahu spánku a epilepsie
Byly popsány 3 věkově vázané epileptické syndromy s výraznou vazbou na spánek. Jde o spánkový elektrický status epilepticus, Landauův-Klefnerův syndrom a benigní epilepsie s centrotemporálními hroty.
Elektrický status epilepticus ve spánku (ESES)
V roce 1971 popsali Pantry et al soubor dětí, u kterých spánek navozoval téměř kontinuální obraz generalizovaných s-w komplexů [24]. Syndrom byl původně nazván subklinický status epilepticus ve spánku, brzy se ale ukázalo, že konstantní charakteristikou stavu je i kognitivní a motorický deficit. Syndrom spíše tedy patří do věkově vázaných dětských encefalopatií. Je charakterizován kognitivním a motorickým deficitem, epileptickými záchvaty různého typu a typickým EEG nálezem.
Epileptické záchvaty jsou obvykle prvním příznakem a objeví se nejčastěji mezi 4-5 lety věku s rozptylem od 2 měsíců do 12 let. Může jít o generalizované tonicko-klonické záchvaty, jednostranné motorické simplexní nebo atypické absence často s tonickou nebo atonickou komponentou.
Syndrom většinou postihuje děti s dosud normálním neuropsychologickým vývojem. Kognitivní deficit je tedy jistě sekundární. Bývá charakterizován poklesem IQ, zhoršením řeči, poruchou časoprostorové orientace a poruchami chování. Tíže postižení kolísá případ od případu a přímo souvisí s dobou trvání stavu. Charakter postižení je dán prostorovým rozložením maxima s-w abnormity. V případech, kdy je maximum abnormity nad frontálními laloky, jsou hlavním příznakem poruchy chování a myšlení. Pokud má abnormita převážně bitemporální distribuci, dominuje postižení řeči. Tyto případy se značně blíží Landauovu-Klefnerovu syndromu [25].
EEG nález v bdělosti je charakterizován výboji pomalých (2-3 Hz) s-w komplexů, které někdy mají klinický korelát, jindy probíhají při běžném pozorování asymptomaticky. Základní elektroencefalografickou charakteristikou jsou generalizované s-w komplexy, které se projeví ihned po usnutí. Komplexy jsou pomalé, 1,5-2 Hz a objevují se ve všech stadiích NREM. V typickém případě zaujímají 85 až 100 % NREM spánku. V REM spánku zaujímají s-w komplexy méně než 25 %, objevují se však fokální výboje zejména ve frontální lokalizaci. I když se prima vista spánkový elektrický status epilepticus jeví jako generalizovaný epileptický děj, má se za to, že jde o projev sekundární bilaterální synchronie vycházející z fokálního zdroje. Dokladem pro to je jednak fokální charakter klinických záchvatů, jednak elektroencefalografické studie prokazující časový posun mezi vrcholy hrotů, který svědčí pro interhemisferální přenos EEG abnormity [26]. Podobně fokální nálezy vykazují i PET studie [27].
Benigní epilepsie s centrotemporálními hroty (BECT)
Jde o věkově vázaný epileptický syndrom s manifestací obvykle mezi 7-10 lety. První záchvat se z 80 % objeví ve spánku. Záchvaty bývají krátké, charakterizované hemifaciálním spazmem, hypersalivací nebo faryngolaryngeálními příznaky jako zakuckáním, chrčením, stridorem. Jindy se vyskytne kombinace všech uvedených.
Záchvatů nebývá mnoho a mají tendenci ke spontánnímu vymizení nejčastěji kolem 12. roku věku. Často se vyskytne jen jeden ojedinělý záchvat. V názvu syndromu obsažená benignost je poněkud zpochybňována doklady o kognitivních problémech postižených dětí, které jsou ale typicky přechodné [28].
S poměrně příznivým klinickým obrazem a prognózou kontrastuje výrazný EEG nález, v centrotemporální krajině se objevují vysoké negativní hroty nebo ostré vlny vystupující na normálním pozadí. Mohou být jednostranné nebo oboustranné a asymetrické. Jejich nález není totožný s diagnózou onemocnění, vyskytují se i u dětí zcela asymptomatických, a to asi ve 3 % [29].
Landauův-Kleffnerův syndrom
Jde o věkově vázaný syndrom postihující dosud normálně se vyvíjející děti ve věku nejčastěji mezi 5.-7. rokem věku. Prvním příznakem bývá epileptický záchvat nebo kognitivní deficit. Epileptický záchvat se objeví častěji ve spánku, ne však výhradně. Může jít o celou škálu záchvatových typů od generalizovaných tonicko-klinických po velmi nenápadné simplexní motorické, které často zpočátku ujdou pozornosti. Záchvaty bývají málo frekventní a nejsou hlavním problémem postižených dětí. Tím je kognitivní deficit, který je velmi specifický a postihuje řečové funkce. Fatická porucha nastupuje pomalu, s fluktuacemi a může nabýt takové závažnosti, že dítě přestává chápat i význam nonverbálních zvukových podnětů [30].
EEG abnormita je charakterizována výboji mnohočetných hrotů a s-w komplexů, jejichž prostorová distribuce je variabilní, a to i interindividuálně. Jednostranné výboje jsou častější, popsány byly ale i generalizované výboje. NREM spánek, především jeho nástup, má na EEG abnormitu výrazný aktivační vliv. Škála závažnosti EEG nálezů je široká, nejzávažnější jsou neodlišitelné od spánkového elektrického status epilepticus [31]. Podobně jako u tohoto syndromu, i u Landauova-Kleffnerova syndromu lze prokázat, že paroxyzmální aktivita má jednostranný, fokální původ [32]. Morfologický podklad ložiska nebyl však v typických případech nikdy prokázán.
Prognóza syndromu je relativně příznivá, fatická porucha se upravuje kolem 15. roku věku a jen asi třetina postižených má nevelké problémy s řečí i v dospělosti. Někteří autoři zpochybňují samostatnou existenci Landauova-Kleffnerova syndromu a pokládají jej za variantu spánkového elektrického status epilepticus [33].
Generalizované epilepsie
Ve skupině generalizovaných epilepsií vynikají svým vztahem ke spánkovému cyklu především dva syndromy: juvenilní myoklonická epilepsie a epilepsie s generalizovanými tonicko-klonickými záchvaty po probuzení. Symptomatika obou syndromů se překrývá a je pravděpodobné, že jde o jednu geneticky podmíněnou vlohu s různou manifestací. Většina nemocných trpících těmito syndromy má více než jeden typ záchvatů. Kombinují se velké generalizované záchvaty, myoklonie a absence s myoklonickou komponentou. Společnou charakteristikou je výskyt záchvatů v prvních asi dvou hodinách po probuzení, s druhým vrcholem při poklesu vigility před usnutím [3,34]. Záchvaty během dne jsou velmi vzácné, a pokud se vyskytnou, pečlivá anamnéza objeví vždy pokles vigility, např. krátké zdřímnutí po obědě. Oba syndromy jsou velmi citlivé na spánkovou deprivaci. Vůbec nejúčinnější provokací záchvatu je násilím přerušený krátký denní spánek po nedostatečném spánku nočním [35].
Vedle epilepsií se záchvaty vázanými na probuzení existují i ryze spánkové, ryze denní a difuzní typy primárně generalizovaných epilepsií. Záchvaty ve spánku jsou podle Gowerse [1] nejčastější v prvních dvou hodinách po usnutí a těsně před probuzením. S vysokou prevalencí se vyskytují v NREM spánku, podobně jako interiktální výboje, které rovněž jeví nárůst v NREM [12]. U epilepsií se záchvaty vázanými na probuzení není výjimkou, že standardní EEG záznam provedený za plné bdělosti bývá zcela prost interiktálních výbojů, které eventuálně prokážeme jen po probuzení nebo v NREM spánku.
Při diagnostické nejistotě by tedy celonoční monitorace měla být zlatým standardem. Někdy při ní zachytíme i myoklonie pacientem vůbec nevnímané a neudávané (vlastní pozorování). Spánek mění i morfologii interiktální aktivity. V NREM spánku se generalizované výboje komplexů hrot-vlna fragmentují a mohou se objevit vícečetné hroty a výboje omezené na jednu oblast nebo hemisféru [36].
Absence nelze ovšem ve spánku klinicky rozpoznat. EEG vzorec pro absence typický se však ve spánku objevuje, a to hlavně v prvním spánkovém cyklu v NREM. Vzorec bývá méně rytmický, často s mnohočetnými hroty a s prohlubováním do 3.-4. stadia NREM spánku se intervaly mezi jednotlivými komplexy prodlužují. Pokud se s-w výboje objeví i v REM, jsou stejné morfologie jako v bdělosti, jen kratšího trvání [37].
Ovlivnění spánku generalizovanými epilepsiemi se nijak neliší od ovlivnění fokálními, pokud bereme v úvahu noci bez záchvatů. Byl pozorován nárůst WASO (wake time after sleep onset), relativní zkrácení REM spánku a procentuální nárůst povrchního NREM, tedy změny typické pro všechny epilepsie [38]. Překvapivě z toho vybočují fotosenzitivní epilepsie, u kterých byl naopak prokázán procentuální nárůst hlubokého NREM, tedy 3. a 4. stadia, na úkor 1. a 2. [39]. Janz na základě osobní zkušenosti předpokládal, že u nemocných s epilepsií se záchvaty vázanými na probuzení je přítomna anomálie spánkového vzorce a zvyklostí ve smyslu obtížného usínání večer a nechuti k rannímu vstávání [40]. Polygrafické studie však předpokládanou anomálii neprokázaly [41]. Sám na základě anekdotických zkušeností spíše soudím, že porucha usínání je často dána úzkostí z nevyspání a následné provokace záchvatu. Jako všechny primárně generalizované epilepsie jsou i ty s ryze spánkovým výskytem dobře léčitelné. Pokud jsou generalizované záchvaty s vazbou na spánek na léčbu rezistentní, je vždy třeba předpokládat sekundární generalizaci a pátrat po ložiskové příčině.
Epilepsie temporálního laloku
Výskyt parciálních komplexních záchvatů je ve spánku poměrně častý, ne však převažující. V pilotní studii Billiardově mělo 9,4 % pacientů s parciálními komplexními záchvaty i spánkový výskyt [5]. Výsledky dalších studií se zásadně neliší. Pokud jde o distribuci do spánkových stadií, převažuje vysoce výskyt v NREM, a to hlavně ve 2. stadiu. NREM spánek je rovněž aktivátorem fokálních hrotů, které se však na rozdíl od záchvatů vyskytují více v hlubokých stadiích [16,42-43].
Spánkové hroty u temporálních epilepsií jsou významným indikátorem lateralizace ložiska. Zejména u pacientů, kteří mají buď oboustranné, nebo nemají žádné výboje v bdělosti, je de novo výskyt hrotů v NREM spánku vždy správně lateralizující [42].
Výskyt interiktálních hrotů v REM je méně častý. Pokud se však hroty vyskytují v REM, mají mimořádně vysokou lateralizační a lokalizační hodnotu. To platí jak pro temporální, tak pro extratemporální epilepsie [43].
U většiny pacientů s temporální epilepsií je struktura spánku narušena, a to i u těch, kteří dobře reagují na léčbu. Pokud se vyskytne noční záchvat, bývá následován plným probuzením. Záchvat obvykle nasedá na přechod do hlubšího stadia a často to bývá časově blízko nástupu REM [43]. Spánek je však ovlivňován i v nocích bez záchvatů. Popsán byl procentuální pokles hlubokých stadií NREM. Zajímavé je, že na kvalitu spánku mají u temporálních epilepsií vliv i denní záchvaty. Vedou k procentuálnímu poklesu REM podílu a ke zvýšení latence jeho nástupu [44].
Temporální záchvaty ve spánku mohou představovat i diagnostický problém, protože bývají anamnesticky zaměňovány za parasomnie.
Epilepsie frontálního laloku
Frontální epilepsie mají vysokou tendenci ke spánkovému výskytu. Vzhledem k obvykle výrazným motorickým projevům málokdy ujdou pozornosti. Popisovány jsou 3 druhy záchvatových projevů: fokální klonické záchvaty, asymetrické tonické záchvaty a komplexní záchvaty.
Fokální klonické záchvaty jsou charakterizovány jednostrannými klonickými záškuby, často bez porušení vědomí. Příkladem je benigní „rolandická“ dětská epilepsie, při které je spánkový výskyt záchvatů převažující, i když ne výlučný [45].
Asymetrické tonické záchvaty mají svůj původ v oblasti suplementární motorické arey. Záchvaty jsou typicky krátké, v trvání řádově desítek sekund, a přes oboustrannou motorickou manifestaci nejsou spojeny s poruchou vědomí. Pokud se vyskytují ve spánku, je to téměř výlučně v NREM [46-47].
Komplexní parciální záchvaty frontálního původu se ve spánku projevují automatizmy s prominentním postižením proximálních svalových skupin. Pro výrazné motorické automatizmy bývají nazývány záchvaty hypermotorickými [48]. Svými bizarními motorickými projevy připomínají neepileptické psychogenní paroxyzmy. EEG ani během záchvatu nemusí být konkluzivní, pro epilepsii svědčí uniformita motorických projevů a některé motorické prvky, jako převracení na břicho a rytmické synchronní „kopání“ oběma dolními končetinami. Některé případy jsou symptomatické, jiné spadají do autozomálně dominantní spánkové frontální epilepsie.
Autozomálně dominantní spánková frontální epilepsie
Relativně nedávno, v roce 1994, popsal Scheffer i samostatnou nozologickou jednotku projevující se spánkovými motorickými paroxyzmy vycházejícími z frontálního laloku a jevící autozomálně dominantní dědičnost [49].
Klinicky začíná tento druh epilepsie kolem 10 let věku. Častá je aura, kterou postižení vnímají brzy po usnutí jako náhlé probuzení spojené s chvěním, zvláštním pocitem v končetinách a úzkostí. Pocit je obtížně definovatelný a bývá různě popisován. Jedna z mých pacientek jej například popisovala jako „vítr v hlavě“. Záchvaty samotné jsou provázeny motorickými projevy různého charakteru a délky. Motorické projevy byly popsány jako hyperkinetické i jako dystonické, většinou krátké, do 60 s. Častá je vokalizace. Záchvaty se často kumulují do sérií typicky kolem 8. Protože záchvaty iniciálně vedou k probuzení, bývá na ně zachována vzpomínka jako doklad neporušeného vědomí intraiktálně [50-51].
Podstatou syndromu je porucha nikotinového typu acetylcholinového receptoru a příslušný lokus leží v typickém případě na chromozomu 20 q [52]. Dosud popsané soubory však jeví genetickou heterogenitu, i když postižené rodiny nelze klinicky odlišit. Časté jsou i sporadické případy [53].
Závěr
Kolísání hladiny vigility během 24hodinového denního cyklu se významně uplatňuje v modulaci epileptických fenoménů. Výskyt interiktálních i iktálních projevů je modulován na několika úrovních. Na úrovni denního cyklu, na úrovni spánkové makrostruktury a konečně na úrovni spánkové mikrostruktury. Vztah mezi epilepsií a úrovní vigility je komplexní a ovlivnění je vzájemné. Lepší poznání tohoto vztahu může nepochybně přispět k lepšímu porozumění záchvatům vázaným na spánek, a tím k jejich účinnější léčbě.
MUDr. Evžen Nešpor
Neurologická klinika
1. LF UK a VFN
Kateřinská 30
120 00 Praha 2
e-mail e.nespor@seznam.cz
Přijato k recenzi: 13. 3. 2006
Přijato do tisku: 14. 9. 2006
Sources
1. Gowers WR. Epilepsy and Other Chronic Convulsive Diseases. Vol. 1. London: William Wood 1885.
2. Langdon-Down M, Brain WR. Time of day in relation to convulsions in epilepsy. Lancet 1929; 2 : 1029–32.
3. Janz D. The grand-mal epilepsies and the sleep-waking cycle. Epilepsia 1962; 3 : 69-129.
4. Gibbs E L, Gibbs FA. Diagnostic and localizing value of electrographic studies in sleep. Res Publ Assoc Res Nerv Ment Dis 1947; 26 : 366–76.
5. Billiard M. Epilepsy and the Sleep-Wake cycle in Man. In: Sterman MB, Shouse MN, Passouant P (Eds). Sleep and Epilepsy. New York: Academic Press 1982 : 269-72.
6. Terzano MG, Mancia D, Salati MF, Costani G, Decembrino A, Parino L. The cyclic alternating pattern as a physiological component of normal NREM sleep. Sleep 1985; 8 : 137-45.
7. Broughton RJ. Biorythmic variations in consciousness and psychological functions. Can Psychol Rev 1975; 16 : 217–30.
8. Borbely AA. Sleep Homeostasis and Models of Sleep Regulations. In: Kryger MH, Roth T, Dement WC (Eds). Principles and Practice of Sleep Medicine. 2. ed. Philadelphia: WBSaunders 1994 : 309–20.
9. Murphy PJ, Campbell SS. Physiology of the circadian system in animals and humans. J Clin Neurophysiol 1966; 13 : 2-16.
10. Dijk DJ, Beersma MG, Brunner DP, Daan S, Borbely AA. Spectral Analysis of Day-Sleep in Humans. In: Horne J (Ed). Sleep ´90. Bochum: Pontenagel Press 1990 : 324–8.
11. Griffiths GN, Fox IT. Rythms in epilepsy. Lancet 1938; 234 : 409-16.
12. Shouse MN, Martins da Silva AM, Sammaritano M. Circadian Rhythm, Sleep and Epilepsy. J Clin Neurophysiol 1996;13 : 32–50.
13. Kleitman N. Sleep and wakefulness. Chicago: University of Chicago Press 1963.
14. Kellaway P. Sleep and epilepsy. Epilepsia 1985; 26 : 15-30.
15. Malow BA, Kushwaha R, Lin X, Morton KJ, Aldrich M. Relationship of interictal epileptiform discharges to sleep depth in partial epilepsy. Electroencephalogr clin Neurophysiol 1997; 102 : 20–6.
16. Crespel A, Baldy-Moulinier R, Coubes P. The relationship between sleep and epilepsy in frontal and temporal lobe epilepsies: Practical and Physiopathologic considerations. Epilepsia 1998; 39(2):150–7.
17. Malow BA, Lin X, Kushwaha R, Aldrich MS. Interictal Spiking Increases with Sleep Depth in Temporal Lobe Epilepsy. Epilepsia 1998; 39 : 1309-16.
18. Terzano MG, Parrino L, and Spaggiari MC. The cyclic alternating pattern sequences in the dynamic organisation of sleep. Electroencephalogr clin Neurophysiol 1988; 69 : 437-47.
19. Parrino L, Terzano MG. Cyclic Alternating Pattern and Sleep. In: Dinner DS, Luders HO (Eds). Epilepsy and Sleep: Physiological and Clinical Relationships. San Diego: Academic Press 2001 : 121–49.
20. Terzano MG, Parrino L. Clinical applications of cyclic alternating pattern. Physiol Behav 1993; 54 : 807-13.
21. Terzano MG, Parrino L, Anelli S, Halász P. Modulation of generalized spike-and-wave discharges during sleep by cyclic alternating pattern. Epilepsia 1989; 30 : 772-81.
22. Terzano MG, Parrino L, Aneliĺi S, Boselli M, Clemens B. Effects of generalized interictal EEG discharges on sleep stability: Assesment by means of alternating cyclic pattern. Epilepsia 1992; 33 : 317-26.
23. Gigli GL, Marciani MG, Mazza S, Mennuni G, Diomedi M, Terzano MG et al. Sleep Microstructure and EEG Epileptiform Activity in Patients with Juvenile Myoclonic Epilepsy. Epilepsia 1992; 33 : 799-804.
24. Pantry G, Lyagoubi S, Tassinari CA. Subclinical electrical status epilepticus induced by sleep in children. Arch Neurol 1971; 24 : 242-52.
25. Tassinari CA, Melleti S, Volpi L, Guido R, Michelucci R. Electrical status epilepticus of sleep. In: Dinner DS, Luders HO (Eds). Epilepsy and Sleep: Physiological and Clinical Relationships. San Diego: Academic Press 2001 : 155–172.
26. Morikawa T, Seino M, Watanabe Y, Watanabe M, Yagi K. Clinical Revelance of Continuous Spike-Waves during Slow Sleep. In: Manelis S, Bental E, Loeber J N, Dreifuss FE (Eds). Advances in Epileptology. New York: Raven Press 1989 : 359 - 63.
27. Hirsch E, Pierre M, Metz-Lutz MN, Motta J, Finck S Marescaux C. The Eponym "Landau-Kleffner Syndreme" Should Not Be Restricted to Childhood-Aquired Aphasia with Epilepsy. In: Beaumanoir M, Bureau M, Deonna T, Mira L, Tassinari CA (Eds). Countinuous Spikes and Waves during Slow Sleep. London: John Libbey 1995 : 57-62.
28. Komárek V. Benigní epilepsie s rolandickými hroty (BERS), benigní epilepsie s centrotemporálními hroty (BECT). In: Komárek V. Epileptické záchvaty a syndromy. Praha: Galén 1997 : 109-10.
29. Eeg-Olofsson O. Rolandic epilepsy. In: Basil CW, Malow BA, Sammaritano MR (Eds). Sleep and Epilepsy: the Clinical Spectrum. Amsterdam: Elsevier 2002 : 257–63.
30. Kaga M. Language disorders in Landau-Kleffner syndrome. J Child Neurol 1999; 14 : 118-22.
31. Komárek V. Landauův-Kleffnerův syndrom (LKS). In: Komárek V. Epileptické záchvaty a syndromy. Praha: Galén 1997 : 109-10.
32. Morrell F, Whisler WW, Smith MC, Hoeppner TJ, De Toledo-Morrell L, Pierre-Luis SJC et al. Landau-Kleffner syndrome.Treatment with subpial intracortical transection. Brain 1995; 118 : 1529-46.
33. Marescaux C, Hirsch E, Finck S, Marquet P, Shlumberger E, Sellal E et al. Landau-Kleffner syndrome. A pharmacologic study of five cases. Epilepsia 1990; 31 : 768-77.
34. Noachtar S. Generalized Epilepsy and Sleep. In: Dinner DS, Luders HO (Eds). Epilepsy and Sleep: Physiological and Clinical Relationships. San Diego: Academic Press 2001 : 75-83.
35. Touchon J, Baldy-Moulinier M, Billiard M, Besset A, Cadilhac J. Effect of Awakening on Epileptic Activity in Primary Generalized Myoclonic Epilepsy. In: Sterman MB, House MN, Passouant P (Eds). Sleep and Epilepsy. New York: Academic Press 1982 : 239–48.
36. Broughton RJ. Epilepsy and Sleep: A Synopsis and Prospectus. In: Degen R, Niedermeyer E (Eds). Epilepsy and sleep and sleep deprivation. Amsterdam: Elsevier 1984 : 317-46.
37. Niedermayer E. Petit Mal, Primary Generalized Epilepsy and Sleep. In: Sterman NB, Passouant P, Shouse MN (Eds). Sleep and Epilepsy. New York: Academic Press 1982 : 191-207.
38. Touchon J, Baldy-Moulinier M, Billiard M, Besset A, Cadilhac J. Sleep Organization and Epilepsy. In: Degan R, Rodin EA (Eds). Epilepsy, Sleep and Sleep Deprivation. 2. ed. New York: Elsevier 1991 : 273-81.
39. Roder-Wanner UU, Wolf P,and Danninger T. Are Sleep Patterns in Epileptic Patients Correlated with Their Type of Epilepsy. In: Martins da Silva A, Binnie C, Meinardi H (Eds). Biorythms and Epilepsy. New York: Raven Press 1985 : 109-21.
40. Janz D. Epilepsy and the sleeping-Waking cycle. In: Wicken PJ, Bruyn, GW (Eds). Handbuch of Clinical Neurology. Amsterdam: North Holland 1974 : 457–90.
41. Passaut P, Besset A, Carriere A, Billiard M. Night sleep and generalized epilepsy. In: Koella VP, Levin P (Eds). Sleep. Basel: Karger 1974 : 185–96.
42. Sammaritano M, Gigli G, Gotman J. Interictal spiking during wakefulness and sleep and the localization of foci in temporal lobe epilepsy. Neurology 1991; 41 : 280-97.
43. Sammaritano MR. Focal Epilepsy and Sleep. In: Dinner DS, Luders HO (Eds). Epilepsy and Sleep: Physiological and Clinical Relationships. San Diego: Academic Press 2001 : 85–100.
44. Bazil CW,Castro HM, Walczak TS. Daytime seizures increase REM latency and decrease total REM. Epilepsia 1997; 38(8): 176.
45. Beaussart M. Benign epilepsy of children with rolandic (centro – temporal) paroxysmal foci – a clinical entity. Study of 221 cases. Epilepsia 1972; 13 : 795–811.
46. Anand I, Dinner DS. Relation of supplementary motor area and sleep. Epilepsia 1997; 38(8): 48.
47. Dinner DS. Supplementary sensomotor area epilepsy. In: Basil CW, Malow BA, Sammaritano MR (Eds). Sleep and Epilepsy: the Clinical Spectrum. Amsterdam: Elsevier 2002 : 223–6.
48. Williamson PD, Spencer DD, Spencer SS, Novelly RA, Mattson RH. Complex partial seizures of frontal lobe origin. Ann Neurol 1985; 18 : 497–504.
49. Scheffer IE, Bhatia KP, Lopes-Cendes I, Fish DR, Marsden CD, Andermann E. Autosomal dominant nocturnal frontal lobe epilepsy: A distinctive clinical disorder. Brain 1995; 118 : 61-73.
50. Oldani A, Zucconi M, Asselta R, Modugno M, Bonati MT, Dapra L et al. Autosomal dominant nocturmal frontal lobe epilepsy. A video-polysomnographic and genetic appraisal of 40 patients and delineation of the epileptic syndrome. Brain 1998; 121 : 205-23.
51. Bercovic SF, Scheffer IE. Autosomal dominant nocturnal lobe epilepsy. In: Basil CW, Malow BA, Sammaritano MR (Eds). Sleep and Epilepsy: the Clinical Spectrum. Amsterdam: Elsevier 2002 : 217–21.
52. Phillips HA, Scheffer IE, Bercovic SF, Hollway GE, Sutherland GR, Mulley JC. Localisation of a gene for autosomal dominant nocturnal frontal lobe epilepsy to chromosome 20q13.2. Nat Genet 1995; 10 : 117–118.
53. Phillips HA, Marini C, Scheffer IE, Sutherland GR, Mulley JC, Bercovic SF. A de novo mutation in sporadic nocturnal frontal lobe epilepsy. Ann Neurol 2000; 48 : 264–67.
Labels
Paediatric neurology Neurosurgery Neurology
Article was published inCzech and Slovak Neurology and Neurosurgery

2007 Issue 2-
All articles in this issue
- Súčasný pohľad na diagnostiku a terapiu afázie
- Jednorázové intratékální podání baklofenu a následné zavedení pumpového systému v léčbě těžké spasticity u osob s roztroušenou sklerózou
- Chirurgická léčba ependymomů krční a horní hrudní míchy
- Komplikace operací z předního přístupu pro degenerativní onemocnění krční páteře
- Solitární fibrózní tumor mening
- Epilepsie a cyklus spánku a bdění
- Zhoršování epileptických záchvatů a epilepsií antiepileptiky - je to možné?
- Význam MR v indikaci systémové trombolýzy – analýza prvních 30 pacientů
- Specifické protilátky proti beta-tubulinu v diferenciální diagnostice demencí
- Riziko vzniku vaskulární příhody při léčbě fluvastatinem a fenofibrátem
- Korelace ptiO2 a apoptózy u fokální mozkové ischemie a vliv systémové hypertenze
- Radiochirurgická léčba schwannomu trojklaného nervu pomocí Leksellova gama nože
- Abnormální mikrostruktura spánku a autonomní odpověď u narkolepsie
- Turbulence srdeční frekvence v posouzení kardiální autonomní funkce u migreniků
- Bazaliom s propagací do mostomozečkového koutu asociovaný s ipsilaterálním neurinomem akustiku – kazuistika
- Czech and Slovak Neurology and Neurosurgery
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Epilepsie a cyklus spánku a bdění
- Súčasný pohľad na diagnostiku a terapiu afázie
- Komplikace operací z předního přístupu pro degenerativní onemocnění krční páteře
- Zhoršování epileptických záchvatů a epilepsií antiepileptiky - je to možné?
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

