-
Medical journals
- Career
Cytoredukce a hypertermická intraperitoneální chemoterapie v léčbě peritoneálních metastáz kolorektálního karcinomu v České republice v roce 2018
Authors: L. Němec 1; J. Novák 2; J. Mužík 3,4; D. Krejčí 3,4; J. Tomášek 5; R. Šefr 1; P. Bartoška 6; F. Antoš 6; P. Dytrych 7; D. Hoskovec 7; M. Levý 8; J. Šimša 8; Dušan Klos 9; Č. Neoral 9
Authors‘ workplace: Klinika operační onkologie LF MU a MOÚ Brno 1; Úsek národního onkologického registru, MOÚ Brno 2; Institut bio statistiky a analýz, LF MU Brno 3; Ústav zdravotnických informací a statistiky ČR, Praha 4; Klinika komplexní onkologické péče LF MU a MOÚ Brno 5; Chirurgická klinika 1. LF UK, IPVZ a Nemocnice Na Bulovce, Praha 6; I. chirurgická klinika 1. LF UK a VFN v Praze 7; Chirurgická klinika 1. LF UK a Thomayerovy nemocnice, Praha 8; I. chirurgická klinika LF UP a FN Olomouc 9
Published in: Klin Onkol 2021; 34(4): 278-282
Category: Review
doi: https://doi.org/10.48095/ccko2021278Overview
Východiska: Výsledky mnoha klinických studií dokládají, že cytoredukce kombinovaná s intraperitoneální chemoterapií může vybraným pacientům s peritoneálními metastázami kolorektálního karcinomu významně prodloužit přežití. V ČR se cytoredukční léčbou v kombinaci s hypertermickou intraperitoneální chemoterapií zabývá pět specializovaných onkochirurgických center. Všechna tato pracoviště dodala přesné informace o počtu provedených cytoredukčních výkonů v roce 2018. Odhad prevalence peritoneálních metastáz kolorektálního karcinomu vychází z dat Národního onkologického registru ČR. Cíl: Zjistit počet cytoredukčních výkonů provedených u pacientů s peritoneálními metastázami kolorektálního karcinomu v ČR v roce 2018 a podle statistických údajů odhadnout počet nemocných, kteří by z dané operace mohli profitovat. Oba údaje, reálný i hypotetický, porovnat. Výsledky: V ČR bylo v roce 2018 provedeno 25 cytoredukčních procedur (cytoreductive surgery – CRS) v kombinaci s hypertermickou intraperitoneální chemoterapií (HIPEC) v indikaci peritoneálních metastáz kolorektálního karcinomu. Vztaženo k odhadu prevalence jednotlivých stadií kolorektálního karcinomu v ČR by CRS + HIPEC mohla být v naší zemi přínosem nejméně pro 150 pacientů ročně. Závěr: Cytoredukci s intraperitoneální hypertermickou chemoterapií pro peritoneální metastázy kolorektálního karcinomu podstoupilo v ČR v roce 2018 výrazně méně pacientů, než kolik odpovídá odhadovanému počtu potenciálně kurabilních. Navýšení počtu nemocných, kterým je možno s terapeutickým záměrem poskytnout výše popsanou léčebnou metodu, je závislé na zlepšení spolupráce specializovaných cytoredukčních center s kooperujícími chirurgy a klinickými onkology a na prohlubování jejich informovanosti o dané problematice.
Klíčová slova:
cytoredukční chirurgie – intraperitoneální chemoterapie – peritoneální metastázy – kolorektální karcinom
Úvod
Kolorektální karcinom (colorectal carcinoma – CRC) je nejčastější malignitou trávicího traktu [1]. Pokud nebereme v úvahu kožní nemelanomové zhoubné nádory, je CRC druhým nejčastěji se vyskytujícím zhoubným nádorem v ČR a celosvětově zaujímá ve výskytu třetí místo. Podle údajů Národního onkologického registru (NOR) byla incidence CRC (dg. C18–C20) v roce 2016 v ČR 72/100 000 obyvatel a mortalita 35/100 000 obyvatel. V ČR je asi 20 % pacientů s CRC diagnostikováno ve stadiu IV tohoto onemocnění; u dalších 20–30 % dojde k manifestaci vzdálených metastáz později [2]. Klinické stadium IV kolorektálního karcinomu je spojeno s vysokou mortalitou, 5leté přežití se u něj uvádí okolo 10 %, medián přežití 14,4 měsíce [3]. Prognóza nemocných ve IV. stadiu CRC se významně zhoršuje, pokud jsou u nich přítomny peritoneální metastázy (PM), tehdy klesá medián přežití u neléčených na 5–6,7 měsíce [4], v případě karcinomu z prstenčitých buněk je tato doba ještě kratší [5].
Incidence synchronního výskytu PM se u CRC udává okolo 5–10 % [6,7], u dalších 4–19 % se PM objeví metachronně [8–10], u 4–8 % pacientů ve IV. stadiu PM CRC je peritoneum dokonce prvním a jediným místem výskytu metastáz [11]. Pitevní nálezy pacientů, jejichž příčinou úmrtí byl CRC, uvádějí ale nejméně 40% výskyt PM [10], což značí, že uváděná incidence PM CRC v populaci je zřejmě podhodnocena – peritoneální diseminace totiž nezřídka probíhá asymptomaticky a její diagnostika je svízelná. CT má pro detekci PM nízkou senzitivitu a radiologický nález tak obvykle zcela nekoreluje s nálezem peroperačním; bývá podhodnocen [12]. Za zlatý standard v diagnostice PM CRC se proto považuje diagnostická laparoskopie/laparotomie s verifikací rozsahu peritoneálního postižení a s biopsií peritonea [13,14].
V minulosti byla karcinomatóza peritonea u CRC vnímána jako inkurabilní stav s infaustní prognózou, pacienti byli zpravidla léčeni pouze paliativní systémovou chemoterapií, taktéž chirurgická léčba byla vedena jen s paliativním záměrem, bez ambicí zásadně prodloužit přežití (zakládání derivačních stomií, periodické punkce ascitu). Tento koncept seznal zásadních změn v posledních 15 letech, během nichž se prokázalo, že agresivní chirurgický přístup zahrnující radikální cytoredukci (cytoreductive surgery – CRS) v kombinaci s intraperitoneální chemoterapií může přežití u pacientů s PM CRC významně prodloužit [15].
Metodika
V ČR nabízí cytoredukční léčbu v kombinaci s intraperitoneální chemoterapií pět specializovaných center. Nejdelší zkušenosti má Chirurgická klinika Nemocnice Na Bulovce v Praze, kde se tyto operace vykonávají od roku 1999 [16,17], dalšími pracovišti jsou I. chirurgická klinika VFN v Praze, Chirurgická klinika Thomayerovy nemocnice v Praze, I. chirurgická klinika FN v Olomouci a Klinika operační onkologie Masarykova onkologického ústavu v Brně (výčet podle časové posloupnosti zavedení metody). Výše uvedená pracoviště dodala přesné informace o počtu cytoredukčních výkonů v indikaci PM CRC v roce 2018. U všech operovaných pacientů byla provedena peroperační kvantifikace rozsahu peritoneálního postižení stanovením hodnoty „peritoneal cancer index“ (PCI), z níž se odvíjí strategie chirurgické léčby. PCI rozděluje dutinu břišní do 13 abdominopelvických regionů vč. čtyř oblastí tenkého střeva. Každý region může nabývat hodnot 0–3, maximální dosažitelná hodnota PCI je tedy 39 [13]. Ve všech případech byla též finálně zhodnocena radikalita provedeného cytoredukčního výkonu pomocí skóre „completeness of cytoreduction after surgery“ (CC score), což je klasifikace hodnotící velikost makroskopicky zjevných reziduálních nádorových ložisek ponechaných v dutině břišní po dokončené cytoredukci, kdy jako CC0 se označuje kompletní odstranění všech nádorových ložisek, jako CC1 ponechání depozit do maximální velikosti 2,5 mm, jako CC2 ponechání nádorových hmot od 2,5 mm do 2,5 cm a jako CC3 ponechání ložisek velikosti > 2,5 cm. Cílem radikální chirurgické léčby je dosažení CC skóre 0/1, které vykazuje nejlepší terapeutické výsledky [13].
Všichni pacienti podstoupili společně s cytoredukcí i hypertermickou intraperitoneální chemoterapii (HIPEC), jejímž cílem je likvidace reziduálních mikroskopických nádorových depozit. Při HIPEC se po dokončené cytoredukci aplikuje do dutiny břišní lavážovací roztok zahřátý na teplotu okolo 42 °C obsahující chemoterapeutikum o vyšší koncentraci než při podávání intravenózním. Hypertermie má potencovat vyšší cytotoxický účinek a hlubší průnik chemoterapeutika do nádorem infiltrovaných tkání [14].
Odhad celkové prevalence CRC (dg. C18–C20) v ČR pro rok 2019 podle dat NOR ČR zahrnuje jednak počty pacientů s nově diagnostikovanými nádory, jednak počty žijících pacientů, kteří byli diagnostikováni a léčeni v letech minulých (kalkulace pomocí populačních modelů přežití). Výsledný odhad je korigován s ohledem na progresi onemocnění. Pacienti, kteří byli dříve diagnostikováni ve stadiu I, II nebo III, ale kteří v daném roce pravděpodobně relabují nebo progredují do diseminace, jsou již zahrnuti v predikované prevalenci stadia IV. Použitý model nesleduje pravděpodobnost relapsů do jiného než IV. stadia. Uvedené odhady jsou upraveny podle pravděpodobnostních modelů přežití a modelů pro relaps/progresi základního onemocnění. Všechny odhady jsou doplněny 90% intervalem spolehlivosti.
Výsledky
V roce 2018 se z důvodu diagnózy peritoneálních metastáz kolorektálního karcinomu uskutečnilo v ČR na 5 chirurgických pracovištích celkem 25 cytoredukčních operací v kombinaci s HIPEC. V jednom případě byla origem diseminace karcinomu rekta (dg. C20), v případech ostatních šlo o adenokarcinom tračníku (dg. C18). Operováno bylo 16 žen a 9 mužů, jejich průměrný věk byl 59 let.
Průměrná hodnota PCI byla 12,4. U metastatického postižení peritonea s PCI > 15 se ani v jediném případě nepodařilo provést kompletní cytoredukci (CC skóre 0). Intraperitoneálně byla podána ve 12 případech oxaliplatina, v 8 případech mitomycin, ve 3 případech mitomycin v kombinaci s cisplatinou, ve 2 případech karboplatina. Shrnutí těchto údajů znázorňuje tab. 1.
Table 1. Cytoredukční chirurgie + HIPEC u pacientů s peritoneálními metastázami kolorektálního karcinomu v ČR v roce 2018. 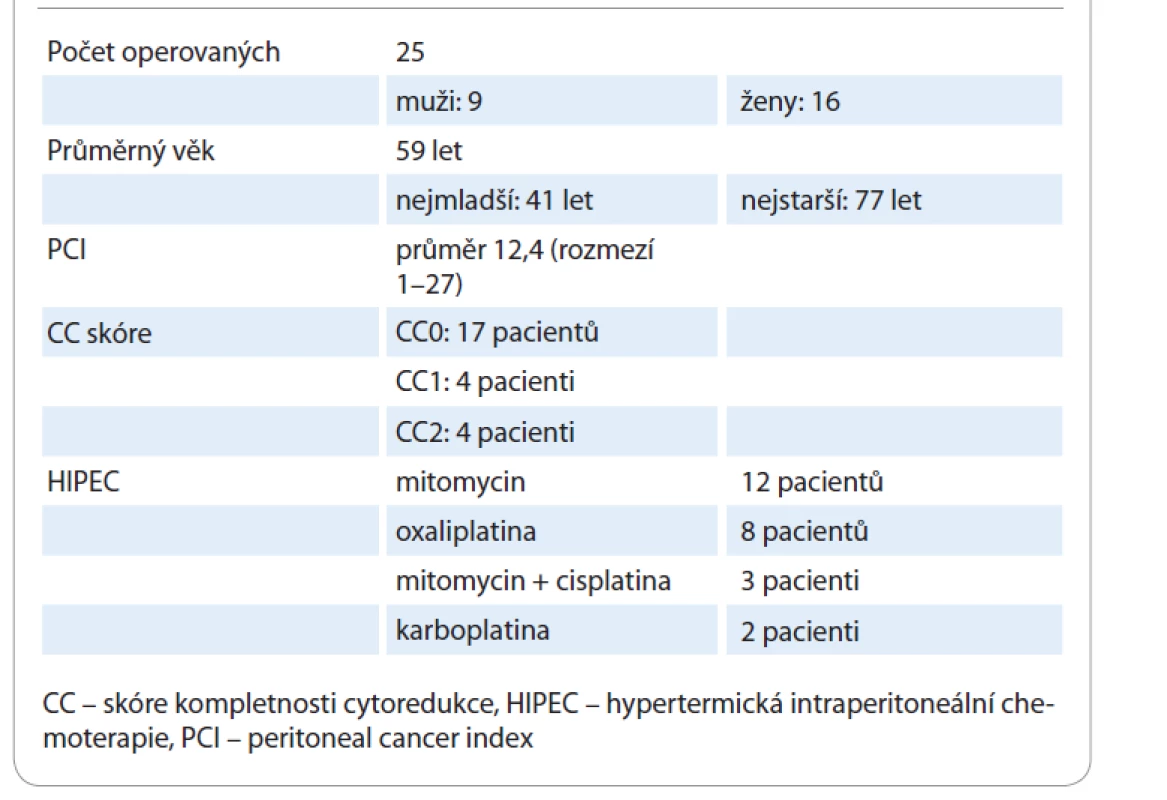
Odhad prevalence CRC (dg. C18–C20) pro rok 2019 podle dat v ČR je uveden v tab. 2.
Table 2. Odhad prevalence kolorektálního karcinomu v ČR pro rok 2019 podle dat Národního onkologického registru. 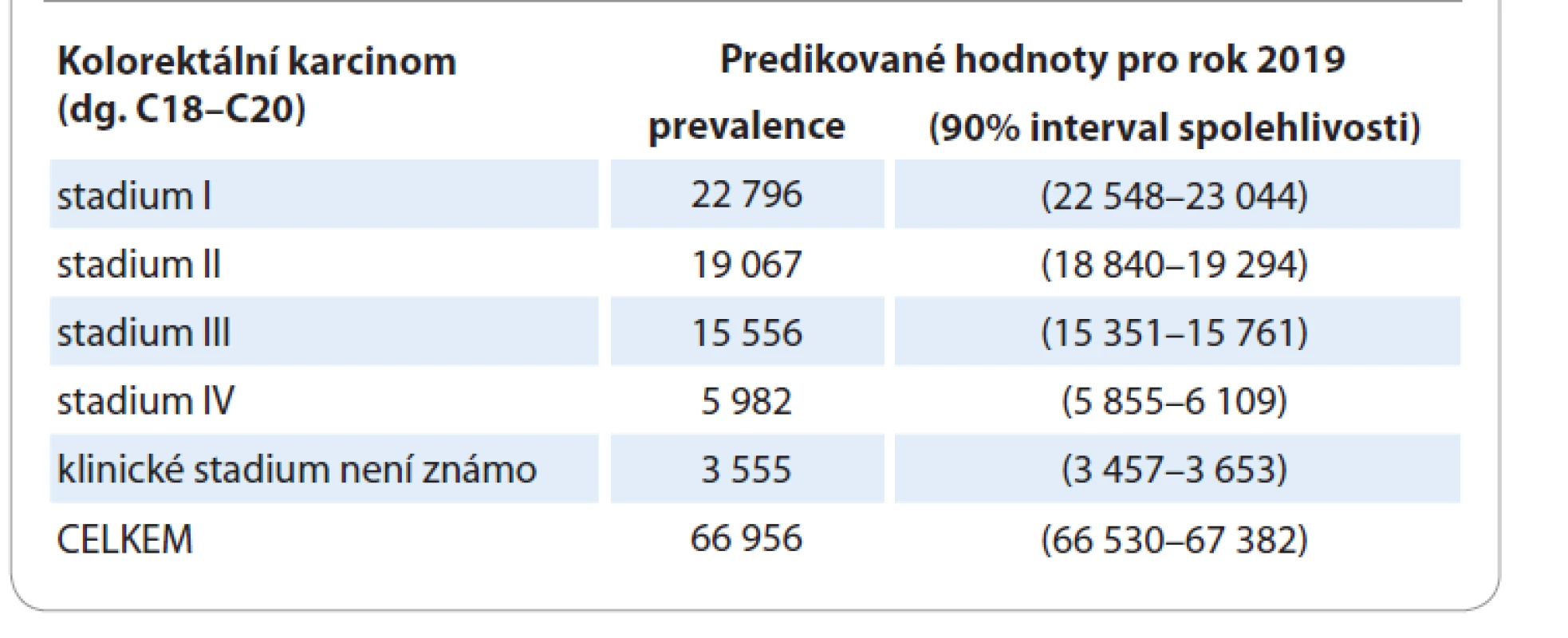
Přepokládáme-li střízlivě, že ve IV. klinickém stadiu CRC se vyskytují peritoneální metastázy u 10–20 % pacientů (přičemž reálné číslo bude pravděpodobně vyšší), dostáváme se při výše uvedené prevalenci k počtu 600–1 200 pacientů s PM CRC v ČR ročně. Uvažujeme-li poté, že čtvrtina z těchto nemocných může profitovat z cytoredukčního výkonu, docházíme k počtu 150–300 pacientů za rok.
Porovnáním odhadu počtu nemocných potenciálně kurabilních s počtem reálně odoperovaných pak docházíme k závěru, že adekvátní terapii v ČR podstupuje nanejvýš pětina pacientů s PM CRC.
Diskuze
Medián přežití se u pacientů s PM CRC léčených klasickou paliativní systémovou chemoterapií na bázi 5-fluorouracilu v modulaci s leukovorinem udával v rozmezí 7,5–12 měsíců [10,18], při použití modernější systémové chemoterapie (oxaliplatina v kombinaci s 5-fluorouracilem a leukovorinem nebo irinotekan v kombinaci s 5-fluorouracilem a leukovorinem) s biologickou léčbou může medián přežití převýšit dobu 16 měsíců a 5leté přežití dosáhnout 5 % [19]. Paliativní systémová chemoterapie má ale na rozdíl od léčby ostatních orgánových metastáz CRC v případě PM menší efektivitu, což se připisuje především existenci tzv. plazma-peritoneální bariéry a dále specificky nízkému krevnímu zásobování pobřišnice omezujícímu průnik intravenózně podaného chemoterapeutika do nádorové peritoneální infiltrace [20].
Vedle systémové chemoterapie se v posledních 15 letech v léčbě PM CRC významně prosazuje CRS s intraperitoneální chemoterapií, ať už se jedná o časnou pooperační intraperitoneální chemoterapii (early postoperative intraperitoneal chemotherapy – EPIC), nebo HIPEC. Prodloužení mediánu přežití po cytoredukční léčbě je dobře zdokumentováno řadou multicentrických retrospektivních studií, které uváděly u selektované skupiny pacientů po kurativní cytoredukci s HIPEC 5leté přežití 30–40 % s mediánem přežití > 42 měsíců [11], s maximem až 63 měsíců [21–25]. CRS a HIPEC, vycházející z původního terapeutického konceptu Paula Sugarbakera z Washingtonu v USA, se tak staly součástí terapeutických protokolů léčby PM CRC v mnoha zemích světa [26]. Metaanalýza 19 studií z období let 1995–2009 (2 492 pacientů), kdy 1 084 pacientů podstoupilo kompletní cytoredukci s HIPEC a 1 408 pacientů paliativní chirurgický výkon a/nebo paliativní systémovou chemoterapii, ukazuje, že medián přežití ve skupině CRS/HIPEC byl 33 měsíců (20–63) a 5leté přežití 40 % (17–51 %), zatímco ve skupině paliativní chirurgie a/nebo systémové chemoterapie byl medián přežití 12,5 měsíce (5–24) a 5leté přežití 13 % (13–22 %) [27]. V současnosti se terapeutickým efektem cytoredukce a intraperitoneální chemoterapie v léčbě PM CRC zabývá řada prospektivních klinických studií (CAIRO-6, ICARuS, PRODIGE-7, COMBATAC), další studie (PROMENADE, COLOPEC, PROPHYLOCHIP, HIPECT4) zkoumají možnost redukce vývoje metachronních PM CRC profylaktickou HIPEC procedurou u rizikových pacientů (pacienti s perforovanými tumory, s T4 tumory, pacientky se synchronními metastázami CRC do ovarií). U pečlivě vybraných pacientů není cytoredukce s HIPEC zásadně kontraindikována ani v případě přítomnosti resekabilních jaterních metastáz [28,29].
Nezávislý léčebný efekt cytoredukce a HIPEC v případě PM CRC není dosud jasně rozpoznán, už proto, že tyto výkony téměř vždy probíhají souběžně. Podle studie PRODIGE-7 má zásadní vliv na prodloužení mediánu přežití právě cytoredukční chirurgický výkon, účinek HIPEC s intraperitoneálně podanou oxaliplatinou na prodloužení přežití prokázán nebyl, resp. projevuje se pouze v podskupině nemocných se středním rozsahem metastatického peritoneálního postižení (PCI 11–15) [30]. Úspěšnost chirurgické léčby PM CRC je podmíněna pečlivým výběrem kandidátů cytoredukce. Pouze okolo 25 % pacientů s manifestací PM CRC má vzhledem k rozsahu peritoneálního postižení šanci z této léčby profitovat [31]. Základními faktory při výběru vhodného kandidáta CRS/HIPEC jsou rozsah postižení peritonea, kdy za únosnou hodnotu u PM CRC se v současnosti považuje PCI ≤ 15. Při vyšších hodnotách PCI se cytoredukce neukazuje jako efektivní ve smyslu prodloužení doby přežití, PCI > 15 se proto u PM CRC obvykle považuje za relativní kontraindikaci cytoredukce [32]. Důležitými faktory proveditelnosti výkonu je též míra postižení tenké kličky a histopatologická klasifikace primárního nádoru. Shoda panuje v názoru, že CRS a HIPEC by se u PM CRC měly provádět pouze tehdy, pokud je uskutečnitelné kompletní nebo téměř kompletní odstranění všech tkání postižených metastatickou infiltrací [26]. Zatímco u ostatních peritoneálních nádorů se považuje za uspokojivý výsledek cytoredukce ponechání reziduálních depozit maximální velikosti 2,5 mm, jelikož se počítá s účinkem cytotoxicity chemoterapeutika pronikajícího do hloubky až 3 mm, u PM CRC se doporučuje odstranit všechna ložiska > 1 mm [33]. Cytoredukční výkon provádíme nejčastěji z laparotomie, při menším rozsahu peritoneálních metastáz je možno uskutečnit jej i laparoskopicky, resp. laparoskopicky asistovaně [34].
Schéma intraperitoneální chemoterapie není u PM CRC unifikováno, běžně se používá mitomycin C (příp. v kombinaci s cisplatinou) v hypertermické laváži dutiny břišní trvající 60–90 minut. Intraperitoneální aplikace oxaliplatiny je v současnosti vesměs opouštěna, studie PRODIGE-7 efektivitu jejího intraperitoneálního podání u PM CRC zpochybnila [30].
Metaanalýza 32 retrospektivních studií publikovaných v letech 2010–2015 uvádí morbiditu po CRS/HIPEC v léčbě PM CRC v rozsahu 17–52,4 % (průměrně 32,6 %) a mortalitu 0–8,1 % (průměrně 2,9 %) [35].
Závěr
Cytoredukční chirurgie představuje u vybraných pacientů s peritoneálními metastázami kolorektálního karcinomu vhodnou léčebnou metodu vedoucí k prokazatelnému prodloužení mediánu přežití. Společnost The Peritoneal Surface Oncology Group International (PSOGI) ji u malého a středního metastatického postižení peritonea doporučuje jako terapeutický standard, obsažena je i v doporučených postupech National Comprehensive Cancer Network (NCCN). V mnoha státech světa se cytoredukce a HIPEC staly v léčbě PM CRC standardem zdravotní péče. V naší zemi by pravděpodobně bylo možno tímto způsobem chirurgicky léčit asi 150–300 pacientů ročně, v roce 2018 jich ale tuto proceduru reálně podstoupilo pouze 25. Znamená to tedy, že pouze necelých 20 % potenciálně kurabilních pacientů s PM CRC má v současnosti v ČR šanci dosáhnout na optimální léčbu.
Příčinou nízkého počtu cytoredukčních operací u PM CRC v ČR bezpochyby není nedostatečné množství tuzemských onkochirurgických center zabývajících se příslušnou problematikou: skutečným důvodem je nízký počet pacientů s PM CRC do příslušných center odesílaných, ať už se jedná o nemocné s peroperačně zjištěným synchronním peritoneálním postižením, nebo o pacienty v dispenzární ambulantní péči, u nichž dojde k progresi nádorového onemocnění. Neuspokojivý počet indikací padá na vrub pozdní diagnostiky, nedostatečného seznámení odborné veřejnosti s vlastní cytoredukční léčbou či nedůvěry v tuto metodu, popřípadě je důsledkem výlučného preferování jiných terapeutických modalit (systémová protinádorová léčba), byť by měly nižší efektivitu. Navýšení počtu nemocných, kterým je v ČR možno cytoredukční operaci s aplikací intraperitoneální chemoterapie s terapeutickým záměrem nabídnout, tak pravděpodobně nelze očekávat dříve, dokud nebude zmíněný terapeutický postup mentálně adoptován zainteresovanými digestivními chirurgy i kooperujícími klinickými onkology.
Podpořeno MZ ČR – RVO (MOÚ, 00209805), (NNB, 00064211), (VFN, 00064165), (TN, 00064190), (FNOl, 00098892).
Supported by the Ministry of Health of the Czech Republic – Development of Research Organization (MOÚ, 00209805), (NNB, 00064211), (VFN, 00064165), (TN, 00064190), (FNOl, 000 98892).
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
The Editorial Board declares that the manuscript met the ICMJE recommendation for biomedical papers.MUDr. Libor Němec
Klinika operační onkologie
Masarykův onkologický ústav
Žlutý kopec 7
602 00 Brno
e-mail: lnemec@mou.cz
Obdrženo/Submitted: 22. 12. 2020
Přijato/Accepted: 25. 2. 2021
Sources
1. Krška Z, Hoskovec D, Petruželka L et al. Chirurgická onkologie. Praha: Grada Publishing 2014.
2. Simkens GA, Rovers KP, Nienhuijs SW et al. Patient selection for cytoreductive surgery and HIPEC for the treatment of peritoneal metastases from colorectal cancer. Cancer Manag Res 2017; 9 : 259–266. doi: 10.2147/CMAR.S119569.
3. Elias D, Honoré C, Dumont F et al. Results of systematic second-look surgery plus hipec in asymptomatic patients presenting a high risk of developing colorectal peritoneal carcinomatosis. Ann Surg 2011; 254 (2): 289–293. doi: 10.1097/SLA.0b013e31822638f6.
4. Rosen SA, Buell JF, Yohida A et al. Initial presentation with stage IV colorectal cancer. Arch Surg 2000; 135 (5): 503–505. doi: 10.1001/ARCHSURG.135.5.530.
5. Simkens GA, Razenberg LG, Lemmens VE et al. H. Histological subtype and systemic metastases strongly influence treatment and survival in patients with synchronous colorectal peritoneal metastases. Eur J Surg Oncol 2016; 42 (6): 794–800. doi: 10.1016/j.ejso.2016.03.014.
6. Lemmens VE, Klaver YL, Verwaal VJ et al. Predictors and survival of synchronous peritoneal carcinomatosis of colorectal origin: a population-based study. Int J Cancer. 2011; 128 (11): 2717–2725. doi: 10.1002/ijc.25596.
7. Segelman J, Granath F, Holm T et al. Incidence, prevalence and risk factors for peritoneal carcinomatosis from colorectal cancer. Br J Surg 2012; 99 (5): 699–705. doi: 10.1002/bjs.8679.
8. Kerscher AG, Chua TC, Gasser M et al. Impact of peritoneal carcinomatosis in the disease history of colorectal cancer management: a longitudinal experience of 2406 patients over two decades. Br J Cancer 2013; 108 (7): 1432–1439. doi: 10.1038/bjc.2013.82.
9. Segelman J, Akre O, Gustafsson UO et al. A. Individualized prediction of risk of metachronous peritoneal carcinomatosis from colorectal cancer. Colorectal Dis 2014; 16 (5): 359–367. doi: 10.1111/codi.12552.
10. Koppe MJ, Boerman OC, Oyen WJ et al. Peritoneal carcinomatosis of colorectal origin: incidence and current treatment strategies. Ann Surg 2006; 243 (2): 212–222. doi: 10.1097/01.sla.0000197702.46394.16.
11. Kok NF, de Hingh IH. Cytoreductive surgery and hyperthermic intraperitoneal chemotherapy for peritoneal metastases of colorectal origin. BJS 2017; 104 (4): 313–315. doi: 10.1002/bjs.10422.
12. Koh JL, Yan TD, Glenn D et al. Evaluation of preoperative computed tomography in estimating peritoneal cancer index in colorectal peritoneal carcinomatosis. Ann Surg Oncol 2009; 16 (2): 327–333. doi: 10.1245/s10434-008-0234-2.
13. Jacquet P, Sugarbaker PH. Clinical research methodologies in diagnosis and staging of patients with peritoneal carcinomatosis. Cancer Treat Res 1996; 82 : 359–374. doi: 10.1007/978-1-4613-1247-5_23.
14. Bartoška P, Antoš F, Němec L et al. Maligní nádory peritonea – úvod do problematiky. Klin Onkol 2019; 32 (5): 324–328. doi: 10.14735/amko2019324.
15. Němec L, Tomášek J, Šefr R. Léčba a profylaxe peritoneálních metastáz kolorektálního karcinomu. Klin Onkol 2019; 32 (5): 338–344. doi: 10.14735/amko2019338.
16. Antoš F. Peritoneální nádory, Klin Onkol 2019; 32 (5): 321.
17. Antoš F. Dytrych P. Vítek P. et al. Maligní ascites – možnost ovlivnění tvorby pomocí hypertermické peroperační chemoterapie (HIPEC). Rozhl Chir 2010; 89 (4): 237–241.
18. Razenberg LG, van Gestel YR, Creemers GJ et al. Trends in cytoreductive surgery and hyperthermic intraperitoneal chemotherapy for the treatment of synchronous peritoneal carcinomatosis of colorectal origin in the Netherlands. Eur J Surg Oncol 2015; 41 (4): 466–471. doi: 10.1016/j.ejso.2015.01.018.
19. Bhatt A. Management of peritoneal metastases - cytoreductive surgery, HIPEC and beyond. Singapore: Springer 2018.
20. Franko J, Shi Q, Meyers JP et al. Prognosis of patients with peritoneal metastatic colorectal cancer given systemic therapy: an analysis of individual patient data from prospective randomised trials from the Analysis and Research in Cancers of the Digestive System (ARCAD) database. Lancet Oncol 2016; 17 (12): 1709–1719. doi: 10.1016/S1470-2045 (16) 30500-9.
21. Elias D, Lefevre JH, Chevalier J et al. Complete cytoreductive surgery plus intraperitoneal chemohyperthermia with oxaliplatin for peritoneal carcinomatosis of colorectal origin. J Clin Oncol 2009; 27 (5): 681–685. doi: 10.1200/JCO.2008.19.7160.
22. Elias D, Gilly F, Boutitie F et al. Peritoneal colorectal carcinomatosis treated with surgery and perioperative intraperitoneal chemotherapy: retrospective analysis of 523 patients from a multicentric French study. J Clin Oncol 2010; 28 (1): 63–68. doi: 10.1200/JCO.2009.23.9 285.
23. Esquivel J, Lowy AM, Markman M et al. The American Society of Peritoneal Surface Malignancies (ASPSM) multi-institution evaluation of the peritoneal surface disease severity score (PSDSS) in 1,013 patients with colorectal cancer with peritoneal carcinomatosis. Ann Surg Oncol 2014; 21 (13): 4195–4201. doi: 10.1245/s10434-014-3798-z.
24. Glehen O, Kwiatkowski F, Sugarbaker PH et al. Cytoreductive surgery combined with perioperative intraperitoneal chemotherapy for the management of peritoneal carcinomatosis from colorectal cancer: a multi-institutional study. J Clin Oncol 2004; 22 (16): 3284–3292. doi: 10.1200/JCO.2004.10.012
25. Kuijpers AM, Mirck B, Aalbers AG et al. Cytoreduction and HIPEC in the Netherlands: nationwide long-term outcome following the Dutch protocol. Ann Surg Oncol 2013; 20 (13): 4224–4230. doi: 10.1245/s10434-013-3145-9.
26. Esquivel J, Piso P, Verwaal V et al. American Society of Peritoneal Surface Malignancies opinion statement on defining expectations from cytoreductive surgery and hyperthermic intraperitoneal chemotherapy in patients with colorectal cancer. J Surg Oncol 2014; 110 (7): 777–778. doi: 10.1002/jso.23722.
27. Chua TC, Esquivel J, Pelz JO et al. Summary of current therapeutic options for peritoneal metastases from colorectal cancer. J Surg Oncol 2013; 107 (6): 566–573. doi: 10.1002/jso.23189.
28. El-Nakeep S, Rashad N, Oweira H et al. Intraperitoneal chemotherapy and cytoreductive surgery for peritoneal metastases coupled with curative treatment of colorectal liver metastases: an updated systematic review. Expert Rev Gastroenterol Hepatol 2017; 11 (3): 249–258. doi: 10.1080/17474124.2017.1284586.
29. Kwakman R, Schrama AM, van Olmen JP et al. Clinicopathological parameters in patient selection for cytoreductive surgery and hyperthermic intraperitoneal chemotherapy for colorectal cancer metastases: a meta-analysis. Ann Surg 2016; 263 (6): 1102–1111. doi: 10.1097/SLA.0000000000001593.
30. Quenet F, Elias D, Roca L et al. A UNICANCER phase III trial of hyperthermic intraperitoneal chemotherapy (HIPEC) for colorectal peritoneal carcinomatosis (PC): PRODIGE 7. [online]. Available from: https: //ascopubs.org/doi/10.1200/JCO.2018.36.18_suppl.LBA3503.
31. März L, Piso P: Treatment of peritoneal metastases from colorectal cancer. Gastroenterology Report 2015; 3 (4): 298–302. doi: 10.1093/gastro/gov044.
32. Elias D, Mariani A, Cloutier AS et al. Modified selection criteria for complete cytoreductive surgery plus HIPEC based on peritoneal cancer index and small bowel involvement for peritoneal carcinomatosis of colorectal origin. Eur J Surg Oncol 2014; 40 (11): 1467–1473. doi: 10.1016/j.ejso.2014.06.006.
33. Sugarbaker PH. Cytoreductive surgery and hyperthermic intraperitoneal chemotherapy in the management of gastrointestinal cancers with peritoneal metastases: Progress toward a new standard of care. Cancer Treat Rev 2016; 48 : 42–49. doi: 10.1016/j.ctrv.2016.06.007.
34. Ha SH, Park SY, Park JS et al. Short-term outcomes after laparoscopic cytoreductive surgery in patients with limited peritoneal metastases from colorectal cancer. Surgery 2019; 165 (4): 775–781. doi: 10.1016/j.surg.2018.09. 017.
35. Baratti D, Kusamura S et al. Progress in treatments for colorectal cancer peritoneal metastases during the years 2010–2015. A systematic review. Crit Rev Oncol Hematol 2016; 100 : 209–222. doi: 10.1016/j.critrevonc.2016.01.017.
Labels
Paediatric clinical oncology Surgery Clinical oncology
Article was published inClinical Oncology

2021 Issue 4-
All articles in this issue
- Editorial
- Základní informace pro rozpoznávání psychických poruch vyvolaných maligním onemocněním
- Cytoredukce a hypertermická intraperitoneální chemoterapie v léčbě peritoneálních metastáz kolorektálního karcinomu v České republice v roce 2018
- Trombóza asociovaná s malignitou – liečba a prevencia priamymi inhibítormi faktora Xa
- PET somatostatinových receptorů nad rámec neuroendokrinních nádorů gastrointestinálního traktu – přehled literatury
- Anizokorie jako nežádoucí účinek léčby paklitaxelem
- Molekulární testování u karcinomu endometria
- Informace z České onkologické společnosti
- Antineoplastické, radiosenzibilizující a radioprotektivní vlastnosti kurkuminu
- Využití buněčných exozomů jako nového nosiče v genové terapii karcinomu prsu
- Vzácný případ gastroezofageálního karcinomu v 24letého muže s achalázií komplikovanou pooperpační aortoezofageální píštělí v důsledku zavedení stentu a časné lokální rekurence
- Myofibroblastický nádor jícnu – kazuistika, dlouhodobý follow-up a přehled literatury
- Antimalarika jako dvousečná zbraň u pacientů s rakovinou a infekcí COVID-19
- Clinical Oncology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Základní informace pro rozpoznávání psychických poruch vyvolaných maligním onemocněním
- Anizokorie jako nežádoucí účinek léčby paklitaxelem
- PET somatostatinových receptorů nad rámec neuroendokrinních nádorů gastrointestinálního traktu – přehled literatury
- Trombóza asociovaná s malignitou – liečba a prevencia priamymi inhibítormi faktora Xa
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

