-
Medical journals
- Career
Využití indocyaninové zeleně k peroperační diagnostice zdroje chylózního ascitu a autologního tkáňového lepidla (Vivostatu) k jeho ošetření
Authors: Andrea Zetelová 1; Ivo Rovný 1; Zdeněk Kala 1; Petr Moravčík 1; Luboš Minář 2
Authors‘ workplace: Chirurgická klinika LF MU a FN Brno 2 Gynekologická klinika FN Brno 1
Published in: Klin Onkol 2020; 33(2): 145-149
Category: Case Report
doi: https://doi.org/10.14735/amko2020145Overview
Východiska: Chylózní ascites neboli chyloperitoneum může vzniknout peroperačním poraněním lymfatických cest, lymfa je následně kumulována v dutině břišní. Incidence chylózního ascitu se liší podle typu operace a rozsahu lymfadenektomie. První volbou léčby je konzervativní postup – totální parenterální výživa nebo event. přísná nízkotučná dieta. Pokud tento postup selže, je indikována operační revize. Ta je však často obtížná pro pooperačně změněný terén a chronickou přítomnost patologického sekretu v dutině břišní. V identifikaci zdroje lymfy může pomoci aplikace tukové emulze nebo indocyaninové zeleně (indocyanin green – ICG) do oblasti drenáže lymfatických cest. ICG se v dnešní době využívá v různých klinických indikacích, např. k hodnocení jaterních funkcí, k angiografii v očním lékařství, ke stanovení prokrvení tkání, prokrvení štěpů v plastické chirurgii, hledání spádových lymfatických uzlin při onkologických výkonech. Výhodou ICG lymfografie je možnost pozorování místa leaku v reálném čase přímo na operačním sále.
Případ: Polymorbidní 66letá pacientka po radikální onkogynekologické operaci s aortopelvickou lymfadenektomií se pooperačně komplikovala perzistentním, vysokoobjemovým chylózním ascitem nereagujícím na konzervativní léčbu. Provedli jsme tedy operační revizi dutiny břišní a úspěšné ošetření zdroje chylózního leaku za pomoci ICG peroperační lymfografie a s následnou aplikací autologního tkáňového lepidla Vivostat na oblast ošetřené léze.
Závěr: Vysokoobjemový refrakterní chylózní ascites je méně častá pooperační komplikace s významným dopadem na kvalitu života, nutriční stav nemocného i další prognózu pacienta. Léčba je přísně individuální. První volbou by měl být konzervativní postup. Tam, kde selže, je indikována obtížná operační revize. V dnešní době však chirurgovi mohou pomoci moderní technologie, jako je např. fluorescenčně navigovaná chirurgie či ošetření zdroje autologními tkáňovými lepidly.
Klíčová slova:
chylózní ascites – chyloperitoneum – lymfatický systém – lymfangiografie – lymforea – indocyaninová zeleň – Vivostat
Úvod
Chylózní ascites (ChA) neboli chyloperitoneum může být pooperační komplikací především po rozsáhlých operačních výkonech, při kterých je prováděna systematická lymfadenektomie nebo resekční výkon v aortokavální a ilické oblasti. Počet těchto komplikací narůstá v souvislosti se stále častějšími radikálními resekcemi při maligních onemocněních se systematickou lymfadenektomií [1,2]. Pooperační ChA je komplikace, která signifikantně prodlužuje dobu hospitalizace a náklady na léčbu, snižuje kvalitu života, způsobuje dehydrataci, imunodeficit s lymfocytopenií pro ztrátu lymfocytů i imunoglobulinů lymfou a malnutrici s následným zhoršeným hojením a oddalováním adjuvantní onkologické terapie. V důsledku těchto komplikací může významným způsobem zhoršit prognózu základního maligního onemocnění, pro kterou byla primární operace indikována [1,3,4]. Léčba ChA je zpravidla konzervativní. Pokud selže, je indikována operační revize. Detekovat místo poranění lymfatických cest je během operační revize ale velmi obtížné pro pooperační otok, srůsty a zánětlivě změněný terén. Jednou z možností, jak dané místo peroperačně lokalizovat, je využití fluorescenční látky zvané indocyaninová zeleň (indocyanin green – ICG), která se recentně používá např. k objektivizaci tkáňového prokrvení nebo lymfografii [5].
Kazuistika
Polymorbidní 66letá pacientka byla pro karcinom endometria indikována v srpnu 2017 k radikální vaginální hysterektomii s oboustrannou adnexektomií, apendektomií a aortopelvickou lymfadenektomií. Histologicky byl potvrzen invazivní endometroidní karcinom děložního těla GII, T1bN0, s odebráním celkem 54 lymfatických uzlin. Necelý měsíc po operaci narůstal objem břicha a pacientka si stěžovala na tlakové bolesti, nechutenství a nauzeu. Ultrazvukovým vyšetřením byla potvrzena volná tekutina v břišní dutině. Při paracentéze měla sekrece mléčný vzhled, obsahovala 3,8 mmol/l triglyceridů (TG), 1,3 mmol/l cholesterolu a cytologicky byla bez nálezu onkologicky suspektních elementů. Potvrdili jsme tak diagnózu ChA, který dosahoval až 8 l za týden. Byla zavedena konzervativní terapie a opakované odlehčující paracentézy pro silný břišní dyskomfort, zvracení, dušnost a nucení na močení. Doplnili jsme výpočetní tomografii (computed tomography – CT) břicha (obr. 1) a lymfoscintigrafii, která potvrdila únik lymfy z oblasti levé pánevní cesty. Pro neustupující ChA byla indikována i radiační terapie dutiny břišní. Z důvodu selhání konzervativní terapie, perzistujícího velkoobjemového ChA, horšení celkového stavu a progresi malnutrice byla na začátku ledna 2018 indikována operace. Pacientka podepsala informovaný souhlas s operací. Na našem pracovišti jsme zrevidovali dutinu břišní s kompletní adheziolýzou tenkého střeva pro četné srůsty, deliberací aortokavální oblasti a ilických svazků, kde bylo očekáváno místo chylózního leaku. Peroperačně jsme evakuovali > 2,5 l ChA (obr. 2). Oblast patologické extravazace chylu jsme nalezli při levé straně aorty, ale nebyl patrný konkrétní zdroj. Nejprve jsme stimulovali sekreci podáním tukové emulze (Intralipid® 20% 100 ml, Fresenius Kabi) do nazogastrické sondy. Chylózní leak se zvětšil, ale nedošlo k upřesnění místa sekrece. Proto jsme přistoupili k aplikaci ICG (Verdye® 2 ml, Diagnostic green) do oblasti mezenteria a za pomoci ICG kamery (Novadaq Pinpoint®) jsme pozorovali postup ICG směrem k radixu mezenteria a následně leak ICG z oblasti při levé hraně aorty proximálně, pod levou renální žílou (obr. 3). Cílenou preparací této oblasti jsme identifikovali lumen silné lymfatické cévy a ošetřili jsme ji klipem, chylózní sekrece ustala. Následně jsme místo leaku a okolí pojistili aplikací autologního tkáňového lepidla Vivostat PRF® s krevními destičkami. Na závěr operace jsme zopakovali podání tukové emulze, ta již nevedla k patrnému chylóznímu leaku. V pooperačním období postupně klesly odpady do břišních drénů, odběrem na TG byla vyloučena chylózní sekrece a drény byly extrahovány 7. pooperační den. Pacientka byla postupně zatížena stravou a propuštěna 13. pooperační den. Na ambulantních kontrolách udávala zprvu občasné nechutenství k masu, které se postupně upravilo, jinak byla bez potíží i váhového úbytku. Břicho bylo klidné, nutriční parametry se upravily do normy a na kontrolních ultrazvukových vyšetřeních byl popsán malý ascites stacionárního množství.
Image 1. CT břicha – patrné lemy ascitu > 6 cm. 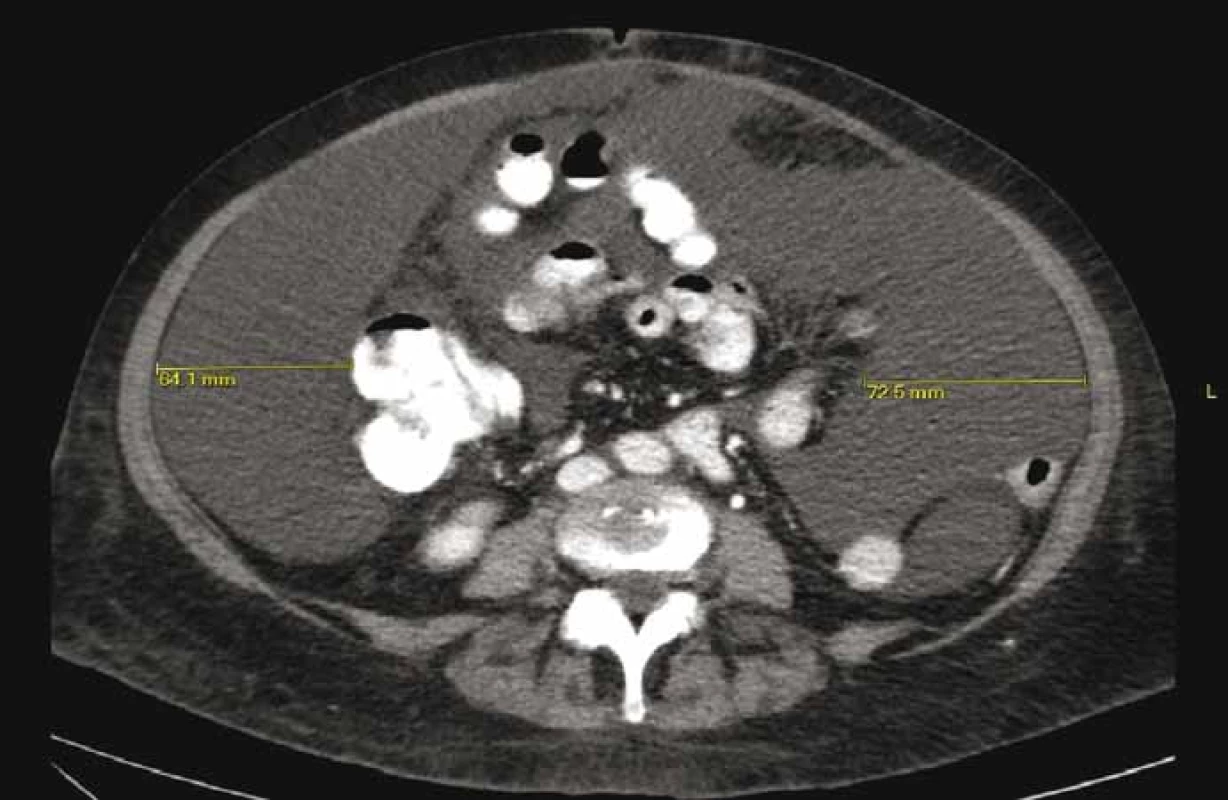
Image 2. Foto z operace – otevření dutiny břišní a patrná mléčná sekrece, tzv. chylózní ascites neboli chyloperitoneum. 
Image 3. Foto z operace – lokalizace lymfatického leaku pomocí ICG. ICG – indocyaninová zeleň 
Diskuze
Při poranění lymfatických cest se v dutině břišní kumuluje exsudativní ascites, který se dělí podle místa postižení na lymfatický a chylózní. ChA obsahuje vysoké množství cholesterolu a TG s dlouhým řetězcem v chylomikronech vstřebaných v gastrointestinálním traktu, proto má mléčný charakter [3,6,7]. Pooperační ChA je definován jako nahromadění chylu v dutině břišní a je výsledkem poranění lymfatických cest proximálně od cisterna chyli (v oblasti L1–2) během operace, nejčastěji přímo cisterny chyli nebo jejich větví, nebo je výsledkem ztráty adekvátní lymfatické drenáže extenzivní lymfadenektomií a hromadění lymfy v distálních lymfatických cestách [1,3,8]. Mezi další příčiny řadíme radiační terapii na oblast dutiny břišní a malé pánve s následnou incidencí ChA přibližně kolem 3 % [1,9]. Diagnóza je určena především na podkladě klinických známek, biochemické a cytologické analýzy ascitu. Po operaci se v drénech, a to hlavně po zátěži stravou, objeví sekrece mléčného charakteru, která obsahuje vysoké množství TG. Dle recentních publikací je hladina vyšší než 187 mg/dl (2,13 mmol/l), alternativou je rozmezí 148–246 mg/dl, se senzitivitou a specifitou nad 95 % [10]. Nicméně množství TG v lymfě je závislé na nutričním stavu a pacienti s malnutricí mohou mít nižší hodnotu v krvi i lymfě, a je tedy lepší porovnat hladinu TG v krvi s hladinou v drénech. (Naše pacientka měla i přes malnutrici TG 3,8 mmol/l.) Pomocí elektroforézy je také možné identifikovat chylomikrony [2,11]. Dále bývá patrná distenze břicha, která během několika týdnů narůstá, a ne vždy je bolestivá. Mohou být přítomny i příznaky zvýšeného nitrobřišního tlaku – nauzea, zvracení, nechutenství, úbytek váhy, únava, dyspnoe. Po gynekologické operaci může být pozorován odchod mléčné sekrece pochvou především v případě, kdy není do dutiny břišní zaveden břišní drén nebo je časně extrahován [2,9,12]. Dle některých autorů se za ChA považuje množství sekrece až od 200 ml/den [1,3,8]. Van der Gaag et al dělí ChA do tří skupin podle závažnosti – A, B a C, kdy stupeň B a C jsou klinicky signifikantní. Uvádí, že ChA u pacientů po pankreatikoduodenektomii mění management pooperační terapie až při množství > 275 ml/den a nižší produkci nazývá chyloformní sekrecí [3]. Mezi zobrazovací vyšetření patří CT břicha k lokalizaci akumulace intraperitoneální tekutiny, ale vyšetření CT není z důvodu stejné denzity schopné rozlišovat mezi ChA a ascitem [2,13]. K diagnostice místa leaku je možné provedení lymfografie, která je úspěšná v 64–86 %, nebo lymfoscintigrafie (99Tc sulfid koloid s dextranem nebo albuminem) [2,14].
Incidence ChA se liší podle typu operace a rozsahu lymfadenektomie, je ovlivněna i rozdílnou definicí u jednotlivých autorů. Udává se od 1 do 9 % po radikálních onkogynekologických výkonech s pánevní a paraaortální lymfadenektomií [1,12,15], od 1 do 6,6 % po kolorektálních operacích, od 1 do 11 % po operacích pankreatu, četná je po operacích abdominální aorty atd. [1,3,9,12,13]. Jsou uváděny četné rizikové faktory – rozsáhlejší resekce a vyšší počet odebraných lymfatických uzlin, manipulace v paraaortální oblasti, invaze tumoru do retroperitonea, konkomitantní cévní resekce, chronická pankreatitida, operace po neoadjuvantní chemoterapii, ženské pohlaví [1,3,16]. Solmaz et al statisticky potvrdili, že rizikovým faktorem je odběr > 14 lymfatických paraaortálních uzlin [9]. Z hlediska rozvoje ChA považují i další autoři paraaortální lymfadenektomii za rizikovější než pelvickou lymfadenektomii [12,15].
První volbou léčby by měl být konzervativní postup, dle některých autorů je však časná chirurgická intervence dobrou alternativou, protože konzervativní léčba může trvat i několik týdnů [9,16]. Konzervativní léčbou je kombinace přísné nízkotučné diety s parenterální výživou, nebo totální parenterální výživa (TPV). Eventuálně může být do medikace přidán octreotid/somatostatin [5,9,17]. Nízkotučná dieta má vysoký obsah proteinů a obsahuje TG pouze středně dlouhého řetězce, které jsou absorbovány přímo ze střeva a transportovány do jater jako glycerol a volné mastné kyseliny, redukují produkci a tok chylu [2]. Na konzervativní léčbě je některými autory doporučeno vyčkat 4–8 týdnů a je úspěšná téměř ve 100 % případů, především při léčbě TPV, která snižuje produkci lymfy a koriguje nutriční deficit [1,2,4,7–9,12,14]. Paracentéza se provádí pouze u pacientů s významným břišním dyskomfortem a dyspnoí, tam kde není břišní drén přítomen. Cílem je úleva od symptomů, ale měla by vždy být použita v kombinaci s další konzervativní léčbou [2,9,18]. Další alternativou může být radiační terapie dutiny břišní nízkými dávkami, která může vést k jizvení a fibrotizaci v místě lymfatické píštěle. Udávané jsou dávky 1 Gy za den na paraaortální oblast, v celkové dávce 8–10 Gy [4,19]. Na toto téma bylo publikováno pouze pár článků, většinou kazuistik. (U naší pacientky však konzervativní léčba vč. radioterapie dutiny břišní vedla pouze k mírnému snížení ChA.) K intervenční radiologické metodě patří např. lymfografie s podáním lipiodolu jako tzv. terapeutické lymfografie. Lipiodol vyvolá v místě leaku zánětlivou reakci okolní tkáně [20].
K chirurgické terapii patří ligace nebo klipáž lymfatických cest a přímo místa leaku, ale i implantace peritoneovenózního shuntu a lymfatickovenózní anastomóza. Indikací k chirurgické léčbě je dle některých autorů chylózní leak > 1 l/den po > 5 dní nebo perzistující leak po > 2 týdny i přes konzervativní léčbu [2,14]. Jiní autoři doporučující vyčkat na konzervativní léčbě 4–8 týdnů [1]. Během operace může být obtížné lokalizovat místo leaku pro otok, zánětlivé či pooperační změny po předchozí operaci. Jednou z možností vizualizace je akcentace lymforey perorální aplikací tukové emulze [8]. Nebo je možné využít peroperační fluorescenční lymfografie pomocí ICG [21,22,25–27]. ICG je fluorescenční látka, která dobře prochází lymfatickými cestami a váže se na lipoproteiny v krvi. Využívá se běžně v jiných indikacích, např. k hodnocení jaterních funkcí, k angiografii v očním lékařství, ke stanovení prokrvení tkání, hledání spádových lymfatických uzlin [23,24,28]. Neměla by být použita u pacientů s alergií na jod. Nežádoucí účinky se vyskytují velmi zřídka [16]. ICG po excitaci infračerveným zářením emituje fluorescenční záření o vlnové délce přibližně 800–830 nm, a pro vizualizaci je tedy nutná infračervená kamera [16,22,23]. Výhodou je pozorovaní místa leaku v reálném čase během operačního výkonu [21]. Kamiya et al první publikovali článek o peroperační ICG lymfografii s úspěšnou detekcí místa chylózní píštěle způsobující chylothorax [21].
Vivostat je v současné době jediný na trhu dostupný systém, který je schopen vyrábět tkáňové lepidlo obsahující fibrin (event. fibrin s trombocyty) přímo z krve pacienta. Výroba tohoto lepidla je rychlá a jeho užití je vzhledem k autolognímu původu zatíženo pouze minimálním rizikem komplikací [29–31].
Závěr
Chylózní ascites je vzácnou komplikací operací dutiny břišní, ale s významným dopadem na pacienta. Léčba by měla být individuální a první volbou by měl být konzervativní postup, který má dobré výsledky u velké části pacientů. Operační řešení a ošetření místa zdroje je kvůli pooperačním a zánětlivým změnám obtížné i pro velmi zkušené chirurgy. V lokalizaci zdroje nám může pomoci peroperační ICG lymfografie.
Podpořeno MZ ČR – RVO (FNBr, 65269705).
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
MUDr. Andrea Zetelová
Chirurgická klinika
LF MU a FN Brno
Jihlavská 20
625 00 Brno
e-mail: zetelova.andrea@fnbrno.cz
Obdrženo: 7. 1. 2019
Přijato: 31. 12. 2019
Sources
1. Weniger M, D’Haese JG, Angele MK et al. Treatment options for chylous ascites after major abdominal surgery: a systematic review. Am J Surg 2016; 211 (1): 206–213. doi: 10.1016/j.amjsurg.2015.04.012.
2. Bhardwaj R, Vaziri H, Gautam A et al. Chylous ascites: a review of pathogenesis, diagnosis and treatment. J Clin Transl Hepatol 2018; 6 (1): 105–113. doi: 10.14218/JCTH.2017.00035.
3. van der Gaag NA, Verhaar AC, Haverkort EB et al. Chylous ascites after pankreaticoduodenectomy: introduction of a grading system. J Am Coll Surg 2008; 207 (5): 751–757. doi: 10.1016/j.jamcollsurg.2008.07. 007.
4. Kim SW, Kim J H. Low-dose radiation therapy for massive chylous leakage after subtotal gastrectomy. Radiat Oncol J 2017; 35 (4): 380–384. doi: 10.3857/roj.2017.00178.
5. Talluri SK, Nuthakki H, Tadakamalla A et al. Chylous ascites. N Am J Med Sci 2011; 3 (9): 438–440. doi: 10.4297/najms.2011.3438.
6. Matějka VM, Fiala O, Tupý R et al. Chylózní ascites jako závažná komplikace neuroendokrinního tumoru ilea – kazuistika. Klin Onkol 2013; 26 (5): 358–361. doi: 10.14735/amko2013358.
7. Frey MK, Ward NM, Caputo TA et al. Lymphatic ascites following pelvic and paraaortic lymphadenectomy procedures for gynecologic malignancies. Gynecol Oncol 2012; 125 (1): 48–53. doi: 10.1016/j.ygyno.2011.11.012.
8. Jelenek G, Náležinská M. Chyloperitoneum – zkušenosti z našeho pracoviště. Onkologie 2015; 9 (1): 43–45.
9. Solmaz U, Turan V, Mat E et al. Chylous ascites following retroperitoneal lymphadenectomy in gynecologic malignancies: incidence, risk factors and management. Int J Surgery 2015; 16 : 88–93. doi: 10.1016/j.ijsu.2015. 02.020.
10. Thaler MA, Bietenbeck A, Schulz C et al. Establishment of triglyceride cut-off values to detect chylous ascites and pleural effusions. Clin Biochem 2017; 50 (3): 134–138. doi: 10.1016/j.clinbiochem.2016.10.008.
11. Staats BA, Ellefson RD, Budahn LL et al. The lipoprotein profile of chylous and nonchylous pleural effusions. Mayo Clin Proc 1980; 55 (11): 700–704.
12. Han D, Wu X, Li J et al. Postoperative chylous ascites in patients with gynecologic malignancies. Int J Gynecol Cancer 2012; 22 (2): 186–190. doi: 10.1097/IGC.0b013e31 8233f24b.
13. Galanopoulos G, Konstantopoulos T, Theodorou S et al. Chylous ascites following open abdominal aortic aneurysm repair: an unusual complication. Methodist Debakey Cardiovasc J 2016; 12 (2): 119–121. doi: 10.14797/mdcj-12-2-119.
14. Lee E W, Shin JH, Ko HK et al. Lymphangiography to treat postoperative lymphatic leakage: a technical review. Korean J Radiol 2014; 15 (6): 724–732. doi: 10.3348/kjr.2014.15.6.724.
15. Zhao Y, Hu W, Hou X et al. Chylous ascites after laparoscopic lymph node dissection in gynecologic malignancies. J Minim Invasive Gynecol 2014; 21 (1): 90–96. doi: 10.1016/j.jmig.2013.07.005.
16. Matsutani T, Hirakata A, Nomura T et al. Transabdominal approach for chylorrhea after esophagectomy by using fluorescence navigation with indocyanine green. Case Rep Surg 2014; 2014 : 464017. doi: 10.1155/2014/464017.
17. Kuboki S, Shimiyu H, Yoshidome H et al. Chylous ascites after hepatopancreatobiliary surgery. Br J Surg 2013; 100 (4): 522–527. doi: 10.1002/bjs.9013.
18. Shibuya Y, Asano K, Hayasaka A et al. A novel therapeutic strategy for chylous ascites after gynecological cancer surgery: a continuous low-pressure drainage system. Arch Gynecol Obstet 2013; 287 (5): 1005–1008. doi: 10.1007/s00404-012-2666-y.
19. Brown S, Abana CO, Hammad H et al. Low-dose radiotherapy is an effective treatment for refractory post-operative chylous ascites: a case report. Radiat Oncol J 2019; 9 (3): 153–157. doi: 10.1016/j.prro.2018.12.001.
20. Alejandre-Lafont E, Krompiec Ch, Rau WS et al. Effectiveness of therapeutic lymphography on lymphatic leakage. Acta Radiol 2011; 52 (3): 305–311. doi: 10.1258/ar.2010.090356.
21. Kamiya K, Unno N, Konno H. Intraoperative indocyanine green fluorescence lymphography, a novel imaging technique to detect a chyle fistula after an esophagectomy: report of a case. Surg Today 2009; 39 (5): 421–424. doi 10.1007/s00595-008-3852-1.
22. Wada T, Kawada K, Takahashi R et al. ICG fluorescence imaging for quantitative evaluation of colonic perfusion in laparoskopic colorectal surgery. Surg Endosc 2017; 31 (10): 4184–4193. doi: 10.1007/s00464-017-5475-3.
23. Ito M, Hasegawa H, Tsukada Y. Indocyanine green fluorescence angiography during laparoscopic rectal surgery. Ann Laprosc Endosc Surg 2017; 2 (2): 7. doi: 10.21037/ales.2016.12.09.
24. Kawada K, Hasegawa S, Wada T et al. Evaluation of intestinal perfusin by ICG fluorescence imaging in laparoscopic colorectal surgery with DST anastomosis. Surg Endosc 2017; 31 (3): 1061–1069. doi: 10.1007/s00464-016-5064-x.
25. Shirotsuki R, Uchida H, Tanaka Y et al. Novel thoracoscopic navigation surgery for neonatal chylothorax using indocyanine-green fluorescent lymphography. J Pediatr Surg 2018; 53 (6): 1246–1249. doi: 10.1016/j.jpedsurg.2018.01.019.
26. Chakedis J, Shirley LA, Terando AM et al. Identification of the thoracic duct using indocyanine green during cervical lymphadenectomy. Ann Surg Oncol 2018; 25 (12): 3711–3717. doi: 10.1245/s10434-018-6690-4.
27. Chiu CH, Chao YK, Liu YH et al. Clinical use of near-infrared fluorescence imaging with indocyanine green in thoracic surgery: a literature review. J Thorac Dis 2016; 8 (Suppl 9): S744–S748. doi: 10.21037/jtd.2016. 09.70.
28. Kitai T, Inomoto T, Miwa M et al. Fluorescence navigation with indocyanine green for detecting sentinel lymph nodes in breast cancer. Breast Cancer 2005; 12 (3): 211–215. doi: 10.2325/jbcs.12.211.
29. Moračík P, Hlavsa J, Kala Z et al. Platelet rich fibrin sealant Vivostat in pancreatic surgery. Pancreatology 2018; 18 (4): S62. doi: 10.1016/j.pan.2018.05.165.
30. Lassen MR, Solgaard S, Kjersgaard AG et al. A pilot study of the effects of vivostat patient-derived fibrin sealant in reducing blood loss in primary hip arthroplasty. Clin Appl Thromb Hemost 2006; 12 (3): 352–357. doi: 10.1177/1076029606291406.
31. Belcher E, Dusmet M, Jordan S et al. A prospective, randomized trial comparing BioGlue and Vivostat for the control of alveolar air leak. J Thorac Cardiovasc Surg 2010; 140 (1): 32–38. doi: 10.1016/j.jtcvs.2009.11.064.
Labels
Paediatric clinical oncology Surgery Clinical oncology
Article was published inClinical Oncology

2020 Issue 2-
All articles in this issue
- Pohybová liečba ako prevencia a podporná liečba onkologických ochorení
- Využití extrakraniální stereotaktické radioterapie při oligometastatickém postižení lymfatických uzlin
- HPV 16 v patogenéze nádorov horného aerodigestívneho traktu
- Invazívna rino-orbito-cerebrálna forma mukormykózy u detskej pacientky s akútnou leukémiou
- Využití indocyaninové zeleně k peroperační diagnostice zdroje chylózního ascitu a autologního tkáňového lepidla (Vivostatu) k jeho ošetření
- Protirakovinný účinek melatoninu s radioprotektivní a radiosenzitivní vlastností
- Karcinom děložního hrdla
- Léčba karcinomu hrdla děložního s postižením paraaortálních uzlin – retrospektivní hodnocení vlastního souboru
- Aktuality z odborného tisku
- Vzpomínka na prof. RNDr. M. Lokajíčka, DrSc.
- Účinek kapecitabinu v léčbě triple negativního karcinomu prsu
- Metformin v onkologii – jak daleko jsme od jeho etablování coby protinádorového léku?
- Asociace polymorfizmu NAD (P) H chininové oxidoreduktázy 1 rs1800566 s karcinomem močového měchýře a prostaty – systematický přehled a metaanalýza
- Clinical Oncology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Karcinom děložního hrdla
- Pohybová liečba ako prevencia a podporná liečba onkologických ochorení
- HPV 16 v patogenéze nádorov horného aerodigestívneho traktu
- Metformin v onkologii – jak daleko jsme od jeho etablování coby protinádorového léku?
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

