-
Medical journals
- Career
Léčba karcinomu hrdla děložního s postižením paraaortálních uzlin – retrospektivní hodnocení vlastního souboru
Authors: Zdeňka Pechačová 1; Emanuela Kmoníčková 1; Iva Křepelková 1; Katarína Adamová Maczvalda 1; Věra Tomancová 1,2; Ferdinand Třebický 1; Zdenka Weitoschová 1; Michal Zikán 3
Authors‘ workplace: Ústav radiační onkologie, 1. LF UK a Nemocnice Na Bulovce, Praha 2 Onkologická klinika 1. LF UK a VFN v Praze 3 Gynekologicko-porodnická klinika 1. LF UK a Nemocnice Na Bulovce, Praha 1
Published in: Klin Onkol 2020; 33(2): 123-131
Category: Original Articles
doi: https://doi.org/10.14735/amko2020123Overview
Východiska: Cílem sdělení je retrospektivní analýza výsledků léčby a toxicity v souboru pacientek s karcinomem hrdla děložního se vstupním metastatickým postižením paraaortálních lymfatických uzlin (PALU), které v Ústavu radiační onkologie Nemocnice Na Bulovce v Praze v letech 2005–2017 podstoupily kombinovanou (chemo) radioterapii.
Soubor pacientek a metody: V uvedeném období bylo na pracovišti léčeno přes 800 pacientek s karcinomem hrdla děložního. Synchronní metastatické postižení limitované na oblast PALU bylo potvrzeno u 85 (10,6 %) pacientek. Kombinovanou (chemo) radioterapii s radikálním záměrem podstoupilo 57 (67,1 %) pacientek, paliativní radioterapie byla provedena u 26 (30,6 %) pacientek. Medián doby sledování v celém souboru je 24 měsíců.
Výsledky: Ve skupině 57 pacientek léčených s radikálním záměrem podstoupily všechny pacientky zevní ozáření (external beam radiation therapy – EBRT) na oblast pánve a PALU, brachyterapie (BRT) byla aplikována u 55 (96,5 %) pacientek, konkomitantní chemoterapie (CHT) cDDP 1× týdně byla podávána u 17 (29,8 %) pacientek. Akutní toxicita G3–4 dle kritérií RTOG (Radiation Therapy Oncology Group) byla zaznamenána u 7 (12,3 %) pacientek, pozdní toxicita G3–4 u 7 (12,3 %) pacientek. Management léčby nežádoucích účinků probíhá v multidisciplinárních týmech. V podskupině pacientek léčených kombinací EBRT + BRT + CHT bylo dosaženo mediánu doby do progrese (progression-free survival – PFS) 37,3 měsíce a celkového přežití (overall survival – OS) 39,2 měsíce, Kaplan-Meierův odhad přežití v 5 letech je 46,8 %. V podskupině léčené EBRT + BRT byl zjištěn medián PFS 22,7 měsíce, medián OS 30,3 měsíce, odhad přežití v 5 letech je 38,6 %.
Závěr: Kombinovaná (chemo) radioterapie u pokročilého karcinomu děložního hrdla vstupně s metastázami do PALU potvrdila v našem souboru pacientek významný benefit v PFS a OS. Zastoupení akutní i pozdní toxicity je akceptovatelné a pro dosažení maximálního léčebného přínosu je nezbytná multidisciplinární podpůrná léčba.
Klíčová slova:
karcinom děložního hrdla – metastázy – radioterapie – chemoradioterapie – brachyterapie – paliativní péče – podpůrná léčba
Úvod
Karcinom hrdla děložního patří k častým nádorovým onemocněním, a i přes možnosti screeningu je často diagnostikován v pokročilém stadiu. Dle dostupných údajů je ve stadiu IV diagnostikováno přibližně 10 % případů [1]. Pacientky se vstupním metastatickým postižením paraaortálních lymfatických uzlin (PALU) mají být dle doporučených postupů ESGO (European Society of Gynaecological Oncology) léčeny s radikálním záměrem kombinovanou (chemo) radioterapií [2,3], přínos tohoto léčebného postupu byl opakovaně potvrzen – multimodální léčba vč. konkomitantní chemoterapie (CHT) vedla k signifikantnímu zlepšení léčebných výsledků [4–7]. Cílem předkládaného sdělení je retrospektivní analýza výsledků léčby a toxicity v souboru pacientek Ústavu radiační onkologie Nemocnice Na Bulovce v Praze. V letech 2005–2017 bylo na pracovišti léčeno přes 800 pacientek s karcinomem hrdla děložního, synchronní postižení PALU bylo potvrzeno u 85 (10,6 %) pacientek.
Soubor pacientek a metody
Do vyhodnocení bylo zahrnuto celkem 85 pacientek, u nichž bylo vstupně zjištěno metastatické postižení limitované na oblast PALU dle zobrazovacích metod nebo na podkladě výsledků laparoskopické paraaortální lymfadenektomie – dříve stadium FIGO IVB, dle revize z roku 2019 stadium FIGO IIIC2 [3,8]. Základní charakteristiky souboru shrnuje tab. 1. Věk pacientek v době diagnózy byl v rozmezí 28–81 let, medián 58,8 roku, většinou se jednalo o ženy ve velmi dobrém klinickém stavu – performance status dle ECOG (Eastern Cooperative Oncology Group) byl stanoven na stupni 0–1 ve > 90 % případů. Histologicky se jednalo v 91 % o spinocelulární karcinom, stupeň diferenciace většinou G2–3. Vstupní hodnota nádorového markeru SCCA byla k dispozici u 39 (45,9 %) pacientek, což je dáno zejména časovým rozsahem souboru. Zvýšená hladina tohoto nádorového markeru byla zjištěna u 31 (79,5 %) pacientek, normální hodnoty markeru byly stanoveny u 8 (20,5 %) pacientek. V zastoupení TNM stadií převažovalo stadium T2bN1M1, které bylo zjištěno u 50 (58,8 %) pacientek, nicméně výrazně byly zastoupeny i lokálně pokročilejší nálezy T3 a T4. Celkem 13 pacientek se zjištěnou hydronefrózou bylo odesláno před zahájením léčby na urologické vyšetření k zajištění derivace moči – 4 pacientky podstoupily zavedení stentu do ureteru, u 7 pacientek byla založena nefrostomie.
Table 1. Charakteristika souboru pacientek (N = 85). 
G – stupeň diferenciace nádoru, PALU – paraaortální lymfatické uzliny, TNM – klasifi - kace zhoubných novotvarů, SCCA – antigen skvamózních buněk, nádorový marker Léčbu s radikálním záměrem podstoupily více než dvě třetiny pacientek v souboru – kombinovaná (chemo) radioterapie s radikálním záměrem byla provedena u 57 (67,1 %) pacientek. Léčbu s paliativním záměrem podstoupilo 26 (30,6 %) pacientek a u 2 (2,4 %) pacientek neproběhla žádná léčba z důvodu rychlého zhoršování stavu před zahájením léčby.
Pacientky léčené s kurativním záměrem podstoupily kombinovanou terapii dle standardů Ústavu radiační onkologie Nemocnice Na Bulovce v Praze – zevní ozáření (external beam radiation therapy – EBRT), intrakavitární brachyterapie uterovaginálním aplikátorem, konkomitantní CHT. EBRT je prováděna na oblast pánve a PALU v dávce 44 Gy ve 22 frakcích po 2 Gy, následuje pokračování v radioterapii zmenšeným objemem na oblast pánevních uzlin a parametrií do celkové dávky 54–60 Gy normofrakcionovaně po 2 Gy na frakci. Ve sledovaném období byla používána technika 3D konformní radioterapie (three-dimensional conformal radiation therapy – 3D-CRT). Brachyterapie (BRT) byla provedena v letech 2005–2006 formou nízkodávkové (low dose rate – LDR) BRT ve 2 frakcích v celkové dávce 35 Gy v bodě A, následně v letech 2007–2017 byla aplikována vysokodávková (high dose rate –HDR) BRT v dávce 24 Gy v bodě A ve 4 frakcích (ekvivalent LDR BRT 35,8 Gy). Plánování BRT probíhá ve 2D na podkladě rentgenových snímků ve dvou kolmých projekcích. Konkomitantně byla podávána CHT cDDP (cisplatina) v dávce 40 mg/m2 1× týdně ve čtyřech až pěti cyklech.
Pacientky léčené s paliativním záměrem podstoupily zevní radioterapii – rozsah cílového objemu a frakcionační schéma byly voleny individuálně dle stavu pacientky, rozsahu onemocnění a léčebného záměru. U pacientek únosných k intenzivnější léčbě byla aplikována zevní radioterapie na oblast pánve a PALU v dávce 44 Gy normofrakcionovaně s pokračováním na oblast tumoru, pánevních lymfatických uzlin a parametrií až do celkové dávky 50–60 Gy. U pacientek v celkově horším stavu byla aplikována paliativní dávka na oblast pánve, popř. pouze na oblast tumoru a lymfatických uzlin s užitím různých frakcionačních schémat (25 × 2 Gy, 10 × 3 Gy, 1 × 8 Gy apod.) za účelem paliativního efektu a zmírnění symptomů, zejména bolesti nebo krvácení.
Akutní a pozdní toxicita byla vyhodnocována dle kritérií RTOG (Radiation Therapy Oncology Group) [9]. Pro statistické zpracování dat byla užita Kaplan-Meierova metoda a log-rank test.
Výsledky
Medián doby sledování v celém souboru pacientek se vstupním metastatickým postižením PALU je 24 měsíců. Medián přežití bez progrese (progression-free survival – PFS) dosáhl 14,7 měsíce, medián celkového přežití (overall survival – OS) byl v celém souboru 24,3 měsíce.
Ve skupině 57 pacientek léčených s radikálním záměrem byla provedena kombinovaná léčba dle standardů pracoviště. Charakteristiku podsouboru shrnuje tab. 2. Všechny pacientky podstoupily EBRT na oblast pánve a PALU, BRT byla aplikována u 55 (96,5 %) pacientek – LDR BRT u 5 (8,8 %) pacientek, u ostatních 50 (87,7 %) pacientek byla použita HDR BRT. U 2 (3,5 %) pacientek kontraindikovaných k provedení BRT byl aplikován boost zevní radioterapií do celkové dávky 72–78 Gy na oblast tumoru. Konkomitantní CHT byla podávána u 17 (29,8 %) pacientek.
Table 2. Pacientky léčené s radikálním záměrem (N = 57). 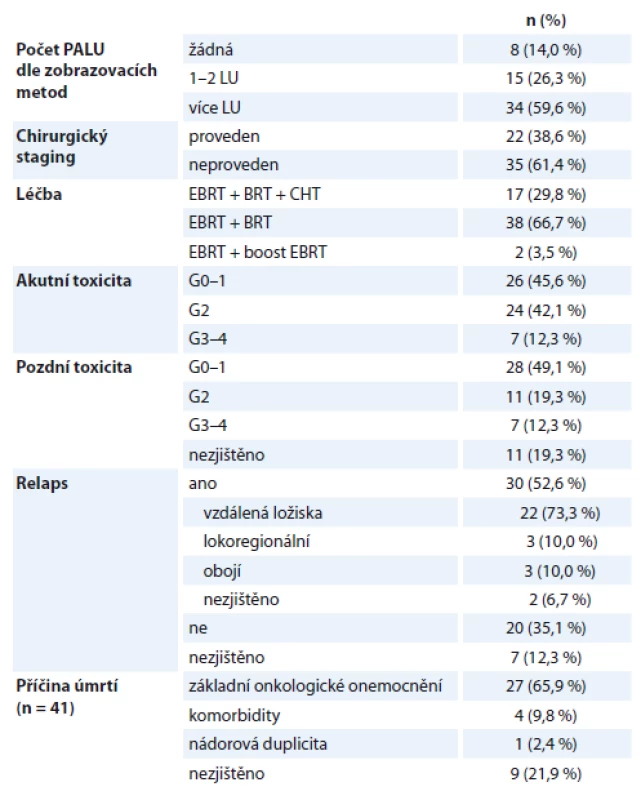
PALU – paraaortální lymfatické uzliny, LU – lymfatické uzliny, EBRT – zevní radioterapie na oblast pánve a paraortálních uzlin, BRT – brachyterapie, CHT – konkomitantní chemoterapie cDDP 1× týdně, G – stupeň toxicity léčby dle kritérií Radiation Therapy Oncology Group Akutní toxicita byla v našem souboru dobře zvládnutelná – většinou stupeň G0–2 (gastrointestinální trakt (GIT): mírné nechutenství, nauzea, břišní dyskomfort, častější stolice, mírné průjmy; urogenitální trakt (GU): mírnější polakisurie, dysurie, nykturie, urgentní močení; hematologická toxicita: mírný pokles krevních elementů) dle kritérií RTOG, nežádoucí účinky v intenzitě G3 (GIT: výrazné nechutenství a zvracení se ztrátou hmotnosti >15 % a nutnost výživy nazogastrickou sondou nebo parenterálně, hematemeza, subileus; GU: polakisurie s frekvencí < 1,0 hod, výraznější dysurie, nykturie, hematurie; výraznější hematologická toxicita) byly zaznamenány u 7 (12,3 %) pacientek, toxicita stupně 4 (GIT: ileus, perforace, krvácení vyžadující převod erymas; GU: hematurie vyžadující převod erymas, obstrukce, ulcerace, nekróza) se nevyskytla (graf 1). Pacientky s významnější akutní toxicitou byly během léčby hospitalizovány k podpůrné léčbě, aby bylo možné dokončit kurativní léčbu dle plánu. EBRT byla kompletně dokončena u všech pacientek, BRT byla nekompletní u 4 pacientek (2 pacientky – 3 frakce HDR BRT, 1 pacientka – 2 frakce HDR BRT, 1 pacientka – 1 frakce HDR BRT), konkomitantní CHT byla nekompletní u 2 pacientek, celkem podstoupilo kompletní plánovanou radikální léčbu 53 (93,0 %) pacientek.
Graph 1. Akutní toxicita radikální (chemo)radioterapie (N = 57). 
G – stupeň toxicity léčby dle kritérií Radiation Therapy Oncology Group, GIT – gastrointestinální trakt, GU – urogenitální trakt Pozdní toxicita je vyhodnocována při pravidelných kontrolách po léčbě, většina pacientek měla dobře zvládnutelné projevy G0–2 (GIT: mírné průjmy nebo křeče, častější stolice, krvácení mírné intenzity; GU: epiteliální atrofie, častější močení, intermitentní hematurie) dle RTOG kritérií. Toxicita vyššího stupně G3–4 (GIT: ileus, krvácení vyžadující chirurgickou intervenci, perforace, píštěl; GU: velmi časté močení a dysurie, hematurie, nekróza, svráštělý močový měchýř, hemorrhagická cystitida) byla zaznamenána u 7 (12,3 %) pacientek většinou v odstupu 12–24 měsíců po ukončení léčby. V souladu s poznatky o radiosenzitivitě orgánových systémů se toxicita v oblasti dolního gastrointestinálního traktu vyskytla mírně častěji a dříve než v oblasti urogenitálního traktu (graf 2).
Graph 2. Pozdní toxicita radikální (chemo)radioterapie (N = 57) – zastoupení nežádoucích účinků dle odstupu od provedené léčby. 
G – stupeň toxicity léčby dle kritérií Radiation Therapy Oncology Group, GIT – gastrointestinální trakt, GU – urogenitální trakt Medián doby sledování v podskupině 57 pacientek léčených s radikálním záměrem byl 34,5 měsíce. Během sledování byl zjištěn relaps onemocnění u 30 (52,6 %) pacientek, ve 22 (73,3 %) případech se jednalo o vzdálená metastatická ložiska, izolovaná lokoregionální recidiva byla zjištěna u 3 (10,0 %) pacientek a u dalších 3 (10,0 %) pacientek došlo k rozvoji relapsu současně lokoregionálně i ve vzdálených lokalizacích. Ve sledovaném období zemřelo 41 (71,9 %) pacientek v této podskupině, příčinou úmrtí byla většinou progrese základního onemocnění (tab. 2).
Hodnoty mediánu PFS a OS v jednotlivých podskupinách pacientek dle rozsahu provedené léčby shrnuje tab. 3, Kaplan-Meierovy křivky PFS a OS dle provedené léčby znázorňuje graf 3.
Graph 3. Kaplan-Meierovy křivky parametrů přežití dle typu provedené léčby. 
PFS – doba do progrese, OS – celkové přežití, EBRT – zevní radioterapie na oblast pánve a paraortálních uzlin, BRT – brachyterapie, CHT – konkomitantní chemoterapie cDDP 1× týdně, Gy – Gray Je zřejmý trend prodloužení PFS i OS při zařazení BRT do léčebného schématu při srovnání výsledků léčby pacientek léčených kombinovanou radioterapií (EBRT + BRT) a podskupiny pacientek léčených pouze EBRT v dávce 56–60 Gy – medián PFS 22,7 vs. 10,9 měsíce (p = 0,15), medián OS 30,3 vs. 17,3 měsíce (p = 0,12). Přínos v parametrech PFS i OS byl zaznamenán ve skupině pacientek léčených kombinací EBRT + BRT + CHT ve srovnání se skupinou pacientek léčených pouze EBRT + BRT bez CHT, rozdíly však nejsou v našem souboru statisticky významné (PFS 37,3 vs. 22,7 měsíce, p = 0,48; OS 39,2 vs. 30,3 měsíce, p = 0,68).
Statisticky významný benefit pro PFS a OS byl v našem souboru potvrzen při srovnání podsouboru pacientek léčených radikálně kombinací EBRT + BRT + CHT ve srovnání s paliativní podskupinou pacientek léčených EBRT dávkou 50 Gy a nižší (PFS 37,3 vs. 7,4 měsíce; p < 0,005; OS 39,2 vs. 10,4 měsíce; p < 0,005), dále je statisticky významný benefit kombinace EBRT + BRT ve srovnání se stejnou paliativní podskupinou (PFS 22,7 vs. 7,4 měsíce; p < 0,005; OS 30,3 vs. 10,4 měsíce; p < 0,005).
V podskupině 22 (38,6 %) pacientek, které podstoupily laparoskopickou lymfadenektomii (LPSK LAE) pánevních a paraaortálních uzlin, nebyl zaznamenán odklad zahájení kombinované (chemo) radioterapie z důvodu komplikací chirurgického stagingového výkonu. Přehled parametrů přežití v podskupinách dle indikace LPSK LAE shrnuje tab. 4. Podskupina pacientek, které podstoupily chirurgický staging, vykazuje mírně lepší parametry ve srovnání s podskupinou bez LPSK LAE. Při srovnání výsledků v podskupinách dle provedení/neprovedení chirurgického stagingu a podání/nepodání konkomitantní CHT se v našem souboru jeví jako nejpřínosnější kombinace neprovedení chirurgického stagingu a následné přidání konkomitantní CHT ke kombinované radioterapii, nicméně jedná se o malé podskupiny pacientek a rozdíly parametrů jsou statisticky zcela nevýznamné.
Table 3. Parametry přežití dle provedené léčby 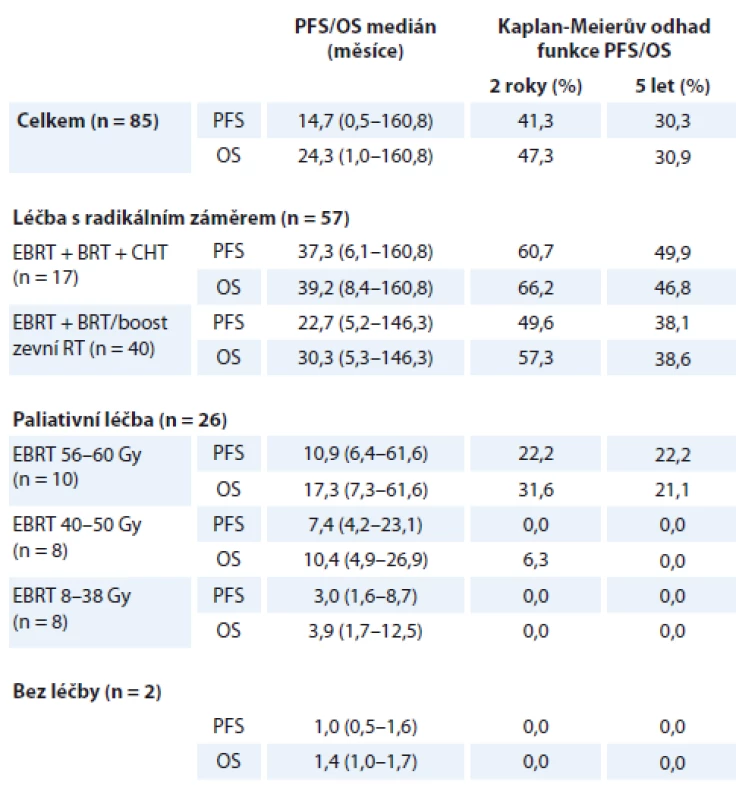
PFS – doba do progrese, OS – celkové přežití, EBRT – zevní radioterapie na oblast pánve a paraortálních uzlin, BRT – brachyterapie, CHT – konkomitantní chemoterapie cDDP 1× týdně, RT – radioterapie, Gy – Gray Table 4. Parametry přežití dle provedení chirurgického stagingu a kombinace primární léčby (N = 57). 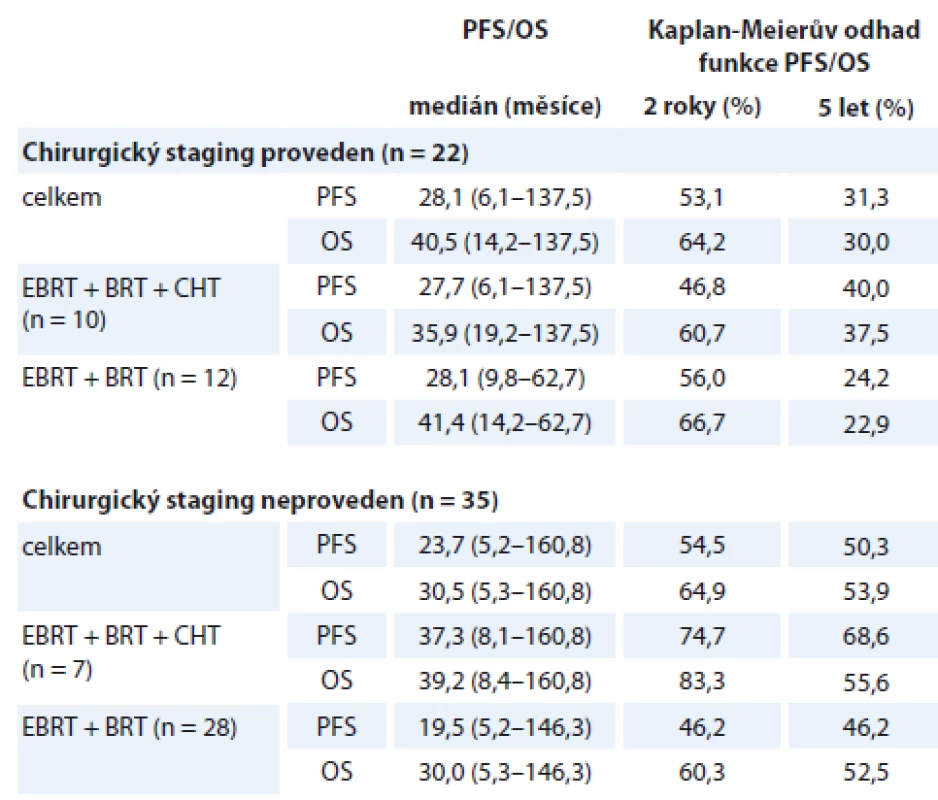
PFS – doba do progrese, OS – celkové přežití, EBRT – zevní radioterapie na oblast pánve a paraortálních uzlin, BRT – brachyterapie, CHT – konkomitantní chemoterapie cDDP 1× týdně Léčbu s paliativním záměrem podstoupilo 26 (30,6 %) pacientek. Paliativní radioterapie potvrdila v našem souboru pacientek dobrý efekt v kontrole symptomů i přínos pro přežití při aplikaci vyšší dávky záření (tab. 3, graf 3) – při srovnání podskupin pacientek ozářených paliativní dávkou v rozmezích 56–60 Gy a 8–38 Gy je statisticky významný přínos pro PFS (10,9 vs. 3,0 měsíce, p = 0,003) i OS (17,3 vs. 3,9 měsíce, p < 0,005).
Diskuze
Kombinovaná radioterapie představuje základní léčebnou metodu lokálně pokročilého karcinomu hrdla děložního již po několik desetiletí. Přínos konkomitantní CHT byl opakovaně prokázán, kombinovaná chemoradioterapie se stala široce užívanou metodou v léčbě tohoto onemocnění a je také doporučena odbornými společnostmi [2,4,5]. Ve studiích zaměřených na léčbu pokročilého karcinomu hrdla děložního bývá zřídka zastoupeno stadium FIGO IIIC2 s metastatickým postižením limitovaným na oblast PALU a je k dispozici jen velmi málo klinických studií přímo cílených na tuto podskupinu pacientek. Postižení PALU je spojeno s horší prognózou pacientek, a i přes možnosti kombinované terapie nejsou léčebné výsledky uspokojivé. Dostupná literární data prokazují přínos kombinované (chemo) radioterapie pro tuto podskupinu [6,7,10,11], ale s ohledem na časté relapsy se jeví jako potenciálně přínosné přidání další systémové léčby ke kombinované chemoradioterapii [12]. Studie zaměřené na hodnocení přínosu adjuvantní CHT po primární chemoradioterapii u lokálně pokročilého karcinomu hrdla děložního aktuálně probíhají, dosud publikované výsledky nejsou jednoznačné a závěry velkých multicentrických studií jsou očekávány [12]. Přidání adjuvantní systémové léčby po primární chemoradioterapii je v současné době dle ESGO guidelines doporučeno pro metastatické postižení limitované na oblast levostranných nadklíčkových lymfatických uzlin [2]. Probíhá výzkum nových prognostických a prediktivních faktorů, které by umožnily přesnější odhad rizika šíření mimo primární lokalizaci a mohly by přispět k individualizaci multimodální léčby [13].
Pacientky v našem souboru podstoupily vstupní stagingová vyšetření v různých kombinacích dle aktuálně platných doporučení, dle indikace lékaře i dle dostupnosti – expertní onkogynekologický ultrazvuk [14], výpočetní tomografii, pozitronovou emisní tomografii / výpočetní tomografii (positron emission tomography / computed tomography – PET/CT), magnetickou rezonanci [15]. V podsouboru 57 pacientek léčených s radikálním záměrem podstoupilo LPSK LAE pánevních a paraaortálních uzlin 22 (38,6 %) pacientek. U 8 (14,0 %) pacientek z této podskupiny přitom nebylo vstupně vysloveno podezření na nádorovou infiltraci PALU dle zobrazovacích metod a četnost falešné negativity zde koresponduje s publikovanými daty pro oblast PALU – v literatuře bývá uváděna četnost falešně negativních PET/CT nálezů v této oblasti přibližně 12 % [16,17]. Na podkladě výsledků analýzy souboru Margulies et al [16] je zřejmé, že díky vysoké specificitě PET/CT s 18-fluorodeoxyglukózou (FDG-PET/CT) je možné při potvrzení akumulujících PALU vynechat provedení chirurgického stagingu. FDG-PET/CT je však málo senzitivní, proto není možné toto vyšetření použít jako alternativu ke stagingové laparoskopické lymfadenektomii, pokud je nález negativní. V případě absence akumulujících uzlin v pánvi dle FDG-PET/CT je dle dostupných dat pravděpodobnost nádorové infiltrace PALU poměrně nízká, 3–8 % [16,18], a o přínosu LPSK LAE jsou dále vedeny diskuze.
Pro zlepšení léčebných výsledků je přínosné zařazení nových technik radioterapie – radioterapie s modulovanou intenzitou (Intensity-Modulated Radiation Therapy – IMRT) a její novější varianta, objemově modulovaná radioterapie (Volumetric Modulated Arc Therapy – VMAT), které umožňují aplikaci vyšší dávky záření do definovaných oblastí cílového objemu za současného šetření zdravých tkání – je tak umožněno navýšení dávky až do 60 Gy na oblast postižených lymfatických uzlin v pánvi a paraaortálně bez většího zatížení kliček tenkého střeva. Při užití těchto metod je nezbytná precizní konturace cílového objemu i přesné denní nastavení pacientek s užitím obrazem řízené radioterapie (Image Guided Radiation Therapy – IGRT) k dosažení lepší lokální kontroly onemocnění se zachováním přijatelné toxicity léčby [19,20]. Ve sledovaném období byla v Ústavu radiační onkologie Nemocnice Na Bulovce v Praze užívána pro léčbu gynekologických tumorů technika 3D-CRT, v současné době je již užívána technika VMAT s využitím IGRT. I za těchto okolností je zastoupení toxicity v našem souboru zejména v oblasti gastrointestinálního traktu akceptovatelné a dobře srovnatelné s publikovanými literárními údaji, kde byla navíc pro radioterapii užívána již technika IMRT [6,21]. Pro doručení dostatečně účinné dávky na oblast primárního tumoru hrdla děložního zůstává nezbytná BRT, která zaručuje největší přínos – boost pomocí různých technik zevní radioterapie vykazuje dle dostupných dat výrazně horší výsledky [22]. Pro aplikaci dostatečné dávky na oblast parametrií jsou užívány různé techniky dle možností a zvyklostí pracovišť – Marnitz et al [6] ve svém souboru 44 pacientek s karcinomem hrdla děložního s metastatickým postižením PALU léčených kombinovanou chemoradioterapií použila simultánní integrovaný boost na oblast parametrií v celkové dávce 59,36 Gy ve 28 frakcích po 2,12 Gy, na našem pracovišti byl boost na oblast parametrií aplikován ve druhé fázi ozařování normofrakcionovaně v dávce 2 Gy/frakci. Lokoregionální kontrola onemocnění je v našem souboru srovnatelná se souborem pacientek Marnitz et al [6] – lokoregionální relaps byl zjištěn u 6 ze 44 pacientek (13,6 %), v našem souboru u 6 z 57 pacientek (10,5 %).
V našem souboru pacientek je zřejmý přínos intenzivnější multimodální léčby pro OS i PFS – jedná se o retrospektivní analýzu souboru jednoho pracoviště, je tedy obtížné hodnotit statistickou významnost přínosu jednotlivých léčebných modalit i z důvodu malého počtu pacientek. Statisticky významný přínos v PFS a OS byl prokázán při srovnání radikálně léčených pacientek s pacientkami léčenými paliativně, ale v souladu s výsledky rozsáhlejších výzkumů [4,5] je z našich výsledků zřejmý jednoznačný trend přínosu v PFS, OS i odhadu 5letého přežití u přidání BRT i přidání CHT do léčebného schématu (tab. 3, graf 3). Delší PFS i OS ve skupině pacientek léčených kombinovanou chemoradioterapií ve srovnání se skupinou pacientek léčených kombinovanou radioterapií bez CHT má zřejmě komplexní důvody – jednalo se o prognosticky příznivější skupinu pacientek (celkově lepší stav, menší zatížení komorbiditami, méně rozsáhlá masa nádorového postižení).
Kombinovaná (chemo) radioterapie karcinomu hrdla děložního přináší pacientkám také řadu nežádoucích účinků daných principem prováděné terapie a vlivem jednotlivých léčebných modalit na orgánové systémy. Podpůrná léčba je obecně nedílnou součástí onkologické léčby – projevy akutní i pozdní toxicity je vhodné aktivně zjišťovat a poskytovat podpůrnou léčbu současně s kurativní i paliativní protinádorovou léčbou [23–25]. Podpůrná léčba je nezbytná pro dosažení maximálního léčebného přínosu, k minimalizaci dyskomfortu způsobeného léčbou a k zajištění dobré kvality života pacientů v průběhu léčby i během dalšího sledování, což platí obecně pro kurativní i paliativní onkologickou léčbu – rovnováha protinádorové, podpůrné a paliativní léčby se v průběhu onemocnění mění podle odpovědi na onkologickou léčbu a klinického stavu pacienta [23,26,27]. Pro dosažení optimálního managementu symptomů je vhodné rozhodování v rámci mezioborového týmu se zapojením odborníků různých specializací dle rizika rozvoje nežádoucích efektů léčby [23,28] – v případě kombinované léčby karcinomu hrdla děložního musí být zapojen klinický a radiační onkolog, onkogynekolog, radiodiagnostik, urolog, gastroenterolog, proktolog, nutriční specialista, klinický farmakolog, klinický psycholog, paliatr a další specializace. Na našem pracovišti je s komplexní podpůrnou léčbou dlouhodobě dobrá zkušenost [29,30] – nežádoucí účinky se během léčby nebo sledování vyskytují v uvedené míře srovnatelné s literárními údaji [6,10,11,31,32], ale s využitím intenzivní multidisciplinární podpůrné terapie je vliv na kvalitu života pacientek velmi malý a dobře akceptovatelný.
Paliativní radioterapie přináší obecně benefit pacientům s pokročilým nebo metastatickým nádorovým onemocněním – jedná se o účinnou, efektivní a relativně snadno proveditelnou metodu, která má své pevné místo v rámci komplexní paliativní péče v onkologii [23] a je vhodné ji využívat i v případě pokročilého karcinomu hrdla děložního a dalších gynekologických tumorů [33].
Rozvaha o rozsahu cílového objemu a užitém frakcionačním schématu je individuální dle rozsahu onemocnění, stavu pacientky a léčebného záměru – ozařovací schéma volíme tak, aby přineslo rychlý efekt při nízké akutní toxicitě a akceptovatelném riziku pozdních nežádoucích účinků s přihlédnutím k očekávané délce života pacientky. Léčebné výsledky u podskupiny pacientek, které byly v našem souboru léčeny s paliativním záměrem, potvrzují v souladu s literárními údaji významnou roli paliativní radioterapie u této gynekologické malignity.
Závěr
Kombinovaná (chemo) radioterapie u pokročilého karcinomu děložního hrdla vstupně s metastázami do PALU přináší významný benefit v PFS a OS, což potvrzují i výsledky v souboru pacientek léčených na našem pracovišti. Zastoupení akutní i pozdní toxicity je akceptovatelné. Vzhledem k náročnosti kombinované radikální léčby je pro dosažení maximálního léčebného přínosu nezbytná intenzivní multidisciplinární podpůrná léčba.
Statistické zpracování výsledků léčby ve vlastních souborech pacientů považujeme za důležité k vyhodnocení efektu i kvality terapie prováděné na daném pracovišti. Předkládané hodnocení souboru pacientek Ústavu radiační onkologie Nemocnice Na Bulovce v Praze je svým rozsahem unikátní a léčebné výsledky jsou dobře srovnatelné s daty publikovanými v renomované zahraniční literatuře.
Podpořeno Ústavem radiační onkologie, Nemocnice Na Bulovce, Praha.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
MUDr. Zdeňka Pechačová
Ústav radiační onkologie
1. LF UK a Nemocnice Na Bulovce
Budínova 67/2
180 81 Praha 8
e-mail: zdenka.pechacova@bulovka.cz
Obdrženo: 30. 11. 2019
Přijato: 31. 12. 2019
Sources
1. Dušek L, Mužík J, Kubásek M et al. Epidemiologie zhoubných nádorů v České republice. [online]. Dostupné z: http: //www.svod.cz.
2. Cibula D, Pötter R, Planchamp F et al. The European Society of Gynaecological Oncology/European Society for Radiotherapy and Oncology/European Society of Pathology guidelines for the management of patients with cervical cancer. Int J Gynecol Cancer 2018; 28 (4): 641–655. doi: 10.1097/IGC.0000000000001216.
3. Sehnal B, Kmoníčková E, Sláma J. Současný FIGO staging karcinomu děložního hrdla a léčba jednotlivých stadií. Klin Onkol 2019; 32 (3): 224–231. doi: 10.14735/amko2019224.
4. Chemoradiotherapy for Cervical Cancer Meta-analysis Collaboration. Reducing uncertainties about the effects of chemoradiotherapy for cervical cancer: individual patient data meta-analysis. Cochrane Database Syst Rev 2010; (1): CD008285. doi: 10.1002/14651858.CD008 285.
5. Green JA, Kirwan JM, Tierney JF et al. Survival and recurrence after concomitant chemotherapy and radiotherapy for cancer of the uterine cervix: a systematic review and meta-analysis. Lancet 2001; 358 (9284): 781–786. doi: 10.1016/S0140-6736 (01) 05965-7.
6. Marnitz S, Schram J, Budach V et al. Extended field chemoradiation for cervical cancer patients with histologically proven paraaortic lymph node metastases after laparaoscopic lymphadenectomy. Strahlenther Onkol 2015; 191 (5): 421–428. doi: 10.1007/s00066-014-07 85-z.
7. Kim HS, Kim T, Lee ES et al. Impact of chemoradiation on prognosis in stage IVB cervical cancer with distant lymphatic metastasis. Cancer Res Treat 2013; 45 (3): 193–201. doi: 10.4143/crt.2013.45.3.193.
8. Bhatla N, Berek JS, Cuello Fredes M et al. Revised FIGO staging for carcinoma of the cervix uteri. Int J Gynaecol Obstet 2019; 145 (1): 129–135. doi: 10.1002/ijgo.12 749.
9. Cox JD, Stetz J, Pajak TF. Toxicity criteria of the Radiation Therapy Oncology Group (RTOG) and the European Organization for Research and Treatment of Cancer (EORTC). Int J Radiat Oncol Biol Phys 1995; 31 (5): 1341–1346. doi: 10.1016/0360-3016 (95) 00060-C.
10. Chantalat E, Vidal F, Leguevaque P et al. Cervical cancer with paraaortic involvement: do patients truly benefit from tailored chemoradiation therapy? A retrospective study on 8 French centers. Eur J Obstet Gynecol Reprod Biol 2015; 193 : 118–122. doi: 10.1016/j.ejogrb.2015.07. 017.
11. Kim JY, Kim JY, Kim JH et al. Curative chemoradiotherapy in patients with stage IVB cervical cancer presenting with paraortic and left supraclavicular lymph node metastases. Int J Radiat Oncol Biol Phys 2012; 84 (3): 741–747. doi: 10.1016/j.ijrobp.2012.01.070.
12. Gupta S. Adjuvant chemotherapy in locally advanced cervical cancer: the ceiling remains unbroken. J Gynecol Oncol 2019; 30 (4): e97. doi: 10.3802/jgo.2019.3 0.e97.
13. Mouková L, Nenutil R, Fabián P et al. Prognostické faktory karcinomu děložního hrdla. Klin Onkol 2013; 26 (2): 83–90. doi: 10.14735/amko201383.
14. Fischerova D, Cibula D, Stenhova H et al. Transrectal ultrasound and magnetic resonance imaging in staging of early cervical cancer. Int J Gynecol Cancer 2008; 18 (4): 766–772. doi: 10.1111/j.1525-1438.2007.01072.x.
15. Haldorsen IS, Lura N, Blaakær J et al. What is the role of imaging at primary diagnostic work-up in uterine cervical cancer? Curr Oncol Rep 2019; 21 (9): 77. doi: 10.1007/s11912-019-0824-0.
16. Margulies AL, Peres A, Barranger E et al. Selection of patients with advanced-stage cervical cancer for para-aortic lymphadenectomy in the era of PET/CT. Anticancer Res 2013; 33 (1): 283–286.
17. Rose PG. Using positron emission tomography imaging for maximum benefit in locally advanced cervical cancer. J Clin Oncol 2014; 32 (4): 357–358. doi: 10.1200/JCO.2013.53.1566.
18. Uzan C, Souadka A, Gouy S et al. Analysis of morbidity and clinical implications of laparoscopic para-aortic lymphadenectomy in a continuous series of 98 patients with advanced-stage cervical cancer and negative PET-CT imaging in the para-aortic area. Oncologist 2011; 16 (7): 1021–1027. doi: 10.1634/theoncologist.2011-0007.
19. Aoki T, Nagata Y, Mizowaki T et al. Clinical evaluation of dynamic arc conformal radiotherapy for paraaortic lymph node metastasis. Radiother Oncol 2003; 67 (1): 113–118. doi: 10.1016/s0167-8140 (02) 00388-2.
20. Keenan LG, Rock K, Azmi A at al. An atlas to aid delineation of para-aortic lymph node region in cervical cancer: design and validation of contouring guidelines. Radiother Oncol 2018; 127 (3): 417–422. doi: 10.1016/j.radonc.2018.02.013.
21. Gupta M, Chopra S, Kunder S et al. Early toxicity and treatment outcomes of extended field-intensity modulated radiotherapy for cervical cancer patients with para-aortic nodal metastasis. Ecancermedicalscience 2019; 13 : 957. doi: 10.3332/ecancer.2019.957.
22. Gill BS et al. National Cancer Data Base analysis of radiation therapy consolidation modality for cervical cancer: the impact of new technological advancements. Int J Radiat Oncol Biol Phys 2014; 90 (5): 1083–1090. doi: 10.1016/j.ijrobp.2014.07.017.
23. Pechačová Z, Zemanová M, Končeková J. Efekt a toxicita radioterapie ve vybraných paliativních indikacích. Klin Onkol 2018; 31 (6): 439–447. doi: 10.14735/amko201 8439.
24. Sochor M, Sláma O, Loučka M. Časná integrace paliativní péče do standardní onkologické péče – benefit, limitace, bariéry a druhy paliativní péče. Klin Onkol 2015; 28 (3): 171–176. doi: 10.14735/amko2015171.
25. Holečková P, Maňásek V, Tomíška M et al. Zajímavé případy z nutriční péče v onkologii. Klin Onkol 2013; 26 (3): 218.
26. Vorlíček J, Skřičková J. Paliativní léčba u onkologických nemocných. Klin Onkol 1993; 6 (4): 119–122.
27. Klasterský J. Podpůrná léčba onkologicky nemocných. Klin Onkol 1994; 7 (1): 9–13.
28. Vokurka S. Význam podpůrné léčby a péče v onkologii. Onkolog revue 2018; 5 : 91–94.
29. Pála M, Holečková P, Veselý J et al. Konkomitantní chemoradioterapie v léčbě nádorů ORL oblasti. Výsledky ÚRO 2002–2005. Klin Onkol 2007; 20 (3): 248–252.
30. Holečková P, Pála M, Mašek M et al. Retrospektivní hodnocení léčebných výsledků u pacientů s nasofaryngeálním karcinomem léčených v ÚRO FNB Praha od roku 1990 do roku 2005. Klin Onkol 2007; 20 (1): 35–37.
31. Kim YS, Kim JH, Ahn SD et al. High-dose extended-field irradiation and high-dose-rate brachytherapy with concurrent chemotherapy for cervical cancer with positive para-aortic lymph nodes. Int J Radiat Oncol Biol Phys 2009; 74 (5): 1522–1528. doi: 10.1016/j.ijrobp.2008.10. 024.
32. Jang H, Chun M, Cho O et al. Prognostic factors and treatment outcome after radiotherapy in cervical cancer patients with isolated para-aortic lymph node metastases. J Gynecol Oncol 2013; 24 (3): 229–235. doi: 10.3802/jgo.2013.24.3.229.
33. Skliarenko J, Barnes EA. Palliative pelvic radiotherapy for gynaecologic cancer. J Radiat Oncol 2012; 1 : 239.
Labels
Paediatric clinical oncology Surgery Clinical oncology
Article was published inClinical Oncology

2020 Issue 2-
All articles in this issue
- Physical Therapy as an Adjuvant Treatment for the Prevention and Treatment of Cancer
- Stereotactic Body Radiotherapy of Lymph Node Oligometastases
- HPV 16 in Pathogenesis of Upper Aerodigestive Tract Tumors
- Invasive Rhino-Orbito-Cerebral Mucormycosis in Pediatric Patient with Acute Leukemia
- The Use of Indocyanin Green for Peroperative Diagnostic of Chylous Ascites and Autologous Tissue Glue (Vivostat) for the Treatment
- Anti-Cancer Effect of Melatonin with Radioprotective/Radiosensitive Property
- Karcinom děložního hrdla
- Léčba karcinomu hrdla děložního s postižením paraaortálních uzlin – retrospektivní hodnocení vlastního souboru
- Aktuality z odborného tisku
- Vzpomínka na prof. RNDr. M. Lokajíčka, DrSc.
- Účinek kapecitabinu v léčbě triple negativního karcinomu prsu
- Metformin in Oncology – How Far Is Its Repurposing as an Anticancer Drug?
- Association of NAD (P) H Quinine Oxidoreductase 1 rs1800566 Polymorphism with Bladder and Prostate Cancers – a Systematic Review and Meta-Analysis
- Clinical Oncology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Karcinom děložního hrdla
- Physical Therapy as an Adjuvant Treatment for the Prevention and Treatment of Cancer
- HPV 16 in Pathogenesis of Upper Aerodigestive Tract Tumors
- Metformin in Oncology – How Far Is Its Repurposing as an Anticancer Drug?
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

