-
Medical journals
- Career
Resekce sarkomu dutiny břišní, pánve a retroperitonea
Authors: Šimůnek Radim 3; Adámková-Krákorová Dagmar 2; Šefr Roman 1,3; Fait Vuk 1,3
Authors‘ workplace: Oddělení chirurgické onkologie, Masarykův onkologický ústav, Brno 1; Klinika komplexní onkologické péče, Masarykův onkologický ústav, Brno 2; Klinika operační onkologie, Masarykův onkologický ústav, Brno 3
Published in: Klin Onkol 2018; 31(3): 230-234
Category: Case Reports
doi: https://doi.org/10.14735/amko2018230Overview
Východiska:
Mezenchymální malignity jsou relativně vzácným typem nádorů, které mají specifické chování. Nedílnou součástí terapie těchto nádorů je chirurgické řešení, které v některých případech nelze standardizovat, řešení je zvláště při intraperitoneálním a retroperitoneálním umístění velmi často vysoce individuální.Případ:
Popisujeme dvě kazuistiky intraperitoneálních a retroperitoneálních sarkomů léčených v našem komplexním onkologickém centru. První pacient, 36letý muž s primárně diagnostikovaným tumorem subrenálního prostoru velikosti 95 × 90 × 140 mm, v těsném kontaktu s dolní dutou žilou a s pravou ledvinou, se samostatným krevním zásobením horního pólu ledviny. Primárně byl nádor hodnocen jako schwannom, pacient byl došetřen, resekce proběhla se zachováním pravé ledviny. Definitivní histologický nález byl ganglioneuroblastom. Po resekci proběhla adjuvantní radioterapie na lůžko tumoru. Pacient je rok po resekci bez známek onemocnění. Druhý pacient byl 52letý muž, s diagnózou liposarkomu retroperitonea velikosti 50 × 36 × 15 cm, po resekci váhy 14 kg. Při resekci bylo nutno odstranit levou ledvinu a nadledvinu. Byla podána adjuvantní chemoterapie IFO/ADM. Celkem 31 měsíců po primární resekci byla resekována lokální recidiva v lůžku tumoru a po dalších 18 měsících byl pacient opět revidován a byla odstraněna další 3 ložiska v retroperitoneu. Po dalších 6 měsících se objevil a byl resekován další relaps v levém semenném provazci. Pacient je nyní 3 měsíce bez známek relapsu.Závěr:
Terapie měkkotkáňových sarkomů vyžaduje komplexní přístup a léčbu, pokud možno od začátku v komplexním onkologickém centru. Nutností je vždy předoperační biopsie.Klíčová slova:
sarkom – resekceÚvod
Sarkomy jsou v rámci malignit v ČR vzácná onemocnění, představují 0,78 % ze všech zhoubných nádorů. Roční incidence tohoto onemocnění je 4–5 pacientů na 100 000 obyvatel. Z výsledků Národního onkologického registru (NOR) vyplývá, že pacienti s nově diagnostikovaným sarkomem jsou primárně operováni na pracovištích komplexních onkologických center (KOC) pouze v 53,9 %.
Sarkomy jsou značně heterogenní skupinou nádorů, u kterých je ve většině případů radikální chirurgické řešení metodou první volby, kdy je sarkom resekován s bezpečnostním lemem do zdravé tkáně [1]. Sarkomy bývají často ohraničeny pseudopouzdrem, které je tvořeno odtlačenou vazivovou tkání. V okolí tohoto pseudopouzdra pak můžeme nalézt satelitní ložiska. Indikována je široká excize, v ideálním případě odstranění celého kompartmentu. Existence satelitních ložisek v okolí pseudopouzdra sarkomu závisí rovněž na histologické povaze nádoru. U nízce maligních nádorů bývá indikováno odstranění tumoru s neporušeným pseudopouzdrem. Tento postup ale není dostatečný u agresivních (high-grade) nádorů. Zde nemusí být bezpečný ani lem 1 cm „makroskopicky zdravé“ tukové tkáně [2].
Dalším problémem, který u pacientů se sarkomy pozorujeme, je výskyt skip ložisek. Jsou to mikroskopická či makroskopická ložiska, která nacházíme ve stejném či protilehlém kompartmentu. Typickým příkladem je nález recidivy perirenálního liposarkomu u kontralaterální ledviny.
Dosažení dostatečného bezpečnostního lemu je v retroperitoneu mnohdy technicky náročné dodržet vhledem k časté lokalizaci nádorů u magistrálních cév a dalších orgánů, což může ústit v R1, v horším případě R2 resekce.
Je třeba zmínit výjimky, kdy je primárně indikovaná nechirurgická léčba. Sem patří především Ewingův sarkom a rabdomyosarkom, kdy je primárně indikovaná indukční chemoterapie.
Velmi častým problémem v léčbě sarkomů dutiny břišní, pánve a retroperitonea je jejich relativně pozdní diagnostika. To přirozeně nastává v důsledku časté nepřítomnosti klinických příznaků u pacientů s tímto onemocněním. Sarkomy bývají mnohdy diagnostikovány až ve značně pokročilém stadiu onemocnění či až dosáhnou enormních rozměrů [3].
V Masarykově onkologickém ústavu (MOÚ) jsme mnohdy nuceni do reresekcí recidiv sarkomů po předchozích onkologicky neradikálních resekcích, které velmi často proběhly bez předchozí histologické verifikace. Tyto reresekce jsou technicky možné, ale velmi náročné kvůli nepřehlednosti operačního pole po předchozí revizi a častému prorůstání do okolních orgánů. Dosažení R0 resekce je pak složitější, což má pro další osud pacienta zcela zásadní význam [4,5]. Přesto i opakované resekce sarkomů jsou technicky možné, pokud to dovoluje lokalizace recidivy a klinický stav pacienta. Jsou pacienti, kteří z opakovaných chirurgických intervencí jednoznačně profitují. Pacientů, kterým byl na jiném pracovišti diagnostikován sarkom a kteří byli následně odesláni k primárnímu řešení do MOÚ, je menšina. Přitom právě tito pacienti nejvíce profitují ze správně vedené léčby.
Kazuistika 1
Pacient (36 let) se dostavil na chirurgickou ambulanci spádové nemocnice pro bolesti v bederní krajině. Po klinickém vyšetření bylo doplněno ultrazvukové vyšetření břicha, kde byla popsána expanze 9 × 10 cm v pravém subrenálním prostoru. Na základě ultrazvukového nálezu bylo doplněno CT (obr. 1). Zde byl nalezen tumor pravého retroperitonea mezi ledvinou, páteří a dolní dutou žilou s rozměry 95 × 90 × 140 mm. Nádor naléhal na dolní dutou žílu, splýval s muculus psoas maior a byl v těsném kontaktu s pravou ledvinou. S těmito výsledky byl pacient odeslán na konziliární ambulanci MOÚ. Případ byl probrán v komisi pro měkkotkáňové sarkomy. Bylo doplněno CT mediastina a plic, kde nebyl shledán patologický nález, a provedena histologická verifikace, která proběhla cestou punkční biopsie pod CT kontrolou s výsledkem schwannom. Byla indikována chirurgická revize, před níž byla doplněna funkční scintigrafie ledvin (FSL) a MRI vyšetření distální hrudní a bederní páteře k vyloučení dalších, byť i drobných schwannomů. Na FSL byla funkce ledvin v normě, podíl na celkové funkci byl 51 : 49 % ve prospěch levé ledviny. Na MRI vyšetření nebyla popsána žádná další tumorózní rezistence paravertebrálně, samotný tumor pak byl lokalizován v retroperitoneu prevertebrálně, retrokaválně vpravo od Th12 po L4 s menší porcí nádoru jdoucí retroaortálně těsně pod odstupem renálních cév. Při samotné operaci byla nejprve od tumoru odpreparována pravá ledvina. Ledvina měla aberantní cévní zásobení dolního pólu, cévní svazek byl lokalizován prekaválně. Arteria renalis pak měla zvyklý retrokavální průběh (obr. 2, 3). Následně byl resekován tumor se zachováním pravé ledviny, vena cava inferior byla v celém infrarenálním průběhu odpreparována od tumoru, byly přerušeny přímé spojky jdoucí z tumoru do zadní stěny dolní duté žíly a kompletně zresekován retroaortální výběžek nádoru (obr. 4). V dorzální části nádor denně adheroval k druhému a třetímu bedernímu obratli. Definitivní histologie potvrdila ganglioneuroblastom. Vzhledem k těsným okrajům resekátu v jeho dorzální části u těl L2 a L3 byla indikována pooperační radioterapie na rizikovou oblast lůžka po resekci nádoru. Následně je pacient dispenzarizován. Na posledním CT, které proběhlo rok od operace, je pacient bez známek recidivy onemocnění.
Image 1. CT snímky pacienta s primárně diagnostikovaným ganglioneuroblastomem retroperitonea vpravo. Pacient podstoupil nejprve biopsii z retroperitoneálního tumoru a následně dle výsledku histologie byla indikována chirurgická resekce. 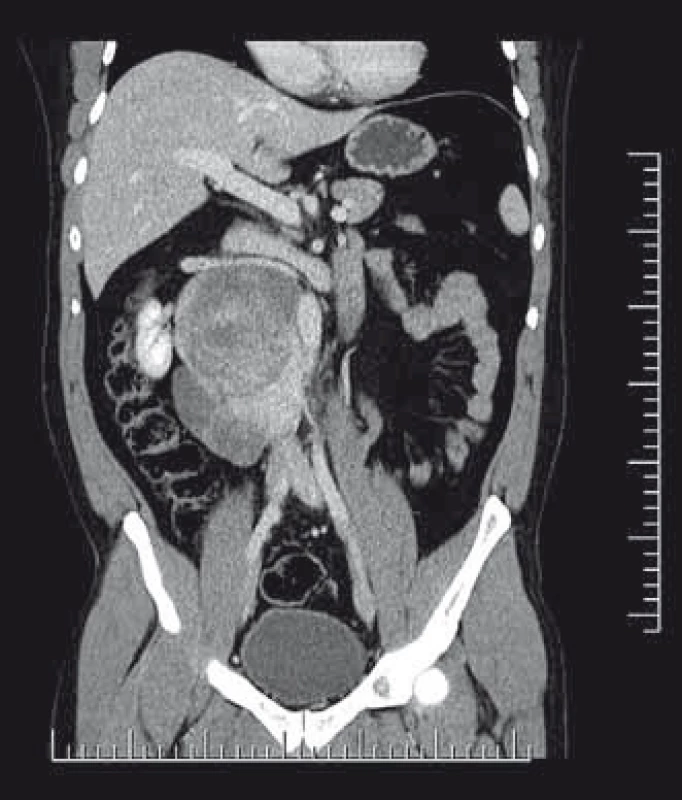
Image 2. Peroperační nález u pacienta s ganglioneuroblastomem retroperitonea. 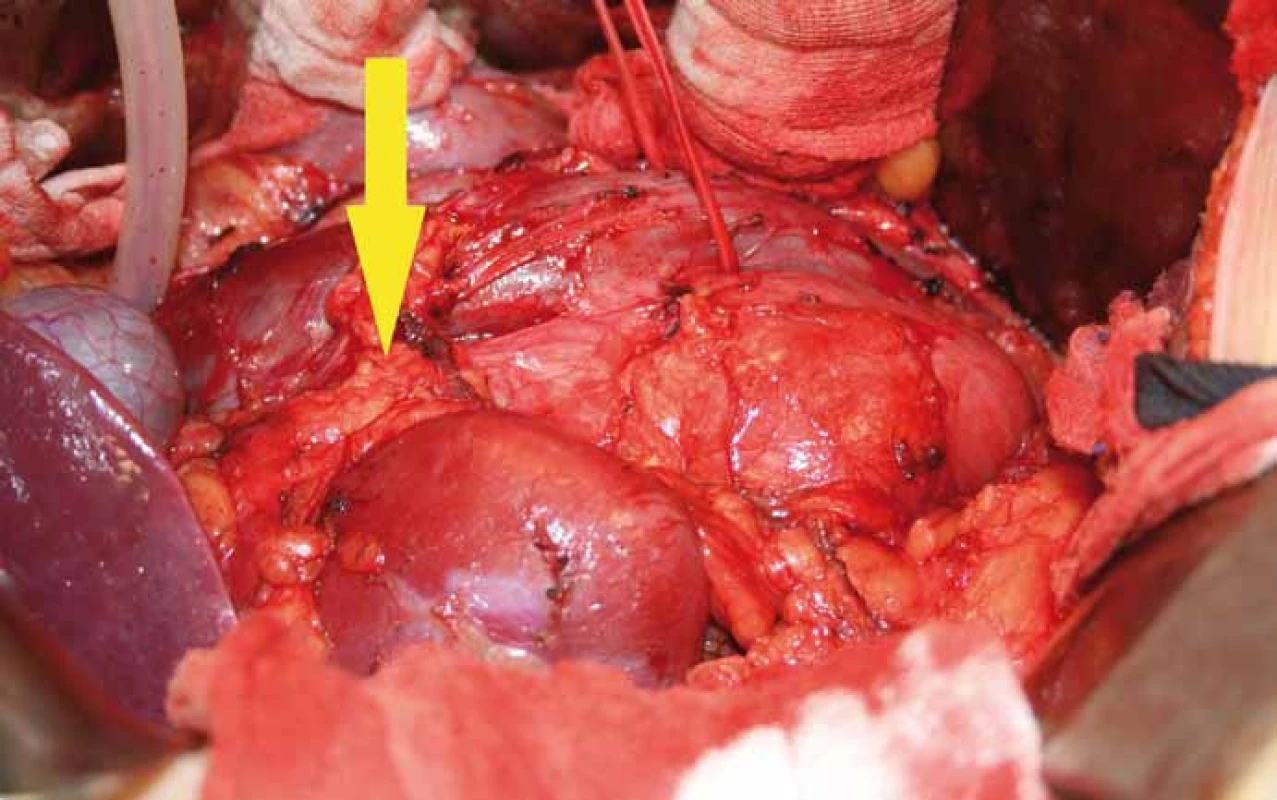
Na snímku je patrná lokalizace tumoru za pravou ledvinou, mediální porce nádoru zasahuje za zadní stěnu dolní duté žíly v celém jejím infrarenálním průběhu, je vypreparovaný aberantní cévní svazek k dolnímu pólu pravé ledviny, který je uložen prekaválně (na snímku označený žlutou šipkou). Image 3. Na snímku je patrná pravá ledvina odpreparovaná od tumoru, je vidět cévní svazek arteria renalis jdoucí retrokaválně (zelená šipka), rovněž i aberantní cévní svazek pro dolní pól ledviny jdoucí prekaválně (modrá šipka). Samotný tumor se zatím nachází ve své mediální porci za dolní dutou žilou (černá šipka). Ureter je označený žlutou šipkou. 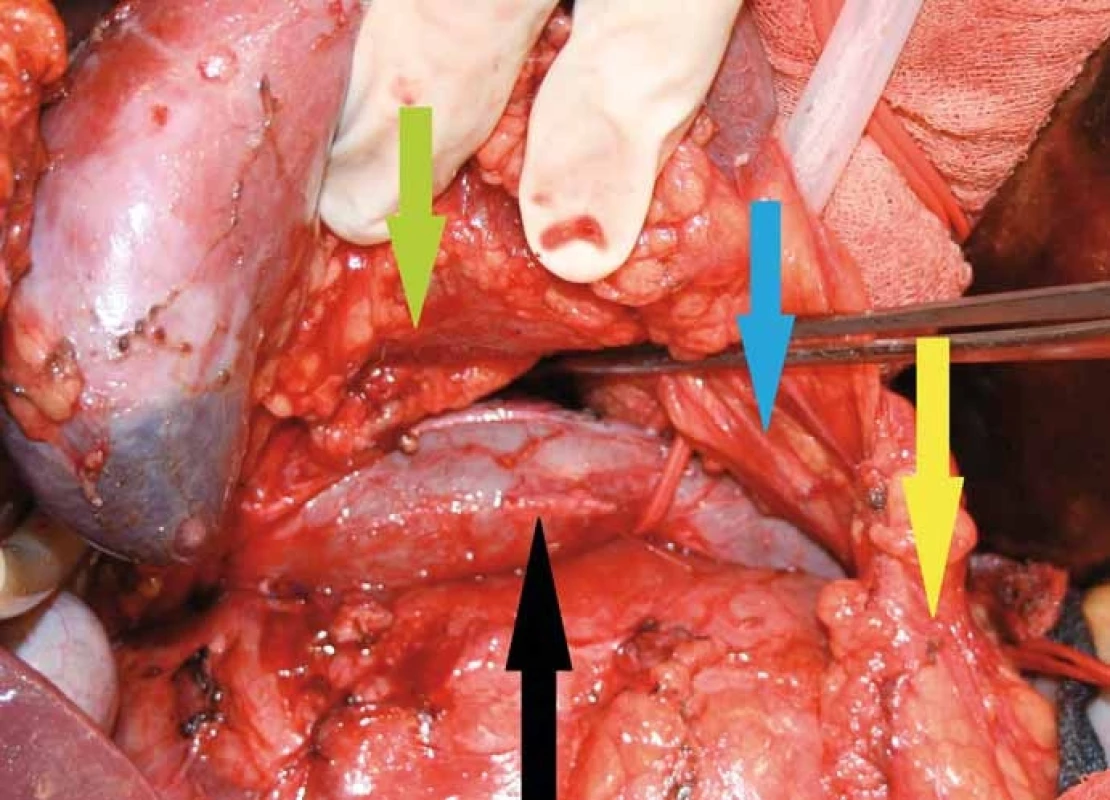
Image 4. Stav po resekci tumoru se zachováním pravé ledviny, vena cava inferior byla v celém infrarenálním průběhu odpreparována od tumoru, byly přerušeny přímé spojky jdoucí z tumoru do zadní stěny dolní duté žíly a zresekována retroaortální porce nádoru. 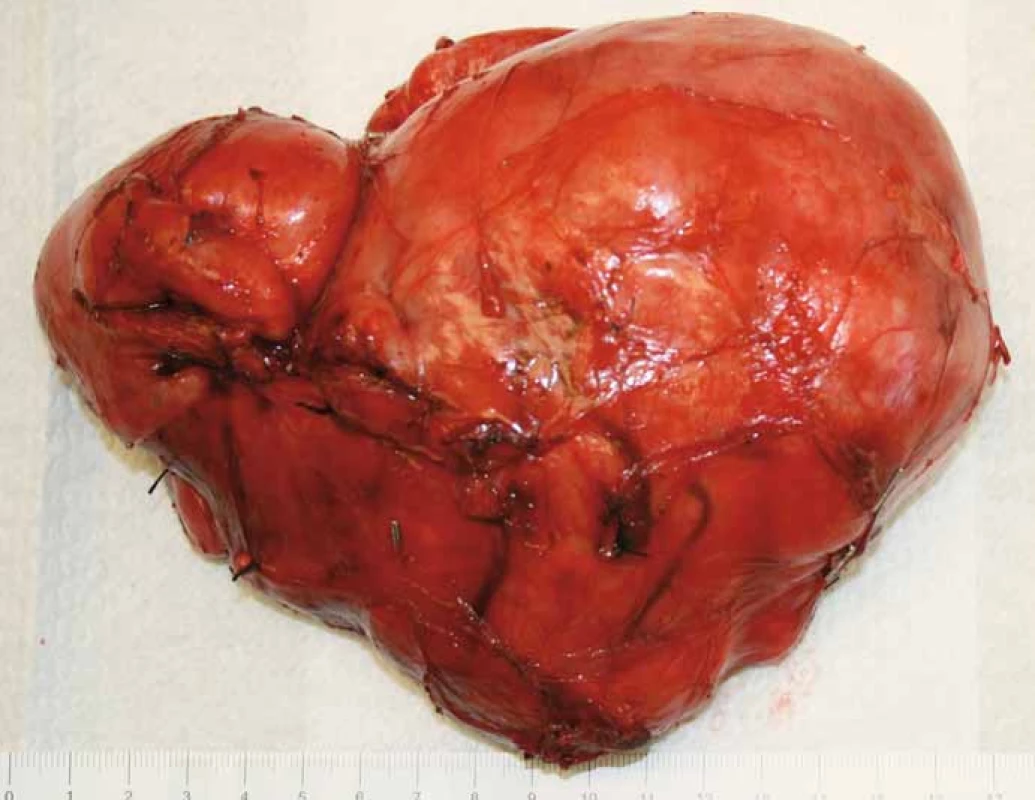
Kazuistika 2
Pacient (52 let) se dostavil na chirurgickou ambulanci sektorové nemocnice pro bolesti břicha, zvýšenou plynatost a zvětšování obvodu břicha. Už při klinickém vyšetření byla hmatná masivní tumorózní rezistence. Bylo doplněno akutně CT vyšetření břicha (obr. 5). Zde byla popsána enormní tumorózní rezistence 30 × 40 × 15 cm vyplňující kompletně levé retroperitoneum, levou část peritoneální dutiny a pravý podbřišek, infiltrující levou ledvinu. Levá nadledvina byla do tumoru zavzata částečně a levá polovina tlustého střeva byla odtlačena ventrálně. Pacient byl odeslán na konziliární ambulanci MOÚ.
Image 5. CT snímky pacienta s enormním liposarkomem retroperitonea. 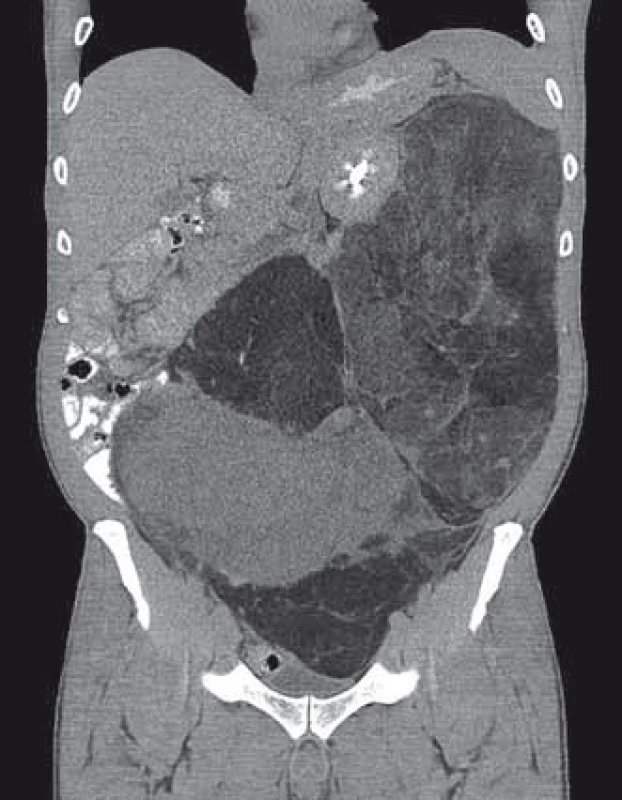
Případ byl probrán na komisi pro měkkotkáňové sarkomy. Byla doplněna biop-sie pod CT kontrolou a doplněno CT mediastina a plic. Nález na CT plic byl negativní, výsledek histologie z punkční biopsie byl liposarkom retroperitonea. Bylo doplněno FSL, kde levá ledvina byla hypofunkční, podíl na celkové funkci byl 77 : 23 % ve prospěch pravé ledviny. Nádor se i přes svou enormní velikost nejevil inoperabilní, bylo indikováno chirurgické řešení. Nádor byl resekován in toto s levostrannou nefrektomií a adrenalektomií, levá polovina tlustého střeva vč. jeho cévního zásobení nebyla nádorem infiltrována a bylo ji možné od nádoru odpreparovat (obr. 6, 7). Celkové rozměry nádoru byly 50 × 36 × 15 cm a nádor vážil 14 kg. Celý nádor byl kryt neporušeným jemným vazivovým pouzdrem, histologie potvrdila původní diagnózu G2 liposarkomu retroperitonea.
Image 6. Peroperační nález po provedení laparotomie. 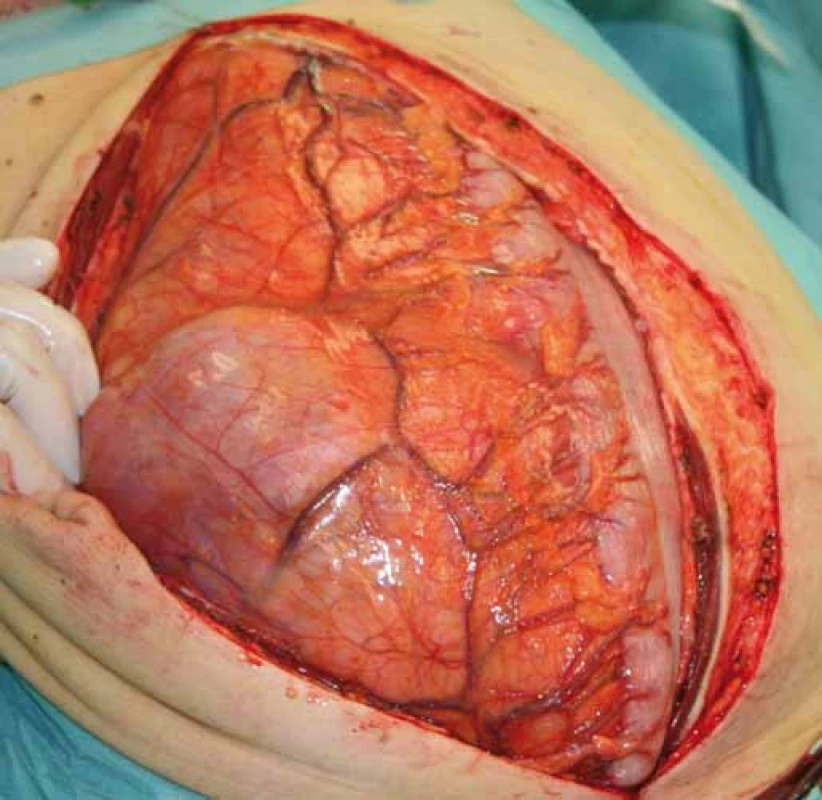
Image 7. Přerušení cévního svazku levé ledviny staplerem. 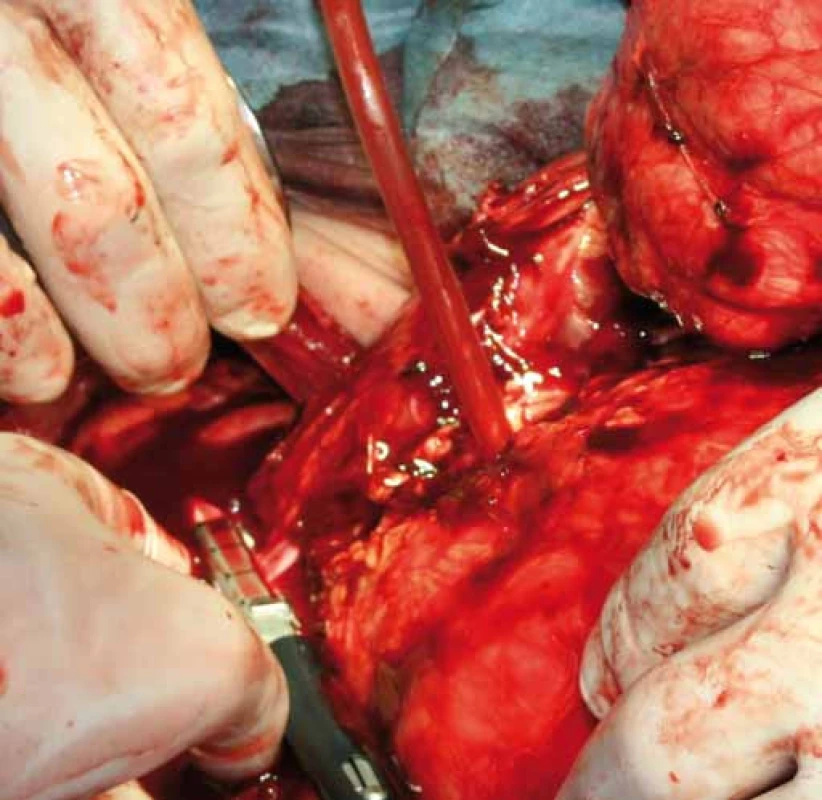
Na časném kontrolním CT vyšetření břicha byl nález suspektní recidivy onemocnění, pro které byla indikována paliativní chemoterapie režimem IFO/ADM (ifosfamid s doxorubicinem). Pooperační radioterapie nebyla indikována vzhledem k enormnímu rozsahu ozařovaného pooperačního pole a možné lézi kliček tenkého střeva. Dále probíhaly pravidelné kontroly. Po 31 měsících od operace byla na kontrolním CT vyšetření nalezena recidiva onemocnění v lůžku po nefrektomii velikosti 16 × 12 × 18 cm. Doplňující CT mediastina a plic bylo bez známek recidivy onemocnění. Byla indikována operační revize.
Při revizi byla resekována recidiva sarkomu v retroperitoneu vlevo a zresekovány 4 další drobné satelity, které nebyly na CT patrné. Všechny tumory byly kryty jemným neporušeným pseudopouzdrem a výsledná histologie potvrdila předchozí diagnózu G2 liposarkomu retroperitonea. Další chemoterapie nebyla indikována.
Celkem 18 měsíců od této operace byla na CT břicha nalezena další recidiva. Po vyloučení diseminace onemocnění do plic byla resekována tři nová ložiska liposarkomu. Jedna porce nádoru byla v oblasti Treitzova vazu, další v oblasti musculus psoas maior vlevo a další ve vstupu do tříselného kanálu. Výsledná histologie byla identická s předchozími – G2 liposarkom retroperitonea, nádor byl kryt neporušeným pouzdrem, resekce byla stejně jako všechny předchozí R0. Pooperační chemoterapie nebyla indikována.
A konečně 6 měsíců od poslední operace byla na CT zjištěna další recidiva v oblasti semenného provazce vlevo. Po vyloučení diseminace do plic byla zresekována recidiva onemocnění a odebrána diagnostická excize z okolní „makroskopicky zdravé“ tukové tkáně. Obě výsledné histologie prokazují G2 liposarkom retroperitonea. Dále bylo indikováno sledování pacienta. Na časném CT 3 měsíce od poslední operace nejsou známky CT verifikovatelné recidivy onemocnění.
Diskuze
V péči o pacienty s histologicky verifikovaným sarkomem či u pacientů, u kterých bylo vysloveno podezření na toto onemocnění, je pro pacienta zcela zásadní multioborová spolupráce. Vzhledem ke komplexnosti problematiky a raritnímu výskytu tohoto onemocnění je nutné léčbu těchto pacientů soustředit v onkologických centrech. Jen tak je možné zlepšení prognózy těchto pacientů. MOÚ má status sarkomového centra při EORTC (European Organisation for Research and Treatment of Cancer).
Každý pacient s diagnostikovaným sarkomem či jeho recidivou by měl být projednán specializovanou komisí, jejímiž členy jsou chirurg znalý problematiky tohoto onemocnění, klinický onkolog, patolog, radioterapeut, radiolog, hrudní chirurg, ortoped a lékaři dalších specializací v souvislosti s lokalizací tumoru, v neposlední řadě i psycholog.
Je nutné opakovaně zdůraznit, že u každé tumorózní léze nejasné etiologie je primárně indikována biopsie k histologické verifikaci, pokud je technicky možná. Přesněji je biopsie indikována u každé povrchové léze větší než 5 cm a u hluboce uložené léze jakékoliv velikosti, tedy u všech nitrobřišních mas. Najdou se i zcela výjimečné případy, při kterých je biopsie retroperitoneálního tumoru kontraindikována. Jako příklad uvádíme pacientku, která byla do našeho ústavu odeslána k operaci pro cystický tumor retroperitonea. Pomocí neinvazivních metod jsme u pacientky diagnostikovali rozsáhlou echinokokovou retroperitoneální cystu a pacientku předali do péče infekcionisty. Proto je velmi vhodné předat pacienta s nově diagnostikovanou lézí nejasné etiologie, kde bylo vysloveno podezření na sarkom (ať už se nachází na končetinách, v retroperitoneu, v pánvi, hrudníku či na krku), na specializované pracoviště, kde mají s diagnostikou a léčbou této raritní diagnózy v rámci naší malé země co možná největší zkušenosti.
I samotná histologická verifikace s sebou nese riziko možných komplikací. Rozsah těchto komplikací, způsob jejich řešení a jejich následné ovlivnění léčby pacienta přesahuje rámec tohoto sdělení.
Nebyla-li patologická diagnóza stanovena v rámci některého z KOC, pak je vhodné požadovat druhé čtení histologie patologem specializujícím se na sarkomy.
Až na výjimky je v léčbě měkkotkáňových sarkomů radikální chirurgické řešení léčbou první volby, jde o jedinou metodu s kurativním potenciálem. Naprosto zásadní je pro pacienta dosažení R0 resekce. Výkony v dutině břišní a retroperitoneu si často vyžadují kooperaci chirurga, cévního chirurga, gynekologa a urologa. V některých případech, které vycházejí z velikosti tumoru, jeho lokalizace a histologie, je před samotné operační řešení předřazena neadjuvantní chemoterapie či radioterapie [6]. Cílem je dosažení bezpečné R0 resekce. Často jsou však sarkomy verifikovány, až dosáhnou extrémní velikosti/hmotnosti. Jejich odstranění pak vyžaduje složité multiviscerální resekce, jejichž rozsah je dán velikostí tumoru a především jeho lokalizací. Dosažení R0 resekce je mnohdy technicky značně problematické vzhledem k těsnému kontaktu s magistrálními cévami a nervovými plexy [7]. Po provedené resekci zůstává v dutině břišní a retroperitoneu resekční plocha enormních rozměrů, ze které hrozí pooperační krvácení. Jedná se o náročné zákroky, které i přes pokroky v perioperační péči zůstávají zatíženy vyšší morbiditou a mortalitou, nejčastěji v důsledku krvácení, sepse až multiorgánového selhání. V širších souvislostech pak mohou vyšší krevní ztráty negativně ovlivnit i samotnou prognózu zhoubného onemocnění. Mají i negativní ekonomické dopady vč. prodloužení doby hospitalizace. Pro minimalizaci rizika peroperačního a pooperačního krvácení používáme kombinace přístrojů a technik umožňující dosažení co nejlepší hemostázy. Standardně používáme na krytí resekční plochy hemostyptika na bázi oxidované celulózy. Nejčastějším námi používaným hemostyptikem v této indikaci je Traumacel FAM vzhledem k jeho ověřeným účinkům, biologickým vlastnostem, snadné dostupnosti v různých velikostech i ekonomické výhodnosti ve srovnání s dalšími materiály.
Závěr
Jedná se o raritní onemocnění, které ale v poslední době vykazuje stoupající incidenci. Dílem je to v důsledku výskytu sekundárních poradiačních sarkomů u pacientů, kteří v minulosti prodělali radioterapii pro jiné nádorové onemocnění. Tento nárůst vedl již v minulosti ke změně ozařovacích technik. V léčbě sarkomů stále narážíme na případy, kdy bylo primárně přistoupeno k chirurgické resekci nádoru bez předchozí histologické verifikace či řádného dalšího došetření. Výsledkem jsou pak mnohdy neradikální resekce R1 v lepším případě či v horším R2. Tito pacienti pak bývají předáváni do onkologických center k další terapii, která je pak značně problematická. Právě primární radikální resekce R0 po předchozí histologické verifikaci je pro osud pacientů zcela zásadní. Někdy je technicky možná R0 reresekce, jindy pak přistupujeme až k resekci recidivy. Nejčastějším limitujícím faktorem při operacích sarkomů dutiny břišní, pánve a retroperitonea je těsná afinita či prorůstání tumoru do okolních orgánů či magistrálních cév. Vzhledem k raritě tohoto onemocnění je vhodné předat pacienty se sarkomy do několika málo center v naší republice specializujících se na léčbu sarkomů, která se nyní ustanovují.
Podpořeno MZ ČR-RVO (MOÚ,00209805).
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
doc. MUDr. Vuk Fait, CSc.
Oddělení chirurgické onkologie
Masarykův onkologický ústav
Žlutý kopec 7 656 53 Brno
e-mail: inbox@vukfait.com
Obdrženo: 6. 3. 2018
Přijato: 20. 3. 2018
Sources
1. Singer S, Antonescu CR, Riedel E et al. Histologic subtype and margin of resection predict pattern of recurrence and survival for retroperitoneal liposarcoma. Ann Surg 2003; 238 (3): 358–370. doi: 10.1097/01.sla.0000086542.11899.38.
2. Tan MC, Yoon SS. Surgical management of retroperitoneal and pelvic sarcomas. J Surg Oncol 2015; 111 (5): 553–561. doi: 10.1002/jso.23840.
3. Bonvalot S, Raut CP, Pollock RE et al. Technical considerations in surgery for retroperitoneal sarcomas: position paper from ESurge,a master class in sarcoma surgery, and EORTC-STBSG. Ann Surg Oncol 2012; 19 (9): 2981–2991. doi: 10.1245/s10434-012-2342-2.
4. Gyorki DE, BrennanMF. Management of recurrent retroperitoneal sarcoma. J Surg Oncol 2014; 109 (1): 53–59. doi: 10.1002/jso.23463.
5. van Dalen T, Hoekstra HJ, van Geel AN et al. Locoregional recurrence of retroperitoneal soft tissue sarcoma: second chance of cure for selected patients. Eur J Surg Oncol 2001; 27 (6): 564–568. doi: 10.1053/ejso.2001. 1166.
6. Gronchi A, De Paoli A, Dani C et al. Preoperative chemoradiation therapy for localised retroperitoneal sarcoma: a phase III study from the Italian Sarcoma Group. Eur J Cancer 2014; 50 (4): 784–792. doi: 10.1016/j.ejca.2013. 11.021.
7. Bonvalot S, Rivoire M, Castaing M et al. Primary retroperitoneal sarcomas: a multivariate analysis of surgical factors associated with local control. J Clin Oncol 2009; 27 : 31–37. doi: 10.1200/JCO.2008.18. 0802.
Labels
Paediatric clinical oncology Surgery Clinical oncology
Article was published inClinical Oncology

2018 Issue 3-
All articles in this issue
- Monoclonal gammopathy of undetermined significance
- Neuroendokrinné neoplázie gastrointestinálneho traktu z pohľadu histopatológie
- Možná úloha ľudských herpetických vírusov podčeľade Alphaherpesvirinae pri vzniku niektorých nádorových ochorení
- Potenciál flavonoidu quercetinu v prevenci a léčbě nádorů – současný stav výzkumu
- Trastuzumab v neoadjuvantní léčbě HER2+ karcinomu prsu – 5leté zkušenosti z onkologické kliniky 1. LF UK a VFNTrastuzumab v neoadjuvantní léčbě HER2+ karcinomu prsu – 5leté zkušenosti z onkologické kliniky 1. LF UK a VFN
- Detekcia mutácií v géne FLT3 u pacientov východoslovenského regiónu
- Výsledky léčby krizotinibem v léčbě nemalobuněčného ALK pozitivního karcinomu plic v České republice
- Resekce sarkomu dutiny břišní, pánve a retroperitonea
- Vybrané genetické polymorfizmy asociované s hypoxií a multilékovou rezistencí u pacientů s monoklonálními gamapatiemi
- Clinical Oncology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Potenciál flavonoidu quercetinu v prevenci a léčbě nádorů – současný stav výzkumu
- Neuroendokrinné neoplázie gastrointestinálneho traktu z pohľadu histopatológie
- Resekce sarkomu dutiny břišní, pánve a retroperitonea
- Detekcia mutácií v géne FLT3 u pacientov východoslovenského regiónu
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

