-
Medical journals
- Career
Detekcia mutácií v géne FLT3 u pacientov východoslovenského regiónu
Authors: Dubayová Katarína 1; Kožlejová Zuzana 2; Vašková Judita 3; Čakanová Gladys 3; Kiktavá Mária 4; Guman Tomáš 5; Sabo Ján 2; Karabinos Anton 3
Authors‘ workplace: Ústav lekárskej a klinickej biochémie UPJŠ LF Košce 1; Ústav lekárskej a klinickej biofyziky UPJŠ LF Košce 2; SEMBID, s. r. o., Košice 3; Oddelenie lekárskej genetiky, Medirex, a. s., Košice 4; Klinika hematológie a onkohematológie UPJŠ LF a UNLP Košice 5
Published in: Klin Onkol 2018; 31(3): 200-206
Category: Original Articles
doi: https://doi.org/10.14735/amko2018200Overview
Východisko:
Práca poukazuje na význam monitoringu mutácií v géne FLT3 aplikáciou jednoduchej metódy molekulovej genetiky.Pacienti a metódy:
Súbor tvorilo 141 pacientov vo veku od 19 do 81 rokov s primárnou akútnou myeloblastovou leukémiou (AML) a 8 pacientov s prechodom myelodysplastického syndrómu (MDS) do AML. Metódou PCR bola analyzovaná DNA zo vzorky periférnej krvi a/alebo kostnej drene. Dôkaz internej tandemovej mutácie FLT3 génu (FLT3-ITD) je založený na amplifikácii exónov 14 a 15. Bodová mutácia v tyrozín kinázovej doméne FLT3 génu (FLT3-TKD) bola detegovaná restrikčnou analýzou PCR produktu exónu 20. Fragmenty boli separované elektroforeticky. PCR produkty pozitívnych vzoriek boli analyzované aj na mikročipe (Bioanalyzer 2100).Výsledky:
Interná tandémová duplikácia FLT3-ITD bola potvrdená u 19 % pacientov a bodová mutácia FLT3-TKD u 8 %. Dvaja pacienti (1 %) mali obidve mutácie. Najväčšiu skupinu FLT3+ tvorili pacienti bez iných chromozómových aberácií (59 %) a pacienti s translokáciou t (15; 17) /PML-RARA (15 %). Úmrtnosť pacientov v skupine FLT3+ bola 33 % oproti 10 % v skupine FLT3–. V rámci FLT3+ skupiny bolo percento úmrtnosti takmer rovnaké u FLT3-ITD aj FLT3-TKD, paradoxne 77-ročná pacientka s dvojitou mutáciou FLT3-ITD/TKD bola v remisii. Ôsmich pacientov s prechodom MDS do AML sme posudzovali samostatne. U troch pacientov bola pri prechode do AML potvrdená FLT3 pozitivita, z toho u dvoch FLT3-ITD a u jedného FLT3-TKD. Iné génové aberácie z vyšetrovaného panelu u nich potvrdené neboli. Prežívanie týchto pacientov s FLT3+ bolo dlhšie ako u FLT3 – pacientov. Výsledky dôkazu mutácií v géne FLT3 u pacientov východoslovenského regiónu korelujú s publikovanými výsledkami iných databáz.Záver:
Aplikovaná PCR metóda je spoľahlivá, relatívne rýchla a finančne nenáročná, čo umožňuje rutinný monitoring mutácií v géne FLT3. Verifikácia FLT3 pozitivity na mikročipe je elegantnou náhradou analýzy na kapilárnej elektroforéze.Klíčová slova:
akútna myeloblastová leukémia – DNA – PCR – mutácia – FLT3-ITD – FLT3-TKDÚvod
Cytogenetika a molekulová genetika významne prispieva k diagnostike leukémií, pretože na podklade prítomnosti chromozómových aberácií definuje genetické markery, ktoré spolu s klinickými parametrami charakterizujú ochorenie a určujú jeho prognózu. Podľa prítomnosti rôznych genetických abnormalít sú pacienti stratifikovaní do prognostických skupín – priaznivá, intermediárna a nepriaznivá prognóza [1,2]. Dôkaz prítomnosti špecifických mutácií v génoch metódami molekulovej genetiky umožňuje monitorovať priebeh ochorenia a hodnotiť odpoveď na liečbu na molekulovej úrovni u pacientov bez štrukturálnych či numerických chromozómových aberácií. U pacientov s chromozómovými aberáciami má taktiež aj prognostický význam.
Jednou z mutácií, ktoré sa podieľajú na procese leukemogenézy, je mutácia v géne FLT3. Tento gén má dôležité postavenie v procese proliferácie, diferenciácie a prežívania prekurzorových krvotvorných buniek. Je lokalizovaný na 13. chromozóme (13q12.2), pozostáva z 24 exónov a pokrýva približne 96 kb. Gén FLT3 kóduje proteín s tyrozínkinázovou (TK) aktivitou triedy III. Tento receptor je zložený z extracelulárnej (tvorí ju päť N-glykozylovaných „imunoglobulín like“ slučiek) transmembránovej, juxtamembránovej a dvoch intracelulárnych TK domén [3]. Je exprimovaný prevažne na prekurzorových kmeňových bunkách v kostnej dreni [4,5]. FLT3 proteín je syntetizovaný ako monomér a po glykozylácii je umiestnený do cytoplazmatickej membrány. FLT3 môže reagovať s ligandom – proteín z triedy rastových faktorov, ktorý stimuluje proliferáciu hematopetických buniek. Po väzbe ligandu na imunoglobulínovú doménu receptora dôjde k dimerizácii, čo vedie ku konformačným zmenám v juxtamembránovej doméne a následnej autofosforylácii, čím sa aktivizuje TK, ktorá následne aktivizuje viaceré signálne intracelulárne dráhy (obr. 1).
Image 1. Obr. 1. Schéma aktivácie FLT3 receptora. 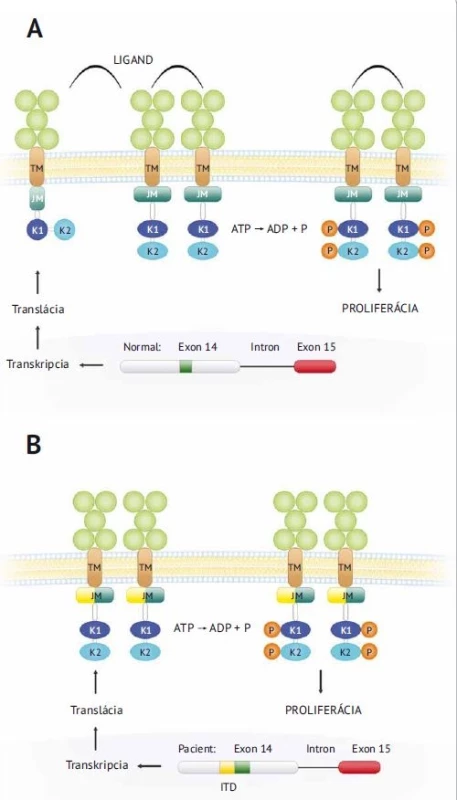
A. Transmembránový FLT3 proteín ako monomér reaguje s ligandom za vzniku proteínového diméru, ktorého konformácia umožní fosforyláciu. Takto aktivovaná tyrozínkináza odštartuje riadenú proliferáciu.
B. Pridaný úsek nukleotidov v exóne 14 v géne FLT3 spôsobí zmenu v primárnej štruktúre proteínu a tak aj bez prítomnosti ligandu dôjde k dimerizácii, a autofosforylácii tyrozínkinázy, výsledkom čoho je nekontrolovateľná proliferácia.V géne FLT3 sú známe dve špecifické mutácie – interná tandemová duplikácia (FLT3-ITD, viď nižšie) a bodová mutácia v TK doméne (FLT3-TKD). Interná tandemová duplikácia zahrňuje 3–400 bázových párov (bp) v exóne 14 a vedie k zmene proteínovej štuktúry v oblasti juxtamembránovej domény. Poškodenia juxtamembránovej domény môžu meniť jej dĺžku ako inzercie a delécie, preto niektorí autori ich nazývajú aj LM mutácie („lenght mutations“). Vo väčšine štúdií sú všetky mutácie postihujúce túto podjednotku označované ako FLT3-ITD mutácie [6]. Pri bodovej mutácii v aktivačnej slučke TK domény (FLT3-TKD) sa jedná o zámenu guanínu za tymín, čo spôsobí zámenu aspartátu (D) na kodóne 835 za tyrozín (Y) [7,8].
Mutácie v géne FLT3 spôsobia konštitutívnu aktiváciu receptora [9], a tak aj bez prítomnosti ligandu dôjde k dimerizácii, následným konformačným zmenám a autofosforylácii TK, výsledkom čoho je nekontrolovateľná proliferácia (obr. 1). Jedna z posledných štúdií tvrdí, že dĺžka a lokalizácia inzercie zásadne podmieňujú charakter internej tandémovej duplikácie a môžu potencovať fulminantnosť ochorenia už aj tak s nepriaznivou prognózou [10–12].
FLT3-ITD sa vyskytuje u 25–30 % pa-cientov s akútnou myeloidnou leukém-iou (AML) a FLT3-TKD u 7 % pacientov [13–15]. Existuje aj asociácia medzi FLT3-ITD a jednotlivými podtypmi AML podľa French-American-British (FAB) klasifikácie. Najčastejšie sa vyskytuje u pacientov s M3 AML [16]. Táto mutácia sa objavuje aj u 3 % pacientov s myelodisplastickým syndromom (MDS) a ojedinele aj u pacientov s chronickou myeloidnou leukémiou (CML). FLT3 mutácie neboli nájdené u pacientov s chronickou lymfocytovou leukémiou (CLL), mnohopočetným myelómom, non-Hodgkinovým lymfómom a samozrejme u zdravých jedincov [17,18]. U detí s AML je výskyt FLT3-ITD nižší a pohybuje sa okolo 15 %, pričom u FLT3-TKD je to 7 % podobne ako u dospelých [19]. Prítomnosť FLT3-ITD u pacientov s AML sa považuje za nepriaznivý prognostický faktor. U týchto pacientov bol zistený vyšší výskyt relapsov a prudký nárast leukemických blastov v periférnej krvi (PK) a kostnej dreni (KD), problematické je aj navodenie kompletnej remisie [20].
Cieľom práce bolo poukázať na význam monitoringu mutácií v géne FLT3 a možnosť aplikácie jednoduchej metódy molekulovej genetiky u pacientov s diagnózou AML de novo a u pacientov so sekundárnou AML, ktorá sa vyvinula z MDS.
Pacienti a metódy
Súbor pacientov
Dospelí pacienti Kliniky hematológie a onkohematológie UPJŠ LF a UNLP Košice – 141 pacientov (67 mužov a 74 žien) s diagnózou AML de novo, priemerný vek v čase diagnózy bol 54,7 rokov (19–81 rokov) a 8 pacientov (5 mužov a 3 ženy) s diagnózou sekundárna AML (MDS s prechodom do AML), priemerný vek 65,6 rokov (60–79 rokov). Analyzovaná bola vzorka PK a KD uvedených pacientov. Prezentované výsledky sú anonymné.
Izolácia DNA
Genómová DNA (gDNA) bola izolovaná zo vzorky PK a/alebo aspirátu KD podľa štandardného protokolu kitu QIAamp DNA Blood Mini Kit (Qiagen) na automatickom robotizovanom zariadení Qiacube (Qiagen). Vzorka DNA bola buď hneď analyzovaná, alebo uskladnená pri –20 °C do následného spracovania.
Genetická analýza FLT3 génu a iných chromozómových aberácií
Dôkaz internej tandemovej duplikácie v géne FLT3 (FLT3-ITD) je založený na amplifikácii exónu 14 a 15 metódou polymerázové reťazovej reakcie (polymerase
chain reaction – PCR) [21]. PCR produkt nemutovaného génu má veľkosť 328 bp. Dlhšie fragmenty svedčia o prítomnosti FLT3-ITD. Detekcia mutácie v tyrozínkinázovej doméne (FLT3-TKD) je založená na restrikčnej analýze PCR produktu exónu 20, ktorý je substrátom restrikčnej endonukleázy EcoRV. EcoRV vertikálne štiepi DNA sekvenciu 5‘-GAT|ATC-3‘ a rozštiepi amplifikovaný fragment veľkosti 114 bp na 68 bp a 46 bp. V prípade bodovej mutácie je guanín (G) zamenený za tymín (T). EcoRV túto sekvenciu neštiepi a tak nerozštiepený fragment veľkosti 114 bp potvrdzuje prítomnosť mutácie. Ak je prítomný len fragment 114 bp, je mutácia prítomná v obidvoch alelách. Vo väčšine prípadov je mutovaná len jedna alela a výsledkom reakcie sú produkty 114, 68 a 46 bp (obr. 3B). Separácia produktov PCR bola realizovaná horizontálnou elektroforézou na 3% agaróze, vizualizácia UV svetlom. Fotodokumentácia z každej analýzy bola archivovaná. PCR produkty pozitívnych vzoriek boli analyzované aj mikročipovou elektroforézou na zariadení Bioanalyzer 2100 (Agilent). Metodický postup analýzy zvyšných chromozómových/genetických aberácií je uvedený inde [1].
Výsledky
Mutácie v géne FLT3 boli detegované jednoduchou a relatívne rýchlou PCR diagnostikou na základe elektroforetickej separácie a identifikácie veľkosti fragmentov (obr. 2). V prípade pozitivity na prítomnosť FLT3 mutácie bol PCR produkt verifikovaný aj separáciou na mikročipe Bioanalyzer 2100 (obr. 3), kde bola presne stanovená veľkosť fragmentu, ako aj pomer intenzity mutovanej a nemutovanej alely.
Image 2. Separácia PCR produktov klasickou elektroforézou. 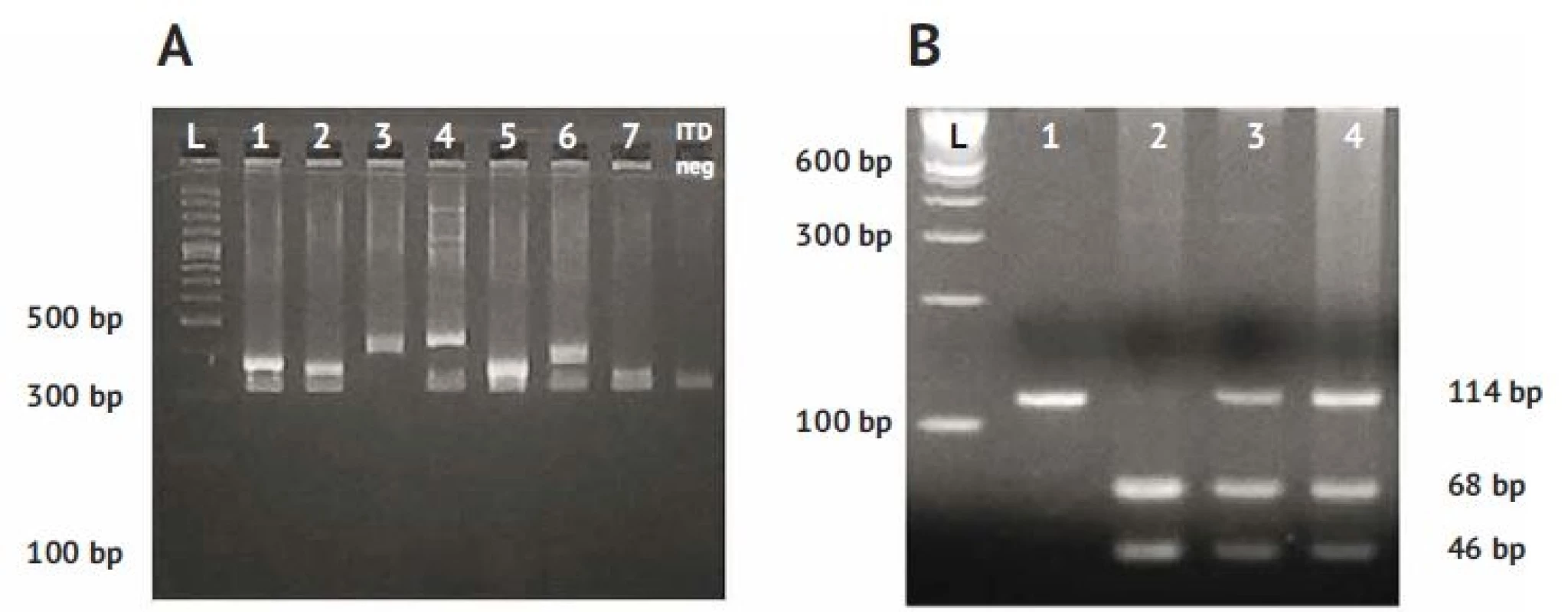
A. FLT3-ITD L – ladder 100 bp, 1-7 FLT3-ITD pozitívni pacienti., FLT3-ITD negatívni pacienti bez mutácie
B. FLT3-TKD 1 – pacient s mutáciou v obidvoch alelách, 2 zdravý jedinec bez mutácie FLT3-TKD, 3,4 – pacienti s jednou mutovanou alelou FLT3-TKD
bp – bázové páryImage 3. Separácia PCR produktov FLT3-ITD na mikročipe Bioanalyzer 2100. 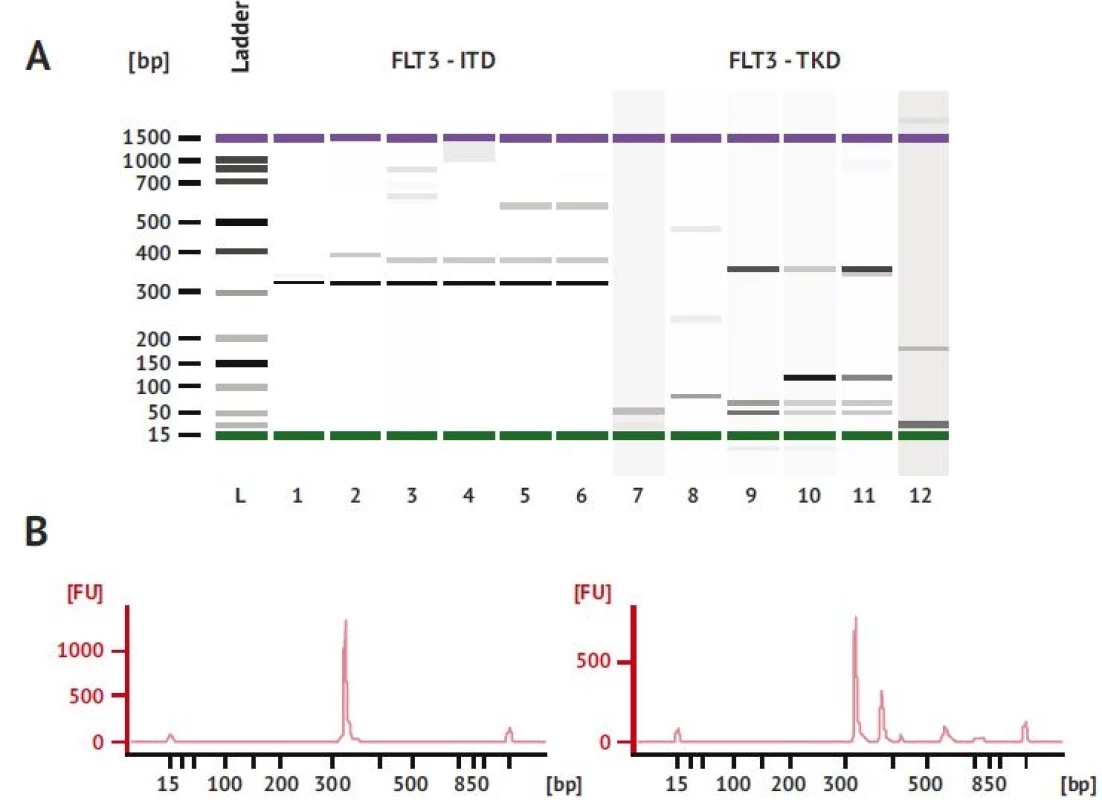
A. Elektroforeogram: L-ladder, 1 – nemutovaný gén FLT3 = 328 bp (zdravý jedinec), 2-6 pacienti s ITD-FLT3 v jednej alele (328 bp –nemutovaná alela, fragmenty dlhšie ako 328 bp = FLT3-ITD), 7- negativna kontrola amplifi kácie (voda), 9 – zdravý jedinec bez mutácie FLT3-TKD, 10,11 – mutácia v 1 alele, 12 - negativna kontrola amplifikácie (voda).
B. Pík 328 bp je fragment nemutovaného génu.
C. Pík 385 bp je dôkaz prítomnosti FLT3-ITD, 328 bp je nemutovaná alela (WT), vypočítava sa aj pomer výšky píku mutovanej a nemutovanej alely (FLT3-ITD : WT).
bp – bázové páryAML pacienti
Súbor tvorilo 141 dospelých pacientov, u ktorých bola diagnostikovaná AML de novo. Priemerný vek AML pacientov v čase diagnózy bol 54,7 rokov (19–81 rokov). Priemerný vek FLT3 negatívnych pacientiov (FLT3–) bol 54,3 rokov, skupina FLT3 pozitívnych pacientov (FLT3+) bola staršia, priemerný vek bol 59,1 rokov.
Pacienti s mutáciou v géne FLT3 tvoria 1/3 (28 %). Pomer mužov (48) a žien (54) v skupine bez FLT3 mutácie je pomer takmer rovnaký, u FLT3+ pacientov je žien (26) 2× viac ako mužov (13). FLT3-ITD bola potvrdená u 18 % pacientov a bodová mutácia FLT3-TKD v 8 % zo všetkých AML pacientov. Dvaja pacienti mali obidve mutácie. V jednom prípade sme potvrdili mutáciu FLT3-ITD v obidvoch alelách, rovnako aj mutáciu FLT3-TKD v obidvoch alelách sme zachytili u jedného pacienta. Obidvaja pacienti zomreli pár dní od potvrdenia diagnózy.
V rámci skupín FLT3+/ – sme pacientov ďalej rozdelili podľa prítomnosti ďalších chromozómových aberácií – bez aberácií, trizómia chromozómu 8, PML-RARA, CBFB-MYH11, AML1-ETO, MLL, komplexný karyotyp. Percentuálne zastúpenie pacientov v jednotlivých špecifických podskupinách bolo takmer rovnaké u FLT3 – aj u FLT3+, s výnimkou translokácie t (15; 17) /PML-RARA, kde u FLT3+ pacientov to bolo 15 oproti 7 % FLT3 – a naopak, pacienti s komplexným karyotypom a viac ako dvoma ďalšími prítomnými genetickými aberáciami v skupine FLT3 – tvorili 14 oproti 3 % v súbore FLT3+. V skupine FLT3+ pacientov sme nezachytili ani jednu translokáciu t (8; 21) /AML1-ETO.
Porovnávali sme úmrtnosť pacientov do 1 roka od stanovenia diagnózy. Mutácia v géne FLT3 predstavuje nepriaznivý prognostický faktor, čo sa potvrdilo aj vo vyššej úmrtnosti pacientov v skupine FLT3+ (33 %) oproti 10 % v skupine FLT3–. V skupine FLT3 – bolo 57 pacientov (56 %) s normálnym karyotypom, z toho zomreli 3 pacienti, čo predstavuje 5 % pacientov s normálnym karyotypom a FLT3 negativitou. FLT3 pozitivitu a normálny karyotyp malo 23 pacientov (59 %), z toho 30 % pacientov (7 pacientov) zomrelo. Aj u pacientov s normálnym karyotypom, ktorí sú zaradení do skupiny s intermediárnou prognózou, sa potvrdil posun k horšej prognóze v prípade mutácie v géne FLT3.
V rámci FLT3+ skupiny bola vyššia úmrtnosť u pacientov s FLT3-ITD (9 pa-cientov) ako u pacientov s FLT3-TKD (3 pacienti), ale percentuálne zastúpenie úmrtí v rámci danej mutácie bolo takmer rovnaké (35, resp. 36 %). Jedna 77-ročná pacientka s dvojitou mutáciou FLT3-ITD-TKD bola paradoxne v remisii.
MDS pacienti s prechodom do AML
Pacientov s diagnózou MDS (8 pacientov), ktorí boli vyšetrení v súvislosti s prechodom MDS do AML, sme zaradili do samostatného súboru. Priemerný vek pacientov bol 65,6 rokov. Z piatich FLT3 – pacientov s prechodom do AML traja zomreli do 6 mesiacov od potvrdenia prechodu do AML. Ostatní remisiu nedosiahli. U troch MDS pacientov bola pri prechode do AML potvrdená FLT3 pozitivita, z toho u dvoch (1 muž a 1 žena, obaja vo veku 60 rokov) FLT3-ITD a u jedného FLT3-TKD. U FLT3 + pacientov bola táto mutácia jedinou pozitívnou genetickou aberáciou z vyšetrovaného panelu. U ženy bola FLT3-ITD počas MDS diagnózy negatívna, pozitivita sa potvrdila až pri prechode do AML po 9 mesiacoch od monitorovania FLT3 počas diagnózy MDS. Pacientka po roku od prechodu do AML je v dispenzári. Druhý pacient – 60ročný muž, bol u nás vyšetrený prvýkrát až pri prechode MDS do AML a odvtedy až do úmrtia (po 16 mesiacoch) bol monitorovaný na FLT3-ITD-pozitivitu. Priebeh ochorenia tohto pacienta je zaznamenaný na obr. 4. Pre názornosť sú tu uvedené aj hodnoty CD34+, ktoré podobne ako ostatné hematologické parametre korelovali s prítomnosťou mutácie FLT3-ITD. Veľkosť fragmentu mutovanej alely bola identická pri 1. analýze aj pri relapse ochorenia (po 13,5 mesiacoch), no odlišný bol pomer medzi mutovanou a nemutovanou alelou. Pri nasledujúcom kontrolnom vyšetrení (po 16 mesiacoch) bol už aj pomer medzi obidvoma alelami rovnaký ako pri 1. analýze.
Image 4. Elektroforeogram PCR fragmentov génu FLT3 u pacienta s prechodom MDS do AML. 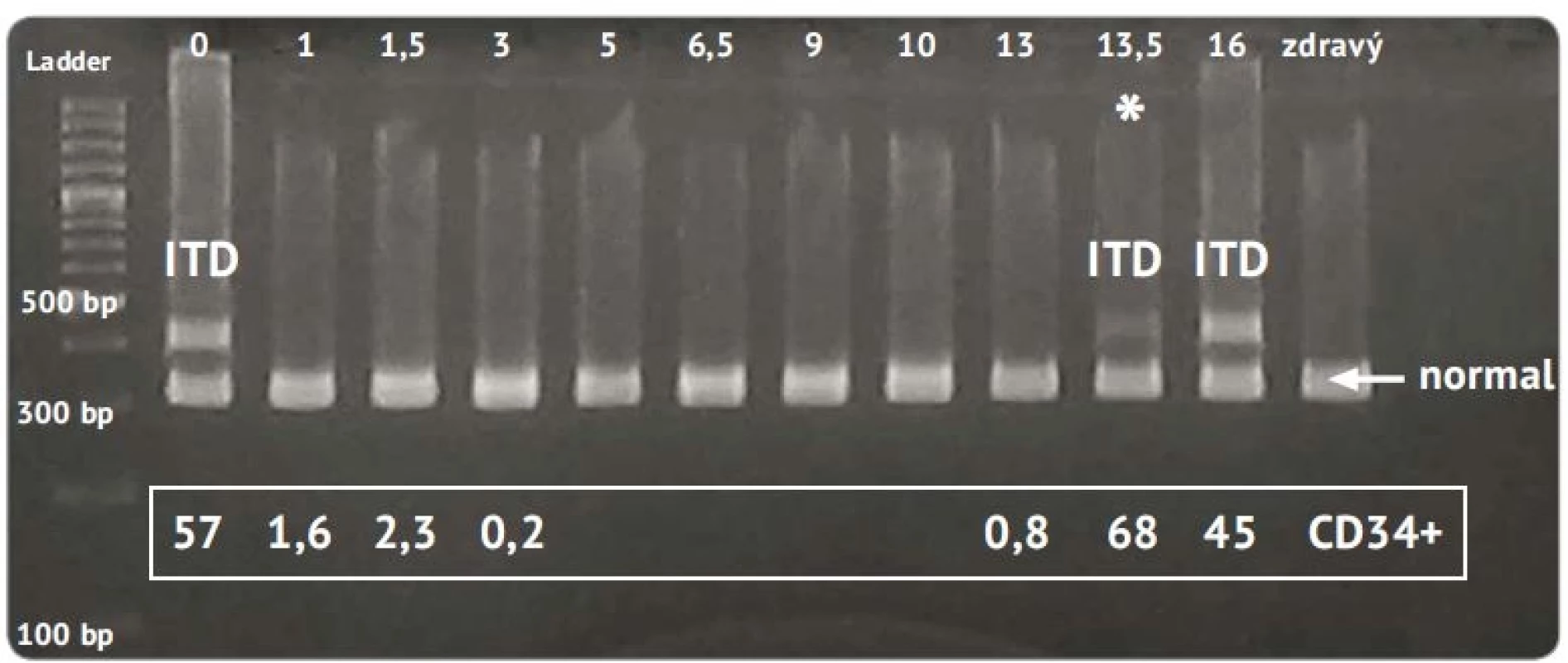
Vzorky boli zoradené podľa časovej osi za účelom potvrdenia identity mutácie FLT3-ITD pri prvej analýze a v čase relapsu. V hornej časti záznamu je časová os monitoringu FLT3 v mesiacoch, hviezdičkou je vyznačený relaps. Zdravý jedinec bol do analýzy zaradený ako kontrola amplifikácie nemutovanej alely (normal). Uvedené hodnoty CD34+ korelujú s FLT3 pozitivitou
ITD – interná tandemová mutácia, PCR – polymerázová řeťazovázová reakcia, MDS – myelodysplastický syndróm, AML – akútna myeloblastová leukémiaDiskusia
Mutácie v géne FLT3 u pacientov s AML patria k negatívnym prognostickým markerom a výrazne zvyšujú riziko relapsov a úmrtia, preto ich monitoring je už súčasťou základných molekulovo-genetických vyšetrovacích panelov. Výsledky dôkazu mutácií v géne FLT3 u pacientov východoslovenského regiónu s diagnózou AML de novo korelujú s publikovanými výsledkami štúdie nemeckých pacientov [21] napriek takmer rádovému rozdielu v počte pacientov (979 pacientov v uvedenej štúdii oproti 142 pacientov v aktuálnej štúdii) (tab. 1). Pre porovnanie výsledkov sme vybrali štúdiu, kde na dôkaz mutácií v géne FLT3 bola použitá rovnaká PCR metóda. Rozdiely vo výskyte translokácií t (15; 17) /PML-RARA a 16inv (16) (p13; q22) / t (16; 16) (p13; q22) //CBFB-MYH11 oproti databáze nemeckých pacientov sú spôsobené pravdepodobne malým počtom pacientov v našom súbore. U pacientov s translokáciou PML/RARA bol pomer medzi FLT3 – a FLT3-ITD+ približne 1 : 2 v obidvoch súboroch.
Table 1. Porovnanie výsledkov monitoringu FLT3 vo vzorkách pacientov s AML de novo analyzovaných v laboratóriu SEMBID a s publikovanou štúdiou (Thiede, 2002). Uvedené hodnoty sú v %. 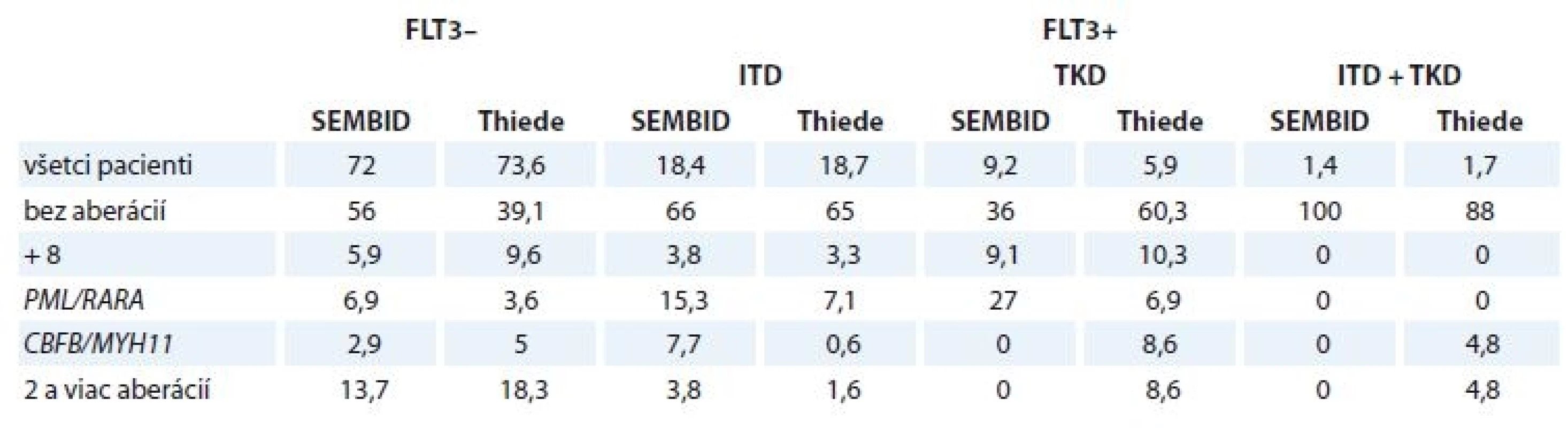
ITD – interná tandemová mutácia, TKD – tyrozinkinézová doména, AML – akútna myeloblastová leukémia V súbore boli aj 2 pacientky (44 a 77 ro-kov) s obidvoma mutáciami. Predpokladá sa [22], že prítomnosť obidvoch mutácií zhoršuje prognózu. Napriek tomu 77-ročná pacientka s obidvoma mutáciami dosiahla remisiu. Materiál tejto pacientky bude podrobený ďalším analýzam za účelom zistenia presného typu bodovej mutácie, ako aj lokalizovania mutácií FLT3-ITD a FLT3-TKD na alelách, t. j. či sú mutácie na tej istej alebo rôznych alelách.
U všetkých pacientov sme vyšetrovali paralelne PK aj KD pri vstupnom vyšetrení aj pri monitorovaní účinku terapie. V obidvoch materiáloch boli mutácie identické a dobre detegovateľné. Len v jedinom prípade relapsu bola mutácia prítomná len vo vzorke KD, vzorka PK bola negatívna.
Typ a veľkosť FLT3-ITD mutácie boli pri vstupnom vyšetrení a relapse u všetkých monitorovaných pacientov rovnaké, teda jednalo sa o rovnaký klon.
Mutácie v géne FLT3 boli vyšetrované aj u MDS pacientov. Do štúdie sme vybrali len tých pacientov, u ktorých bol diagnostikovaný prechod do AML. Zaujímavosťou bolo, že pacienti bez FLT3 mutácie po prechode do AML zomreli do 6 mesiacov, zatiaľ čo pacient s FLT3-ITD prežil 16 mesiacov a druhá pacientka s FLT3-ITD zatiaľ prežíva viac ako rok. Tento fakt koreluje s publikovaným údajom [17], kde pacienti bez FLT3 mutácie prežívali kratšie (priemer 16 mesiacov) ako pacienti s mutáciou FLT3 (19 mesiacov). Vzhľadom na náš veľmi malý súbor sekundárnych AML pacientov nie je možné robiť podrobnejšie závery ani porovnávať údaje s literatúrou.
Na dôkaz mutácií v géne FLT3 sme aplikovali jednoduchú PCR metódu so separáciou fragmentov na klasickej agarózovej elektroforéze a verifikácii pozitivity na mikročipe na zariadení Bioanalyzer 2100, kde sme presne určili veľkosti fragmentov ako aj pomer medzi mutovanou a nemutovanou alelou v prípade FLT3-ITD. Táto metóda bola dostatočne citlivá na dôkaz mutácií. Nebol problém ani s amplifikáciou dlhších úsekov FLT3-ITD, kde je viditeľný vyšší podiel mutovanej alely, ktorá je dlhšia ako nemutovaný fragment s nižšou intenzitou.
Výber vhodnej metódy je dôležitý pre správne zachytenie nielen pozitivity, ale aj pomeru medzi mutovanou (FLT3-ITD) a nemutovanou alelou (wild type – WT) v súvislosti s prognózou a možnosťou skoršieho relapsu a celkovým prežívaním pacienta. Dlhšie fragmenty a vyšší pomer FLT3-ITD: WT zhoršujú prognózu ochorenia [23].
Záver
Výsledky analyzovaného súboru poukazujú na vhodne zvolenú PCR metódu, ktorá je relatívne rýchla a finančne nenáročná, čo umožňuje monitorovať mutácie v géne FLT3 nielen u pacientov s AML, ale rutinne aj u všetkých MDS a CMMoL (chronická myelomonocytová leukémia) pacientov. Aplikovaná metóda bola dostatočne citlivá na dôkaz mutácií a bezproblémovú amplifikáciu aj dlhších úsekov FLT3-ITD. Verifikácia FLT3 pozitivity na mikročipe nahrádza separáciu PCR produktu na kapilárnej elektroforéze, ktorá je finančne podstatne náročnejšia ako analýza na mikročipe.
V rutinnej klinickej praxi sú FLT3+ pacienti zatiaľ dilemou. Z dôvodu určenia prognózy v súčasnosti pre našich klinikov úplne stačí dôkaz FLT3 pozitivity a pravidelný monitoring tejto mutácie pri každej kontrole. Stanovenie pomeru FLT3-ITD: WT sa zatiaľ nevyžaduje. Monitoring MDS a CMMoL pacientov na prítomnosť FLT3 mutácií by mal byť súčasťou základného vyšetrovacieho panelu v rámci molekulovej genetiky, pretože objavenie sa FLT3 pozitivity u týchto pacientov je predzvesťou prechodu do AML.
Vzhľadom na vývoj inhibítorov FLT3 – tyrozínkinázy v súvislosti s liečbou FLT3+ pacientov sa uvažuje aj o zavedení štandardného postupu pri monitorovaní minimálneho reziduálneho ochorenia (minimal residual disease – MRD) na základe kvantifikácie FLT3-ITD (podobne ako u CML monitoring fúzneho génu BCR/ABL). V mnohých prípadoch je mutácia v géne FLT3 jediný pozitívny genetický marker u AML pacientov.
Poďakovanie
Vďaka za spoluprácu patrí Mgr. Ivete Lučkovej a RNDr. Františkovi Spišákovi, PhD.
Táto práca bola podporená grantom z Európského fondu regionálneho rozvoja OPVaV - -2009/2.2/05-SORO (ITMS kód: 26220220143).
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
doc. Ing. Katarína Dubayová, PhD.
Ústav lekárskej a klinickej biochémie UPJŠ LF Košice
Trieda SNP 1 040 11 Košice
e-mail: sembid.vyskum@gmail.com
Obdržané: 19. 10. 2017
Prijaté: 15. 2. 2018
Sources
1. Vašková J, Dubayová K, Čakanová G et al. Incidence and prognostic value of known genetic aberrations in patients with acute myeloid leukemia – a two year study. Klin Onkol 2015; 28 (4): 278–283. doi: 10.14735/amko2015278.
2. Testa U, Pelosi E. The impact of FLT3 mutations on the development of acute myeloid leukemias. [online]. Leukemia Research and Treatment; 2013. Available from: http: //dx.doi.org/10.1155/2013/275760.
3. Grafone T, Palmisano M, Nicci C et al. An overview on the role of FLT3-tyrosine kinase receptor in acute myeloid leukemia: biology and treatment. Oncology Reviews 2012; 6 (1): 8e. doi: 10.4081/oncol.2012.e8.
4. Rosnet O, Schiff C, Pebusque MJ et al. Human FLT3/FLK2 gene: cDNA cloning and expression in hematopoietic cells. Blood 1993; 82 (4): 1110–1119.
5. Rosnet O, Buhring HJ, Delapayere O et al. Expression and signal transduction of the FLT3 tyrosine kinase receptor. Acta Haematol 1996; 95 (3–4): 218–223. doi: 10.1159/000203881.
6. Griffith J, Black J, Faerman C et al. The structural basis for autoinhibition of FLT3 by the juxtamembrane domain. Mol Cell 2004; 13 (2): 169–178.
7. Abu-Duhier FM, Goodeve AC, Wilson GA et al. Identification of novel FLT-3 Asp835 mutations in adult acute myeloid leukaemia. Br J Haematol 2001; 113 (4): 983–988.
8. Yamatoto Y, Kioyi H, Nakano Y et al. Activating mutation of D835 within the activation loop of FLT3 in human hematologic malignancies. Blood 2001; 97 (8): 2434–2439.
9. Quentmeier H, Reinhardt J, Zaborski M et al. FLT3 mutations in acute myeloid leukemia cell lines. Leukemia 2003; 17 (1): 120–124. doi: 10.1038/sj.leu.2402740.
10. Whitman SP, Archer KJ, Feng I et al. Absence of the wild-type allele predicts poor prognosis in adult de novo acute myeloid leukemia with normal cytogenetics and the internal tandem duplications of FLT-3: a cancer and leukemia group B study. Cancer Res 2001; 61 (19): 7233–7239.
11. Stirewalt DL, Kopecky KJ, Meschinchi S et al. Size of FLT3 internal tandem duplication has prognostic significance in patients with acute myeloid leukemia. Blood 2006; 107 (9): 3724–3726. doi: 10.1182/blood-2005-08-3453.
12. Kayser S, Schlenk RF, Londono MC et al. Insertion of FLT3 internal tandem duplication in the tyrosine kinase domain-1 is associated with resistance to chemotherapy and inferior outcome. Blood 2009, 114 (12): 2386–2392. doi: 10.1182/blood-2009-03-209999.
13. Kioyi H, Ohno R, Ueda R et al. Mechanism of constitutive activation of FLT3 with internal tandem duplication in the juxtamembrane domain. Oncogene 2002; 21 (16): 2555–2563. doi: 10.1038/sj.onc.1205332.
14. Kusec R, Vrsalovic M, Bobetic T et al. Fms-Like Tyrosine kinase (FLT3) gene ITD mutation in acute myeloid leukemia. Zdrav Vestn 2004, 73 (supl 1): 5–7.
15. Small, D. FLT3 Mutations: Biology and Treatment. Hematology Am Soc Hematol Educ Program 2006 : 178–184. doi: 10.1182/asheducation-2006.1.178.
16. Zaker F, Mohammadzadeh M, Mohammadi M. Detection of KIT and FLT3 Mutations in Acute Myeloid Leukemia with Different Subtypes. Arch Iran Med 2010; 13 (1): 21–25.
17. Daver N, Strati P, Jabbour E et al. FLT3 mutations in myelodysplastic syndrome and chronic myelomonocytic leukemia. Am J Hematol 2013; 88 (1): 56–59. doi: 10.1002/ajh.23345.
18. Takahashi S. Downstream molecular pathways of FLT3 in the pathogenesis of acute myeloid leukemia: biology and therapeutic implications. [online]. Journal of Hematology & Oncology 2011; 4 : 13. Available from: https: //doi.org/10.1186/1756-8722-4-13.
19. Ilenčíková D, Sýkora J, Mikulášová Z et al. Identifikácia molekulárnych markerov u detí s akútnou myeloblastovou leukémiou (AML). Klin Onkol 2012; 25 (1): 26–35. doi: 10.14735/amko201226.
20. Meshinchi S, Appelbaum FR. Structural and functional alterations of FLT3 in acute myeloid leukemia. Clin Cancer Res 2009; 15 (13): 4263–4269. doi: 10.1158/1078-0432.CCR-08-1123.
21. Thiede C, Steudel C, Mohr B et al. Analysis of FLT3-activating mutations in 979 patients with acute myelogenous leukemia: association with FAB subtypes and identification of subgroups with poor prognosis. Blood 2002; 99 (12): 4326–4335.
22. Bagrintseva K, Geisenhof S, Kern R et al. FLT3-ITD-TKD dual mutants associated withAMLconfer resistance to FLT3 PTK inhibitors and cytotoxic agents by overexpression of Bcl-x (L). Blood 2005; 105 (9): 3679–3685. doi: 10.1182/blood-2004-06-2459.
23. Levis M. FLT3 mutations in acute myeloid leukemia: what is the best approach in 2013? Hematology Am Soc Hematol Educ Program 2013; 2013 : 220–226. doi: 10.1182/asheducation-2013.1.220.
Labels
Paediatric clinical oncology Surgery Clinical oncology
Article was published inClinical Oncology

2018 Issue 3-
All articles in this issue
- Monoclonal gammopathy of undetermined significance
- Neuroendokrinné neoplázie gastrointestinálneho traktu z pohľadu histopatológie
- Možná úloha ľudských herpetických vírusov podčeľade Alphaherpesvirinae pri vzniku niektorých nádorových ochorení
- Potenciál flavonoidu quercetinu v prevenci a léčbě nádorů – současný stav výzkumu
- Trastuzumab v neoadjuvantní léčbě HER2+ karcinomu prsu – 5leté zkušenosti z onkologické kliniky 1. LF UK a VFNTrastuzumab v neoadjuvantní léčbě HER2+ karcinomu prsu – 5leté zkušenosti z onkologické kliniky 1. LF UK a VFN
- Detekcia mutácií v géne FLT3 u pacientov východoslovenského regiónu
- Výsledky léčby krizotinibem v léčbě nemalobuněčného ALK pozitivního karcinomu plic v České republice
- Resekce sarkomu dutiny břišní, pánve a retroperitonea
- Vybrané genetické polymorfizmy asociované s hypoxií a multilékovou rezistencí u pacientů s monoklonálními gamapatiemi
- Clinical Oncology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Potenciál flavonoidu quercetinu v prevenci a léčbě nádorů – současný stav výzkumu
- Neuroendokrinné neoplázie gastrointestinálneho traktu z pohľadu histopatológie
- Resekce sarkomu dutiny břišní, pánve a retroperitonea
- Detekcia mutácií v géne FLT3 u pacientov východoslovenského regiónu
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

