-
Medical journals
- Career
Aktuální doporučení pro prevenci a terapii venózní trombembolické nemoci u onkologicky nemocných
Authors: J. Halámková 1,2; M. Penka 3
Authors‘ workplace: Klinika komplexní onkologické péče LF MU a Masarykův onkologický ústav, Brno 1; Ústav lékařské etiky, LF MU, Brno 2; Oddělení klinické hematologie, LF MU a FN Brno 3
Published in: Klin Onkol 2017; 30(2): 100-105
Category: Reviews
doi: https://doi.org/doi: 10.14735/amko2017100Overview
Během svého onkologického onemocnění prodělá venózní tromboembolickou nemoc (VTE) kolem 20 % pacientů. Aktivní nádorové onemocnění společně s onkologickou léčbou toto riziko dále výrazně zvyšuje, pravděpodobnost vzniku VTE stoupá v prvních 6 měsících od stanovení diagnózy. Nejčastěji VTE doprovází hematoonkologická onemocnění, nádory centrálního nervového systému, gastrointestinálního traktu, prsu, plic, ovarií a dělohy. Přítomnost vzdálených metastáz společně se zavedením centrálního venózního katetru toto riziko ještě zvyšuje. Onkologicky nemocný pacient má během antikoagulační terapie také 2–5× vyšší riziko rekurence VTE proti pacientovi bez malignity a současně 2–6× vyšší riziko závažného krvácení. Tromboembolická nemoc je také nezávislým prognostickým faktorem úmrtí pacientů s malignitou. Prevence a léčba VTE je tak součástí každodenní praxe onkologa, který by měl znát základní doporučení, týkající se jednotlivých léčebných postupů a klinických situací, které mohou u onkologicky nemocného nastat a měl by být schopen je adekvátně vyřešit. Je třeba myslet i na jistá specifika, která profylaxi, diagnostiku a léčbu žilního tromboembolizmu v rámci onkologické péče provázejí. Mezinárodní iniciativa pro trombózu a nádorová onemocnění (ITAC-CME) vytvořila mobilní aplikaci, která se zakládá na mezinárodních pokynech pro prevenci a léčbu VTE. Jedná se o jednoduchý schématický algoritmus pro rozhodování, který pomáhá volit správné léčebné strategie a podporuje uvážlivé a odpovídající použití antikoagulancií v profylaxi a v léčbě VTE u pacientů s nádorovým onemocněním. Toto sdělení je souhrnem základních doporučení aplikovatelných v běžné klinické praxi.
Klíčová slova:
embolie a trombóza – zhoubný nádor – trombóza centrálního venózního katetru – doporučeníÚvod
Během svého onkologického onemocnění prodělá venózní trombembolickou nemoc (venous thrombembolism – VTE) kolem 20 % pacientů. Aktivní nádorové onemocnění zvyšuje u těchto nemocných riziko vzniku VTE 4,1–6,9×, společně s chemoterapií je pak toto riziko ještě vyšší (6,5–9,9×) [1]. Se stoupající incidencí nádorových onemocnění stoupá i výskyt venózního trombembolizmu vznikajícího v souvislosti s nádorem. Prevence a léčba VTE je tak součástí každodenní praxe onkologa. Nejčastěji VTE doprovází hematoonkologická onemocnění, zhoubné nádory centrálního nervového systému, gastrointestinálního traktu, prsu, plic, ovarií a dělohy. Přítomnost vzdálených metastáz společně se zavedením centrálního venózního katetru toto riziko ještě zvyšuje. Pravděpodobnost vzniku VTE se v průběhu onemocnění mění, nejvyšší je v prvních 6 měsících od stanovení diagnózy, následně stoupá s případným operačním zákrokem, systémovou léčbou či hospitalizací. Pokud se pacienta podaří uvést do kompletní remise, riziko VTE klesá a opět roste se vznikem vzdálených metastáz a následně v preterminálním a terminálním stadiu onemocnění. Onkologicky nemocný pacient má během antikoagulační terapie také 2–5× vyšší riziko rekurence VTE proti pacientovi bez malignity a současně 2–6× vyšší riziko závažného krvácení [2,3]. Trombembolická nemoc je také nezávislým prognostickým faktorem úmrtí pacientů s malignitou (graf 1) [1]. Rizikové faktory pro vznik VTE v přítomnosti nádorového onemocnění jsou shrnuty v tab. 1.
Graph 1. Pravděpodobnost úmrtí pacienta po proběhlé hospitalizaci podle Levitan et al [12]. ![Pravděpodobnost úmrtí pacienta po proběhlé hospitalizaci podle Levitan et al [12].](https://pl-master.mdcdn.cz/media/image/2b847acde6dfefbd96c8f042e8dde35a.png?version=1537793214)
Table 1. Rizikové faktory pro vznik VTE [12–16]. ![Rizikové faktory pro vznik VTE [12–16].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/ed0722e921b768e2232250f633279414.png)
Farmakologická profylaxe venózního trombembolizmu
Doporučení pro farmakologickou profylaxi u onkologického pacienta – chirurgický výkon
Operační riziko vzniku VTE u pacienta s aktivním onkologickým onemocněním je 2× vyšší než u operace z jiné než onkologické příčiny.
- V prevenci VTE se u operovaných pacientů s malignitou doporučuje nejvyšší možná profylaktická dávka nízkomolekulárního heparinu (low molecular weight heparin – LMWH) 1× denně nebo nízká dávka nefrakcionovaného heparinu (unfractionated heparin – UFH) 3× denně, zahájení 12–2 hod před výkonem a následně 7–10 dní, aplikace LMWH 1× denně je výhodnější.
- U pacientů s vysokým rizikem VTE, nízkým rizikem krvácení, po laparotomickém, příp. rozsáhlém chirurgickém výkonu je doporučena prodloužená profylaxe 4 týdny.
- V případě laparoskopie platí obdobná doporučení jako u laparotomie [1].
Doporučení pro farmakologickou profylaxi u onkologického pacienta – nechirurgická terapie
- U hospitalizovaných onkologických pacientů léčených chemoterapií, radioterapií, hormonoterapií či cílenou léčbou se profylaxe VTE doporučuje, zatímco u nemocných v ambulantní péči rutinně antitrombotická profylaxe doporučena není [4].
- Farmakologickou profylaxi VTE lze indikovat u ambulantních pacientů s lokálně pokročilým nebo metastatickým karcinomem pankreatu, kteří jsou léčeni chemoterapií a mají nízké riziko krvácení a vysoké riziko VTE. Farmakologickou profylaxi lze doporučit i u ambulantních pacientů s lokálně pokročilým nebo metastatickým karcinomem plic léčených chemoterapií s nízkým rizikem krvácení a vysokým rizikem VTE (studie PROTECHT, TOPIC 2) [1,2,5–8].
- Farmakologická profylaxe VTE je doporučena u pacientů s mnohočetným myelomem léčených talidomidem nebo lenalidomidem v kombinaci se steroidy a/nebo chemoterapií (v tomto případě lze volit mezi LMWH v profylaktických dávkách, warfarinem v nízkých nebo terapeutických dávkách, ale také kyselinou acetylsalicylovou v nízké dávce) [9].
- Prevence VTE se jednoznačně doporučuje u hospitalizovaných farmakologicky léčených málo mobilních pacientů s malignitou.
- U pacientů s centrálním žilním katetrem se primární profylaxe VTE nedoporučuje.
Specifické situace v onkologii
- U pacientů s těžkým renálním selháním (clearance kreatininu < 30 ml/min) lze použít mechanickou profylaxi a individuálně lze zvážit farmakologickou profylaxi (po individuálním zvážení lze použít UFH).
- U pacientů s malignitou a mírnou trombocytopenií – při počtu trombocytů > 80 × 109/l – lze použít farmakologickou profylaxi, pokud je počet trombocytů < 80 × 109/l, lze individuálně uvažovat o farmakologické profylaxi za důsledné laboratorní a klinické monitorace, při počtu trombocytů < 50 × 109/l je antikoagulační terapie kontraindikována.
- U gravidních pacientek s karcinomem je nutno provádět standardní profylaxi [1].
Pro výpočet pravděpodobného vzniku VTE lze využít např. prediktivní model pro vznik trombózy (tab. 2).
Table 2. Prediktivní model pro vznik VTE v přítomnosti nádorového onemocnění [15]. ![Prediktivní model pro vznik VTE v přítomnosti nádorového onemocnění [15].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/bcdf08a6c889a55c4e059ef59fd858e1.png)
Diagnostika venózního trombembolizmu
Hlavní klinické projevy hluboké žilní trombózy (HŽT) jsou bolest končetiny, otok, barevné změny končetiny, zvýšená náplň žil, jedná se však o nespecifické a nespolehlivé symptomy. Homansovo případně plantární znamení může být zavádějící. U hospitalizovaných a starších pacientů často probíhá HŽT asymptomaticky. Na základě klinického vyšetření a anamnézy většinou nelze HŽT diagnostikovat, proto byly vypracovány nejrůznější skórovací systémy. Lze využít např. Wellsova klinická kritéria (tab. 3). Mezinárodní iniciativa pro trombózu a nádorová onemocnění (ITAC-CME) vytvořila mobilní aplikaci, která se zakládá na mezinárodních pokynech pro prevenci a léčbu VTE. Jedná se o jednoduchý schematický algoritmus pro rozhodování, který pomáhá volit správné léčebné strategie a podporuje uvážlivé a odpovídající použití antikoagulancií v profylaxi a v léčbě VTE u pacientů s nádorovým onemocněním. Je k dispozici k volnému stažení na https: //www.itaccme.com/en/practice-guidelines/guidelines-app.
Table 3. Wellsova klinická kritéria pro diagnostiku HŽT. 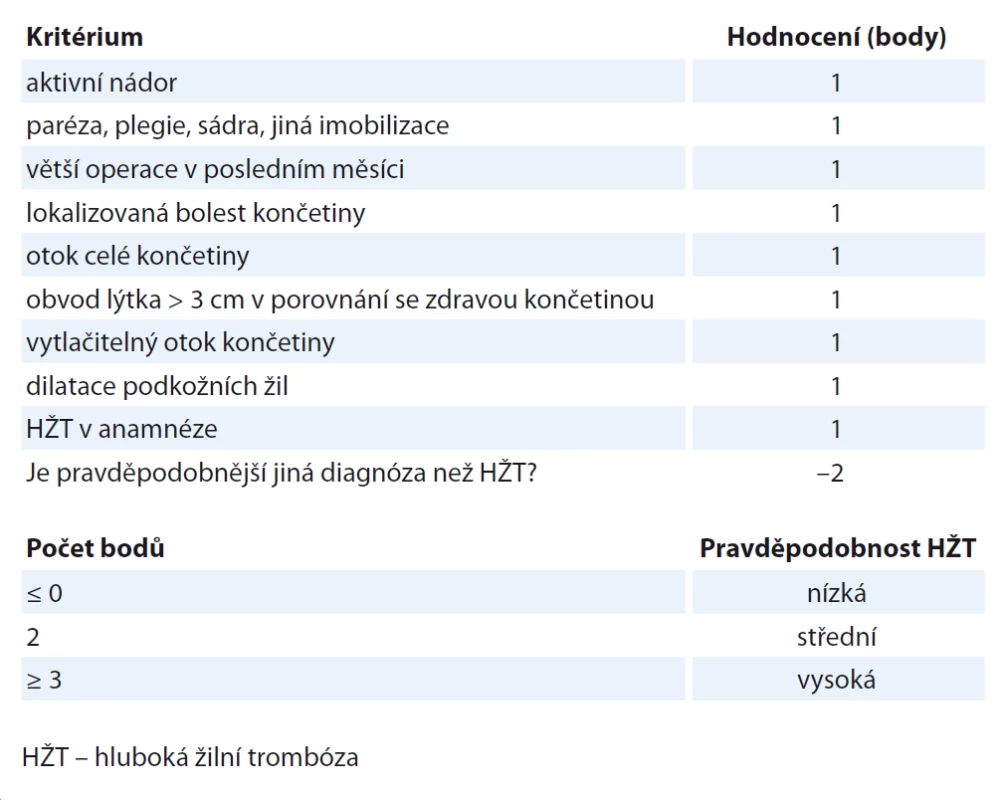
Vzhledem k možným tichým příznakům HŽT musí být každé klinické podezření řádně verifikováno zobrazovací metodou. Vyšetřovací metodou první volby je kompresní celokončetinová ultrasonografie, která má vysokou senzitivitu (91–97 %) i specifitu (91–94 %), jako metodu druhé volby lze využít i CT flebografie, kterou lze kombinovat s CT angiografií k vyloučení současně probíhající plicní embolie, případně flebografie MRI, která je také metodou druhé volby. RTG flebografie se dnes již běžně nepoužívá. Vyšetření D dimerů lze, vzhledem k modifikaci hladiny samotným nádorovým onemocněním, využít pouze k vyloučení VTE, nikoliv k potvrzení, senzitivita tohoto vyšetření je 93 %, specifita je však pouze kolem 25 %. Stanovaní hladiny D dimerů má však negativní prediktivní výpovědní hodnotu 99,5 %, v případě, že je jejich hladina v normálním laboratorním rozmezí, pak se s velkou pravděpodobností o VTE nejedná [1].
Z klinických příznaků plicní embolie se jedná nejčastěji o dušnost, bolesti na hrudníku, hypotenzi, tachykardii, případně synkopu. Kašel či hemoptýza jsou jako prvotní projev plicní embolie vzácnější. V případě hemodynamické stability pacienta s malou nebo střední pravděpodobností vzniku plicní embolie provádíme vyšetření D dimerů, pokud jsou pozitivní, pak došetřujeme provedením spirálního CT plic. U hemodynamicky nestabilních pacientů je pak spirální CT plic metodou volby. Pokud není CT dostupné, je metodou druhé volby ventilačně-perfuzní plicní scintigrafie. Dalšími pomocnými metodami je pak RTG plic, echokardiografie srdce, EKG, BNP (natriuretický peptid B), NT proBNP (N-terminální fragment natriuretického propeptidu typu B), troponin [1].
Terapie VTE u pacientů s maligním onemocněním
Základem konzervativní léčby VTE u onkologických pacientů je podání LMWH. Trombolýza není pro onkologické pacienty metodou volby z důvodu rizika krvácení, může však být ve specifických případech zvažována. V případě kontraindikace antikoagulační terapie či recidiv i přes adekvátní antikoagulační léčbu lze zvážit zavedení kaválního filtru, ten však není indikován jako primární profylaxe VTE u onkologických pacientů. LMWH jsou preferovány pro:
- lepší biologickou dostupnost,
- delší dobu působení než UFH,
- rychlý nástup účinku,
- dobrou korelaci antikoagulační odpovědi s hmotností,
- není třeba laboratorní monitorace (pouze u pacientů s renálním selháním, těhotných, obézních, astenických či dětí),
- menší riziko heparinem indukované trombocytopenie.
Délka podání LMWH je min. 3 měsíce, obecně je však doporučováno 3–6 měsíců dle tolerance, aktivity nádoru či preference pacienta. Delší terapie, tj. 6–12 měsíců, je indikována v případě přetrvávání vyvolávajícího faktoru VTE; u komplikovaného průběhu (např. symptomatická plicní embolie, rozsáhlá žilní trombóza) lze individuálně zvážit podávání i nad 12 měsíců (např. recidivující VTE, průkaz trombofilie). Léčba VKA (antagonisté vitaminu K) u onkologických pacientů není vhodná, protože zvyšuje riziko relapsu VTE a krvácení. Samotný LMWH na rozdíl od LMWH následovaného VKA signifikantně snižuje riziko rekurence VTE o 50 % bez současného zvýšení rizika krvácení, ale nemá žádný vliv na mortalitu [2]. Cíle terapie HŽT jsou shrnuty v tab. 4.
Léčba a profylaxe katetrové trombózy u onkologicky nemocných
- Pro léčbu katetrové žilní trombózy u onkologických pacientů je doporučeno min. 3měsíční podávání LMWH, VKA mohou být užity, chybí však vzájemné přímé srovnání s LMWH.
- Pokud je katetr v dobré pozici, neinfikovaný a funkční, lze jej i v případě diagnostikované žilní trombózy ponechat.
- Bez ohledu na to, zda je centrální žilní katetr ponechán na svém místě nebo vyjmut, nebyla z hlediska délky antikoagulační léčby přijata žádná standardní doporučení.
- Rutinní užití antikoagulancií v profylaxi katetrové trombózy (catheter related thrombosis – CRT) není doporučováno [10].
Role nových perorálních antikoagulačních přípravků u onkologicky nemocných
- Ve studiích s přímými orálními antikoagulancii (direct oral anticoagulants – DOAC) byla jejich účinnost u onkologických pacientů hodnocena jako noninferiorní vůči VKA; k dispozici jsou pouze omezené údaje.
- Není žádné srovnání vůči LMWH, který je standardem v léčbě onkologických pacientů.
- U onkologických pacientů léčených systémovou terapií mohou mít lékové interakce s DOAC klinický význam.
- V této chvíli nejsou z důvodu chybění údajů k dispozici žádná doporučení.
- Prospektivní klinické studie u onkologicky nemocných probíhají [2,11].
Aktuální doporučení Americké společnosti pro klinickou onkologii ASCO – Update 2014 [4]
- Většina hospitalizovaných pacientů s aktivním nádorem je indikována k profylaxi VTE během hospitalizace. Data, která by podpořila rutinní profylaxi VTE u pacientů hospitalizovaných pro krátkodobou aplikaci chemoterapie nebo pro jiné krátkodobé, např. diagnostické důvody, nejsou.
- Rutinní podávání tromboprofylaxe pro ambulantní pacienty není indikováno až na vysoce selektované skupiny s vysokým rizikem VTE.
- Pacient s mnohočetným myelomem léčený antiangiogenní léčbou s chemoterapií a/nebo kortikoidy by měl být indikován k tromboprofylaxi (LMWH nebo nízce dávkovanou kyselinou acetylsalicylovou).
- Pacient, který podstupuje chirurgický výkon, by měl mít standardní profylaxi v délce 7–10 dní začínající 12–24 hod před výkonem.
- Pacient s větším abdominálním či pelvickým výkonem by měl podstoupit rozšířenou profylaxi na 4 týdny.
- V případě diagnózy VTE je indikován LMWH na 5–10 dní s následnou profylaxí na nejméně 6 měsíců.
- DOAC zatím nejsou běžně doporučována v léčbě VTE u pacientů s malignitou.
- Antikoagulační léčba není indikována k prodloužení života nemocných s malignitou, pokud chybí další indikace.
- U onkologicky nemocných by mělo pravidelně proběhnout anamnestické i fyzikální vyšetření s pátráním po VTE.
- Pacient by měl být onkologem instruován o symptomech VTE.
Závěr
Cílem textu není uvést veškeré informace o prevenci a léčbě VTE u pacientů s nádorovým onemocněním, ale upozornit na jistá specifika, která profylaxi, diagnostiku a léčbu žilního trombembolizmu v rámci onkologické péče provázejí, a shrnout základní doporučení aplikovatelná v běžné klinické praxi.
Během recenzního řízení článku byly aktualizovány doporučené postupy ITAC-CME pro léčbu a profylaxi VTE u onkologických pacientů – Farge D, Bounameaux H, Brenner B et al. International clinical practice guidelines including guidance for direct oral anticoagulants in the treatment and prophylaxis of venous thromboembolism in patients with cancer. Lancet Oncol 2016; 17 (10): e452–e466. doi: 10.1016/S1470-2045 (16) 30369-2.
Práce byla podpořena MZ ČR – RVO (MOÚ, 00209805).
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Obdrženo: 1. 8. 2016
Přijato: 26. 10. 2016
MUDr. Jana Halámková, Ph.D.
Klinika komplexní onkologické péče
LF MU a Masarykův onkologický ústav
Žlutý kopec 7
656 53 Brno
e-mail: jana.halamkova@mou.cz
Sources
1. Hirmerová J, Karetová D, Malý R et al. Akutní žilní trombóza 2014: současný stav prevence, diagnostiky a léčby. Doporučený postup české angiologická společnosti ČLS JEP [citováno 23. července 2016]. Dostupné z: http: //csth.cz/index.php?goto=doporucene postupy.
2. Farge D, Debourdeau P, Beckers M et al. International clinical practice guidelines for the treatment and prophylaxis of venous thromboembolism in patients with cancer. J Thromb Haemost 2013; 11 (1): 56–70. doi: 10.1111/jth.12070.
3. Chew HK, Wun T, Harvey D et al. Incidence of venous trombembolism and its effect on survival among patients with common cancers. Arch Intern Med 2006; 166 (4): 458–464.
4. Lyman GH, Bohlke K, Khorana AA et al. Venous thromboembolism prophylaxis and treatment in patients with cancer: american society of clinical oncology clinical practice guideline update 2014. J Clin Oncol 2015; 33 (6): 654–656. doi: 10.1200/JCO.2014.59.7351.
5. Agnelli G, Gussoni G, Bianchini C et al. Nadroparin for the prevention of thromboembolic events in ambulatory patients with metastatic or locally advanced solid cancer receiving chemotherapy: a randomised, placebo-controlled, double-blind study. Lancet Oncol 2009; 10 (10): 943–949. doi: 10.1016/S1470-2045 (09) 70232-3.
6. Verso M, Gussoni G, Agnelli G. Prevention of venous thromboembolism in patients with advanced lung cancer receiving chemotherapy: a combined analysis of the PROTECHT and TOPIC-2 studies. J Thromb Haemost 2010; 8 (7): 1649–1651. doi: 10.1111/j.1538-7836.2010.03901.x.
7. Maraveyas A, Waters J, Roy R et al. Gemcitabine versus gemcitabine plus dalteparin thromboprophylaxis in pancreatic cancer. Eur J Cancer 2012; 48 (9): 1283–1292. doi: 10.1016/j.ejca.2011.10.017.
8. Riess H, Pelzer U, Opitz et al. A prospective, randomized trial of simultaneous pancreatic cancer treatment with enoxaparin and chemotherapy: final results of the CONKO-004 trial. J Clin Oncol 2010; 28 (Suppl 15): abstr. 4033.
9. Becattini C, Agnelli G, Schenone A et al. Aspirin for preventing the recurrence of venous thromboembolism. N Engl J Med 2012; 366 (21): 1959–1967. doi: 10.1056/ NEJMoa1114238.
10. Debourdeau P, Farge D, Beckers M et al. International clinical practice guidelines for the treatment and prophylaxis of thrombosis associated with central venous catheters in patients with cancer. J Thromb Haemost 2013; 11 (1): 71–80. doi: 10.1111/jth.12 071.
11. Short NJ, Connors JM. New oral anticoagulants and the cancer patient. Oncologist 2014; 19 (1): 82–93. doi: 10.1634/theoncologist.2013-0239.
12. Levitan N, Dowlati A, Remick SC et al. Rates of initial and recurrent thromboembolic disease among patients with malignancy versus those without malignancy. Risk analysis using Medicare claims data. Medicine (Baltimore) 1999; 78 (5): 285–291.
13. Ay C, Dunkler D, Marosi C et al. Prediction of venous thromboembolism in cancer patients. Blood 2010; 116 (24): 5377–5382. doi: 10.1182/blood-2010-02-270 116.
14. Farge-Bancel D, Bounameaux H, Brenner B et al. Implementing thrombosis guidelines in cancer patients: a review. Rambam Maimonides Med J 2014; 5 (4): e0041. doi: 10.5041/RMMJ.10175.
15. Khorana AA, Kuderer NM, Culakova E et al. Development and validation of a predictive model for chemotherapy-associated thrombosis. Blood 2008; 111 (10): 4902–4907. doi: 10.1182/blood-2007-10-116327.
16. Lyman GH, Khorana AA, Falanga A et al. American Society of Clinical Oncology guideline: recommendations for venous thromboembolism prophylaxis and treatment in patients with cancer. J Clin Oncol 2007; 25 (34): 5490–5505.
Labels
Paediatric clinical oncology Surgery Clinical oncology
Article was published inClinical Oncology

2017 Issue 2-
All articles in this issue
- Poškození kognitivních funkcí po chemoterapii u pacientů s Hodgkinovým lymfomem – patofyziologie a rizikové faktory
- Aktuální doporučení pro prevenci a terapii venózní trombembolické nemoci u onkologicky nemocných
- Káva v chemoprevenci nádorů
- Vybrané epidemiologické ukazovatele karcinómu prostaty na Slovensku v porovnaní so zahraničím
- Stereotaktická radioterapie karcinomu prostaty – efektivita a toxicita
- Effect of Erlotinib in 2nd and 3rd Line Anticancer Treatment in Patients with Squamous Cell Lung Cancer – Case Series
- Autoimunní hemolytická anémie způsobená léčbou ipilimumabem
- Clinical Oncology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Poškození kognitivních funkcí po chemoterapii u pacientů s Hodgkinovým lymfomem – patofyziologie a rizikové faktory
- Káva v chemoprevenci nádorů
- Stereotaktická radioterapie karcinomu prostaty – efektivita a toxicita
- Vybrané epidemiologické ukazovatele karcinómu prostaty na Slovensku v porovnaní so zahraničím
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career


