-
Medical journals
- Career
Stereotaktická radioterapie karcinomu prostaty – efektivita a toxicita
: E. Skácelíková 1; D. Feltl 1; J. Cvek 1; T. Jelenová 2; L. Knybel 1; H. Tomášková 3
: Onkologická klinika LF OU a FN Ostrava 1; Úsek hygienika, Ústav epidemiologie a ochrany veřejného zdraví, LF OU a FN Ostrava 2; Zdravotní ústav se sídlem v Ostravě, Ústav epidemiologie a ochrany veřejného zdraví, LF OU v Ostravě 3
: Klin Onkol 2017; 30(2): 121-127
: Original Articles
prolekare.web.journal.doi_sk: https://doi.org/10.14735/amko2017121Východiska:
Karcinom prostaty je nejčastějším nádorovým onemocněním mužské populace, jehož incidence nadále stoupá. Velká část onemocnění je diagnostikována v časném bezpříznakovém období, kdy má velice dobrou prognózu. Při rozhodnutí o léčbě pro konkrétního pacienta hraje roli účinnost jednotlivých terapeutických modalit a jejich toxicita. Jednou z metod léčby časných stadií karcinomu prostaty je stereotaktická radioterapie, jejíž první výsledky z našeho pracoviště článek prezentuje.Soubor pacientů a metody:
Soubor zahrnuje 261 pacientů s diagnózou nízce nebo středně rizikového karcinomu prostaty léčených na našem pracovišti stereotaktickou radioterapií v období od srpna 2010 do července 2012. Pacienti absolvovali SBRT (stereotactic body radiotherapy) v dávce 36,25 Gy v pěti frakcích po 7,25 Gy obden. Toxicita léčby byla hodnocena dle škály RTOG. Pro hodnocení kvality života pacienti vyplňovali modifikovaný dotazník EPIC (Expanded Prostate Index Composite).Výsledky:
Celkové přežití pacientů po léčbě dosahuje 93,1 %. Vysoká je i hodnota bRFS (biochemical relapse free survival) – 97,7 % pro celý soubor našich pacientů, očekávaně horší výsledky jsou ve skupině pacientů se středním rizikem rekurence. Akutní i chronická urologická a gastrointestinální toxicita léčby dle RTOG je nízká. Kvalita života pacientů po léčbě dle dotazníku EPIC byla bezprostředně po léčbě mírně snížena, s delším časovým odstupem se vrátila minimálně ke vstupním hodnotám.Závěr:
Stereotaktická radioterapie je účinnou léčebnou modalitou časného karcinomu prostaty s akceptovatelnou časnou a minimální pozdní toxicitou.Klíčová slova:
karcinom prostaty – stereotaktická radioterapie – kvalita životaÚvod
Karcinom prostaty je nejčastějším onkologickým onemocněním mužské populace, v ČR byla v roce 2014 tato diagnóza nově stanovena u 6 584 pacientů, zemřelo na ni 1 509 mužů. Zvyšující se incidence tohoto onemocnění spolu s velice dobrou prognózou pacientů, kterou dokládá i setrvalý nestoupající stav mortality, vede k nárůstu prevalence tohoto onemocnění, která koncem roku 2014 dosáhla počtu 49 941 pacientů [1,2]. Jedná se zde tedy o významnou a neustále narůstající skupinu pacientů, kteří po léčbě karcinomu prostaty přežívají řadu let a je pro ně důležitá nejen otázka účinnosti onkologické léčby, ale stále více také kvalita dalšího života, a to v dlouhodobém časovém horizontu. O druhu lokální léčby rozhodujeme na základě rozsahu onemocnění, míře rizikovosti nemoci, předpokládané délce života, která souvisí s věkem pacienta, přidruženými nemocemi a jeho celkovým biologickým stavem. Významnou roli v rozhodování o dalším postupu hraje také toxicita jednotlivých modalit léčby, jako jsou obtíže s močením, inkontinence, erektilní dysfunkce a potíže s vyprazdňováním [3,4]. Na výběr máme chirurgické řešení, tj. radikální prostatektomii, kurativní radioterapii (konvenční radioterapii, stereotaktickou radioterapii, event. brachyterapii), nebo lze v určitých případech léčbu odložit a zvolit taktiku watchfull waiting nebo active survaillance [5–7]. Podle dostupných údajů, např. v roce 2016 publikovaných výsledků studie ProtecT, kde byly srovnávány výsledky aktivního sledování, operačního řešení a kurativní radioterapie s 10letou dobou sledování, jsou jednotlivé léčebné modality srovnatelné v celkovém přežití (overall survival – OS) pacientů, rozdíly jsou zejména v toxicitě léčby – radioterapie bývá více spojena s gastrointestinální toxicitou, zatímco v operované skupině je vyšší výskyt inkontinence a sexuálních poruch [8]. V radiační onkologii dochází na základě radiobiologických prací publikovaných v posledních letech ke změně frakcionačních režimů směrem k hypofrakcionaci [9–11]. Tyto práce udávají nejčastěji hodnotu α/β pro karcinom prostaty 1,5 Gy, což je hodnota nižší než hodnota udávaná pro většinu zhoubných nádorů – cca 10 Gy – a je i nižší než hodnota 3 Gy, která je používána pro výpočet pozdní rektální toxicity. Tento rozdíl v poměru α/β tumorózní prostatické a rektální tkáně otevřel cestu hypofrakcionovaným režimům, díky kterým jsme schopni dosáhnout vyšší lokální kontroly onemocnění bez navýšení toxicity léčby. Vyšší klinické rozšíření ultrahypofrakcionovaných režimů zajistila dostupnost stereotaktické radioterapie (stereotactic body radiotherapy – SBRT, event. SABR – stereotactic ablative radiotherapy), která umožňuje aplikaci vysokých dávek v jednotlivých frakcích do limitovaného objemu, s tím souvisí také šetření přiléhajících rizikových orgánů [12–14].
Soubor pacientů a metody
V období od srpna 2010 do července 2012 jsme na našem pracovišti léčili hypofrakcionovanou stereotaktickou radioterapií 261 pacientů s lokalizovaným karcinomem prostaty, z tohoto počtu bylo 175 (64 %) pacientů s onemocněním nízkého rizika a 86 (33 %) pacientů s onemocněním středního rizika. Vstupními kritérii pro léčbu SBRT bylo onemocnění lokalizovaným karcinomem prostaty s nízkým rizikem, event. prognosticky příznivější skupina pacientů se středním rizikem, kdy za horní hranici pro indikaci léčby SBRT byl považován prostatický specifický antigen (PSA) max. 15,0 ng/mL, GS 3 + 4. Náš soubor zahrnuje muže ve věku 46–83 let, medián věku byl 67 let, vstupní hodnoty PSA se pohybovaly v rozmezí 1,5–15,0 ng/mL (medián 6,7 ng/mL), velikost CTV (clinical target volume), který určuje velikost prostaty při zahájení terapie, byl v rozmezí 18–67 ml (medián 49 ml). Před samotnou radioterapií byly do prostaty pod sonografickou kontrolou transrektálně zavedeny čtyři RTG kontrastní markery, tzv. fiducials. Předepsaná cílová dávka byla ve všech případech 36,25 Gy v pěti frakcích po 7,25 Gy aplikovaná obden ke snížení rektální toxicity. SBRT byla aplikovaná přístrojem CyberKnife firmy Accuray.
Akutní a chronická urologická, gastrointestinální toxicita byla hodnocena podle škály RTOG lékařem při pravidelných dispenzárních kontrolách, akutní toxicita při kontrole za 3 měsíce po ukončení léčby, chronická kontrola s minimálním odstupem 2 roky po léčbě.
Při hodnocení kvality života a nežádoucích vedlejších účinků po léčbě karcinomu prostaty radioterapií se postupně stále více klade důraz na kvalitu života tak, jak ji vnímá samotný pacient [15]. Pro hodnocení kvality života u pacientů s rakovinou prostaty po léčbě byl sestaven standardizovaný dotazník EPIC (Expanded Prostate Index Composite). EPIC slouží jako nástroj usnadňující obsáhlejší zhodnocení kvality života po léčbě rakoviny prostaty, pomocí něhož lze kvantifikovat subjektivně vnímané akutní i pozdní účinky léčby [16–18].
Pacienti v našem souboru opakovaně vyplňovali modifikovaný EPIC dotazník, a to nejprve před léčbou, následně po 3 měsících a 3–5 let po ukončení léčby. Otázky v rámci dotazníku jsou rozděleny do pěti domén, kdy pacienti hodnotí své močové obtíže (udržení moči, krev v moči, bolesti a pálení při močení, kontrola nad močením, počet plen na den, slabý proud moči, vnímání problému nočního močení, vnímání problému častého močení, celková spokojenost s močením), problémy se stolicí a střevy (nucení na stolici, nekontrolovaný únik stolice, vodnatá a kašovitá stolice, krev ve stolici, bolesti při stolici, množství stolic za den, křečovité bolesti břicha), sexuální život (chuť na sex, schopnost erekce, schopnost dosáhnout vyvrcholení, kvalita erekce, frekvence erekcí, četnost probuzení se s erekcí, četnost sexuální aktivity, četnost sexuálního styku), hormonální funkce (návaly horka, pocit napětí v prsou, přítomnost deprese, ztráta energie, změna váhy), závěrečná otázka pak shrnuje celkový stav pacienta. Jednotlivé odpovědi byly dle metodiky převedeny na škálu od 0–100, kdy hodnota 100 odpovídá maximální kvalitě života.
Pro grafické zobrazení OS byla použita Kaplan-Meierova metoda, pro statistické zhodnocení jednotlivých parametrů kvality životy je využita analýza rozptylu ANOVA (Analysis of variance).
Výsledky
Všech 261 pacientů absolvovalo celou plánovanou léčbu – tj. pět frakcí. Celková doba léčby byla v průměru 11 dnů (v rozmezí 9–20 dnů). OS pacientů po léčbě je očekávaně vysoké, během sledovaného období zemřelo po léčbě 18 pacientů (tj. 6,9 %), ani v jednom případě nebylo úmrtí v souvislosti s onemocněním karcinomem prostaty (graf 1).
1. Celkové přežití pacientů po léčbě. 
V rámci hodnocení účinnosti léčby jsme sledovali vývoj PSA po léčbě. Z následujícího grafu vyplývá, že nejvýraznější pokles PSA byl zaznamenán v prvních 6 měsících po léčbě, dále byl pokles pozvolnější, nicméně je trend k dalšímu snižování PSA po celé sledované období. Medián PSA 36 měsíců po léčbě je 0,29 ng/mL (v rozmezí 0–37,6 ng/mL) (graf 2).
2. Vývoj PSA po léčbě (PSA v jednotkách ng/mL). 
Dále jsme sledovali, zda se liší četnost výskytu biochemického relapsu u pacientů s nízkým rizikem onemocnění (tj. T1–T2a, GS max. 6, PSA max. 10 ng/mL) a středním rizikem onemocnění (tj. T2b + c, GS 3 + 4 nebo PSA 10,1–15,0 ng/mL). Pro hodnocení biochemického relapsu jsme používali Phoenix kritéria, tj. vzestup PSA na hodnotu nadiru PSA + 2 ng/mL [19]. Během sledovaného období se u skupiny pacientů s onemocněním ve středním riziku vyskytly čtyři (4,65 %) případy biochemického relapsu, ve skupině s nízkým rizikem dva (1,14 %) případy. Výsledná p hodnota Gehan-Wilcoxonova testu p = 0,173 neprokazuje statisticky významné zhoršení prognózy pacientů se středním rizikem. Pokud jsme pro klasifikaci středního rizika zadali pouze hodnotu PSA a GS, bylo pacientů ve skupině nízkého rizika 210 a středního rizika 51, biochemický relaps byl potvrzen u dvou pacientů nízkého rizika (0,95%) a čtyřech pacientů středního rizika (7,48 %). Výsledná hodnota Gehan-Wilcoxonova testu p = 0,014 ukazuje na horší výsledky pacientů se středně rizikovým karcinomem dle PSA a GS (graf 3).
3. Kumulativní přežití pro pacienty s nízkým rizikem (skupina 0) a pro pacienty se středním rizikem onemocnění (skupina 1). 
Akutní toxicita byla hodnocena u 256 pacientů při kontrole za 3 měsíce po ukončení léčby podle RTOG škály. Nejvyšší zaznamenaná urologická toxicita byla stupně 3 dle RTOG u šesti pacientů (2,35 %), gastrointestinální toxicita stupně 3 dle RTOG byla zjištěna u sedmi pacientů (2,73 %). U žádného pacienta nebyla urologická ani gastrointestinální toxicita 4. stupně dle RTOG (graf 4, 5).
4. Akutní urologická toxicita dle RTOG. 
5. Akutní gastrointestinální toxicita dle RTOG. 
Chronická toxicita byla hodnocena lékařem během dispenzárních kontrol s minimálním odstupem 2 roky po radioterapii – u 187 pacientů urologická toxicita, resp. u 189 pacientů gastrointestinální toxicita. Chronická urologická toxicita stupně 3 byla popsána u jednoho pacienta (0,53 %), nejvyšší chronická gastrointestinální toxicita byla pouze stupně 2 u dvou pacientů (1,06 %) (graf 6, 7).
6. Chronická urologická toxicita dle RTOG. 
7. Chronická gastrointestinální toxicita dle RTOG. 
Další část naší práce byla zaměřena na subjektivní hodnocení kvality života samotnými pacienty. Námi použitý dotazník byl tematicky rozdělen do několika částí, tzv. domén – otázky 1–7 se zaměřením na potíže s močením, otázky 8–15 se týkaly potíží se stolicí a střevy, otázky 16–23 zkoumaly sexuální život, otázky 24–29 byly zaměřeny na hormonální změny a závěrečná otázka číslo 30 vyjadřovala celkové pacientovo hodnocení aktuálního stavu po léčbě. Při vyhodnocení jednotlivých domén dotazníku pacienti před zahájením léčby nejlépe hodnotili doménu 2, tedy problémy se stolicí a střevy, dále doménu 1 močové obtíže, nejhůře hodnotili doménu 3 sexuální život. U všech domén je bezprostředně po ukončení léčby zřetelné snížení hodnocení kvality života. Naopak při hodnocení provedeném 3–5 let po léčbě hodnocení kvality života ve všech doménách vzrostlo. Celkové srovnání jednotlivých domén je uvedeno v tab. 1.
1. Kvalita života pacientů s diagnostikovaným karcinomem prostaty hodnocena před zahájením léčby, po ukončení léčby a 3–5 let po léčbě. 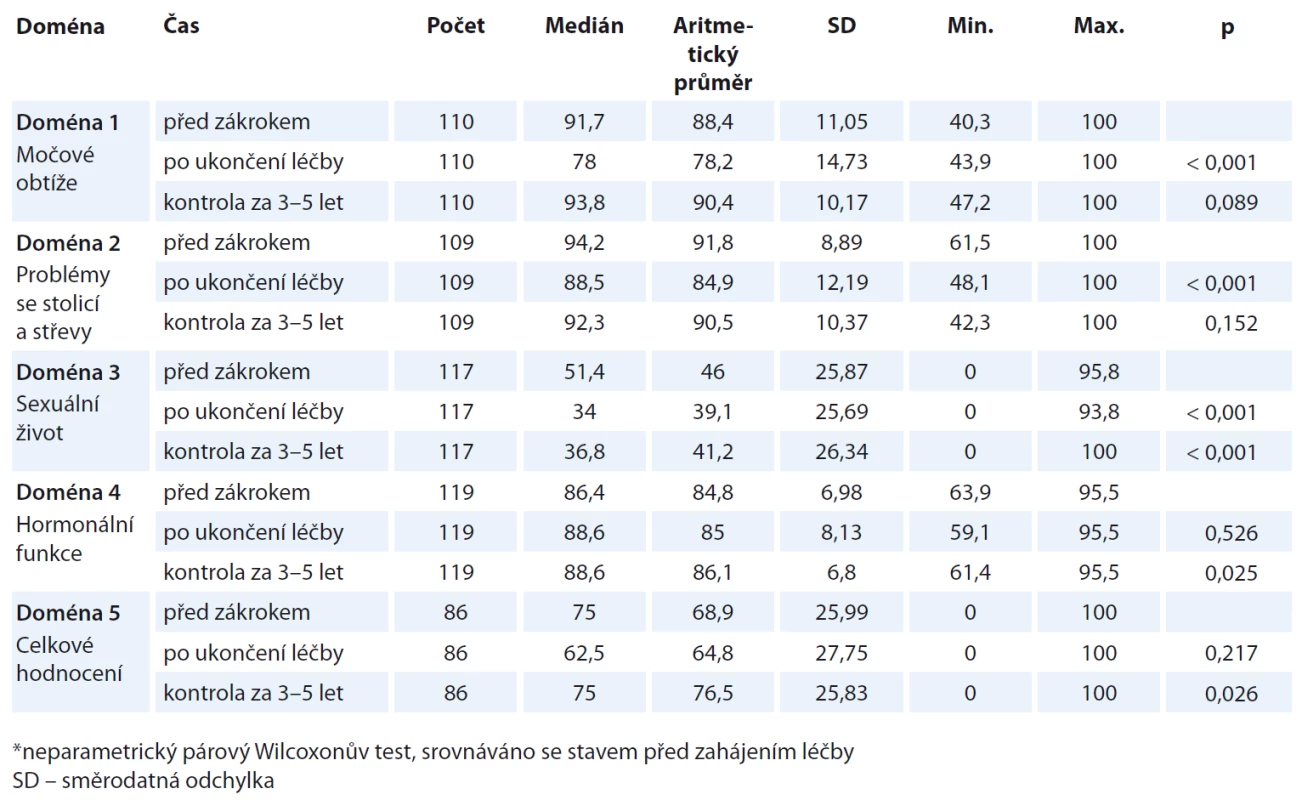
Diskuze
Námi získané výsledky jsme srovnávali s dosud nejrozsáhlejší publikovanou metaanalýzou studií fáze II celkem 1 100 pacientů léčených v období 2003–2011 na celkem osmi pracovištích, publikovanou Kingem et al v roce 2013, která prokázala srovnatelné výsledky 5letého OS bez biochemického relapsu onemocnění, které dosahovaly 93 % pro všechny pacienty, 95 % pro nízce rizikové pacienty, 84 % pro pacienty se středním rizikem a 81 % pro vysoce rizikové pacienty [13]. Při hodnocení odpovědi na léčbu dochází k poklesu PSA, který je nejvýraznější prvních 6 měsíců po léčbě, celkově pokračuje dále po dobu až 3 let, nadir PSA dosahuje k 0,4 ng/mL. U části pacientů dochází k tzv. bounce fenoménu, který je definován jako nárůst PSA o 0,2 ng/mL nad nadir. Tento fenomén bývá popsán u cca 30 % pacientů, častěji mladších, a jeho přítomnost není spojena s horší prognózou onemocnění. Pětileté OS zatím vzhledem k době poléčebného sledování na našem pracovišti nemůžeme srovnat, ale trend zachování vysoké účinnosti léčby se nemění. Vývoj PSA po léčbě je srovnatelný s publikovanými daty, pozorujeme také obdobný trend k rychlému poklesu PSA prvních 6 měsíců po léčbě s dalším postupným snižováním po dobu až 36 měsíců.
Námi získané údaje o kvalitě života pacientů jsme srovnávali s výsledky prospektivní studie publikované Kingem et al v roce 2013. Studie hodnotila 864 pacientů s lokalizovaným karcinomem prostaty léčených pomocí stereotaktické radioterapie v období let 2005–2012. Ve zmíněné studii byl použit standardizovaný dotazník EPIC o 26 otázkách. Pacienti zařazení do studie hodnotili kvalitu života každé 3 měsíce po dobu 1 roku, po ukončení léčby a dále 1× za rok až do 6 let po léčbě. U močových a gastrointestinálních obtíží pacienti uváděli nejvyšší snížení kvality života bezprostředně po ukončení léčby (po 3 měsících). Při hodnocení 6 měsíců po ukončení léčby uváděli pacienti vyšší hodnocení kvality života, které bylo trvalé zhruba 3 roky po ukončení léčby. Po 3 letech se hodnocení zvyšovalo na hodnoty vyšší, než uváděli před zahájením léčby [20]. Tyto výsledky korelují s výsledky naší práce, kdy se při hodnocení kvality života bezprostředně po ukončení léčby hodnoty snížily oproti hodnotám před zahájením léčby, naopak při hodnocení 3–5 let po léčbě byly uváděny hodnoty vyšší než před zahájením léčby.
Závěr
Výsledky léčby pacientů v našem souboru prokazují vysokou efektivitu a nízkou toxicitu SBRT nízce nebo středně rizikového karcinomu prostaty. Kvalita života pacientů po léčbě zůstává dlouhodobě na vysoké úrovni. Vzhledem k horším výsledkům pacientů se středním rizikem karcinomu prostaty jsme u těchto pacientů nově standardně zařadili krátkodobou neoadjuvantní androgen deprivační terapii. Vzhledem k prozatím krátké době sledování pokračujeme ve sběru dat a výhledově plánujeme hodnocení OS, bRFS (biochemical relapse free survival) i kvality života podstatně většího souboru pacientů.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Obdrženo: 5. 1. 2017
Přijato: 1. 2. 2017
MUDr. Eva Skácelíková
Onkologická klinika
LF OU a FN Ostrava
17. listopadu 1790
708 52 Ostrava
e-mail: eva.skacelikova@fno.cz
Sources
1. Dušek L, Mužík J, Kubásek M et al. Epidemiologie zhoubných nádorů v České republice [online]. Masarykova univerzita, c2005, [citováno 8. prosince 2016]. Dostupný z: http: //www.svod.cz.
2. Úzis.cz [online]. Zdravotnictví ČR: Nová data Národního onkologického registru ČR/NOR) za rok 2014, NZIS report č. R/1 (09/2016), 2015, [citováno 16. prosince 2016]. Dostupný z: http: //www.uzis.cz.
3. Novotný J, Vítek P et al. Onkologie v klinické praxi. Standardní přístupy v diagnostice a léčbě vybraných zhoubných nádorů. 1. vyd. Praha: Mladá fronta 2012.
4. Nccn.org [online]. Prostate cancer. version 3.2016, 05/26/16, [cited 2016 Dec 10]. Available from: http: //www.nccn.org.
5. Grepl M. Radikální prostatektomie. Onkologie 2010; 4 (2): 72–74.
6. Soumarová R, Homola L. Nové indikace a techniky brachyterapie. Postgrad Med 2009; 11 (3): 288–294.
7. Soumarová R, Homola L, Perková H et al. Místo permanentní brachyterapie v léčbě lokalizovaného karcinomu prostaty. Klin Onkol 2010; 23 (3): 141–145.
8. Hamdy FC, Donovan JL, Lane JA et al. 10-year outcomes after monitoring, surgery, or radiotherapy for localized prostate cancer. N Engl J Med 2016; 375 (15): 1415–1424.
9. Brenner DJ, Hall EJ. Fractionation and protraction for radiotherapy of prostate carcinoma. Int J Radiat Oncol Biol Phys 1999; 43 (5): 1095–1101.
10. Fowler J, Chapell R, Ritter M. Is alpha/beta for prostate tumors really low? Int J Radiat Oncol Biol Phys 2001; 50 (4): 1021–1031.
11. Zaorsky N, Palmer J, Hurwitz M et al. What is the ideal radiotherapy dose to treat prostate cancer? A meta-analysis of biologically equivalent dose escalation. Radiother Oncol 2015; 115 (3): 295–300. doi: 10.1016/j.radonc.2015.05.011.
12. Katz A, Santoro M, Diblasio F et al. Stereotactic body radiotherapy for localized prostate cancer: disease control and quality of life at 6 years. Radiat Oncol 2013; 8 : 118. doi: 10.1186/1748-717X-8-118.
13. King C, Freeman D, Kaplan I et al. Stereotactic body radiotherapy for localized prostate cancer: pooled analysis from a multi-institutional consortium of prospective phase II trials. Radiother Oncol 2013; 109 (2): 217–221. doi: 10.1016/j.radonc.2013.08.030.
14. Tan TJ, Siva S, Foroudi F et al. Stereotactic body radiotherapy for primary prostate cancer: a systematic review. Med Imaging Radiat Oncol 2014; 58 (5): 601–611. doi: 10.1111/1754-9485.12213.
15. Sonn GA, Sadetsky N, Presti JC et al. Differing perceptions of quality of life in patients with prostate cancer and their doctors. J Urol 2013; 189 (Suppl 1): S59–S65. doi: 10.1016/j.juro.2012.11.032.
16. Litwin MS, Havs RD, Fink A et al. The UCLA Prostate Cancer Index: development, reliability, and validity of a health-related quality of life measure. Med Care 1998; 36 (7): 1002–1012.
17. Szymanski KM, Wei JT, Dunn RL et al. Development and validation of an abbreviated version of the expanded prostate cancer index composite instrument for measuring health-related quality of life among prostate cancer survivors Urology 2010; 76 (5): 1245–1250. doi: 10.1016/j.urology.2010.01.027.
18. EPIC Expanded Prostate Cancer Index Composite. Medicine Umich [online]. Michigan: Urology, University od Michigan Health System. Available from: https: //medicine.umich.edu/dept/urology/research/ epic.
19. Roach M, Hanks G, Thames H Jr et al. Defining biochemical failure following radiotherapy with or without hormonal therapy in men with clinically localized prostate cancer: recommendations of the RTOG-ASTRO Phoenix Consensus Conference. Int J Radiat Oncol Biol Phys 2006; 65 (4): 965–974.
20. King C, Collins S, Fuller D et al. Health-related quality of life after stereotactic body radiation therapy for localized prostate cancer: results from a multi-institutional consortium of prospective trials. Int J Radiat Oncol Biol Phys 2013; 87 (5): 939–945. doi: 10.1016/j.ijrobp.2013.08. 019.
Labels
Paediatric clinical oncology Surgery Clinical oncology
Article was published inClinical Oncology

2017 Issue 2-
All articles in this issue
- Chemotherapy-related Cognitive Impairment in Patients with Hodgkin Lymphoma – Pathophysiology and Risk Factors
- Current Recommendations for the Prevention and Treatment of Venous Thromboembolism in Cancer Patients
- Coffee in Cancer Chemoprevention
- Trends in Prostate Cancer Epidemiology in Slovakia – an International Comparison
- Stereotactic Body Radiotherapy of Prostate Cancer – Effectiveness and Toxicity
- Effect of Erlotinib in 2nd and 3rd Line Anticancer Treatment in Patients with Squamous Cell Lung Cancer – Case Series
- An Autoimmune Haemolytic Anaemia Secondary to Ipilimumab Treatment
- Clinical Oncology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Chemotherapy-related Cognitive Impairment in Patients with Hodgkin Lymphoma – Pathophysiology and Risk Factors
- Coffee in Cancer Chemoprevention
- Stereotactic Body Radiotherapy of Prostate Cancer – Effectiveness and Toxicity
- Trends in Prostate Cancer Epidemiology in Slovakia – an International Comparison
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

