-
Medical journals
- Career
Možnosti chemoterapie v léčbě karcinomu prostaty
Authors: I. Richter 1,2; J. Dvořák 2; J. Bartoš 1
Authors‘ workplace: Onkologické oddělení, Krajská nemocnice Liberec, a. s. 1; Onkologická klinika 1. LF UK a Thomayerova nemocnice, Praha 2
Published in: Klin Onkol 2017; 30(1): 28-33
Category: Review
doi: https://doi.org/10.14735/amko201728Overview
Východiska:
Karcinom prostaty patří mezi nejčastější onkologické onemocnění u mužů. V léčebném algoritmu karcinomu prostaty má své místo i systémová chemoterapie. Její uplatnění je hlavně v léčbě metastatického kastračně rezistentního karcinomu prostaty (metastatic castration-resistant prostate cancer – mCRPC). Možností je ale i její aplikace v léčbě hormonálně senzitivního pokročilého onemocnění na podkladě výsledků recentně publikovaných klinických studií.Cíl:
Cílem přehledového článku je pohled na aktuální možnosti chemoterapie u karcinomu prostaty.Výsledky:
V léčbě mCRPC je standardním lékem od roku 2004 v 1. linii docetaxel, který jako první lék prokázal prodloužení celkového přežití na podkladě klinických studií TAX 327 a SWOG 9916. Ve 2. linii léčby mCRPC je k dispozici kabazitaxel, který prokázal prodloužení celkového přežití ve srovnání s mitoxantronem v klinické studii TROPIC. Kromě chemoterapie se v léčbě mCRPC uplatňují i nové možnosti cílené hormonální léčby, podání radia-223 či možnosti imunoterapie. Diskutovanou otázkou je nalezení optimální sekvence jednotlivých léčebných postupů. U pacientů s pokročilým hormon senzitivním karcinomem prostaty je indikovaná androgen deprivační terapie (ADT). Podle nedávno publikovaných studií CHAARTED a STAMPEDE prokázal docetaxel v kombinaci s ADT delší celkové přežití než samotná ADT. V České republice je ale tato indikace zatím off-label. Indikace chemoterapie u lokalizovaného karcinomu prostaty po radikální prostatektomii či radioterapii nepatří mezi léčebné standardy.Klíčová slova:
karcinom prostaty – metastázy – chemoterapie – docetaxel – kabazitaxelÚvod
Karcinom prostaty patří mezi nejčastější onkologická onemocnění u mužů [1]. V systémové léčbě karcinomu prostaty má svůj význam i chemoterapie, kde došlo v poslední době k vývoji poznatků nejenom v léčbě metastatického kastračně rezistentního karcinomu prostaty (metastatic castration-resistant prostate cancer – mCRPC), ale i u hormonálně senzitivního onemocnění. Přehledový článek předkládá aktuální možnosti chemoterapie u tohoto závažného onemocnění.
Chemoterapie mCRPC
Metastatický karcinom prostaty je prakticky vždy zpočátku hormonálně senzitivní onemocnění. Postupem času dochází k poklesu účinku na primární hormonální léčbu, i přes kastrační hodnoty testosteronu. Onemocnění definujeme jako CRCP [2]. Po selhání účinku primární hormonální manipulace se u pacientů indikovala systémová chemoterapie [3,4]. Mezi prvními hodnocenými cytostatiky v léčbě mCRPC byl mitoxantron, který s prednisonem prokázal zlepšení kvality života a měl významnější vliv na symptomatologii onemocnění než samotný prednison. Léčba mitoxantronem ale neměla vliv na celkové přežití (overall survival – OS) pacientů [5]. Až v roce 2004 byly publikovány dvě klinické studie TAX 327 a SWOG 9916, které prokázaly významné prodloužení OS. Obě studie hodnotily jako nové cytostatikum docetaxel, který se stal následně standardem léčby v kombinaci s prednisonem v 1. linii léčby mCRCP [6,7]. Méně často je v literatuře uváděna klinická studie, která srovnávala docetaxel v dávce 50 mg/m2 ve 2týdenním režimu a docetaxel ve standardní dávce 75 mg/m2 ve 3týdenním režimu, vše v kombinaci s prednisonem. Celkem bylo hodnoceno 361 mužů s mCRPC. Při mediánu sledování 18 měsíců bylo prokázáno významně delší OS u pacientů s 2týdenním podáváním docetaxelu (19,5 vs. 17,0 měsíce; p = 0,02). Dvoutýdenní režim také prokázal nižší výskyt neutropenie stupně III a IV než 3týdenní režim [8]. Další linie léčby po docetaxelu nebyly dlouho standardně definované. Proběhlo několik klinických studií, které hodnotily přínos paklitaxelu, etopozidu, satraplatiny a jiných, ale bez prodloužení OS [9,10]. Často používaným lékem v minulých letech byl i vinorelbin v kombinaci s hydrokortizonem. Byl zjištěn jeho příznivý vliv hlavně na relativně rychlý nástup klinického efektu, i když bez prodloužení OS [11]. V ČR také patřilo použití vinorelbinu v kombinaci s hydrokortizonem k oblíbenému léčebnému postupu po selhání terapie docetaxelem [12]. V roce 2010 byly publikovány výsledky randomizované klinické studie fáze III, která hodnotila kabazitaxel a mitoxantron v kombinaci s prednisonem u 755 pacientů s mCRPC, kteří byli předléčení docetaxelem. Studie prokázala významné prodloužení OS u pacientů léčených kabazitaxelem (15,1 vs. 12,7 měsíce), byla popsána 30% redukce relativního rizika úmrtí (hazard ratio – HR 0,7; 95% CI 0,59–0,83; p < 0,0001) [13]. Na podkladě těchto prezentovaných dat byl kabazitaxel schválen k léčbě mCRPC u nemocných po předchozí terapii docetaxelem. Zpočátku byla jeho aplikace schválená plátci zdravotní péče jenom pro nemocné s progresí buď při terapii docetaxelem, nebo do tří měsíců od ukončení léčby docetaxelem. V současné době již toto omezení není v aktuální úhradové vyhlášce. V roce 2013 byla publikována další analýza dat ze studie TROPIC, která hodnotila 2leté OS u pacientů léčených kabazitaxelem nebo mitoxantronem. Podle Kaplan-Meierovy analýzy bylo OS delší než 2 roky u 27 % (95% CI 23–32 %) pacientů léčených kabazitaxelem a u 16 % (95% CI 12–20 %) případů léčených mitoxantronem [14]. Pacienti přežívající více než 2 roky absolvovali více léčebných cyklů kabazitaxelu než pacienti s OS kratším než 2 roky (medián 10 vs. 6 cyklů). Podle výsledků se zdá, že přibližně u 25 % nemocných léčených kabazitaxelem lze očekávat delší OS. Výzvou aktuálního výzkumu je identifikovat faktory s cílem predikovat déletrvající OS pacientů léčených kabazitaxelem. Na podkladě analýzy studie TROPIC bylo zatím identifikováno několik klinických parametrů jako možné prognostické faktory pro delší OS (tab. 1).
Table 1. Prognostické faktory pro 2leté OS u pacientů podle analýzy klinické studie TROPIC [13]. ![Prognostické faktory pro 2leté OS u pacientů podle analýzy klinické studie TROPIC [13].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/a2458f5a68bc500206fee05e9139fcfc.png)
Při indikaci cytostatické léčby je nutno předpokládat i výskyt možných nežádoucích účinků. Problémem delšího trvání léčby docetaxelem jako standardního cytostatika 1. linie mCRPC může být výskyt periferní neuropatie jako příkladu kumulativní toxicity, která může vést k předčasnému ukončení dosud účinné léčby a je obtížně léčebně ovlivnitelná [15]. Diskutovalo se její možné zhoršení při další léčbě kabazitaxelem jako představitele taxanů nové generace ve 2. linii léčby. V rámci studie TROPIC byla incidence závažné periferní neuropatie nízká a vyskytla se jenom u 0,8 % léčených pacientů. V rámci hodnocení hematologické toxicity po podání kabazitaxelu ve studii TROPIC byla pozorována neutropenie až v 94 % případů, z toho až 82 % pacientů mělo vyjádřeno stupeň neutropenie III a IV. Možností je podání profylaktické aplikace růstových faktorů, které významně redukuje riziko vzniku neutropenie a její komplikaci (HR 0,7; p = 0,04) [16]. Mezi rizikové faktory vzniku neutropenie stupně III a IV patří věk nad 75 let, aplikace prvního cyklu chemoterapie a počet neutrofilů méně než 4 000/mm3 před podáním kabazitaxelu [17]. S cílem redukovat toxicitu kabazitaxelu se často diskutuje i použití nižší dávky kabazitaxelu než standardní dávka 25 mg/m2. Aktuálně probíhá klinická studie PROSELICA, která hodnotí dávku kabazitaxelu 20 mg/m2 po předchozí terapii docetaxelem, a studie FIRSTANA, která hodnotí podobnou dávku kabazitaxelu v 1. linii léčby mCRPC. Tady navíc dochází i ke srovnání účinnosti s docetaxelem. Tato studie si tedy položila i otázku, zda není kabazitaxel účinnější než docetaxel v 1. linii mCRPC. Vychází z dříve prezentovaných dat, která hodnotila kabazitaxel jako účinnější než docetaxel z důvodu vlivu na p-glykoprotein s následnou redukcí vyplavení cytostatika z nádorových buněk [18].
Výsledky výše zmíněných studií byly prezentovány na ASCO v roce 2016. Ve studii PROSELICA dávka kabazitaxelu 20 mg/m2 neprokázala horší OS než dávka 25 mg/m2 navíc s lepší tolerancí. Ve studii FIRSTANA neprokázal kabazitaxel prodloužení OS ve srovnání s docetaxelem.
Sekvence léčby mCRPC
Vzhledem k dalšímu vývoji v léčbě mCRPC se nabízí i otázka hledání optimální sekvence jednotlivých léčebných postupů. Kromě cytostatické terapie lze po předchozí terapii docetaxelem aplikovat kromě kabazitaxelu i abirateron, enzalutamid nebo u pacientů s izolovaným kostním postižením i α zářič radium-223 [19–21]. Imunoterapie není v ČR zatím dostupná. Situaci navíc „komplikuje“ i možnost podání abirateronu či enzalutamidu v 1. linii terapie mCRPC podle nedávno publikovaných klinických studií [22,23]. U pacientů nevhodných k podání chemoterapie se zdá být nalezení léčebného algoritmu snazší než u pacientů, kde chemoterapii podat lze. Tady lze standardně definovat tři linie léčby. Proběhlo několik většinou retrospektivních hodnocení, která se zabývala problematikou nalezení optimální sekvence systémové terapie mCRPC. Účinnost kabazitaxelu po předchozí léčbě docetaxelem a abirateronem hodnotily dvě významnější retrospektivní klinické studie. První francouzsko-britská studie neprokázala snížení léčebné odpovědi kabazitaxelu ve 3. linii ve srovnání s jeho výsledky v registrační studii TROPIC, kde byl podáván ve 2. linii léčby [24]. Naproti tomu nizozemská studie prokázala kratší medián podávání kabazitaxelu ve 3. linii než data z 2. linie ze studie TROPIC (2,8 vs. 4,9 měsíce), navíc se doba trvání poklesu prostatického specifického antigenu (PSA) zkrátila o jednu třetinu [25]. Data o efektu chemoterapie po předchozí terapii enzalutamidem nemáme zatím k dispozici. Zajímavou práci publikoval Mezynski et al, kteří retrospektivně hodnotili podání docetaxelu po předchozí terapii abirateronem. Jejich studie prokázala nižší aktivitu docetaxelu po terapii abirateronem než účinnost docetaxelu v 1. linii ve studiích TAX 327 nebo SWOG 9916 [26]. Přehled léčebných výsledků jednotlivých sekvencí léčby je uveden v tab. 2. Nabízí se otázka, zda existuje zkřížená rezistence mezi taxany a signální dráhou androgenního receptoru. Taxany prokázaly interakci s androgenní signalizací v buňkách karcinomu prostaty, jednak v cytoplazmě, jednak na úrovni buněčného jádra s vlivem na transkripční faktory androgenní genové exprese [27–30]. Hypotézu zkřížené rezistence mezi taxany a androgenní signální dráhou podporuje i další preklinická studie, která neprokázala protinádorový efekt docetaxelu a kabazitaxelu na abirateron rezistentních buňkách [31]. Výsledky výše zmíněných prací naznačují, že nové možnosti cílené hormonální léčby lze u pacientů schopných podstoupit chemoterapii aplikovat až po selhání chemoterapie, kde její efekt byl potvrzen v této indikaci již ve zmíněných studiích AFFIRM a COU-AA-301 [19,20]. Potvrdila to i další retrospektivní studie 57 pacientů s mCRPC, kde významné prodloužení OS bylo v multivariantní analýze zjištěno u pacientů léčených osmi a více cykly docetaxelu [32]. Další diskutovanou léčebnou možností jsou opakované aplikace docetaxelu u skupiny pacientů s dobrou odpovědí na první podání docetaxelu. Výhodou opětovného podání docetaxelu je nižší cena léčby. Nevýhodou je riziko zvýšené incidence kumulativní toxicity docetaxelu, zvláště neuropatie. Proběhlo několik menších, převážně retrospektivních studií, které se snažily specifikovat nemocné s mCRPC, kteří by profitovali z reindukce docetaxelu [33–35]. Petrioli et al ve svém přehledu prezentují možné faktory, kde lze zvážit opětovné podání docetaxelu – interval bez progrese po předchozí léčbě docetaxelem delší než 3–6 měsíců, větší než 50% pokles koncentrace PSA po 1. linii léčby docetaxelem, nepřítomnost kumulativní toxicity docetaxelu u pacientů mladších než 75 let a výkonnostní stav 0–1 dle ECOG [36]. Na druhé straně již výše zmíněná studie Poona et al prokázala delší OS při použití abirateronu nebo kabazitaxelu ve 2. linii terapie mCRPC než při opakované aplikaci docetaxelu [32]. Pro kabazitaxel, abirateron i enzalutamid jsou k dispozici prospektivní klinické studie na větších počtech pacientů ve srovnání s převážně retrospektivními studiemi hodnotícími opětovné použití docetaxelu.
Table 2. Účinnost léčebných sekvencí v léčbě mCRCP. 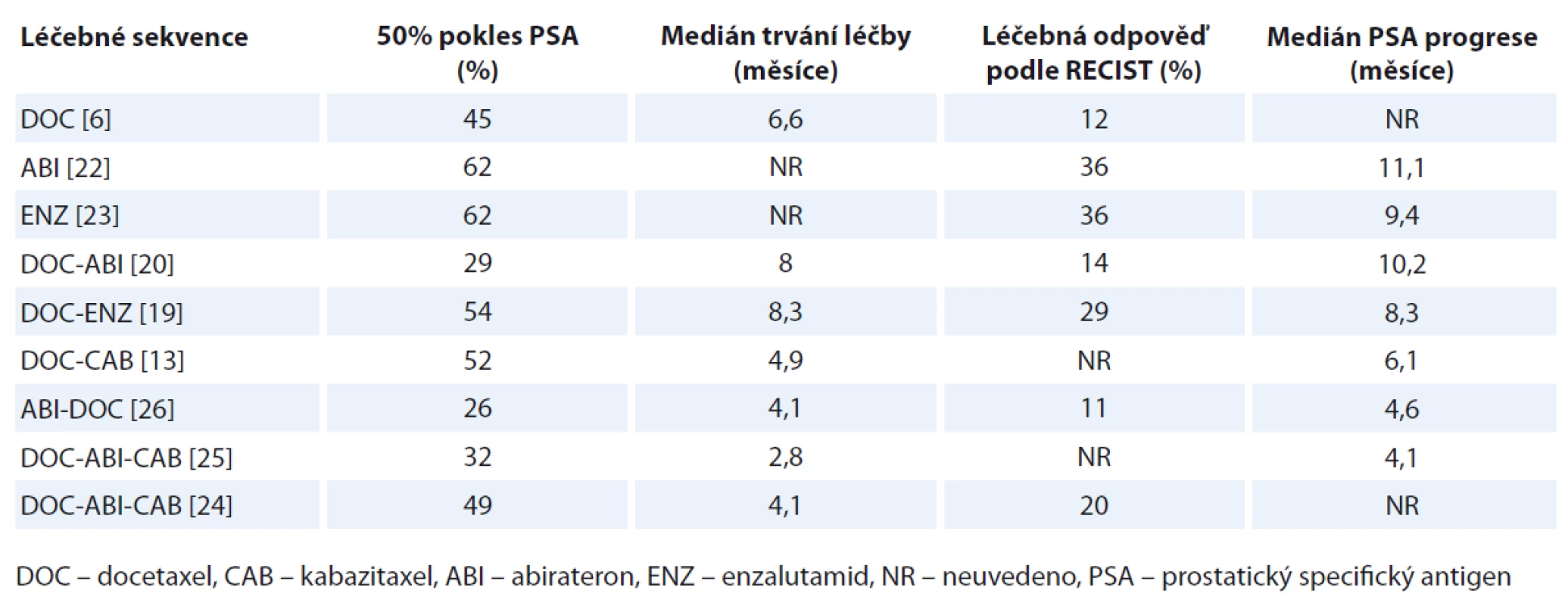
Chemoterapie hormonálně senzitivního onemocnění
První klinická studie, která hodnotila přínos chemoterapie u pacientů s pokročilým hormonálně senzitivním karcinomem prostaty, byla studie GETUG-AFU-15 prezentovaná v roce 2013. Celkem hodnotila 385 pacientů, kteří byli léčení androgen deprivační terapií (ADT) nebo její kombinací s docetaxelem. Při mediánu sledování 50 měsíců kombinace ADT a docetaxel neprokázala významně delší OS než samotná ADT (58,9 vs. 54,2 měsíce; HR 1,01; 95% CI 97,5–1,30) [37]. V roce 2015 bylo prezentováno hodnocení pacientů při mediánu sledování 7 let. Byla prokázaná statisticky nevýznamná 20% redukce rizika úmrtí u pacientů s kombinovanou léčbou [38]. Další dvě klinické studie naopak prokázaly přínos přidání chemoterapie k ADT u pacientů s hormonálně senzitivním pokročilým onemocněním. Klinická studie CHAARTED hodnotila účinnost kombinace docetaxel a ADT ve srovnání se samotnou ADT. Při mediánu sledování 28,9 měsíce prokázala kombinovaná léčba významně delší OS než ADT samotná (576 vs. 44 měsíců; HR 0,61, 95% CI 0,47–0,8; p = 0,001) [39]. Rozsáhlejší klinická studie STAMPEDE kromě významu chemoterapie hodnotila i přínos bisfosfonátů. Celkem bylo hodnoceno téměř 3 000 pacientů s pokročilým hormonálně senzitivním karcinomem prostaty. Přibližně 60 % pacientů mělo vzdálené metastatické postižení. Přidání docetaxelu k ADT prokázalo významné prodloužení OS při mediánu sledování 43 měsíců. Přínos bisfosfonátů na OS nebyl prokázán. Byla podávána zolendronová kyselina po dobu 2 let [40]. Příčinou kontroverzních výsledků na délku OS studie GETUG-AFU-15 na jedné straně a studií CHAARTED a STAMPEDE na straně druhé mohl být rozdílný počet cyklů chemoterapie, různá doba sledování nemocných, odlišný počet pacientů s rozsáhlým metastatickým postižením. Na léčebné výsledky ale mohl mít vliv i typ další onkologické terapie po vzniku kastračně rezistentního karcinomu prostaty. Zvláště pacienti v první klinické studii GETUG-AFU-15 byli léčení mnohem méně často kabazitaxelem, enzalutamidem nebo abirateronem než pacienti v klinických studiích STAMPEDE a CHAARTED, kdy nové možnosti léčby již byly k dispozici. V klinické studii CHAARTED bylo více pacientů po předchozí kombinaci docetaxelu s ADT léčeno při vzniku mCRPC kabazitaxelem (24 vs. 13 %) a abirateronem či enzalutamidem (44 vs. 36 %) než skupina pacientů se samotnou ADT. V této skupině ale byla častěji indikovaná v dalším průběhu opakovaná terapie docetaxelem (23 vs. 48 %). Podobná sekvence léčby byla i ve studii STAMPEDE. V roce 2015 byla prezentovaná metaanalýza všech třech výše zmíněných studií, která potvrdila přínos pro OS kombinace chemoterapie a ADT ve srovnání se samotnou ADT jednak u pacientů s metastatickým hormonálně citlivým onemocněním (HR 0,73; 95% CI 0,6–0,9; p = 0,02), jednak v celé hodnocené populaci i s nemocnými bez metastatického onemocnění (HR 0,74; 95% CI 0,61–0,91; p = 0,003) [41].
Chemoterapie nemetastatického karcinomu prostaty
Chemoterapie prokázala účinnost v léčbě mCRPC i v léčbě hormonálně senzitivního metastatického onemocnění. Do popředí se nyní dostává otázka využití systémové chemoterapie v adjuvantní léčbě po radioterapii či radikální prostatektomii u pacientů s nemetastatickým lokalizovaným onemocněním. Byla publikovaná klinická studie RTOG 9902, která hodnotila přidání paklitaxelu, estramustinu a etoposidu u pacientů po radikální radioterapii v kombinaci s dlouhotrvající ADT celkem u 397 pacientů s lokálně nemetastatickým vysoce rizikovým karcinomem prostaty. Přidání chemoterapie neprokázalo prodloužení OS [42]. Na druhé straně klinická studie GETUG 12 prokázala vyšší počet PSA odpovědí a zvýšení přežití bez známek progrese u pacientů léčených neoadjuvantní chemoterapií docetaxelem a estramustinem před zahájením radikální radioterapie a následnou hormonální léčbou u pacientů v podobné indikaci jako studie RTOG 9902 [43]. Další klinická studie RTOG 0521 prokázala prodloužení OS u pacientů s lokalizovaným vysoce rizikovým karcinomem prostaty, kterým byl přidán docetaxel adjuvantně v kombinaci s ADT po radikální radioterapii [44]. Podobné klinické studie probíhají v současnosti i s kabazitaxelem, navíc s rozvojem ozařovacích technik dochází také k vyšším cílovým dávkám radioterapie. Klinická studie SWOG S9921 hodnotila přínos adjuvantní chemoterapie po radikální prostatektomii. Nebyl prokázán benefit ve smyslu prodloužení přežití bez známek recidivy při použití mitoxantronu [45]. Další klinické studie s využitím modernějších cytostatik aktuálně probíhají i v kombinaci s radioterapií a hormonální léčbou po radikální prostatektomii, zvláště u pacientů s vysokým rizikem rekurence onemocnění. V současné době není tato léčebná strategie standardem. Podobně probíhají i klinické studie hodnotící přínos chemoterapie u pacientů po lokální léčbě, kdy dochází k elevaci PSA bez průkazu diseminace onemocnění.
Závěr
Podle doporučení NCCN a ESMO lze u pacientů v 1. linii mCRCP podat docetaxel (kategorie IA), u pacientů mírně symptomatických či asymptomatických lze podat i abirateron nebo enzalutamid (kategorie IA). U pacientů s kostním postižením bez viscerálních metastáz lze použít i radium-223 (kategorie IA). Sipuleucel-T není u nás dostupný. V léčbě 2. linie po předchozí terapii docetaxelem lze zvážit podání abirateronu, enzalutamidu, kabazitaxelu či radia-223 (vše kategorie IA). Optimální sekvence léčby není zcela jasná. Asi nejperspektivnější se zdá být sekvence docetaxel – kabazitaxel – cílená hormonální léčba. Výběr léku je ale nutno individualizovat i vzhledem k celkovému stavu pacienta, jeho preferencím, rozsahu postižení, léčebné odpovědi na předchozí terapii apod. U skupiny vybraných pacientů lze zvážit i opětovné použití docetaxelu nebo i jiných cytostatik (kupř. mitoxantrom s dobrým paliativním účinkem).
U pacientů s metastatickým hormonálně senzitivním karcinomem prostaty je standardem použití androgen deprivační terapie. Podle doporučení ESMO lze u pacientů podat i docetaxel (kategorie IA). Podle NCCN doporučení lze docetaxel podat u pacientů s masivnějším metastatickým postižením (viscerální metastázy, čtyři a více metastatických ložisek ve skeletu, z toho jedno musí být mimo páteř a pánev). Celkem se doporučuje šest cyklů docetaxelu v kombinací s ADT. U nás je tato léčba zatím off-label.
Indikace systémové chemoterapie u lokalizovaného karcinomu prostaty po radikální prostatektomii nebo radioterapii nepatří zatím mezi léčebné standardy.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Obdrženo: 9. 5. 2016
Přijato: 6. 6. 2016
MUDr. Igor Richter, Ph.D.
Onkologické oddělení
Krajská nemocnice Liberec, a. s.
Husova 10
460 63 Liberec
e-mail: igor.richter@seznam.cz
Sources
1. Ondrušová M, Mužík J, Kliment J et al. Prostate cancer incidence and mortality in selected countries of central Europe. Klin Onkol 2011; 24 (2): 126–132.
2. Mottet N, Bellmunt J, van den Bergh RC et al. EAU Guidelines on prostate cancer – update April 2014. Arnhem: European Association of Urology 2014 : 172.
3. Katolická J. Chemoterapie v léčbě kastračně rezistentního karcinomu prostaty. Urol Prax 2014; 15 : 120–122.
4. Ondruš D, Ondrušová M. Manažement pacientov s kastračne rezistentným metastatickým karcinómom prostaty. Klin Onkol 2015; 28 (1): 24–29. doi: 10.14735/ amko24.
5. Tannock IF, Osoba D, Stockler MR et al. Chemotherapy with mitoxantrone plus prednisone or prednisone alone for symptomatic hormone-resistant prostate cancer: a Canadian randomised trila with palliative end points. J Clin Oncol 1996; 14 (6): 1756–1764.
6. Tannock IF, de Wit R, Berry WR et al. Docetaxel plus prednisone or mitoxantron plus prednisone for advanced prostate cancer. N Engl J Med 2004; 351 (15): 1502–1512.
7. Petrylak DP, Tangen CM, Hussain MH et al. Docetaxel and estramustine compared with mitoxantrone plus prednisone for advanced refractory prostate cancer. N Engl J Med 2004; 351 (15): 1513–1520.
8. Kellokumpu-Lehtinen PL, Harmenberrg U, Joensuu T et al. 2-weekly versus 3-weekly docetaxel to treat castration-resistant advanced prostate cancer: a randimised, phase 3 trial. Lancet Oncol 2013; 14 (2): 117–124. doi: 10.1016/S1470-2045 (12) 70537-5.
9. Millikan RE. Chemotherapy of advanced prostatic carcinoma. Semin Oncol 1999; 26 (2): 185–191.
10. Sternberg CN, Petrylak DP, Sartor O et al. Multinational, double-blind, phase III study of prednison and either satraplatin or placebo in patients with castrate-refractory prostate cancer progressing after prior chemotherapy: the SPARC trial. J Clin Oncol 2009; 27 (32): 5431–5438. doi: 10.1200/JCO.2008.20.1228.
11. Zampino MG, Verri E, Locatelli M et al. Vinorelbine-based chemotherapy in hormone-refractory prostate cancer. Anticancer Res 2006; 26 (3B): 2375–2380.
12. Matoušková M, Katolická J, Hanuš M et al. Chemoterapie II. linie CRCP-vinorelbin + hydrokortizon – prospektivní multicentrická studie. Ces Urol 2012; 16 (Suppl 1): 74.
13. de Bono JS, Oudard S, Ozguroglu M et al. Prednisone plus cabazitaxel or mitoxantrone for metastatic castration-resistant prostatae cancer progressing after docetaxel treatment: a randimised open-label trial. Lancet 2010; 376 (9747): 1147–1154. doi: 10.1016/S0140-6736 (10) 61389-X.
14. Bahl A, Oudard S, Tombal B et al. Impact of cabazitaxel on 2-year survival and palliation of tumour-related pain in men with metastatic castration-resistant prostate cancer treated in the TROPIC trial. Ann Oncol 2013; 24 (9): 2402–2408. doi: 10.1093/annonc/mdt194.
15. Lee JJ, Swain SM. Peripheral neuropathy induced by microtubule-stabilizing agents. J Clin Oncol 2006; 24 (10): 1633–1642.
16. Tsao CK, Cutting E, Martin J et al. The role of cabazitaxel in the treatment of metastatic castration-resistant prostate cancer. Ther Adv Urol 2014; 6 (3): 97–104. doi: 10.1177/1756287214528557.
17. Heidenreich A, Bracarda S, Mason M et al. Safety of cabazitaxel in senior adults with metastatic castration-resistant prostate cancer: results of the European compassionate-use programme. Eur J Cancer 2014; 50 (6): 1090–1099. doi: 10.1016/j.ejca.2014.01.006.
18. Mita AC, Denis LJ, Rowinski EK et al. Phase I and pharmacokinetic study of XRP6258 (RPR 116258A), a novel taxane, administered as 1-hour infusion every 3 weeks in patients with advanced solid tumors. Clin Cancer Res 2009; 15 (2): 723–730. doi: 10.1158/1078-0432.CCR-08-0596.
19. Scher HI, Fizazi K, Saad F et al. Increased survival with enzalutamide in prostate cancer after chemotherapy. N Engl J Med 2012; 367 (13): 1187–1197.
20. de Bono JS, Logothesis CJ, Molina A et al. Abiraterone and increased survival in metastatic prostate cancer. N Engl J Med 2011; 364 (21): 1995–2005. doi: 10.1056/NEJMoa1014618.
21. Parker C, Nilsson S, Heinrich D et al. Alpha emitter radium-223 and survival in metastatic prostate cancer. N Engl J Med 2013; 369 (3): 213–223. doi: 10.1056/NEJMoa1213755.
22. Ryan CJ, Smith MR, de Bono JS et al. Abirateron in metastatic prostate cancer without previous chemotherapy. N Engl J Med 2013; 368 (2): 138–148. doi: 10.1056/NEJMoa1209096.
23. Beer TM, Amstrong AJ, Rathkof DE et al. Enzalutamide in metastatic prostate cancer before chemotherapy. N Engl J Med 2014; 371 (5): 424–433. doi: 10.1056/NEJMoa1405095.
24. Pezaro CJ, Le Moulec S, Albiges L et al. Response to cabazitaxel in CRPC patients previously treated with docetaxel and abirateron acetate. J Clin Oncol 2013; 31 (Suppl 6): abstr. 155.
25. Wissing MD, Coenen JL, Van den Berg P et al. A retrospective study on cabazitaxel and abirateron acetate sequential treatment (CAST) in docetaxel treated metastatic castrate-resistant prostate cancer patients. Eur Cancer Congr 2013; abstr. 2904.
26. Mezynski J, Pezaro C, Bianchini D et al. Antitumour aktivity of docetaxel following treatment with the CYP17A1 inhibitor abirateron: clinical evidence for cross-resistence? Ann Oncol 2012; 23 (11): 2943–1947. doi: 10.1093/annonc/mds119.
27. Darshan MS, Loftus MS, Thadani-Mulero M et al. Taxane-induced blockade to nuclear accumulation of the androgen receptor predicts clinical response in metastatic prostate cancer. Cancer Res 2011; 71 (18): 6019–6029. doi: 10.1158/0008-5472.CAN-11-1417.
28. Jordan MA, Wilson L. Microtubules as a target for anticancer drugs. Nat Rew Cancer 2004; 4 (4): 253–265.
29. Moos PJ, Fritzpatrick FA. Taxane propagate apoptosis via two cell populations with distinctive cytological traits. Cell Growth Differ 1998; 9 (8): 687–697.
30. Li Y, Li X, Hussain M et al. Regulation of mikrotubul, apoptosis, and cell cycle-related genes by Taxotere in prostate cancer cells analyzed by microarray. Neoplasia 2004; 6 (2): 158–167.
31. van Soest RJ, van Royen ME, de Morree ES et al. Cross-resistance between taxanes and new hormonal agents abiraterone and enzalutamid may affect drug sequence choices in metastatic castration-resistant prostate cancer. Eur J Cancer 2013; 49 (18): 3821–3830. doi: 10.1016/j.ejca.2013.09.026.
32. Poon DM, Ng J, Chan K. Importance of cycles of chemotherapy and postdocetaxel novel therapies in metastatic castration resistant prostate cancer. Prostate Inter 2015; 3 (2): 51–55. doi: 10.1016/j.prnil.2015.03.002.
33. Caffo O, Pappagallo G, Brugnara S et al. Multiple rechallenges for castration-resistant prostate cancer patients responding to first-line docetaxel: assesment of clinical outcomes and predictive factors. Urology 2012; 79 (3): 644–649. doi: 10.1016/j.urology.2011.11.043.
34. Oudard S, Kramer G, Caffo O et al. Docetaxel rechallenge after an initial good response in patients with metastatic castration-resistant prostate cancer. BJU Int 2015; 115 (5): 744–752. doi: 10.1111/bju.12845.
35. Loriot Y, Massard C, Gross-Goupil M et al. The interval from the last cycle of docetaxel-based chemotherapy to progression is associated with efficacy of subsequent docetaxel in patients with prostate cancer. Eur J Cancer 2010; 46 (10): 1770–1772. doi: 10.1016/j.ejca.2010.04.010.
36. Petrioli R, Francini E, Roviello G et al. Is there still a place for docetaxel rechallenge in prostate cancer? World J Clin Oncol 2015; 6 (5): 99–103. doi: 10.5306/wjco.v6.i5.99.
37. Gravis G, Fizazi K, Joly F et al. Androgen-deprivation therapy alone or with docetaxel in non-castrate metastatic prostate cancer (GETUG-AFU 15): a randomised, open-label, phase 3 trial. Lancet Oncol 2013; 14 (2): 149–158. doi: 10.1016/S1470-2045 (12) 70560-0.
38. Gravis G, Boher JM, Joly F et al. Androgen deprivation therapy (ADT) plus docetaxel versus ADT alone in metastatic non castrate prostate cancer: impact of metastatic burden and long-term survival analys sof the randomised phase 3 GETUG-AFU trial. Eur Urol 2015; 70 (2): 256–262. doi: 10.1016/j.eururo.2015.11.005.
39. Sweeney CJ, Chen YH, Carducci M et al. Chemohormonal therapy in metastatic hormone-sensitive prostate cancer. N Engl J Med 2015; 373 (8): 737–746. doi: 10.1056/NEJMoa1503747.
40. James ND, Sydes MR, Clarke NW et al. Addition of docetaxel, zolendronic acid, or both to first-line long-term hormone therapy in prostate cancer (STAMPEDE): survival results from an adaptive, multiarm, multistage platform randomised controlled trial. Lancet 2016; 387 (10024): 1163–1177. doi: 10.1016/S0140-6736 (15) 01037-5.
41. Tucci M, Bertaglia V, Vignani F et al. Addition of docetaxel to androgen deprivation therapy for patients with hormone-sensitive metastatic prostate cancer: a systemic review and meta-analysis. Eur Urol 2016; 69 (4): 563–573. doi: 10.1016/j.eururo.2015.09.013.
42. Rosenthal SA, Hunt D, Sartor AO et al. A phase 3 trial of 2 years od androgen suppression and radiation therapy with or without adjutant chemotherapy for high-risk prostate cancer: final results of Radiation therapy oncology group phase III ransomised trial NRG Oncology RTOG 9902. Int J Radiat Oncol Biol Phys 2015; 93 (2): 294–302. doi: 10.1016/j.ijrobp.2015.05.024.
43. Fizazi K, Faivre L, Lesaunier F et al. Androgen deprivation therapy plus docetaxel and estramustine versus androgen deprivation therapy alone for high-risk localised prostate cancer (GETUG 12): a phase 3 randomised controlled trial. Lancet Oncol 2015; 16 (7): 787–794. doi: 10.1016/S1470-2045 (15) 00011-X.
44. Sandler HM, Hu C, Rosenthal SA et al. A phase III protocol of androgen suppression (AS) and 3DCRT/IMRT versus AS and 3DCRT/IMRT followed by chemotherapy (CT) with docetaxel and prednisone for localized, high-risk prostate cancer (RTOG 0521). J Clin Oncol 2015; 33 (Suppl): abstr. 5002.
45. Dorff TB, Flaig TW, Tangen CM et al. Adjuvant androgen deprivation of high-risk prostate cancer after radical prostatectomy: SWOG S9921 study. J Clin Oncol 2011; 29 (15): 2040–2045. doi: 10.1200/JCO.2010.32. 2776.
Labels
Paediatric clinical oncology Surgery Clinical oncology
Article was published inClinical Oncology

2017 Issue 1-
All articles in this issue
- Analytická interference může vést k diagnostice lymfoproliferativního onemocnění
- Daratumumab – naděje pro myelomové pacienty, výzva pro klinické laboratoře
- Epitelo-mezenchymální tranzice v nádorové tkáni a její role při metastatickém šíření karcinomů
- Možnosti chemoterapie v léčbě karcinomu prostaty
- Lymfedém po operacích na spádových lymfatických uzlinách pro karcinom prsu
- Rozdiely vo vekovej distribúcii, onkologických diagnózach a štádiu ochorenia medzi rómskymi a nerómskymi onkologickými pacientmi registrovanými na ambulantnom onkologickom oddelení v Poprade v rokoch 2014 a 2015 – retrospektívna štúdia
- Rozdiely v incidencii a biologických charakteristikách karcinómu prsníka medzi rómskymi a nerómskymi pacientkami na Slovensku
- Clinical Oncology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Lymfedém po operacích na spádových lymfatických uzlinách pro karcinom prsu
- Daratumumab – naděje pro myelomové pacienty, výzva pro klinické laboratoře
- Epitelo-mezenchymální tranzice v nádorové tkáni a její role při metastatickém šíření karcinomů
- Možnosti chemoterapie v léčbě karcinomu prostaty
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

