-
Medical journals
- Career
Aktuality v podpůrné léčbě chronické lymfocytární leukemie
Authors: M. Brejcha
Authors‘ workplace: Hematologické oddělení, Nemocnice Nový Jičín a. s.
Published in: Klin Onkol 2015; 28(Supplementum 3): 50-54
doi: https://doi.org/10.14735/amko20153S50Overview
Pacienti s chronickou lymfocytární leukemií mají narušenou buněčnou i humorální imunitu s kvantitativním a kvalitativním postižením jednotlivých buněk imunitního systému. Nerovnováha imunity se u nich projevuje zvýšeným výskytem infekcí a autoimunitních cytopenií. Podpůrná péče se u chronické lymfocytární leukemie zaměřuje na prevenci a léčbu těchto nejčastějších komplikací prostřednictvím antimikrobiální profylaxe, substituce imunoglobulinů, imunosupresivní léčby, aplikace růstových faktorů a substituce krevních přípravků.
Klíčová slova:
chronická lymfocytární leukemie – podpůrná léčba – infekční komplikaceÚvod
Většina komplikací, které typicky provází chronickou lymfocytární leukemii (CLL), souvisí s nerovnováhou imunitního systému. CLL je spjata s humorálním a buněčným imunitním deficitem [1]. U nemocných s CLL dochází k rozvoji hypogamaglobulinemie a kvalitativnímu i kvantitativnímu postižení B lymfocytů, T lymfocytů, NK buněk, neutrofilů, monocytů a makrofágů. Porucha imunity vede ke zvýšenému výskytu infekčních komplikací, které jsou hlavní příčinou morbidity a mortality u CLL [2]. Na zvýšeném výskytu infekcí se kromě imunodeficitu spojeného se samotnou CLL podílí i imunosuprese navozená terapií. Autoimunitní projevy jsou pozorovány přibližně u čtvrtiny nemocných a nejčastěji se manifestují jako autoimunitní hemolytická anémie (AIHA), imunitní trombocytopenie (ITP) a čistá aplazie červené řady (pure red cell aplasia – PRCA) [3]. Kromě projevů autoimunity se na vzniku cytopenií může podílet infiltrace kostní dřeně při základním onemocnění a myelosuprese navozená léčbou.
Infekční komplikace u nemocných s CLL
Neoplastické CLL buňky indukují funkční změny v imunitním systému prostřednictvím přímé mezibuněčné reakce a produkcí řady cytokinů, jako jsou IL‑6, IL‑10, TNF a TGF‑β [4]. Imunitní systém je zároveň narušen cytotoxickou terapií, která vede ke snížení počtu jednotlivých typů buněčných elementů. Změny funkce T lymfocytů vedou k narušení interakce s B lymfocyty v procesu prezentace antigenu, je deficientní funkce T helperů a zvýšená aktivita T supresorů. Snížení cytotoxické aktivity NK buněk souvisí s chyběním azurofilních granul, neutrofily a monocyty mají sníženou fagocytární a baktericidní funkci s poruchou migrace a chemotaxe, je narušena aktivace komplementu [5 – 7]. V průběhu nemoci se infekce vyskytují až u 80 % pacientů a 25 – 50 % nemocných v důsledku infekce umírá [8]. Spektrum prokazovaných infekčních agens se mění v průběhu nemoci od běžných bakteriálních organizmů až po méně časté oportunní patogeny. Zatímco bakteriální infekce jsou projevem imunodeficitu spojeného se samotnou CLL, virové, oportunní a mykotické infekce jsou zpravidla komplikací podávané léčby. Bakteriální infekce jsou nejčastější a postihují zpravidla dýchací cesty, mohou ale postihnout i kůži, močový a gastrointestinální trakt [6]. Nejčastějšími patogeny v respiračním traktu jsou Streptococcus pneumoniae, Staphylococcus aureus a Haemophilus influenzae, na infekcích močových cest se podílejí gramnegativní bakterie jako Escherichia coli, Klebsiella pneumoniae, Pseudomonas aeruginosa [9]. Častým problémem u CLL jsou virové infekce nebo jejich reaktivace. Riziko představují zvláště herpes simplex virus, varicella zoster virus, cytomegalovirus (CMV), virus Epstein‑Barrové a viry hepatitidy B a C. Zvláště u pacientů léčených chemoterapií v kombinaci s monoklonálními protilátkami mohou mít virové infekce velmi vážný průběh [10]. Oportunní a mykotické infekce jsou vzácné u dosud neléčených pacientů, jejich frekvence ale stoupá při léčbě purinovými analogy, steroidy a monoklonálními protilátkami. Typickým oportunním patogenem, který postihuje pacienty léčené monoklonálními protilátkami a purinovými analogy, je Pneumocystis jiroveci [11].
Spektrum infekčních komplikací dle terapeutických režimů
Při léčbě alkylačními cytostatiky je většina prokazovaných infekcí bakteriálního původu. Způsobené jsou jak grampozitivními, tak gramnegativními patogeny a typicky se projevují opakovanými infekcemi dýchacích cest. Mykotické a virové infekce nejsou při léčbě alkylačními cytostatiky běžné, může k nim ale dojít při dlouhodobé neutropenii, souběžné léčby kortikosteroidy nebo dlouhodobé léčbě širokospektrými antibiotiky [8].
V posledních dvou dekádách získala hlavní podíl v léčbě CLL purinová analoga. Jejich použití na jedné straně vede ke zlepšení léčebné odpovědi, na druhé straně se zvyšuje incidence a mění spektrum infekcí. Ve srovnání s pacienty léčenými chlorambucilem mají nemocní užívající fludarabin více herpetických a oportunních infekcí [12]. Při léčbě fludarabinovým režimem se tak můžeme setkat s méně obvyklými infekčními agens, jako jsou např. Listeria species, Mycobacterium species, Nocardia species, mykotickými infekcemi, které většinou způsobuje Candida species nebo Aspergiullus species, a zvýšeným výskytem pneumocystové infekce. Herpetické infekce jsou při léčbě fludarabinem spojeny se zvýšenou incidencí postherpetické neuralgie [13]. Patogeneze infekcí při léčbě purinovými analogy souvisí s kvantitativní a kvalitativní poruchou T lymfocytů, zvláště CD4+, která může přetrvávat i několik let po terapii [14]. Riziko infekcí je vyšší u pacientů, kteří již byli dříve léčeni, než u těch, kteří dostávají fludarabin v 1. linii léčby [11]. Dalšími rizikovými faktory infekcí u pacientů léčených purinovými analogy jsou pokročilé stadium nemoci, zvýšená hladina sérového kreatininu, anémie a snížená hladina IgG. Cytostatikum strukturou podobné alkylačním cytostatikům a pu-rinovým analogům je bendamustin. Přestože podobnost s purinovými analogy by mohla teoreticky vést ke zvýšenému výskytu infekcí, dosavadní zkušenosti tento předpoklad při léčbě bendamustinem nepotvrzují [15].
Důležitou roli v péči o pacienty s refrakterní CLL mají vysoké dávky kortikoidů, zvláště u nemocných s masivní lymfadenopatií. Kortikoidy nezpůsobují myelosupresi, ale zvýšené riziko invazivních mykóz představuje obávaný vedlejší účinek [16].
Nedílnou součástí léčby pacientů s CLL jsou monoklonální protilátky. Rituximab způsobuje depleci B lymfocytů v periferní krvi, která přetrvává až půl roku po ukončení léčby. Frekvence infekčních komplikací u monoterapie rituximabem je nízká, ale pokud je rituximab podáván v kombinaci se steroidy nebo chemoterapií, dochází ke zvýšenému riziku reaktivace hepatitidy B, která může vést až k fulminantní hepatitidě a jaternímu selhání [17]. Alemtuzumab způsobuje dlouhodobou a výraznou depleci zdravých B a T lymfocytů. Jeho podání může být komplikováno reaktivací cytomegalovirové infekce a pneumonií způsobenou pneumocystou [18].
Recentně se do léčby CLL zařazuje cílená léčba reprezentovaná inhibitory tyrozinkináz ibrutinibem a idelalisibem. V současné době jsou používány zpravidla u těžce předléčených pacientů a jejich podání není spojeno s dalším navýšením výskytu infekcí, které je běžně pozorováno u této skupiny nemocných [19,20].
Strategie profylaktické léčby
Význam profylaktického podání antibiotik na snížení výskytu infekcí u CLL dosud nebyl hodnocen v žádné prospektivní randomizované studii. Antibiotická profylaxe obecně indikována není, může ale být zvážena u pacientů s hypogamaglobulinemií a opakovanými bakteriálními infekcemi [21]. Tento přístup může být přínosem u pacientů s chronickou obstrukční plicní nemocí (CHOPN), u kterých profylaktické podání makrolidových antibiotik vede ke snížení incidence exacerbací [22]. Profylaxe pneumocystové infekce je doporučována u pacientů léčených alemtuzumabem, purinovými analogy a u pacientů léčených vysokými dávkami kortikoidů [23]. Lékem volby je perorální trimetroprim ‑ sulfametoxazol (TMP/ SMX), v případě alergie lze použít dapson nebo inhalační pentamidin [24]. Profylaxe aciklovirem proti herpetickým infekcím je doporučována u pacientů léčených intenzivními nebo imunosupresivními režimy, kteří jsou séropozitivní, mají nízkou hladinu CD4+ lymfocytů a anamnézu předchozí herpetické infekce [21]. Trvání pneumocystové a herpetické profylaxe se doporučuje minimálně ještě dva měsíce po ukončení léčby, popř. do vzestupu CD4+ lymfocytů nad 0,2 × 109/ l. U pacientů léčených alemtuzumabem je problematická CMV reaktivace, vyskytující se v 10 – 25 % případů [25]. Je nutné, aby nemocní léčení alemtuzumabem užívali profylakticky aciklovir (nebo ekvivalenty) po dobu léčby a minimálně dva, lépe však šest měsíců po jejím skončení. Dále je doporučována týdenní monitorace CMV viremie pomocí kvantitativní PCR v reálném čase. Při významném vzestupu počtu CMV kopií či při výskytu febrilií s pozitivitou CMV je nutné léčbu alemtuzumabem přerušit a zahájit preemptivní léčbu ganciklovirem, valganciklovirem nebo foscavirem. Při nízké CMV viremii bez klinických příznaků je možné zvážit pokračování v léčbě alemtuzumabem s pečlivými dalšími kontrolami CMV viremie [26]. Léčba monoklonálními protilátkami může mít za následek reaktivaci hepatitidy B nebo C.Všichni pacienti by měli být před zahájením léčby vyšetřeni na přítomnost obou typů hepatitid a v případě pozitivního nálezu léčeni ve spolupráci s odborníkem na virovou hepatitidu [27]. Preemptivní protivirová léčba je indikována u HBsAg pozitivních pacientů. U pacientů s pozitivitou anti‑HBc protilátek a negativitou HBsAg je nezbytné vyšetření DNA viru hepatitidy B. V případě pozitivního nálezu je postup stejný jako u HbsAg pozitivních nemocných. Souhrn antimikrobiální profylaxe je uveden v tab. 1.
Table 1. Přehled antimikrobiální profylaxe. 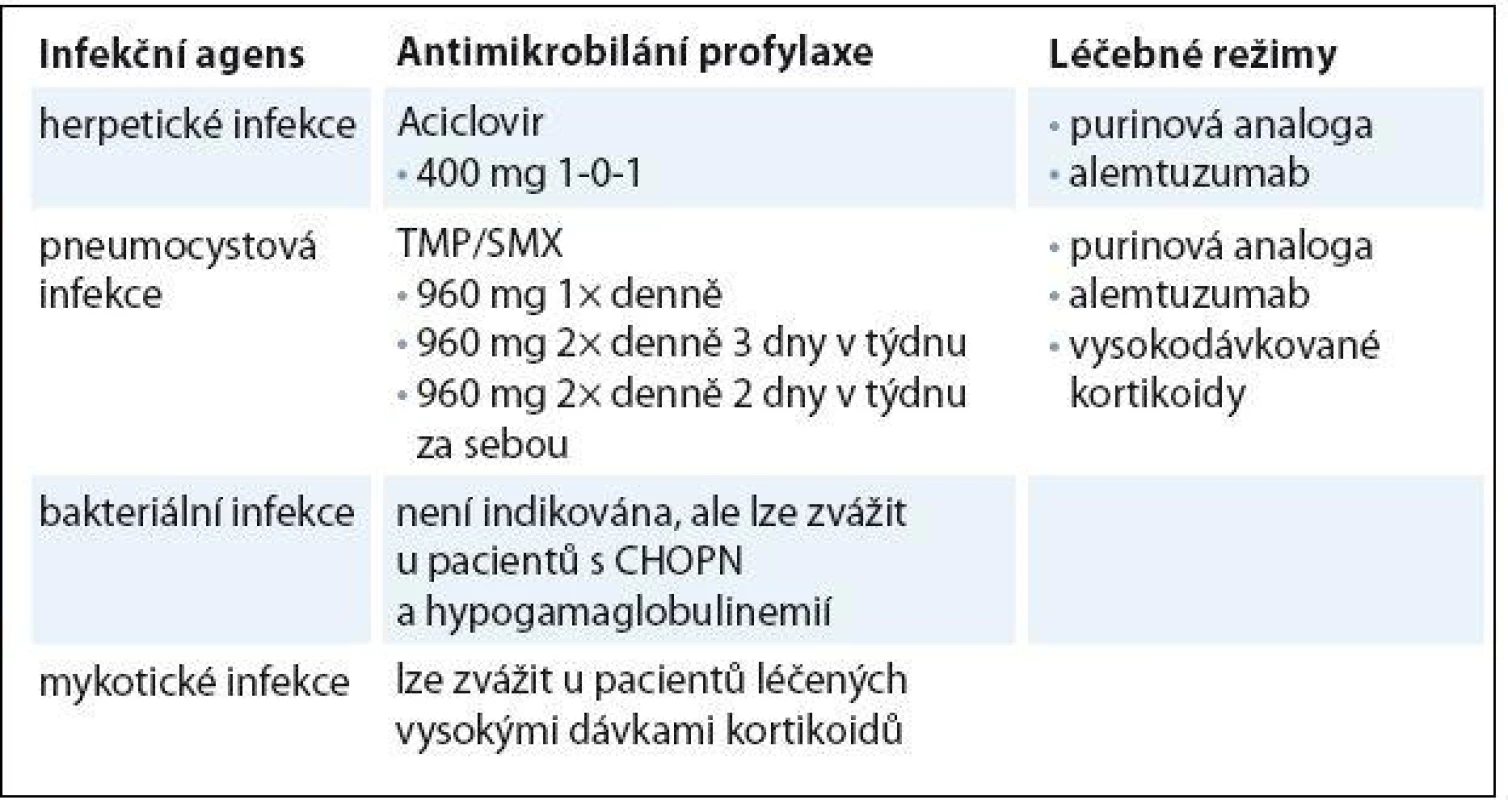
CHOPN – chronická obstrukční plicní nemoc Substituce imunoglobulinů
Normální hladina IgG u zdravých jedinců je 7 – 16 g/ l. Pokles hladiny IgG pod 6,5 g/ l vede ke zvýšení pětiletého rizika infekčních komplikací z 26 na 57 % [28]. V průběhu nemoci dojde k poklesu hladiny IgG u více než 85 % pacientů s CLL [29]. Na jejím vzniku se podílí dysfunkce neklonálních CD5 – B lymfocytů a regulační abnormality T buněk, zároveň samotné maligní B lymfocyty mají schopnost inhibovat imunoglobuliny produkující plazmatické buňky [30]. V patogenezi imunodeficitu se uplatňuje především porucha opsonizace a neutralizační funkce imunoglobulinů. V důsledku nízké hladiny imunoglobulinů dochází ke zvýšené náchylnosti k bakteriálním infekcím, nejčastěji prokazovanými patogeny jsou opouzdřené bakterie (Streptococcus pneumoniae, Staphylococcus aureus a Haemophilus influenzae). V klinickém obraze pak dominují infekce dýchacích cest, především opakované sinusitidy, pneumonie, bronchitidy. Dosavadní zkušenosti ukazují, že substituce imunoglobulinů vede k poklesu výskytu bakteriálních infekcí, na celkovou mortalitu pacientů s CLL však vliv nemá [31]. Podání imunoglobulinů je indikováno u pacientů s opakovanými infekcemi a hladinou IgG < 5 g/ l. Iniciální dávka je 0,2 – 0,4 g/ kg a opakuje se každé 3 – 4 týdny [32]. Pokud substituce imunoglobulinů nevede ke snížení výskytu bakteriálních infekcí, měl by být další postup u těchto pacientů řešen ve spolupráci s imunologem a mikrobiologem. Alternativou intravenózního podání imunoglobulinů je podání subkutánní [33]. Efekt subkutánního podání na snížení incidence infekcí je srovnatelný s intravenózním a umožňuje aplikaci samotným pacientem v domácím prostředí.
Vakcinace
Protilátková odpověď na očkování je u pacientů s CLL ve srovnání se zdravou populací celkově snížená [34 – 36]. U neselektované skupiny pacientů s CLL dochází k odpovědi na pneumokokovou polysacharidovou vakcínu u 0 – 22 % případů. Pokud je však vakcína podána v počáteční fázi onemocnění, před zahájením chemoterapie a rozvojem hypogamaglobulinemie, tak k významné odpovědi na očkování proti pneumokokům dochází u 35 – 47 %, proti Haemofilus influenzae u 27 – 43 % a proti tetanu u 24 – 65 % pacientů. Odpověď na očkování proti sezónní chřipce je u pacientů s CLL rovněž snížená a jejího zvýšení lze dosáhnout podáním dvou dávek vakcíny s odstupem 21 dní [37]. Pacienti by měli být o snížené účinnosti vakcinace informováni, ale obecně je doporučováno každoroční očkování proti chřipce a každých pět let pravidelné očkování proti pneumokokům [38]. V době chřipkové sezóny by však měla být věnována zvýšená pozornost i těm nemocným, kteří očkování podstoupili. Pacienti léčení rituximabem by měli být očkováni až poté, co dojde k regeneraci B lymfocytů. Živé vakcíny jsou u pacientů s CLL kontraindikovány.
Autoimunitní cytopenie
Autoimunitní komplikace jsou u CLL poměrně častým jevem a v průběhu nemoci se objevují u 10 – 25 % pacientů [3]. Jsou dalším z projevů celkové imunitní dysbalance a u CLL postihují především krevní složky. Nejčastější formou autoimunitní poruchy u CLL je AIHA. V laboratorním obraze se projeví izolovaným poklesem hemoglobinu, retikulocytózou, vzestupem bilirubinu a laktátdehydrogenázy, poklesem haptoglobinu a pozitivním Coombsovým testem (direct antiglobulin test – DAT). Rizikovými faktory pro rozvoj AIHA jsou pokročilé stadium, věk nad 65 let a pozitivní DAT [39]. Rozvoj AIHA může také souviset s prodělanou terapií [40]. Ve studii CLL4 měli pacienti léčení chlorambucilem nebo fludarabinem více než 2krát vyšší riziko rozvoje AIHA než ti, kteří byli léčeni kombinací fludarabinu a cyklofosfamidu (FC). Vysvětlením může být lepší léčebná odpověď na FC, nižší dávka fludarabinu v kombinovaném režimu a imunosupresivní efekt cyklofosfamidu. U pacientů, kteří mají pozitivní DAT nebo AIHA v anamnéze a vyžadují léčbu CLL, by měl být preferován kombinovaný režim před monoterapií chlorambucilem nebo fludarabinem. ITP se objevuje přibližně u 2 – 5 % pacientů a přibližně 1/ 3 případů má současně AIHA (Evansův syndrom) [41]. Vyšší výskyt ITP byl pozorován v souvislosti s vysokým počtem leukocytů, pozitivním DAT a nemutovaným IgVH genem. Souvislost mezi rozvojem ITP a prodělanou léčbou pozorován nebyl. PRCA je vzácná komplikace, která se projeví poklesem hemoglobinu, retikulocytopenií a negativním DAT. U této poruchy je důležité vyloučit virové infekce (virus Epstein‑Barrové, CMV, parvovirus B19).
Imunosupresivní léčba autoimunních cytopenií
Léčba autoimunitních cytopenií je v 1. linii založena na podání kortikoidů [3]. Podává se prednisolon v dávce 1 mg/ kg/ den po dobu 2 – 4 týdnů s následným pozvolným snižováním dávky nebo pulzy dexametazonu 40 mg/ den po dobu čtyř dnů. V případě potřeby rychlé léčebné odpovědi mohou být podány intravenózní imunoglobuliny. U pacientů nereagujících na kortikoidy může mít efekt jiná imunosupresivní terapie, jako např. azatioprin nebo cyklosporin A [42]. U nekontrolovatelné hemolýzy nebo trombocytopenie může být přínosem splenektomie [43]. Při její indikaci je však nutné vzít v úvahu, že její provedení dále prohlubuje imunodeficit a zvyšuje riziko infekcí. U nemocných, kteří nejsou schopni podstoupit splenektomii, může být zváženo ozáření sleziny [44]. V léčbě autoimunitních cytopenií může mít efekt i monoterapie rituximabem nebo alemtuzumabem [45,46]. V literatuře jsou popsány i případy úspěšného použití agonistů trombopoetinového receptoru v léčbě ITP pacientů s CLL [47,48]. Přestože přítomnost autoimunní cytopenie není indikací k léčbě CLL, její rozvoj může být projevem progrese nemoci a k jejímu zvládnutí je v některých případech nutná chemoimunoterapie [49].
Růstové faktory a transfuze
Kromě základních laboratorních vyšetření vyžaduje komplexní diagnóza všech cytopenií provést diagnostický odběr kostní dřeně. K rozhodnutí o léčebném postupu je nezbytné odlišit autoimunitní cytopenii od cytopenie způsobené útlakem krvetvorby leukemickou populací nebo protinádorovou léčbou. Anémie, která vzniká v důsledku útlaku erytropoézy při infiltraci kostní dřeně a nelepší se při terapii CLL, může reagovat na podání erytropoetinu [50]. U pacientů, kteří reagují na léčbu erytropoetinem, dochází ke snížení potřeby transfuzí a zlepšení kvality života. Podání transfuzí může být u těžce imunosuprimovaných nemocných spojeno se zvýšeným rizikem rozvoje reakce štěpu proti hostiteli [51]. U nemocných léčených fludarabinem či alemtuzumabem a po alogenní transplantaci, stejně jako u nemocných, u kterých se uvažuje o provedení alogenní transplantace v budoucnu, by proto měly být používány ozářené transfúzní přípravky [52]. Podání leukocytárních růstových faktorů u CLL nejen vede ke zvýšení počtu neutrofilů, ale má i pozitivní vliv na jejich funkci [53]. Jejich podání je indikováno v primární profylaxi u nemocných léčených režimy s rizikem rozvoje febrilní neutropenie více než 20 %, v sekundární profylaxi pak u nemocných, kteří prodělali komplikovanou neutropenii v předchozím léčebném cyklu [54]. V léčbě CLL je riziko těžké infekce vyskytující se u více než 20 % pacientů spojeno s režimy kombinujícími rituximab s purinovými analogy [55].
Závěr
Podpůrná péče u pacientů s CLL zahrnuje zajištění širokého spektra preventivních a léčebných opatření. Základem prevence výskytu komplikací v léčbě CLL je uvědomění si rizik, která jsou spojena s jednotlivými druhy léčby, a znalost specifických poruch imunity, jež provázejí CLL. Dodržení doporučených postupů je tak základem ke snížení rizika rozvoje komplikací a umožňuje pacientům projít náročnou protinádorovou léčbou.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do bi omedicínských časopisů.
MUDr. Martin Brejcha
Hematologické oddělení
Nemocnice Nový Jičín a.s.
Revoluční 2214/35
741 01 Nový Jičín
e-mail: martin.brejcha@nnj.agel.cz
Obdrženo: 15. 7. 2015
Přijato: 2. 8. 2015
Sources
1. Dearden C. Disease ‑ specific complications of chronic lymphocytic leukemia. Hematology Am Soc Hematol Educ Program 2008; 2008(1): 450 – 456. doi: 10.1182/ asheducation ‑ 2008.1.450.
2. Hamblin AD, Hamblin TJ. The immunodeficiency of chronic lymphocytic leukaemia. Br Med Bull 2008; 87(1): 49 – 62. doi: 10.1093/ bmb/ ldn034.
3. Diehl LF, Ketchum LH. Autoimmune disease and chronic lymphocytic leukemia: autoimmune hemolytic anemia, pure red cell aplasia, and autoimmune thrombocytopenia. Semin Oncol 1998; 25(1): 80 – 97.
4. Buggins AG, Patten PE, Richards J et al. Tumor ‑ derived IL‑6 may contribute to the immunological defect in CLL. Leukemia 2008; 22(5): 1084 – 1087.
5. Kay NE, Zarling JM. Impaired natural killer activity in patients with chronic lymphocytic leukemia is associated with a deficiency of azurophilic cytoplasmic granules in putative NK cells. Blood 1984; 63(2): 305 – 309.
6. Itälä M, Vainio O, Remes K. Functional abnormalities in granulocytes predict susceptibility to bacterial infections in chronic lymphocytic leukaemia. Eur J Haematol 1996; 57(1): 46 – 53.
7. Schlesinger M, Broman I, Lugassy G. The complement system is defective in chronic lymphatic leukemia patients and in their healthy relatives. Leukemia 1996; 10(9): 1509 – 1513.
8. Wadhwa PD, Morrison VA. Infectious complications of chronic lymphocytic leukemia. Semin Oncol 2006; 33(2): 240 – 249.
9. Morrison VA. Management of infectious complications in patients with chronic lymphocytic leukemia. Hematology Am Soc Hematol Educ Program 2007; 2007(1): 332 – 338.
10. Melchardt T, Weiss L, Greil R et al. Viral infections and their management in patients with chronic lymphocytic leukemia. Leuk Lymphoma 2013; 54(8): 1602 – 1613. doi: 10.3109/ 10428194.2012.755178.
11. Anaissie EJ, Kontoyiannis DP, O’Brien S et al. Infections in patients with chronic lymphocytic leukemia treated with fludarabine. Ann Intern Med 1998; 129(7): 559 – 566.
12. Cheson BD. Infectious and immunosuppressive complications of purine analog therapy. J Clin Oncol 1995; 13(9): 2431 – 2448.
13. Byrd JC, McGrail LH, Hospenthal DR et al. Herpes virus infections occur frequently following treatment with fludarabine: results of a prospective natural history study. Br J Haematol 1999; 105(2): 445 – 447.
14. Frank DA, Mahajan S, Ritz J. Fludarabine‑induced immunosuppression is associated with inhibition of STAT1 signaling. Nat Med 1999; 5(4): 444 – 447.
15. Gurion R, Raanani P, Shpilberg O et al. bendamustine is not associated with an increase in infections – systematic review and meta‑analysis of randomized controlled trials. Blood 2013; 122(21): 5125 – 5125.
16. Smolej L, Doubek M, Panovská A et al. Rituximab in combination with high‑dose dexamethasone for the treatment of relapsed/ refractory chronic lymphocyticleukemia. Leuk Res 2012; 36(10): 1278 – 1282. doi: 10.1016/ j.leukres.2012.07.005.
17. Dervite I, Hober D, Morel P. Acute hepatitis B in a patient with antibodies to hepatitis B surface antigen who was receiving rituximab. N Engl J Med 2001; 344(1): 68 – 69.
18. Martin SI, Marty FM, Fiumara K et al. Infectious complications associated with alemtuzumab use for lymphoproliferative disorders. Clin Infect Dis 2006; 43(1):16 – 24.
19. Brown JR, Byrd JC, Coutre SE et al. Idelalisib, an inhibitor of phosphatidylinositol 3 - kinase p110δ, for relapsed/ refractory chronic lymphocytic leukemia. Blood 2014; 123(22): 3390 – 3397. doi: 10.1182/ blood ‑ 2013 ‑ 11 ‑ 535047.
20. Byrd JC, Furman RR, Coutre SE et al. Targeting BTK with ibrutinib in relapsed chronic lymphocytic leukemia. N Engl J Med 2013; 369(1): 32 – 42. doi: 10.1056/ NEJMoa1215637.
21. Oscier D, Dearden C, Erem E et al. Guidelines on the diagnosis, investigation and management of chronic lymphocytic leukaemia. Br J Haematol 2012; 159(5): 541 – 564. doi: 10.1111/ bjh.12067.
22. Donath E, Chaudhry A, Hernandez ‑ Aya LF et al. A meta‑analysis on the prophylactic use of macrolide antibiotics for the prevention of disease exacerbations in patients with chronic obstructive pulmonary disease. Respir Med 2013; 107(9): 1385 – 1392. doi: 10.1016/ j.rmed.2013.05.004.
23. Segal BH, Freifeld AG, Baden LR et al. Prevention and treatment of cancer‑related infections. J Natl Compr Canc Netw 2008; 6(2): 122 – 174.
24. Radocha J, Zavřelová A, Žák P. Profylaxe pneumocystové pneumonie u hematologických nemocných. Postgraduální medicína 2013; 15 (Suppl): 35 – 37.
25. Osterborg A, Foà R, Bezares RF et al. Management guidelines for the use of alemtuzumab in chronic lymphocytic leukemia. Leukemia 2009; 23(11): 1980 – 1988. doi: 10.1038/ leu.2009.146.
26. O’Brien SM, Keating MJ, Mocarski ES. Updated guidelines on the management of cytomegalovirus reactivation in patients with chronic lymphocytic leukemia treated with alemtuzumab. Clin Lymphoma Myeloma 2006; 7(2): 125 – 130.
27. Artz AS, Somerfield MR, Feld JJ et al. American Society of Clinical Oncology provisional clinical opinion: chronic hepatitis B virus infection screening in patients receiving cytotoxic chemotherapy for treatment of malignant diseases. J Clin Oncol 2010; 28(19): 3199 – 3202. doi: 10.1200/ JCO.2010.30.0673.
28. Molica S, Levato D, Levato L. Infections in chronic lymphocytic leukemia. Analysis of incidence as a function of length of follow‑up. Haematologica 1993; 78(6): 374 – 377.
29. Itälä M, Helenius H, Nikoskelainen J et al. Infections and serum IgG levels in patients with chronic lymphocytic leukemia. Eur J Haematol 1992; 48(5): 266 – 270.
30. Sampalo A, Brieva JA. Humoral immunodeficiency in chronic lymphocytic leukemia: role of CD95/ CD95L in tumoral damage and escape. Leuk Lymphoma 2002; 43(4): 881 – 884.
31. Raanani P, Gafter ‑ Gvili A, Paul M et al. Immunoglobulin prophylaxis in hematological malignancies and hematopoietic stem cell transplantation. Leuk Lymphoma 2009; 50(5): 764 – 772. doi: 10.1080/ 10428190902856824.
32. Zelenetz AD, Abramson JS, Advani R et al. Non ‑ Hodgkin’s Lymphomas. J Natl Compr Canc Netw 2010; 8(3): 288 – 334.
33. Compagno N, Cinetto F, Semenzato G et al. Subcutaneous immunoglobulin in lymphoproliferative disorders and rituximab‑related secondary hypogammaglobulinemia: a single‑center experience in 61 patients. Haematologica 2014; 99(6): 1101 – 1106. doi: 10.3324/ haematol.2013.101261.
34. Hartkamp A, Mulder AH, Rijkers GT et al. Antibody responses to pneumococcal and haemophilus vaccinations in patients with B ‑ cell chronic lymphocytic leukaemia. Vaccine 2001; 19(13): 1671 – 1677.
35. Sinisalo M, Aittoniemi J, Oivanen P et al. Response to vaccination against different types of antigens in patients with chronic lymphocytic leukaemia. Br J Haematol 2001; 114(1): 107 – 110.
36. Sinisalo M, Vilpo J, Itälä M et al. Antibody response to 7 - valent conjugated pneumococcal vaccine in patients with chronic lymphocytic leukaemia. Vaccine 2007; 26(1): 82 – 87.
37. De Lavallade H, Garland P, Sekine T et al. Repeatedvaccination is required to optimize seroprotection against H1N1 in the immunocompromised host. Haematologica 2011; 96(2): 307 – 314. doi: 10.3324/ haematol.2010.032664.
38. Kim DK, Bridges CB, Harriman KH et al, Advisory committee on immunization practices recommended immunization schedule for adults aged 19 years or older – United States, 2015. Ann Intern Med 2015; 162(3): 214 – 223.
39. Barcellini W, Capalbo S, Agostinelli RM et al. Relationship between autoimmune phenomena and disease stage and therapy in B ‑ cell chronic lymphocytic leukemia. Haematologica 2006; 91(12): 1689 – 1692.
40. Dearden C, Wade R, Else M et al. The prognostic significance of a positive direct antiglobulin test in chronic lymphocytic leukemia: a beneficial effect of the combination of fludarabine and cyclophosphamide on the incidence of hemolytic anemia. Blood 2008; 111(4): 1820 – 1826.
41. Visco C, Ruggeri M, Laura EM et al. Impact of immune thrombocytopenia on the clinical course of chronic lymphocytic leukemia. Blood 2008; 111(3): 1110 – 1116.
42. Cortes J, O’Brien S, Loscertales J et al. Cyclosporin A for the treatment of cytopenia associated with chronic lymphocytic leukemia. Cancer 2001; 92(8): 2016 – 2022.
43. Hill J, Walsh RM, McHam S et al. Laparoscopic splenectomy for autoimmune hemolytic anemia in patients with chronic lymphocytic leukemia: a case series and review of the literature. Am J Hematol 2004; 75(3): 134 – 138.
44. Guiney MJ, Liew KH, Quong GG et al. A study of splenic irradiation in chronic lymphocytic leukemia. Int J Radiat Oncol Biol Phys 1989; 16(1): 225 – 229.
45. D’Arena G, Laurenti L, Capalbo S et al. Rituximab therapy for chronic lymphocytic leukemia‑associated autoimmune hemolytic anemia. Am J Hematol 2006; 81(8): 598 – 602.
46. Karlsson C, Hansson L, Celsing F et al. Treatment of severe refractory autoimmune hemolytic anemia in B ‑ cell chronic lymphocytic leukemia with alemtuzumab (humanized CD52 monoclonal antibody). Leukemia 2007; 21(3): 511 – 514.
47. Koehrer S, Keating MJ, Wierda W. Eltrombopag, a second ‑ generation thrombopoietin receptor agonist, for chronic lymphocytic leukemia‑associated ITP. Leukemia 2010; 24(5): 1096 – 1098. doi: 10.1038/ leu.2010.45.
48. Sinisalo M, Sankelo M, Itälä ‑ Remes M. Thrombopoietin receptor agonists can be used temporarily with patients suffering from refractory chronic lymphocytic leukemia‑associated immunologic thrombocytopenia. Leuk Lymphoma 2011; 52(4): 724 – 725. doi: 10.3109/ 10428194.2010.551794.
49. Kaufman M, Limaye SA, Driscoll N et al. A combination of rituximab, cyclophosphamide and dexamethasone effectively treats immune cytopenias of chronic lymphocytic leukemia. Leuk Lymphoma 2009; 50(6): 892 – 899. doi: 10.1080/ 10428190902887563.
50. Siakantaris MP, Angelopoulou MK, Vassilakopoulos TP et al. Correction of disease related anaemia of B ‑ chronic lymphoproliferative disorders by recombinant human erythropoietin: maintenance is necessary to sustain response. Leuk Lymphoma 2000; 40(1 – 2): 141 – 147.
51. Maung ZT, Wood AC, Jackson GH et al. Transfusion‑associated graft ‑ versus ‑ host disease in fludarabine‑treated B ‑ chronic lymphocytic leukaemia. Br J Haematol 1994; 88(3): 649 – 652.
52. Treleaven J, Gennery A, Marsh J et al. Guidelines on the use of irradiated blood components prepared by the British Committee for Standards in Haematology blood transfusion task force. Br J Haematol 2011; 152(1): 35 – 51. doi: 10.1111/ j.1365 ‑ 2141.2010.08444.x.
53. Itälä M, Pelliniemi TT, Remes K et al Long‑term treatment with GM‑CSF in patients with chronic lymphocytic leukemia and recurrent neutropenic infections. Leuk Lymphoma 1998; 32(1 – 2): 165 – 174.
54. Lyman GH. Guidelines of the National Comprehensive Cancer Network on the use of myeloid growth factors with cancer chemotherapy: a review of the evidence. J Natl Compr Cancer Netw 2005; 3(4): 557 – 571.
55. Byrd JC, Peterson BL, Morrison VA et al. Randomized phase 2 study of fludarabine with concurrent versus sequential treatment with rituximab in symptomatic, untreated patients with B ‑ cell chronic lymphocytic leukemia: results from Cancer and Leukemia Group B 9712 (CALGB 9712). Blood 2003; 101(1): 6 – 14.
Labels
Paediatric clinical oncology Surgery Clinical oncology
Article was published inClinical Oncology

2015 Issue Supplementum 3-
All articles in this issue
- Molekulární prognostické markery chronické lymfocytární leukemie a jejich klinický význam
- Význam minimální zbytkové nemoci u chronické lymfocytární leukemie
- Monoklonální protilátky v léčbě chronické lymfocytární leukemie v roce 2015
- Léčebné možnosti pro nemocné s chronickou lymfocytární leukemií a významnými přidruženými chorobami
- Léčba chronické lymfocytární leukemie s aberací TP53
- Malé molekuly v léčbě chronické lymfocytární leukemie v roce 2015 a v blízké budoucnosti
- Aktuality v podpůrné léčbě chronické lymfocytární leukemie
- Maligní lymfomy − minulost, současnost a budoucnost
- Difuzní velkobuněčný B lymfom – moderní způsoby diagnostiky a molekulárně cílené léčby
- Folikulární lymfom
- Lymfom z plášťových buněk – současný stav poznání a možnosti léčby
- Hodgkinův lymfom – vývoj léčebných přístupů a současné trendy
- Záchranná léčba a role transplantací u lymfomů
- Současné možnosti imunoterapie nádorových onemocnění
- Clinical Oncology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Difuzní velkobuněčný B lymfom – moderní způsoby diagnostiky a molekulárně cílené léčby
- Folikulární lymfom
- Lymfom z plášťových buněk – současný stav poznání a možnosti léčby
- Hodgkinův lymfom – vývoj léčebných přístupů a současné trendy
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

