-
Medical journals
- Career
Profil aktivace receptorových tyrozinkináz a mitogenem aktivovaných proteinkináz v terapii Maffucciho syndromu
Authors: K. Melichárková 1; J. Neradil 2,3; P. Múdrý 1; K. Zitterbart 1,3; R. Obermannová 3,5; J. Skotáková 4; R. Veselska 1,2; J. Štěrba 1,3
Authors‘ workplace: Klinika dětské onkologie LF MU a FN Brno 1; Laboratoř nádorové biologie, Ústav experimentální biologie, PřF MU, Brno 2; Regionální centrum aplikované molekulární onkologie, Masarykův onkologický ústav, Brno 3; Klinika dětské radiologie LF MU a FN Brno 4; Klinika komplexní onkologické péče, Masarykův onkologický ústav, Brno 5
Published in: Klin Onkol 2015; 28(Supplementum 2): 47-51
doi: https://doi.org/10.14735/amko20152S47Overview
Východiska:
Maffucciho syndrom je vzácné kongenitální nehereditární onemocnění charakterizované přítomností mnohočetných hemangiomů a enchondromů s tendencí k malignímu zvratu. Kauzální terapie neexistuje a léčba je zaměřena na řešení komplikací. Stanovení vhodného postupu je komplikované a často je nutná multioborová spolupráce v péči o tyto pacienty.Případ:
Autoři prezentují případ 20leté pacientky s Maffucciho syndromem. V průběhu života se u ní objevily mnohočetné enchondromy i progredující hemangiomy, které postupem času působily řadu komplikací jako např. omezení hybnosti, poruchy růstu, bolesti, fluidothorax nebo ascites. Byl vyšetřen profil fosforylace vybraných tyrozinových kináz a MAP kináz z progredujících ložisek hemangiomů, což vedlo ke změně léčebné strategie reflektující výsledky vyšetření. Personalizovaná léčba nasazená na základě profilu fosforylace kináz vedla ke klinicky významné léčebné odpovědi trvající šest měsíců.Klíčová slova:
enchondromatóza – hemangiom – protein-tyrozinkinázy – MAP kinázový signální systém – individualizovaná medicína – Maffucciho syndromÚvod
Maffucciho syndrom je vzácné kongenitální nehereditární onemocnění, které patří spolu s Ollierovou chorobou mezi enchondromatózy. Toto onemocnění je charakterizováno přítomností četných hemangiomů a enchondromů, které mají tendenci k malignímu zvratu až u 40 % pacientů [1]. Standardní léčebná doporučení, která by ovlivňovala přirozený průběh vzniku a progrese mnohočetných enchondromů a hemangiomů, nejsou k dispozici a doporučuje se jen symptomatická a podpůrná léčba [2,3].
Případ
Dvacetiletá mladá žena byla sledována již od kojeneckého věku pro přítomnost mnohočetných enchondromů na končetinách, genua vara a poruchu kostního růstu s těžkou růstovou retardací. Její stav vyžadoval opakované korekční ortopedické výkony. Ve dvou letech věku se u ní objevil myelodysplastický syndrom, který se následně rozvinul do RAEB (refractory anemia with excess blasts) s nutností terapie dle protokolu pro akutní myeloidní leukemii zahrnující i alogenní transplantaci kostní dřeně.
Ve věku šesti let se u ní začaly objevovat postupně progredující hemangiomy na rukou (obr. 1), proto bylo při podezření na Maffucciho syndrom provedeno celkové přešetření. Výsledky potvrdily přítomnost chondromu/ enchondromu pravé sfenoidální kosti o velikosti 3,4 × 2,5 × 1,7 cm. V rámci základní nemoci docházelo k postupné progresi histologicky vřetenobuněčných hemangiomů na pažích a vzniku nových lézí na nohou i v parenchymových orgánech, proto bylo tři roky po transplantaci kostní dřeně doporučeno zahájit léčbu nízce dávkovanou chemoterapií. Byla zvolena terapie vincristin 1,5 mg/ m2/ týden + cyklofosfamid 300 mg/ m2/ à 3 týdny, avšak vzhledem ke špatné toleranci již vysoce předléčené pacientky bylo nutné tuto léčbu po šesti měsících přerušit.
Image 1. Fotografi e levé ruky (zdroj: archiv KDO) a RTG snímek levé ruky (zdroj: archiv KDR). 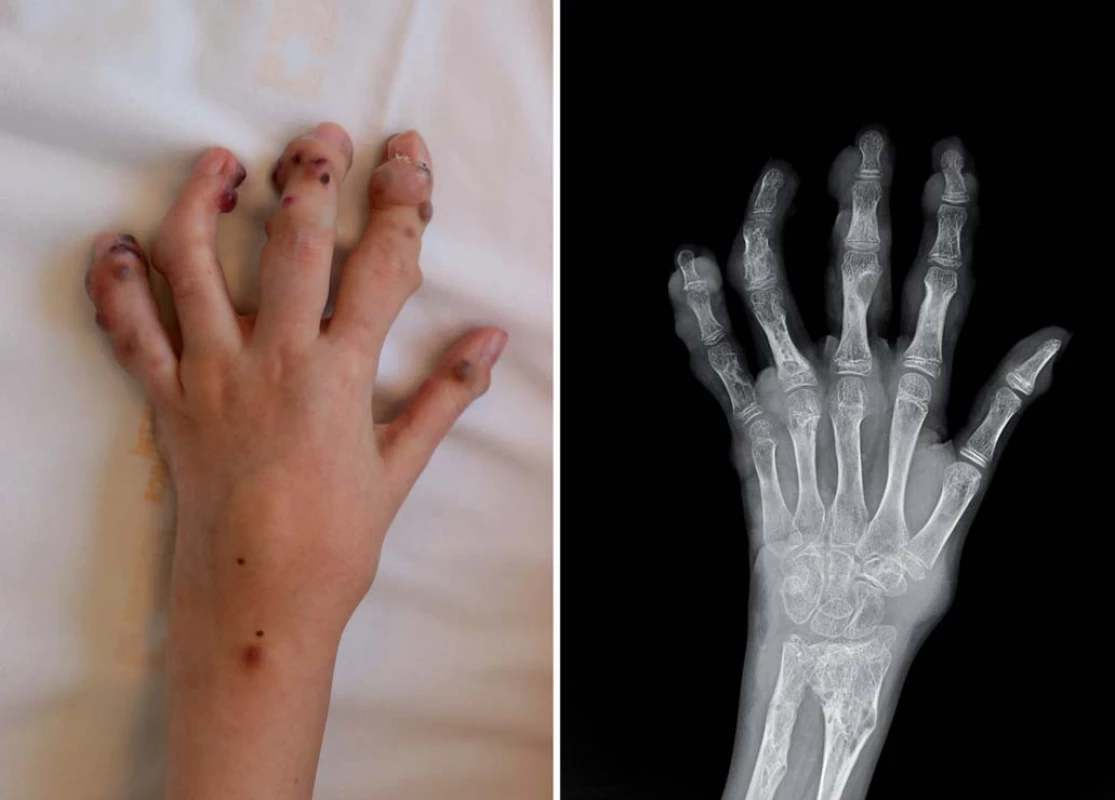
Stav se postupně dále zhoršoval, objevilo se nové ložisko hemangiomu na játrech 4,8 × 3,8 cm a další ložiska na hrudníku a horních končetinách. Proběhl pokus o ovlivnění těchto ložisek kortikoterapií, a to metylprednisolonem 30 mg/ kg/ den D1, D3 a D5, 20 mg/ kg/ den D6 a v dávce 10 mg/ kg/ den D7 a dále navázáno prednizonem 4 mg/ kg/ den po 2 týdny [4]. Výsledkem této terapie byla v nejlepším případě smíšená odpověď. V průběhu léčby proběhly pokusy o ovlivnění ložisek zářením, laserem i chirurgickými korekcemi.
Od 18 let se pacientka potýkala s opakovaným chylózním fluidothoraxem a přítomností chylózní ascitické tekutiny v důsledku aktivity hemangiomů. Tento stav vyžadoval opakované punkce ascitu, v průměru 2 l ascitické tekutiny každé dva týdny. Byl nasazen bevacizumab 10 mg/ kg/ à 2 týdny, po osmi měsících terapie bylo dosaženo pouze stacionárního stavu s pokračující potřebou punkcí ascitu i fluidothoraxu. V této době byla změněna léčba na sirolimus 1 mg/ den a paclitaxel 12,5 mg/ m2// à 1 týden [5]. Tato terapie byla podávána šest měsíců s nutností redukce paclitaxelu na 50 % dávky pro hematologickou toxicitu. Výsledek byl pouze stacionární stav.
Nově byl vyšetřen profil fosforylace receptorových tyrozinkináz (RTK) a MAP kináz (mitogen‑activated protein kinases) z ložiska na patě a dle těchto výsledků byla terapie upravena na sunitinib 12,5 mg/ den a taxol 5,5 mg/ týden. Mimo těchto léků měla dívka v dlouhodobé medikaci také β‑blokátory z kardiologické indikace, u nichž některé práce poukazují na jejich antineoplastický potenciál [6]. Po nasazení této personalizované terapie došlo postupně k prodlužování intervalů pro evakuace ascitu či chylothoraxu, s periodou čtyř měsíců bez potřeby evakuace, což mělo významný dopad na kvalitu života pacientky. Po čtyřech měsících od poslední evakuace ascitu se i přes nasazenou léčbu obnovila potřeba evakuace chylothoraxu s potřebou opakovaných chirurgických intervencí a tedy i s přerušováním, až vysazením antineoplastické medikace na dobu téměř tří měsíců. V průběhu významně redukované či vysazené antineoplastické léčby progredovala potřeba chirurgické derivace chylu charakteru jahodového mléka. Pacientka zemřela náhlou smrtí na akutní krvácení do dutiny břišní v důsledku spontánní ruptury jaterního hemangioendotheliomu tři měsíce po deeskalaci antineoplastické terapie, devět měsíců po zahájení personalizované terapie.
Metodika a výsledky
Pro detekci fosforylace RTK byl použit Human Phospho ‑ RTK Array Kit (R&D Systems) umožňující současné stanovení fosforylace 49 kináz z 16 receptorových rodin, přičemž u člověka bylo zatím popsáno 58 RTK rozdělených do 20 rodin v závislosti na podobnosti proteinové struktury receptorů [7]. Princip metody detekce spočívá v nanesení proteinového lyzátu na nitrocelulózovou membránu, na níž jsou ve dvojicích bodů imobilizovány specifické protilátky proti dané kináze. Fosforylované i nefosforylované formy proteinu se na protilátku naváží v ekvimolárním poměru a v následujícím kroku jsou pouze fosforylované formy proteinu označeny protilátkou proti fosforylovanému tyrozinu konjugovanou s peroxidázou. Po aplikaci chemiluminiscenčního substrátu na membránu lze luminiscenci detekovat na filmu nebo pomocí chemiluminiscenčního skeneru.
Fosforylační status MAP kináz a vybraných serin/ treoninových kináz a dalších signálních molekul byl analyzován pomocí Human Phospho ‑ MAPK Array Kit (R&D Systems) umožňující současné stanovení fosforylace 26 kináz včetně zástupců tří hlavních rodin (ERK, JNK a p38). Princip metody je podobný jako v předchozím v případě, s tou výjimkou, že pro odlišení fosforylovaných a nefosforylovaných forem kináz je použito specifických protilátek přímo proti fosforylovaným formám kináz konjugovaných s biotinem. Na biotin se následně naváže streptavidin konjugovaný s peroxidázou, jež aktivuje chemiluminiscenční substrát.
Zmražený vzorek tkáně byl rozdělen na dvě části a lyzáty pro obě analýzy byly připraveny dle pokynů výrobce, následně bylo použito 300 µg celkového proteinu pro každou z analýz. Míra fosforylace jednotlivých proteinů byla denzitometricky kvantifikována softwarem ImageJ, z duplikátů byl vypočítán průměr a od něj odečtena hodnota pozadí. Data byla normalizována vztažením k maximální hodnotě dosažené na každé z použitých membrán.
Fosforylace RTK byla výrazná především u receptoru pro epidermální růstový faktor (EGFR), inzulinového receptoru (InsR) a obou variant receptoru pro růstový faktor krevních destiček (platelet derived growth factor – PDGFRα a PRGFRβ) (graf 1A, C).
Graph 1. Profi l fosforylace receptorových tyrozinkináz (RTK), MAP kináz a vybraných cytoplazmatických proteinů ve vzorku hemangiomu odebraného pacientce s Maff ucciho syndromem. 
A. Denzitometrická analýza fosforylace RTK. B. Denzitometrická analýza fosforylace MAPK a vybraných cytoplazmatických proteinů. C. Proteinová array s označenými RTK, jež vykazují nejvyšší hodnotu denzity. D. Proteinová array s označenými MAPK a vybranými cytoplazmatickými proteiny, jež vykazují nejvyšší hodnotu denzity. V rámci analýzy fosforylace MAP kináz byla zaznamenána vysoká míra fosforylace ERK1 a ERK2 a částečně i kinázy p38γ. Dále byla aktivována kináza Akt 2, jež patří do rodiny nejvýznamnějších signálních molekul serin/ treoninových kináz Akt. Jedním z nejvíce fosforylovaných proteinů, jenž může být fosforylačním cílem v případě aktivace kináz rodiny p38 [8], byl HSP27 (graf 1B, D).
Diskuze
Maffucciho syndrom patří mezi velmi vzácná onemocnění a manifestuje se v 78 % před začátkem puberty [9]. Je charakterizován přítomností enchondromů, mnohočetných hemangiomů a vzácně také lymfangiomů. Standardní terapie neexistuje a výběr vhodné strategie může být velmi svízelný. Enchondromy vznikají nejčastěji v oblasti dlouhých kostí dolních končetin, nohy a ruky [9]. V případě, že omezují funkčnost končetiny, ovlivňují normální růst nebo působí bolest, je přistoupeno k chirurgickému řešení. Hemangiomy jsou benigní cévní tumory, které mohou vznikat prakticky kdekoliv v těle, v rámci tohoto onemocnění mohou postupně progredovat a výrazně omezovat kvalitu života postiženého jedince. V literatuře jsou popsány případy, u nichž bylo úspěšně využito antiangiogenní terapie k ovlivnění hemangiomů u těchto pacientů [5].
V případě této pacientky bylo těžké vybrat vhodnou léčebnou strategii, mimo jiné především z důvodu komorbidit a rozsahu jejího onemocnění. Bylo vyzkoušeno několik, dříve v literatuře popsaných, léčebných modalit, avšak výsledky léčby byly dosti nepřesvědčivé. V rámci snahy nalézt vhodný terapeutický cíl na úrovni proteinů, který by odrážel skutečnou aktivitu v patologických buňkách, byl vyšetřen profil fosforylace RTK a navazujících signálních drah. Tato diagnostická metoda se jeví jako slibný prostředek, který by mohl umožnit podávání cílené biologické léčby pacientům s prokázanou aktivací signální dráhy na úrovni proteinů. Tento postup by v konečném důsledku mohl zlepšit výsledky léčby, snížit množství komplikací a celkově snížit náklady na léčbu vlastního onemocnění, které mohou být při empirickém podávání takovýchto léků dosti vysoké.
Na základě výsledků naší analýzy byl do léčebného schématu přidán sunitinib v kombinaci s paclitaxelem. Sunitinib je multikinázový inhibitor, který cílí především proti receptoru pro růstový faktor krevních destiček (PDGFR) a proti receptoru pro cévní endoteliální růstový faktor (vascular endothelial growth factor – VEGFR), čímž ovlivňuje angiogenezi a buněčnou proliferaci. FDA (Food and Drug Administration – Úřad pro kontrolu léčiv) jej oficiálně schválila k léčbě GIST, renálního karcinomu a neuroendokrinních tumorů pankreatu, avšak pro silný antiangiogenní potenciál byl výhodný i pro naše účely. Paclitaxel je alkaloid, který blokuje depolymerizaci mikrotubulů dělícího vřeténka a je používán pro léčbu řady malignit. Při metronomickém dávkování a v kombinaci s dalšími léky prokázal významný antiangiogenní potenciál [10]. Prezentovaná kazuistika dokumentuje obtížnost péče o pacienty s Maffucciho syndromem, kdy interpretace klinického průběhu posledních týdnů a vysvětlení úmrtí pacientky zůstává spekulativní.
Závěr
Terapie vzácných onemocnění je nesnadná. Neexistují ověřené postupy a většina poznatků o takových stavech je známa pouze z kazuistik. Velké randomizované klinické studie fáze III zde nikdy nebudou k dispozici, přestože je systém registrací a úhrad zdravotních pojišťoven vyžaduje i v těchto případech. Vyšetření signálních drah aktivovaných RTK by mohlo do budoucna přispět k sestavování individualizované léčby tam, kde standardní léčba není známa anebo není dostatečně účinná, jako jsou vzácná, refrakterní nebo některá pokročilá nádorová onemocnění dětského věku. Vytváření a následná realizace personalizovaných léčebných postupů vyžadují komplexní, multioborovou spolupráci a pečlivé vyvažovaní rizik a event. přínosů takových postupů.
Práce byla podpořena Evropským fondem pro regionální rozvoj a státním rozpočtem České republiky OP VaVpI – RECAMO, CZ.1.05/2.1.00/03.0101, projektem CEB, OPVK CZ.1.07/2.3.00/20.0183 a projektem MUNI//A/1552/2014.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
MUDr. Kristýna Melichárková
Klinika dětské onkologie
LF MU a FN Brno
Černopolní 9
613 00 Brno
e-mail: kristyna.melicharkova@fnbrno.cz
Obdrženo: 18. 4. 2015
Přijato: 26. 6. 2015
Sources
1. Verdegaal SH, Bovee JV, Pansuriya TC et al. Incidence, predictive factors, and prognosis of chondrosarcoma in patients with Ollier disease and Maffucci syndrome: an international multicenter study of 161 patients. Oncologist 2011; 16(12): 1771 – 1779. doi: 10.1634/ theoncologist.2011 ‑ 0200.
2. Lissa F, Argente J, Antunes G et al. Maffucci syndrome and soft tissue sarcoma: a case report. Int Semin Surg Oncol 2009; 6(1): 2. doi: 10.1186/ 1477 ‑ 7800 ‑ 6 ‑ 2.
3. Lin PP, Moussallem CD, Deavers MT. Secondary chondrosarcoma. J Am Acad Orthop Surg 2010; 18(10): 608 – 615.
4. Park EA, Seo JW, Lee SW et al. Infantile hemangioendothelioma treated with high dose methylprednisolone pulse therapy. J Korean Med Sci 2001; 16(1): 127 – 129.
5. Riou S, Morelon E, Guibaud L et al. Efficacy of rapamycin for refractory hemangioendotheliomas in Maffucci’s syndrome. J Clin Oncol 2012; 30(23): e213 – e215. doi: 10.1200/ JCO.2012.41.7287.
6. Pasquier E, Street J, Pouchy C et al. β‑blockers increase response to chemotherapy via direct antitumour and anti‑angiogenic mechanisms in neuroblastoma. Br J Cancer 2013; 108(12): 2485 – 2494. doi: 10.1038/ bjc.2013.205.
7. Lewis RJ, Ketcham AS. Maffucci’s syndrome: functional and neoplastic significance. Case report and review of the literature. J Bone Joint Surg Am 1973; 55(7): 1465 – 1479.
8. Lemmon MA, Schlessinger J. Cell signaling by receptor tyrosine kinases. Cell 2010; 141(7): 1117 – 1134.
9. Dorion S, Landry J. Activation of the mitogen‑activated protein kinase pathways by heat shock. Cell Stress Chaperones 2002; 7(2): 200 – 206.
10. Pasquier E, Tuset MP, Street J et al. Concentration ‑ and schedule ‑ dependent effects of chemotherapy on the angiogenic potential and drug sensitivity of vascular endothelial cells. Angiogenesis 2013; 16(2): 373 – 386. doi: 10.1007/ s10456 ‑ 012 ‑ 9321 ‑ x.
Labels
Paediatric clinical oncology Surgery Clinical oncology
Article was published inClinical Oncology

2015 Issue Supplementum 2-
All articles in this issue
- Nádory u adolescentů
- Bioinformatika a sekvenování nové generace
- Co může přinést studium oligomerizace proteinů v procesu onkogeneze?
- Analýza změn fosfoproteomu nádorové buněčné linie MDA‑ MB‑ 468 v odpovědi na expresi izoforem p63 pomocí hmotnostní spektrometrie
- „Cukry zasahují“ aneb glykomika na poli nádorových biomarkerů
- Nrf2 – dve tváre regulátora antioxidačného systému
- Polo‑like kináza 1 jako cíl protinádorové terapie
- PDLIM2 a jeho role v onkogenezi – tumor supresor nebo onkoprotein?
- Profil aktivace receptorových tyrozinkináz a mitogenem aktivovaných proteinkináz v terapii Maffucciho syndromu
- Rekombinantní protilátky a jejich využití v protinádorové terapii
- Imunologické aspekty v onkologii – cirkulující γδ T lymfocyty
- Cirkulující nádorová DNA v krvi a její využití jako potenciálního biomarkeru nádorových onemocnění
- Adenovírusové vektory v génovej terapii
- Clinical Oncology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Adenovírusové vektory v génovej terapii
- Nrf2 – dve tváre regulátora antioxidačného systému
- Rekombinantní protilátky a jejich využití v protinádorové terapii
- Co může přinést studium oligomerizace proteinů v procesu onkogeneze?
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

