-
Medical journals
- Career
Subependymální obrovskobuněčný astrocytom u pacientů s tuberózní sklerózou – farmakologická léčba mTOR inhibitory
: K. Zitterbart
: Klinika dětské onkologie LF MU a FN BrnoÚstav experimentální biologie, PřF MU, BrnoRegionální centrum aplikované molekulární onkologie, Masarykův onkologický ústav, Brno
: Klin Onkol 2014; 27(6): 401-405
: Review
prolekare.web.journal.doi_sk: https://doi.org/10.14735/amko2014401Tuberózní skleróza je neurokutánní syndrom vznikající na podkladě zárodečné mutace genu TSC1 nebo TSC2. Patologická aktivace proteinového komplexu mTORC1 má u pacientů s tuberózní sklerózou klíčovou úlohu v tumorigenezi subependymálního obrovskobuněčného astrocytomu. Blokáda deregulované signální dráhy užitím mTOR inhibitorů má potenciál vést ke zmenšení objemu tohoto nádoru mozku o nízkém stupni malignity. V přehledném článku jsou shrnuty současné poznatky o farmakologické léčbě subependymálního obrovskobuněčného astrocytomu. Dlouhodobé sledování a včasná léčebná opatření snižují morbiditu a mortalitu a zlepšují kvalitu života pacientů s nádory spjatými s tuberózní sklerózou.
Klíčová slova:
subependymální obrovskobuněčný astrocytom − komplex tuberózní sklerózy – mTOR – everolimus
Tuberózní skleróza (tuberous sclerosis complex – TSC) je onemocnění ze skupiny neurokutánních syndromů (dříve fakomatóz), geneticky podmíněných systémových chorob postihujících typicky nervový systém a kůži. Tuberózní skleróza vzniká na podkladě zárodečné mutace genů TSC1 nebo TSC2, odhadovaný výskyt TSC je přibližně 1 : 6 000 narozených dětí [1 – 7]. Pro TSC je charakteristický nález hamartogenních a benigních nádorových lézí v centrální nervové soustavě a dalších orgánových systémech. Klinické obtíže i míra jejich závažnosti je u jednotlivých pacientů s TSC velmi různorodá. Dnes platná diagnostická kritéria TSC (11 „velkých“ a 6 „malých“ znaků) byla revidována v roce 2012 [3]. Pro klinickou praxi je důležitý vývojový pohled, neboť jednotlivé orgánové manifestace TSC jsou věkově podmíněné, s typickým vzorcem nástupu obtíží v průběhu dětství, dospívání a dospělosti [3 – 7]. Rabdomyomy srdce mohou být nalezeny již při screeningovém ultrazvukovém vyšetření srdce plodu, nalezneme je přibližně u dvou třetin všech případů tuberózní sklerózy [5,8]. Postižení kůže je v průběhu života patrno téměř u všech nemocných, do obrazu TSC patří depigmentace (hypomelanotické makuly), typické kožní morfy v obličeji (angiofibromy, adenoma sebaceum Pringle), unguální fibromy, névy z pojivové tkáně a další [2,6]. Neurologické projevy mohou být u TSC dominující symptomatologií – u mnoha případů TSC jsou prvním projevem nemoci epileptické paroxysmy, typicky se objevují již v průběhu prvního roku života dítěte (infantilní spazmy, parciální paroxysmy, atypické absence). Vedle těchto projevů jsou u jedinců s TSC přítomny často neuropsychiatrické poruchy (postižení intelektu, poruchy autistického spektra, porucha pozornosti s hyperaktivitou, depresivní a úzkostná porucha a další) [9,10]. Postižení ledvin je během života přítomno až u 85 % všech osob s TSC a zahrnuje jak výskyt angiomyolipomů ledvin mezenchymálního původu, tak rovněž epiteliální patologii (epiteliální cysty, onkocytomy, renální karcinomy) [2,11 – 13]. Renální postižení souvisí s řadou předčasných úmrtí pacientů s TSC, proaktivní přístup vedoucí k ochraně reziduální funkce zdravého ledvinného parenchymu vede k oddálení případného rozvoje chronické renální insuficience a terminálního selhání ledvin (profylaktická/ preemptivní embolizace cestou a. renalis, především při průkazu významných aneuryzmat) [14 – 16]. Lymfangioleiomyomatóza plic je primární plicní projev TSC, vyskytuje se téměř výhradně u žen. Až 40 % premenopauzálních žen s TSC má rentgenologické změny na plicích, ale jen u 5 % z nich jde o změny klinicky významné. V nejtěžších případech dochází ke kritické respirační nedostatečnosti vyžadující transplantaci plic. Pro angiomyolipomy ledvin, stejně jako pro lymfangioleiomyomatózu plic je slibnou léčebnou možností mTOR inhibice [11,12,17]. U některých případů TSC byly popsány další vzácné klinické nádorové manifestace, např. chordomy [18].
Subependymální obrovskobuněčný astrocytom
Subependymální obrovskobuněčný astrocytom (subependymal giant cell astrocytoma – SEGA) je nádor mozku nízkého stupně malignity (stupeň 1) spjatý s TSC. Jde o benigní nádor, přestože v mikroskopickém obraze mohou být u některých případů přítomny vaskulární proliferace, nekrózy a mitotické figury [2,19,20]. Typická je intraventrikulární lokalizace SEGA v postranních a třetí mozkové komoře, nejčastěji při foramen Monroi. SEGA se v průběhu života vyskytne až u 20 % jedinců s TSC. Růst nádoru je typický pro první dvě dekády života pacientů s TSC, vede ke vzniku obstrukčního hydrocefalu a podmiňuje klinický obraz intrakraniální hypertenze. Postižení SEGA může být i vícečetné či bilaterální [2,19 – 22]. Subependymální noduly (SEN) jsou zcela obvyklým nálezem při zobrazovacím vyšetření mozku u pacientů s TSC, jsou přítomny v 80 – 90 % všech případů. SEN však nejsou na rozdíl od SEGA spojovány s klinickými obtížemi [22]. V odlišení SEN od SEGA doposud existují jisté kontroverze. Současný pohled na problematiku shrnují závěry konsenzuální konference z roku 2012 – pomocí zobrazovacích metod nelze spolehlivě odlišit, které ze SEN mají potenciál dalšího růstu v SEGA, rovněž histopatologický obraz SEN i SEGA je považován za shodný, byť SEN jsou pravděpodobně pouze raritně operovány. Za hlavní kritérium odlišující SEN od SEGA je proto pokládána velikostní progrese při zobrazování magnetickou rezonancí (MRI). SEGA je tedy lézí v růstové progresi, typicky v lokalizaci kaudothalamické rýhy, většinou s postkontrastním sycením při MRI, o velikosti větší než 5 – 10 mm [22].
Management SEGA
V rámci komplexního sledování pacientů s TSC je doporučeno provádět MRI vyšetření mozku v časových odstupech 1 – 3 let, a to od dětského věku až do třetí dekády života [2,4,9,21 – 22]. Typickým věkem, kdy rostoucí SEGA vyvolá klinické obtíže vyžadující léčebný zásah, je druhá dekáda [21 – 23]. Případy symptomatického SEGA jsou však popsány i u dětí mladších tří let [9]. U klinicky bezpříznakového pacienta a při stabilní velikosti subependymální patologie na MRI lze u jedinců starších 25 let zvažovat prodlužování časových intervalů MRI zobrazení. Naopak jakékoliv nové obtíže pacienta, které by mohly být podmíněny syndromem intrakraniální hypertenze, vyžadují akutní klinické a zobrazovací vyšetření s cílem vyloučit rostoucí SEGA [22].
Chirurgický resekční výkon je považován u benigních intrakraniálních nádorů za jedinou efektivní léčebnou možnost, zvláště přihlédneme‑li k tomu, že u nádorových predispozičních syndromů, včetně případů TSC, mohou radioterapie a chemoterapie signifikantně zvyšovat riziko sekundárních malignit [24]. I přes rozvoj neurochirurgických technik (transkalózní přístup, neuroendoskopické techniky aj.) není ve všech případech radikální chirurgická resekce SEGA možná, a to především u rozsáhlých, bilaterálních či vícečetných lézí, u nichž existuje významné riziko pooperačního neurologického deficitu [22,23,25]. Z chirurgického řešení SEGA profitují pacienti, u nichž je dosaženo primárního cíle bezpečné radikální resekce, což jsou pacienti s jednoznačně rostoucí unilaterální lézí při foramen Monroi [23,25]. Recentní metaanalýza chirurgických výsledků léčby SEGA však ukazuje, že časný i pozdní pooperační stav je jednoznačně spjat se zhoršenou kvalitou života (statisticky signifikantní zhoršení některých symptomů jako epilepsie, bolesti hlavy, poruchy vizu, poruchy autistického spektra a překvapivě i rekurence hydrocefalu) [26].
Farmakologická léčba SEGA mTOR inhibitorem (everolimus), jak bude diskutováno níže, může být alternativou chirurgické léčby a vést k signifikantnímu zmenšení SEGA, což dokumentují výsledky dvou recentních prospektivních studií [27,28].
mTORC1 jako terapeutický cíl u nádorů spojených s TSC
mTOR (mammalian target of rapamycin) je proteinová kináza, která je hlavní složkou proteinového komplexu označovaného jako mTORC1. Buněčné signály integrující se prostřednictvím mTORC1 vedou fyziologicky k aktivaci anabolických drah, tedy k syntéze lipidů, proteinů a nukleových kyselin, a kontrole buněčného růstu a proliferace [29]. Mutace genů TSC1 nebo TSC2 u TSC je podkladem disrupce komplexu TSC1 – TSC2 (tuberin‑hamartin) a ve svém důsledku hyperaktivity mTORC1. mTORC1 je farmakologicky ovlivnitelný molekulární terč [29 – 32]. Sirolimus (rapamycin) je prototypem mTOR inhibitorů souhrnně označovaných jako rapaloga, která vedou k disociaci mTORC1, a tím inhibici mTOR signální dráhy. Dalšími rapalogy jsou everolimus (RAD001) a temsirolimus (CCI ‑ 779). Sirolimus byl izolován z půdní bakterie Streptomyces hygroscopicus na ostrově Rapa Nui východní části Polynésie v roce 1975 a byl původně zkoumán jako účinné antimykotikum. Posléze byl odhalen jeho významný antiproliferační a imunosupresivní efekt a rapaloga se dnes užívají v transplantační medicíně. Jde o relativně lipofilní molekuly. Zvířecí modely naznačují, že v případě everolimu může docházet k lepší penetraci léčiva přes hematoencefalickou bariéru ve srovnání se sirolimem [29,31]. První desetiletí nového tisíciletí je érou výzkumu mTOR signální dráhy v patofyziologii orgánového postižení spjatého s TSC, včetně nádorového růstu. Preklinický a následně klinický výzkum potvrdily, že mTOR inhibice může vést k léčebné odpovědi u nádorů spjatých s TSC a rapaloga jsou účinná u pacientů se SEGA, angiomyolipomy ledvin, lymfangioleiomyomatózou plic i kožními angiofibromy [12,29,33 – 35].
Farmakologická léčba SEGA
První klinická pozorování o účinnosti sirolimu u SEGA dokumentovali Franz et al v roce 2006 – u všech čtyř pacientů léčených mTOR inhibitorem došlo k redukci objemu rostoucího SEGA [33]. První obdobná pediatrická zkušenost byla popsána kanadskými autory v roce 2010 na souboru tří dětských pacientů s TSC ve věku 9, 10 a 13 let, u nichž tříměsíční léčba sirolimem vedla k redukci objemu rostoucího SEGA o 50 – 65 % [34]. Ve stejném roce jsou publikovány výsledky první prospektivní studie, v níž byl k mTOR inhibici v léčbě SEGA užit everolimus (open ‑ label fáze I/ II s označením C2485, NCT00411619). Léčba vedla v této studii u pacientů s TSC a SEGA v růstové fázi ke klinicky významnému zmenšení objemu SEGA a zlepšení kvality života nemocných. Medián věku pacientů byl 11 let (3 – 34 let, n = 28), cílová koncentrace everolimu 5 – 15 µg/ l, 6měsíční léčba vedla u 75 % nemocných k redukci objemu SEGA o více než 30 % [27]. V letošním roce byly publikovány dlouhodobé výsledky – po čtyřech letech trvání studie C2485 byla léčebná odpověď (redukce objemu SEGA o více než 50 %) pozorována u 78 % pacientů [36]. Účinnost a bezpečnost everolimu k léčbě SEGA byla jednoznačně potvrzena v prospektivní mezinárodní multicentrické, placebem kontrolované studii fáze III (studie EXIST‑1, NCT00789828), která zařadila 117 pacientů. Do ramene s everolimem bylo randomizováno 78 nemocných, léčebná odpověď (nejméně 50% zmenšení objemu SEGA ve třech měsících léčby) byla pozorována u 35 % pacientů v experimentálním a u žádného v kontrolním rameni [28]. I zde dlouhodobé výsledky ukazují nárůst léčebných odpovědí s délkou trvání studie (response rate 49 % v 29. měsíci léčby everolimem) [37]. Na základě výše uvedených dat získal everolimus registraci k léčbě SEGA jak v USA, tak v Evropě (v letech 2010, resp. 2011) a je dle SPC indikován k léčbě pacientů se SEGA spojeným TSC, kteří vyžadují terapeutický zásah, ale nejsou vhodní k chirurgickému zákroku (obr. 1) [38]. Akutní nežádoucí účinky léčby everolimem u SEGA jsou dobře zvladatelné, převažují toxicity stupně 1 – 2, velmi časté jsou především stomatitida a infekce horního dýchacího traktu [27,28]. Mukoadhezivní pasta s dexamethazonem či triamcinolonem je v případě stomatitidy indukované mTOR inhibitorem velmi efektivním léčebným opatřením [39]. Mezi další časté pozorované nežádoucí účinky léčby everolimem patří porucha metabolizmu lipidů (hypertriglyceridemie a hypercholesterolemie), zvladatelná mnohdy samotnými režimovými opatřeními, případně farmakologickou intervencí hypolipidemiky [39,40]. Nejasný je dlouhodobý dopad sekundární amenorey pozorovaný u části žen užívajících mTOR inhibitor, stejně tak vliv mTOR inhibice na fertilitu mužů není jednoznačně určen a je doporučeno před zahájením léčby zvážit zamražení spermatu [41]. Optimální doba léčby nebyla doposud stanovena a je předmětem četných diskuzí na mezinárodních setkáních, konsenzu zatím nebylo dosaženo. Jsou pozorovány případy, kdy po vysazení dlouhodobé léčby mTOR inhibitorem došlo k opětovnému nárůstu velikosti SEGA [33]. Lze shrnout, že u pacientů se SEGA léčených mTOR inhibitorem je nutný dlouhodobý monitoring terapeutických hladin léku, akutní a pozdní toxicity léčby a léčebné odpovědi, s cílem vybalancovat efektivní dávku léčiva při akceptovatelných nežádoucích účincích a dobré kvalitě života nemocného [21,22,42].
1. Zmenšení velikosti SEGA u 15letého pacienta s bilaterálním postižením, léčeného everolimem. 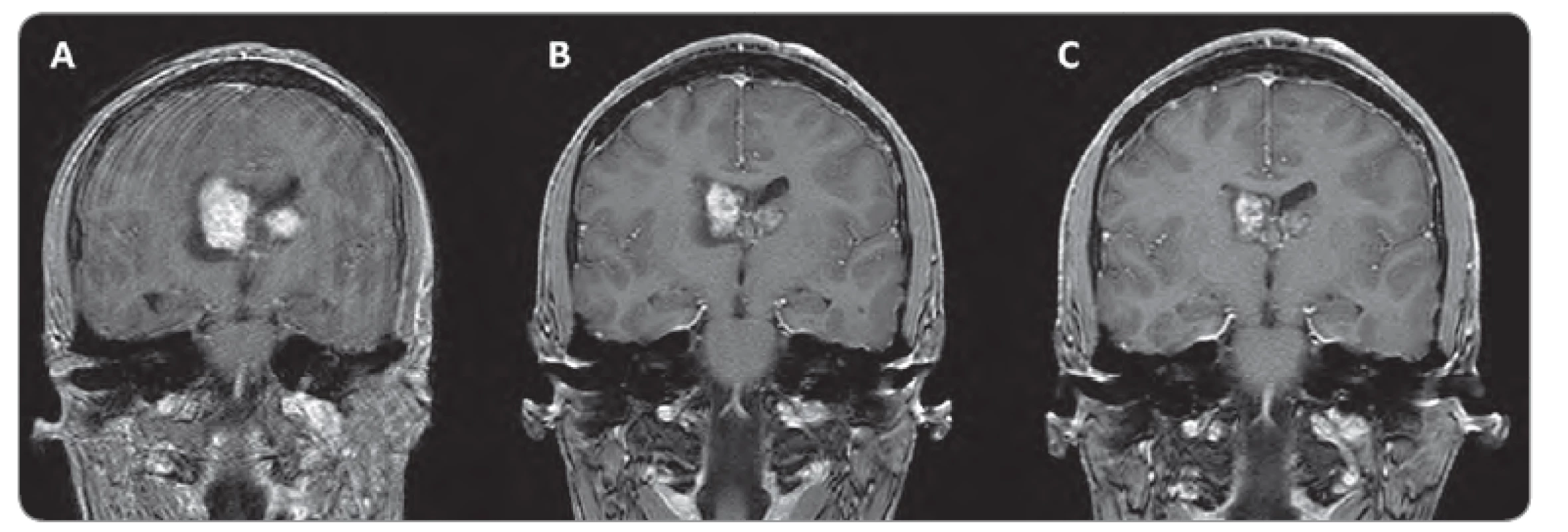
A. stav před léčbou; B, C: stav po 3 a 16 měsících léčby (zdroj: archiv autora, zobrazovací dokumentace: MUDr. Miloš Keřkovský, Ph.D., Radiologická klinika FN Brno). Závěr
Až pětina pacientů s TSC vyžaduje během svého života, typicky ve druhé dekádě, léčebný zásah pro rostoucí a/ nebo již symptomatický SEGA. Rizika radikálního resekčního chirurgického výkonu často přesahují očekávaný přínos operace. V těchto případech bychom měli jednoznačně zvažovat léčbu mTOR inhibitorem (everolimus), což dle publikovaných prospektivních studií vede k signifikantní redukci velikosti SEGA a je efektivním způsobem kontroly onemocnění. Dlouhodobé sledování pacientů se SEGA léčených mTOR inhibitorem přinese odpovědi na otázky chronické toxicity a nákladové efektivity léčby.
Práce byla podpořena Evropským fondem pro regionální rozvoj a státním rozpočtem České republiky: projekt RECAMO CZ.1.05/2.1.00//03.0101 a projekt CEB CZ.1.07/2.3.00/20.0183.
V souvislosti s tématem článku obdržel autor v minulém roce honorarium za přednáškovou činnost od firmy Novartis.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
MUDr. Karel Zitterbart, Ph.D.
Klinika dětské onkologie
LF MU a FN Brno
Černopolní 9
613 00 Brno
e-mail: kzitter@med.muni.cz
Obdrženo: 18. 11. 2014
Přijato: 20. 11. 2014
Sources
1. Lagos JC, Gomez MR. Tuberous sclerosis: reappraisal of a clinical entity. Mayo Clin Proc 1967; 42(1):26 – 49.
2. Kwiatkowski DJ, Whittemore VH, Thiele EA (ed.). Tuberous sclerosis complex: genes, clinical features and therapeutics. Weinheim: Wiley ‑ VCH 2010.
3. Northrup H, Krueger DA, International Tuberous Sclerosis Complex Consensus Group. Tuberous sclerosis complex diagnostic criteria update: recommendations of the 2012 International Tuberous Sclerosis Complex Consensus Conference. Pediatr Neurol 2013; 49(4): 243 – 254. doi: 10.1016/ j.pediatrneurol.2013.08.001.
4. Vrtěl R, Filipová H, Vodička R et al. Tuberózní skleróza. Klin Onkol 2009; 22 (Suppl): S50 – S53.
5. Petrák B, Gabera A, Filipová H et al. Tuberózní skleróza u dětí sledovaných od novorozeneckého věku pro prenatální nález rhabdomyomů srdce – dvě kazuistiky. Cesk Slov Neurol N 2013; 76/ 109(6): 763 – 768.
6. Doležel Z, Ráčilová Z, Pavlovská D et al. Tuberózní skleróza. Pediatr Prax 2012; 13 : 130.
7. Zitterbart K. mTOR inhibice: nové možnosti farmakologické léčby nádorů u pacientů s tuberózní sklerózou. Postgrad Med 2014; 16 : 880 – 886.
8. Gusman M, Servaes S, Feygin T et al. Multimodal imaging in the prenatal diagnosis of tuberous sclerosis complex. Case Rep Pediatr 2012; 2012 : 925646. doi: 10.1155/ 2012/ 925646.
9. Kotulska K, Chmielewski D, Borkowska J et al. Long‑term effect of everolimus on epilepsy and growth in children under 3 years of age treated for subependymal giant cell astrocytoma associated with tuberous sclerosis complex. Eur J Paediatr Neurol 2013; 17(5): 479 – 485. doi: 10.1016/ j.ejpn.2013.03.002.
10. Hallett L, Foster T, Liu Z et al. Burden of disease and unmet needs in tuberous sclerosis complex with neurological manifestations: systematic review. Curr Med Res Opin 2011; 27(8): 1571 – 1583. doi: 10.1185/ 03007995. 2011.586687.
11. Bissler JJ, Kingswood JC, Radzikowska E et al. Everolimus for angiomyolipoma associated with tuberous sclerosis complex or sporadic lymphangioleiomyomatosis (EXIST‑2): a multicentre, randomised, double‑blind, placebo ‑ controlled trial. Lancet 2013; 381(9869): 817 – 824.
12. Bissler JJ, McCormack FX, Young LR et al. Sirolimus for angiomyolipoma in tuberous sclerosis complex or lymphangioleiomyomatosis. N Engl J Med 2008; 358(2): 140 – 151. doi: 10.1056/ NEJMoa063564.
13. Ürge T, Hora M, Hes O et al. Renální angiomyolipom, histologie, diagnostika a terapie. Urol Prax 2005; 6 : 270 – 272.
14. Webb DW, Kabala J, Osborne JP. A population study of renal disease in patients with tuberous sclerosis. Br J Urol 1994; 74(2): 151 – 154.
15. Schillinger F, Montagnac R. Chronic renal failure and its treatment in tuberous sclerosis. Nephrol Dial Transplant 1996; 11(3): 481 – 485.
16. Chatziioannou A, Gargas D, Malagari K et al. Transcatheter arterial embolization as therapy of renal angiomyolipomas: the evolution in 15 years of experience. Eur J Radiol 2012; 81(9): 2308 – 2312. doi: 10.1016/ j.ejrad.2011.06.003.
17. McCormack FX, Travis WD et al. Lymphangioleiomyomatosis: calling it what it is: a low ‑ grade, destructive, metastasizing neoplasm. Am J Respir Crit Care Med 2012; 186(12): 1210 – 1212. doi: 10.1164/ rccm.201205 ‑ 0848OE.
18. McMaster ML, Goldstein AM, Parry DM. Clinical features distinguish childhood chordoma associated with tuberous sclerosis complex (TSC) from chordoma in the general paediatric population. J Med Genet 2011; 48(7): 444 – 449. doi: 10.1136/ jmg.2010.085092.
19. Chan JA, Zhang H, Roberts PS et al. Pathogenesis of tuberous sclerosis subependymal giant cell astrocytomas: biallelic inactivation of TSC1 or TSC2 leads to mTOR activation. J Neuropathol Exp Neurol 2004; 63(12): 1236 – 1242.
20. Svajdler M Jr, Deák L, Rychlý B et al. Subependymal giant cell astrocytoma with atypical clinical and pathological features: a diagnostic pitfall. Cesk Patol 2013; 49(2): 76 – 79.
21. Jóźwiak S, Nabbout R, Curatolo P. Management of subependymal giant cell astrocytoma (SEGA) associated with tuberous sclerosis complex (TSC): clinical recommendations. Eur J Paediatr Neurol 2013; 17(4): 348 – 352. doi: 10.1016/ j.ejpn.2012.12.008.
22. Roth J, Roach ES, Bartels U et al. Subependymal giant cell astrocytoma: diagnosis, screening, and treatment. Recommendations from the International Tuberous Sclerosis Complex Consensus Conference 2012. Pediatr Neurol 2013; 49(6): 439 – 444. doi: 10.1016/ j.pediatrneurol.2013.08.017.
23. Harter DH, Bassani L, Rodgers SD et al. A management strategy for intraventricular subependymal giant cell astrocytomas in tuberous sclerosis complex. J Neurosurg Pediatr 2014; 13(1): 21 – 28. doi: 10.3171/ 2013.9.PEDS13193.
24. Matsumura H, Takimoto H, Shimada N et al. Glioblastoma following radiotherapy in a patient with tuberous sclerosis. Neurol Med Chir (Tokyo) 1998; 38(5): 287 – 291.
25. de Ribaupierre S, Dorfmüller G, Bulteau C et al. Subependymal giant ‑ cell astrocytomas in pediatric tuberous sclerosis disease: when should we operate? Neurosurgery 2007; 60(1): 83 – 89.
26. Sun P, Krueger D, Liu J et al. Surgical resection of subependymal giant cell astrocytomas (SEGAs) and changes in SEGA‑related conditions: a US national claims database study. Curr Med Res Opin 2012; 28(4): 651 – 666. doi: 10.1185/ 03007995.2012.658908.
27. Krueger DA, Care MM, Holland K et al. Everolimus for subependymal giant ‑ cell astrocytomas in tuberous sclerosis. N Engl J Med 2010; 363(19): 1801 – 1811. doi: 10.1056/ NEJMoa1001671.
28. Franz DN, Belousova E, Sparagana S et al. Efficacy and safety of everolimus for subependymal giant cell astrocytomas associated with tuberous sclerosis complex (EXIST‑1): a multicentre, randomised, placebo ‑ controlled phase 3 trial. Lancet 2013; 381(9861): 125 – 132. doi: 10.1016/ S0140 ‑ 6736(12)61134 ‑ 9.
29. Franz DN. Everolimus: an mTOR inhibitor for the treatment of tuberous sclerosis. Expert Rev Anticancer Ther 2011; 11(8): 1181 – 1192. doi: 10.1586/ era.11.93.
30. Howell JJ, Ricoult SJ, Ben ‑ Sahra I et al. A growing role for mTOR in promoting anabolic metabolism. Biochem Soc Trans 2013; 41(4): 906 – 912. doi: 10.1042/ BST20130041.
31. Serkova N, Jacobsen W, Niemann CU et al. Sirolimus, but not the structurally related RAD (everolimus), enhances the negative effects of cyclosporine on mitochondrial metabolism in the rat brain. Br J Pharmacol 2001; 133(6): 875 – 885.
32. Študentová H, Melichar B. Nový mechanizmus v léčbě karcinomu ledviny: m ‑ TOR – nová cílová struktura. Onkologie 2010; 4(3): 185 – 188.
33. Franz DN, Leonard J, Tudor C et al. Rapamycin causes regression of astrocytomas in tuberous sclerosis complex. Ann Neurol 2006; 59(3): 490 – 498.
34. Lam C, Bouffet E, Tabori U et al. Rapamycin (sirolimus) in tuberous sclerosis associated pediatric central nervous system tumors. Pediatr Blood Cancer 2010; 54(3): 476 – 479. doi: 10.1002/ pbc.22298.
35. Campen CJ, Porter BE. Subependymal giant cell astrocytoma (SEGA) treatment update. Curr Treat Options Neurol 2011; 13(4): 380 – 385. doi: 10.1007/ s11940 ‑ 011 ‑ 0123 ‑ z.
36. Franz DN. 11th European Congress on Epileptology; June 29 – July 3, 2014; Stockholm, Sweden.
37. Franz DN. 13th International Child Neurology Congress; May 2014, Brazil.
38. European Medicines Agency [homepage on the Internet]. Available from: http:/ / www.ema.europa.eu/ docs/ en_GB/ document_library/ EPAR_ – _Product_Information/ human/ 002311/ WC500112238.pdf.
39. Grünwald V, Weikert S, Pavel ME et al. Practical management of everolimus‑related toxicities in patients with advanced solid tumors. Onkologie 2013; 36 : 295 – 302.
40. Peterson ME. Management of adverse events in patients with hormonereceptor ‑ positive breast cancer treated with everolimus: observations from a phase III clinical trial. Support Care Cancer 2013; 21(8): 2341 – 2349. doi: 10.1007/ s00520 ‑ 013 ‑ 1826 ‑ 3.
41. Boobes Y, Bernieh B, Saadi H et al. Gonadal dysfunction and infertility in kidney transplant patients receiving sirolimus. Int Urol Nephrol 2010; 42(2): 493 – 498. doi: 10.1007/ s11255 ‑ 009 ‑ 9644 ‑ 8.
42. Wheless JW, Klimo P Jr. Subependymal giant cell astrocytomas in patients with tuberous sclerosis complex: considerations for surgical or pharmacotherapeutic intervention. J Child Neurol 2014; 29(11): 1562 – 1571. doi: 10.1177/ 0883073813501870.
Labels
Paediatric clinical oncology Surgery Clinical oncology
Article was published inClinical Oncology

2014 Issue 6-
All articles in this issue
- Adverse Effects of Modern Treatment of Malignant Melanoma and their Treatment/ Management
- Subependymal Giant Cell Astrocytoma Associated with Tuberous Sclerosis Complex – Pharmacological Treatment using mTOR Inhibitors
- Treatment and Prognosis of Relapsed or Refractory Hodgkin Lymphoma Patients Ineligible for Stem Cell Transplantation
- Squamous Cell Carcinoma in Localized Scleroderma
- Cancer Incidence and Mortality in the Czech Republic
- The First Slovak Experience with Second‑line Vinflunine in Advanced Urothelial Carcinomas
- Multiple Metachronous Malignant Fibrous Histiocytomas of the Upper Limbs – a Case Report
- Clinical Oncology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Adverse Effects of Modern Treatment of Malignant Melanoma and their Treatment/ Management
- Cancer Incidence and Mortality in the Czech Republic
- Subependymal Giant Cell Astrocytoma Associated with Tuberous Sclerosis Complex – Pharmacological Treatment using mTOR Inhibitors
- Squamous Cell Carcinoma in Localized Scleroderma
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

