-
Medical journals
- Career
Kazuistika pacienta se značně pokročilým a diseminovaným karcinomem žaludku léčeným preparátem S-1
: J. Katolická 1; S. Rotnáglová 1; J. Vaníček 2
: Onkologicko‑chirurgické oddělení, FN u sv. Anny v Brně 1; Klinika zobrazovacích metod LF MU a FN u sv. Anny v Brně 2
: Klin Onkol 2014; 27(3): 207-209
: Case Report
Východiska:
Prognóza pacientů s metastatickým karcinomem žaludku je velmi nepříznivá a řádově se pohybuje v měsících života. S-1 je perorální fluoropyrimidinový protinádorový přípravek. Jde o fixní kombinaci tří účinných látek – tegafuru, gimeracilu a oteracilu draselného.Popis případu:
Prezentujeme případ 71letého muže léčeného pro lokálně značně pokročilý a současně metastatický karcinom žaludku v první linii pomocí kombinovaného režimu S-1 a cisplatiny. Léčebná odpověď dosáhla parciální remise a trvala šest měsíců. Vlastní léčba byla velmi dobře tolerována, bez toxicity stupně 3 a 4 (grade 3 a 4). Po progresi tak pacient mohl podstoupit další linii protinádorové léčby.Závěr:
Zkušenosti s přípravkem S-1 jsou v populaci českých pacientů dosud velmi limitované. Naše kazuistika poukazuje na dobrou léčebnou odpověď a minimální toxicitu zvolené léčby a je tak v souladu s výsledky studie FLAGS.Klíčová slova:
kazuistika – metastatický karcinom žaludku – chemoterapie – S-1 – cisplatinaÚvod
S-1 (Teysuno®) je perorální fluoropyrimidinový protinádorový přípravek. Jde o fixní kombinaci tří účinných látek – tegafuru (proléčivo), který je po absorpci konvertován na protinádorovou látku 5-fluorouracil (5-FU), gimeracilu, inhibitoru dihydropyrimidindehydrogenázy (DPD), určeného k prevenci degradace 5-FU v těle, a oteracilu draselného, inhibitoru orotátfosforibosyltransferázy (OPRT), který snižuje účinnost 5-FU v normální gastrointestinální sliznici [1].
Karcinom žaludku je u více než 50 % nemocných diagnostikován ve stadiu metastatického onemocnění. Příčinou pozdní diagnostiky jsou často nespecifické příznaky onemocnění. Radikální chirurgická léčba je jedinou kurativní metodou pro časné onemocnění. Podle lokalizace, rozsahu a histologie nádoru je volena parciální nebo totální gastrektomie s lymfadenektomií. V léčbě lokálně pokročilých nádorů žaludku byl prokázán přínos perioperační chemoterapie, kdy jejím podáním bylo dosaženo regrese nádoru bez zvýšení pooperačních komplikací. Perioperační chemoterapií bylo dosaženo signifikantně delšího přežití. Prognóza pacientů s metastatickým karcinomem žaludku se řádově pohybuje v měsících života [2].
Benefit paliativní protinádorové léčby proti symptomatické léčbě byl prokázán několika randomizovanými studiemi. Paliativní chemoterapie prodlužuje medián celkového přežití (overall survival – OS) na 7 – 10 měsíců. Přínosná je jen pro pacienty v dobrém výkonnostním stavu. K nejvíce používaným režimům patří kombinace cisplatiny a 5-FU. Fluoropyrimidiny v injekční nebo tabletové formě jsou nejčastěji předepisovanými cytostatiky pro léčbu metastatického karcinomu žaludku [3]. Režimy s oxaliplatinou a kapecitabinem mají jednodušší aplikaci a jsou velmi vhodné pro ambulantní podání. Požíváním tripeltů, zejména přidáním taxanu nebo antracyklinu k cisplatině a 5-FU dochází k navýšení nežádoucích účinků. Docetaxel v kombinaci s cisplatinou a 5-FU mírně zvyšuje OS (9,2 vs 8,6 měsíce; p = 0,020), ale za cenu významného vzestupu toxicity léčby [4].
Data z multicentrické mezinárodní, mimo Asii probíhající, randomizované kontrolované nezaslepené klinické studie fáze III FLAGS (Fluorouracil in advanced gastric or gastroesophageal adenocarcinoma study), podporují použití přípravku S ‑ 1 v kombinaci s cisplatinou k léčbě pacientů s pokročilým karcinomem žaludku. V této studii bylo 521 pacientů randomizováno k léčbě přípravkem S ‑ 1 25 mg/ m2 perorálně 2krát denně po dobu 21 dnů následované 7denním obdobím bez léčby a cisplatinou 75 mg/ m2 jako intravenózní infuze 1krát za 4 týdny a 508 pacientů bylo randomizováno k léčbě 5 - FU 1 000 mg/ m2/ 24 hodin jako kontinuální intravenózní infuze ve dnech 1 – 5 opakovaných každé 4 týdny a cisplatina 100 mg/ m2 jako intravenózní infuze v den 1 opakovaná každé 4 týdny. Primárním cílem studie FLAGS bylo hodnocení OS. S ‑ 1 v kombinaci s cisplatinou neprokázalo inferioritu proti 5 - FU v kombinaci s cisplatinou. Léčba S ‑ 1 a cisplatinou měla také signifikantně lepší bezpečnostní profil. V následné subanalýze tato kombinace statisticky signifikantně prodloužila OS u nemocných s difuzním typem karcinomu [1].
Popis případu
Představujeme kazuistiku 71letého muže, který byl vyšetřován pro bolest v epigastriu. Váhový úbytek negoval, měl dobrou chuť k jídlu. Matka nemocného zemřela v 86 letech stářím, otec na infarkt myokardu v 72 letech. Pacient je léčen asi dva roky pro hyperurikemii. Z operačních výkonů byla před 20 lety provedena operace menisku vpravo. Je nekuřák. Občas pije pivo, tvrdý alkohol a víno nepožívá. Alergie neguje. Na ambulanci gastroenterologie v místě bydliště byla v březnu 2013 provedena gastrofibroskopie, která makroskopicky verifikuje rozsáhlou kontaktně krvácející navalitou sliznici v oblasti fundu a malé kurvatury. Následné histologické vyšetření potvrzuje středně až nízce diferencovaný adenokarcinom žaludku. Vyšetření na HER2 pozitivitu provedeno nebylo. Sérové hladiny nádorových markerů zvýšené nebyly. CT vyšetření břicha a malé pánve popisuje nepravidelně zesílenou stěnu žaludku v oblasti fundu a malé kurvatury, stěna je šíře až 22 mm, v oblasti malé kurvatury je stěna výrazně dekonturovaná, nepravidelně prominuje do okolí mediálně a kaudálně. V okolí zvětšené lymfatické uzliny velikosti 15 mm, v játrech jsou vícečetná metastatická ložiska (obr. 1).
1. CT břicha a malé pánve, ložiska jaterní před zahájením léčby. 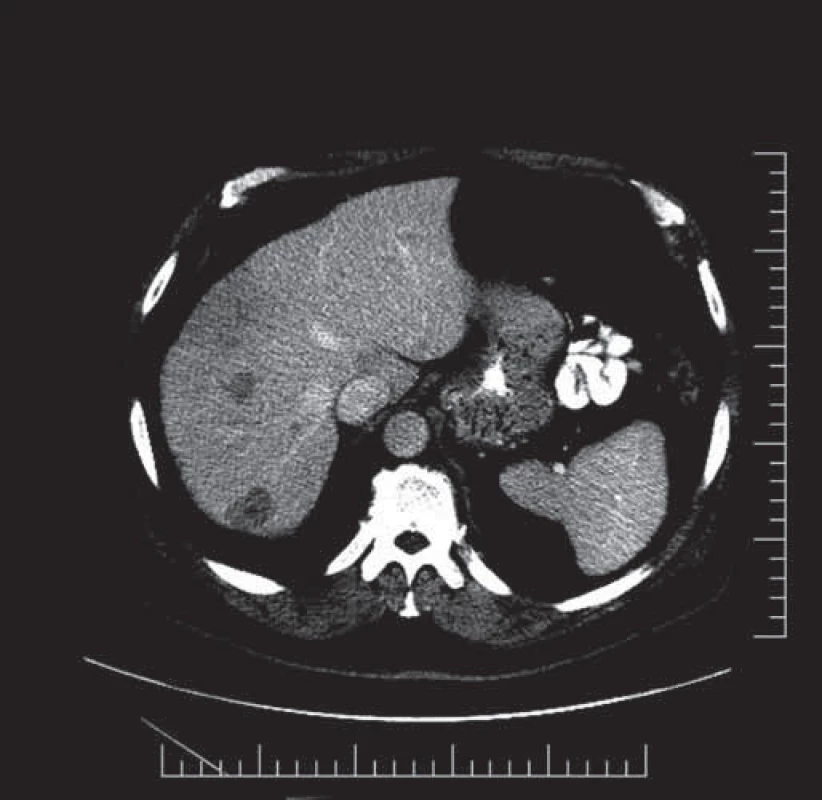
Velmi zajímavý byl výsledek laboratorních vyšetření, kde i přes rozsáhlý lokálně pokročilý nález v oblasti žaludku nebyl zaznamenán pokles hemoglobinu. Biochemický rozbor zaznamenal pouze minimální elevaci GMT, jinak byly všechny sledované parametry v normě. U pacienta s performans statusem (PS) 0, bez limitujících interkurencí, jsme zahájili léčbu první linie pro metastatický karcinom žaludku v kombinaci S-1 25 mg/ m2 perorálně 2krát denně po dobu 21 dnů následovanou 7denním obdobím bez léčby a cisplatinou 75 mg/ m2 jako intravenózní infuze jednou za 4 týdny. Po třech cyklech bylo provedeno kontrolní CT vyšetření břicha a malé pánve, kde byla popisovaná regrese nepravidelně zesílené stěny žaludku v oblasti fundu a malé kurvatury z 22 mm na 16 mm, dále zmenšení zvětšených lymfatických uzlin z velikosti 15 mm na 8 mm, v játrech došlo jak ke zmenšení velikosti, tak počtu metastatických ložisek (obr. 2).
2. CT vyšetření břicha a malé pánve, ložiska jaterní po třech cyklech léčby. 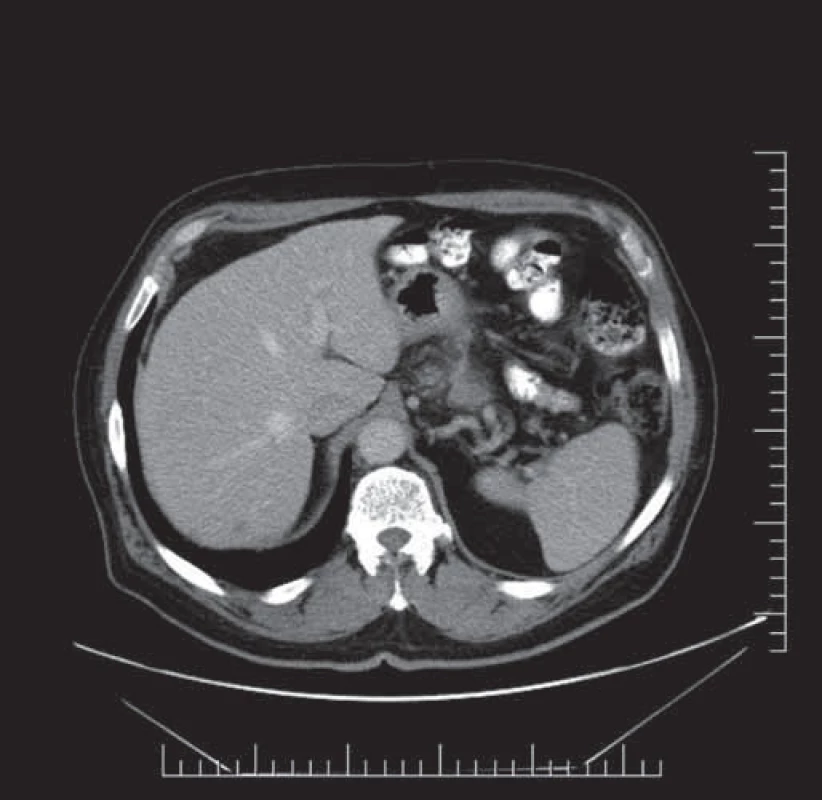
Efekt léčby po třech cyklech jsme zhodnotili jako parciální remisi, pacient absolvoval celkem šest cyklů kombinované terapie. Následné CT vyšetření břicha a malé pánve neprokázalo progresi onemocnění. Celková odpověď na léčbu trvala šest měsíců, co přibližně odpovídá výsledkům studie FLAGS, poté došlo k progresi metastatického postižení jater. V současné době je nemocný léčen druhou linií chemoterapie pro metastatický karcinom žaludku.
Léčba nebyla provázena žádnými závažnými nežádoucími účinky. I přes poměrně rozsáhlou lokální nádorovou infiltraci v oblasti žaludku nebyla během celé doby terapie pozorována nevolnost vyšší než stupeň 1. Po čtvrté sérii byl zaznamenán pokles hemoglobinu stupně 1. Za celou dobu terapie jsme nezaznamenali toxicitu stupně 3 a 4. Po čtvrtém cyklu chemoterapie byl pacient na klinice infekčních nemocí přeléčen antibiotikem azitromycin pro sérologicky pozitivní IgM protlátky proti borelióze po předchozím přisátí klíštěte.
Diskuze
Kombinací S-1/ cisplatina jsme léčili 71letého nemocného bez závažných přidružených chorob, ve velmi dobrém klinickém stavu. Terapie probíhala bez výraznější toxicity. Porovnáme‑li naši malou klinickou zkušenost s výsledky bezpečnosti u 71 pacientů ve věku ≥ 70 let a u 450 pacientů < 70 let léčených přípravkem S-1 v kombinaci s cisplatinou ve studii FLAGS, které ukazují, že incidence všech nežádoucích reakcí stupně tři nebo vyšších (62 % vs 52 %), všech závažných nežádoucích reakcí (30 % vs 19 %) a počtu předčasného odstoupení v důsledku nežádoucích reakcí přípravku a počtu předčasného odstoupení v důsledku nežádoucích reakcí u přípravku S-1 i cisplatina (21 % vs 12 %) se zdály být vyšší u pacientů ve věku ≥ 70 let, tak toxicita u námi léčeného pacienta byla pouze v rozmezí stupně jedna. Analýza populační farmakokinetiky v rámci studie FLAGS ukázala, že sice expozice 5 - FU měla tendenci se zvyšovat s věkem, ale rozsah byl v rámci individuální variability [5]. Naše malá klinická zkušenost tuto individuální variabilitu potvrdila.
Jaký je pohled na použití S ‑ 1 v českých a mezinárodních doporučeních? NCCN (National Comprehensive Cancer Network), doporučení verze 2.2013, zmiňuje výsledky studie FLAGS. Poukazuje ale na potřebu dalších studií pro potvrzení aktivity S ‑ 1 u západní a americké populace [6]. Modrá kniha, která zahrnuje doporučení pro racionální onkologickou léčbu lege artis v České republice, informuje o S ‑ 1 do první linie léčby metastatického karcinomu žaludku [7]. V doporučeních ESMO (European Society for Medical Oncology), publikovaných v časopise Annals of Oncology [8] pro léčbu karcinomu žaludku, infomace o S ‑ 1 uvedeny nejsou.
Závěr
Léčba metastatického karcinomu žaludku je léčbou s paliativním záměrem, se snahou o prodloužení přežití za dobré kvality života. S ‑ 1 podávané v tabletové formě umožňuje pacientovi absolvovat terapii v domácím prostředí. Má přijatelnou toxicitu, což významně působí na zlepšení kvality života nemocných s předpokládánou několikaměsíční délkou přežití.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do bi omedicínských časopisů.
MUDr. Jana Katolická, Ph.D.
Onkologicko-chirurgické oddělení FN u sv. Anny
Pekařská 53
656 91 Brno
e-mail: jana.katolicka@fnusa.cz
Obdrženo: 12. 2. 2014
Přijato: 5. 5. 2014
Sources
1. Ajani JA, Rodriguez W, Bodoky G et al. Multicenter phase III comparison of cisplatin/ S ‑ 1 with cisplatin/ infusional fluorouracil in advanced gastric or gastroesophageal adenocarcinoma study: the FLAGS trial. J Clin Oncol 2010; 28(9): 1547 – 1553. doi: 10.1200/ JCO.2009.25.4706.
2. Tomášek J. Karcinom žaludku. Acta Medicinae 2012; 1(2): 49 – 51.
3. Price TJ, Shapiro JD, Segelov E et al. Management of advanced gastric cancer. Expert Rev Gastroenterol Hepatol 2012; 6(2): 199 – 208. doi: 10.1586/ egh.11.103.
4. Van Cutsem E, Moiseyenko VM, Tjulandin S et al. Phase IIIstudy of docetaxel and cisplatin plus fluorouracil compared with cisplatin and fluorouracil as first‑line therapy for advanced gastric cancer: a report of the V325 Study Group. J Clin Oncol 2006; 24(31): 4991 – 4997.
5. Taiho. Comparison of results in subpopulations. Marketing Authorisation Application: S ‑ 1.2009.
6. Nccn.org [homepage on the Internet]. National Comprehensive Cancer Network. Washington: c2014. Available from: www.nccn.org.
7. Vyzula R et al (eds). Modrá kniha České onkologické společnosti, 18. vyd. Brno: Masarykův onkologický ústav 2014. Dostupné z: http:/ / www.linkos.cz/ informace ‑ pro‑praxi/ modra ‑ kniha/ .
8. Waddell T, Verheij M, Allum W et al. Gastric cancer: ESMO ‑ ESSO ‑ ESTRO Clinical practice guidelines for diagnosis, treatment and follow‑up. Ann Oncol 2013; 24(6): 57 – 63.
Labels
Paediatric clinical oncology Surgery Clinical oncology
Article was published inClinical Oncology

2014 Issue 3-
All articles in this issue
- Very Late Effects of Radiotherapy – Limiting Factor of Current Radiotherapy Techniques
- The Combination of Neoadjuvant Chemoradiotherapy and Epidermal Growth Factor Receptor Inhibitors in the Treatment of Rectal Adenocarcinoma
- Effect of Vitamin D Receptor Polymorphisms on the Development and Progression of Malignant Melanoma
- Molecular Cytogenetic Analysis of Chromosomal Aberrations in Cells of Low Grade Gliomas and Its Contribution for Tumour Classification
- Cost Analysis of Radiotherapy Provided in Inpatient Setting – Testing Potential Predictors for a New Prospective Payment System
- Inverted Papiloma and Its Rare Forms
- Case Report of a Patient with Advanced and Disseminated Gastric Carcinoma Treated by S-1
- Cancer in Elderly
- Analysis of Disease‑free Survival and Overall Survival in Patients with Luminal A Breast Cancer Stratified According to TNM
- Bevacizumab as Second‑line Treatment of Glioblastoma – Worth the Effort?
- Clinical Oncology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Very Late Effects of Radiotherapy – Limiting Factor of Current Radiotherapy Techniques
- Inverted Papiloma and Its Rare Forms
- Cancer in Elderly
- Bevacizumab as Second‑line Treatment of Glioblastoma – Worth the Effort?
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

